Марганец – химический элемент: что это такое, какова формула вещества и степень окисления
Долгое время одно из соединений этого элемента, а именно его двуокись (известна под названием пиролюзит) считалось разновидностью минерала магнитный железняк. Лишь в 1774 году один из шведских химиков выяснил, что в пиролюзите есть неизученный металл. В результате нагревания этого минерала с углем удалось получить тот самый неизвестный металл. Вначале его называли манганум, позже появилось современное название — марганец. Химический элемент обладает многими интересными свойствами, речь о которых пойдет далее.
Содержание
Марганец как химический элемент
Расположен в побочной подгруппе седьмой группы периодической таблицы (важно: все элементы побочных подгрупп — металлы). Электронная формула 1s2 2s2 2p6 3s2 3p6 4s2 3d5 (типичная формула d-элемента). Марганец как свободное вещество имеет серебристо-белый цвет. Из-за химической активности в природе встречается лишь в виде соединений, таких как окислы, фосфат и карбонат. Вещество тугоплавкое, температура плавления составляет 1244 градуса по шкале Цельсия.
Вещество тугоплавкое, температура плавления составляет 1244 градуса по шкале Цельсия.
Интересно! В природе встречается только один изотоп химического элемента, имеющий атомную массу 55. Остальные изотопы получены искусственным путем, и наиболее устойчив радиоактивный изотоп с атомной массой 53 (период полураспада примерно такой же, как у урана).
Марганец
Степень окисления марганца
У него шесть разных степеней окисления. В нулевой степени окисления элемент способен образовывать комплексные соединения с органическими лигандами (например, P(C5H5)3), а также неорганическими лигандами:
- окисью углерода (декакарбонил димарганца),
- азотом,
- трифторидом фосфора,
- окисью азота.
Степень окисления +2 типична для солей марганца. Важно: у этих соединений сугубо восстановительные свойства. Наиболее устойчивые соединения, имеющие степень окисления +3, — оксид Mn2O3, а также гидрат этого оксида Mn(OH)3. В степени окисления +4 наиболее устойчивы MnO2 и амфотерный оксид-гидроксид MnO(OH)2.
В степени окисления +4 наиболее устойчивы MnO2 и амфотерный оксид-гидроксид MnO(OH)2.
Степень окисления марганца +6 типична для существующей только в водном растворе марганцеватой кислоты и ее солей. Степень окисления +7 типична для существующей только в водном растворе марганцевой кислоты, ее ангидрида, а также солей — перманганатов (аналогия с перхлоратами) — сильных окислителей. Интересно, что при восстановлении перманганата калия (в быту называется марганцовкой) возможны три разные реакции:
- В присутствии серной кислоты анион MnO4- восстанавливается до Mn2+.
- Если среда нейтральная, ион MnO4- восстанавливается до MnO(OH)2 или MnO2.
- В присутствии щелочи анион MnO4- восстанавливается до манганат-иона MnO42-.
Марганец как химический элемент
Химические свойства
В обычных условиях малоактивен. Причина — появляющаяся при воздействии кислорода воздуха оксидная пленка. Если же порошок металла слегка нагреть, он сгорает, превращаясь в MnO2.
При нагревании взаимодействует с водой, вытесняя водород. В результате реакции получается практически нерастворимый гидрат закиси Mn(OH)2. Это вещество препятствует дальнейшему взаимодействию с водой.
Интересно! Водород растворим в марганце, и при повышении температуры растворимость увеличивается (получается раствор газа в металле).
При очень сильном нагревании (температура выше 1200 градусов по шкале Цельсия) взаимодействует с азотом, при этом получаются нитриды. Эти соединения могут иметь различный состав, что типично для так называемых бертоллидов. Взаимодействует с бором, фосфором, кремнием, а в расплавленном виде — с углеродом. Последняя реакция протекает при восстановлении марганца коксом.
При взаимодействии с разбавленной серной и соляной кислотами получается соль и выделяется водород. А вот взаимодействие с крепкой серной кислотой иное: продукты реакции — соль, вода и двуокись серы (вначале серная кислота восстанавливается в сернистую, но из-за неустойчивости сернистая кислота распадается на диоксид серы и воду).
Это интересно! Что такое алканы: строение и химические свойства
При реакции с разбавленной азотной кислотой получается нитрат, вода, окись азота.
Образует шесть оксидов:
- закись, или MnO,
- окись, или Mn2O3,
- закись-окись Mn3O4,
- двуокись, или MnO2,
- марганцеватый ангидрид MnO3,
- марганцевый ангидрид Mn2O7.
Интересно! Закись под воздействием кислорода воздуха постепенно превращается в окись. Ангидрид марганцеватой кислоты не выделен в свободном виде.
Закись-окись — соединение с так называемой дробной степенью окисления. При растворении в кислотах образуются соли двухвалентного марганца (соли с катионом Mn3+ неустойчивы и восстанавливаются до соединений с катионом Mn2+).
Двуокись, окись, закись-окись — наиболее устойчивые оксиды. Марганцевый ангидрид неустойчив. Прослеживаются аналогии с другими химическими элементами:
- Mn2O3 и Mn3O4 — основные оксиды, и по свойствам похожи на аналогичные соединения железа,
- MnO2 — амфотерный оксид, по свойствам похож на оксиды алюминия и трехвалентного хрома,
- Mn2O7 — кислотный оксид, по свойствам весьма похож на высший оксид хлора.

Несложно заметить и аналогию с хлоратами и перхлоратами. Манганаты, подобно хлоратам, получаются косвенным путем. А вот перманганаты можно получить как прямым путем, то есть при взаимодействии ангидрида и оксида/гидроксида металла в присутствии воды, так и косвенным.
В аналитической химии катион Mn2+ попал в пятую аналитическую группу. Есть несколько реакций, позволяющих обнаружить этот катион:
- При взаимодействии с сульфидом аммония выпадает осадок MnS, его цвет — телесный, при добавлении минеральных кислот наблюдается растворение осадка.
- При реакции с щелочами получается белый осадок Mn(OH)2, однако при взаимодействии с кислородом воздуха цвет осадка меняется с белого на бурый — получается Mn(OH)3.
- Если к солям с катионом Mn2+ добавить перекись водорода и раствор щелочи, выпадает темно-бурый осадок MnO(OH)2.
- При добавлении к солям с катионом Mn2+ окислителя (двуокись свинца, висмутат натрия) и крепкий раствор азотной кислоты, раствор окрашивается в малиновый цвет — это значит, что Mn2+ окислился до HMnO4.

Химические свойства
Валентности марганца
Элемент находится в седьмой группе. Типичные валентности марганца – II, III, IV, VI, VII.
Нулевая валентность типична для свободного вещества. Двухвалентные соединения — соли с катионом Mn2+, трехвалентные – оксид и гидроксид, четырехвалентные – двуокись, а также оксид-гидроксид. Шести- и семивалентные соединения — соли с анионами MnO42- и MnO4-.
Как получить и из чего получают марганец? Из марганцевых и железо-марганцевых руд, а также из растворов солей. Известно три разных способа получения марганца:
- восстановление коксом,
- алюмотермия,
- электролиз.
В первом случае в качестве восстановителя используется кокс, а также окись углерода. Восстанавливается металл из руды, где есть примесь оксидов железа. В результате получается как ферромарганец (сплав с железом), так и карбид (что такое карбид? это соединение металла с углеродом).
Для получения более чистого вещества используется один из способов металлотермии — алюмотермия. Сначала прокаливается пиролюзит, при этом получается Mn2O3. Затем полученный оксид смешивают с порошком алюминия. В ходе реакции выделяется много теплоты, в результате получающийся металл плавится, а оксид алюминия покрывает его шлаковой «шапкой».
Сначала прокаливается пиролюзит, при этом получается Mn2O3. Затем полученный оксид смешивают с порошком алюминия. В ходе реакции выделяется много теплоты, в результате получающийся металл плавится, а оксид алюминия покрывает его шлаковой «шапкой».
Марганец — металл средней активности и стоит в ряду Бекетова левее водорода и правее алюминия. Это значит, что при электролизе водных растворов солей с катионом Mn2+ на катоде восстанавливается катион металла (при электролизе весьма разбавленного раствора на катоде восстанавливается и вода). При электролизе водного раствора MnCl2 протекают реакции:
MnCl2 Mn2+ + 2Cl-
Катод (отрицательно заряженный электрод): Mn2+ + 2e Mn0
Анод (положительно заряженный электрод): 2Cl- 2e 2Cl0 Cl2
Итоговое уравнение реакции:
MnCl2 (эл-з) Mn + Cl2
При электролизе получается наиболее чистый металлический марганец.
Полезное видео: марганец и его соединения
Применение
Применение марганца довольно широко. Используется как сам металл, так и его различные соединения. В свободном виде используется в металлургии для разных целей:
Используется как сам металл, так и его различные соединения. В свободном виде используется в металлургии для разных целей:
- как «раскислитель» при плавке стали (связывается кислород, и образуется Mn2O3),
- в качестве легирующего элемента: получается прочная сталь с высокими показателями износостойкости и ударопрочности,
- для выплавки так называемой броневой марки стали,
- как компонент бронзы и латуни,
- для создания манганина, сплава с медью и никелем. Из этого сплава делают различные электротехнические устройства, например реостаты
Для изготовления гальванических элементов Zn-Mn используется MnO2. В электротехнике применяются MnTe и MnAs.
Это интересно! Уроки химии: что это такое галогены
Применение марганца
Интересные факты
Перманганат калия, часто называемый марганцовкой, широко применяется как в быту (для лечебных ванночек), так и в промышленности и лабораториях. Малиновая окраска перманганата обесцвечивается при пропускании через раствор ненасыщенных углеводородов с двойными и тройными связями. При сильном нагревании перманганаты разлагаются. При этом получаются манганаты, MnO2, а также кислород. Это один из способов получить химически чистый кислород в лабораторных условиях.
При сильном нагревании перманганаты разлагаются. При этом получаются манганаты, MnO2, а также кислород. Это один из способов получить химически чистый кислород в лабораторных условиях.
Получить соли марганцеватой кислоты можно лишь косвенным путем. Для этого MnO2 смешивают с твердой щелочью и в присутствии кислорода нагревают. Другой способ получения твердых манганатов – прокаливание перманганатов.
Растворы манганатов имеют красивую темно-зеленую окраску. Однако эти растворы неустойчивы и подвергаются реакции диспропорционирования: темно-зеленая окраска меняется на малиновую, также выпадает бурый осадок. В результате реакции получается перманганат и MnO2.
Это интересно! Для чего делают и что это такое гидролиз солей
Диоксид марганца применяется в лаборатории как катализатор при разложении хлората калия (бертолетовой соли), а также для получения чистого хлора. Интересно, что в результате взаимодействия MnO2 с хлороводородом получается промежуточный продукт – крайне неустойчивое соединение MnCl4, распадающееся на MnCl2 и хлор.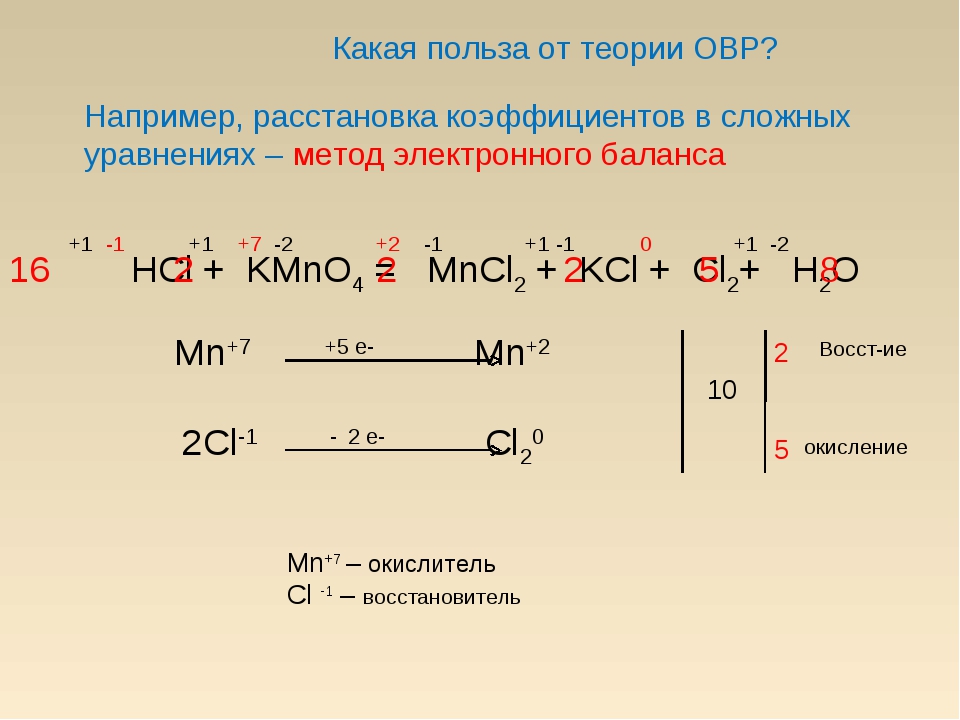 Нейтральные или подкисленные растворы солей с катионом Mn2+ имеют бледно-розовую окраску (Mn2+ создает комплекс с 6 молекулами воды).
Нейтральные или подкисленные растворы солей с катионом Mn2+ имеют бледно-розовую окраску (Mn2+ создает комплекс с 6 молекулами воды).
Полезное видео: марганец элемент жизни
Вывод
Такова краткая характеристика марганца и его химические свойства. Это серебристо-белый металл средней активности, взаимодействует с водой лишь при нагревании, в зависимости от степени окисления проявляет как металлические, так и неметаллические свойства. Его соединения используются в промышленности, в быту и в лабораториях для получения чистого кислорода и хлора.
Вопрос 17
Марганец
Не встречаясь в свободном виде,он входит в состав руд,важнейшие:пиролюзитMnO2,браунит Mn2O3,гаусманитMn3O4.
Из оксидов марганец восстанавливают кремнием или алюминием
3Mn3O4+8Al=9Mn+4Al2O3
Чистый
марганец получают электролизом водного
раствора сульфата марганца.
Чистый марганец-серебристо-белый,твердый,хрупкий металл.На воздухе покрывается защитной оксидной пленкой.
Из соляной и разбавленной серной кислот марганец вытесняет водород:
Mn+2H(+)->Mn(2+)+h3(улетает)
Концентрированную серную кислоту он восстанавливает до двуокиси серы
Mn+2h3SO4=SO2(улетает)+MnSO4+2h3O
А азотную-до оксида азота(||)
3Mn+8HNO3=3Mn(NO3)2+2NO(улетает)+4h3O
Известны:дигалиды,сульфиды(MnS,MnS2),нитриды(Mn2N),карбиды(Mn3C), силициды(MnSi)марганца
С кислородом образует 5 простых оксидов:оксид марганца(||) MnO,оксид марганца(|||)Mn2O3,оксид марганца(4)MnO2,оксид марганца (6) MnO3,оксид марганца(7) MnO7,смешанный оксид марганца (||,|||) Mn3O4
Oксиды(2)и(3)-основные,оксид(4)-амфотерен,высшие оксиды проявляют кислотные свойства
Гидроксид марганца(2) Mn(OH)2 выпадает в виде белого осадка при действии щелочей на соли марганца(2),имеющие розовую окраску:
MnCl2+2NaOH=Mn(OH)2(осадок)+2NaCl
Он
проявляет только основные
свойства:растворяется в кислотах,но не
растворим в избытке щелочей.
На воздухе белый осадок Mn(OH)2 буреет,окисляясь до оксида-гидроксида марганца(4) MnO(OH)2, изображаемого в виде кислоты h3MnO3(соли ее наз.
Метаманганитами).
Оксид марганца (4)MnO2-наиболее стоек,проявляет амфотерные свойства
Гидроксид марганца(4) Mn(OH)4 амфотерен,растворяется в кислотах и щелочах.Поэтому он наз. марганцоватистой кислотой h5MnO4.Ее соли-ортоманганиты.
Оксид марганца(6) MnO3 неустойчив,ему соответствует марганцовистая кислота h3MnO4,тоже нестойка и в свободном виде не существует.более устойчивые соли ее наз. Манганатами,напр K2MnO4-манганат калия
Оксид марганца(7) Mn2O7-зеленовато-бурая,маслянистая жидкость,сильнейший окислитель.Ей соответствует марганцовая кислота HMnO4, неустойчивая,известная только в водных растворах,но очень сильная(практ полностью диссоциирует на ионы).Соли ее наз. Перманганатами
В водных растворах марганцовая кислота и перманганаты окрашены в малиново-фиолетовый цвет.обусловленный перманганат-ионом MnO4(-)
Перманганаты-сильные
окислители. Степень окисления марганца
в реакциях изменяется в зависимости от
pH
раствора.
Степень окисления марганца
в реакциях изменяется в зависимости от
pH
раствора.
Перманганат калия применяют в медицине и ветеринарии.Марганец-важнейший микроэлемент.Недостаток его в почвах приводит к заболеваниям растений,поэтому в такие почвы вносят марганцовые микроудобрения,обычно в виде сульфата марганца.Недостаток марганца в кормах,отрицательно сказывается на состоянии с/х животных.Марганец-раскислитель и легирующий металл в производстве стали.Он сообщает сталям твердость и прочность.Он входит в состав многих сплавов
___________________________________________________________________________________________________________________________________________________________________________________________
Железо
Железные руды:магнитный железняк Fe3O4,красный железняк Fe2O8,бурый железняк 2Fe2O3*3h3O,шпатовый железняк FeCO3.Железный колчедан FeS2 перерабатывают на серную кислоту.Железо из руд получают путем восстановления
Чистое
железо-серебристо-белый мягкий
металл,легко намагничивающийся и
размагничивающийся. Его получают
эликтролизом растворов солей железа
или термическим разложением пентакарбонила
железа:[Fe(СO)5]=Fe+5
CO(улетуч-я)
Его получают
эликтролизом растворов солей железа
или термическим разложением пентакарбонила
железа:[Fe(СO)5]=Fe+5
CO(улетуч-я)
При обычных условия Fe не взаимодействует с самыми активными неметаллами(галогенами,кислородом,серой,фтором)
Во влажном оздухе техническое железо покрывается ржавчиной FeOOh.Оно легко растворяется соляной,в разбавленных серной и азотной кислотах,но концентрированне серная и азотная кислоты пассивируют Fe. В щелочах оно растворимо.
В устойчивых соединениях железо проявляет С.О= +2 и +3
Имеет 2 простых оксида и 1 смешанный-оксид железа(2,3) Fe3O4(FeO*Fe2O3)
Оксид железа(2) FeO-черный порошок.Взаимодействует с кислотами,образуя соли железа(2),проявляет основные свойства.
Гидроксид железа(2) Fe(OH)2 осаждают,действуя щелочами на растворы соли железа(2):FeSO4+2NaOH=Fe(OH)2(осадок)+Na2SO4
Гидроксид амфотерен,частично растворяется в сильнощелочных средах.Это бурое вещ-во легко окисляется кислородом воздуха до красно-бурого гидроксида железа(3) 4Fe(OH)2+O2+2h3O-4Fe(OH)3
Гидроксид железа(2) легко растворяется в кислотах
Оксид
железа(3) Fe2O3-
красно-бурый порошок,обладает основными
свойстваим(с признаками амфотерности),образует
с кислотами соли железа(3).
Fe2O3+Na2CO3=2NaFeO2+CO2(улетает)
Гидроксид железа(3) Fe(OH)3 выпадает при действии щелочей на солижелеза(3) в виде красно-бурго осадка: Fe2(SO4)3+6NaOH=2Fe(OH)3(осадок)+3Na2SO4
Гидроксид железа(3) проявляет основные свойства,растворяется в кислотах,признак амфотерности.При окислении этого гидроксида в щелочной среде получаются соли железной кислоты-ферраты,напр K2FeO4-феррат калия
У железа хорошо выражена способность образовывать комплексные соединения.Прочный комплексный анион [Fe(СN)6] (4-) получается при взаимодействии солей железа(2) с цианидами:
FeSO4+6KCN=K4[Fe(CN)6]+K2SO4
Образующееся ком-ое соединение-гексациано(||)феррат калия с солями железа(|||)дает синий осадок берлинской лазури,напр
4FeCl3+3K4[Fe(CN)6]=Fe4[Fe(CN)6]3(осадок)+12KCl
Гексациано(|||) феррат калия K3[Fe(CN)6] также выделяет из растворов солей железа(2) синий осадок
3FeSO4+2K3[Fe(CN)6]=Fe3[Fe(CN)6]2(осадок)+3K2SO4
раньше называли турнбуллевой синью
Соли железа(3) с роданидами образуют кроваво-красные компоненты,напр
Fe(3+) +SCN(-) =[Fe(SCN)](2+)
При
высокой концентрации роданид-ионов
получаются комплексные соединения с
большим числом лигандов,напр
K3[Fe(SCN)6]. Координационное
число железа в комплексных соединениях
равно шести.
Координационное
число железа в комплексных соединениях
равно шести.
Соли железа имеют практическое значение:сульфат железа(2),или железный купорос,FeSO4*7h3O-с/х ядохимикат.Соль Мора (Nh5)2SO4*FeSO4*6h3O, или сульфат аммония железа(2),прим в хим анализе.Железоамминийные квасцы,ли сульфат аммония железа(3),(Nh5)2SO4*fe2(SO4)3*24h3O- крашение тканей.Хлорид железа(3) FeCl3*6h3O-кристаллическое вещ-во бурого цвета,исп в лаб практике.Берлинская лазурь-основа нескольких красителей
Биологическое значение-составная часть гемоглобина в кровиЖелезо содержится в печени и селезенке человека и животных.У растений-оно участвует в ок-восстанов процессах,в кислородном обмене.
___________________________________________________________________________________________________________________________________________________________________________________________
Какова степень окисления 2mno2? – Assemblymade.com
Какова степень окисления 2mno2?
-2
Это соединение, называемое диоксидом марганца, также содержит два иона кислорода, каждый из которых имеет степень окисления -2. Ион марганца также проявляет другие степени окисления, такие как +2 и +7… Спасибо.
Ион марганца также проявляет другие степени окисления, такие как +2 и +7… Спасибо.
| Связанные вопросы и ответы | |
|---|---|
| Эволюционные изменения невозможны в | Си Единица Времени |
Какова степень окисления Na+?
+1
Степень окисления любого простого одноатомного иона равна его заряду; таким образом, степень окисления Na+ равна +1; Са2+, +2; и Cl-, -1. 3. Степень окисления водорода в любом неионогенном соединении равна +1. Это правило применимо к подавляющему большинству соединений водорода, таких как H,O, Nh4, HCl и Ch5.
Какова степень окисления Mn в MnO2 4?
+4
Степень окисления иона марганца в соединении с химической формулой MnO2 равна +4.
Какова степень окисления P в hpo4 2?
Ответ: Степень окисления фосфора +5.
Какова степень окисления al2o3?
One +3
Степени окисления One +3 Степень окисления алюминия можно найти в составном оксиде алюминия Al2O3. В AlO, монооксиде алюминия, он имеет степень окисления +2, а AlH имеет степень окисления +1.
В AlO, монооксиде алюминия, он имеет степень окисления +2, а AlH имеет степень окисления +1.
Почему степень окисления натрия +1?
1. Степень окисления атома равна нулю в нейтральном веществе, содержащем атомы только одного элемента. Таким образом, атомы в O2, O3, P4, S8 и металлическом алюминии имеют степень окисления 0. Например, степень окисления натрия в ионе Na+ равна +1, а степень окисления хлора в Cl- ион -1.
Какова степень окисления H в hpo32?
кислород всегда будет иметь заряд -2, а водород +1. Соединение электрически нейтрально, поэтому фосфор должен иметь степень окисления +3.
Какая степень окисления у калия?
Калий имеет степень окисления +1, что дает общий заряд +2.
Какова общая степень окисления MnO2?
Степень окисления MnO2 равна 0. Сумма степеней окисления элементов в нейтральном соединении равна 0. Степень окисления аниона оксида равна -2. Поскольку имеется 2 иона оксида, общая степень окисления оксида равна -4. Поскольку сумма степеней окисления должна быть равна 0, степень окисления катиона марганца равна +4.
9-, Fe4[Fe(CN)6]3, Nh5NO3, so42-, ch4cooh, cuso4*5h3o).
Поскольку сумма степеней окисления должна быть равна 0, степень окисления катиона марганца равна +4.
9-, Fe4[Fe(CN)6]3, Nh5NO3, so42-, ch4cooh, cuso4*5h3o).
Какова степень окисления одноатомного элемента?
Степень окисления свободного элемента всегда равна 0. Степень окисления одноатомного иона равна заряду иона. Фтору в соединениях всегда присваивается степень окисления -1. Щелочные металлы (группа I) всегда имеют степень окисления +1. Щелочноземельным металлам (группа II) всегда присваивается степень окисления +2.
Какова степень окисления кислорода группы II?
Щелочноземельным металлам (группа II) всегда присваивается степень окисления +2. Кислород почти всегда имеет степень окисления -2, за исключением пероксидов (h3O2), где она равна -1, и соединений с фтором (OF2), где она равна +2.
WebElements Periodic Table » Марганец » диоксид марганца
- Формула: MnO 2
- Формула системы Хилла: Mn 1 O 2
- Регистрационный номер CAS: [1313-13-9]
- Вес формулы: 86,937
- Класс: оксид
- Цвет: от серого до черного
- Внешний вид: кристаллическое твердое вещество
- Температура плавления: 535°C (разлагается, теряет O 2 )
- Точка кипения:
- Плотность: 5100 кг·м -3
Ниже приведены некоторые синонимы двуокиси марганца :
- диоксид марганца
- оксид марганца(IV)
- оксид марганца
Степень окисления марганца в двуокиси марганца составляет 4 .
Синтез
Нет в наличии
Твердотельная структура
- Геометрия марганца:
- Прототип конструкции:
Элементный анализ
В таблице показано процентное содержание элементов для MnO
| Элемент | % |
|---|---|
| Мн | 63,19 |
| О | 36,81 |
Изотопная схема MnO
2На приведенной ниже диаграмме показана расчетная изотопная картина для формулы MnO 2 с наиболее интенсивным ионом, установленным на 100%.
Каталожные номера
Данные на страницах этих соединений собраны и адаптированы из основной литературы и нескольких других источников, включая следующие.
- Р.Т. Сандерсон в Chemical Periodicity , Reinhold, New York, USA, 1960.

- Н.Н. Гринвуд и А. Эрншоу в Chemistry of the Elements , 2-е издание, Butterworth, UK, 1997.
- Ф.А. Коттон, Г. Уилкинсон, К.А. Мурильо и М. Бохманн, в Advanced Inorganic Chemistry , John Wiley & Sons, 1999.
- А. Ф. Тротман-Дикенсон, (редактор) в Комплексная неорганическая химия , Пергамон, Оксфорд, Великобритания, 1973.
- Р.В.Г. Вайкофф, в Crystal Structures , том 1, Interscience, John Wiley & Sons, 1963.
- A.R.West в Базовая химия твердого тела Химия , John Wiley & Sons, 1999.
- А. Ф. Уэллс в Структурная неорганическая химия , 4-е издание, Оксфорд, Великобритания, 1975.
- Дж.Д.Х. Донней, (ред.) в Определяющие таблицы данных о кристаллах , монография ACA № 5, Американская кристаллографическая ассоциация, США, 1963.
- Д.Р. Лиде, (редактор) в справочнике по химии и физике компании Chemical Rubber Company , CRC Press, Бока-Ратон, Флорида, США, 77-е издание, 1996.





