Как найти число нейтронов в атоме: 11 шагов
‘).insertAfter(«#intro»),$(‘
‘).insertBefore( «.youmightalsolike»),$(‘
‘).insertBefore(«#quiz_container»),$(‘
‘).insertBefore(«#newsletter_block_main»),ja(!0),c=document.getElementsByClassName(«scrolltomarker»),a=0;a
В этой статье:
Определение числа нейтронов в атомах (не изотопах)
Определение числа нейтронов в изотопах
Дополнительные статьи
Источники
В атомах одного и того же элемента число протонов неизменно, в то время как число нейтронов может меняться. Зная, сколько нейтронов содержится в конкретном атоме, вы сможете определить, является ли он обычным атомом или изотопом, который будет иметь меньшее или большее количество нейтронов.[1]
X
Источник информации Определить количество нейтронов в атоме — довольно просто.
Шаги
1
Найдите элемент в периодической таблице. Для примера мы будем рассматривать осмий (Os), который находится в шестом периоде (шестой ряд сверху).
2
Найдите атомный номер элемента. Это, как правило, наиболее заметное число в ячейке элемента и обычно находится над его символом (в варианте периодической системы, которую мы используем в нашем примере, других номеров и нет). Атомный номер — это количество протонов в одном атоме этого элемента. Для осмия это число 76, то есть в одном атоме осмия содержится 76 протонов.
- Число протонов неизменно, именно оно и делает элемент элементом.
3
Найдите атомную массу элемента. Это число обычно находится под символом элемента. Обратите внимание, что в варианте периодической системы в нашем примере атомная масса не приведена (это не всегда так; во многих вариантах периодической системы атомная масса указана).
Атомная масса осмия — 190,23.
4
Округлите атомную массу до ближайшего целого числа. В нашем примере 190,23 округляется до 190.
- Атомная масса — среднее число изотопов конкретного элемента, обычно она не выражается целым числом.
5
Вычтите атомный номер из атомной массы. Поскольку абсолютная часть атомной массы приходится на протоны и нейтроны, вычитание числа протонов (то есть атомного номера, который равен числу протонов) из атомной массы дает число нейтронов в атоме. Цифры после десятичной запятой относятся к очень малой массе электронов в атоме. В нашем примере: 190 (атомный вес) — 76 (число протонов) = 114 (число нейтронов).
6
Запомните формулу. Чтобы найти число нейтронов в будущем, просто используйте эту формулу:
- N = M – n
- N = количество нейтронов
- M = атомная масса
- n = атомный номер
Реклама
- N = M – n
1
Найдите элемент в периодической таблице.
 В качестве примера мы будем рассматривать изотоп углерода 14С. Поскольку неизотопный углерод 14С есть просто углерод С, найдите углерод в периодической таблице (второй период или второй ряд сверху).
В качестве примера мы будем рассматривать изотоп углерода 14С. Поскольку неизотопный углерод 14С есть просто углерод С, найдите углерод в периодической таблице (второй период или второй ряд сверху).2
Найдите атомный номер элемента. Это, как правило, наиболее заметное число в ячейке элемента и обычно находится над его символом (в варианте периодической системы, которую мы используем в нашем примере, других номеров и нет). Атомный номер – это количество протонов в одном атоме этого элемента. Углерод находится под номером 6, то есть один атом углерода имеет шесть протонов.
3
Найдите атомную массу. В случае изотопов делать это очень просто, так как они названы в соответствии с их атомной массой. В нашем случае у углерода 14С атомная масса равна 14. Теперь мы знаем атомную массу изотопа; последующий процесс расчета такой же, как и для определения числа нейтронов в атомах (не изотопах).
4
Вычтите атомный номер из атомной массы.
 Поскольку абсолютная часть атомной массы приходится на протоны и нейтроны, вычитание числа протонов (то есть атомного номера, который равен числу протонов) из атомной массы дает число нейтронов в атоме. В нашем примере: 14 (атомная масса) — 6 (число протонов) = 8 (число нейтронов).
Поскольку абсолютная часть атомной массы приходится на протоны и нейтроны, вычитание числа протонов (то есть атомного номера, который равен числу протонов) из атомной массы дает число нейтронов в атоме. В нашем примере: 14 (атомная масса) — 6 (число протонов) = 8 (число нейтронов).5
Запомните формулу. Чтобы найти число нейтронов в будущем, просто используйте эту формулу:
- N = M – n
- N = количество нейтронов
- M = атомная масса
- n = атомный номер
Реклама
- N = M – n
Советы
- Протоны и нейтроны составляют практически абсолютную массу элементов, в то время как электроны и прочие частицы составляют крайне незначительную массу (эта масса стремится к нулю). Так как один протон имеет примерно ту же массу, что и один нейтрон, а атомное число представляет собой число протонов, то можно просто вычесть число протонов от общей массы.
- Осмий — металл в твердом состоянии при комнатной температуре, получил свое название от греческого слова «osme» — запах.

- Если вы не уверены, что значит какое-то число в периодической таблице, запомните: таблица, как правило, строится вокруг атомного номера (то есть числа протонов), который начинается с 1 (водород) и растет на одну единицу слева направо, заканчиваясь на 118 (Оганесон). Это потому, что число протонов в атоме определяет сам элемент и такое число — наиболее легкий способ систематизации элементов (например, атом с 2 протонами — всегда гелий, так же, как и атом с 79 протонами — всегда золото).
Реклама
Источники
Об этой статье
На других языках
Как найти число нейтронов в атоме — Wiki How Русский
В атомах одного и того же элемента число протонов неизменно, в то время как число нейтронов может меняться. Зная, сколько нейтронов содержится в конкретном атоме, вы сможете определить, является ли он обычным атомом или изотопом, который будет иметь меньшее или большее количество нейтронов.[1]
X
Источник информации
Определить количество нейтронов в атоме — довольно просто.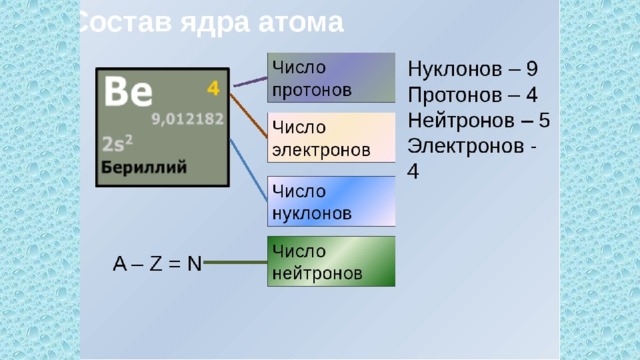
Эту страницу просматривали 188 317 раз.
Реклама
Физики измерили толщину нейтронной кожи ядра никеля
Физики нашли толщину нейтронного слоя на поверхности ядра никеля, сравнив зарядовые радиусы ядер 54Ni и 54Fe. Это значение связано с величиной энергии обменного взаимодействия в ядерной материи, поэтому и важно для понимания физики тяжелых атомных ядер и нейтронных звезд. Результаты эксперимента достаточно хорошо совпали с данными, полученными в предыдущих лабораторных экспериментах, и данными наблюдений за слиянием пары нейтронных звезд. Исследование опубликовано в Physical Review Letters.
Нуклоны в ядрах атомов распределены неравномерно. Особенно сильно этот эффект проявляется для ядер, в которых число нейтронов существенно превышает число протонов. В этом случае на поверхности ядра образуется избыток нейтронов, который называется «нейтронной кожей». Толщина этого слоя составляет несколько десятых фемтометра. Радиус самого ядра — в несколько десятков раз больше. Например, для хорошо исследованного с помощью рассеяния поляризованных электронов ядра свинца 208Pb эти величины равны приблизительно 0,3 и 6,7 фемтометров, соответственно, а радиус нейтрона — 0,8 фемтометра.
В этом случае на поверхности ядра образуется избыток нейтронов, который называется «нейтронной кожей». Толщина этого слоя составляет несколько десятых фемтометра. Радиус самого ядра — в несколько десятков раз больше. Например, для хорошо исследованного с помощью рассеяния поляризованных электронов ядра свинца 208Pb эти величины равны приблизительно 0,3 и 6,7 фемтометров, соответственно, а радиус нейтрона — 0,8 фемтометра.
Толщина нейтронной кожи связана с фундаментальным для ядерной физики параметром — величиной обменного вклада в энергию связи нуклонов в ядре. Существование этого вклада связано с тем, что нуклоны — это фермионы, поэтому два нуклона одного типа не могут занять одно и то же квантовое состояние. Поэтому если количество протонов и нейтронов в ядре разное и они занимают разное число энергетических уровней, то добавление в ядро нейтрона не эквивалентно добавлению протона. От величины обменного взаимодействия между нуклонами зависит форма и размер тяжелых ядер, в которых нейтронов существенно больше, чем протонов. Кроме того, оно влияет на вид уравнения состояния вещества нейтронной звезды.
Кроме того, оно влияет на вид уравнения состояния вещества нейтронной звезды.
Экспериментально измерить толщину нейтронной кожи, которая равна разности среднеквадратичных радиусов нейтронного и протонного распределений, очень сложно. Зарядовый радиус ядра, определяемый протонами, достаточно просто измерить в экспериментах по рассеянию заряженных частиц на ядрах. Незаряженные нейтроны не влияют на результаты таких экспериментов, а потому физики используют другие методы для нахождения нейтронного распределения. Кроме поляризационных экспериментов, это и эксперименты с антипротонными атомами, и измерение сечения фоторождения пионов при взаимодействии электронов с ядрами, и астрономические наблюдения за слиянием нейтронных звезд.
Теперь группа физиков из Германии и США под руководством Алекса Брауна (Alex Brown) из Мичиганского государственного университета определила толщину нейтронной кожи ядра никеля 54Ni, измерив его зарядовый радиус и сравнив его с зарядовым радиусом зеркального ядра железа 54Fe. Зеркальными называются ядра, имеющие одинаковое общее число нуклонов, но разное число протонов. В данном случае, в ядре никеля 28 протонов и 26 нейтронов, а в ядре железа — наоборот. Эксперимент ученые проводили с помощью лазерной спектроскопии в Циклотронной лаборатории Университета штата Мичиган — в нем ядра никеля облучались лазерными лучами с длиной волны 352 нанометра.
Зеркальными называются ядра, имеющие одинаковое общее число нуклонов, но разное число протонов. В данном случае, в ядре никеля 28 протонов и 26 нейтронов, а в ядре железа — наоборот. Эксперимент ученые проводили с помощью лазерной спектроскопии в Циклотронной лаборатории Университета штата Мичиган — в нем ядра никеля облучались лазерными лучами с длиной волны 352 нанометра.
Размеры зеркальных ядер почти одинаковы из-за одинакового количества нуклонов, так что толщина нейтронной кожи более богатого нейтронами ядра равна разности зарядовых радиусов двух зеркальных ядер. Измеренный в данном исследовании зарядовый радиус 54Ni оказался равен приблизительно 3,737 фемтометра, тогда как известный из более ранних измерений зарядовый радиус 54Fe составляет около 3,688 фемтометра, так что толщина нейтронной кожи 54Ni равна 0,049 фемтометра.
Чтобы установить связь между толщиной нейтронной кожи и величиной обменного взаимодействия физики вынуждены использовать не очень точные феноменологические модели строения ядра.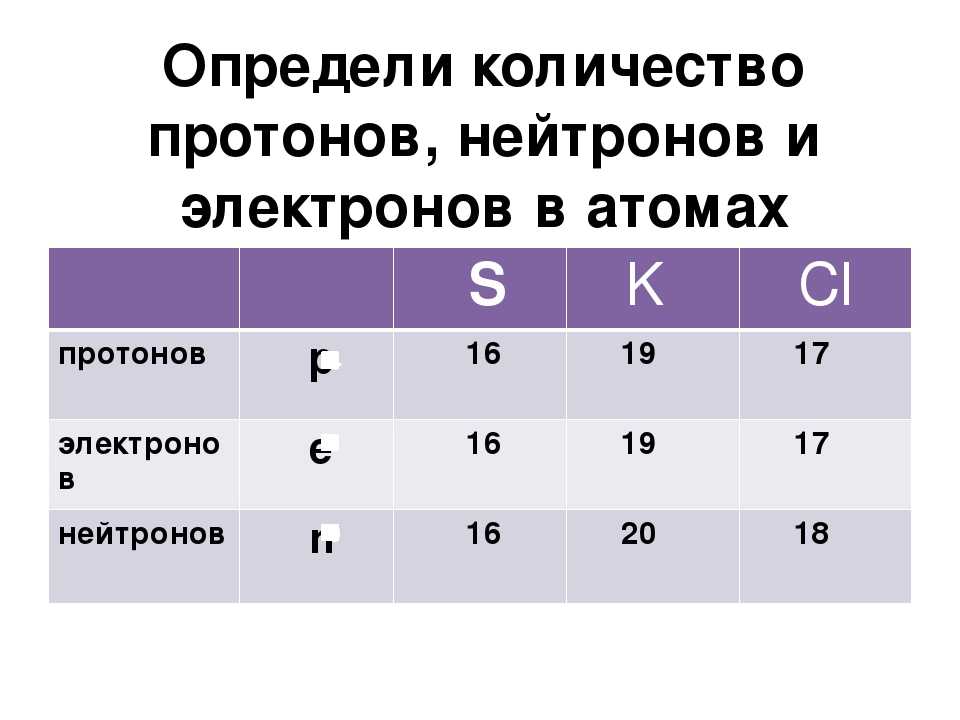 Из-за этого получающаяся величина обменного взаимодействия варьируется от 20 до 70 мегаэлектронвольт на один нейтрон. Этот результат, впрочем, существенно точнее ее оценки, сделанной исследователями по результатам измерений зарядовых радиусов зеркальных ядер кальция 36Ca и серы 36S, которая дала разброс от 5 до 70 мегаэлектронвольт.
Из-за этого получающаяся величина обменного взаимодействия варьируется от 20 до 70 мегаэлектронвольт на один нейтрон. Этот результат, впрочем, существенно точнее ее оценки, сделанной исследователями по результатам измерений зарядовых радиусов зеркальных ядер кальция 36Ca и серы 36S, которая дала разброс от 5 до 70 мегаэлектронвольт.
Результат исследования хорошо совпал с величиной обменного взаимодействия, которая получается из наблюдений за слиянием двух нейтронных звезд (11–65 мегаэлектронвольт), но оказался достаточно далек от его величины, измеренной в поляризационном эксперименте (106±37 мегаэлектронвольт). Однако из-за достаточно широкого разброса в вычисленной величине обменного взаимодействия это различие составляет всего около одного стандартного отклонения.
Исследователи надеются, что будущие лабораторные эксперименты и астрономические наблюдения позволят определить величину обменного взаимодействия более точно, уменьшив таким образом произвол в параметрах феноменологических моделей строения ядра и, соотвественно, улучшив наше понимание физики тяжелых ядер и физики нейтронных звезд.
Ранее мы писали про измерение толщины нейтронной кожи в ядре свинца в эксперименте по облучению тонкого слоя этого материала пучком поляризованных электронов.
Андрей Фельдман
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Как найти количество нейтронов в изотопе
Обновлено 10 мая 2018 г.
Автор: Karen G Blaettler
Вся материя состоит из атомов. Все, что имеет массу и объем, большое или маленькое, содержит атомы. Удивительно, но крошечные атомы содержат еще более мелкие частицы. Протоны, нейтроны и электроны являются тремя основными компонентами всех атомов. Количество и расположение этих трех невообразимо малых частиц определяет свойства и поведение содержащих их атомов.
TL;DR (слишком длинно, не читал)
Чтобы найти количество нейтронов в изотопе, вычтите количество протонов из атомной массы изотопа. Атомный номер элемента равен количеству протонов. Расчет количества нейтронов затем становится атомной массой изотопа минус атомный номер элемента, равным количеству нейтронов. Для урана-235 с атомным номером 92 число нейтронов составляет 235-92=143, или 143 нейтрона.
Для урана-235 с атомным номером 92 число нейтронов составляет 235-92=143, или 143 нейтрона.
Частицы в атомах
Почти все атомы содержат три основные частицы: протоны, нейтроны и электроны. Протоны и нейтроны составляют ядро или центр атома. Электроны, намного меньшие, чем протоны и нейтроны, вращаются вокруг ядра со скоростью света. Протоны имеют положительный заряд, нейтроны не имеют заряда, а электроны имеют отрицательный заряд. В нейтральном атоме количество протонов равно количеству электронов, но количество нейтронов не всегда равно количеству протонов.
Идентификация атомов
Количество протонов в атоме определяет, какой тип элемента образует атом. Водород, первый элемент периодической таблицы, имеет только один протон. Гелий, второй в периодической таблице, имеет два протона. Золото, номер 79 в периодической таблице, имеет 79 протонов. Периодическая таблица элементов показывает элементы в порядке количества протонов в атомах.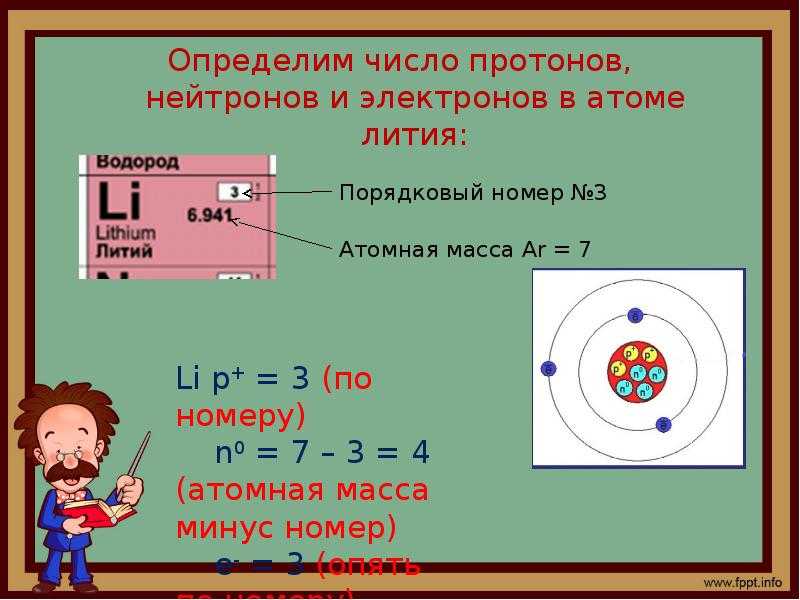
Изотопы атомов
Изотоп элемента означает атомы с одинаковым атомным номером, но разными массовыми числами. Так, изотопы элемента имеют разное количество нейтронов. Водород имеет три изотопа. Водород, наиболее распространенная форма атома, имеет один протон и один электрон. Дейтерий, один из изотопов водорода, по-прежнему имеет только один протон и один электрон, но также имеет один нейтрон. Тритий, еще один изотоп водорода, по-прежнему имеет только один протон и один электрон, но два нейтрона.
Расчет нейтронов
Масса атома состоит из объединенных масс протонов и нейтронов. Масса электронов пренебрежимо мала в общей массе атома. Протоны имеют размер около одной атомной единицы массы, а нейтроны имеют размер чуть более одной атомной единицы массы. Чтобы найти количество нейтронов в атоме, вычтите атомный номер из атомной массы.
Атомный номер и среднюю атомную массу можно найти в периодической таблице. Однако массу различных изотопов часто записывают как часть названия изотопа. Уран-235 означает элемент уран, атомный номер 9.2 имеет 92 протона и атомную массу 235. С другой стороны, уран-238 имеет массу 238, но по-прежнему имеет только 92 протона. Альтернативный метод записи изотопа показывает атомную массу в виде верхнего индекса и атомный номер в виде нижнего индекса. Уран-235 также можно записать как 235 92 U, где U — стандартное сокращение для урана.
Однако массу различных изотопов часто записывают как часть названия изотопа. Уран-235 означает элемент уран, атомный номер 9.2 имеет 92 протона и атомную массу 235. С другой стороны, уран-238 имеет массу 238, но по-прежнему имеет только 92 протона. Альтернативный метод записи изотопа показывает атомную массу в виде верхнего индекса и атомный номер в виде нижнего индекса. Уран-235 также можно записать как 235 92 U, где U — стандартное сокращение для урана.
Используя изотопы водорода в качестве примера, «нормальный» атом водорода имеет атомную массу 1 и атомный номер 1, что означает, что атом имеет только один протон. Используя формулу, атомная масса 1 минус атомный номер или количество протонов 1 дает уравнение 1-1=0, поэтому атом водорода имеет 0 нейтронов. С другой стороны, тритий, изотоп водорода, имеет атомную массу 3, но атомный номер водорода остается равным 1, потому что атом имеет только один протон. Используя уравнение, атомная масса минус атомный номер равняется количеству нейтронов, дает 3-1=2, поэтому тритий имеет 2 нейтрона.
Другой распространенный элемент, углерод, также имеет несколько изотопов. Обычный атом углерода с атомным номером 6 имеет атомную массу 12. Используя формулу, атомная масса минус атомный номер равняется количеству нейтронов, показывает 12-6=6, поэтому атом углерода-12 имеет 6 нейтронов. Углерод-14, используемый для датирования радиоактивного возраста окаменелостей возрастом менее 10 000 лет, по-прежнему имеет 6 протонов, но имеет атомную массу 14. Для расчета количества нейтронов используется та же формула, поэтому 14-6=8, поэтому углерод-14 имеет 8 нейтронов в ядре.
| 1 | Найдите число нейтронов | Х | |
| 2 | Найдите массу 1 моля | Н_2О | |
| 3 | Весы | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 4 | Найдите массу 1 моля | Х | |
| 5 | Найдите число нейтронов | Фе | |
| 6 | Найдите число нейтронов | ТК | |
| 7 | Найдите электронную конфигурацию | Х | |
| 8 | Найдите число нейтронов | Са | |
| 9 | Весы | CH_4+O_2→H_2O+CO_2 | |
| 10 | Найдите количество нейтронов | С | |
| 11 | Найдите число протонов | Х | |
| 12 | Найдите число нейтронов | О | |
| 13 | Найдите массу 1 моля | СО_2 | |
| 14 | Весы | C_8H_18+O_2→CO_2+H_2O | |
| 15 | Найдите атомную массу | Х | |
| 16 | Определите, растворимо ли соединение в воде | Н_2О | |
| 17 | Найдите электронную конфигурацию | На | |
| 18 | Найдите массу отдельного атома | Х | |
| 19 | Найдите число нейтронов | № | |
| 20 | Найдите число нейтронов | Золото | |
| 21 | Найдите число нейтронов | Мн | |
| 22 | Найдите число нейтронов | Ру | |
| 23 | Найти электронную конфигурацию | О | |
| 24 | Найдите массовые проценты | Н_2О | |
| 25 | Определите, растворимо ли соединение в воде | NaCl | |
| 26 | Н_2О | ||
| 27 | Найти степени окисления | Н_2О | |
| 28 | Найдите электронную конфигурацию | К | |
| 29 | Найдите электронную конфигурацию | Мг | |
| 30 | Найдите электронную конфигурацию | Са | |
| 31 | Найдите число нейтронов | Рх | |
| 32 | Найдите число нейтронов | На | |
| 33 | Найдите число нейтронов | Пт | |
| 34 | Найдите число нейтронов | Быть | Быть |
| 35 | Найдите число нейтронов | Кр | |
| 36 | Найдите массу 1 моля | Н_2SO_4 | |
| 37 | Найдите массу 1 моля | HCl | |
| 38 | Найдите массу 1 моля | Фе | |
| 39 | Найдите массу 1 моля | С | |
| 40 | Найдите число нейтронов | Медь | |
| 41 | Найдите число нейтронов | С | |
| 42 | Найдите степени окисления | Х | |
| 43 | Весы | CH_4+O_2→CO_2+H_2O | |
| 44 | Найдите атомную массу | О | |
| 45 | Найдите атомный номер | Х | |
| 46 | Найдите число нейтронов | Пн | |
| 47 | Найдите число нейтронов | ОС | |
| 48 | Найдите массу 1 моля | NaOH | |
| 49 | Найдите массу 1 моля | О | |
| 50 | Найдите электронную конфигурацию | Фе | |
| 51 | Найдите электронную конфигурацию | С | |
| 52 | Найдите массовые проценты | NaCl | |
| 53 | Найдите массу 1 моля | К | |
| 54 | Найдите массу отдельного атома | На | |
| 55 | Найдите количество нейтронов | Н | |
| 56 | Найдите число нейтронов | Ли | |
| 57 | Найдите число нейтронов | В | |
| 58 | Найдите число протонов | № 92О | |
| 60 | Упростить | ч*2р | |
| 61 | Определите, растворимо ли соединение в воде | Х | |
| 62 | Определение плотности на STP | Н_2О | |
| 63 | Найти степени окисления | NaCl | |
| 64 | Найдите атомную массу | Он | Он |
| 65 | Найдите атомную массу | мг | |
| 66 | Найдите число электронов | Х | |
| 67 | Найдите число электронов | О | |
| 68 | Найдите число электронов | С | |
| 69 | Найдите количество нейтронов | Пд | |
| 70 | Найдите число нейтронов | рт. |


 В качестве примера мы будем рассматривать изотоп углерода 14С. Поскольку неизотопный углерод 14С есть просто углерод С, найдите углерод в периодической таблице (второй период или второй ряд сверху).
В качестве примера мы будем рассматривать изотоп углерода 14С. Поскольку неизотопный углерод 14С есть просто углерод С, найдите углерод в периодической таблице (второй период или второй ряд сверху). Поскольку абсолютная часть атомной массы приходится на протоны и нейтроны, вычитание числа протонов (то есть атомного номера, который равен числу протонов) из атомной массы дает число нейтронов в атоме. В нашем примере: 14 (атомная масса) — 6 (число протонов) = 8 (число нейтронов).
Поскольку абсолютная часть атомной массы приходится на протоны и нейтроны, вычитание числа протонов (то есть атомного номера, который равен числу протонов) из атомной массы дает число нейтронов в атоме. В нашем примере: 14 (атомная масса) — 6 (число протонов) = 8 (число нейтронов).