Масса и энергия связи ядра
Масса и энергия связи ядраМасса ядра измеряется в атомных единицах массы (а.е.м). За одну атомную единицу массы принимается 1/12 часть массы нейтрального атома углерода 12 С: 1а.е.м = 1.6606 10-27 кг. А.е.м. выражается через энергетические единицы: 1а.е.м = 1.510-3 эрг = 1.510-10Дж = 931.49 МэВ Масса ядра всегда меньше суммы масс составляющих его нуклонов. Избыток масс Δ связан с массой атома Mат(A,Z) и массовым числом A соотношением: Δ = Мат(A,Z) — А. Энергия связи
ядра Eсв(A,Z) это минимальная энергия, необходимая, чтобы развалить
ядро на отдельные, составляющие его нуклоны. Есв(A, Z) = [Z mp + (A — Z)mn — M(A, Z)]c2, где Z — число протонов, ( A — Z) — число нейтронов, mp — масса протона, mn — масса нейтрона, М(A,Z) — масса ядра с
массовым числом А и зарядом Z. Есв(A, Z) = [ZmH + (A — Z)mn — Mат(A, Z)]c2 , где mH — масса атома водорода.
Удельная энергия связи ядра ε(A, Z) это энергия связи, приходящаяся на один нуклон ε(A, Z) = Eсв(A,Z) / A. На рис. 1 показана зависимость удельной
энергии связи ядра ε от числа нуклонов A. Видно, что наиболее сильно связаны
ядра в районе железа и никеля (A ~ 55-60). Используется также понятие энергия связи (отделения) частицы в ядре Энергия отделения нейтрона Bn = [М(А-1,Z) + mn − М(А, Z)]c2 = W(А, Z) − W(А-1,Z). Энергия отделения протона Bp = [М(А-1,Z-1) + mp − М(А, Z)]c2 = W(А, Z) − W(А-1,Z-1). Энергия отделения α-частицы Bα = [M(A-4,Z-2) + mα − M(A,Z)]c2 = W(A,Z) − W(A-4,Z-2) − W(4,2).
Наиболее устойчивы ядра, у которых магическое число протонов или нейтронов.
ЗАДАЧИ Подробно
о массовых формулах см. 17.11.15 | |||||||||||||
Относительная атомная масса химических элементов 8 класс онлайн-подготовка на Ростелеком Лицей
Модель Дж. Дальтона
В начале 19 в. (спустя 150 лет после работ Роберта Бойля) английский ученый Джон Дальтон предложил способ определения массы атомов химических элементов. Рассмотрим суть этого метода.
Дальтон предложил модель, в соответствии с которой в молекулу сложного вещества входит только по одному атому различных химических элементов. Например, он считал, что молекула воды состоит из 1 атома водорода и 1 атома кислорода. В состав простых веществ по Дальтону тоже входит только один атом химического элемента. Т.е. молекула кислорода должна состоять из одного атома кислорода.
Т.е. молекула кислорода должна состоять из одного атома кислорода.
И тогда, зная массовые доли элементов в веществе, легко определить во сколько раз масса атома одного элемента отличается от массы атома другого элемента. Таким образом, Дальтон считал, что массовая доля элемента в веществе определяется массой его атома.
Известно, что массовая доля магния в оксиде магния равна 60 %, а массовая доля кислорода – 40 %. Идя по пути рассуждений Дальтона, можно сказать, что масса атома магния больше массы атома кислорода в 1,5 раза (60/40 = 1,5):
Ученый заметил, что масса атома водорода самая маленькая, т. к. нет сложного вещества, в котором бы массовая доля водорода была бы больше массовой доли другого элемента. Поэтому он предложил массы атомов элементов сравнивать с массой атома водорода. И таким путем вычислил первые значения относительных (относительно атома водорода) атомных масс химических элементов.
Атомная масса водорода была принята за единицу. А значение относительной массы серы получилось равным 17. Но все полученные значения были либо приблизительными, либо неверными, т. к. техника эксперимента того времени была далека от совершенства и установка Дальтона о составе вещества была неверной.
Но все полученные значения были либо приблизительными, либо неверными, т. к. техника эксперимента того времени была далека от совершенства и установка Дальтона о составе вещества была неверной.
Исследование Й. Я. Берцелиуса
В 1807 – 1817 гг. шведский химик Йёнс Якоб Берцелиус провел огромное исследование по уточнению относительных атомных масс элементов. Ему удалось получить результаты, близкие к современным.
Относительная атомная масса
Значительно позже работ Берцелиуса массы атомов химических элементов стали сравнивать с 1/12 массы атома углерода (рис. 1).
Рис. 1. Модель расчета относительной атомной массы химического элемента
Относительная атомная масса химического элемента показывает, во сколько раз масса атома химического элемента больше 1/12 массы атома углерода.
Относительная атомная масс обозначается Аr, она не имеет единиц измерения, так как показывает отношение масс атомов.
Например: Аr(S) = 32, т. е. атом серы в 32 раза тяжелее 1/12 массы атома углерода.
Атомная единица массы
Абсолютная масса 1/12 атома углерода является эталонной единицей, значение которой вычислено с высокой точностью и составляет 1,66 *10-24 г или 1,66 *10-27 кг. Эта эталонная масса называется атомной единицей массы (а. е. м.).
Значения относительных атомных масс химических элементов запоминать не надо, они приведены в любом учебнике или справочнике по химии, а также в периодической таблице Д. И. Менделеева.
|
Знак химического элемента |
Аr |
|
H |
1 |
|
C |
12 |
|
N |
14 |
|
O |
16 |
|
Mg |
24 |
|
Na |
23 |
|
Al |
27 |
|
P |
31 |
|
S |
32 |
|
Cu |
64 |
При расчетах значения относительных атомных масс принято округлять до целых.
Исключение составляет относительная атомная масса хлора – для хлора используют значение 35,5.
Список рекомендованной литературы
- Сборник задач и упражнений по химии: 8-й класс: к учебнику П. А. Оржековского и др. «Химия, 8 класс» / П. А. Оржековский, Н. А. Титов, Ф. Ф. Гегеле. – М.: АСТ: Астрель, 2006.
- Ушакова О. В. Рабочая тетрадь по химии: 8-й кл.: к учебнику П. А. Оржековского и др. «Химия. 8 класс» / О. В. Ушакова, П. И. Беспалов, П. А. Оржековский; под. ред. проф. П. А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006. (с. 24-25)
- Химия: 8-й класс: учеб. для общеобр. учреждений / П. А. Оржековский, Л. М. Мещерякова, Л. С. Понтак. М.: АСТ: Астрель, 2005. (§10)
- Химия: неорг. химия: учеб. для 8 кл. общеобр. учреждений / Г. Е. Рудзитис, Ф. Г. Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2009. (§§8, 9)
- Энциклопедия для детей. Том 17. Химия / Глав. ред. В. А. Володин, вед. науч. ред.
 И. Леенсон. – М.: Аванта+, 2003.
И. Леенсон. – М.: Аванта+, 2003.
Дополнительные веб-ресурсы
- Единая коллекция цифровых образовательных ресурсов (Источник)
- Электронная версия журнала «Химия и жизнь» (Источник)
- Тесты по химии (онлайн) (Источник)
Домашнее задание
с. 24-25 №№ 1-7 из Рабочей тетради по химии: 8-й кл.: к учебнику П. А. Оржековского и др. «Химия. 8 класс» / О. В. Ушакова, П. И. Беспалов, П. А. Оржековский; под. ред. проф. П. А. Оржековского. — М.: АСТ: Астрель: Профиздат, 2006.
2.2.5: Средняя атомная масса — LibreTexts по биологии
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 8789
- Безграничный
- Безграничный
Средняя атомная масса элемента представляет собой сумму масс его изотопов, умноженных на их естественное содержание.
Цели обучения
- Вычислить среднюю атомную массу элемента, зная его изотопы и их распространенность в природе
Ключевые моменты
- Элемент может иметь разное количество нейтронов в ядре, но всегда имеет одинаковое количество протонов . Варианты элемента с разными нейтронами имеют разную массу и называются изотопами.
- Средняя атомная масса элемента рассчитывается путем суммирования масс изотопов элемента, умноженных на их естественное содержание на Земле.
- При выполнении любых расчетов массы элементов или соединений всегда используйте среднюю атомную массу, которую можно найти в периодической таблице.
Ключевые термины
- массовое число : общее количество протонов и нейтронов в атомном ядре.
- природное изобилие : Обилие определенного изотопа, естественным образом присутствующего на планете.
- средняя атомная масса : Масса, рассчитанная путем суммирования масс изотопов элемента, умноженных на их естественное содержание на Земле.

Атомный номер элемента определяет идентичность элемента и означает количество протонов в ядре одного атома. Например, элемент водород (самый легкий элемент) всегда будет иметь в ядре один протон. Элемент гелий всегда будет иметь два протона в своем ядре.
Изотопы
Однако атомы одного и того же элемента могут иметь разное количество нейтронов в ядре. Например, существуют стабильные атомы гелия, которые содержат один или два нейтрона, но оба атома имеют два протона. Эти разные типы атомов гелия имеют разную массу (3 или 4 атомные единицы массы), и их называют изотопами. Для любого данного изотопа сумма числа протонов и нейтронов в ядре называется массовым числом. Это потому, что каждый протон и каждый нейтрон весят одну атомную единицу массы (а.е.м.). Сложив количество протонов и нейтронов и умножив их на 1 а.е.м., можно рассчитать массу атома. Все элементы существуют в виде набора изотопов. Слово «изотоп» происходит от греческих слов «isos» (что означает «один и тот же») и «topes» (что означает «место»), потому что элементы могут занимать одно и то же место в периодической таблице, но иметь разное субатомное строение.
Расчет средней атомной массы
Средняя атомная масса элемента представляет собой сумму масс его изотопов, умноженную на его естественное содержание (десятичная дробь, связанная с процентом атомов этого элемента, принадлежащих к данному изотопа).
Средняя атомная масса = f 1 M 1 + f 2 M 2 +… + f n M n где f — доля естественного содержания изотопа, а M — массовое число (масса) изотопа.Среднюю атомную массу элемента можно найти в периодической таблице, обычно под символом элемента. Когда доступны данные о естественном содержании различных изотопов элемента, легко вычислить среднюю атомную массу.
- Для гелия примерно один изотоп гелия-3 приходится на каждый миллион изотопов гелия-4; поэтому средняя атомная масса очень близка к 4 а.
 е.м. (4,002602 а.е.м.).
е.м. (4,002602 а.е.м.). - Хлор состоит из двух основных изотопов: один с 18 нейтронами (75,77% атомов природного хлора), а другой с 20 нейтронами (24,23% атомов природного хлора). Атомный номер хлора 17 (у него в ядре 17 протонов).
Для расчета средней массы сначала преобразуйте проценты в дроби (разделите их на 100). Затем рассчитайте массовые числа. Изотоп хлора с 18 нейтронами имеет содержание 0,7577 и массовое число 35 а.е.м. Чтобы вычислить среднюю атомную массу, умножьте дробь на массовое число для каждого изотопа, а затем сложите их вместе.
Средняя атомная масса хлора = (0,7577 ⋅⋅ 35 а.е.м.) + (0,2423 ⋅⋅ 37 а.е.м.) = 35,48 а.е.м. с естественной численностью 19,9% и B-11 с численностью 80,1%. Следовательно,
Средняя атомная масса бора = (0,199⋅⋅10 а.е.м.) + (0,801⋅⋅11 а.е.м.) = 10,80 а.е.м. массы.
ЛИЦЕНЗИИ И ОТНОШЕНИЯ
CC ЛИЦЕНЗИОННОЕ СОДЕРЖИМОЕ, КОНКРЕТНОЕ АВТОРСТВО
- ионная связь. Предоставлено : Викисловарь.
 Расположен по адресу : en.wiktionary.org/wiki/ionic_bond. Лицензия : CC BY-SA: Attribution-ShareAlike
Расположен по адресу : en.wiktionary.org/wiki/ionic_bond. Лицензия : CC BY-SA: Attribution-ShareAlike - Колледж OpenStax, Биология. 16 октября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m44390/latest…ol11448/latest. Лицензия : CC BY: Атрибуция
- Биохимия/Обмен веществ и энергетика. Предоставлено : Wikibooks. Расположен по адресу : en.wikibooks.org/wiki/Biochem…%23Ionic_bonds. Лицензия : CC BY-SA: Attribution-ShareAlike
- ион. Предоставлено : Викисловарь. Расположен по адресу : en.wiktionary.org/wiki/ion. Лицензия : CC BY-SA: Attribution-ShareAlike
- Колледж OpenStax, Атомы, изотопы, ионы и молекулы: строительные блоки. 16 октября 2013 г. Предоставлено : OpenStax CNX.
 Расположен по адресу : http://cnx.org/content/m44390/latest…e_02_01_10.jpg. Лицензия : CC BY: Attribution
Расположен по адресу : http://cnx.org/content/m44390/latest…e_02_01_10.jpg. Лицензия : CC BY: Attribution - Колледж OpenStax, Биология. 16 октября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m44390/latest…ol11448/latest. Лицензия : CC BY: Attribution
- Биохимия/Обмен веществ и энергетика. Предоставлено : Wikibooks. Расположен по адресу : en.wikibooks.org/wiki/Biochem…%23Ionic_bonds. Лицензия : CC BY-SA: Attribution-ShareAlike
- диполь. Предоставлено : Викисловарь. Расположен по адресу : en.wiktionary.org/wiki/dipole. Лицензия : CC BY-SA: Attribution-ShareAlike ковалентная связь
- . Предоставлено : Викисловарь. Расположен по адресу : en.
 wiktionary.org/wiki/covalent_bond. Лицензия : CC BY-SA: Attribution-ShareAlike Водородная связь
wiktionary.org/wiki/covalent_bond. Лицензия : CC BY-SA: Attribution-ShareAlike Водородная связь - . Предоставлено : Викисловарь. Расположен по адресу : en.wiktionary.org/wiki/hydrogen_bond. Лицензия : CC BY-SA: Attribution-ShareAlike
- Колледж OpenStax, Атомы, изотопы, ионы и молекулы: строительные блоки. 16 октября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m44390/latest…e_02_01_10.jpg. Лицензия : CC BY: Attribution
- Колледж OpenStax, Атомы, изотопы, ионы и молекулы: строительные блоки. 16 октября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m44390/latest…e_02_01_11.jpg. Лицензия : CC BY: Attribution
- Структура АТФ. Предоставлено : Wikimedia.
 Расположен по адресу : commons.wikimedia.org/wiki/Fi…_structure.svg. Лицензия : Общественное достояние: Нет данных Авторские права
Расположен по адресу : commons.wikimedia.org/wiki/Fi…_structure.svg. Лицензия : Общественное достояние: Нет данных Авторские права - Водородная связь. Предоставлено : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/Hydrogen_bond. Лицензия : CC BY-SA: Attribution-ShareAlike
- электроотрицательность. Предоставлено : Викисловарь. Расположен по адресу : en.wiktionary.org/wiki/electronegativity. Лицензия : CC BY-SA: Attribution-ShareAlike
- межмолекулярный. Предоставлено : Викисловарь. Расположен по адресу : en.wiktionary.org/wiki/межмолекулярный. Лицензия : CC BY-SA: Attribution-ShareAlike
- Колледж OpenStax, Атомы, изотопы, ионы и молекулы: строительные блоки. 16 октября 2013 г.
 Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m44390/latest…e_02_01_10.jpg. Лицензия : CC BY: Attribution
Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m44390/latest…e_02_01_10.jpg. Лицензия : CC BY: Attribution - Колледж OpenStax, Атомы, изотопы, ионы и молекулы: строительные блоки. 16 октября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m44390/latest…e_02_01_11.jpg. Лицензия : CC BY: Attribution
- Структура АТФ. Предоставлено : Wikimedia. Расположен по адресу : commons.wikimedia.org/wiki/Fi…_structure.svg. Лицензия : Общественное достояние: Нет данных Copyright
- Файл:3D модель водородных связей в воде.svg — Википедия, бесплатная энциклопедия. Предоставлено : Википедия. Расположен по адресу : en.Wikipedia.org/w/index.php?…ter.svg&page=1. Лицензия : CC BY-SA: Attribution-ShareAlike
- Капли воды на зеленом листе.
 Предоставлено : Wikimedia Commons. Расположен по адресу : commons.wikimedia.org/wiki/Fi…green_leaf.jpg. Лицензия : CC BY-SA: Attribution-ShareAlike
Предоставлено : Wikimedia Commons. Расположен по адресу : commons.wikimedia.org/wiki/Fi…green_leaf.jpg. Лицензия : CC BY-SA: Attribution-ShareAlike - Число Авогадро и родинка. Предоставлено : Веб-сайт Стива Лоуера. Расположен по адресу : http://www.chem1.com/acad/webtext/intro/int-2.html#SEC2. Лицензия : CC BY-SA: Attribution-ShareAlike
- Моль (ед.). Предоставлено : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/Mole_(unit). Лицензия : CC BY-SA: Attribution-ShareAlike
- Постоянная Авогадро. Предоставлено : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/Avogadro_constant. Лицензия : CC BY-SA: Attribution-ShareAlike
- моль. Предоставлено : Викисловарь.
 Расположен по адресу : en.wiktionary.org/wiki/mole. Лицензия : CC BY-SA: Attribution-ShareAlike
Расположен по адресу : en.wiktionary.org/wiki/mole. Лицензия : CC BY-SA: Attribution-ShareAlike - Колледж OpenStax, Атомы, изотопы, ионы и молекулы: строительные блоки. 16 октября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m44390/latest…e_02_01_10.jpg. Лицензия : CC BY: Атрибуция
- Колледж OpenStax, Атомы, изотопы, ионы и молекулы: строительные блоки. 16 октября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m44390/latest…e_02_01_11.jpg. Лицензия : CC BY: Attribution
- Структура АТФ. Предоставлено : Wikimedia. Расположен по адресу : commons.wikimedia.org/wiki/Fi…_structure.svg. Лицензия : Общественное достояние: Авторские права неизвестны
- Файл:3D модель водородных связей в воде.
 svg — Википедия, бесплатная энциклопедия. Предоставлено : Википедия. Расположен по адресу : en.Wikipedia.org/w/index.php?…ter.svg&page=1. Лицензия : CC BY-SA: Attribution-ShareAlike
svg — Википедия, бесплатная энциклопедия. Предоставлено : Википедия. Расположен по адресу : en.Wikipedia.org/w/index.php?…ter.svg&page=1. Лицензия : CC BY-SA: Attribution-ShareAlike - Капли воды на зеленом листе. Предоставлено : Wikimedia Commons. Расположен по адресу : commons.wikimedia.org/wiki/Fi…green_leaf.jpg. Лицензия : CC BY-SA: Attribution-ShareAlike
- Крот, Авогадро. Расположен по адресу : http://www.youtube.com/watch?v=TqDqLmwWx3A. Лицензия : Общественное достояние: неизвестно Авторское право . Условия лицензии : Стандартная лицензия YouTube
- Авогадро Амедео. Предоставлено : Wikimedia. Расположен по адресу : en.Wikipedia.org/wiki/Avogadr…dro_Amedeo.jpg. Лицензия : Общественное достояние: Нет данных Copyright
- Введение в химию онлайн/Измерения и атомная структура.
 Предоставлено : Wikibooks. Расположен по адресу : en.wikibooks.org/wiki/Introdu…omic_Structure. Лицензия : CC BY-SA: Attribution-ShareAlike
Предоставлено : Wikibooks. Расположен по адресу : en.wikibooks.org/wiki/Introdu…omic_Structure. Лицензия : CC BY-SA: Attribution-ShareAlike - Атомная масса. Предоставлено : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/Atomic_mass. Лицензия : CC BY-SA: Attribution-ShareAlike
- Средняя атомная масса. Предоставлено : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/Average_atomic_mass. Лицензия : CC BY-SA: Attribution-ShareAlike
- природное изобилие. Предоставлено : Википедия. Расположен по адресу : en.Wikipedia.org/wiki/natural%20abundance. Лицензия : CC BY-SA: Attribution-ShareAlike
- Безграничный. Предоставлено : Безграничное обучение.
 Расположен по адресу : www.boundless.com//biology/de…atomic-mass—2. Лицензия : CC BY-SA: Attribution-ShareAlike изотоп
Расположен по адресу : www.boundless.com//biology/de…atomic-mass—2. Лицензия : CC BY-SA: Attribution-ShareAlike изотоп - . Предоставлено : Викисловарь. Расположен по адресу : en.wiktionary.org/wiki/isotope. Лицензия : CC BY-SA: Attribution-ShareAlike
- массовое число. Предоставлено : Викисловарь. Расположен по адресу : en.wiktionary.org/wiki/mass_number. Лицензия : CC BY-SA: Attribution-ShareAlike
- Колледж OpenStax, Атомы, изотопы, ионы и молекулы: строительные блоки. 16 октября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m44390/latest…e_02_01_10.jpg. Лицензия : CC BY: Attribution
- Колледж OpenStax, Атомы, изотопы, ионы и молекулы: строительные блоки.
 16 октября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m44390/latest…e_02_01_11.jpg. Лицензия : CC BY: Attribution
16 октября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m44390/latest…e_02_01_11.jpg. Лицензия : CC BY: Attribution - Структура АТФ. Предоставлено : Wikimedia. Расположен по адресу : commons.wikimedia.org/wiki/File:ATP_structure.svg. Лицензия : Общественное достояние: Нет данных Copyright
- Файл:3D модель водородных связей в воде.svg — Википедия, бесплатная энциклопедия. Предоставлено : Википедия. Расположен по адресу : en.Wikipedia.org/w/index.php?title=File:3D_model_hydrogen_bonds_in_water.svg&page=1. Лицензия : CC BY-SA: Attribution-ShareAlike
- Капли воды на зеленом листе. Предоставлено : Wikimedia Commons. Расположен по адресу : commons.wikimedia.org/wiki/Fi…green_leaf.
 jpg. Лицензия : CC BY-SA: Attribution-ShareAlike
jpg. Лицензия : CC BY-SA: Attribution-ShareAlike - Крот, Авогадро. Расположен по адресу : http://www.youtube.com/watch?v=TqDqLmwWx3A. Лицензия : Общественное достояние: неизвестно Авторское право . Условия лицензии : Стандартная лицензия YouTube
- Авогадро Амедео. Предоставлено : Wikimedia. Расположен по адресу : en.Wikipedia.org/wiki/Avogadr…dro_Amedeo.jpg. Лицензия : Общественное достояние: Нет данных Copyright
- Файл:Stylised Lithium Atom.svg — Википедия, свободная энциклопедия. Предоставлено : Википедия. Расположен по адресу : en.Wikipedia.org/w/index.php?…tom.svg&page=1. Лицензия : Общественное достояние: Нет данных Copyright
Эта страница под названием 2.2.5: Средняя атомная масса распространяется под лицензией CC BY-SA 4. 0 и была создана, изменена и/или курирована Boundless.
0 и была создана, изменена и/или курирована Boundless.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Безграничный
- Лицензия
- CC BY-SA
- Версия лицензии
- 4,0
- Показать оглавление
- нет
- Теги

Калькулятор средней атомной массы.0032 Содержание:
- Определение средней атомной массы
- Калькулятор средней атомной массы
- Уравнение средней атомной массы
- Как рассчитать среднюю атомную массу
- Содержание изотопов и средняя атомная масса
- Добро пожаловать в FAQ
- 3 калькулятор средней атомной массы! Этот инструмент будет полезен всем любителям химии, а также учащимся, которые, возможно, не слишком увлечены химией, но все же должны выполнять свои задания.
Здесь вы узнаете определение средней атомной массы, но это еще не все. Мы также обсудим разницу и взаимосвязь между атомной массой и средней атомной массой.
Определение средней атомной массы
Средняя атомная масса элемента — это средняя масса всех изотопов элемента.
Как мы знаем, атомная масса элемента равна приблизительно сумме протонов и нейтронов, присутствующих в ядре .
 В атоме каждый протон и нейтрон вносят вклад примерно в одну а.е.м., а электронная масса, будучи такой малой, пренебрежимо мала, поэтому атомная масса примерно равна массовому числу.
В атоме каждый протон и нейтрон вносят вклад примерно в одну а.е.м., а электронная масса, будучи такой малой, пренебрежимо мала, поэтому атомная масса примерно равна массовому числу.✅ Вы можете использовать наш калькулятор атомной массы, чтобы определить атомную массу элемента, используя его протоны и нейтроны .
Некоторые атомы одного и того же элемента имеют разное количество нейтронов, что не делает их новым элементом. Эти атомы элемента с одинаковым числом протонов и электронов, но с разным числом нейтронов называются изотопами . И здесь на помощь приходит средняя атомная масса.
Калькулятор средней атомной массы
Наш калькулятор средней атомной массы — это инструмент для вашего удобства и знаний. Он прост в использовании и эффективно определяет среднюю атомную массу элементов.
Давайте рассмотрим необходимые шаги.
- Введите процентное содержание первого элемента, убедившись, что вы выбрали правильную единицу измерения, % для процентного содержания и десятичное число для дробного содержания.

- Введите массу первого изотопа;
- Введите процент содержания второго изотопа;
- Введите массу второго изотопа; и
- Результатом является средняя атомная масса, выраженная как атомных единиц массы (а.е.м.).
🔎 Вы можете рассчитать среднюю атомную массу до 10 элементов , так как наибольшее количество стабильных изотопов одного из элементов равно 10. Можете ли вы угадать, какой это элемент?
Уравнение средней атомной массы
С формулой средней атомной массы легко работать, если вы понимаете основы вычислений.
Использует изотопное содержание элемента в процентах и атомную массу изотопа в единицах атомной массы (а.е.м.) .
Уравнение средней атомной массы:
AM=f1m1+f2m2+…+fnmn\small\text {AM} = \text{f}_1\text{m}_1 + \text{f}_2\ text{m}_2 + … + \text{f}_n\text{m}_nAM=f1m1+f2m2+…+fnmn
где:
- AM\ text{AM}AM – средняя атомная масса;
- fₙ \text{fₙ }fₙ – природное содержание n-го изотопа; и
- мₙ\text{мₙ}мₙ — атомная масса n-го изотопа.

🔎 И вы угадали, элемент с десятью и наибольшим количеством стабильных изотопов это олово .
Как рассчитать среднюю атомную массу
Средняя атомная масса основана на содержании изотопа и массе изотопа . Таким образом, в расчете участвуют обе переменные. Вопросы, расчеты, ответы, вы хотите все это, а значит, все это у нас есть.
- Как рассчитать среднюю атомную массу изотопов?
- Как найти среднюю атомную массу с процентным содержанием? и
- Какова формула средней атомной массы?
Независимо от того, что из этого вам интересно, мы удовлетворим вас.
Итак, уравнение средней атомной массы, как упоминалось выше, имеет вид:
AM=f1m1+f2m2+…+fnmn\small\text {AM} = \text{f}_1\text{m}_1 + \text{f}_2\text{m}_2 + … + \text{f}_n\text{m}_nAM=f1m1+f2m2+…+fnmn
Это может показаться сложным уравнением, но не беспокойтесь; это не.
 Это кусок пирога. Теперь давайте посмотрим, из чего сделан этот кусок пирога и поймем , как найти среднюю атомную массу с процентным содержанием.
Это кусок пирога. Теперь давайте посмотрим, из чего сделан этот кусок пирога и поймем , как найти среднюю атомную массу с процентным содержанием. -процентное содержание изотопа — это содержание или количество изотопа, которое естественным образом существует на планете . Это причудливый способ сказать, какое количество изотопа существует?
Первым шагом является умножение содержания изотопа на массу изотопа. Сделайте это для каждого изотопа доступного элемента.
Затем сложите произведения изобилия и массы, полученные на первом шаге.
Результатом является средняя атомная масса.
Просто, но увлекательно, не так ли? А если вы хотите использовать аналогичные инструменты, воспользуйтесь нашим калькулятором молекулярной массы.
Содержание изотопов и средняя атомная масса
Мы знакомы с атомной массой элемента с тех пор, как начали изучать элементы и их атомы.
 Это масса одного атома этого элемента.
Это масса одного атома этого элемента.Экспериментально рассчитывается с помощью масс-спектрометрии (аналитический метод, используемый для измерения отношения массы к заряду ионов). Но мы можем вычислить это по , сложив число протонов и нейтронов в ядре атома . Этот расчет дает нам массу одного атома элемента. Единица атомной массы не входит в систему СИ, аму (атомная единица массы) .
Затем появились изотопы, атомы, которые немного различаются по атомной массе из-за разного количества нейтронов в их ядрах. Изотопы стали причиной расчета средних атомных масс, так как мы должны учитывать изотопы элемента. Средняя атомная масса выражает атомную массу элементов с изотопами. 9Блок 0053 также является аму .
Но средняя атомная масса зависит еще от одного критического аспекта, содержания изотопов. Обилие изотопов элемента, встречающегося в природе, выраженное в процентах.
Итак, технически и атомная масса, и средняя атомная масса являются атомными массами, но одна представляет собой отдельный атом, а другая представляет собой среднее значение изотопов .

💡 Если вас интересуют изотопы, вы также можете узнать об ионах, тогда не забудьте проверить наш калькулятор ионной силы, который быстро вычисляет ионную силу раствора.
Часто задаваемые вопросы
Как рассчитать среднюю атомную массу изотопов?
Для расчета средней атомной массы можно использовать простую формулу.
АМ = f₁ × m₁ + f₂ × m₂ + … + fₙ × mₙ
где:
- AM – средняя атомная масса;
- fₙ – Естественное содержание n-го изотопа; и
- mₙ – Атомная масса n-го изотопа.
Все, что вам нужно сделать, это:
- Умножьте естественное содержание на атомную массу каждого изотопа.
- Суммируйте всех продуктов, полученных на первом этапе.
- Полученное значение представляет собой среднюю атомную массу элемента.
Какова средняя атомная масса хлора?
Два стабильных изотопа хлора — это 3⁵Cl и 3⁷Cl.

Их атомные массы составляют 34,96885 а.е.м. и 36,96590 а.е.м. А их естественная численность составляет 75,78% и 24,22% соответственно.
AM = (масса ³⁵C × изотопное изобилие ³⁵C) + (масса ³⁷cl × изотопическое содержание ³⁷cl)
Заменить значения:
AM = [34,96885555585) +25555855551961 гг. ]/100
AM = 35,452536 а.е.м.
Является ли средняя масса такой же, как атомная масса?
Иногда их принимают друг за друга, они немного отличаются .
Атомная масса равна приблизительной сумме протонов и нейтронов присутствует в ядре элемента.
Атомы некоторых элементов имеют разное количество нейтронов, в результате чего образуются изотопы. Это означает, что каждый изотоп имеет свою атомную массу. Итак, мы вычисляем среднее значение для атомных масс изотопов на основе их масс (а.е.м.) и естественного содержания (%) , известного как средняя атомная масса.

- Введите процентное содержание первого элемента, убедившись, что вы выбрали правильную единицу измерения, % для процентного содержания и десятичное число для дробного содержания.


 Такой ход зависимости ε(A)
показывает, что для легких ядер энергетически выгодны реакции синтеза более
тяжелых ядер, а тяжелых − деление на более легкие осколки.
Такой ход зависимости ε(A)
показывает, что для легких ядер энергетически выгодны реакции синтеза более
тяжелых ядер, а тяжелых − деление на более легкие осколки. Н.Н. Колесников.
Массы ядер и массовые формулы.
Н.Н. Колесников.
Массы ядер и массовые формулы.

 е.м. (4,002602 а.е.м.).
е.м. (4,002602 а.е.м.).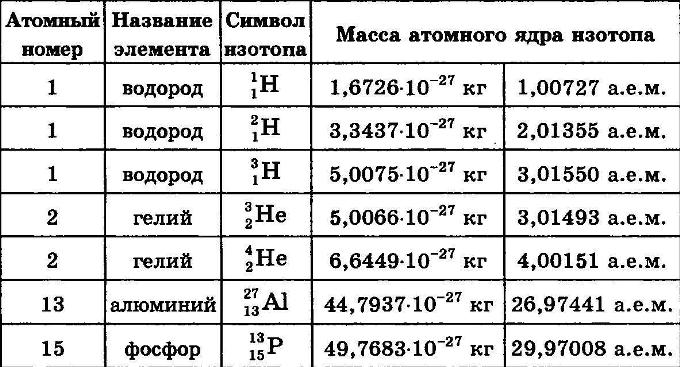 Расположен по адресу : en.wiktionary.org/wiki/ionic_bond. Лицензия : CC BY-SA: Attribution-ShareAlike
Расположен по адресу : en.wiktionary.org/wiki/ionic_bond. Лицензия : CC BY-SA: Attribution-ShareAlike  Расположен по адресу : http://cnx.org/content/m44390/latest…e_02_01_10.jpg. Лицензия : CC BY: Attribution
Расположен по адресу : http://cnx.org/content/m44390/latest…e_02_01_10.jpg. Лицензия : CC BY: Attribution  wiktionary.org/wiki/covalent_bond. Лицензия : CC BY-SA: Attribution-ShareAlike
wiktionary.org/wiki/covalent_bond. Лицензия : CC BY-SA: Attribution-ShareAlike  Расположен по адресу : commons.wikimedia.org/wiki/Fi…_structure.svg. Лицензия : Общественное достояние: Нет данных Авторские права
Расположен по адресу : commons.wikimedia.org/wiki/Fi…_structure.svg. Лицензия : Общественное достояние: Нет данных Авторские права  Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m44390/latest…e_02_01_10.jpg. Лицензия : CC BY: Attribution
Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m44390/latest…e_02_01_10.jpg. Лицензия : CC BY: Attribution  Предоставлено : Wikimedia Commons. Расположен по адресу : commons.wikimedia.org/wiki/Fi…green_leaf.jpg. Лицензия : CC BY-SA: Attribution-ShareAlike
Предоставлено : Wikimedia Commons. Расположен по адресу : commons.wikimedia.org/wiki/Fi…green_leaf.jpg. Лицензия : CC BY-SA: Attribution-ShareAlike  Расположен по адресу : en.wiktionary.org/wiki/mole. Лицензия : CC BY-SA: Attribution-ShareAlike
Расположен по адресу : en.wiktionary.org/wiki/mole. Лицензия : CC BY-SA: Attribution-ShareAlike  svg — Википедия, бесплатная энциклопедия. Предоставлено : Википедия. Расположен по адресу : en.Wikipedia.org/w/index.php?…ter.svg&page=1. Лицензия : CC BY-SA: Attribution-ShareAlike
svg — Википедия, бесплатная энциклопедия. Предоставлено : Википедия. Расположен по адресу : en.Wikipedia.org/w/index.php?…ter.svg&page=1. Лицензия : CC BY-SA: Attribution-ShareAlike  Предоставлено : Wikibooks. Расположен по адресу : en.wikibooks.org/wiki/Introdu…omic_Structure. Лицензия : CC BY-SA: Attribution-ShareAlike
Предоставлено : Wikibooks. Расположен по адресу : en.wikibooks.org/wiki/Introdu…omic_Structure. Лицензия : CC BY-SA: Attribution-ShareAlike  Расположен по адресу : www.boundless.com//biology/de…atomic-mass—2. Лицензия : CC BY-SA: Attribution-ShareAlike
Расположен по адресу : www.boundless.com//biology/de…atomic-mass—2. Лицензия : CC BY-SA: Attribution-ShareAlike  16 октября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m44390/latest…e_02_01_11.jpg. Лицензия : CC BY: Attribution
16 октября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : http://cnx.org/content/m44390/latest…e_02_01_11.jpg. Лицензия : CC BY: Attribution  jpg. Лицензия : CC BY-SA: Attribution-ShareAlike
jpg. Лицензия : CC BY-SA: Attribution-ShareAlike 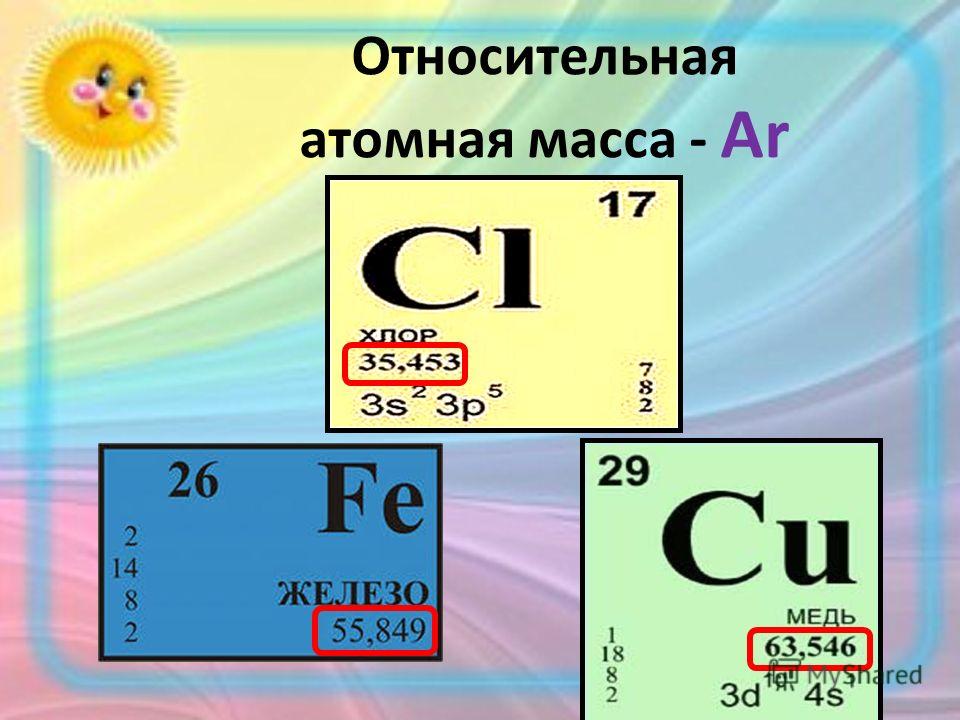
 В атоме каждый протон и нейтрон вносят вклад примерно в одну а.е.м., а электронная масса, будучи такой малой, пренебрежимо мала, поэтому атомная масса примерно равна массовому числу.
В атоме каждый протон и нейтрон вносят вклад примерно в одну а.е.м., а электронная масса, будучи такой малой, пренебрежимо мала, поэтому атомная масса примерно равна массовому числу.

 Это кусок пирога. Теперь давайте посмотрим, из чего сделан этот кусок пирога и поймем , как найти среднюю атомную массу с процентным содержанием.
Это кусок пирога. Теперь давайте посмотрим, из чего сделан этот кусок пирога и поймем , как найти среднюю атомную массу с процентным содержанием.  Это масса одного атома этого элемента.
Это масса одного атома этого элемента.

