| 1 | Найти число нейтронов | H | |
| 2 | Найти массу одного моля | H_2O | |
| 3 | Баланс | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 4 | Найти массу одного моля | H | |
| 5 | Найти число нейтронов | Fe | |
| 6 | Найти число нейтронов | Tc | |
| 7 | Найти конфигурацию электронов | H | |
| 8 | Найти число нейтронов | Ca | |
| 9 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 10 | Найти число нейтронов | C | |
| 11 | Найти число протонов | H | |
| 12 | Найти число нейтронов | O | |
| 13 | Найти массу одного моля | CO_2 | |
| 14 | Баланс | C_8H_18+O_2→CO_2+H_2O | |
| 15 | Найти атомную массу | H | |
| 16 | Определить, растворима ли смесь в воде | H_2O | |
| 17 | Найти конфигурацию электронов | Na | |
| 18 | Найти массу одного атома | H | |
| 19 | Найти число нейтронов | Nb | |
| 20 | Найти число нейтронов | Au | |
| 21 | Найти число нейтронов | Mn | |
| 22 | Найти число нейтронов | Ru | |
| 23 | Найти конфигурацию электронов | ||
| 24 | Найти массовую долю | H_2O | |
| 25 | Определить, растворима ли смесь в воде | NaCl | |
| 26 | Найти эмпирическую/простейшую формулу | H_2O | |
| 27 | Найти степень окисления | H_2O | |
| 28 | Найти конфигурацию электронов | K | |
| 29 | Найти конфигурацию электронов | Mg | |
| 30 | Найти конфигурацию электронов | Ca | |
| 31 | Найти число нейтронов | Rh | |
| 32 | Найти число нейтронов | Na | |
| 33 | Найти число нейтронов | Pt | |
| 34 | Найти число нейтронов | Be | Be |
| 35 | Найти число нейтронов | Cr | |
| 36 | Найти массу одного моля | H_2SO_4 | |
| 37 | Найти массу одного моля | HCl | |
| 38 | Найти массу одного моля | Fe | |
| 39 | Найти массу одного моля | C | |
| 40 | Найти число нейтронов | Cu | |
| 41 | Найти число нейтронов | S | |
| 42 | Найти степень окисления | H | |
| 43 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 44 | Найти атомную массу | O | |
| 45 | Найти атомное число | H | |
| 46 | Найти число нейтронов | Mo | |
| 47 | Найти число нейтронов | Os | |
| 48 | Найти массу одного моля | NaOH | |
| 49 | Найти массу одного моля | O | |
| 50 | Найти конфигурацию электронов | Fe | |
| 51 | Найти конфигурацию электронов | C | |
| 52 | Найти массовую долю | NaCl | |
| 53 | Найти массу одного моля | ||
| 54 | Найти массу одного атома | Na | |
| 55 | Найти число нейтронов | N | |
| 56 | Найти число нейтронов | Li | |
| 57 | Найти число нейтронов | V | |
| 58 | Найти число протонов | N | |
| 59 | Упростить | H^2O | |
| 60 | Упростить | h*2o | |
| 61 | Определить, растворима ли смесь в воде | H | |
| 62 | Найти плотность при стандартной температуре и давлении | H_2O | |
| 63 | Найти степень окисления | NaCl | |
| 64 | Найти атомную массу | He | He |
| 65 | Найти атомную массу | Mg | |
| 66 | Найти число электронов | H | |
| 67 | Найти число электронов | O | |
| 68 | Найти число электронов | S | |
| 69 | Найти число нейтронов | Pd | |
| 70 | Найти число нейтронов | Hg | |
| 71 | Найти число нейтронов | B | |
| 72 | Найти массу одного атома | Li | |
| 73 | Найти эмпирическую формулу | H=12% , C=54% , N=20 | , , |
| 74 | Найти число протонов | Be | Be |
| 75 | Найти массу одного моля | Na | |
| 76 | Найти конфигурацию электронов | Co | |
| 77 | Найти конфигурацию электронов | S | |
| 78 | Баланс | C_2H_6+O_2→CO_2+H_2O | |
| 79 | Баланс | H_2+O_2→H_2O | |
| 80 | Найти конфигурацию электронов | P | |
| 81 | Найти конфигурацию электронов | Pb | |
| 82 | Найти конфигурацию электронов | Al | |
| 83 | Найти конфигурацию электронов | Ar | |
| 84 | Найти массу одного моля | O_2 | |
| 85 | Найти массу одного моля | H_2 | |
| 86 | Найти число нейтронов | K | |
| 87 | Найти число нейтронов | P | |
| 88 | Найти число нейтронов | Mg | |
| 89 | Найти число нейтронов | W | |
| 90 | Найти массу одного атома | C | |
| 91 | Упростить | na+cl | |
| 92 | Определить, растворима ли смесь в воде | H_2SO_4 | |
| 93 | Найти плотность при стандартной температуре и давлении | NaCl | |
| 94 | Найти степень окисления | C_6H_12O_6 | |
| 95 | Найти степень окисления | Na | |
| 96 | Определить, растворима ли смесь в воде | C_6H_12O_6 | |
| 97 | Найти атомную массу | Cl | |
| 98 | Найти атомную массу | Fe | |
| 99 | Найти эмпирическую/простейшую формулу | CO_2 | |
| 100 | Найти число нейтронов | Mt |
Относительная атомная масса и молекулярная масса веществ и элементов в таблице (химия, 8 класс)
4. 6
6
Средняя оценка: 4.6
Всего получено оценок: 1148.
4.6
Средняя оценка: 4.6
Всего получено оценок: 1148.
Для измерения массы атома используется относительная атомная масса, которая выражается в атомных единицах массы (а. е. м.). Относительная молекулярная масса складывается из относительных атомных масс веществ.
Понятия
Для осознания, что такое относительная атомная масса в химии, следует понимать, что абсолютная масса атома слишком мала, чтобы выражать её в граммах, а тем более в килограммах. Поэтому в современной химии за атомную единицу массы (а. е. м.) взята 1/12 часть массы углерода. Относительная атомная масса равна отношению абсолютной массы к 1/12 абсолютной массы углерода. Другими словами относительная масса отражает, во сколько раз масса атома конкретного вещества превышает 1/12 массы атома углерода. Например, относительная масса азота – 14, т.е. атом азота содержит 14 а. е. м. или в 14 раз больше, чем 1/12 часть атома углерода.
Среди всех элементов водород самый лёгкий, его масса равна 1 единице. Самые тяжёлые атомы имеют массу в 300 а. е. м.
Молекулярная масса – значение, показывающее, во сколько раз масса молекулы превышает 1/12 часть массы углерода. Также выражается в а. е. м. Масса молекулы складывается из массы атомов, поэтому для вычисления относительной молекулярной массы необходимо сложить значения масс атомов вещества. Например, относительная молекулярная масса воды равна 18. Это значение складывается из относительных атомных масс двух атомов водорода (2) и одного атома кислорода (16).
Рис. 2. Углерод в периодической таблице.Как видно, эти два понятия имеют несколько общих характеристик:
- относительная атомная и молекулярная массы вещества – безразмерные величины;
- относительная атомная масса имеет обозначение Ar, молекулярная – Mr;
- единица измерения одинакова в обоих случаях – а. е.
 м.
м.
Молярная и молекулярная массы совпадают численно, но отличаются по размерности. Молярная масса – это отношение массы вещества к количеству молей. Она отражает массу одного моля, который равен числу Авогадро, т.е. 6,02 ⋅ 10 23. Например, 1 моль воды весит 18 г/моль, а Mr(Н2О) = 18 а. е. м. (тяжелее в 18 раз одной атомной единицы массы).
Как рассчитать
Чтобы выразить относительную атомную массу математически, следует определить, что 1/2 часть углерода или одна атомная единица массы равна 1,66⋅10−24 г. Следовательно, формула относительной атомной массы имеет следующий вид:
Ar(X) = ma(X) / 1,66⋅10−24,
где ma – абсолютная атомная масса вещества.
Относительная атомная масса химических элементов указана в периодической таблице Менделеева, поэтому её не нужно рассчитывать самостоятельно при решении задач. Относительные атомные массы принято округлять до целых. Исключение составляет хлор. Масса его атомов равна 35,5.
Исключение составляет хлор. Масса его атомов равна 35,5.
Следует обратить внимание, что при расчёте относительной атомной массы элементов, имеющих изотопы, учитывается их среднее значение. Атомная масса в этом случае высчитывается следующим образом:
Ar = ΣAr,ini,
где Ar,i – относительная атомная масса изотопов, ni – содержание изотопов в природных смесях.
Например, кислород имеет три изотопа – 16О,17О, 18О. Их относительная масса равна 15,995, 16,999, 17,999, а их содержание в природных смесях – 99,759 %, 0,037 %, 0,204 % соответственно. Поделив проценты на 100 и подставив значения, получим:
Ar = 15,995 ∙ 0,99759 + 16,999 ∙ 0,00037 + 17,999 ∙ 0,00204 = 15,999 а.е.м.
Обратившись к периодической таблице, легко найти это значение в клетке кислорода.
Рис. 3. Таблица Менделеева.Относительная молекулярная масса – сумма масс атомов вещества:
Mr = ΣAr.
При определении значения относительной молекулярной массы учитываются индексы символов. Например, вычисление массы H2CO3 выглядит следующим образом:
Mr = 1 ∙ 2 + 12 + 16 ∙ 3 = 62 а. е. м.
Зная относительную молекулярную массу, можно вычислить относительную плотность одного газа по второму, т.е. определить, во сколько раз одно газообразное вещество тяжелее второго. Для этого используется уравнение D(y)x = Mr(х) / Mr(y).
Что мы узнали?
Из урока 8 класса узнали об относительной атомной и молекулярной массе. За единицу относительной атомной массы принята 1/12 часть массы углерода, равная 1,66⋅10−24 г. Для вычисления массы необходимо абсолютную атомную массу вещества разделить на атомную единицу массы (а. е. м.). Значение относительной атомной массы указано в периодической системе Менделеева в каждой клетке элемента. Молекулярная масса вещества складывается из суммы относительных атомных масс элементов.
Тест по теме
Доска почёта
Чтобы попасть сюда — пройдите тест.
Александр Котков
10/10
Захар Харитонов
10/10
Александр Котков
10/10
Евгения Медникова
10/10
Александр Котков
10/10
Сергей Ефремов
9/10
Сергей Макаров
10/10
Вася Загайнов
9/10
Оценка доклада
4.6
Средняя оценка: 4.6
Всего получено оценок: 1148.
А какая ваша оценка?
Формула атомной массы — расчет, примеры решений и часто задаваемые вопросы
Материя состоит из очень маленьких частиц, называемых атомами. Он описывается как нечто, что занимает пространство и имеет массу. Физическое свойство материи — это масса. Атомная масса упоминается как масса атома или молекулы. В этой статье мы изучим формулу атомной массы, формулу молярной массы и формулу средней атомной массы, которая поможет рассчитать субатомные частицы, а также массу атома.
Формула атомного номера
Атомный номер представляет собой номер. протонов в ядре атома. Формула для атомного номера:
Атомный номер = нет. протонов, находящихся в ядре атома.
Атомная масса
Сумма масс протонов, нейтронов и электронов в атоме или группе атомов является атомной массой. В отличие от протонов или нейтронов, электроны имеют гораздо меньшую массу, поэтому масса электронов в расчет не входит.
Формула атомной массы = Масса протонов + Масса нейтронов + Масса электронов
Относительная атомная масса элемента представляет собой общую массу встречающихся в природе изотопов элемента по отношению к массе атома 12C, что означает относительная атомная масса ровно 12 дается одному атому.
Масса электронов пренебрежимо мала и, следовательно, не всегда учитывается. Таким образом, атомная масса атома обычно называется массой всех присутствующих протонов и нейтронов, объединенных вместе. Но из-за массы электронов существует небольшая разница между фактической массой атома, записанной в периодической таблице, и атомной массой, полученной с помощью способов расчета атомной массы, которым обучают студентов.
Таким образом, атомная масса атома обычно называется массой всех присутствующих протонов и нейтронов, объединенных вместе. Но из-за массы электронов существует небольшая разница между фактической массой атома, записанной в периодической таблице, и атомной массой, полученной с помощью способов расчета атомной массы, которым обучают студентов.
Расчет атомной массы
Существует три различных метода расчета атомной массы: представление элемента.
Например-
(изображение будет загружено в ближайшее время)
В целом, однако, атомная масса атома будет очень похожа на его массовое число, хотя десятичные разряды будут иметь некоторые различия.
Добавление протонов и нейтронов
Чтобы рассчитать массу отдельного атома элемента, можно использовать количество протонов и нейтронов, присутствующих в них. Складывая массы каждого протона и нейтрона, присутствующих в ядре данного атома, можно извлечь атомную массу этого атома. В расплывчатой терминологии атомная масса также может быть определена как число протонов и нейтронов.
Складывая массы каждого протона и нейтрона, присутствующих в ядре данного атома, можно извлечь атомную массу этого атома. В расплывчатой терминологии атомная масса также может быть определена как число протонов и нейтронов.
Например, подумайте, должен ли учащийся найти атомную массу изотопа атома кислорода с 10 нейтронами, присутствующими в их ядре. Студент сможет найти с помощью периодической таблицы, что атомы кислорода имеют 8 протонов и 8 электронов в них. Таким образом, сумма этих двух величин даст 18, что будет атомной массой этого определенного атома изотопов кислорода в терминах аму (единицы атомной массы). Средняя атомная масса этого изотопа составляет 17,999 или 18 (прибл.).
Средняя атомная масса различных элементов определяется путем умножения атомной массы каждого изотопа на его фракционное содержание и сложения полученного значения.
 Например, хлор содержит два типа атомов с относительными массами 35u и 37u. Относительное содержание этих изотопов в природе находится в соотношении 3:1. Таким образом, атомная масса хлора представляет собой среднее значение этих различных относительных масс.
Например, хлор содержит два типа атомов с относительными массами 35u и 37u. Относительное содержание этих изотопов в природе находится в соотношении 3:1. Таким образом, атомная масса хлора представляет собой среднее значение этих различных относительных масс.
Таким образом, формула средней атомной массы хлора = {(35 х 3) + (37 х 1)} / 4 = 35,5u
Atomic Mass of Elements
Element | Atomic Mass |
Lithium | 6.9 |
Carbon | 12 |
Натрий | 22,9 |
Калий | 3 06 |
Относительная атомная масса
Отношение между массой элемента и числом содержащихся в нем атомов называется относительной атомной массой элемента. Для измерения масс отдельных атомов используется шкала относительной атомной массы.
Для измерения масс отдельных атомов используется шкала относительной атомной массы.
Относительная атомная масса, равная 1, изначально была присвоена атому водорода, самому легкому атому, и относительной атомной массе других атомов по сравнению с этой.
Относительная атомная масса элементов
Element | Relative Atomic Mass |
Hydrogen | 1 |
Carbon | 12 |
Oxygen | 16 |
Решенные примеры
Пример 1. Найдите элемент с массовым числом, атомный номер которого равен 15, а количество присутствующих нейтронов равно 15.
Решение: можно рассчитать по формуле молярной массы
Атомный номер = количество присутствующих протонов
Массовое число = количество протонов + количество нейтронов
В химии важно определение атомного веса, так как большинство химических реакций протекают в соответствии с простым числовым соотношением между атомами. Поскольку невозможно явно подсчитать атомы в веществе, химики количественно определяют реагенты и продукты, измеряя и используя измерения атомного веса, чтобы сделать свои выводы. 923 — описывает количество атомов в моле элемента. Взвешивание образца элемента дает его массу в граммах. Если у вас есть все три элемента информации — атомный вес, граммы и число Авогадро — вы можете рассчитать количество атомов в образце.
TL;DR (слишком длинный; не читал)
Чтобы рассчитать количество атомов в образце, разделите его вес в граммах на атомную массу аму из периодической таблицы, а затем умножьте результат на число Авогадро: 6,02 х 10^23.
Выразите взаимосвязь между тремя частями информации, необходимой для расчета количества атомов в образце, в виде уравнения. Ученые выражают атомный вес в граммах на моль, поэтому полученное уравнение выглядит так: атомный вес, выраженный в единицах атомной массы = грамм/моль. В научной записи это выглядело бы так: u = г/моль.
Найдите атомный вес образца в периодической таблице элементов. Например, атомный вес бора составляет 10,811 атомных единиц массы, что также можно выразить как 10,811 грамма на моль элемента. Подстановка этой цифры в приведенное выше уравнение будет выглядеть так: 10,811 = г/моль.
Решите уравнение для неизвестной величины; если u = г/моль и у вас есть число для u и g, то вашей целью является количество молей. Умножьте все на делитель, чтобы выделить неизвестную величину, и вы получите уравнение, которое выглядит так: моль = g ÷ u, где g равно весу образца в граммах, а u равно атомному весу элемента в атомных единицах массы.
Разделите граммы вашего образца на его атомный вес, чтобы получить количество молей, содержащихся в образце.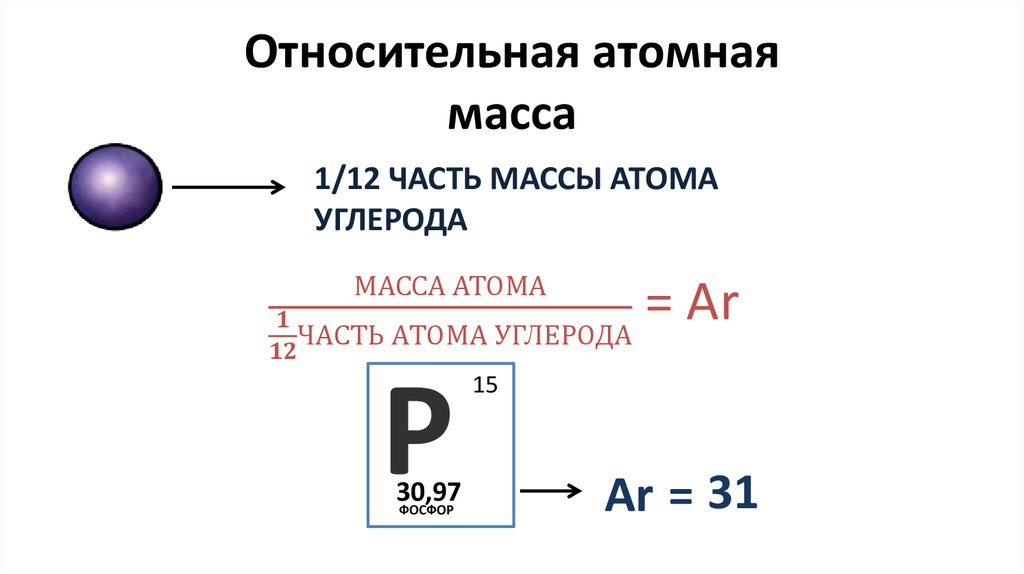

 м.
м. Например, хлор содержит два типа атомов с относительными массами 35u и 37u. Относительное содержание этих изотопов в природе находится в соотношении 3:1. Таким образом, атомная масса хлора представляет собой среднее значение этих различных относительных масс.
Например, хлор содержит два типа атомов с относительными массами 35u и 37u. Относительное содержание этих изотопов в природе находится в соотношении 3:1. Таким образом, атомная масса хлора представляет собой среднее значение этих различных относительных масс.