Молярная масса — что это? Как рассчитать? Формулы и примеры
Поможем понять и полюбить химию
Начать учиться
163.1K
Для решения многих задач по химии нужно знать количество молекул или других частиц, необходимое для реакции. Однако оперировать столь малыми числами неудобно, поэтому ученые ввели новые величины. В этой статье вы познакомитесь с такими понятиями, как моль, количество вещества, молярная масса в химии.
Что такое моль
Прежде чем говорить о том, как найти молярную массу вещества, определимся с понятием «моль». Его ввели как искусственную величину для упрощения расчетов. Это количество вещества, в котором содержится столько же мельчайших частиц, сколько в 12 г одного из изотопов углерода — C12.
Для всех химических веществ это количество одинаково и представляет собой число Авогадро 6,02 · 1023. Постоянная Авогадро обозначается NA, а измеряется в моль-1.
Постоянная Авогадро обозначается NA, а измеряется в моль-1.
Число Авогадро — это количество молекул, ионов или других мельчайших частиц в 1 моле вещества.
NA = 6,02 · 1023 моль-1.
Историческая справка
В 1811 году химик Амедео Авогадро предположил, что если взять два равных объема газов в равных значимых условиях (при одинаковой температуре и давлении), то количество молекул в этих объемах тоже будет одинаковым. Опираясь на свою гипотезу, он определил атомные и молекулярные массы многих веществ, а также рассчитал количество атомов в молекулах воды, оксидов азота и т. д. Однако в научных кругах гипотеза Авогадро долго не находила понимания. Общепринятой она стала только в 1860 году.
Узнай, какие профессии будущего тебе подойдут
Пройди тест — и мы покажем, кем ты можешь стать, а ещё пришлём подробный гайд, как реализовать себя уже сейчас
Что такое молярная масса
Молярная масса — это масса одного моля вещества, она измеряется в граммах деленных на моль (г/моль). Данная величина представляет собой отношение массы вещества к его количеству, которое измеряется в молях.
Данная величина представляет собой отношение массы вещества к его количеству, которое измеряется в молях.
Как обозначается молярная масса: М.
, где — это масса вещества, а — количество вещества.
Единица измерения молярной массы: г/моль.
Запоминаем!
Правильно говорить именно молярная, а не мольная масса.
Несмотря на то, что в 1 моле любого химического вещества содержится одинаковое количество молекул (и оно равно числу Авогадро), молярные массы разных веществ отличаются. Все потому, что отличаются атомы, которые входят в состав этих молекул. В частности, разница между ними заключается в относительной атомной массе (Ar) — например, Ar(Mg) = 24, а Ar(Hg) = 200. Сейчас станет ясно, какое это имеет значение.
Как определить молярную массу
Данная величина тесно связана с такими понятиями, как относительные атомная и молекулярная массы. Именно относительные, потому что абсолютную массу молекулы или атома вещества в химии не используют для решения задач — это слишком малые величины.
Именно относительные, потому что абсолютную массу молекулы или атома вещества в химии не используют для решения задач — это слишком малые величины.
Относительная атомная масса вещества (Ar) показывает, во сколько раз его атом больше 1/12 атома углерода. Это значение для каждого химического элемента можно увидеть в таблице Менделеева.
Относительная молекулярная масса (Mr) складывается из Ar каждого атома в молекуле вещества с учетом индексов. Она показывает, на сколько масса молекулы больше 1/12 атома углерода.
, где — это количество атомов.
Разберемся на примерах.
Mr(NaCl) = 23 + 35,5 = 58,5.
В молекуле NaNO2 есть 1 атом натрия, 1 атом азота и 2 атома кислорода.
Ar(Na) = 23, Ar(N) = 14, Ar(O) = 16.
Mr(NaNO2) = 23 + 14 + 16 · 2 = 69.
Собственно, для вычисления молярной массы больше ничего и не требуется.
Важно
Молярная масса вещества численно равна относительной молекулярной массе. Но путать эти два понятия не стоит — у них разный физический смысл. Молярная масса характеризует 1 моль, а относительная молекулярная — 1 молекулу.
Количество вещества
Из предыдущих формул понятно, что молярная масса и количество вещества тесно связаны. Рассмотрим эту связь подробнее. Начнем с того, что количество вещества может обозначаться как латинской буквой , так и греческой буквой (ню). Международное обозначение — , но не стоит удивляться, встретив в формулах любую из этих букв.
В формуле нахождения молярной массы мы обозначили количество вещества через :
, следовательно .
Пользуясь этим, можно найти количество вещества (в молях), если нам известны его абсолютная и молярная масса.
Пример 1
Как определить, какое количество вещества включают 350 г сульфата бария BaSO4?
Воспользуемся формулой .
Мы помним, что M = Mr (значение молярной массы равно значению относительной молекулярной).
Mr(BaSO4) = Ar(Ba) + A
М(BaSO4) = Mr(BaSO4) = 233 г/моль.
Подставим значение молярной массы в формулу:
моль.
Есть и еще одна формула количества вещества, которая позволяет найти его, если известно число молекул или других структурных единиц.
, где — число структурных единиц, — число Авогадро.
Пример 2
Допустим, некий объем CaCO3 содержит 3,01 · 1023 молекул. Как найти количество вещества, соответствующее данному объему?
Воспользуемся формулой моль.
Молярный объем
Выше мы находили количество вещества через молярную массу, но для газов это можно сделать и через молярный объем. Согласно закону Авогадро количество любого газа, равное 1 моль, будет занимать один и тот же объем, если газы рассматриваются при одинаковой температуре и давлении.
При стандартных физических условиях — температуре 0°С и давлении 1 атм или 760 мм ртутного столба, 1 моль газа занимает объем 22,4 л.
Молярный объем — это объем газа, взятого в количестве 1 моль. Он обозначается Vm.
При нормальных условиях Vm = 22,4 л/моль.
Значения молярного и фактического объема газа помогают найти количество вещества.
, где — фактический объем газа, а — молярный объем.
Пример 1
Сколько молей содержится в 120 литрах газа при нормальных условиях?
Рассчитаем по формуле моль.
Ответ: 120 литров любого газа при стандартных условиях содержат 5,36 моль.
Относительная плотность одного газа по другому
Иногда для решения задачи нужно знать, как найти молярную массу газа, о котором сообщается лишь его плотность по воздуху или по другому газу. Это возможно, если знать формулу относительной плотности, которая обозначается буквой D.
, где и — некие газы.
Пример 1
Как определить, во сколько раз угарный газ плотнее водорода?
Для начала найдем молярную массу CO и H2:
М(CO) = Mr(CO) = Ar(C) + Ar(O) = 12 + 16 = 28.
М(H) = Mr(H2) = 2 · Ar(H) = 2 · 1 = 2.
.
Ответ: угарный газ в 14 раз плотнее водорода.
Пример 2
Как посчитать молярную массу газа х, о котором известно, что он в 10 раз плотнее углекислого газа CO2?
Подсчитаем для начала молярную массу углекислого газа:
M(CO2) = Mr(CO2) = 12 + 2 · 16 = 44.
Ориентируясь на формулу относительной плотности, произведем расчет молярной массы искомого газа х.
М(х) = D(х/CO2) · M(CO2) = 10 · 44 = 440 г/моль.
Ответ: у данного газа молярная масса 440 г/моль.
Примеры задач
Итак, мы разобрались, как находить молярную массу жидкости, газа или твердого тела и как это понятие связано с количеством вещества, а также с относительной плотностью одного газа по другому.
Задача 1
Известно, что 300 г неустановленного вещества содержат 12,04 · 1023 молекул. Чему равна молярная масса данного вещества?
Дано:
N(х) = 12,04 · 1023.
m(х) = 300 г.
M(х) = ?
Решение:
Найдем количество вещества моль.
Подставим количество вещества в формулу :
г/моль.
Ответ: молярная масса данного вещества 150 г/моль.
Задача 2
Какой объем займет водород в количестве 0,7 моль?
Дано:
моль.
Решение:
По формуле мы можем найти объем .
Зная, что молярный объем при обычных условиях составляет 22,4 л/моль, вычислим фактический объем водорода:
л.
Ответ: объем водорода составляет 15,68 литров.
Задача 3
В порции оксида серы SO3 содержится 8,356 · 1023 атомов кислорода. Какова масса этой порции?
Дано:
N(O) = 8,356 · 1023.
m(SO3) = ?
Решение:
Для решения задачи нам подходит формула , т. е. . Но для начала нужно найти количество вещества.
Мы знаем, что в одной молекуле SO3 есть 3 атома кислорода, исходя из этого можно вычислить количество молекул в порции оксида:
, следовательно .
Зная количество молекул, рассчитаем количество вещества:
моль.
Теперь можно узнать молярную массу SO3:
M(SO3) = 32 + 16 · 3 = 80 г/моль.
Рассчитаем фактическую массу через молярную массу:
г.
Ответ: абсолютная масса порции оксида серы 36,8 грамм.
Задача 4
Как рассчитать молярную массу простого вещества, о котором известно, что в порции 100 г содержится 15,05 · 1023 молекул? Назовите это вещество.
Дано:
m(x) = 100 г.
N(x) = 15,05 · 1023.
М(х) = ?
Решение:
В данном случае поможет вычислить молярную массу NA, с помощью которого мы сначала узнаем количество вещества:
моль.
Исходя из этого, рассчитаем молярную массу:
г/моль.
Ответ: согласно таблице Менделеева можно предположить, что это кальций Ca.
Задача 5
Определите, насколько сероводород H2S плотнее водорода H2?
Решение:
Нам требуется вычислить относительную плотность сероводорода по водороду:
.
Для этого вычислим молярные массы H2S и H2:
М(H2S) = 1 · 2 + 32 = 34 г/моль.
М(H2) = 1 · 2 = 2 г/моль.
Подставим значения в формулу:
.
Ответ: сероводород в 17 раз плотнее водорода.
Вопросы для самопроверки
Что такое число Авогадро и чему оно равно?
В чем измеряется молярная масса?
Напишите формулу молярной массы вещества.
Какая формула связывает количество вещества и его объем?
Как узнать количество вещества, если известно число молекул в порции?
Яна Кононенко
К предыдущей статье
Сложные эфиры
К следующей статье
138. 9K
9K
Окислительно-восстановительные реакции
Получите план обучения, который поможет понять и полюбить химию
На вводном уроке с методистом
Выявим пробелы в знаниях и дадим советы по обучению
Расскажем, как проходят занятия
Подберём курс
Плотность вещества — как определить и чему равна?
Покажем, как применять знание физики в жизни
Начать учиться
Есть такая детская загадка: что тяжелее килограмм ваты или килограмм гвоздей? Кажется, что гвозди тяжелее, а потом понимаешь, что килограмм — он и в Африке килограмм. Но почему же создается такая иллюзия?
Масса
Начнем с самого сложного — с массы. Казалось бы, это понятие мы слышим с самого детства, примерно знаем, сколько в нас килограмм, и ничего сложного здесь быть не может. На самом деле, все сложнее.
На самом деле, все сложнее.
До недавнего времени в Международном бюро мер и весов в Париже хранился цилиндр массой один килограмм. Цилиндр был изготовлен из сплава иридия и платины и служил для всего мира эталоном килограмма. Правда, со временем его масса изменилась, и пришлось придумать новый эталон — электромагнитные весы.
Высота этого цилиндра была приблизительно равна 4 см, но чтобы его поднять, нужно было приложить немалую силу. Необходимость эту силу прикладывать обуславливается инерцией тел и математически записывается через второй закон Ньютона.
Второй закон Ньютона F = ma F — сила [Н] m — масса [кг] a — ускорение [м/с2] |
В этом законе массу можно считать неким коэффициентом, который связывает ускорение и силу. Также масса важна при расчете силы тяготения. Она является мерой гравитации: именно благодаря ей тела притягиваются друг к другу.
Также масса важна при расчете силы тяготения. Она является мерой гравитации: именно благодаря ей тела притягиваются друг к другу.
Закон всемирного тяготения F — сила тяготения [Н] M — масса первого тела (часто планеты) [кг] m — масса второго тела [кг] R — расстояние между телами [м] G — гравитационная постоянная G = 6,67 · 10−11м3 · кг−1 · с−2 |
Когда мы встаем на весы, стрелка отклоняется. Это происходит потому, что масса Земли очень большая, и сила тяготения буквально придавливает нас к поверхности. На более легкой Луне человек весит меньше в шесть раз. Когда думаешь об этом, хочется взвешиваться исключительно на Луне. 🙃
Это происходит потому, что масса Земли очень большая, и сила тяготения буквально придавливает нас к поверхности. На более легкой Луне человек весит меньше в шесть раз. Когда думаешь об этом, хочется взвешиваться исключительно на Луне. 🙃
Полезные подарки для родителей
В колесе фортуны — гарантированные призы, которые помогут наладить учебный процесс и выстроить отношения с ребёнком!
Откуда берется масса
Физики убеждены, что у элементарных частиц должна быть масса. Доказано, что у электрона, например, масса есть. В противном случае они не могли бы образовать атомы и всю видимую материю.
Вселенная без массы представляла бы собой хаос из различных излучений, двигающихся со скоростью света. Не существовало бы ни галактик, ни звезд, ни планет. Здорово, что это не так, и у элементарных частиц есть масса. Только вот пока непонятно, откуда эта масса у них берется.
Мужчину на этой фотографии зовут Питер Хиггс. Ему мы обязаны за предположение, экспериментально доказанное в 2012 году, что массу всех частиц создает некий бозон.
Ему мы обязаны за предположение, экспериментально доказанное в 2012 году, что массу всех частиц создает некий бозон.
Источник: Википедия
Бозон Хиггса невозможно представить. Это точно не частица в форме шарика, как обычно рисуют электрон в учебнике. Представьте, что вы бежите по песку. Бежать ощутимо сложно, как будто бы увеличилась масса. Частицы пробираются в поле Хиггса и получают таким образом массу.
Объем тела
Объем — это физическая величина, которая показывает, сколько пространства занимает тело. Это важный навык — уметь объемы соотносить. Например, чтобы посчитать, сколько пластиковых шариков помещается в гигантский бассейн.
Скажем, чтобы рассчитать объем прямоугольного параллелепипеда, нам нужно перемножить три его параметра.
Формула объема параллелепипеда V = abc V — объем [м3] a — длина [м] b — ширина [м] c — высота [м] |
А для цилиндра будет справедлива такая формула:
Формула объема цилиндра V = Sh V — объем [м3] S — площадь основания [м2] h — высота [м] |
Плотность вещества
Плотность — скалярная физическая величина. Определяется как отношение массы тела к занимаемому этим телом объему.
Определяется как отношение массы тела к занимаемому этим телом объему.
Формула плотности вещества р = m/V р — плотность вещества [кг/м3] m — масса вещества [кг] V — объем вещества [м3] |
Плотность зависит от температуры, агрегатного состояния вещества и внешнего давления. Обычно если давление увеличивается, то молекулы вещества утрамбовываются плотнее — следовательно, плотность больше. А рост температуры, как правило, приводит к увеличению расстояний между молекулами вещества — плотность понижается.
Маленькое исключение
Исключение составляет вода. Так, плотность воды меньше плотности льда. Объяснение кроется в молекулярной структуре льда. Когда вода переходит из жидкого состояния в твердое, она изменяет молекулярную структуру так, что расстояние между молекулами увеличивается. Соответственно, плотность льда меньше плотности воды.
Так, плотность воды меньше плотности льда. Объяснение кроется в молекулярной структуре льда. Когда вода переходит из жидкого состояния в твердое, она изменяет молекулярную структуру так, что расстояние между молекулами увеличивается. Соответственно, плотность льда меньше плотности воды.
Ниже представлены значения плотностей для разных веществ. В дальнейшем это поможет при решении задач.
Твердое вещество | кг/м3 | г/см3 |
Платина | 21500 | 21,5 |
Золото | 19300 | 19,3 |
Вольфрам | 19000 | 19,0 |
Свинец | 11400 | 11,4 |
Серебро | 10500 | 10,5 |
Медь | 8900 | 8,9 |
Никель | 8800 | 8,8 |
Латунь | 8500 | 8,5 |
Сталь, железо | 7900 | 7,9 |
Олово | 7300 | 7,3 |
Цинк | 7100 | 7,1 |
Чугун | 7000 | 7,0 |
Алмаз | 3500 | 3,5 |
Алюминий | 2700 | 2,7 |
Мрамор | 2700 | 2,7 |
Гранит | 2600 | 2,6 |
Стекло | 2600 | 2,6 |
Бетон | 2200 | 2,2 |
Графит | 2200 | 2,2 |
Лёд | 900 | 0,9 |
Парафин | 900 | 0,9 |
Дуб (сухой) | 700 | 0,7 |
Берёза (сухая) | 650 | 0,65 |
Пробка | 200 | 0,2 |
Платиноиридиевый сплав | 21500 | 21,5 |
Жидкость | кг/м3 | г/см3 |
Ртуть | 13600 | 13,6 |
Мёд | 1300 | 1,3 |
Глицерин | 1260 | 1,26 |
Молоко | 1036 | 1,036 |
Морская вода | 1030 | 1,03 |
Вода | 1000 | 1 |
Подсолнечное масло | 920 | 0,92 |
Нефть | 820 | 0,82 |
Спирт | 800 | 0,8 |
Бензин | 700 | 0,7 |
Газ | кг/м3 |
Хлор | 3,22 |
Озон | 2,14 |
Пропан | 2,02 |
Диоксид углерода | 1,98 |
Кислород | 1,43 |
Воздух | 1,29 |
Азот | 1,25 |
Гелий | 0,18 |
Водород | 0,09 |
Где самая большая плотность?
Самая большая плотность во Вселенной — в черной дыре. Плотность черной дыры составляет около 1014 кг/м3.
Плотность черной дыры составляет около 1014 кг/м3.
Онлайн-курсы физики в Skysmart не менее увлекательны, чем наши статьи!
Средняя плотность
В школьном курсе чаще всего говорят о средней плотности тела. Дело в том, что если мы рассмотрим какое-нибудь неоднородное тело, то в одной его части будет, например, большая плотность, а в другой — меньшая.
Если вы когда-то делали ремонт, то знакомы с такой вещью, как цемент. Он состоит из двух веществ: клинкера и гипса. Значит нам нужно отдельно найти плотность гипса, плотность клинкера по формуле, указанной выше, а потом найти среднее арифметическое двух плотностей. Можно сделать так.
А можно просто массу цемента разделить на объем цемента и мы получим ровно то же самое. Просто в данном случае мы берем не массу и объем вещества, а массу и объем тела.
Формула плотности тела р = m/V р — плотность тела [кг/м3] m — масса тела [кг] V — объем тела [м3] |
Решение задач: плотность вещества
А теперь давайте тренироваться!
Задача 1
Цилиндр 1 поочерёдно взвешивают с цилиндром 2 такого же объёма, а затем с цилиндром 3, объем которого меньше (как показано на рисунке).
Какой цилиндр имеет максимальную среднюю плотность?
Решение:
Плотность тел прямо пропорциональна массе и обратно пропорциональна объему:
р = m/V
Исходя из проведенных опытов можно сделать следующие выводы:
1) масса первого цилиндра больше массы второго цилиндра при одинаковом объеме. Значит плотность первого цилиндра выше плотности второго.
2) масса первого цилиндра равна массе третьего цилиндра, объем которого меньше. Следовательно, плотность третьего цилиндра больше плотности первого цилиндра.
Таким образом, средние плотности цилиндров:
р2 < р1 < р3
Ответ: 3.
Задача 2
Шар 1 последовательно взвешивают на рычажных весах с шаром 2 и шаром 3 (как показано на рисунке). Для объёмов шаров справедливо соотношение V1 = V3 < V2.
Для объёмов шаров справедливо соотношение V1 = V3 < V2.
Какой шар имеет максимальную среднюю плотность?
Решение:
Из рисунка ясно, что масса шаров 1 и 2 равна — следовательно, плотность второго шара меньше, чем первого. Третий шар тяжелее, чем первый при одинаковом объёме, поэтому плотность третьего шара больше плотности первого. Таким образом, максимальную среднюю плотность имеет шар 3.
Ответ: 3
Задача 3
Найти плотность шара объемом 0,5 м3 и массой 1,5 кг.
Решение:
Возьмем формулу плотности и подставим в нее данные нам значения.
р = m/V
р = 1,5/0,5 = 3 кг/м3
Ответ: р = 3 кг/м3
Плавание тел
Почему шарик с гелием взлетает? Или мяч при игре в водное поло не тонет?
Жидкости и газы действуют на погруженные тела с выталкивающей силой. Подробно это явление рассматривают в теме «Сила Архимеда». Если говорить простым языком: если плотность тела, погруженного в жидкость, больше плотности жидкости — тело пойдет ко дну. Если меньше – оно всплывет на поверхность.
Подробно это явление рассматривают в теме «Сила Архимеда». Если говорить простым языком: если плотность тела, погруженного в жидкость, больше плотности жидкости — тело пойдет ко дну. Если меньше – оно всплывет на поверхность.
Задача 1
Стальной шарик в воде падает медленнее, чем в воздухе. Чем это объясняется?
Решение:
Плотность воды значительно выше, чем воздуха, поэтому стальной шарик в воде падает медленнее
Задача 2
В таблице даны плотности некоторых твердых веществ. Если вырезать из этих веществ кубики, то какие кубики смогут плавать в воде? Плотность воды — 1000 кг/м3.
Название вещества | Плотность вещества, кг/м3 |
Алюминий | 2700 |
Парафин | 900 |
Плексиглас | 1200 |
Фарфор | 2300 |
Сосна | 400 |
Решение:
Плавать будут кубики, плотность которых меньше плотности воды, то есть сделанные из парафина или сосны.
Карина Хачатурян
К предыдущей статье
Сила тяжести
К следующей статье
140.9K
Основные агрегатные состояния вещества
Получите индивидуальный план обучения физике на бесплатном вводном уроке
На вводном уроке с методистом
Выявим пробелы в знаниях и дадим советы по обучению
Расскажем, как проходят занятия
Подберём курс
10.8: Плотность газа — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 53772
Почему углекислый газ тонет в воздухе?
Когда мы запускаем реакцию для получения газа, мы ожидаем, что он поднимется в воздух. Многие студенты проводили эксперименты с образованием таких газов, как водород. Газ можно уловить в пробирке, которую держат вверх дном над реакцией. Углекислый газ, с другой стороны, тонет, когда он выделяется. Углекислый газ имеет большую плотность, чем воздух, поэтому он не будет подниматься, как газообразный водород.
Многие студенты проводили эксперименты с образованием таких газов, как водород. Газ можно уловить в пробирке, которую держат вверх дном над реакцией. Углекислый газ, с другой стороны, тонет, когда он выделяется. Углекислый газ имеет большую плотность, чем воздух, поэтому он не будет подниматься, как газообразный водород.
Плотность газа
Как известно, плотность определяется как масса на единицу объема вещества. Поскольку все газы занимают один и тот же объем в пересчете на моль, плотность конкретного газа зависит от его молярной массы. Газ с малой молярной массой будет иметь меньшую плотность, чем газ с большой молярной массой. Плотность газа обычно указывается в \(\text{г/л}\). Плотность газа можно рассчитать по молярной массе и молярному объему.
Рисунок \(\PageIndex{2}\): Воздушные шары, наполненные газообразным гелием, плавают в воздухе, потому что плотность гелия меньше плотности воздуха. (Источник: Фотограф: Уоррен Деннинг, любезно предоставлено компанией Pioneer Balloon Company; Источник: http://commons. wikimedia.org/wiki/File:Congrats_bqt.jpg(открывается в новом окне); Лицензия: Общественное достояние)
wikimedia.org/wiki/File:Congrats_bqt.jpg(открывается в новом окне); Лицензия: Общественное достояние)Пример \( \PageIndex{1}\): Плотность газа
Какова плотность газообразного азота на STP ?
Раствор
Шаг 1: Перечислите известные количества и спланируйте проблему. Известно- \(\ce{N_2} = 28,02 \: \text{г/моль}\)
- \(1 \: \text{моль} = 22,4 \: \text{L}\)
- плотность = ? г/л
Молярная масса, деленная на молярный объем, дает плотность газа при нормальных условиях.
Шаг 2: Расчет.\[\frac{28,02 \: \text{g}}{1 \: \text{mol}} \times \frac{1 \: \text{mol}}{22,4 \: \text{L} } = 1,25 \: \text{г/л}\номер\]
При установке с коэффициентом преобразования единица \(\text{моль}\) отменяется, оставляя \(\text{г/л}\) в качестве единицы измерения в результате.
Молярная масса азота немного больше молярного объема, поэтому плотность немного больше \(1 \: \text{г/л}\).
В качестве альтернативы можно определить молярную массу газа, если известна плотность газа при нормальных условиях.
Пример \(\PageIndex{2}\): Молярная масса из плотности газа
Какова молярная масса газа, плотность которого равна \(0,761 \: \text{г/л}\) при нормальных условиях?
Решение
Шаг 1: Перечислите известные количества и спланируйте задачу .
Известно- \(\ce{N_2} = 28,02 \: \text{г/моль}\)
- \(1 \: \text{моль} = 22,4 \: \text{L}\)
- молярная масса = ? г/моль
Молярная масса равна плотности, умноженной на молярный объем.
Шаг 2: Расчет.\[\frac{0,761 \: \text{g}}{1 \: \text{L}} \times \frac{22,4 \: \text{L}}{1 \: \text{mol} } = 17,0 \: \text{г/моль}\номер \]
Шаг 3: Подумайте о своем результате.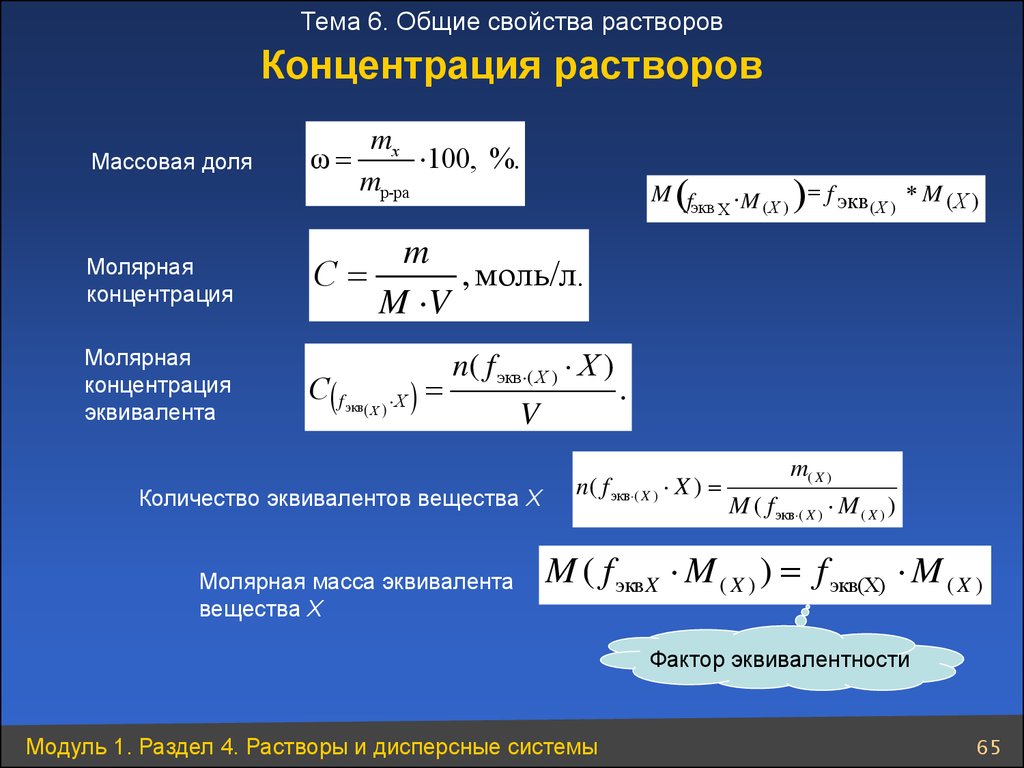
Поскольку плотность газа меньше \(1 \: \text{г/л}\), молярная масса меньше 22,4.
Резюме
- Описаны расчеты, показывающие преобразование молярной массы в плотность для газов.
Обзор
- Как рассчитывается плотность?
- Как рассчитывается молярная масса?
- Каков будет объем 3,5 молей газа?
Эта страница под названием 10.8: Плотность газа распространяется под лицензией CK-12 и была создана, изменена и/или курирована Фондом CK-12 с использованием исходного контента, который был отредактирован в соответствии со стилем и стандартами платформы LibreTexts; подробная история редактирования доступна по запросу.
ЛИЦЕНЗИЯ ПОД
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Фонд CK-12
- Лицензия
- СК-12
- Программа OER или Publisher
- СК-12
- Показать страницу TOC
- № на стр.

- Теги
- Плотность газа
- источник@https://flexbooks.ck12.org/cbook/ck-12-chemistry-flexbook-2.0/
Как преобразовать молекулярный вес в плотность
Обновлено 14 декабря 2020 г.
Автор: Элиза Хансен
Вы, вероятно, рано узнали на уроках естествознания, что плотность — это масса, деленная на объем, или «количество» вещества в определенном пространстве. Для твердых тел это довольно простая мера. Если вы наполните банку монетами, она будет иметь гораздо больше «привлекательности», чем если бы вы наполнили ее зефиром. Когда вы наполняете ее монетами, в банку набивается гораздо больше вещества, тогда как зефир очень пухлый и легкий.
Как насчет молекулярной массы? Молекулярный вес и плотность кажутся очень похожими, но есть важное различие. Молекулярная масса – это масса вещества на моль. Дело не в том, сколько места занимает вещество, а в «количестве», «силе» или «весе» определенного количества вещества.
Молекулярная масса – это масса вещества на моль. Дело не в том, сколько места занимает вещество, а в «количестве», «силе» или «весе» определенного количества вещества.
Итак, резюмируем: Плотность это масса, деленная на объем. Математическая формула выглядит следующим образом:
\rho = \frac{m}{V}
Единицей СИ для массы являются килограммы (хотя вы можете иногда видеть, что она выражается в граммах), а для объема обычно используется m 3 . Итак, плотность в единицах СИ измеряется в кг/м 3 .
Молекулярная масса — это масса на моль, которая записывается:
\text{молекулярная масса}=\frac{m}{n}
Опять же, единицы измерения имеют значение: масса, m, вероятно, будет в килограммах, а n равно измерение числа молей. Таким образом, единицами измерения молекулярной массы будут килограммы на моль.
Закон об идеальном газе
Итак, как вы выполняете преобразование между этими мерами? Чтобы преобразовать молекулярную массу газа в плотность (или наоборот), используйте Закон идеального газа . Закон идеального газа определяет взаимосвязь между давлением, объемом, температурой и количеством молей газа. Написано:
Закон идеального газа определяет взаимосвязь между давлением, объемом, температурой и количеством молей газа. Написано:
PV=nRT
где P обозначает давление, V обозначает объем, n — количество молей, R — постоянная, зависящая от газа (и обычно дается тебе), а T — температура.
Использование закона идеального газа для преобразования молекулярного веса в плотность
Но в законе идеального газа молекулярный вес не упоминается! Однако, если вы перепишете n, число родинок, в несколько иных терминах, вы можете настроить себя на успех.
Моль равно массе, деленной на молекулярную массу.
n=\frac{m}{\text{молекулярная масса}}
Зная это, вы можете переписать закон идеального газа следующим образом:
PV=\frac{m}{M}RT
где M обозначает молекулярную массу.
Как только вы это сделаете, вычисление плотности станет простым.

