Число нейтронов в атоме. Изотопы — урок. Химия, 8–9 класс.
Число нейтронов в атоме
Мы знаем, что масса атома определяется массой ядра. Ядро состоит из протонов и нейтронов, относительные массы которых равны \(1\). Масса ядра равна сумме масс протонов и нейтронов. Число протонов определяем по порядковому номеру элемента. Значит, число нейтронов в ядре можно найти, если от относительной атомной массы отнять порядковый номер.
Пример:
фтор — элемент № \(9\). Его относительная атомная масса равна \(19\).
В ядре атома фтора — \(9\) протонов и \(19\) \(–\) \(9\) \(=\) \(10\) нейтронов.
Рубидий — элемент № \(37\). Его относительная атомная масса равна \(85\).
В ядре атома рубидия — \(37\) протонов и \(85\) \(–\) \(37\) \(=\) \(48\) нейтронов.
Нуклиды
Вид атомов с определённым числом протонов и нейтронов в ядре называется нуклидом.
Нуклид обозначается следующим образом: внизу слева записывается число протонов \(Z\)
Для обозначения нуклидов используют и другие способы записи:
углерод — \(12\), C — \(12\), C12;
селен — \(79\), Se — \(79\), Se79.
Изотопы
Атомы одного и того же химического элемента могут иметь разные массы. Существуют атомы водорода с массами \(1\), \(2\) и \(3\), атомы хлора с массами \(35\) и \(37\) и т. д.
Разновидности атомов одного химического элемента, имеющие разные атомные массы, называют изотопами.
С учётом знаний о строении ядра это определение можно сформулировать по-другому.
Изотопы — разновидности атомов с одинаковым числом протонов в ядре (зарядом ядра), но разным числом нейтронов.
Значит, изотопы отличаются только числом нейтронов.
Протоны определяют свойства атома, то есть придают ему индивидуальность. А нейтроны не влияют на свойства атома, а отражаются на его массе. Поэтому все изотопы одного и того же элемента химически неотличимы.
Химический элемент — это вид атомов с определённым зарядом ядра.
Относительная атомная масса элемента
Большинство химических элементов существуют в виде смеси изотопов. Приведённая в Периодической таблице относительная атомная масса элемента — это средняя величина атомных масс всех его изотопов.
Пример:
определим относительную атомную массу хлора. \(25\) % его атомов — это атомы с массой \(37\), а \(75\) % — с массой \(35\). Найдём среднее значение:
Ar(Cl)=(37 ·25+35 ·75)100 \(=\) 35,5.
Состав атомного ядра. Число протонов — урок. Химия, 8–9 класс.
Предложенная Э. Резерфордом в \(1911\) году ядерная (планетарная) модель строения атома сводится к следующим положениям:
- атом состоит из положительно заряженного ядра и движущихся вокруг него электронов;
- более \(99,96\) % массы атома сосредоточено в его ядре;
- диаметр ядра примерно в сто тысяч раз меньше диаметра самого атома.
Согласно этой модели можно дать следующее определение атома:
Атом — электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
Ядро атома состоит из элементарных частиц: протонов и нейтронов. Протоны и нейтроны имеют общее название нуклоны (ядерные частицы).
Протон (\(p\)) — частица, имеющая заряд \(+1\) и относительную массу, равную \(1\).
Нейтрон (\(n\)) — частица без заряда с относительной массой \(1\).
К элементарным частицам относятся также электроны (\(e\)), которые образуют электронную оболочку атома.
Протоны и нейтроны имеют одинаковую массу. Масса электрона составляет 11840 массы протона и нейтрона. Поэтому основная масса атома сосредоточена в его ядре.
Протон имеет положительный заряд \(+1\). Заряд электрона — отрицательный и по величине равен заряду протона: \(–\)\(1\).
Частицы | Обозначения | Относительная масса | Относительный заряд |
| Протон | \(p\) | \(1\) | \(+1\) |
| Нейтрон | \(n\) | \(1\) | \(0\) |
| Электрон | \(e\) | \(1/1840\) | \(–1\) |
Установлено, что число протонов в ядре равно порядковому номеру элемента в Периодической таблице.
Заряд ядра определяется числом протонов в нём. Значит, заряд ядра тоже равен порядковому номеру элемента.
Атом — электронейтральная частица, поэтому число электронов в нём равно числу протонов.
Обрати внимание!
Порядковый номер элемента \(=\) заряд ядра атома \(=\) число протонов в ядре \(=\) число электронов в атоме.
Водород — элемент № \(1\). Заряд ядра его атома равен \(+1\). В ядре находится один протон, а в электронной оболочке — один электрон.
Углерод — элемент № \(6\). Заряд ядра его атома равен \(+6\), в нём — \(6\) протонов. В атоме содержится \(6\) электронов с общим зарядом \(–\)\(6\).
Обрати внимание!
Заряд ядра — главная характеристика атома.
Изучение строения атомных ядер привело к уточнению формулировки периодического закона. Современная формулировка звучит следующим образом:
cвойства химических элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от величин зарядов ядер их атомов.
Состав ядра атома. Расчет протонов и нейтронов
Согласно современным представлениям, атом состоит из ядра и расположенных вокруг него электронов. Ядро атома, в свою очередь, состоит из более малых элементарных частиц ‒ из определенного количества
Количество протонов в ядре определяет строение электронной оболочки атома. А электронная оболочка определяет физико-химические свойства вещества. Число протонов соответствует порядковому номеру атома в периодической системе химических элементов Менделеева, именуется также зарядовое число, атомный номер, атомное число. Например, число протонов у атома Гелия – 2. В периодической таблице он стоит под номером 2 и обозначается как He2 Символом для обозначения количества протонов служит латинская буква Z. При записи формул зачастую цифра, указывающая на количество протонов, располагается снизу от символа элемента либо справа, либо слева: He2 / 2He.
Количество нейтронов соответствует определённому изотопу того или иного элемента. Изотопы – это элементы с одинаковым атомным номером (одинаковым количеством протонов и электронов), но с разным массовым числом. Массовое число – общее количество нейтронов и протонов в ядре атома (обозначается латинской буквой А). При записи формул массовое число указывается вверху символа элемента с одной из сторон: He42/42He (Изотоп Гелия – Гелий — 4)
Таким образом, чтобы узнать число нейтронов в том или ином изотопе, следует от общего массового числа отнять число протонов. Например, нам известно, что в атоме Гелия-4 He42 cодержится 4 элементарные частицы, так как массовое число изотопа – 4 . При этом нам известно, что He42 меет 2 протона. Отняв от 4 (общее массовое число) 2 (кол-во протонов) получаем 2 – количество нейтронов в ядре Гелия-4.
ПРОЦЕСС РАСЧЁТА КОЛИЧЕСТВА ФАНТОМНЫХ ЧАСТИЧЕК ПО В ЯДРЕ АТОМА. В качестве примера мы не случайно рассмотрели Гелий-4 (He
Именно с участием альфа-частиц была проведена Э. Резерфордом первая в официальной истории физики реакция ядерного превращения. В ходе реакции α-частицами (He42) «бомбардировались» ядра изотопа азота (N147), вследствие чего образовался изотоп оксигена (O178) и один протон (p11)
Данная ядерная реакция выглядит следующим образом:
Осуществим расчёт количества фантомных частичек По до и после данного преобразования.
ДЛЯ РАСЧЁТА КОЛИЧЕСТВА ФАНТОМНЫХ ЧАСТИЧЕК ПО НЕОБХОДИМО:
— количество протонов указано в нижнем показателе;
— количество нейтронов узнаем, отняв от общего массового числа (верхний показатель) количество протонов (нижний показатель).
Шаг 2. Посчитать количество фантомных частичек По в атомном ядре:
— умножить количество протонов на количество фантомных частичек По, содержащихся в 1 протоне;
— умножить количество нейтронов на количество фантомных частичек По, содержащихся в 1 нейтроне;
Шаг 3. Сложить количество фантомных частичек По:
— сложить полученное количество фантомных частичек По в протонах с полученным количеством в нейтронах в ядрах до реакции;
— сложить полученное количество фантомных частичек По в протонах с полученным количеством в нейтронах в ядрах после реакции;
— сравнить количество фантомных частичек По до реакции с количеством фантомных частичек По после реакции.
ПРИМЕР РАЗВЁРНУТОГО ВЫЧИСЛЕНИЯ КОЛИЧЕСТВА ФАНТОМНЫХ ЧАСТИЧЕК ПО В ЯДРАХ АТОМОВ.
(Ядерная реакция с участием α-частицы (He42), провёденная Э. Резерфордом в 1919 году)
ДО РЕАКЦИИ (N147 + He42)
N147
Количество протонов: 7
Количество нейтронов: 14-7 = 7
Количество фантомных частичек По:
в 1 протоне – 12 По, значит в 7 протонах: (12 х 7) = 84;
в 1 нейтроне – 33 По, значит в 7 нейтронах: (33 х 7) = 231;
Общее количество фантомных частичек По в ядре: 84+231 = 315
He42
Количество протонов – 2
Количество нейтронов 4-2 = 2
Количество фантомных частичек По:
в 1 протоне – 12 По, значит в 2 протонах: (12 х 2) = 24
в 1 нейтроне – 33 По, значит в 2 нейтронах: (33 х 2) = 66
Общее количе
Как узнать сколько протонов, нейтронов и электронов находится в атоме фтора?
Атом размером в арбуз или протон-арбуз конечно нонсенс. Ядерная плотность протона равна 2.3×10¹⁷ кг/м³ и размером в средний арбуз он бы весил около 5 триллионов тонн. Это многовато.
Есть другой способ — воображение (или моделирование), на основе законов физики.
Pассмотрим атом водорода, состоящий из ядра и электрона. Напускать туману о квантомеханической природе атома и волновой функции электрона не будем и перейдём прямо к сути вопроса. Что мы увидим окажись рядом с атомом, но на безопасном расстоянии? — Ничего, так как электрон не имеет размеров, точнее, может и имеет, только меньше чем 10⁻²² м. Это ооочень мало. Но зато он имеет электромагнитный радиус равный 2.8×10⁻¹⁵ м из-за заряда, и мы, имея воображаемый зарядо-оптический детектор, можем его увидеть. Но осторожно, вблизи электронного облака (орбитали) атома, температура близка к температуре на поверхности Солнца.
Как отметил Мерфи — «Всякое решение плодит новые проблемы» и электрон в атоме не движется, как двигаются все нормальные люди. Он квантовый объект, захваченный электростатическим полем ядра, и обязан подчиняться законам квантовой теории поля по которой, квантовые объекты постоянно взаимодействуют с вакуумным полем. Время, которое тратится на это, порядка времени электромагнитных взаимодействий, т.е. ~10⁻¹⁶ сек. На рис. внизу показана плотность вероятности увидеть электрон в произвольном месте на поверхности сферы радиуса r с центром в ядре атома.
Наиболее вероятное место появления электрона в атоме водорода — это сфера радиусом a₀= 0.529 Å вокруг ядра при r = 0, а тёмная врезка справа показывает экспоненциальную волновую функцию Ψ(r) в основном состоянии (1s) атома водорода.
Сделав съёмку атома со скоростью выше ~10¹⁶ кадров/сек воображаемым зарядо-оптическим детектором, в замедленном просмотре на экране, сидя на диване, мы заметим, что электрон то появляется, то исчезает в разных местах, но чаще всего в области Боровской орбиты с радиусом r = a₀ вокруг ядра. Само ядро (протон) будет практически неподвижным в центре атома водорода с электромагнитным размером ~ 1 Фм (10⁻¹⁵ м). Самое интересное, в среднем будет казаться, что электрон вращается вокруг ядра с частотой порядка 10¹⁶ оборотов в сек, что определяет квази-классическую модель атома Бора.
С протоном и нейтроном дела обстоят значительно сложнее. Близко подходить к ним нельзя. Температура кварк-глюонной жидкости (моря) из-за цветового (ядерного) поля внутри протона — порядка 1 триллиона К (см рис.).
Протон и нейтрон содержат избыток валентных uud и udd кварков соответственно, и увидеть их возможно только съемкой со скоростью порядка 10²⁴ кадров/сек с применением теперь уже цвето (хромо) оптических детекторов, чувствительных к цветовому (ядерному) заряду кварков и глюонов, описываемых в рамках КХД.
Никаких конечно, выше перечисленных, супер скоростных зарядо и цвето чувствительных камер существать не может. Вместо этого физики строят ускорители, где разгоняют ядра, протоны и электроны до сверхвысоких энергий и, сталкивая их, исследуют внутреннюю структуру элементарных частиц.
Определение нейтрон общее значение и понятие. Что это такое нейтрон
Первое, что нужно сделать, — это определить этимологическое происхождение слова нейтрон, которое сейчас нас занимает. Таким образом, мы должны были бы уточнить, что оно происходит от латинского и, более конкретно, от слова Neuer, которое состоит из двух разных частей: префикс ne -, который эквивалентен отрицанию, и uter, который можно перевести как «one u другой «.
Нейтрон — это массивная частица без электрического заряда . Это барион (субатомная частица, состоящая из трех кварков), образованная двумя кварками внизу и одним кварком сверху. Нейтроны и протоны являются ядрами атомов .
Нейтрон имеет период полураспада около 15 минут вне атомного ядра, когда он испускает электрон и антинейтрон, чтобы стать протоном. Нейтроны, масса которых аналогична протонам, необходимы для стабильности атомных ядер (за исключением водорода).
Физик и химик новозеландец Эрнест Резерфорд был тем, кто в 1920 году провозгласил существование нейтрона. Таким образом он объяснил, почему ядра не распадаются из-за электромагнитного отталкивания протонов.
Нейтроны действуют на ядерные реакции, которые происходят, когда нейтрон управляет делением атома и генерирует большее количество нейтронов, что, в свою очередь, вызывает новые деления. В зависимости от того, как происходит эта реакция, мы можем говорить о контролируемой реакции (замедлитель ядерного реактора используется для использования ядерной энергии) или неконтролируемой реакции (образуется критическая масса ядерного топлива).
В дополнение ко всему вышесказанному, нам пришлось бы прояснить существование еще одной серии терминов, которые также основаны на использовании слова, которое сейчас нас занимает. Это было бы в случае медленного нейтрона, особенность которого заключается в том, что он имеет скорость, которая имеет тот же порядок, что и при нормальной температуре, которая является молекулярным перемешиванием.
Точно так же мы не должны забывать быстрый нейтрон. Как следует из названия, именно он считается отличительной чертой того факта, что его скорость сопоставима со скоростью света.
Ко всему этому следует добавить термин нейтронная бомба. Это, также известное как увеличенная прямая радиационная бомба, является ядерным оружием, которое происходит из Соединенных Штатов. Он был создан в десятилетие 70-х годов руками физика Сэмюэля Коэна и фундаментально основан на том, что является ядерным делением.
После перерыва в его продвижении именно президент Рональд Рейган поддержал проекты этой ядерной бомбы большой опасности.
Поэтому ядерное деление — это реакция, которая происходит в ядре атома. Деление происходит, когда тяжелое ядро делится на более мелкие ядра, в дополнение к другим побочным продуктам, таким как свободные нейтроны и фотоны. Следовательно, деление тяжелых ядер является экзотермическим процессом, при котором выделяется большое количество энергии.
Структура атома: что такое нейтрон?
Что такое нейтрон? Каковы его структура, свойства и функции? Нейтроны — это самые большие из частиц, составляющих атомы, являющиеся строительными блоками всей материи.

Структура атома
Нейтроны находятся в ядре — плотной области атома, также заполненной протонами (положительно заряженными частицами). Эти два элемента удерживаются вместе при помощи силы, называем ядерной. Нейтроны имеют нейтральный заряд. Положительный заряд протона сопоставляется с отрицательным зарядом электрона для создания нейтрального атома. Несмотря на то что нейтроны в ядре не влияют на заряд атома, они все же обладают многими свойствами, которые влияют на атом, включая уровень радиоактивности.

Нейтроны, изотопы и радиоактивность
Частица, которая находится в ядре атома — нейтрон на 0,2% больше протона. Вместе они составляют 99,99% всей массы атома. Атомы одного и того же элемента могут иметь различное количество нейтронов. Когда ученые ссылаются на атомную массу, они имеют в виду среднюю атомную массу. Например, углерод обычно имеет 6 нейтронов и 6 протонов с атомной массой 12, но иногда он встречается с атомной массой 13 (6 протонов и 7 нейтронов). Углерод с атомным номером 14 также существует, но встречается редко. Итак, атомная масса для углерода усредняется до 12,011.
Когда атомы имеют различное количество нейтронов, их называют изотопами. Ученые нашли способы добавления этих частиц в ядро для создания больших изотопов. Теперь добавление нейтронов не влияет на заряд атома, так как они не имеют заряда. Однако они увеличивают радиоактивность атома. Это может привести к очень неустойчивым атомам, которые могут разряжать высокие уровни энергии.

Что такое ядро?
В химии ядро является положительно заряженным центром атома, который состоит из протонов и нейтронов. Слово «ядро» происходит от латинского nucleus, которое является формой слова, означающего «орех» или «ядро». Этот термин был придуман в 1844 году Майклом Фарадеем для описания центра атома. Науки, участвующие в исследовании ядра, изучении его состава и характеристик, называются ядерной физикой и ядерной химией.
Протоны и нейтроны удерживаются сильной ядерной силой. Электроны притягиваются к ядру, но двигаются так быстро, что их вращение осуществляется на некотором расстоянии от центра атома. Заряд ядра со знаком плюс исходит от протонов, а что такое нейтрон? Это частица, которая не имеет электрического заряда. Почти весь вес атома содержится в ядре, так как протоны и нейтроны имеют гораздо большую массу, чем электроны. Число протонов в атомном ядре определяет его идентичность как атома определенного элемента. Число нейтронов означает, какой изотоп элемента является атомом.
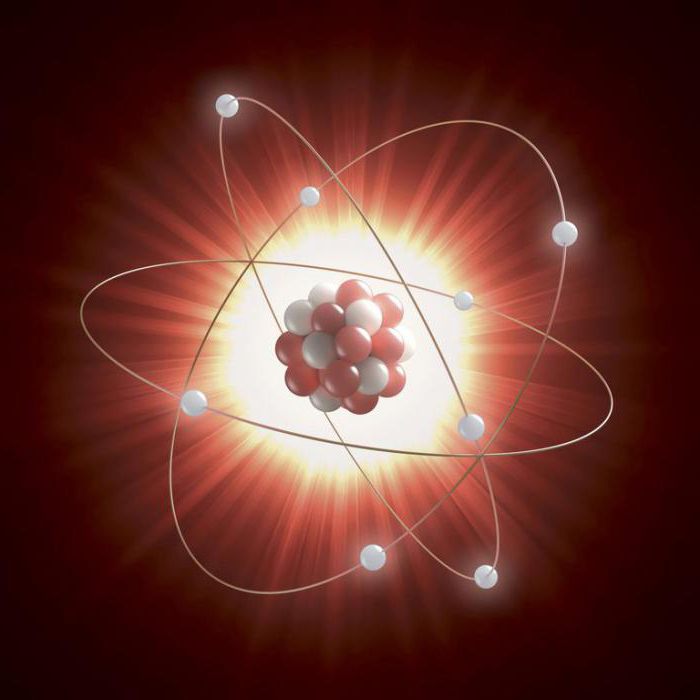
Размер атомного ядра
Ядро намного меньше общего диаметра атома, потому что электроны могут быть отдалены от центра. Атом водорода в 145 000 раз больше своего ядра, а атом урана в 23 000 раз больше своего центра. Ядро водорода является наименьшим, потому что оно состоит из одиночного протона.
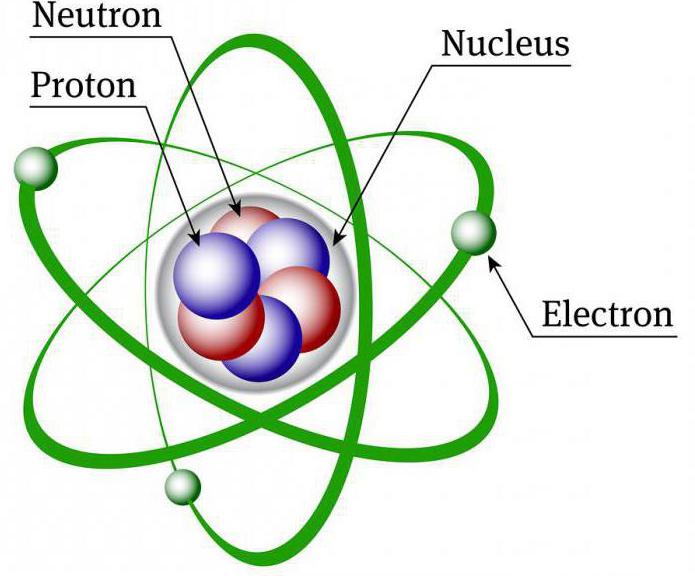
Расположение протонов и нейтронов в ядре
Протон и нейтроны обычно изображаются как уплотненные вместе и равномерно распределенные по сферам. Однако это упрощение фактической структуры. Каждый нуклон (протон или нейтрон) может занимать определенный уровень энергии и диапазон местоположений. В то время как ядро может быть сферическим, оно может быть также грушевидным, шаровидным или дисковидным.

Ядра протонов и нейтронов представляют собой барионы, состоящие из наименьших субатомных частиц, называемых кварками. Сила притяжения имеет очень короткий диапазон, поэтому протоны и нейтроны должны быть очень близки друг к другу, чтобы быть связанными. Это сильное притяжение преодолевает естественное отталкивание заряженных протонов.
Протон, нейтрон и электрон
Мощным толчком в развитии такой науки, как ядерная физика, стало открытие нейтрона (1932 год). Благодарить за это следует английского физика Д. Чедвика, который был учеником Резерфорда. Что такое нейтрон? Это нестабильная частица, которая в свободном состоянии всего за 15 минут способна распадаться на протон, электрон и нейтрино, так называемую безмассовую нейтральную частицу.
Частица получила свое название из-за того, что она не имеет электрического заряда, она нейтральна. Нейтроны являются чрезвычайно плотными. В изолированном состоянии один нейтрон будет иметь массу всего 1,67·10—27, а если взять чайную ложку плотно упакованную нейтронами, то получившийся кусок материи будет весить миллионы тонн.
Количество протонов в ядре элемента называется атомным номером. Это число дает каждому элементу свою уникальную идентичность. В атомах некоторых элементов, например углерода, число протонов в ядрах всегда одинаково, но количество нейтронов может различаться. Атом данного элемента с определенным количеством нейтронов в ядре называется изотопом.

Опасны ли одиночные нейтроны?
Что такое нейтрон? Это частица, которая наряду с протоном входит в состав ядра атома. Однако иногда они могут существовать сами по себе. Когда нейтроны находятся вне ядер атомов, они приобретают потенциально опасные свойства. Когда они двигаются с высокой скоростью, они производят смертельную радиацию. Так называемые нейтронные бомбы, известные своей способностью убивать людей и животных, при этом оказывают минимальное влияние на неживые физические структуры.
Нейтроны являются очень важной частью атома. Высокая плотность этих частиц в сочетании с их скоростью придает им чрезвычайную разрушительную силу и энергию. Как следствие, они могут изменить или даже разорвать на части ядра атомов, которые поражают. Хотя нейтрон имеет чистый нейтральный электрический заряд, он состоит из заряженных компонентов, которые отменяют друг друга относительно заряда.
Нейтрон в атоме — это крошечная частица. Как и протоны, они слишком малы, чтобы увидеть их даже с помощью электронного микроскопа, но они там есть, потому что это единственный способ, объясняющий поведение атомов. Нейтроны очень важны для обеспечения стабильности атома, однако за пределами его атомного центра они не могут существовать долго и распадаются в среднем всего лишь за 885 секунд (около 15 минут).
Атомное ядро — Википедия
А́томное ядро́ — центральная часть атома, в которой сосредоточена основная его масса (более 99,9 %). Ядро заряжено положительно, заряд ядра определяет химический элемент, к которому относят атом. Размеры ядер различных атомов составляют несколько фемтометров, что более чем в 10 тысяч раз меньше размеров самого атома. Атомные ядра изучает ядерная физика.
Атомное ядро состоит из нуклонов — положительно заряженных протонов и нейтральных нейтронов, которые связаны между собой при помощи сильного взаимодействия. Протон и нейтрон обладают собственным моментом количества движения (спином), равным ℏ/2=h/4π{\displaystyle \hbar /2=h/4\pi }[сн 1] и связанным с ним магнитным моментом. Единственный стабильный атом, не содержащий нейтронов в ядре — лёгкий водород (протий).
Атомное ядро, рассматриваемое как класс частиц с определённым числом протонов и нейтронов, принято называть нуклидом.
В некоторых редких случаях могут образовываться короткоживущие экзотические атомы, у которых вместо нуклона ядром служат иные частицы.
Количество протонов в ядре называется его зарядовым числом Z{\displaystyle Z} — это число равно порядковому номеру элемента, к которому относится атом, в таблице (Периодической системе элементов) Менделеева. Количество протонов в ядре определяет структуру электронной оболочки нейтрального атома и, таким образом, химические свойства соответствующего элемента. Количество нейтронов в ядре называется его изотопическим числом N{\displaystyle N}[источник не указан 219 дней (обс.)]. Ядра с одинаковым числом протонов и разным числом нейтронов называются изотопами. Ядра с одинаковым числом нейтронов, но разным числом протонов — называются изотонами. Термины изотоп и изотон используются также применительно к атомам, содержащим указанные ядра, а также для характеристики нехимических разновидностей одного химического элемента. Полное количество нуклонов в ядре называется его массовым числом A{\displaystyle A} (A=N+Z{\displaystyle A=N+Z}) и приблизительно равно средней массе атома, указанной в таблице Менделеева. Нуклиды с одинаковым массовым числом, но разным протон-нейтронным составом принято называть изобарами.
Как и любая квантовая система, ядра могут находиться в метастабильном возбуждённом состоянии, причём в отдельных случаях время жизни такого состояния исчисляется годами. Такие возбуждённые состояния ядер называются ядерными изомерами[1][2][3].
В 1911 году Резерфорд в своём докладе «Рассеяние α- и β-лучей и строение атома» в философском обществе Манчестера заявил[4]:
Рассеяние заряженных частиц может быть объяснено, если предположить такой атом, который состоит из центрального электрического заряда, сосредоточенного в точке и окружённого однородным сферическим распределением противоположного электричества равной величины. При таком устройстве атома α- и β-частицы, когда они проходят на близком расстоянии от центра атома, испытывают большие отклонения, хотя вероятность такого отклонения мала.
Таким образом Резерфорд открыл атомное ядро, с этого момента и ведёт начало ядерная физика, изучающая строение и свойства атомных ядер.
После обнаружения стабильных изотопов элементов, ядру самого лёгкого атома была отведена роль структурной частицы всех ядер. С 1920 года ядро атома водорода имеет официальный термин — протон. В 1921 году Лиза Мейтнер предложила[5] первую, протон-электронную, модель строения атомного ядра, согласно которой оно состоит из протонов, электронов и альфа-частиц[6]:96. Однако в 1929 году произошла «азотная катастрофа» — В. Гайтлер и Г. Герцберг установили[7], что ядро атома азота подчиняется статистике Бозе — Эйнштейна, а не статистике Ферми — Дирака, как предсказывала протон-электронная модель[8][9]:374. Таким образом, эта модель вступила в противоречие с экспериментальными результатами измерений спинов и магнитных моментов ядер[10]. В 1932 году Джеймсом Чедвиком была открыта новая электрически нейтральная частица, названная нейтроном. В том же году Иваненко[11] и, независимо, Гейзенберг выдвинули гипотезу о протон-нейтронной структуре ядра. В дальнейшем, с развитием ядерной физики и её приложений, эта гипотеза была полностью подтверждена[12].
Теории строения атомного ядра[править | править код]
В процессе развития физики выдвигались различные гипотезы строения атомного ядра; тем не менее, каждая из них способна описать лишь ограниченную совокупность ядерных свойств. Некоторые модели могут взаимоисключать друг друга.
Наиболее известными являются следующие:
Зарядовым числом Z{\displaystyle Z} полностью определяется химический элемент. Парой чисел Z{\displaystyle Z} и A{\displaystyle A} (массовое число) полностью определяется нуклид. Можно рассмотреть некоторые ядерно-физические характеристики нуклидов с заданными зарядовыми и массовыми числами.
Заряд[править | править код]
Число протонов в ядре Z{\displaystyle Z} определяет непосредственно его электрический заряд; у изотопов одинаковое количество протонов, но разное количество нейтронов. Ядерные свойства изотопов элемента, в отличие от химических, могут различаться чрезвычайно резко[1].
Впервые заряды атомных ядер определил Генри Мозли в 1913 году. Свои экспериментальные наблюдения учёный интерпретировал зависимостью длины волны рентгеновского излучения от некоторой константы Z{\displaystyle Z}, изменяющейся на единицу от элемента к элементу и равной единице для водорода:
- 1/λ=aZ−b{\displaystyle {\sqrt {1/\lambda }}=aZ-b}, где
a{\displaystyle a} и b{\displaystyle b} — постоянные.
Из чего Мозли сделал вывод, что найденная в его опытах константа атома, определяющая длину волны характеристического рентгеновского излучения и совпадающая с порядковым номером элемента, может быть только зарядом атомного ядра, что стало известно под названием закон Мозли[2].
Масса[править | править код]
Из-за разницы в числе нейтронов A−Z{\displaystyle A-Z} изотопы элемента имеют разную массу M(A,Z){\displaystyle M(A,Z)}, которая является важной характеристикой ядра. В ядерной физике массу ядер принято измерять в атомных единицах массы (а. е. м.), за одну а. е. м. принимают 1/12 часть массы нуклида 12C[сн 2]. Следует отметить, что стандартная масса, которая обычно приводится для нуклида — это масса нейтрального атома. Для определения массы ядра нужно из массы атома вычесть сумму масс всех электронов (более точное значение получится, если учесть ещё и энергию связи электронов с ядром).
Кроме того, в ядерной физике часто используется энергетический эквивалент массы. Согласно соотношению Эйнштейна, каждому значению массы M{\displaystyle M} соответствует полная энергия:
- E=Mc2{\displaystyle E=Mc^{2}}, где c{\displaystyle c} — скорость света в вакууме.
Соотношение между а. е. м. и её энергетическим эквивалентом в джоулях:
- E1=1,660539⋅10−27⋅(2,997925⋅108)2=1,492418⋅10−10{\displaystyle E_{1}=1{,}660539\cdot 10^{-27}\cdot (2{,}997925\cdot 10^{8})^{2}=1{,}492418\cdot 10^{-10}},
а так как 1 электронвольт = 1,602176⋅10−19 Дж, то энергетический эквивалент а. е. м. в МэВ равен[1][3]:
- E1=931,494{\displaystyle E_{1}=931{,}494}.
Радиус[править | править код]
Анализ распада тяжёлых ядер уточнил оценку Резерфорда[сн 3] и связал радиус ядра с массовым числом простым соотношением:
- R=r0A1/3{\displaystyle R=r_{0}A^{1/3}},
где r0{\displaystyle r_{0}} — константа.
Так как радиус ядра не является чисто геометрической характеристикой и связан прежде всего с радиусом действия ядерных сил, то значение r0{\displaystyle r_{0}} зависит от процесса, при анализе которого получено значение R{\displaystyle R}, усреднённое значение r0=1,23⋅10−15{\displaystyle r_{0}=1{,}23\cdot 10^{-15}} м, таким образом радиус ядра в метрах[1][2]:
R=1,23⋅10−15A1/3{\displaystyle R=1{,}23\cdot 10^{-15}A^{1/3}}.
Моменты ядра[править | править код]
Как и составляющие его нуклоны, ядро имеет собственные моменты.
Спин[править | править код]
Поскольку нуклоны обладают собственным механическим моментом, или спином, равным 1/2{\displaystyle 1/2}, то и ядра должны иметь механические моменты. Кроме того, нуклоны участвуют в ядре в орбитальном движении, которое также характеризуется определённым моментом количества движения каждого нуклона. Орбитальные моменты принимают только целочисленные значения ℏ{\displaystyle \hbar } (постоянная Дирака). Все механические моменты нуклонов, как спины, так и орбитальные, суммируются алгебраически и составляют спин ядра.
Несмотря на то, что число нуклонов в ядре может быть очень велико, спины ядер обычно невелики и составляют не более нескольких ℏ{\displaystyle \hbar }, что объясняется особенностью взаимодействия одноимённых нуклонов. Все парные протоны и нейтроны взаимодействуют только так, что их спины взаимно компенсируются, то есть пары всегда взаимодействуют с антипараллельными спинами. Суммарный орбитальный момент пары также всегда равен нулю. В результате ядра, состоящие из чётного числа протонов и чётного числа нейтронов, не имеют механического момента. Отличные от нуля спины существуют только у ядер, имеющих в своём составе непарные нуклоны, спин такого нуклона суммируется с его же орбитальным моментом и имеет какое-либо полуцелое значение: 1/2, 3/2, 5/2. Ядра нечётно-нечётного состава имеют целочисленные спины: 1, 2, 3 и т. д.[2].
Магнитный момент[править | править код]
Измерения спинов стали возможными благодаря наличию непосредственно связанных с ними магнитных моментов. Они измеряются в магнетонах и у различных ядер равны от −2 до +5 ядерных магнетонов. Из-за относительно большой массы нуклонов магнитные моменты ядер очень малы по сравнению с магнитными моментами электронов, поэтому их измерение гораздо сложнее. Как и спины, магнитные моменты измеряются спектроскопическими методами, наиболее точным является метод ядерного магнитного резонанса.
Магнитный момент чётно-чётных пар, как и спин, равен нулю. Магнитные моменты ядер с непарными нуклонами образуются собственными моментами этих нуклонов и моментом, связанным с орбитальным движением непарного протона[10].
Электрический квадрупольный момент[править | править код]
Атомные ядра, спин которых больше или равен единице, имеют отличные от нуля квадрупольные моменты, что говорит об их не точно сферической форме. Квадрупольный момент имеет знак плюс, если ядро вытянуто вдоль оси спина (веретенообразное тело), и знак минус, если ядро растянуто в плоскости, перпендикулярной оси спина (чечевицеобразное тело). Известны ядра с положительными и отрицательными квадрупольными моментами. Отсутствие сферической симметрии у электрического поля, создаваемого ядром с ненулевым квадрупольным моментом, приводит к образованию дополнительных энергетических уровней атомных электронов и появлению в спектрах атомов линий сверхтонкой структуры, расстояния между которыми зависят от квадрупольного момента[2].
Энергия связи[править | править код]
Большая энергия связи нуклонов, входящих в ядро, говорит о существовании ядерных сил, поскольку известные гравитационные силы слишком малы, чтобы преодолеть взаимное электростатическое отталкивание протонов в ядре. Связь нуклонов осуществляется чрезвычайно короткодействующими силами, которые возникают вследствие непрерывного обмена частицами, называемыми пи-мезонами, между нуклонами в ядре.
Экспериментально было обнаружено, что для всех стабильных ядер масса ядра меньше суммы масс составляющих его нуклонов, взятых по отдельности. Эта разница называется дефектом массы или избытком массы и определяется соотношением:
- ΔM(Z,A)=Zmp+(A−Z)mn−M(Z,A){\displaystyle \Delta M(Z,A)=Zm_{p}+(A-Z)m_{n}-M(Z,A)},
где mp{\displaystyle m_{p}} и mn{\displaystyle m_{n}} — массы свободного протона и нейтрона, M(Z,A){\displaystyle M(Z,A)} — масса ядра.
Согласно принципу эквивалентности массы и энергии дефект массы представляет собой массу, эквивалентную работе, затраченной ядерными силами, чтобы собрать все нуклоны вместе при образовании ядра. Эта величина равна изменению потенциальной энергии нуклонов в результате их объединения в ядро.
Энергия, эквивалентная дефекту массы, называется энергией связи ядра и равна:
- Ec=(Zmp+(A−Z)mn−M(Z,A))c2{\displaystyle E_{c}=(Zm_{p}+(A-Z)m_{n}-M(Z,A))c^{2}},
где c{\displaystyle c} — скорость света в вакууме.
Другим важным параметром ядра является энергия связи, приходящаяся на один нуклон ядра, которую можно вычислить, разделив энергию связи ядра на число содержащихся в нём нуклонов:
- ε=EcA{\displaystyle \varepsilon ={\frac {E_{c}}{A}}}
Эта величина представляет собой среднюю энергию, которую нужно затратить, чтобы удалить один нуклон из ядра, или среднее изменение энергии связи ядра, когда свободный протон или нейтрон поглощается в нём.
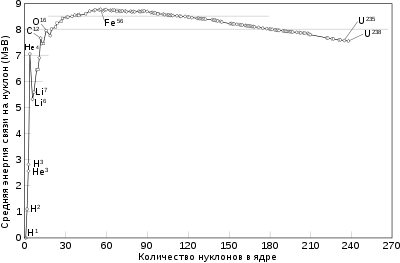
Как видно из поясняющего рисунка, при малых значениях массовых чисел удельная энергия связи ядер резко возрастает и достигает максимума при A≈50÷60{\displaystyle A\approx 50\div 60} (примерно 8,8 Мэв). Нуклиды с такими массовыми числами наиболее устойчивы. С дальнейшим ростом A{\displaystyle A} средняя энергия связи уменьшается, однако в широком интервале массовых чисел значение энергии почти постоянно (ϵ≈8{\displaystyle \epsilon \approx 8} МэВ), из чего следует, что можно записать Ec≈ϵA{\displaystyle E_{c}\approx \epsilon A}.
Такой характер поведения средней энергии связи указывает на свойство ядерных сил достигать насыщения, то есть на возможность взаимодействия нуклона только с малым числом «партнёров». Если бы ядерные силы не обладали свойством насыщения, то в пределах радиуса действия ядерных сил каждый нуклон взаимодействовал бы с каждым из остальных и энергия взаимодействия была бы пропорциональна A(A−1){\displaystyle A(A-1)}, а средняя энергия связи одного нуклона не была бы постоянной у разных ядер, а возрастала бы с ростом A{\displaystyle A}.
Общая закономерность зависимости энергии связи от массового числа описывается формулой Вайцзеккера в рамках теории капельной модели ядра[1][2][13][14].
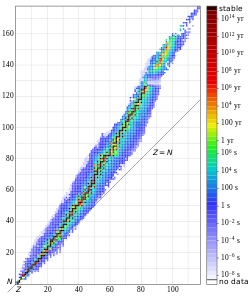 Зависимость числа нейтронов N от числа протонов Z в атомных ядрах (N=A-Z).
Зависимость числа нейтронов N от числа протонов Z в атомных ядрах (N=A-Z).Из факта убывания средней энергии связи для нуклидов с массовыми числами больше или меньше 50-60 следует, что для ядер с малыми A{\displaystyle A} энергетически выгоден процесс слияния — термоядерный синтез, приводящий к увеличению массового числа, а для ядер с большими A{\displaystyle A} — процесс деления. В настоящее время оба этих процесса, приводящих к выделению энергии, осуществлены, причём последний лежит в основе современной ядерной энергетики, а первый находится в стадии разработки.
Детальные исследования показали, что устойчивость ядер также существенно зависит от параметра N/Z{\displaystyle N/Z} — отношения чисел нейтронов и протонов. В среднем для наиболее стабильных ядер[15]N/Z≈1+0.015A2/3{\displaystyle N/Z\approx 1+0.015A^{2/3}}, поэтому ядра лёгких нуклидов наиболее устойчивы при N≈Z{\displaystyle N\approx Z}, а с ростом массового числа всё более заметным становится электростатическое отталкивание между протонами, и область устойчивости сдвигается в сторону N>Z{\displaystyle N>Z}(см. поясняющий рисунок).
Если рассмотреть таблицу стабильных нуклидов, встречающихся в природе, можно обратить внимание на их распределение по чётным и нечётным значениям Z{\displaystyle Z} и N{\displaystyle N}. Все ядра с нечётными значениями этих величин являются ядрами лёгких нуклидов 12H{\displaystyle {}_{1}^{2}{\textrm {H}}}, 36Li{\displaystyle {}_{3}^{6}{\textrm {Li}}}, 510B{\displaystyle {}_{5}^{10}{\textrm {B}}}, 714N{\displaystyle {}_{7}^{14}{\textrm {N}}}. Среди изобар с нечётными A, как правило, стабилен лишь один. В случае же чётных A{\displaystyle A} часто встречаются по два, три и более стабильных изобар, следовательно, наиболее стабильны чётно-чётные, наименее — нечётно-нечётные. Это явление свидетельствует о том, что как нейтроны, так и протоны, проявляют тенденцию группироваться парами с антипараллельными спинами, что приводит к нарушению плавности вышеописанной зависимости энергии связи от A{\displaystyle A}[1].
| Z | N=A-Z | A | Число нуклидов |
|---|---|---|---|
| Чётное | Чётное | Чётное | 167 |
| Чётное | Нечётное | Нечётное | 55 |
| Нечётное | Чётное | Нечётное | 53 |
| Нечётное | Нечётное | Чётное | 4 |
Таким образом, чётность числа протонов или нейтронов создаёт некоторый запас устойчивости, который приводит к возможности существования нескольких стабильных нуклидов, различающихся соответственно по числу нейтронов для изотопов и по числу протонов для изотонов. Также чётность числа нейтронов в составе тяжёлых ядер определяет их способность делиться под воздействием нейтронов[2].
Ядерные силы — это силы, удерживающие нуклоны в ядре, представляющие собой большие силы притяжения, действующие только на малых расстояниях. Они обладают свойствами насыщения, в связи с чем ядерным силам приписывается обменный характер (с помощью пи-мезонов). Ядерные силы зависят от спина, не зависят от электрического заряда и не являются центральными силами[2].
В отличие от свободных частиц, для которых энергия может принимать любые значения (так называемый непрерывный спектр), связанные частицы (то есть частицы, кинетическая энергия которых меньше абсолютного значения потенциальной), согласно квантовой механике, могут находиться в состояниях только с определёнными дискретными значениями энергий, так называемый дискретный спектр. Так как ядро — система связанных нуклонов, оно обладает дискретным спектром энергий. Обычно оно находится в наиболее низком энергетическом состоянии, называемым основным. Если передать ядру энергию, оно перейдёт в возбуждённое состояние.
Расположение энергетических уровней ядра в первом приближении:
- D=ae−bE∗{\displaystyle D=ae^{-b{\sqrt {E^{*}}}}}, где:
D{\displaystyle D} — среднее расстояние между уровнями,
E∗{\displaystyle E^{*}} — энергия возбуждения ядра,
a{\displaystyle a} и b{\displaystyle b} — коэффициенты, постоянные для данного ядра:
a{\displaystyle a} — среднее расстояние между первыми возбуждёнными уровнями (для лёгких ядер примерно 1 МэВ, для тяжёлых — 0,1 МэВ)
b{\displaystyle b} — константа, определяющая скорость сгущения уровней при увеличении энергии возбуждения (для лёгких ядер примерно 2 МэВ−1/2, для тяжёлых — 4 МэВ−1/2).
С ростом энергии возбуждения уровни сближаются быстрее у тяжёлых ядер, также плотность уровней зависит от чётности числа нейтронов в ядре. Для ядер с чётными (особенно магическими) числами нейтронов плотность уровней меньше, чем для ядер с нечётными, при равных энергиях возбуждения первый возбуждённый уровень в ядре с чётным числом нейтронов расположен выше, чем в ядре с нечётным.
Во всех возбуждённых состояниях ядро может находиться лишь конечное время, до тех пор, пока возбуждение не будет снято тем или иным путём. Состояния, энергия возбуждения которых меньше энергии связи частицы или группы частиц в данном ядре, называются связанными; в этом случае возбуждение может сниматься лишь гамма-излучением. Состояния с энергией возбуждения, превышающей энергию связи частиц, называются квазистационарными. В этом случае ядро может испустить частицу или гамма-квант[1].
Ядерная реакция — процесс превращения атомных ядер, происходящий при их взаимодействии с элементарными частицами, гамма-квантами и друг с другом.
Лишь небольшая часть нуклидов являются стабильными. В большинстве случаев ядерные силы оказываются неспособны обеспечить их постоянную целостность, и ядра рано или поздно распадаются. Это явление получило название радиоактивности.
Для обозначения атомных ядер используется следующая система:
- в середине ставится символ химического элемента, что однозначно определяет зарядовое число Z{\displaystyle Z} ядра;
- слева сверху от символа элемента ставится массовое число A{\displaystyle A}.
Таким образом, состав ядра оказывается полностью определён, так как N=A−Z{\displaystyle N=A-Z}.
Пример такого обозначения:
238U{\displaystyle {}^{238}{\textrm {U}}} — ядро урана-238, в котором 238 нуклонов, из которых 92 — протоны, так как элемент уран имеет 92-й номер в таблице Менделеева.
Иногда, однако, для полноты вокруг обозначения элемента указывают все характеризующие ядро его атома числа:
- слева снизу — зарядовое число Z{\displaystyle Z}, то есть, то же самое, что указано символом элемента;
- слева сверху — массовое число A{\displaystyle A};
- справа снизу — изотопическое число N{\displaystyle N}[

