Расчет концентрации и титра раствора. Задачи 107
Задача 107.
Из Nа2СО3 массой 5,3000 г приготовили 1 дм3 раствора. Вычислите молярную, нормальную концентрации и титр раствора.
Решение:
V(p-pa) = 1 дм3 = 1000 cм3;
М(Nа2СО3) = 106 г/моль;
m(Nа2СО3) = 5,3000 г;
Э(Nа2СО3) = 53 г/моль; ;
СМ(Nа2СО3) = ?
СН(Nа2СО3) = ?
Т(р-ра) = ?
Определяемое вещество (А) – Nа2СО3
1. Рассчитаем титр раствора
ТА = m(Nа2СО3)/V(p-pa) = 5,3000/1000 = 0,005300 г/см3.
2. Расчет молярной концентрации (молярность)
Молярную концентрацию (СМ) можно определить по формуле:
СМ(в-ва) = (Т · 1000)/M(в-ва)
Тогда
СМ(Nа2СО3) = (ТA · 1000)/М(Nа2СО3) = (0,005300 · 1000)/106 = 0,05 моль/дм3.
3. Расчет нормальной концентрации (нормальность)
Для определения нормальной концентрации (СН) воспользуемся формулой:
СН(в-ва) = (Т · 1000)/Э(в-ва)
Тогда
СН(Nа2СО3) = (ТA · 1000)/Э(Nа2СО3) = (0,005300 · 1000)/53 = 0,10 моль/дм3.
Ответ: 0,05 моль/дм3; 0,10 моль/дм3; 0,005300 г/см3.
Задача 108.
Вычислите молярную и нормальную концентрации раствора Н2SО4 с титром 0,004900 г/см3.
Решение:
М(Н2SО4) = 98 г/моль;
ТА = 0,004900 г/см3;
Э(Н2SО4) = 49 г/моль;
СМ(Н2SО4) = ?
СН(Н2SО4) = ?
Определяемое вещество (А) –Н2SО4
1. Расчет молярной концентрации (молярность)
Молярную концентрацию (СМ) можно определить по формуле:
СМ(в-ва) = (Т · 1000)/M(в-ва)
Тогда
СМ(Н2SО4) = (ТA · 1000)/М(Н2SО4) = (0,004900 · 1000)/98 = 0,05 моль/дм3.
2. Расчет нормальной концентрации (нормальность)
Для определения нормальной концентрации (СН) воспользуемся формулой:
СН(в-ва) = (Т · 1000)/Э(в-ва)
Тогда
СН(Н2SО4) = (ТA · 1000)/Э(Н2SО4) = (0,004900 · 1000)/49 = 0,10 моль/дм3.
Ответ: СМ = 0,05 моль/дм 3; СН = 0,10 моль/дм3.
Задача 109.
Вычислите нормальную концентрацию раствора NаОН, если Т(NаОН/СаО) равен 0,002914 г/см3.
Решение:
Т(NаОН/СаО) = 0,002914 г/см3;
Э(NаОН) = 40 г/моль;
Э(СаО) = 28 г/моль;
СН(NаОН) = ?
Определяемое вещество (А) – NаОН
1. Расчет титра раствора NаОН
Титр раствора NаОН определим, используя формулу:
Т(А/B) = [ТА · Э(B)]/Э(A), где
А — определяемое вещество; В — стандартное вещество; Э — масса эквивалента; ТА — титр раствора.
Тогда
Т(NаОН) = [Т(NаОН/СаО) · Э(NаОН)]/Э(CaO) = (0,002914 · 40)/28 = 0,004163.
2. Расчет нормальной концентрации раствора
Для определения нормальной концентрации (СН) воспользуемся формулой:
СН(в-ва) = (ТA · 1000)/Э(в-ва)
Тогда
СН(NаОН) = [(Т(NаОН) · 1000)/Э(NаОН)] = (0,004163 · 1000)/40 = 0,1041 моль/дм3.
Ответ: СН(NаОН) = 0,1041 моль/дм3.
формула для расчета, связь с другими концентрациями
Титр раствора. Формула для его расчета достаточно проста и чем-то напоминает формулу для расчета плотности раствора, так как выражается в тех же единицах.
Титр раствора: формула для расчета
Титр – один из способов выражения количественного состава раствора. Является основной концентрацией в титриметрическом анализе.
Титр (Т) – это масса вещества (в граммах), которая содержится в 1 мл (1 см3) раствора.
Например, титр раствора азотной кислоты равен 0,005672 г/мл. Это означает, что в каждом одном миллилитре раствора содержится 0,005672 г азотной кислоты.
Переход от титра раствора к другим видам концентраций
В титриметрическом анализе применяются и другие концентрации: молярная (См) и нормальная (Сн). Между ними и титром существует взаимосвязь: можно от одной концентрации перейти к другой. Например, взаимосвязь титра и молярной концентрации.
Для См объем измеряется в литрах (л) , для Т – в миллилитрах (мл), то есть в 1000 раз меньше. Учтем это и получим:
Аналогичные преобразования можно провести и с нормальной концентрацией (Сн). В результате получим:
Титр связан и с массовой долей растворенного вещества:
Титр раствора: формула и примеры расчетов
Приведем конкретные примеры вычисления титра раствора и других концентраций, связанных с ним.
Пример 1. Какая масса азотной кислоты содержится в 500 мл раствора, если его титр равен 0,00630 г/мл?
Какая масса азотной кислоты содержится в 500 мл раствора, если его титр равен 0,00630 г/мл?
Пример 2. В 1 кг воды растворили 250 г NaOH. Плотность полученного раствора равна 1,219 г/мл. Какова массовая доля NaOH, титр, молярная и нормальная концентрации раствора щелочи.
Пример 3. Титр раствора HCl равен 0,003592 г/мл. Вычислите его нормальную концентрацию.
Пример 4. Нормальная концентрация раствора H2SO4 составляет 0,1205 н. Определите его титр.
Пример 5. Какова нормальная концентрация раствора H2C2O4·2H2O, полученного растворением 1,7334 г ее в мерной колбе вместимостью 250 мл?
Пример 6. Питьевую соду массой 4,2 г растворили в дистиллированной воде. Объем раствора составил 200 мл. Каковы титр и молярная концентрация полученного раствора?
Объем раствора составил 200 мл. Каковы титр и молярная концентрация полученного раствора?
Пример 7. В 100 г раствора (ρ = 1г/мл) хлорида цинка ZnCl2 содержится 5 г соли. Определите титр, массовую долю, молярную и нормальную концентрации раствора.
Таким образом, зная титр раствора, формулу для вычисления его значения, можно перейти к другим видам концентрации раствора, и наоборот.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
Пожалуйста, оцените публикацию. Большая просьба, если вы оцениваете публикацию от 1 до 3 звезд, обязательно оставьте свой комментарий с указанием того, что не так с этой публикацией. Мы постараемся устранить недостатки.
Ваше мнение для нас важно!
Нормальность — измерение концентрации элемента
Тим Лофтус
некоторые растворы в лаборатории. Хотя он используется во многих областях лаборатории
технический мир, мы в области водоснабжения и водоотведения используем его почти
исключительно для измерения концентрации кислот и оснований для таких растворов
в качестве титранта при анализе кислотности и щелочности, а также для корректировки рН
Образцы БПК, аммиака и фосфора.
Хотя он используется во многих областях лаборатории
технический мир, мы в области водоснабжения и водоотведения используем его почти
исключительно для измерения концентрации кислот и оснований для таких растворов
в качестве титранта при анализе кислотности и щелочности, а также для корректировки рН
Образцы БПК, аммиака и фосфора.
Нормальность аналогична концепции молярности (см. предыдущую статью Молярность). Где молярность (M) представляет собой концентрацию иона или соединения в растворе, нормальность (N) идет еще дальше и представляет собой молярную концентрации только кислотного компонента (обычно иона Н+ в кислой растворе) или только основной компонент (обычно ОН-ион в основном растворе).
Вот простой пример, показывающий взаимосвязь нормальной кислоты и основания.
растворы: 1 н. раствор кислоты h3SO4 полностью нейтрализует равную
объем 1н раствора основания NaOH. Несмотря на то, что h3SO4 обеспечивает два
(кислотные) ионы H+ на молекулу по сравнению с одним (основным) ионом OH- на молекулу NaOH,
расчеты N учитывают эти различия и помещают все это в
эквивалентная шкала.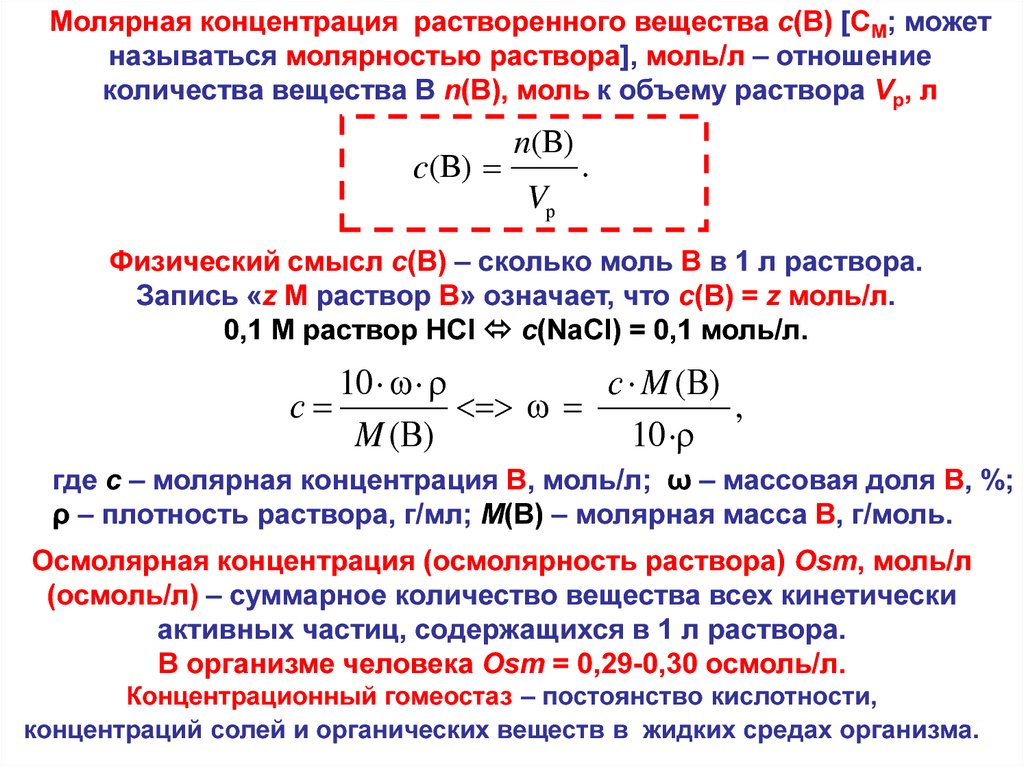 В некотором смысле, с расчетами нормальности вы действительно можете
сравните яблоки с апельсинами по кислоте и щелочи в любом случае.
В некотором смысле, с расчетами нормальности вы действительно можете
сравните яблоки с апельсинами по кислоте и щелочи в любом случае.
Если вы знаете молярность раствора кислоты или основания, вы можете легко преобразовать ее до нормальности путем умножения молярности на количество водорода (или гидроксида) ионов в кислоте (или основании).
N = (M)(количество ионов водорода или гидроксида)
Например, 2M раствор h3SO4 будет иметь нормальность 4N (2M x 2 водорода ионы). Раствор 2 М h4PO4 будет иметь нормальность 6 н.
Однако, чтобы сделать решение заданной нормальности, требуется немного больше расчет. Во-первых, необходимо определить эквивалентную массу соединений. Это получают, взяв грамм-молекулярную массу соединения и разделив ее на число ионы водорода или гидроксид-ионы. Вот несколько примеров:
h3SO4, серная кислота.
Грамм-молекулярная масса равна 98 (Из периодической диаграммы отдельные атомные
массы: H=1, S=32, O=16: {1×2}+32+{16×4}=98).
Число кислых ионов водорода (H+) равно 2.
Эквивалентная масса для h3SO4 составляет 98/2 = 49.
h4PO4, фосфорная кислота. Грамм-молекулярная масса также равна 98. Число ионов водорода (H+) равно 3. Эквивалентная масса для h4PO4 составляет 98/3 = 32,6.
NaOH, гидроксид калия. Грамм-молекулярная масса равна 40. Количество ионы гидроксида (OH-) равны 1. Эквивалентная масса NaOH составляет 40/1 = 40,9.0003
После определения эквивалентной массы кислоты или основания вы можете рассчитайте количество граммов, необходимое на объем воды для N.
Формула для расчета:
Необходимое количество граммов соединения = (нужное N)(эквивалентная масса)(объем в литрах желанный).
Например, сколько граммов гидроксида натрия вам нужно разбавить до литров для приготовления 1 н раствора NaOH?
Эквивалентная масса равна 40, как определено выше.
Необходимое количество граммов NaOH = (1N)(40 экв. массы)(1 литр) = 40 граммов NaOH.
Аналогично, чтобы получить 0,25 л 0,05 н. гидрофталата калия
(KHC8h5O4) раствора (кислоты), вы бы сначала определили эквивалентную массу.
гидрофталата калия
(KHC8h5O4) раствора (кислоты), вы бы сначала определили эквивалентную массу.Из периодической диаграммы К=39, Н=1, С=12, О=16. Его грамм-молекулярная масса 39+1+(12×8)+(1×4)+(16×4) = 204.
Количество ионов водорода, которое он может образовать, равно 1 (Кислотные атомы водорода обычно в левой части химической формулы. Водороды, перечисленные где-либо еще, обычно не способствуют кислотной части соединения. В случае KHC8h5O4, только самый левый водород является кислым водородом.) Его эквивалентная масса составляет 204/1. = 204,
Чтобы найти количество гидрофталата калия (KHC8h5O4), необходимого для производства 0,25 л 0,05 н. раствора:
граммов KHC8h5O4 необходимо = (0,05 н.)(204 экв. массы)(0,25 л) = 2,6 граммов КНС8х5О4.
Оба химических вещества в приведенных выше примерах, гидроксид натрия и калий
фталат водорода, считаются сухими химическими веществами, что делает его относительно
легко вычислить их нормальности. Для жидких химикатов, где
основное соединение составляет лишь часть от общего объема, например концентрированный
формы соляной (HCl), серной (h3SO4) и фосфорной (h4PO4) кислот,
необходимо выполнить несколько дополнительных вычислений, чтобы получить решение конкретного
Нормальность.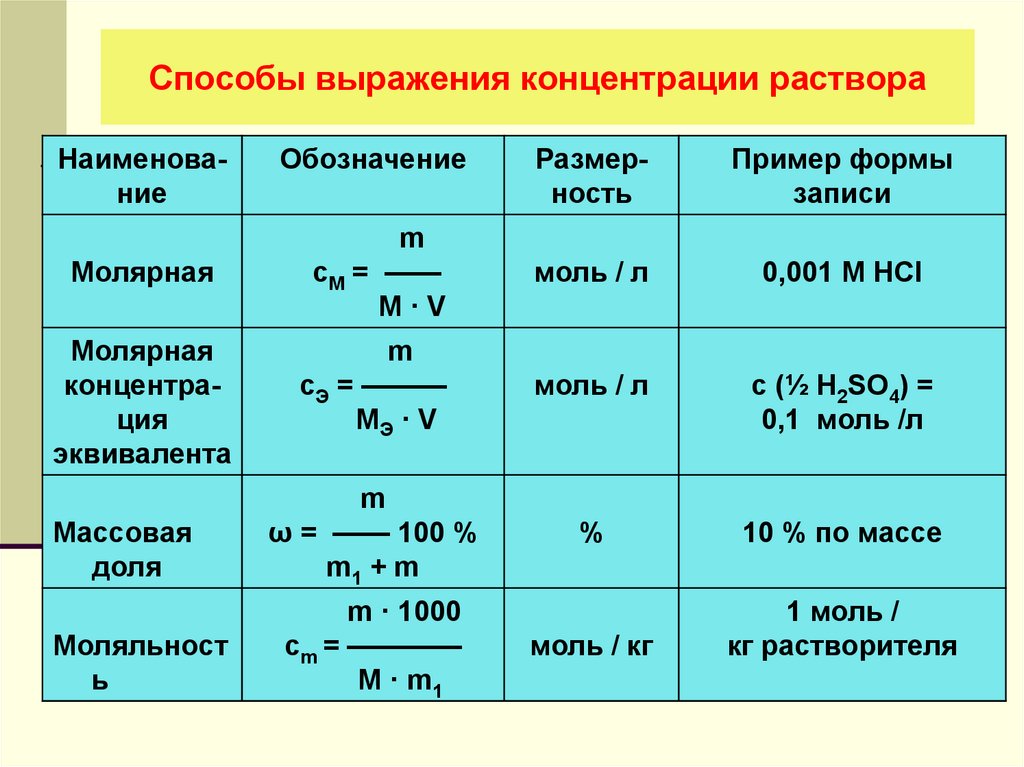
В следующей статье будут описаны и приведены примеры этих дополнительных расчеты. Они не только полезны для приготовления растворов кислот и оснований, но и полезны при расчете концентраций любого типа концентрированных растворенных соединения, такие как квасцы (сульфат алюминия), отбеливатель (гипохлорит натрия), железо хлорид и многие другие растворы, используемые при очистке сточных вод.
Обратите внимание, что в этой статье конкретно рассматривается то, что обычно встречается в лаборатория по очистке сточных вод. Существуют исключения из того, как концентрации кислот и оснований измеряются, и это зависит от области применения и применения конкретного метода испытаний.
Если у вас есть какие-либо вопросы, предложения или комментарии, обращайтесь в лабораторию NEWEA Lab Practices.
Председатель комитета Тим Лофтус, тел. (508) 949-3865 [email protected]. Для большего
информацию о Комитете по лабораторной практике NEWEA, пожалуйста, свяжитесь с Тимом
Лофтус или Элизабет Кутон, исполнительный директор NEWEA, 100 Tower Office Park,
Woburn, MA 01801, (781) 939-0908, ecutone@newea.
Все прошлые статьи размещены на нашем сайте. Зайдите на www.NEWEA.org и следуйте ссылку на страницы комитетов, а затем на страницу лабораторной практики.
Связь между нормальностью и молярностью
На кухне можно разделить растворы на слабые и сильные, но этого недостаточно в лаборатории. Концентрация раствора определяет, как молекулы в растворе будут сталкиваться друг с другом, и, таким образом, определяет условия равновесия и скорости реакции. Существует множество способов определения концентрации растворов. Среди них наиболее часто используются нормальность и молярность.
Что такое нормальность?
Нормальность относится к граммовому эквиваленту вещества, растворенного в одном литре раствора. Эквивалентный вес в граммах можно определить как реактивную способность молекулы. Он измеряется как «N», экв/л или мэкв/л, где «экв» означает эквиваленты, а «мэкв» означает миллиэквивалент. Нормальность является наиболее предпочтительной формой измерения концентрации для расчетов титрования.
\[Нормальность = \frac{\text{Граммовый эквивалент растворенного вещества}}{\text{объем раствора в литрах}}\]
Измеряет химическую концентрацию, определяемую изучаемой химической реакцией.
Эта единица измерения используется не для всех реакций. Одна из причин, по которой он редко используется, заключается в том, что нормальность рассчитывается на основе эквивалентного веса в граммах. Это определяется количеством ионов, которые вступают в реакцию. Она может меняться в зависимости от типа протекающей реакции. Таким образом, эквивалентный вес в граммах не является постоянным. В свою очередь, это может вызвать путаницу.
Нормальность используется для измерения:
Окислительно-восстановительные реакции

Пример — Zn + Cu 2+ → Zn 2+ + Cu
В этом уравнении атом цинка отдает 2 электрона, а каждый атом меди принимает только 1 электрон.
Кислотно-основная химия
В таких реакциях нормальность является мерой гидроксидов или протонов, которые реагируют друг с другом. Он описывает концентрацию гидроксида (OH-) и гидроксония (H 3 O + ).
Пример
В 1 М растворе H 2 SO 4 на каждую молекулу H 2 SO 4 приходится 2 протона. Таким образом, нормальность решения равна 2N.
Реакции осаждения
Нормальность указывает количество ионов, которые будут осаждены.
Важно отметить, что нормальность не является заданным значением для всех химических растворов. Значение N может меняться в зависимости от изучаемой химической реакции. Например, раствор CaCl 2 имеет значение 2 н при реакции с ионом хлорида (Cl-), но он будет иметь значение 1 н при реакции с ионами магния (Mg 2+ ).
Что такое молярность?
Молярность является наиболее часто используемой мерой концентрации в растворе. Молярность также может называться молярной концентрацией. Его можно определить как количество молей растворенного вещества на литр раствора.
Молярность выражается в моль/л. Молярность также может быть описана как молярная концентрация и может быть представлена как «М».
Для расчета молярности вам потребуется разделить массу раствора на молекулярную массу вещества. Например, растворение 174,26 г моль-1 (1М) сульфата калия в одном литре воды даст раствор сульфата калия с молярностью 1М.
\[Молярность = \frac{\text{Количество молей растворенного вещества}}{\text{Объем раствора в 1 литре}}\]
Формула для расчета количества молей вещества:
Количество молей = \[\frac{\text{Заданная масса вещества}}{\text{Молекулярная масса вещества}}\]
Молярность может меняться в зависимости от температуры и объема. При повышении температуры молярность уменьшается. Точно так же, когда объем раствора увеличивается, молярность уменьшается. Молярность раствора также зависит от растворимости растворенного вещества, и если к раствору добавляются какие-либо дополнительные вещества, молярность имеет прямую зависимость от количества растворенного вещества в растворе. Это означает, что по мере увеличения количества растворенного вещества в растворе будет увеличиваться и молярность.
При повышении температуры молярность уменьшается. Точно так же, когда объем раствора увеличивается, молярность уменьшается. Молярность раствора также зависит от растворимости растворенного вещества, и если к раствору добавляются какие-либо дополнительные вещества, молярность имеет прямую зависимость от количества растворенного вещества в растворе. Это означает, что по мере увеличения количества растворенного вещества в растворе будет увеличиваться и молярность.
Другие значения молярности:
Десятичный — \[\frac {M} {10}\]=0,1 M
Полумолярный: \[\frac {M} {2}\]=0,5 M
Пентимолярный: \[\frac {M} {5}\]=0,2 M
Сантимоляр: \[\frac {M} {100}\]=0,01 M
Миллимоляр: \[\frac {M} {1000}\] =0,001 М
Связь между нормальностью и молярностью
Существует очень тесная связь между молярностью и нормальностью. Нормальность можно описать как кратность молярности. В то время как молярность относится к концентрации соединения или иона в растворе, нормальность относится к молярной концентрации только кислотного компонента или только основного компонента раствора.
В то время как молярность относится к концентрации соединения или иона в растворе, нормальность относится к молярной концентрации только кислотного компонента или только основного компонента раствора.
Таким образом, нормальность предлагает более глубокое понимание концентрации раствора в кислотно-основных реакциях. Одно из основных различий между нормальностью и молярностью раствора заключается в том, что нормальность описывает количество грамм-эквивалента соединения, присутствующего в растворе, а молярность описывает количество молей, присутствующих в растворе.
Пример зависимости нормальности от молярности в растворе
1 н. кислый раствор H 2 SO 4 нейтрализует эквивалентное количество 1 н. основного раствора NaOH. При расчете N для этой реакции учитывается тот факт, что H 2 SO 4 дает 2 (кислотных) иона H + на молекулу, в то время как NaOH дает только 1 (основной) ион OH — на молекулу.
