|
Random converter |
Конвертер молярной концентрацииКонвертер длины и расстоянияКонвертер массыКонвертер мер объема сыпучих продуктов и продуктов питанияКонвертер площадиКонвертер объема и единиц измерения в кулинарных рецептахКонвертер температурыКонвертер давления, механического напряжения, модуля ЮнгаКонвертер энергии и работыКонвертер мощностиКонвертер силыКонвертер времениКонвертер линейной скоростиПлоский уголКонвертер тепловой эффективности и топливной экономичностиКонвертер чисел в различных системах счисления.Конвертер единиц измерения количества информацииКурсы валютРазмеры женской одежды и обувиРазмеры мужской одежды и обувиКонвертер угловой скорости и частоты вращенияКонвертер ускоренияКонвертер углового ускоренияКонвертер плотностиКонвертер удельного объемаКонвертер момента инерцииКонвертер момента силыИмпульс (количество движения)Импульс силыКонвертер вращающего моментаКонвертер удельной теплоты сгорания (по массе)Конвертер плотности энергии и удельной теплоты сгорания топлива (по объему)Конвертер разности температурКонвертер коэффициента теплового расширенияКонвертер термического сопротивленияКонвертер удельной теплопроводностиКонвертер удельной теплоёмкостиКонвертер энергетической экспозиции и мощности теплового излученияКонвертер плотности теплового потокаКонвертер коэффициента теплоотдачиКонвертер объёмного расходаКонвертер массового расходаКонвертер молярного расходаКонвертер плотности потока массыКонвертер молярной концентрацииКонвертер массовой концентрации в раствореКонвертер динамической (абсолютной) вязкостиКонвертер кинематической вязкостиКонвертер поверхностного натяженияКонвертер паропроницаемостиКонвертер плотности потока водяного параКонвертер уровня звукаКонвертер чувствительности микрофоновКонвертер уровня звукового давления (SPL)Конвертер уровня звукового давления с возможностью выбора опорного давленияКонвертер яркостиКонвертер силы светаКонвертер освещённостиКонвертер разрешения в компьютерной графикеКонвертер частоты и длины волныОптическая сила в диоптриях и фокусное расстояниеОптическая сила в диоптриях и увеличение линзы (×)Конвертер электрического зарядаКонвертер линейной плотности зарядаКонвертер поверхностной плотности зарядаКонвертер объемной плотности зарядаКонвертер электрического токаКонвертер линейной плотности токаКонвертер поверхностной плотности токаКонвертер напряжённости электрического поляКонвертер электростатического потенциала и напряженияКонвертер электрического сопротивленияКонвертер удельного электрического сопротивленияКонвертер электрической проводимостиКонвертер удельной электрической проводимостиЭлектрическая емкостьКонвертер индуктивностиКонвертер реактивной мощностиКонвертер Американского калибра проводовУровни в dBm (дБм или дБмВт), dBV (дБВ), ваттах и др. Исходная величина моль на метр³моль на литрмоль на сантиметр³моль на миллиметр³киломоль на метр³киломоль на литркиломоль на сантиметр³киломоль на миллиметр³миллимоль на метр³миллимоль на литрмиллимоль на сантиметр³миллимоль на миллиметр³моль на куб. дециметрмолярныймиллимолярныймикромолярныйнаномолярныйПикомолярныйФемтомолярныйАттомолярныйзептомолярныййоктомолярный Преобразованная величина моль на метр³моль на литрмоль на сантиметр³моль на миллиметр³киломоль на метр³киломоль на литркиломоль на сантиметр³киломоль на миллиметр³миллимоль на метр³миллимоль на литрмиллимоль на сантиметр³миллимоль на миллиметр³моль на куб. Работа и заказыВы можете бесплатно разместить заказы на перевод или информацию о вакансиях на нашей доске объявлений о работах для переводчиков! Общие сведения Факторы, влияющие на молярную концентрацию Единицы Как найти молярную концентрацию Примеры Применение В фармацевтике Общие сведенияОдин моль углерода — это количество вещества, в котором содержится такое же число атомов как в 12 граммах углерода-12, то есть 6×10²³ атомов. Концентрацию раствора можно измерять разными способами, например как отношение массы растворенного вещества к общему объему раствора. В этой статье мы рассмотрим молярную концентрацию, которую измеряют как отношение между количеством вещества в молях к общему объему раствора. В нашем случае вещество — это растворимое вещество, а объем мы измеряем для всего раствора, даже если в нем растворены другие вещества. Использовать моли удобно в случае, если мы работаем с количеством вещества настолько малым, что его количество легко можно измерить домашними или промышленными приборами. Иначе пришлось бы работать с очень большими числами, что неудобно, или с очень маленьким весом или объемом, которые трудно найти без специализированного лабораторного оборудования. Чаще всего при работе с молями используют атомы, хотя возможно использовать и другие частицы, например молекулы или электроны. Следует помнить, что если используются не атомы, то необходимо это указать. Иногда молярную концентрацию также называют молярностью. Следует не путать молярность с моляльностью. Вес одного моля разных веществ. Его можно найти с помощью таблицы Менделеева. Факторы, влияющие на молярную концентрациюМолярная концентрация зависит от температуры, хотя эта зависимость сильнее для одних и слабее для других растворов, в зависимости от того, какие вещества в них растворены. Некоторые растворители при повышении температуры расширяются. В этом случае, если растворенные в этих растворителях вещества не расширяются вместе с растворителем, то молярная концентрация всего раствора понижается. С другой стороны, в некоторых случаях с повышением температуры растворитель испаряется, а количество растворимого вещества не меняется — в этом случае концентрация раствора увеличится. ЕдиницыМолярную концентрацию измеряют в молях на единицу объема, например молях на литр или молях на кубический метр. Моли на кубический метр — это единица СИ. Молярность можно также измерять, используя и другие единицы объема. Как найти молярную концентрациюЧтобы найти молярную концентрацию необходимо знать количество и объем вещества. Количество вещества можно вычислить, используя химическую формулу этого вещества и информацию об общей массе этого вещества в растворе. То есть, чтобы узнать количество раствора в молях, узнаем из таблицы Менделеева атомную массу каждого атома в растворе, а потом разделим общую массу вещества на общую атомную массу атомов в молекуле. Перед тем, как складывать вместе атомную массу следует убедиться, что мы умножили массу каждого атома на количество атомов в молекуле, которую мы рассматриваем. Можно производить вычисления и в обратном порядке. Если известна молярная концентрация раствора и формула растворимого вещества, то можно узнать количество растворителя в растворе, в молях и граммах. ПримерыНайдем молярность раствора из 20 литров воды и 3-х столовых ложек соды. В одной столовой ложке — примерно 17 грамм, а в трех — 51 грамм. Сода — это гидрокарбонат натрия, формула которого — NaHCO₃. В этом примере мы будем использовать атомы для вычисления молярности, поэтому найдем атомную массу составляющих натрия (Na), водорода (H), углерода (C) и кислорода (O). Na: 22.989769 Молярная концентрация 1 кубика сахара в чашке чая равна 0,049 моля на литр. Так как кислород в формуле — O₃, то необходимо умножить атомную массу кислорода на 3. Получим 47,9982. Теперь сложим массы всех атомов и получим 84,006609. Атомную массу указывают в таблице Менделеева в атомных единицах массы, или а. е. м. Наши вычисления тоже в этих единицах. Получается, что наш раствор — это 0,6 моля соды, растворенные в 20 литрах воды. Разделим это количество соды на общий объем раствора, то есть 0,6 моля / 20 л = 0.03 моль/л. Так как в растворе использовали большое количество растворителя и малое количество растворимого вещества, то его концентрация мала. Рассмотрим другой пример. Найдем молярную концентрацию одного кусочка сахара в чашке чая. Столовый сахар состоит из сахарозы. Сначала найдем вес одного моля сахарозы, формула которой — C₁₂H₂₂O₁₁. Используя таблицу Менделеева, найдем атомные массы и определим массу одного моля сахарозы: 12×12 + 22×1 + 11×16 = 342 грамм. В одном кубике сахара 4 грамма, что дает нам 4/342 = 0,01 молей. В одной чашке около 237 миллилитров чая, значит концентрация сахара в одной чашке чая равна 0,01 моля / 237 миллилитров × 1000 (чтобы перевести миллилитры в литры) = 0,049 моля на литр.
ПрименениеВ стехиометрии определяют количество веществ, которые взаимодействуют друг с другом в химической реакции, а также количество веществ, полученных в результате этой реакции. Молярная концентрация удобна: при одинаковой температуре и давлении один моль разных газов занимает одинаковый объем, и это свойство можно использовать в разных вычислениях. Молярную концентрацию широко используют в вычислениях, связанных с химическими реакциями. Раздел химии, в котором рассчитывают соотношения между веществами в химических реакциях и часто работают с молями, называется стехиометрией. Молярную концентрацию можно найти по химической формуле конечного продукта, который потом становится растворимым веществом, как в примере с раствором соды, но можно также вначале найти это вещество по формулам химической реакции, во время которой оно образуется. Для этого нужно знать формулы веществ, участвующих в этой химической реакции. Решив уравнение химической реакции, узнаем формулу молекулы растворяемого вещества, а потом найдем массу молекулы и молярную концентрацию с помощью таблицы Менделеева, как в примерах выше. Когда нам известны вещества, которые вступают в химическую реакцию друг с другом, мы можем узнать формулу, решив уравнение для химической реакции. Добавив полученное в этой реакции вещество в раствор, можно найти молярную концентрацию, как в предыдущих примерах. Рассмотрим простой пример. На этот раз смешаем соду с уксусом, чтобы увидеть интересную химическую реакцию. И уксус, и соду легко найти — наверняка они есть у вас на кухне. Как уже упоминалось выше, формула соды — NaHCO₃. Уксус — это не чистое вещество, а 5% раствор уксусной кислоты в воде. Формула уксусной кислоты — CH₃COOH. Концентрация уксусной кислоты в уксусе может быть больше или меньше 5%, в зависимости от производителя и страны, в которой она сделана, так как в разных странах концентрация уксуса разная. В этом эксперименте можно не беспокоиться о химических реакциях воды с другими веществами, так как вода не реагирует с содой. Вначале решим уравнение для химической реакции между содой и уксусной кислотой: NaHCO₃ + CH₃COOH → NaC₂H₃O₂ + H₂CO₃ Продукт реакции — H₂CO₃, вещество, которое из-за низкой стабильности снова вступает в химическую реакцию. H₂CO₃ → H₂O + CO₂ В результате реакции получаем воду (H₂O), углекислый газ (CO₂) и ацетат натрия (NaC₂H₃O₂). Смешаем полученный ацетат натрия с водой и найдем молярную концентрацию этого раствора, так же, как перед этим мы находили концентрацию сахара в чае и концентрацию соды в воде. При вычислении объема воды необходимо учитывать и воду, в которой растворена уксусная кислота. Ацетат натрия — интересное вещество. Его используют в химических грелках, например в грелках для рук. Используя стехиометрию для вычисления количества веществ, вступающих в химическую реакцию, или продуктов реакции, для которых мы позже будем находить молярную концентрацию, следует заметить, что только ограниченное количество вещества может вступать в реакцию с другими веществами. При использовании рецептов, будь то в кулинарии, в изготовлении лекарств, или при создании идеальной среды для аквариумных рыбок, необходимо знать концентрацию. В повседневной жизни чаще всего удобнее использовать граммы, но в фармацевтике и химии чаще используют молярную концентрацию. При изготовлении лекарств, которые контактируют с мембранами в организме, например при изготовлении глазных капель, необходимо уравновесить осмотическую концентрацию лекарства с концентрацией жидкости в организме. Если этого не сделать, то из-за разницы в осмотической концентрации жидкость начнет передвигаться через мембрану, что может вызвать осложнения. В фармацевтикеПри создании лекарств молярная концентрация очень важна, так как от нее зависит, как лекарство влияет на организм. Пациент получает лекарство методом внутривенного вливания из капельницы. Стоит заметить, что в некоторых случаях молярная и осмотическая концентрация равны, но это не всегда так. Это зависит от того, распалось ли растворенное в воде вещество на ионы в процессе электролитической диссоциации. Вычисляя осмотическую концентрацию, учитывают частицы в общем, в то время как при вычислении молярной концентрации учитывают только определенные частицы, например молекулы. Поэтому если, например, мы работаем с молекулами, но вещество распалось на ионы, то молекул будет меньше общего числа частиц (включая и молекулы и ионы), и значит и молярная концентрация будет ниже осмотической. В изготовлении лекарственных препаратов фармацевты также учитывают тоничность раствора. Тоничность — свойство раствора, которое зависит от концентрации. В отличие от осмотической концентрации, тоничность — это концентрация веществ, которые не пропускает мембрана. Процесс осмоса заставляет растворы с большей концентрацией перемещаться в растворы с меньшей концентрацией, но если мембрана предотвращает это движение, не пропуская через себя раствор, то возникает давление на мембрану. Такое давление обычно проблематично. Если лекарство предназначено для того, чтобы проникнуть в кровь или другую жидкость в организме, то необходимо уравновесить тоничность этого лекарства с тоничностью жидкости в организме, чтобы избежать осмотического давления на мембраны в организме. Чтобы уравновесить тоничность, лекарственные препараты нередко растворяют в изотоническом растворе. Изотонический раствор — это раствор столовой соли (NaCL) в воде с такой концентрацией, которая позволяет уравновесить тоничность жидкости в организме и тоничность смеси этого раствора и лекарства. Литература Автор статьи: Kateryna Yuri Вас могут заинтересовать и другие конвертеры из группы «Гидравлика и гидромеханика — жидкости»:Конвертер объёмного расхода Конвертер массового расхода Конвертер молярного расхода Конвертер плотности потока массы Конвертер массовой концентрации в растворе Конвертер динамической (абсолютной) вязкости Конвертер кинематической вязкости Конвертер поверхностного натяжения Конвертер паропроницаемости Конвертер массы Конвертер удельного объема Конвертер объема и единиц измерения в кулинарных рецептах Компактный калькулятор Полный калькулятор Определения единиц Вы затрудняетесь в переводе единицы измерения с одного языка на другой? Коллеги готовы вам помочь. Опубликуйте вопрос в TCTerms и в течение нескольких минут вы получите ответ. |
Перевод из грамм в число моль и из числа моль в граммы
УчебаХимия
Калькулятор выполняет перевод из массы вещества, заданной в граммах, в количество вещества в молях и обратно.
Для задач по химии бывает нужно перевести массу вещества в граммах в количество вещества в молях и обратно.
Решается это через простое соотношение:
,
где — масса вещества в граммах, — количество вещества в молях, — молярная масса вещества в грамм/моль
Калькулятор ниже автоматически вычисляет молярную массу по формуле вещества и рассчитывает массу вещества в граммах или количество вещества в молях, в зависимости от выбора пользователя. Для справки также выводится молярная масса соединения и детали ее расчета
Химические элементы следует писать так, как они написаны в таблице Менделеева, т. е. учитывать большие и маленькие буквы. Например Co — кобальт, CO — моноксид углерода, угарный газ. Таким образом, Na3PO4 — правильно, na3po4, NA3PO4 — неправильно.
Перевод из грамм в число молей и из числа молей в граммы
Формула соединения
Перевести
граммы в моли
моли в граммы
Масса вещества, грамм
Количество вещества, моль
Точность вычисления
Знаков после запятой: 3
Масса вещества в граммах
Количество вещества в молях
Молярная масса соединения
Детали расчета молярной массы
Молярная масса — характеристика вещества, отношение массы вещества к количеству молей этого вещества, то есть масса одного моля вещества. Для отдельных химических элементов молярной массой является масса одного моля отдельных атомов этого элемента, то есть масса атомов вещества взятых в количестве равном числу Авогадро (собственно, число Авогадро — это число атомов углерода-12 в 12 граммах углерода-12). Таким образом молярная масса элемента, выраженная в г/моль, численно совпадает с молекулярной массой — массой атома элемента, выраженной в а. е. м. (атомная единица массы). А молярные массы сложных молекул (химических соединений) можно определить, суммируя молярные массы входящих в них элементов.
Таким образом молярная масса элемента, выраженная в г/моль, численно совпадает с молекулярной массой — массой атома элемента, выраженной в а. е. м. (атомная единица массы). А молярные массы сложных молекул (химических соединений) можно определить, суммируя молярные массы входящих в них элементов.
И, собственно, самым сложным моментом в расчете является определение молярной массы химического соединения.
К счастью, на нашем сайте уже есть калькулятор Молярная масса соединений, который подсчитывает молярную массу химических соединений, основываясь на данных по атомной массе из справочника Таблица Менделеева. Он и используется, чтобы получить молярную массу по введенной формуле химического соединения в калькуляторе.
Теперь небольшое отступление. При написании этого текста у меня возник вопрос — как правильно писать с точки зрения русского языка: перевод молей в литры или перевод моль в литры.
Согласно викисловарю, слово моль склоняется, т.е. моль, моля, молю, моль, молем, моле в единственном числе, и моли, молей, молям, моли, молями, молях во множественном числе.
При этом согласно Методическому указанию от 1979 года Государственного комитета СССР по стандартам, «Обозначение единиц, совпадающих с наименованиями этих единиц, по падежам и числам изменять не следует, если они помещены после числовых значений, а также в заголовках граф, боковиков таблиц и выводов, в пояснениях обозначений величин к формулам. К таким обозначениям относятся: бар, бэр, вар, моль, рад. Следует писать 1 моль, 2 моль, 5 моль и т.д. Исключение составляет обозначение «св.год», которое изменяется следующим образом: 1 св.год, 2,3,4 св.года, 5 св.лет.»
Таким образом получается что «перевод молей в литры» — правильно, а «перевод моль в литры» — неправильно, но «5 моль» — правильно, «5 молей» — неправильно.
Ссылка скопирована в буфер обмена
Похожие калькуляторы
- • Молярная масса соединений
- • Перевод литров газа в граммы и наоборот
- • Перевод молей в литры и литров в моли
- • Уравнение Клапейрона-Менделеева. Связь между числом молей газа, его температурой, объемом и давлением.

- • Перевод из золотников в граммы и обратно
- • Раздел: Химия ( 16 калькуляторов )
#моль #химия грамм граммы моли моль молярная масса таблица Менделеева Химия элементы
PLANETCALC, Перевод из грамм в число моль и из числа моль в граммы
Timur2020-11-03 14:19:34
Формулавесовых процентов | Как перевести весовые проценты в мольные доли
1 Комментарий / К физикакатализатор / 17 февраля 2019 г.
В этом посте мы рассмотрим, что такое массовые проценты или массовые проценты, что такое массовые проценты или массовые проценты, как преобразовать массовых процентов в мольные доли
Массовые проценты или массовые проценты определяется как масса растворенного вещества в 100 г раствора
$Вес\; процент = \ гидроразрыв {масса \; из \; \; растворенный {масса \; из \; \; решение} \times 100$
Итак, если m — масса растворенного вещества, а M — масса растворителя, то формула процента веса будет
$Вес \; процент= \frac {m}{m+M} \times 100$
Обычно дается как 30% раствор NaCL по весу или 50% раствор HCL по весу
Пример весовых процентов
1. Раствор получают добавлением 3 г вещества А к 17 г воды. Рассчитайте массовую долю растворенного вещества.
Раствор получают добавлением 3 г вещества А к 17 г воды. Рассчитайте массовую долю растворенного вещества.
Решение
$Вес \; процент = \ гидроразрыв {масса \; из \; \; растворенный {масса \; из \; \; решение} \times 100$
$=\frac {3}{3+17} \times 100$
=15%
2. Сколько граммов 5,0%-ного по массе раствора NaCL требуется на 6,4 г NaCL?
Раствор
5% растворы NaCL содержат 5 г NaCL в 100 г раствора
Таким образом, 1 г NaCL будет содержаться в = 100/5 = 20 г раствора
Следовательно, 6,4 г NaCL будет присутствовать в = 20 X 6,4 = 128 г раствора
Альтернативный метод
Вес $\; процент = \ гидроразрыв {масса \; из \; \; растворенный {масса \; из \; \; решение} \times 100$
$5= \frac {6.4}{x} \times 100$
или x = 128 г
Как преобразовать проценты веса в мольные доли
Теперь, если известен процент веса раствора, мы можем рассчитать мольную долю раствора или растворителя легко объяснить в приведенном ниже примере
Пример
Рассчитайте мольную долю HCl и H 2 O в растворе кислоты HCL в воде, содержащем 20% HCl по массе.
Решение
Раствор содержит 20 граммов соляной кислоты и 80 граммов воды. Кроме того,
Молярная масса HCl составляет 36,5 г/моль.
Молярная масса воды 18 г/моль.
моль HCl = 20/36,5 = 0,547 моль HCl
моль воды = 80/18 = 4,44 моль H3O.
$ Моль\; Доля \; из \; растворенное вещество = \ гидроразрыва {нет \; из \; родинки \; из \; раствор {нет \; из \; родинки \; из \; раствор + нет \; из \; родинки \; из \; растворитель}$
$Моль\; доля \; из \; HCl = \ frac {0,547} {0,547 + 4,44} = 0,109$
$Мольная доля h3O = \frac {4,44}{,547 + 4,44} = 0,891$
Итак, вкратце, необходимо выполнить следующие шаги:
- Найдите вес растворенного вещества и растворителя из весовых процентов. или массовых процентов
- Найдите массу молекул растворенного вещества и растворителя
- Рассчитайте количество молей растворенного вещества и растворителя, используя вес и молекулярную массу
- Примените формулу мольной доли, чтобы получить мольную долю
Практические вопросы
- Найти массовую долю, если 10 г X растворить в 80 г Y?
- Рассчитайте мольную долю HCl и H 2 O в растворе кислоты HCL в воде, содержащей 10 % HCl по весу.

- Периодическая таблица элементов
- Калькулятор
Молярные доли всех веществ в смеси должны составлять до 100 процентов.

Определите массу всех химических соединений в смеси. Если смесь уже приготовлена, необходимо указать эту информацию. Если вы готовите смесь самостоятельно, запишите массу каждого вещества в граммах. Например, рассмотрим раствор, приготовленный путем соединения 10 граммов хлорида натрия (NaCl) и 100 миллилитров или 100 граммов воды (h3O). Если смесь готовится с использованием неметрических единиц измерения, таких как унции, переведите ее в единицы граммов с помощью онлайн-калькулятора.
Рассчитайте формульные веса или молекулярные массы всех компонентов смеси, умножив количество атомов каждого типа в формуле на соответствующий атомный вес. Проверьте периодическую таблицу элементов на атомный вес. Например, NaCl содержит один атом натрия и один атом хлорида с атомным весом 22,99 и 35,45 соответственно.
Поэтому вес формулы NaCl равен (1 х 22,99) + (1 х 35,45) = 58,44. h3O содержит один атом водорода и один атом кислорода с атомным весом 1,01 и 16,00 соответственно. Это дает воде молекулярную массу (2 х 1,01) + (1 х 16,00) = 18,02.
Определите количество молей каждого вещества, разделив его массу в граммах на его формулу или молекулярную массу. В этом случае 10 граммов NaCl представляют собой 10 ÷ 58,44 = 0,171 моля NaCl, а 100 граммов воды представляют собой 100 ÷ 18,02 = 5,55 моля H3O.
Рассчитайте мольный процент одного из компонентов, разделив его количество молей на общее количество молей всех веществ и умножив результат на 100. В случае 0,171 моль NaCl и 5,55 моль H3O, молярная доля NaCl становится 0,171 ÷ (0,171 + 5,55) x 100 = 2,99 процентов. Мольная доля воды становится 5,55 ÷ (5,55 + 0,171) = 97,01 процента.
Вещи, которые вам понадобятся


 дециметрмолярныймиллимолярныймикромолярныйнаномолярныйПикомолярныйФемтомолярныйАттомолярныйзептомолярныййоктомолярный
дециметрмолярныймиллимолярныймикромолярныйнаномолярныйПикомолярныйФемтомолярныйАттомолярныйзептомолярныййоктомолярный Количество вещества — это число элементарных составляющих, например атомов или молекул вещества. Так как даже в малом количестве вещества обычно большое число элементарных составляющих, то для измерения количества вещества используют специальные единицы, моли. Один моль равен числу атомов в 12 г углерода-12, то есть это приблизительно 6×10²³ атомов.
Количество вещества — это число элементарных составляющих, например атомов или молекул вещества. Так как даже в малом количестве вещества обычно большое число элементарных составляющих, то для измерения количества вещества используют специальные единицы, моли. Один моль равен числу атомов в 12 г углерода-12, то есть это приблизительно 6×10²³ атомов. В отличии от молярности, моляльность — это отношение количества растворимого вещества к массе растворителя, а не к массе всего раствора. Когда растворитель — вода, а количество растворимого вещества по сравнению с количеством воды мало, то молярность и моляльность похожи по значению, но в остальных случаях они обычно отличаются.
В отличии от молярности, моляльность — это отношение количества растворимого вещества к массе растворителя, а не к массе всего раствора. Когда растворитель — вода, а количество растворимого вещества по сравнению с количеством воды мало, то молярность и моляльность похожи по значению, но в остальных случаях они обычно отличаются. Иногда происходит наоборот. Иногда изменение температуры влияет на то, как растворяется растворимое вещество. Например, часть или все растворимое вещество перестает растворяться, и концентрация раствора уменьшается.
Иногда происходит наоборот. Иногда изменение температуры влияет на то, как растворяется растворимое вещество. Например, часть или все растворимое вещество перестает растворяться, и концентрация раствора уменьшается.
 Одна а. е. м. равна массе одного моля вещества в граммах. То есть, в нашем примере — масса одного моля NaHCO₃ равна 84,006609 грамма. В нашей задаче — 51 грамм соды. Найдем молярную массу, разделив 51 грамм на массу одного моля, то есть на 84 грамма, и получим 0,6 моля.
Одна а. е. м. равна массе одного моля вещества в граммах. То есть, в нашем примере — масса одного моля NaHCO₃ равна 84,006609 грамма. В нашей задаче — 51 грамм соды. Найдем молярную массу, разделив 51 грамм на массу одного моля, то есть на 84 грамма, и получим 0,6 моля.
 Конечно, можно производить вычисления и в обратном порядке, используя информацию о молярной концентрации вещества.
Конечно, можно производить вычисления и в обратном порядке, используя информацию о молярной концентрации вещества. Нам важен только объем воды, когда позже мы будем вычислять концентрацию раствора.
Нам важен только объем воды, когда позже мы будем вычислять концентрацию раствора. Это также влияет на количество конечного продукта. Если молярная концентрация известна, то, наоборот, можно определить количество исходных продуктов методом обратного расчета. Этот метод нередко используют на практике, при расчетах, связанных с химическими реакциями.
Это также влияет на количество конечного продукта. Если молярная концентрация известна, то, наоборот, можно определить количество исходных продуктов методом обратного расчета. Этот метод нередко используют на практике, при расчетах, связанных с химическими реакциями. Если концентрация слишком высока, то лекарства могут быть даже смертельны. С другой стороны, если концентрация слишком мала, то лекарство неэффективно. Кроме этого, концентрация важна при обмене жидкостей через клеточные мембраны в организме. При определении концентрации жидкости, которая должна либо проходить, либо, наоборот, не проходить через мембраны, используют либо молярную концентрацию, либо с ее помощью находят осмотическую концентрацию. Осмотическую концентрацию используют чаще, чем молярную. Если концентрация вещества, например лекарства, выше с одной стороны мембраны, по сравнению с концентрацией с другой стороны мембраны, например, внутри глаза, то более концентрированный раствор переместится через мембрану туда, где концентрация меньше. Такой поток раствора через мембрану нередко проблематичен. Например, если жидкость перемещается внутрь клетки, к примеру, в кровеносную клетку, то возможно, что из-за этого переполнения жидкостью мембрана будет повреждена и разорвется.
Если концентрация слишком высока, то лекарства могут быть даже смертельны. С другой стороны, если концентрация слишком мала, то лекарство неэффективно. Кроме этого, концентрация важна при обмене жидкостей через клеточные мембраны в организме. При определении концентрации жидкости, которая должна либо проходить, либо, наоборот, не проходить через мембраны, используют либо молярную концентрацию, либо с ее помощью находят осмотическую концентрацию. Осмотическую концентрацию используют чаще, чем молярную. Если концентрация вещества, например лекарства, выше с одной стороны мембраны, по сравнению с концентрацией с другой стороны мембраны, например, внутри глаза, то более концентрированный раствор переместится через мембрану туда, где концентрация меньше. Такой поток раствора через мембрану нередко проблематичен. Например, если жидкость перемещается внутрь клетки, к примеру, в кровеносную клетку, то возможно, что из-за этого переполнения жидкостью мембрана будет повреждена и разорвется. Утечка жидкости из клетки тоже проблематична, так как из-за этого нарушится работоспособность клетки. Любое вызванное медикаментами течение жидкости через мембрану из клетки или в клетку желательно предотвратить, и для этого концентрацию лекарства стараются сделать похожей на концентрацию жидкости в организме, например в крови.
Утечка жидкости из клетки тоже проблематична, так как из-за этого нарушится работоспособность клетки. Любое вызванное медикаментами течение жидкости через мембрану из клетки или в клетку желательно предотвратить, и для этого концентрацию лекарства стараются сделать похожей на концентрацию жидкости в организме, например в крови.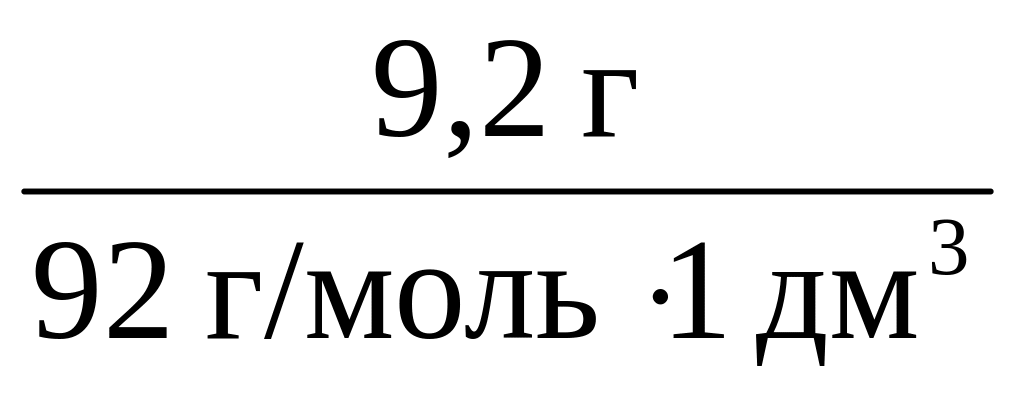 Чтобы перевести молярную концентрацию в осмотическую, нужно знать физические свойства раствора.
Чтобы перевести молярную концентрацию в осмотическую, нужно знать физические свойства раствора. Обычно изотонический раствор хранят в стерильных контейнерах, и вливают его внутривенно. Иногда его используют в чистом виде, а иногда — как смесь с лекарством.
Обычно изотонический раствор хранят в стерильных контейнерах, и вливают его внутривенно. Иногда его используют в чистом виде, а иногда — как смесь с лекарством.
 В Международной системе единиц (СИ) измеряется в моль/м³.
В Международной системе единиц (СИ) измеряется в моль/м³. Конвертеры пригодятся инженерам, переводчикам и всем, кто работает с разными единицами измерения.
Конвертеры пригодятся инженерам, переводчикам и всем, кто работает с разными единицами измерения. », то есть «…умножить на десять в степени…». Компьютерная экспоненциальная запись широко используется в научных, математических и инженерных расчетах.
», то есть «…умножить на десять в степени…». Компьютерная экспоненциальная запись широко используется в научных, математических и инженерных расчетах. com на YouTube
com на YouTube


