Поташ — это… Формула и применение поташа
Поташ — это… Формула и применение поташа
Калий — неофициальное название вещества, которое химики называют карбонатом калия. Эта соль была известна людям с древних времен, поскольку она содержится в золе. Раньше этим словом называли именно сухой остаток после испарения раствора продуктов сгорания растений. Итак, что сейчас известно о калии?
Содержание
- 1 Формула
- 2 История открытия и изучения
- 3 Химические и физические свойства
- 4 Разновидности и формы
- 5 Добыча
- 6 Обработка
- 7 Использование
- 8 Другие особенности
Формула
Другое название этого вещества — карбонат калия. И его химическая формула записывается так: K2CO3. Это средняя соль калия и угольной кислоты. Это означает, что раствор калия не является кислым или основным, он нейтрален. Его долгое время путали с бикарбонатом натрия — NaHCO3.
Это средняя соль калия и угольной кислоты. Это означает, что раствор калия не является кислым или основным, он нейтрален. Его долгое время путали с бикарбонатом натрия — NaHCO3.
История открытия и изучения
Конечно, мы не знаем наверняка, кто первым получил калий, потому что он был известен еще в Древней Греции и Риме. Затем его отделили от золы и использовали для промывки. Любопытно, что его долгое время путали с другим веществом — бикарбонатом калия. Есть знакомые бикарбонат натрия, калий — вместе их называли просто щелочными или щелочными солями. Они начали выделяться в 18-19 веках. Впервые об этом стало известно в 1759 году, когда Андреас Маргграф установил, что сода является минеральной щелочью, а поташ — растительной. А в 1807 году Гэмфри Дэви установил химический состав каждого из этих веществ.
Первые известия о производстве калия относятся к XIV веку. Самое крупное из предприятий располагалось в Германии и Скандинавских странах. Карбонат калия использовался на мыловаренных заводах, в текстильной промышленности, в химчистках. В 15 веке к конкурсу присоединилась и Россия. До этого не умели отделить калий от золы, а просто вывозили продукты горения вместе, например, с мехами. Стекольная промышленность как внутри России, так и за рубежом тоже нуждалась в этом веществе. Спрос вырос, как и предложение.
В 15 веке к конкурсу присоединилась и Россия. До этого не умели отделить калий от золы, а просто вывозили продукты горения вместе, например, с мехами. Стекольная промышленность как внутри России, так и за рубежом тоже нуждалась в этом веществе. Спрос вырос, как и предложение.
Кстати, само название «поташ» буквально является ключом к разгадке того, как его получали в древности. Дело в том, что на латыни это звучит как поташ, который, в свою очередь, представляет собой сплав слов «ясень» и «горшок».
Химические и физические свойства
В ходе экспериментов с этим веществом ученые получили информацию о некоторых присущих ему качествах. Сегодня известно, что в нормальных условиях чистый калий представляет собой твердое вещество в виде бесцветных кристаллов или белого порошка. Его плотность 2,43 г / см3. Температура плавления карбоната калия составляет 891 градус Цельсия. Высокая гигроскопичность.
Это вещество не взрывоопасно и не воспламеняется. Вызывает раздражение при контакте с кожей или влажными слизистыми оболочками. Поэтому его относят к третьему классу опасности.
Поэтому его относят к третьему классу опасности.
Разновидности и формы
Есть два типа калия: кальцинированный и полуторный водяной. В отличие от второй, первая форма не содержит воды — в процессе прокаливания она испаряется и удаляется органическое вещество, в результате чего раствор карбоната калия этого типа становится полностью бесцветным.
Кроме того, калий тоже различают разновидностями, их всего три. Качество конечного продукта зависит от содержания примесей, таких как железо, алюминий, хлориды, соли и сульфаты натрия. Кроме того, при присвоении марки учитывается массовая доля осадка, выпавшего в растворе, и потери при прокаливании.
Добыча
Хотя использование калия не происходит в таких масштабах, как в случае с содой, люди по-прежнему активно его используют. Но прежде всего его нужно получить. В небольших количествах это можно делать и в домашних условиях.
В первую очередь нужно сделать доступной вам золу растения. Затем нужно растворить его в определенном количестве горячей воды, хорошо перемешать и немного подождать. Далее нужно приступить к выпариванию раствора калия со смесью органических веществ, в результате чего выпадут кристаллы. Конечно, выделенный таким образом карбонат калия не будет высокого качества, и затраченные усилия будут слишком велики по отношению к количеству. Очевидно, что в промышленных масштабах все иначе.
Далее нужно приступить к выпариванию раствора калия со смесью органических веществ, в результате чего выпадут кристаллы. Конечно, выделенный таким образом карбонат калия не будет высокого качества, и затраченные усилия будут слишком велики по отношению к количеству. Очевидно, что в промышленных масштабах все иначе.
Следовательно, водный раствор карбоната калия взаимодействует с CO2, что приводит к образованию KHCO3. В свою очередь, он нагревается, и выделяются вода и углекислый газ, а остальное — оригинальный калий.
Есть много других способов получить это вещество, но самые простые и эффективные из них описаны выше.
Обработка
Как уже было сказано, существует два вида калия: кальцинированный и полуторный водный. Как карбонат калия обрабатывается для получения определенного сорта?
Во-первых, различаются и их формулы. Полувода выглядит так: K2CO3 + 1.5h3O, то есть изначально содержит воду. Однако он даже более гигроскопичен, чем обычно. Из этой формы можно получить и безводную форму — достаточно нагреть порошок до 130-160 градусов Цельсия.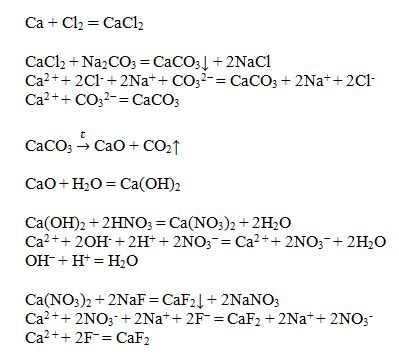
Кальцинированная форма получается при переработке карбоната калия, полученного выпариванием зольного раствора в деревянных чанах. Такого вещества нет он отличается чистотой, поэтому его необходимо прокаливать или прокаливать. После выполнения одной из этих процедур порошок карбоната калия оказывается белого цвета, а его раствор совершенно бесцветным. В этом случае вещество не содержит воды.
Использование
На сегодняшний день калий в различных формах используется в огромном количестве отраслей и для самых разных целей. Например, его превосходная очищающая способность до сих пор используется при производстве жидкого мыла и другой бытовой химии.
Кроме того, калий является антифризной добавкой для строительных растворов. Таким образом, это позволяет смеси быть более устойчивыми к холоду, что позволяет продолжать строительство даже при довольно низких температурах. Его существенное преимущество перед аналогами в том, что он не вызывает коррозии конструкций, а также образования высолов, которые могли сказываются на прочности конструкции.
Карбонат калия по-прежнему используется в высококачественном хрустальном и оптическом стекле. В этом вопросе ему нет замены. Аналогов этому веществу нет, например, при производстве тугоплавкого стекла.
Калий часто входит в состав красок, а в химической промышленности он также используется для поглощения сероводорода из газовых смесей — он справляется с этим намного лучше, чем сода. Этому есть место в фармацевтике: карбонат калия участвует в некоторых реакциях, а местами проявляется как побочное действие. Еще одна область применения — пожаротушение. Именно этим веществом обрабатывают деревянные конструкции, повышая тем самым их огнестойкость.
Удивительно, но калий также является пищевой добавкой. Его код E501, поэтому он относится к классу E. Некоторое время его использовали в кондитерских изделиях, например, при производстве имбирных пряников. В легкой промышленности это вещество также участвует в процессе одевания кожи.
Наконец, есть большие перспективы использования калия в производстве безхлорных калийных удобрений. Зола использовалась в этом качестве долгое время, но в последние десятилетия ее вытеснили промышленные корма. Вероятно, в ближайшем будущем широко известный метод получит широкое распространение и будет наименее вредным по сравнению с используемыми сейчас минеральными удобрениями.
Зола использовалась в этом качестве долгое время, но в последние десятилетия ее вытеснили промышленные корма. Вероятно, в ближайшем будущем широко известный метод получит широкое распространение и будет наименее вредным по сравнению с используемыми сейчас минеральными удобрениями.
Другие особенности
Поскольку калий является чрезвычайно гигроскопичным веществом, его упаковка, хранение и транспортировка проходят в особых условиях. Обычно для упаковки карбоната калия используются пятислойные пакеты. Это единственный способ избежать нежелательного попадания воды в это вещество.
Также неожиданно, несмотря на отличную реакцию с h3O, карбонат калия полностью нерастворим в ацетоне и этаноле.
Поделиться:
- Предыдущая записьВал — это что такое? Значение, происхождение, синонимы
- Следующая записьСажень — это сколько? Сколько саженей в метре и версте
×
Рекомендуем посмотреть
Adblock
detector
Co2 получить nahco3
На изотерме в точке Q в осадке содержится 2 соли, поле кристаллизации которых граничат с изотермой.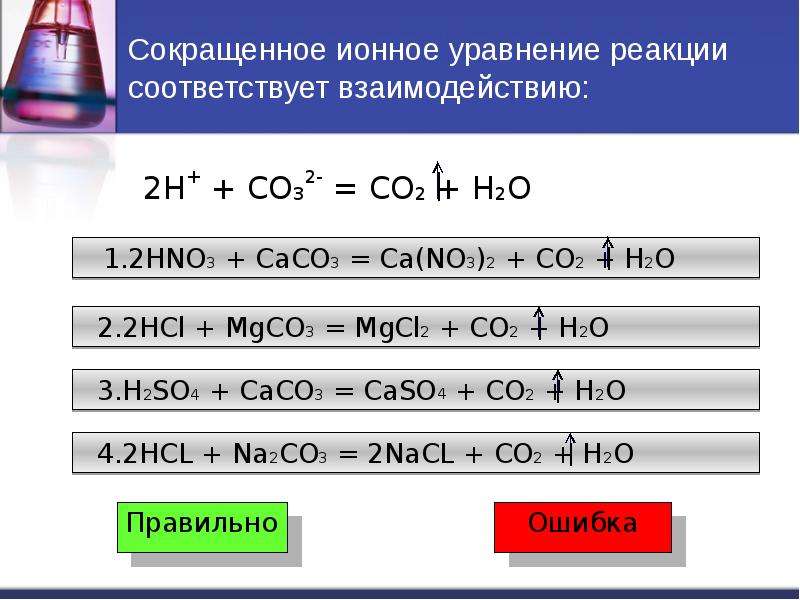 При дальнейшем упаривании кристаллизация идет вдоль линии изотермы до тройной точки Р1 или Р2. Точки, в которых сходятся 3 луча, эвтоническими Линии со знаками 40, 30, 20, 19 — изогидры — количество молей воды на. Максимальный выход соды будет, если взять исходный состав соли в точке а.
При дальнейшем упаривании кристаллизация идет вдоль линии изотермы до тройной точки Р1 или Р2. Точки, в которых сходятся 3 луча, эвтоническими Линии со знаками 40, 30, 20, 19 — изогидры — количество молей воды на. Максимальный выход соды будет, если взять исходный состав соли в точке а.
Поиск данных по Вашему запросу:
Схемы, справочники, даташиты:
Прайс-листы, цены:
Обсуждения, статьи, мануалы:
Дождитесь окончания поиска во всех базах.
По завершению появится ссылка для доступа к найденным материалам.
Содержание:
- Реакция термического разложения гидрокарбоната натрия
- Аммиачный способ получения кальцинированной соды
- Презентация по теме:Углекислый газ.
Угольная кислота и ее соли.
Углекислый газ, угольная кислота и ее соли - Сода пищевая (натрий двууглекислый, бикарбонат натрия, гидрокарбонат натрия)
- Как из c5h30 получить co2. Как получить из co co2
- Учительские университеты
- Вы точно человек?
- Положительное влияние повышения kH на растения: NaHCO3, KHCO3, K2CO3
ПОСМОТРИТЕ ВИДЕО ПО ТЕМЕ: How to Balance Na2CO3 + CO2 + h3O = NaHCO3 (Sodium carbonate + Carbon dioxide + Water)
Реакция термического разложения гидрокарбоната натрия
Реактивы и оборудования: пробирки, стойка для пробирок, пробка с газоотводной трубкой, хим.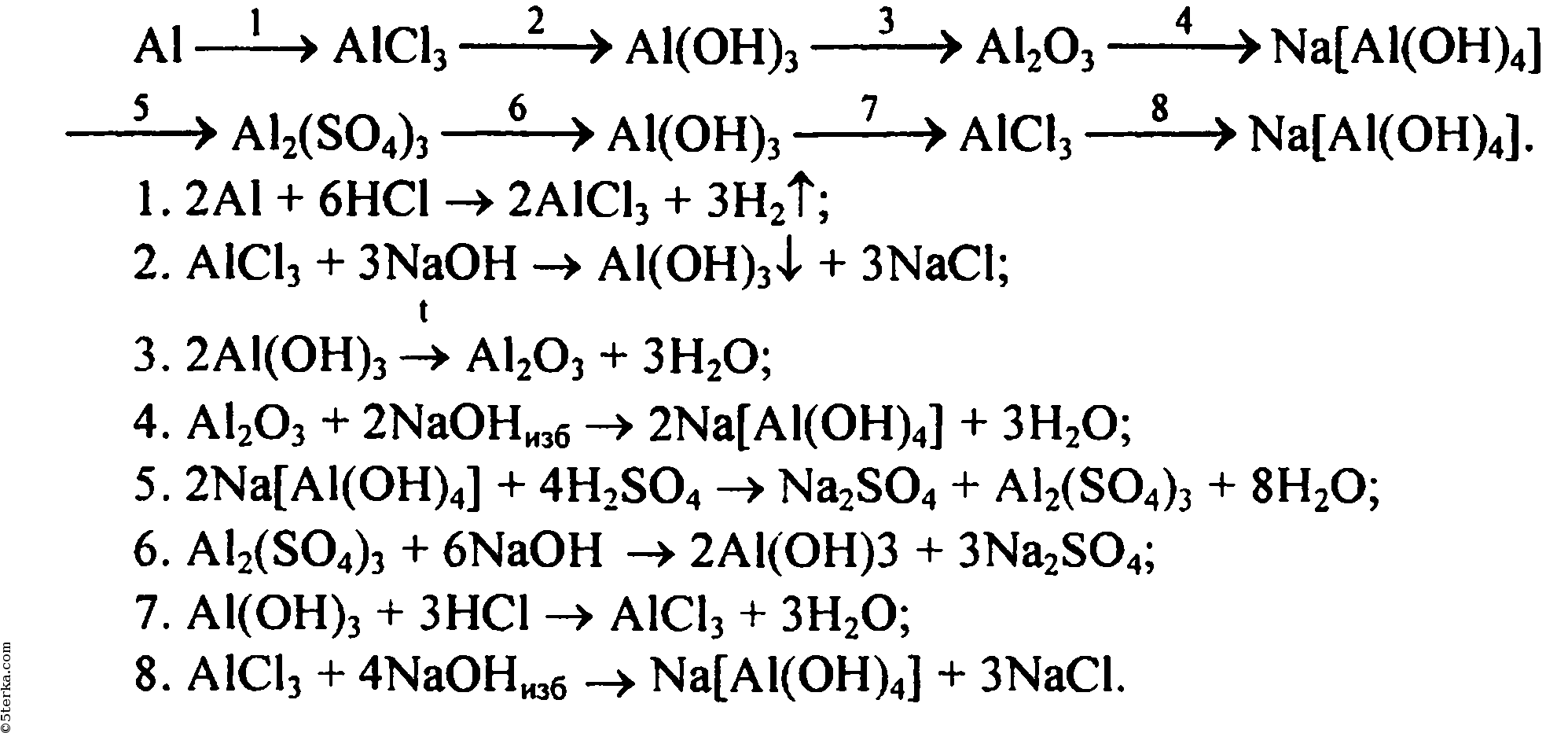
Пробирку закрываем пробкой с газоотводной трубкой, свободный конец которой опускаем в пробирку с известковой водой — Ca OH 2. Что наблюдали? Химия 11 класс ФГОС. Электронная тетрадь по химии 8 класс Химия 10 класс ФГОС. Вводный курс. Электронная тетрадь по химии 9 класс Химия 8 класс.
Химия 9 класс ФГОС. Электронная тетрадь по химии 10 класс Если вы хотите увидеть все свои работы, то вам необходимо войти или зарегистрироваться. Личный сайт учителя. Добавить свою работу. Получение оксида углерода IV и изучение его свойств. Распознавание карбонатов. Пропускаем углекислый газ через дистиллированную воду и добавляем раствор лакмуса. Предмет: Химия Категория: Прочее Целевая аудитория: 9 класс.
Скачать Практическая работа. Бесплатное скачивание файла. Введите Ваш Email. Автор: Шарипова Оксана Николаевна Дата: Пожалуйста, введите ваш Email.
Удобный поиск материалов для учителей. Восстановить пароль Вход Регистрация. Номер свидетельства.
Номер свидетельства.
Аммиачный способ получения кальцинированной соды
Академия сказочных наук. Сайт детских домов Казахстана. Школа-портал учителей Алматы. ТЮЗ им.
2 NaHCO3 + h3SO4 → Na2SO4 + 2 CO2↑ + 2 h3O см3 6% раствора Na2SO4 (плотность раствора 1, г/см3), чтобы получить 1,3 М.
Презентация по теме:Углекислый газ. Угольная кислота и ее соли.
Аммиачный способ получения соды был предложен еще в — английскими инженерами-химиками Г. Грей-Дьюаром и Д. Диоксид углерода CO2, необходимый для проведения процесса, получали из карбоната кальция СаСО3 — мела или известняка — при прокаливании:. Таким образом, аммиак все время находился в обращении и не расходовался, отходом производства оставался только хлорид кальция CaCl2. Эрнест Сольве не внес принципиальных новшеств в химическую основу содового процесса английских инженеров, он только технологически оформил производство, однако, это тоже непросто. В частности, он применил здесь аппараты колонного типа, которые позволили вести процесс непрерывно и достичь высокого выхода продукта. Преимущества аммиачного метода над способом Леблана состояли в получении более чистой соды, меньшем загрязнении окружающей среды и экономии топлива поскольку температура здесь ниже. Все вместе это привело к тому, что в — х закрылись почти все заводы, работавшие по методу Леблана. Первыми в мире заводами, использующими аммиачный способ получения соды, стали бельгийский завод в Куйе, построенный по проекту самого Сольве в , и Камско-Содовый завод Лихачева в России, который начал работать в Российский завод был создан полковником Иваном Лихачевым в его имении на берегу реки Камы в Казанской губернии.
Преимущества аммиачного метода над способом Леблана состояли в получении более чистой соды, меньшем загрязнении окружающей среды и экономии топлива поскольку температура здесь ниже. Все вместе это привело к тому, что в — х закрылись почти все заводы, работавшие по методу Леблана. Первыми в мире заводами, использующими аммиачный способ получения соды, стали бельгийский завод в Куйе, построенный по проекту самого Сольве в , и Камско-Содовый завод Лихачева в России, который начал работать в Российский завод был создан полковником Иваном Лихачевым в его имении на берегу реки Камы в Казанской губернии.
Углекислый газ, угольная кислота и ее соли
Кудрявцев А. Составление химических уравнений — Просвещение , Скачать прямая ссылка : sostavlenhimreakciy Составить уравнения реакций образования гидроокисей скйндия, иттрия и лантана. Как получить нитрат скандия и.
Строение молекулы: Углекислый газ имеет следующие электронную и структурную формулы — Все четыре связи ковалентые полярные. Термическим разложением солей угольной кислоты карбонатов.
Термическим разложением солей угольной кислоты карбонатов.
Сода пищевая (натрий двууглекислый, бикарбонат натрия, гидрокарбонат натрия)
На нашем сайте собрано более бесплатных онлайн калькуляторов по математике, геометрии и физике. Не можете решить контрольную?! Мы поможем! Более 20 авторов выполнят вашу работу от руб! Здесь есть кто-нибудь, кто хорошо разбирается в химии? Охарактеризуйте соединение углекислый газ: укажите его основные физические и химические свойства, а также способы получения.
Как из c5h30 получить co2. Как получить из co co2
Сейчас этот форум просматривают: Google Adsense [Bot] и 3 гостя. Конфиденциальность Правила. Форум химиков Форум химиков Пропустить. Практическое осуществление реакции. Вопросы, связанные с химией вообще. Вы можете задать здесь свой вопрос, и мы постараемся на него ответить.
NaHCO3 + Ch4COOH → Ch4COONa + h3O + CO2↑.(фото) Пиролитический метод получения гидроксида натрия является наиболее.
Учительские университеты
Slideshare uses cookies to improve functionality and performance, and to provide you with relevant advertising. If you continue browsing the site, you agree to the use of cookies on this website. See our User Agreement and Privacy Policy.
If you continue browsing the site, you agree to the use of cookies on this website. See our User Agreement and Privacy Policy.
Вы точно человек?
Реактивы и оборудования: пробирки, стойка для пробирок, пробка с газоотводной трубкой, хим. Что делали? Помещаем в пробирку кусочки мрамора и приливаем HCL. Пробирку закрываем пробкой с газоотводной трубкой, свободный конец которой опускаем в пробирку с известковой водой — Ca OH 2. Что наблюдали? Химия 11 класс ФГОС.
Ваш заказ Отдел продаж: 68 О компании Продукция Крахмалы Кукурузный крахмал Картофельный крахмал Тапиоковый крахмал Модифицированный крахмал Пшеничный крахмал Патоки и сиропы Крахмальная патока сироп глюкозный Мальтозная патока Глюкозно-фруктозный сироп Пищевые ингредиенты Глюкоза кристаллическая пищевая Сода пищевая Желатин пищевой Картофельные хлопья Пшеничная клейковина пшеничный глютен Корма и кормовые добавки Глютен кукурузный Корм кукурузный сухой Кукурузно-фосфатидный концентрат Заказать Доставка Пресс-центр Новости аграрного рынка Рекомендации Глоссарий Контакты.
Положительное влияние повышения kH на растения: NaHCO3, KHCO3, K2CO3
Switch to English регистрация. Телефон или email. Чужой компьютер. Занимательная Химия. Занимательная Химия запись закреплена 26 янв Сода питьевая, кристаллическая, стиральная и каустическая Все эти вещества имеют разный состав, но они образованы одним и тем же элементом, который присутствует в них в виде катиона, — натрием. Питьевая сода представляет собой гидрокарбонат натрия — NaHCO3.
Категории вопросов. Любовные отношения. Семейные отношения.
Microsoft Word — devries_nicholas
%PDF-1.5 % 1 0 объект > эндообъект 5 0 объект > эндообъект 2 0 объект > транслировать PScript5.dll Версия 5.2.22014-05-02T11:56:25-05:002014-05-02T11:56:25-05:00application/pdf
(24a) Улавливание CO2 с помощью раствора карбоната калия/МЭА
Перейти к основному содержанию
- Конференция: Весенняя встреча AIChE и Всемирный конгресс по безопасности процессов
- Год: 2012
- Материалы: 8-я Глобальная весенняя встреча и 8-й Всемирный весенний конгресс 2012 по технологической безопасности
- Группа: 12-я Тематическая конференция по утилизации газа
- Сессия:
Конверсия CO2
- Время:
Понедельник, 2 апреля 2012 г.
 — 13:30-14:00
— 13:30-14:00
Авторы:
Сун Ю. — Ведущий , Департамент энергетики/Netl
Дилмор, Р. – Ведущий , Министерство энергетики США
Хеджес, С. — Ведущий , DOE/NETL США
Allen, D.E. — Presenter , Salem State College
Большое беспокойство было выражено в связи с глобальным изменением климата и его связью с растущими концентрациями углекислого газа в атмосфере. Для уменьшения воздействия антропогенного CO 2 о глобальном климате, в настоящее время разрабатывается несколько стратегий, которые потенциально могут удалить CO 2 из атмосферы или уменьшить выбросы CO 2 . Одна из таких стратегий включает улавливание CO 2 из крупных точечных источников (таких как заводы по производству пылеугольного топлива (ПУ)) и долгосрочное хранение CO 2 под землей. Улавливание CO 2 после сжигания является сложной задачей, поскольку (1) низкое давление и разбавленная концентрация (от 10 до 15 %) диоксида углерода диктуют необходимость обработки большого объема газа и (2) следовые количества примесей в дымовых газах снижают эффективность CO 2 абсорбционные процессы.
В этой области было проведено много исследований, включая разработку жидких сорбентов на основе аминов, твердых сорбентов на основе аминов, сорбентов на основе карбонатов металлов, ионных растворов, химических петель, мембранных систем и других новых технологий. Система водного амина является одной из коммерческих технологий улавливания CO 2 для электростанций с ПК.
Обычно используемый в чистящих растворах амин содержит моноэтаноламин (2-аминоэтанол) (NH 2 CH 2 CH 2 OH) (MEA). К недостаткам использования растворов МЭА относятся энергоемкость, аминовая деградация и коррозионная активность. Типичная реакция проиллюстрирована следующим образом:
2 MEA + H + + HCO 3 — ¬> MEA · H + + MEA · HCO 3 —
Также проводились работы. удаление углекислого газа из дымовых газов. Сообщалось о процессе улавливания диоксида углерода с использованием регенерируемых сорбентов, таких как оксид щелочного металла или карбонат щелочного металла. Карбонат калия (К 2 CO 3 ) можно наносить на активированный оксид алюминия с большой площадью поверхности (Al 2 O 3 ). Продукт, образующийся при поглощении диоксида углерода, отводят в сторону и нагревают для регенерации сорбента. Значительной химической деградации не наблюдается, но наблюдается физическое истирание. Загрузка происходит в интервале от примерно 60 0 °С до 100 0 °С в соответствии со следующим уравнением реакции.
Карбонат калия (К 2 CO 3 ) можно наносить на активированный оксид алюминия с большой площадью поверхности (Al 2 O 3 ). Продукт, образующийся при поглощении диоксида углерода, отводят в сторону и нагревают для регенерации сорбента. Значительной химической деградации не наблюдается, но наблюдается физическое истирание. Загрузка происходит в интервале от примерно 60 0 °С до 100 0 °С в соответствии со следующим уравнением реакции.
K 2 CO 3 + H 2 O + CO 2 ¬> 2 KHCO 3
Термическая десорбция бикарбоната калия (KHCO 3 ) и подложки из оксида алюминия происходит при температурах от 145 0 C до 0 0
В этой статье представлен процесс улавливания CO 2 (патент США 7,842,126), в котором CO 2 из топочного газа растворяется в водном растворе амина и растворимого карбоната калия. Карбонат калия быстро реагирует с карбаматом, связанным с амином, и водой с образованием менее растворимого бикарбоната калия, который выпадает в осадок из раствора. Эта реакция служит как для химической регенерации раствора амина путем удаления карбамата, так и для отделения CO 2 в виде твердого гидрокарбонатного осадка. Осажденный бикарбонат калия далее физически отделяется от основного раствора и нагревается до температуры выше примерно 150 ºC для термической регенерации обратно в твердый карбонат калия и выделения концентрированного газа CO 2 . Из-за отсутствия объемного водного раствора прогнозируется, что требования к энтальпии регенерации для отделенного твердого бикарбоната будут низкими по сравнению с указанными для регенерации в традиционных абсорбционных процессах на основе МЭА. После термической регенерации отделенного твердого вещества карбонат калия повторно растворяют в водном растворе амина, обедненного карбонатом калия, и реакционноспособный раствор повторно подвергают воздействию дымовых газов для замыкания технологического цикла.
Карбонат калия быстро реагирует с карбаматом, связанным с амином, и водой с образованием менее растворимого бикарбоната калия, который выпадает в осадок из раствора. Эта реакция служит как для химической регенерации раствора амина путем удаления карбамата, так и для отделения CO 2 в виде твердого гидрокарбонатного осадка. Осажденный бикарбонат калия далее физически отделяется от основного раствора и нагревается до температуры выше примерно 150 ºC для термической регенерации обратно в твердый карбонат калия и выделения концентрированного газа CO 2 . Из-за отсутствия объемного водного раствора прогнозируется, что требования к энтальпии регенерации для отделенного твердого бикарбоната будут низкими по сравнению с указанными для регенерации в традиционных абсорбционных процессах на основе МЭА. После термической регенерации отделенного твердого вещества карбонат калия повторно растворяют в водном растворе амина, обедненного карбонатом калия, и реакционноспособный раствор повторно подвергают воздействию дымовых газов для замыкания технологического цикла.

 Угольная кислота и ее соли.
Угольная кислота и ее соли. — 13:30-14:00
— 13:30-14:00