Энергия из воздуха, виски, фекалий и другие удивительные проекты
- Анастасия Зырянова
- Русская служба Би-би-си
Подпишитесь на нашу рассылку ”Контекст”: она поможет вам разобраться в событиях.
Автор фото, Wessex Water
Подпись к фото,Биоотходы одного человека за год могут обеспечить такой автобус топливом на 60 км
Российские ученые разработали способ утилизации углекислого газа и преобразования его в топливо. В случае реализации их идея позволит аккумулировать и использовать энергию, добытую так называемым чистым путем — буквально из воздуха.
О возможности накапливать энергию и одновременно перерабатывать вредные выбросы в атмосферу сообщило 17 октября 2017 года издание сибирского отделения РАН «Наука в Сибири».
Водород (h3), который высвобождается в результате электролиза воды, при определенных условиях реагирует с углекислым газом (CO2), который ученые предлагают брать прямо из воздуха. В результате химической реакции получается метан Ch5 и вода.
В результате химической реакции получается метан Ch5 и вода.
- Исследование: закисление океана угрожает океанской жизни
- Почему полный переход на электромобили случится не сразу
- Летающая колония в атмосфере Венеры — реальность?
«Энергия в этом топливе хранится в форме химических связей, и ее можно использовать по мере потребности. Инфраструктура для таких технологий уже существует — способные транспортировать Ch5 на большие расстояния газопроводы, хранилища, системы доставки к конечному потребителю», — рассказала научный сотрудник Института катализа им. Г.К.Борескова СО РАН кандидат химических наук Жанна Веселовская.
Добыть углекислый газ можно где угодно, но для этого необходим сорбент, который будет «собирать», то есть концентрировать CO2. В качестве сорбента ученые новосибирского института использовали карбонат калия (K2CO3).
Чтобы ускорить процесс концентрации CO2, ученые подключили к реакции пористый носитель (похожий на губку с наноразмерными порами, пишет «Наука в Сибири»), специально разработанный ими для этой реакции.
Автор фото, Sean Gallup/Getty Images
Подпись к фото,Содержание углекислого газа в атмосфере планеты стремительно растет
«Тот факт, что карбонат калия взаимодействует с углекислым газом на воздухе, хорошо известен и открыт не нами. Сорбенты на основе карбоната калия тоже изучались ранее. Вместе с тем работ по применению этих материалов для сорбции углекислого газа из воздуха практически не было — равно как и по совмещению технологии концентрирования атмосферного CO2 с его последующим метанированием», — передает издание слова Веселовской.
В действительности все не так просто. Из школьного курса химии известно, что водород и углекислый газ реагируют напрямую лишь при высокой температуре, что требует дополнительной энергии.
Однако недавно химики из университета Дьюка в США нашли способ упростить эту реакцию. Они обнаружили, что при наличии ультрафиолета и катализатора — наночастиц родия — реакция получения метана из водорода и углекислого газа протекает легко и быстро.
Такой процесс получения синтетического газового топлива становится не только энергоэффективным, но и максимально чистым.
Резкий скачок
Мы уже привыкли к тому, что энергия добывается из воды, из ветра, из солнечных лучей. Но они есть не везде.
Воздух же и углекислый газ в его составе есть всюду. И концентрация СО2 в земной атмосфере растет — люди дышат, печи горят, двигатели выбрасывают отработанный газ.
Диоксид углерода — один из парниковых газов. Сейчас содержание углекислого газа в атмосфере планеты равно 400 ppm (долей на миллион). Это значит, что в одном кубометре воздуха 400 мл CO2.
На протяжении сотен тысяч лет в атмосфере Земли не было такого объема CO2, какой мы наблюдаем в последние несколько десятков лет. Это заставляет ученых искать новые способы добычи чистой энергии.
Холодно, тепло, горячо
Существуют проекты, позволяющие добывать энергию из лавы, растительного масла, человеческих тел и отходов жизнедеятельности, а также микроорганизмов, мусора и некоторых напитков.
Самым очевидным из вышеперечисленного кажется жидкая магма: она раскаленная, у нее огромный объем тепловой энергии — так почему бы этим не воспользоваться?
Но использование жидкой магмы в качестве источника энергии не распространено: за это пока взялись лишь в Исландии. В рамках проекта Iceland Deep Drilling бур «Тор» сверлит Срединно-Атлантический хребет земной коры, который проходит через остров Исландия.
Автор фото, HALLDOR KOLBEINS/AFP/Getty Images
Подпись к фото,Геотермальная электростанция в Исландии, участвующая в проекте The Iceland Deep Drilling
На глубине в несколько километров, в условиях огромного давления вода нагревается расплавленной магмой до сверхкритического состояния, при котором исчезает различие между жидкостью и газом. Сверхкритическая вода, имеющая температуру 400-600 градусов по Цельсию, извлекается на поверхность и используется в качестве источника энергии.
Как замечает в своей статье Пит Роули, вулканолог из Университета Портсмута, сверхкритическая вода может генерировать энергию объемом до десяти раз больше, чем обычные геотермальные источники. Потенциальными местами ее добычи могут стать территории, где находятся молодые вулканы.
Потенциальными местами ее добычи могут стать территории, где находятся молодые вулканы.
Автор фото, BERNARD MERIC/AFP/Getty Images
Подпись к фото,Нагретая лавой до сверхкритического состояния вода может быть источником энергии
Пропустить Подкаст и продолжить чтение.
Подкаст
Что это было?
Мы быстро, просто и понятно объясняем, что случилось, почему это важно и что будет дальше.
эпизоды
Конец истории Подкаст
В качестве альтернативных и возобновляемых источников энергии ученые рассматривают не только высокотемпературные. Некоторые специалисты уверены, что температуры человеческого тела может быть вполне достаточно.
Шведская компания Jernhusen еще несколько лет назад придумала, как обогревать здание в Стокгольме энергией теплом тел пассажиров расположенного рядом Центрального вокзала.
Как отмечала компания, она не отнимала тепло у пассажиров, а лишь использовала избыточное — то, что все равно бы ушло в атмосферу.
Этот способ экологичен, но у него есть свои минусы. Для того, чтобы транспортировать такую энергию из одного здания в другое, нужно, чтобы они находились относительно близко, а людской поток в помещении-источнике должен быть интенсивным. Это сужает возможности применения технологии.
То же самое можно сказать о способе, который предложила американская компания EnGoPlanet: она установила в Лас-Вегасе фонари, которые обеспечиваются электричеством благодаря кинетической энергии — аккумуляторы заряжаются, когда мимо кто-то проходит.
Один человеческий шаг генерирует 4-8 ватт, но чтобы фонари работали всю ночь, нужно много прохожих. Это реально, но применимо не везде.
Шокирующие технологии
В Дании, Швеции и Британии крематории продают избытки энергии, которая получается в результате сжигания тел умерших. Эта энергия идет на обогрев домов, а британский крематорий в Дареме даже преобразовывает ее в электричество.
Эта энергия идет на обогрев домов, а британский крематорий в Дареме даже преобразовывает ее в электричество.
Автор фото, YE AUNG THU/AFP/Getty Images
Подпись к фото,В некоторых странах крематории продают избытки энергии, которая получается в результате сжигания тел
За одну кремацию выделяется энергия, которой хватит на питание полутора тысяч телевизоров в течение часа. Кого-то такой источник энергии может шокировать, но сторонники этой идеи считают, что вклад в экологию — достаточный аргумент.
Неоднозначным выглядит еще один источник энергии — фекалии. Так называемый Bio-Bus, который отправила на британские дороги бристольская компания GENeco, ездит на полученном из фекалий биогазе.
За один 15-мильный маршрут Bio-Bus отрабатывает отходы более 30 тысяч домохозяйств. Сначала он ездил между городами Бат и Бристоль, затем его пустили и по улицам Бристоля.
Технология подобная той, что использует GENeco, применяется широко по всему миру, рассказывает на своем сайте норвежская компания Cambi.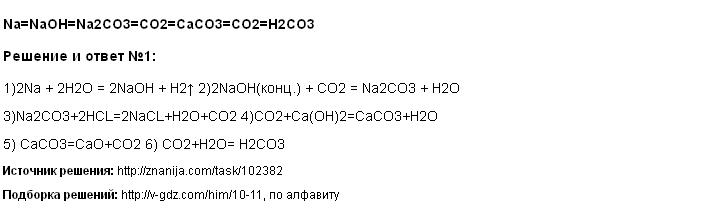 Запатентованный ей способ термального гидролиза используют в более чем 20 странах мира.
Запатентованный ей способ термального гидролиза используют в более чем 20 странах мира.
Автор фото, Sean Gallup/Getty Images
Подпись к фото,Фабрики по переработке навоза активно строят в Германии с 2000-х годов
Он применяется в том числе и на заводе по переработке биоотходов в Вашингтоне. Биомассу нагревают под высоким давлением примерно до 160℃, после чего она проходит процедуру анаэробного (то есть в отсутствие кислорода) разложения. В результате получается биогаз, который потом и становится источником энергии.
«Когда в следующий раз вы будете нажимать на кнопку слива в своем туалете в столице [американской] нации, учтите, что вы — или, точнее, то, что вы слили, — помогает генерировать чистую энергию», — писала газета Washington Post.
Не только биомасса годна для переработки в топливо, но и твердый мусор. Это хорошо усвоили в Швеции — процент мусора, который отправляется на свалки, там стремится к нулю. Почти все отходы перерабатываются, в том числе в тепло и электричество. Мусор же на свалках выделяет метан и вредит экологии.
Мусор же на свалках выделяет метан и вредит экологии.
С этим также пытаются бороться британские компании Bio-Bean и Celtic Renewables. Первая была основана в 2013 году и занимается переработкой отходов кофейной индустрии в биотопливо. Среди ее партнеров — крупная сеть кофеен Costa Coffee, чьи производственные отходы на территории Британии составляют примерно 3 тысячи тонн в год.
Celtic Renewables же занимается сбором и переработкой отходов от производства скотча, которым занимается сотня вискокурен в Шотландии. Чистый виски на выходе из дистиллятора составляет лишь 10% от общего объема сырья, остальное идет в отходы.
Celtic Renewables перерабатывает эти отходы в электричество, а также путем ABE-брожения (процесса ацетоно-бутилового разложения углеводов, открытого в начале XX века химиком Хаимом Вейцманом) синтезирует топливо для дизельных двигателей. В июле 2017 года компания впервые продемонстрировала автомобиль на своем «вискотопливе».
Автор фото, Alexander Hassenstein/Getty Images
Подпись к фото,Современный самолет может летать не только на авиакеросине
Возможно, уже скоро заправка автомобиля топливом, полученным из виски или кофе, перестанет казаться чем-то из ряда вон выходящим. Как и самолет на растительном масле.
Как и самолет на растительном масле.
В мае 2017 года авиакомпания Singapore Airlines отправила в рейс Сан-Франциско — Сингапур первый лайнер, заправленный керосином с добавкой топлива из отработанного растительного масла. Тогда компания объявила, что планирует запустить по этому маршруту еще 12 таких рейсов в течение трех последующих месяцев.
Ранее на подобное решилась китайская авиакомпания Hainan Airlines в марте 2015 года — ее самолет выполнил рейс из Шанхая в Пекин на топливе, частично синтезированном из отработанного растительного масла.
Биотопливо, сделанное из масла, при сгорании выделяет меньше вредных веществ, чем нефтепродукты. Кроме того, его использование позволит снизить потребность в добыче углеводородов.
Но у него есть и минусы: эксперты опасаются, что переход на растительное биотопливо повлечет вырубку лесов ради расширения плантаций пальм, из которых добывают масло.
.
Карбонат калия — хим.
 свойства и получение
свойства и получение
Карбонат калия K2CO3 — соль щелочного металла калия и угольной кислоты. Белое вещество, плавится без разложения, при дальнейшем нагревании разлагается. Очень хорошо растворяется в воде.
Относительная молекулярная масса Mr = 138,20; относительная плотность для тв. и ж. состояния d = 2,428; tпл = 891º C;
1. Карбонат калия можно получить путем взаимодействия при комнатной температуре пероксида калия и влажного углекислого газа. В результате реакции образуется карбонат калия и кислород:
4KO2 + 2CO2 = 2K2CO3 + 3O2
2. В результате взаимодействия пероксида калия и угарного газа при 50º С образуется карбонат калия и кислород:
2KO2 + CO = K2CO3 + O2
3. При взаимодействии концентрированного гидроксида калия и углекислого газа образуется карбонат калия и вода:
При взаимодействии концентрированного гидроксида калия и углекислого газа образуется карбонат калия и вода:
2KOH + СO2 = K2СO3 + H2O
4. Взаимодействуя с углеродом (графитом) при 30º С надпероксид калия карбонат калия и углекислый газ:
4KO2 + 3C = 2K2CO3 + CO2
5. Разлагаясь при температуре 100 — 400 ºС гидрокарбонат калия образует карбонат калия, углекислый газ и воду:
2KHCO3 = K2CO3 + CO2 + H2O
6. В результате реакции между гидрокарбонатом калия и гидроксидом калия образуется карбонат калия и вода:
KHCO3 + KOH = K2CO3 + H2O
Качественная реакция на карбонат калия — взаимодействие его с раствором сильных кислот. В результате реакции происходит бурное выделение углекислого газа, образование которого можно проверить, если пропустить его через известковую воду, которая мутнеет из-за образования осадка:
В результате реакции происходит бурное выделение углекислого газа, образование которого можно проверить, если пропустить его через известковую воду, которая мутнеет из-за образования осадка:
1. При взаимодействии с хлороводородной кислотой, карбонат калия образует хлорид калия, углекислый газ и воду:
K2CO3 + 2HCl = 2KCl + CO2↑ + H2O
2. Взаимодействуя с серной кислотой, карбонат калия образует углекислый газ и воду, а также сульфат калия:
K2CO3 + H2SO4 = 2K2SO4 + CO2↑ +H2O.
1. Карбонат калия может реагировать с простыми веществами:
С хлором, бромом и йодом концентрированный и горячий раствор карбоната калия реагирует с образованием хлорида, бромида или йодида калия, хлората, бромата или йодата калия и углекислого газа:
K2CO3 + 3Cl2 = 5KCl + KClO3 + 3CO2↑
K2CO3 + 3Br2 = 5KBr + KBrO3 + 3CO2↑
K2CO3 + 3I2 = 5KI + KIO3 + 3CO2↑
2. Карбонат калия вступает в реакцию со многими сложными веществами:
Карбонат калия вступает в реакцию со многими сложными веществами:
2.1. Насыщенный карбонат калия реагирует при 30–40º C с водой и углекислым газом, образуя осадок гидрокарбоната калия:
K2CO3 + H2O + CO2 ↔ 2KHCO3↓
2.2. Карбонат калия может реагировать с насыщенным гидроксидом кальция с образованием гидроксида калия и осадка карбоната кальция:
K2CO3 + Ca(OH)2 = 2KOH + CaCO3↓
2.3. Карбонат калия способен реагировать с кислотами:
2.3.1. При взаимодействии с разбавленной хлороводородной кислотой карбонат калия образует хлорид калия, углекислый газ и воду:
K2CO3 + 2HCl = 2KCl + CO2↑ +H2O
2. 3.2. В результате реакции между насыщенным карбонатом калия и концентрированной и холодной хлорной кислотой образуется осадок хлорат калия, вода и газ углекислый газ:
3.2. В результате реакции между насыщенным карбонатом калия и концентрированной и холодной хлорной кислотой образуется осадок хлорат калия, вода и газ углекислый газ:
K2CO3 + 2HClO4 = 2KClO4↓ + H2O + CO2↑
2.3.3. Взаимодействуя с разбавленной фосфорной кислотой концентрированный раствор карбоната калия образует фосфат калия, воду и углекислый газ:
3K2CO3 + 2H3PO4 = 2K3PO4 + 3H2O + 3CO2↑
2.3.4. Карбонат калия взаимодействует с плавиковой кислотой. В результате реакции образуется фторид калия, вода и углекислый газ, если кислота разбавленная:
K2CO3 + 2HF = 2KF + H2O + CO2↑,
а если кислота концентрированная, то образуется гидрофторид калия, вода и углекислый газ:
K2CO3 + 4HF = 2K(HF2) + H2O + CO2↑
2. 5. Концентрированный раствор карбоната калия взаимодействует с оксидом серы. При этом образуются карбонат калия и углекислый газ:
5. Концентрированный раствор карбоната калия взаимодействует с оксидом серы. При этом образуются карбонат калия и углекислый газ:
K2CO3 + SO2 = K2SO3 + CO2↑.
Понравилось это:
Нравится Загрузка…
Исследование прямого улавливания воздуха (DAC) с использованием поглощающего раствора KOH/K2CO3 для улавливания CO2, Антуан Руксе, Со-ман Ким, Грегуар Леонар :: SSRN
Скачать эту статью
Открыть PDF в браузере
Добавить бумагу в мою библиотеку
Делиться:
13 страниц Опубликовано: 10 ноября 2022 г.
Просмотреть все статьи Antoine Rouxhet
Льежский университет – Факультет химического машиностроения
Льежский университет – Факультет химического машиностроения
Дата написания: 10 ноября 2022 г.
Резюме
Прямой улавливание воздуха (DAC) заключается в выделении CO2 из окружающего воздуха с помощью абсорбции или адсорбции. механизмы. В первом случае в качестве абсорбирующего агента обычно используются щелочные растворы, такие как КОН, благодаря достигаемым высоким значениям рН, способствующим абсорбции СО2. Однако щелочность этих растворов вызывает высокую коррозионную активность и вредные свойства, что затрудняет обращение с ними. Раствор смеси KOH/K2CO3 исследуется в этой статье и предлагается в качестве альтернативы более широко используемому раствору сильного основания. Этот смешанный раствор направлен на то, чтобы использовать преимущества низкой токсичности и коррозионной активности растворов K2CO3, при этом все еще включая фракцию KOH.

Ключевые слова: Прямой захват воздуха (DAC), KOH, K2CO3, эффективность удаления, осаждение, равновесие
Рекомендуемое цитирование: Рекомендуемая ссылка
Руше, Антуан и Ким, Со-ман и Леонар, Грегуар, Исследование прямого улавливания воздуха (DAC) с использованием поглощающего раствора KOH/K2CO3 для улавливания CO2 (10 ноября 2022 г.). Материалы 16-й конференции по технологиям контроля парниковых газов (GHGT-16), 23–24 октября 2022 г., доступно на сайте SSRN: https://ssrn.com/abstract=4273837 или http://dx.doi.org/10.2139/ssrn.4273837
У вас есть вакансия, которую вы хотели бы рекламировать в SSRN?
Связанные электронные журналы
Обратная связь
Обратная связь с SSRN
Обратная связь (необходимый)
Электронная почта (необходимый)
Если вам нужна немедленная помощь, позвоните по номеру 877-SSRNHelp (877 777 6435) в США или +1 212 448 2500 за пределами США с 8:30 до 18:00 по восточному поясному времени США, с понедельника по пятницу.
Кинетические исследования захвата углекислого газа карбонатом калия на активированном угле с использованием реактора с псевдоожиженным слоем
Перейти к основному содержанию включая учетные данные) с кодом ELEARN25 .
Предложение действительно с 10 по 31 марта. Общедоступные курсы исключены из акции.
Источник: Айше
- Тип:
Презентация конференции
Касса
Проверить
У вас уже есть это?
Войдите в систему, чтобы получить инструкции по доступу к этому содержание.
- Тип конференции:
Весенняя встреча AIChE и Всемирный конгресс по безопасности процессов
- Дата презентации:
29 апреля 2015 г.0004 Промежуточный
- PDH:
CO2 является основным антропогенным газом, способствующим глобальному потеплению. Растущая озабоченность по поводу изменения климата стимулировала исследовательскую деятельность по разработке более эффективных процессов улавливания CO2. Некоторые превосходные адсорбенты, такие как цеолиты, твердые сорбенты на основе углеродных нанотрубок и углеродные молекулярные сита, были предложены для адсорбции CO2 в потоке сухого газа. Однако наличие влаги оказывает разрушающее действие на эти сорбенты [1].
Некоторые превосходные адсорбенты, такие как цеолиты, твердые сорбенты на основе углеродных нанотрубок и углеродные молекулярные сита, были предложены для адсорбции CO2 в потоке сухого газа. Однако наличие влаги оказывает разрушающее действие на эти сорбенты [1].
СО2 может быть химически адсорбирован на сухих регенерируемых сорбентах на основе карбонатов щелочных металлов (М2СО3, где М = К, Na, Li) по реакции: . Это показывает, что этот класс сорбентов имеет неотъемлемое преимущество, поскольку влага необходима для этой реакции. Видно, что K2CO3 дает наилучшие характеристики и имеет широкий диапазон температур карбонизации, где эффективность сорбента составляет почти 100 % [2].
В настоящей работе активированный уголь (АУ) выбран в качестве носителя для карбоната калия из-за его высокопористой структуры и большой площади поверхности. На АУ методом влажной пропитки наносится 30 мас. % K2CO3 [3]. Этот сорбент затем характеризуется XRD, EDX, SEM и BET площадью поверхности.
Кинетические исследования проводятся в колонне с псевдоожиженным слоем, нагретой в печи, с использованием в качестве псевдоожижающей среды смеси воздуха или N2 и CO2, увлажненной до желаемого содержания влаги. За реакцией следят, измеряя концентрацию CO2 в выходящем газе в зависимости от времени. Исследовано влияние различных параметров, таких как расход газа, состав газа, высота слоя и температура, на конверсию K2CO3. Реакцию проводят в интервале температур 60-90 o C. Состав как CO2, так и водяного пара варьируется в пределах 5-20% при скоростях газа в пределах 1-3-кратной минимальной скорости псевдоожижения.
Ссылки:
1. Саманта А., А. Чжао, Г.К.Х. Shimizu, P. Sarkar и R. Gupta, «Улавливание CO2 после сжигания с использованием твердых сорбентов: обзор», Ind. Eng. хим. Res., 51 , 1438-1463 (2012)
2. Хаяши Х., Дж. Таниучи, Н. Фуруясики, С. Сугияма, С. Хирано, Н. Шигемото и Т. Нонака, «Эффективное восстановление» диоксида углерода из дымовых газов угольных электростанций при циклических операциях с неподвижным слоем над K2CO3-на-углероде?, Инд.
