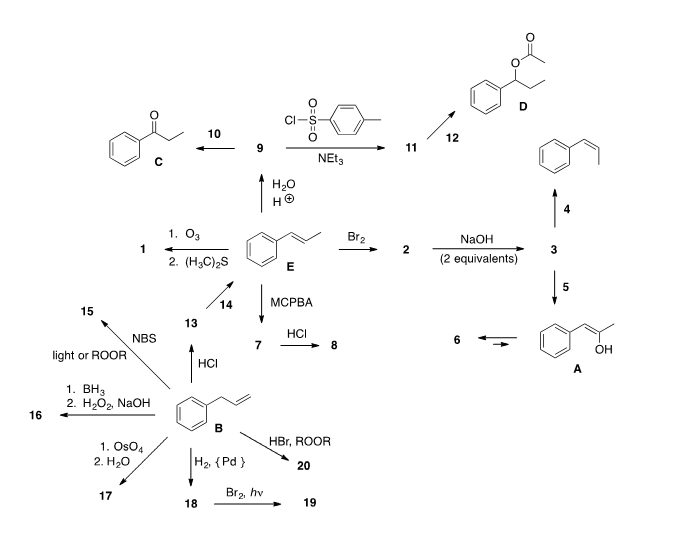
Химия
СОЛИ
Оглавление:
1. Определение
2. Классификация
3. Электролитическая
диссоциация
4. Получение
5. Важнейшие химические
свойства
6. Специфические свойства
7. Задания
8. Ответы
|
Соли – |
КЛАССИФИКАЦИЯ
По химическому составу соли классифицируют на средние, кислые, основные и двойные.
Отдельным типом солей являются комплексные соли
(соли с комплексными катионами или анионами) . В формулах этих солей
комплексный ион заключён в квадратные скобки.
Комплексные ионы — это сложные ионы, состоящие из ионов элемента (комплексообразователя) и связанных с ним нескольких молекул или ионов (лигандов).
Примеры комплексных
солей приведены ниже.
а) С комплексным анионом:
K2[PtCl]4
— тетрахлороплатинат(II)
калия,
K2[PtCl]6
— гексахлороплатинат(IV)
калия,
К3[Fe(CN)6] — гексацианоферрат(III) калия.
б) С комплексным катионом:
[Cr(NH3)6]Cl3 — хлорид гексаамминхрома (III),
[Ag(NH3)2]Cl
— хлорид диамминсеребра (I)
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
Растворимые соли при растворении в воде
диссоциируют на катионы металлов и анионы кислотных остатков.
NaCl → Na+ +
Cl—
K2SO4 → 2K+
+ SO42-
Al(NO3)3 → Al3+ + 3NO3—
ВАЖНЕЙШИЕ СПОСОБЫ ПОЛУЧЕНИЯ СОЛЕЙ
1. Металл + неметалл = соль
2Fe + 3Cl2
= 2FeCl3
2. Металл + кислота = соль + водород
Zn + 2HCl
= ZnCl2 + H2↑
3. Металл + соль = другой металл + другая соль
Fe + CuSO4 = Cu + FeSO4
4. Кислота + основный (амфотерный) оксид = соль
+ вода
3H2SO4+Al2O3=Al2(SO4)3+
3H2O
5. Кислота + основание = соль + вода
H2SO4
+ 2NaOH = Na2SO4
+ 2H2O
При неполной нейтрализации многоосновной кислоты основанием
получают кислую соль:
H2SO4
+ NaOH = NaHSO4
+ H2O
При неполной нейтрализации многокислотного основания кислотой
получают основную соль:
Zn(OH)2
+ HCl = ZnOHCl +
H2O
6.
AgNO3 + HCl = AgCl + HNO3
BaCl2 + H2SO4 = BaSO4 + 2HCl
7. Основный (амфотерный) оксид + кислота = соль
+ вода
CaO + 2HCl = CaCl2 +H2O
8. Основный оксид + кислотный оксид = соль
Li2O+CO2 = Li2CO3
9. Кислотный оксид + основание = соль + вода
SO3 + 2NaOH = Na2SO4
+ H2O
10. Щёлочь + соль = основание + другая соль
CuSO4 + 2NaOH
= Cu(OH)2
+ Na2SO4
11. Реакция обмена между солями: соль(1) + соль (2) = соль(3) + соль(4)
NaCl + AgNO3 =Na NO3 + AgCl
12. Кислые соли могут быть получены
действием избытка кислоты на средние соли и оксиды:
Кислые соли могут быть получены
действием избытка кислоты на средние соли и оксиды:
Na2SO4
+ H2SO4
= 2NaHSO4
Li2O
+ 2H2SO4
= 2LiHSO4 + H2O
13. Основные соли получают при осторожном
добавлении небольших количеств щелочей к растворам средних солей:
AlCl3 + 2NaOH = Al(OH)2Cl +
2NaCl
ВАЖНЕЙШИЕ ХИМИЧЕСКИЕ СВОЙСТВА
1. Соль + щёлочь = другая соль + другое
основание
CuCl2 + 2KOH = 2KCl + Cu(OH)2
2. Соль + кислота = другая соль + другая кислота
BaCl 2 +
H2SO4
= BaSO4 + 2HCl
3. Соль(1) + соль (2) = Соль(3) + соль(4)
Na2SO4 + BaCl2
=2NaCl + BaSO4
4. Соль + металл = другая соль + другой металл
(согласно электрохимическому ряду напряжений металлов)
Соль + металл = другая соль + другой металл
(согласно электрохимическому ряду напряжений металлов)
Zn + Pb(NO3)2
= Pb + Zn(NO3)2
5. Некоторые соли разлагаются при нагревании
CaCO3 = CaO + CO2
KNO3 = KNO2
+ O2
СПЕЦИФИЧЕСКИЕ ХИМИЧЕСКИЕ СВОЙСТВА
Специфические химические свойства солей зависят от того, какой катион и какой анион образуют данную соль.
|
Специфические свойства солей по катиону |
Специфические свойства солей по аниону |
|
Ag+ + Cl— = AgCl↓ белый творожистый осадок Cu2+ + 2OH— = Cu(OH)2↓ синий осадок Ba2+ + SO42- = BaSO4↓ белый мелкокристаллический осадок Fe3+ + 3SCN— = Fe(SCN)3 кроваво-красное окрашивание Al3+ + 3OH— = Al(OH)3↓ белый желеобразный осадок Ca2+ + CO3 2- = CaCO3↓ белый осадок |
Ag+ + Cl— = AgCl↓ белый творожистый осадок Ba2+ + SO42- = BaSO4↓ белый мелкокристаллический осадок 2H+ + SO32- = H2O + SO2↑ газ с резким запахом 2H+ + CO32- = H2O + CO2↑ газ без запаха 3Ag+ + PO43- = Ag3PO4↓ жёлтый осадок 2H+ + S2- = H2S↑ газ с неприятным запахом тухлых яиц |
ЗАДАНИЯ
Задание 1. Из приведённого перечня выберите
соли, назовите их, определите тип.
Из приведённого перечня выберите
соли, назовите их, определите тип.
1) КNO2
2)
LiOH 3) CaS 4) CuSO4 5) P2O5
6) Al(OH)2Cl 7) NaHSO3 8) H2SO4
Задание 2. С какими из перечисленных веществ
может реагировать а) BaCl2 б)
CuSO4 в)
Na2CO3?
1)Na2O 2)HCl 3)H2O 4) AgNO3 5)HNO3
6)Na2SO4 7)BaCl2 8)Fe
9)Cu(OH)2 10) NaOH
ОТВЕТЫ.
Наверх
Задание по химии : Добути Na2so4… -reshimne.ru
Новые вопросы
Ответы
Na2S04 — это соль сульфат натрия ее можно получить: а) взаимодействием основания и кислоты
2NaOH + h3SO4 = Na2SO4 + 2h3O б)взаимодествием оксида и кислоты Na2O + h3SO4 = Na2SO4 + h3O в) взаимодействием кислотного оксида и основания SO3 +2 NaOH= Na2SO4 + h3O
г) взаимодествием основного и кислотного оксидов Na2O + SO3 = Na2SO4д) взаимодействием соли и снования CuSO4 +2 NaOH = Cu(OH)2 + Na2SO4
Похожие вопросы
Определить массу 10 л. водорода…
водорода…
Переделить объём 20 граммов кислорода…
Ребята, решите срочно!)…
Ионная связь осуществляется в веществе 1),h3SO 2)O2 3)SO2 4)NaBr…
Ca3(PO4)2 —> CaCl2 —> CaCO3 —> Ca(HCO3)2 —>CO2…
C3H6 + Cl2 -> C3H6Cl2 — как называется эта хим. реакция…
Математика
Литература
Алгебра
Русский язык
Геометрия
Английский язык
Химия
Физика
Биология
Другие предметы
История
Обществознание
Окружающий мир
География
Українська мова
Українська література
Қазақ тiлi
Беларуская мова
Информатика
Экономика
Музыка
Право
Французский язык
Немецкий язык
МХК
ОБЖ
Психология
Химические уравнения — как расставлять коэффициенты?
Химическое уравнение — это условная запись химического превращения с помощью химических формул и математических знаков
При составлении химических уравнений используют математические знаки «+», «−», «=», а также числа — они выступают в качестве коэффициентов и индексов.
Коэффициенты показывают число частиц (атомов или молекул), а индексы — число атомов, которые входят в состав молекулы.
Химическую реакцию можно изобразить в виде схемы:
На схеме протекание реакции представлено нагляднее, но сложные химические процессы изобразить таким способом сложно. Поэтому их записывают в виде химического уравнения.
Вещества, которые вступают в реакцию, называют исходными веществами, или реагентами. Вещества, которые образуются в результате, называют продуктами реакции.
Давайте разберем этот пример химического уравнения. Здесь видно, что из двух молекул водорода и одной молекулы кислорода образуются две молекулы воды. Реагенты в данном случае — водород и кислород, продукт реакции — вода.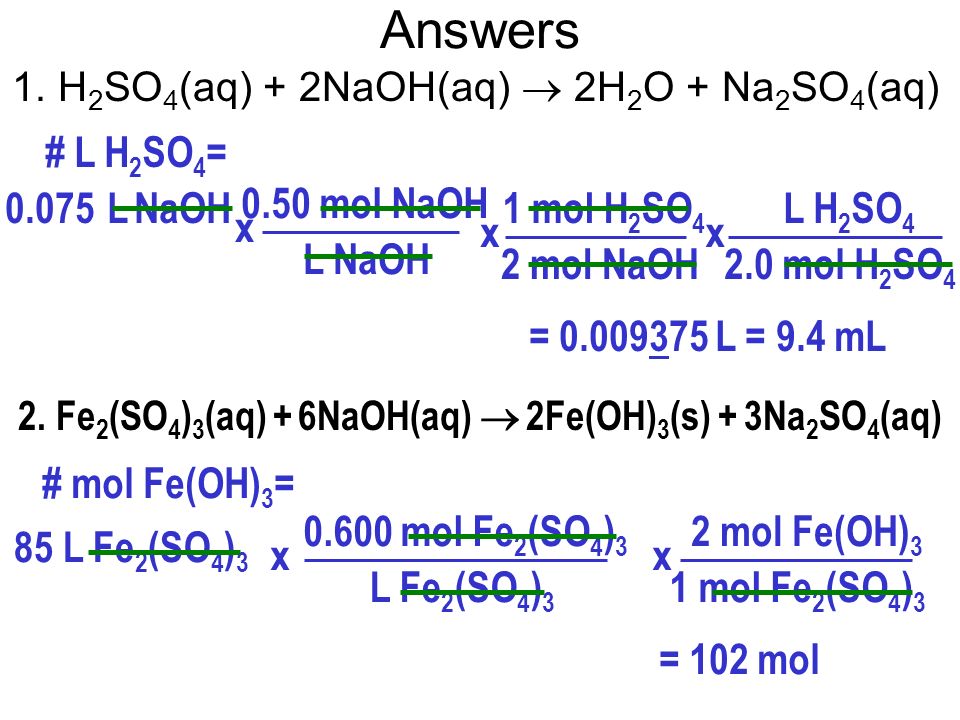
Новые вещества образуются вследствие перегруппировки исходных атомов. В результате химической реакции атомы химических элементов никуда не исчезают и не возникают новые, их число остается неизменным — это следует из закона сохранения массы веществ.
Закон сохранения массы веществ
Масса веществ, вступивших в реакцию, равна массе веществ, образовавшихся в ходе этой реакции.
Закон сохранения массы веществ лежит в основе химии и используется при составлении уравнений химических реакций.
Алгоритм составления уравнения химической реакции
Рассмотрим, как составлять уравнения химических реакций, на примере взаимодействия магния и кислорода с образованием оксида магния.
Записываем химические формулы исходных веществ в левой части уравнения. Напоминаем: молекулы H2, N2, O2, F2, Cl2, Br2, I2 двухатомны.
 Между исходными веществами ставим «+», а затем знак «=».
Между исходными веществами ставим «+», а затем знак «=».После знака равенства записываем химическую формулу продукта. Химическую формулу необходимо составить с учетом валентностей химических элементов.
Согласно закону сохранения массы веществ, число атомов каждого химического элемента до и после реакции должно быть одинаковым. Давайте посмотрим, как расставлять коэффициенты в химических уравнениях, чтобы закон выполнялся.
Из составленной химической реакции видно, что количество атомов магния слева и справа от знака равенства одинаково, но атомов кислорода слева два, а справа один.
Чтобы уравнять число атомов в химическом уравнении, находим наименьшее общее кратное (НОК), в нашем случае — 2. А затем делим НОК на количество атомов кислорода в реагентах и полученное число записываем в виде коэффициента.
Это важно
Коэффициент 1 в уравнении химической реакции не указывается, но при подсчете суммы коэффициентов в уравнении его необходимо учитывать.

Проверим количество атомов магния до и после знака «=». Если перед химической формулой уже стоит коэффициент, то для подсчета количества атомов необходимо умножить коэффициент на индекс, который относится к этому химическому элементу.
Чтобы уравнять количество атомов магния в химической реакции, посчитаем НОК и разделим его на количество атомов с каждой стороны от знака «=». Результат деления и будет являться коэффициентом (повторяем расстановку коэффициентов в химическом уравнении из 3-го пункта).
Получаем уравнение химической реакции, в котором в исходных веществах и продуктах реакции по 2 атома магния и кислорода.
Сумма коэффициентов в этом химическом уравнении равна 5 (2 + 1 + 2 = 5).
Коэффициенты, которые стоят в химическом уравнении перед веществами, указывают на мольное соотношение исходных веществ и продуктов реакции, по которому и производятся расчеты.
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Типы химических реакций
Химические реакции можно классифицировать по различным признакам:
По числу и составу исходных веществ и продуктов реакции.
По изменению степени окисления.
По тепловому эффекту.
По агрегатному состоянию.
По наличию или отсутствию катализатора.
По обратимости.
По числу и составу исходных веществ и продуктов реакции
По этому признаку выделяют 4 типа реакций: реакции соединения, реакции разложения, реакции замещения и реакции обмена.
Реакции соединения — это реакции, в результате которых из нескольких более простых веществ образуется одно более сложное.
Например, простые вещества барий и кислород взаимодействуют с образованием сложного вещества оксида бария:
2Ba + O2 = 2BaO.
Также к реакциям соединения относится взаимодействие оксида натрия с водой с образованием более сложного вещества гидроксида натрия. Оно более сложное, так как состоит уже из трех атомов химических элементов, в отличие от веществ-реагентов, которые состоят из двух атомов:
Na2O + H2O = 2NaOH.
Реакции разложения — это реакции, в результате которых из одного более сложного вещества образуется несколько более простых веществ. Является процессом, обратным реакции соединения.
Пример такой реакции — разложение нитрата серебра на несколько более простых веществ: серебро, оксид азота (IV) и кислород.
2AgNO3 = 2Ag + 2NO2↑ + O2↑.
Что это за стрелочка? 🤔
Стрелка вверх означает, что получившееся вещество является газом, который покидает место проведения реакции и больше не участвует в ней.
Реакции замещения — это такие реакции, в результате которых атомы простого вещества замещают атомы одного химического элемента в сложном веществе. Также возможно замещение функциональных групп в сложном веществе.
Например, замещение атомов водорода в молекуле соляной кислоты на атомы цинка:
Zn + 2HCl = ZnCl2 + H2↑.
Реакции обмена — это реакции между двумя сложными веществами, в результате которых вещества обмениваются своими составными частями.
Например, NaOH + H2SO4 = Na2SO4 + H2O.
Реакции нейтрализации
Реакция щелочи с кислотой называется реакцией нейтрализации и является частным случаем реакции обмена.
Для наглядности показали все типы химических реакций по этому признаку на схеме:
По изменению степени окисления
По этому признаку выделяют два вида реакций:
реакции, протекающие без изменения степени окисления;
окислительно-восстановительные реакции (ОВР) — реакции, протекающие с изменением степени окисления нескольких элементов.
В ОВР всегда участвуют вещество-окислитель и вещество-восстановитель. Другие исходные вещества, принимающие участие в реакции, выступают в качестве среды, в которой протекает эта реакция.
Окислитель — вещество, в состав которого входит ион или атом, который в процессе реакции принимает электроны, тем самым понижая свою степень окисления.
Восстановитель — вещество, в состав которого входит ион или атом, который в процессе реакции отдает электроны, тем самым повышая свою степень окисления.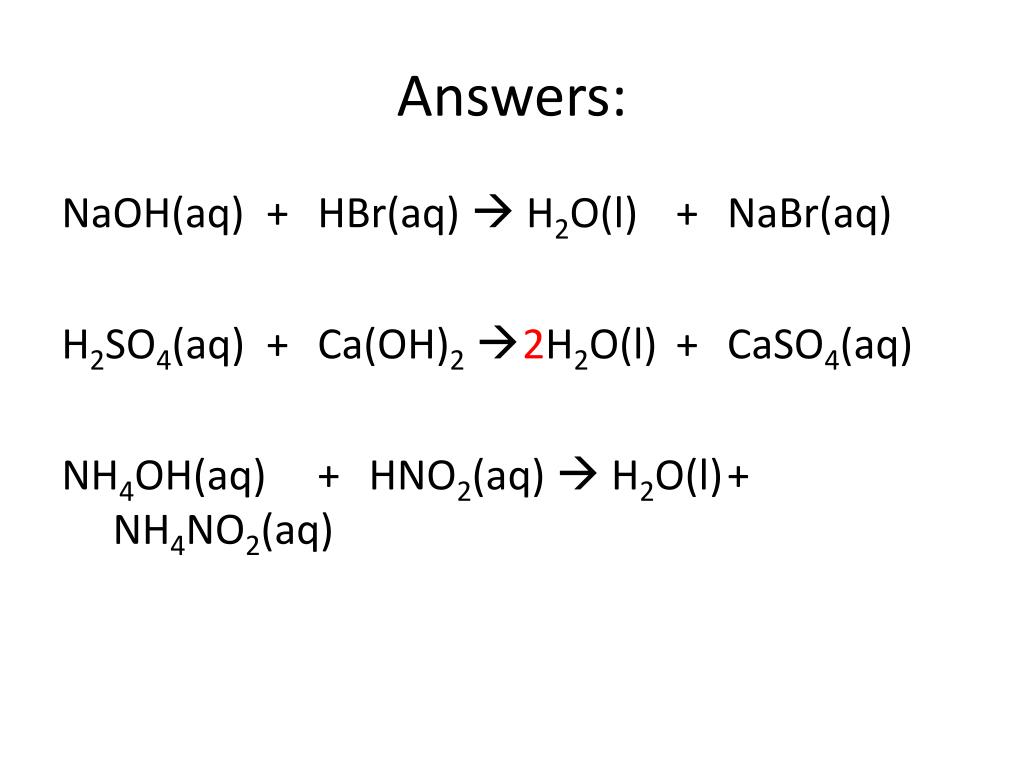
Из определений можно сделать вывод, что в ходе реакции протекает два процесса: принятие электронов (восстановление) и отдача электронов (окисление). Протекают они одновременно.
По тепловому эффекту
По тепловому эффекту реакции делятся на эндотермические и экзотермические.
Эндотермические реакции протекают с поглощением теплоты (−Q). Буквой Q обозначается количество теплоты.
К таким реакциям относятся практически все реакции разложения. Пример:
CaCO3 = CaO + CO2 − Q.
Экзотермические реакции протекают с выделением теплоты (+Q).
К таким реакциям относятся практически все реакции соединения. Пример:
2H2 + O2 = 2H2O + Q.
По агрегатному состоянию исходных веществ
По этому признаку все реакции разделяют на гомогенные и гетерогенные.
Гомогенные реакции протекают в одной фазе.
К гомогенным реакциям относятся те, исходные вещества которых находятся либо в жидком агрегатном состоянии, либо в газообразном. Например, взаимодействие двух газообразных веществ — водорода и хлора:
H2(г) + Cl2(г) = 2HCl.
Агрегатное состояние указывается в правом нижнем углу: «г» — газообразное, «ж» — жидкое, «тв» — твердое.
Гетерогенные реакции протекают на границе раздела фаз.
Как правило, такие реакции протекают между веществами, которые находятся в разных агрегатных состояниях:
2Na(тв) + 2H2O(ж) = 2NaOH + H2.
Также к гетерогенным относятся реакции между двумя несмешивающимися жидкостями. Собрали несколько примеров гетерогенных реакций:
Химия 3 ноябрь/декабрь 2013
| ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||
| ||||||||||||||
| ||||||||||||||
h3so4 наох na2so4 h3o
ПоискЧатте
Залитый красками
азиатка детка путана
боялись во всем мире так же, как h3o
ТротТоТ
Мясистые подводные лодки
Тип реакции для NaHCO3 + h3SO4 = Na2SO4 + CO2 + h3O
Как сбалансировать Na2SO4 Ba(NO3)2 = BaSO4 NaNO3
Как сбалансировать NaOH h3SO4 = Na2SO4 h3O (гидроксид натрия серная кислота)
Na h3SO4
Как сбалансировать h3SO4 NaOH = Na2SO4 h3O
Balancer por inspección simple или tanteo NaOH + h3SO4 – Na2SO4 + h3O
Как сбалансировать NaOH + h3SO4 = Na2SO4 + h3O
KMnO4+Na2SO3+h3SO4.avi
h3SO4 + Na2S2O3
Как сбалансировать NaOH (Nh5)2SO4 = Nh4 h3O Na2SO4
Молярная масса / молекулярная масса h3SO4: серная кислота
растворы h3SO4
Как написать результирующее ионное уравнение для BaCl2 + Na2SO4 = BaSO4 + NaCl
KMnO4 + Na2SO3 – MnO2 + Na2SO4 + KOH
Na2CO3 h3SO4
Тип реакции для Na2CO3 h3SO4 = Na2SO4 CO2 h3O
Сбалансируйте химическое уравнение. наох h3so4=na2so4 h3o.
наох h3so4=na2so4 h3o.
Реакция сульфата меди (CuSO4) с гидроксидом натрия (NaOH)
Тип реакции для SO3 h3O = h3SO4
Как сбалансировать NaOH + h3SO4 — NA2SO4 + h3O
Как сбалансировать NaOH HCl = NaCl h3O (гидроксид натрия плюс соляная кислота)
As2S3 HNO3 h3O – h4AsO4 h3SO4 НЕТ
Как сбалансировать NaOH h3SO4 – Na2SO4 h3O
Гидроксид натрия и серная кислота дают сульфат натрия и воду
Как происходит ионизация NaOH?
KMnO4 h3SO4
Как написать результирующее ионное уравнение для h3SO4 Na2S = h3S Na2SO4
Как сбалансировать химическое уравнение NaOH h3SO4=Na2SO4 h3O
Тип реакции для h3SO4 Ca(OH)2 = CaSO4 h3O
Как сбалансировать h3SO4 Nh5OH = (Nh5)2SO4 h3O (серная кислота, гидроксид аммония)
ÐÐ¾Р»ССРµР½Р¸Рµ ССР»ССР¸Р´Р° Р¼РµР´Р¸ | CuSO4 + Na2S = CuS + Na2SO4
Простые советы по балансировке NaOH h3SO4 = Na2SO4 h3O
Как сбалансировать Na2O2·h3O = NaOH·h3O2 (перекись натрия, ХОЛОДНАЯ вода)
Как найти количество атомов в Na2SO4 (сульфат натрия)
Тип реакции для h3SO4 Ba(OH)2 = BaSO4 h3O
NaHCO3+h3SO4=Na2SO4+h3O+CO2 сбалансируйте уравнение @My документальный фильм. nahco3+h3so4=na2so4+h3o+co2
nahco3+h3so4=na2so4+h3o+co2
Баланс: NaOH + h3SO4 — Na2SO4 +h3O Вопрос 6(b) NCERT Химические реакции и уравнения Класс 10
Как сбалансировать NaOH + h3SO4 = Na2SO4 + h3O
Сбалансируйте следующие химические уравнения. (a) HNO3 Ca(OH)2 ÷ Ca (NO3)2 h3O (b) NaOH h3SO4 ÷ Na2SO4 h3O (c) NaCl AgNO3 ÷ AgCl NaNO3 (d) BaCl2 h3SO4 ÷ BaSO4 HCl — Химия Вопросы и ответы
Серная кислота гидроксида натрия — реакция нейтрализации кислотного основания
Куантограмм NaOH, необходимый для нейтрализации 300 мл h3SO4 0,4N
h3SO4 НАОН
Как сбалансировать Na2SO4 C = Na2S CO2
NaOH·ч3SO4
Как сбалансировать h3SO4 Na = Na2SO4 h3 (серная кислота, натрий)
Реакция нейтрализации с гидроксидом натрия и сульфуром
h3SO4 NaOH
Na2S2O3 h3SO4 – Na2SO4 S – SO2 – h3O | Na2S2O3 или Na2SO4 | Na2S2O3 ра S | Na2S2O3 или SO2.
Реакция натрия (Na) с концентрированной серной кислотой (h3SO4) с неожиданным результатом
– h3SO4 C = SO2 CO2 h3O Метод алгебраической обработки (SOLUCIÃN)
Как сбалансировать NaOH h3SO4=Na2SO4 h3O|Химическое уравнение NaOH h3SO4=Na2SO4 h3O|NaOH h3SO4=Na2SO4 h3O
NaCl h3SO4. avi
avi
как сбалансировать naoh h3so4 na2so4 h3o
KMnO4 Na2SO3 h3SO4=K2SO4 MnSO4 Na2SO4 h3O сбалансировать химическое уравнение алгебраическим методом.
Как сбалансировать h3SO4 NaHCO3 = Na2SO4 h3O CO2
Как сбалансировать Na + h3O = NaOH + h3 (натрий плюс вода)
Тип реакции для h3SO4 NaOH = Na2SO4 h3O
Как сбалансировать NaOH + h3SO4 = Na2SO4 + h3O
UFMG «O гидроксид садио (NaOH) нейтрализует или ацидо сульфурико (h3SO4) де акордо с эквação…»
Как сбалансировать Fe h3SO4 = FeSO4 Fe2(SO4)3 h3O SO2 (концентрированная серная кислота железа)
– HI + h3SO4 = h3S + I2 + h3O (РАСТВОР РЕДОКС)
HCl+NaOH
K2Cr2O7 + KI + h3SO4 – K2SO4 + Cr2(SO4)3 +I2+h3O
Как написать результирующее ионное уравнение для NaCl + h3SO4
ⶠNaCl MnO2 h3SO4 = Cl2 MnSO4 Na2SO4 h3O Método REDOX (SOLUCIÃN)
Как написать результирующее ионное уравнение для h3SO4 NaOH = Na2SO4 h3O
Как написать результирующее ионное уравнение для h3SO4 Na2CO3 = Na2SO4 h3O CO2
Реакси Эксотерм и Эндотерм
Как сбалансировать химическое уравнение [NAOH h3SO4=NA2SO4 h3O],[HG(NO3)2 KI=HGI2 KNO3], [KCLO3=KCL O2]
NaOH+h3SO4=Na2SO4+h3O сбалансировать химическое уравнение алгебраическим методом или методом abcd.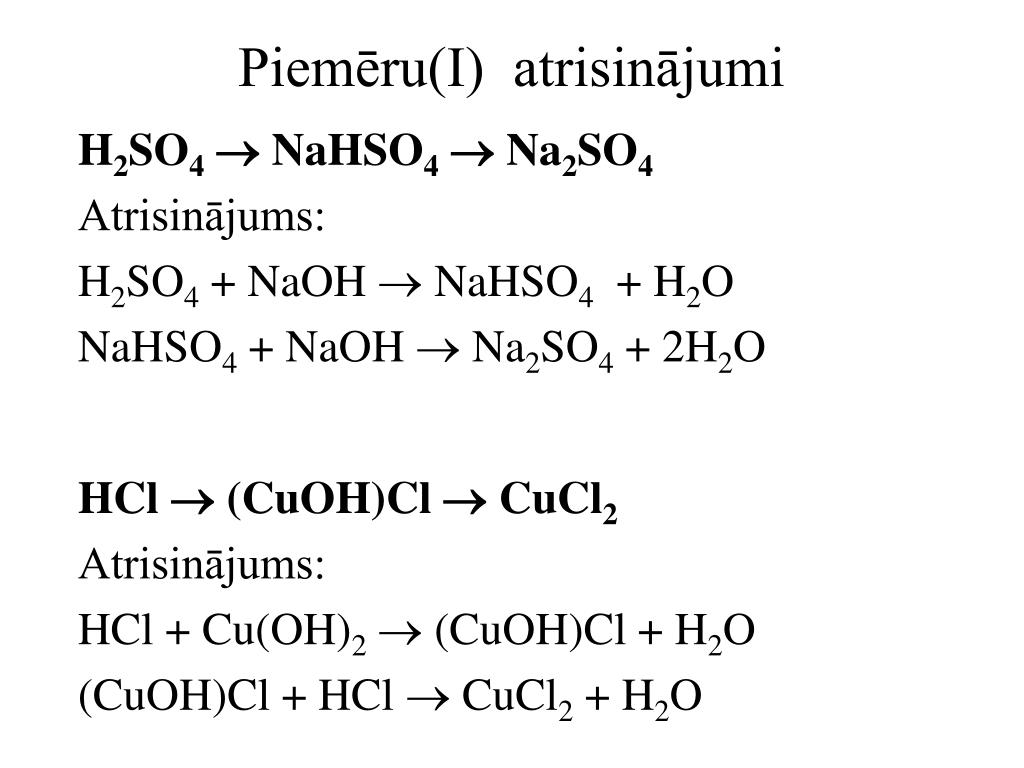
Как написать результирующее ионное уравнение для (Nh5)2SO4 NaOH = Na2SO4 Nh4 h3O
Как написать результирующее ионное уравнение для Na2CO3 (Nh5)2SO4 = Na2SO4 (Nh5)2CO3
NaCl h3SO4 в HD
Как сбалансировать h3SO4 Na2CO3 = Na2SO4 CO2 h3O
Является ли Na2SO3 кислотным, щелочным или нейтральным (растворенным в воде)?
Сбалансируйте следующие химические уравнения HNO3 + Ca(OH)2 Ca(NO3)2 + h3O и NaOH + h3SO4
Как сбалансировать h3SO4 NaHCO3 = Na2SO4 h3O CO2
Как сбалансировать: Al(NO3)3 NaOH = Al(OH)3 NaNO3
Как сбалансировать Al(NO3)3 h3SO4 = Al2(SO4)3 HNO3 (нитрат алюминия серная кислота)
QUIMICA REDOX E13 Ajuste reacción en medio ácido KMnO4 h3SO4 h3O2
▶ KMnO4 h3SO4 h3O2 = MnSO4 O2 K2SO4 h3O — АЛГЕБРАИКО МАТОДО
Как написать результирующее ионное уравнение для CuSO4 Na3PO4 = Cu3(PO4)2 Na2SO4
Как сбалансировать NaOH + h4PO4 = Na3PO4 + h3O (гидроксид натрия и фосфорная кислота)
Как написать результирующее ионное уравнение для BaCl2 h3SO4 = BaSO4 HCl
Как написать результирующее ионное уравнение для NaOH MgSO4
Категории
сумасшедший
транссексуал
плотный
мастурбация соло
просверленный
бондаж
сперма в киске
прекрасный
падчерица
пизда
крупным планом
сиськи
красивая
блондинка
кровать
кримпай зрелой
подпрыгивая
экзотика
блондинка Мамочка
черное дерево
Популярные запросы
© porn-stalker. fr, Все права защищены. Любое копирование запрещено.
fr, Все права защищены. Любое копирование запрещено.
Правила растворимости — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 238
При смешивании вещества с растворителем возможны несколько результатов. Определяющим фактором для результата является растворимость вещества, которая определяется как максимально возможная концентрация растворенного вещества. Правила растворимости помогают определить, какие вещества растворимы и в какой степени.
Влияние растворимости на реакции
В зависимости от растворимости растворенного вещества возможны три результата: 1) если в растворе меньше растворенного вещества, чем максимальное количество, которое оно способно растворить (его растворимость), то это разбавленный раствор; 2) если количество растворенного вещества точно равно его растворимости, то оно насыщено; 3) если растворенного вещества больше, чем оно может быть растворено, избыток растворенного вещества отделяется от раствора. Если этот процесс разделения включает кристаллизацию, то образуется осадок. Осаждение снижает концентрацию растворенного вещества до насыщения, чтобы повысить стабильность раствора.
Если этот процесс разделения включает кристаллизацию, то образуется осадок. Осаждение снижает концентрацию растворенного вещества до насыщения, чтобы повысить стабильность раствора.
Правила растворимости
Ниже приведены правила растворимости для обычных ионных твердых веществ. Если два правила кажутся противоречащими друг другу, предыдущее правило имеет приоритет.
- Соли, содержащие элементы I группы (Li + , Na + , K + , Cs + , Rb + ), растворимы. Есть несколько исключений из этого правила. Соли, содержащие ион аммония (NH 4 + ), также растворимы.
- Соли, содержащие нитрат-ион (NO 3 — ) обычно растворимы.
- Соли, содержащие Cl —, Br — или I —, обычно растворимы. Важными исключениями из этого правила являются галоидные соли Ag + , Pb 2 + и (Hg 2 ) 2+ .
 Так, AgCl, PbBr 2 и Hg 2 Cl 2 нерастворимы.
Так, AgCl, PbBr 2 и Hg 2 Cl 2 нерастворимы. - Большинство солей серебра нерастворимы. AgNO 3 и Ag(C 2 H 3 O 2 ) — обычные растворимые соли серебра; практически все остальные нерастворимы.
- Большинство сульфатных солей растворимы. Важные исключения из этого правила включают CaSO 4 , BaSO 4 , PbSO 4 , Ag 2 SO 4 и SrSO 4 .
- Большинство гидроксидных солей мало растворимы. Гидроксидные соли элементов I группы растворимы. Гидроксидные соли элементов II группы (Ca, Sr, Ba) малорастворимы. Гидроксидные соли переходных металлов и Al 3 + нерастворимы. Так, Fe(OH) 3 , Al(OH) 3 , Co(OH) 2 не растворимы.
- Большинство сульфидов переходных металлов плохо растворимы, включая CdS, FeS, ZnS и Ag 2 S. Нерастворимы также сульфиды мышьяка, сурьмы, висмута и свинца.

- Карбонаты часто нерастворимы. Карбонаты группы II (CaCO 3 , SrCO 3 и BaCO 3 ) нерастворимы, как и FeCO .3 и PbCO 3 .
- Хроматы часто нерастворимы. Примеры включают PbCrO 4 и BaCrO 4 .
- Фосфаты, такие как Ca 3 (PO 4 ) 2 и Ag 3 PO 4 , часто нерастворимы.
- Фториды, такие как BaF 2 , MgF 2 и PbF 2 , часто нерастворимы.
{{media(«www.youtube.com/watch?v=VJoKQ3ULCVs&NR=1»)}}
Ссылки
- Петруччи, Ральф Х., Ф. Джеффри Херринг, Джеффри Д. Мадура и Кэри Биссоннетт. Общая химия: принципы и современные приложения. 10-е изд. Река Аппер-Сэдл, Нью-Джерси: Pearson Education, 2011. Печать.
- Натан, Гарольд Д. и Чарльз Хенриксон. Химия . Нью-Йорк: Wiley, 2001. Печать.
Проблемы
1. Растворим ли FeCO 3 ?
Растворим ли FeCO 3 ?
Согласно правилу №5 карбонаты обычно нерастворимы. Следовательно, FeCO 3 может образовывать осадок .
2. Имеет ли ClO 4 — склонность к образованию осадка?
Это перхлорат, который, согласно правилу №2, скорее всего, растворим. Следовательно, не будет образовывать осадок.
3. Какое из этих веществ может образовывать осадок?
a) CaSO 4 b) поваренная соль c) AgBr
Буквы a и c могут образовывать осадки .
Относительно а) CaSO 4 , хотя сульфаты, как правило, растворимы, Правило № 5 указывает, что сульфат кальция является важным исключением из этого правила.
Для b) Правило № 1 указывает, что поваренная соль (NaCl) растворима, поскольку она является солью щелочного металла.
c) является примером двух правил, противоречащих друг другу. Правило № 4 гласит, что бромиды обычно растворимы, а Правило № 3 гласит, что соли серебра нерастворимы. Поскольку правило № 3 предшествует правилу № 4, соединение нерастворимо и образует осадок.
Поскольку правило № 3 предшествует правилу № 4, соединение нерастворимо и образует осадок.
4. Предскажите, будет ли образовываться осадок в результате этой реакции:
\[2AgNO_3 + Na_2S \rightarrow Ag_2S + 2NaNO_3 \]
Продукты реакции необходимо исследовать; если одно из образовавшихся в реакции веществ нерастворимо, выпадет осадок.
Принимая во внимание NaNO 3 , Правило №3 гласит, что нитраты обычно растворимы. Осадок этого соединения не образуется.
Далее рассмотрим Ag 2 S. Согласно Правилу №5, эти сульфиды имеют тенденцию быть нерастворимыми. Поэтому из-за этого соединения в ходе этой реакции образуется осадок .
5. Предскажите, будет ли образовываться осадок в результате этой реакции:
\[2NaOH + K_2CrO_4 \rightarrow KOH + Na_2CrO_4 \]
Еще раз рассмотрим продукты реакции: если один из них нерастворим, образуется осадок .
Первый продукт, KOH, является примером двух противоречащих друг другу правил. Хотя Правило № 5 говорит, что гидроксиды, как правило, нерастворимы, Правило № 1 утверждает, что соли катионов щелочных металлов имеют тенденцию быть растворимыми, а Правило № 1 предшествует Правилу № 5. Следовательно, это соединение не будет способствовать образованию каких-либо осадков.
Хотя Правило № 5 говорит, что гидроксиды, как правило, нерастворимы, Правило № 1 утверждает, что соли катионов щелочных металлов имеют тенденцию быть растворимыми, а Правило № 1 предшествует Правилу № 5. Следовательно, это соединение не будет способствовать образованию каких-либо осадков.
Второй продукт, Na 2 CrO 4 , также соответствует правилу № 1, которое гласит, что соли щелочных металлов склонны к растворимости.
Поскольку оба продукта растворимы, в результате этой реакции не образуется осадок.
Solubility Rules распространяется под лицензией CC BY 4.0, автором, ремиксом и/или куратором выступили Антуанетта Мурса и Кеннет В. Буш.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Лицензия
- СС BY
- Версия лицензии
- 4,0
- Показать страницу TOC
- нет на стр.


 Между исходными веществами ставим «+», а затем знак «=».
Между исходными веществами ставим «+», а затем знак «=».
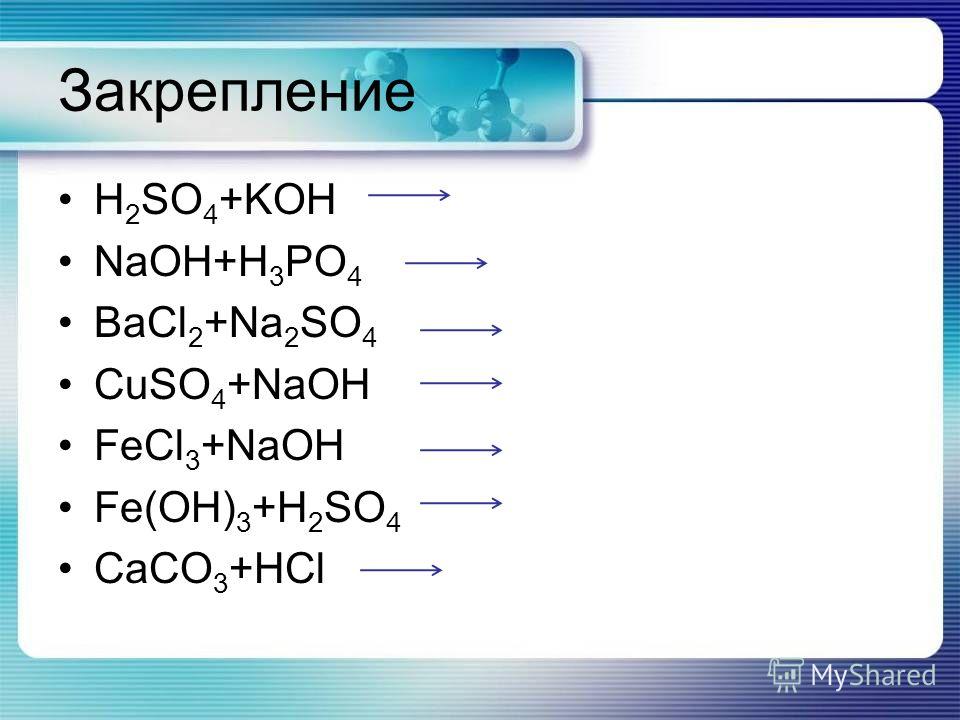
 Уравнение реакции:
Уравнение реакции: ) + NaOH(водн.) Na2SO4(водн.) + h3(ж)
) + NaOH(водн.) Na2SO4(водн.) + h3(ж)

 Так, AgCl, PbBr 2 и Hg 2 Cl 2 нерастворимы.
Так, AgCl, PbBr 2 и Hg 2 Cl 2 нерастворимы.
