Что нужно прибавить к Na3PO4 чтоб получить Ca3(PO4)2?… -reshimne.ru
Новые вопросы
Ответы
2Na3PO4 +3 CaCl2=Ca3(PO4)2 + 6NaCl
Похожие вопросы
Подскажите пожалуйста Будет ли совмещаться вода и кислород…
ОЧЕНЬ СРОЧНО!!!Предложите максимальное кол-во способов получения ZnCI2….
Нужно узнать массу растворенного вещества и массу воды в растворе известна Масса раствора 600 г а массовая доля растворенного вещества 30 %…
ОЧЕНЬ СРОЧНО!!!Предложите максимальное кол-во способов получения ZnCI2….
СРОЧНООООООООООО!!!!!!!!!!!!!!!!!!!!!. ..
..
Как бы вы разделили смесь древесных опилок и железных опилок? предложите 2 способа…
Математика
Литература
Алгебра
Русский язык
Геометрия
Английский язык
ХимияФизика
Биология
Другие предметы
История
Обществознание
Окружающий мир
География
Українська мова
Українська література
Қазақ тiлi
Беларуская мова
Информатика
Экономика
Музыка
Право
Французский язык
Немецкий язык
МХК
ОБЖ
Психология
Помощь студентам в учёбе от Людмилы Фирмаль
Здравствуйте!
Я, Людмила Анатольевна Фирмаль, бывший преподаватель математического факультета Дальневосточного государственного физико-технического института со стажем работы более 17 лет. На данный момент занимаюсь онлайн обучением и помощью по любыми предметам. У меня своя команда грамотных, сильных бывших преподавателей ВУЗов. Мы справимся с любой поставленной перед нами работой технического и гуманитарного плана. И не важно: она по объёму на две формулы или огромная сложно структурированная на 125 страниц! Нам по силам всё, поэтому не стесняйтесь, присылайте.
На данный момент занимаюсь онлайн обучением и помощью по любыми предметам. У меня своя команда грамотных, сильных бывших преподавателей ВУЗов. Мы справимся с любой поставленной перед нами работой технического и гуманитарного плана. И не важно: она по объёму на две формулы или огромная сложно структурированная на 125 страниц! Нам по силам всё, поэтому не стесняйтесь, присылайте.
Срок выполнения разный: возможно онлайн (сразу пишите и сразу помогаю), а если у Вас что-то сложное – то от двух до пяти дней.
Для качественного оформления работы обязательно нужны методические указания и, желательно, лекции. Также я провожу онлайн-занятия и занятия в аудитории для студентов, чтобы дать им более качественные знания.
Моё видео:
Вам нужно написать сообщение в Telegram . После этого я оценю Ваш заказ и укажу срок выполнения. Если условия Вас устроят, Вы оплатите, и преподаватель, который ответственен за заказ, начнёт выполнение и в согласованный срок или, возможно, раньше срока Вы получите файл заказа в личные сообщения.
После этого я оценю Ваш заказ и укажу срок выполнения. Если условия Вас устроят, Вы оплатите, и преподаватель, который ответственен за заказ, начнёт выполнение и в согласованный срок или, возможно, раньше срока Вы получите файл заказа в личные сообщения.
Стоимость заказа зависит от задания и требований Вашего учебного заведения. На цену влияют: сложность, количество заданий и срок выполнения. Поэтому для оценки стоимости заказа максимально качественно сфотографируйте или пришлите файл задания, при необходимости загружайте поясняющие фотографии лекций, файлы методичек, указывайте свой вариант.
Какой срок выполнения заказа?Минимальный срок выполнения заказа составляет 2-4 дня, но помните, срочные задания оцениваются дороже.
Как оплатить заказ?Сначала пришлите задание, я оценю, после вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
В течение 1 года с момента получения Вами заказа действует гарантия. В течении 1 года я и моя команда исправим любые ошибки в заказе.
Качественно сфотографируйте задание, или если у вас файлы, то прикрепите методички, лекции, примеры решения, и в сообщении напишите дополнительные пояснения, для того, чтобы я сразу поняла, что требуется и не уточняла у вас. Присланное качественное задание моментально изучается и оценивается.
Теперь напишите мне в Telegram или почту и прикрепите задания, методички и лекции с примерами решения, и укажите сроки выполнения. Я и моя команда изучим внимательно задание и сообщим цену.
Если цена Вас устроит, то я вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Мы приступим к выполнению, соблюдая указанные сроки и требования. 80% заказов сдаются раньше срока.
После выполнения отправлю Вам заказ в чат, если у Вас будут вопросы по заказу – подробно объясню. Гарантия 1 год. В течении 1 года я и моя команда исправим любые ошибки в заказе.
Гарантия 1 год. В течении 1 года я и моя команда исправим любые ошибки в заказе.
youtube.com/embed/ElMEic2MJ-U» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
Можете смело обращаться к нам, мы вас не подведем. Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
В заключение хочу сказать: если Вы выберете меня для помощи на учебно-образовательном пути, у вас останутся только приятные впечатления от работы и от полученного результата!
Жду ваших заказов!
С уважением
Пользовательское соглашение
Политика конфиденциальности
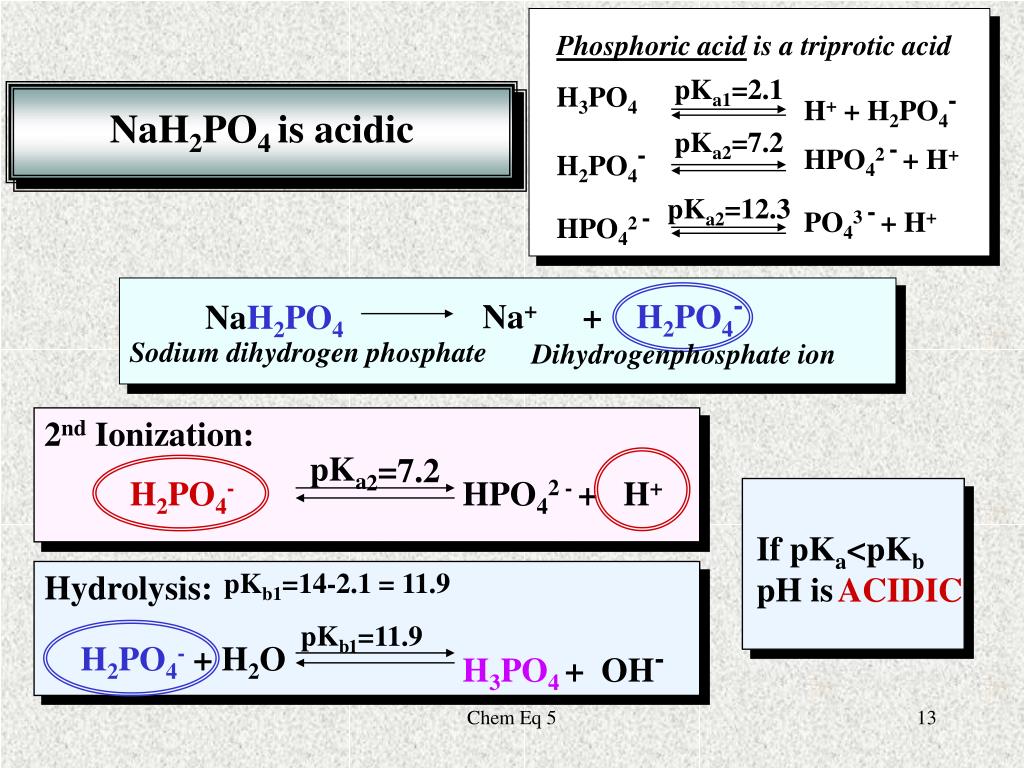
Фосфат натрия – формула, структура, типы и применение
Фосфат натрия представляет собой ионное соединение, состоящее из катиона натрия и аниона фосфата. Это соль, встречающаяся как в гидратированных, так и в безводных солях, среди которых в природе чаще встречается безводный (безводный) фосфат натрия. Химическая формула фосфата натрия: Na 3 PO 4 , молекулярная масса 163,94 г/моль. Помимо монофосфата натрия, в природе встречаются дифосфат натрия, трифосфат, тетрафосфат и полифосфаты. Поскольку это ионное соединение, оно образует кристаллические структуры. Он выглядит как белые или не совсем белые кристаллы, гранулы или, возможно, в виде порошка. Его плотность составляет 2,536 г/куб.см. Его температура кипения 373 К, как у воды, а температура плавления 1856 К.
Его плотность составляет 2,536 г/куб.см. Его температура кипения 373 К, как у воды, а температура плавления 1856 К.
Структура фосфата натрия
Фосфат натрия представляет собой ионное соединение и поэтому имеет электровалентную химическую структуру. Сам анион фосфата имеет ковалентную структуру. Атомы натрия имеют в общей сложности 11 электронов, один из которых находится на внешней оболочке, поскольку натрий является щелочным металлом. Натрий легко вытесняет крайний электрон с образованием катиона натрия. Три Na
Различные типы фосфатов натрия
Хотя тринатриймонофосфат (Na 3 PO 4 ) встречается гораздо чаще, кроме этого, встречаются многие виды фосфатов натрия. Это динатрийфосфат или динатрийгидрофосфат, мононатрийфосфат или дигидрофосфат натрия, динатрийпирофосфат и тетранатрийпирофосфат, которые имеют молекулярные формулы Na 2 HPO 4 , NaH 2 PO 4 , Na 2 9соответственно.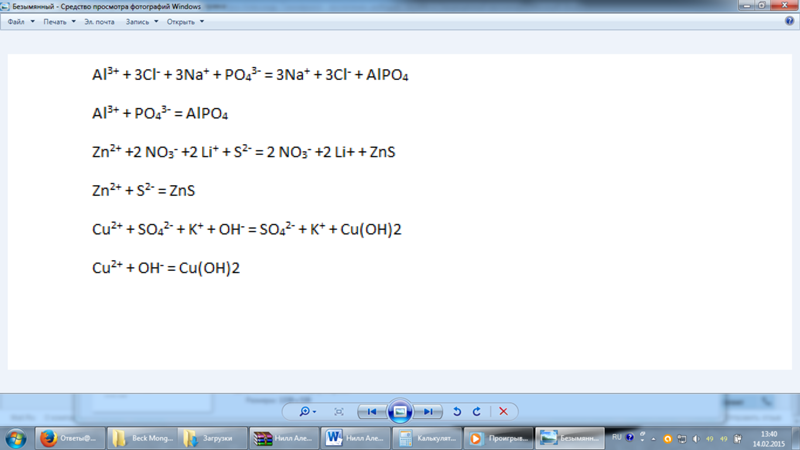
Тринатрийфосфат получают в лаборатории простой реакцией гидроксида натрия или едкого натра с фосфорной кислотой. Три молекулы гидроксида натрия нейтрализуют трехосновной ортофосфорной кислотой (H 3 PO 4 ) с получением соли тринатрийфосфата и воды.
H 3 PO 4 + 3NaOH → Na 3 PO 4 + 3H 2 O
Динатрийфосфат промышленно получают действием дикальцийфосфата на бисульфат натрия. Пирофосфат натрия получают термическим разложением монофосфата натрия.
Использование фосфата натрия в промышленности
Наиболее распространенный фосфат натрия, тринатриймонофосфат, в основном используется в качестве моющих средств, мыла и удобрений. Он действует как консервант при переработке продуктов животного происхождения. Тринатрийфосфат, наряду с динатрийфосфатом и мононатрием, используется в основном в качестве пищевых добавок. Они используются в качестве эмульгаторов в плавленых сырах в молочной промышленности. Он также используется в качестве загустителя в хлебопекарной промышленности. Пирофосфат динатрия используется в качестве буфера. Кроме того, его используют при обработке консервированных морепродуктов для сохранения их вкуса и цвета. Он также используется в кожевенной промышленности для удаления пятен со шкур. Пирофосфат тетранатрия также используется при переработке консервов в качестве пищевой добавки и консерванта. Пирофосфат тетранатрия обладает уникальным свойством удалять магний из слюны, что может уменьшить накопление зубных бляшек и кариеса. Таким образом, это соединение уникально используется среди фосфатов в зубной пасте.
Он также используется в качестве загустителя в хлебопекарной промышленности. Пирофосфат динатрия используется в качестве буфера. Кроме того, его используют при обработке консервированных морепродуктов для сохранения их вкуса и цвета. Он также используется в кожевенной промышленности для удаления пятен со шкур. Пирофосфат тетранатрия также используется при переработке консервов в качестве пищевой добавки и консерванта. Пирофосфат тетранатрия обладает уникальным свойством удалять магний из слюны, что может уменьшить накопление зубных бляшек и кариеса. Таким образом, это соединение уникально используется среди фосфатов в зубной пасте.
Неблагоприятные последствия использования фосфатов в промышленности
Фосфаты в основном ответственны за эвтрофикацию воды. Это процесс, при котором водоемы получают избыток фосфатов, которые стимулируют усиленный рост водорослей, называемый цветением водорослей. В конечном итоге это приводит к разложению водорослей, в результате чего содержание кислорода в воде снижается. Фосфаты, используемые в качестве моющих средств и мыла, в основном ответственны за эвтрофикацию, поскольку они смываются и смешиваются в прудах, реках или озерах. По этой причине использование фосфатов в качестве моющих средств или удобрений становится ограниченным.
Фосфаты, используемые в качестве моющих средств и мыла, в основном ответственны за эвтрофикацию, поскольку они смываются и смешиваются в прудах, реках или озерах. По этой причине использование фосфатов в качестве моющих средств или удобрений становится ограниченным.
Медицинское использование фосфатов
Иногда фосфаты используются при приготовлении лекарств от запоров, которые используются для опорожнения кишечника, но использование фосфатов в медицине небезопасно. Фосфаты могут увеличить риск проблем с почками в случае применения высоких доз. Этот симптом обозначается в медицинской терминологии как фосфатная нефропатия. Так что их использование в больших дозах совсем не безопасно.
Триполифосфат натрия
Полифосфат натрия имеет молекулярную формулу Na 5 Р 3 О 10 . Он имеет молекулярную массу 367,86 г/моль. Его получают путем нагревания смеси дигидрофосфата натрия и гидрофосфата динатрия. Эти два вещества конденсируются, удаляют воду и производят триполифосфат натрия.
Эти два вещества конденсируются, удаляют воду и производят триполифосфат натрия.
Знаете ли вы?
Фосфат натрия в основном изготавливается из фосфоритов шахты.
Регулярное и длительное употребление фосфата натрия становится вредным для здоровья.
Хотя FDA (Управление по санитарному надзору за качеством пищевых продуктов и медикаментов) считает фосфат натрия безопасным в обработанных пищевых продуктах, где он используется в качестве консервантов, пациентам с заболеваниями почек следует избегать продуктов, содержащих фосфат натрия.
Потребление больших доз фосфата натрия вызывает снижение плотности костей, проблемы с почками, болезни сердца и даже раннюю смерть.
При употреблении фосфата натрия в смеси с другими фосфатами это способствует обогащению организма фосфором.

Мясо, бобы, чечевица и орехи являются хорошими источниками фосфатов.
Фосфат может увеличить рост водорослей в 500 раз по сравнению с их нормальным ростом в водоеме.
Соль Грэма, соль Куррола и соль Мадрелла являются производными полифосфата.
Оральный фосфат натрия не следует использовать в качестве слабительного в возрасте до 5 лет.
Заключение
Фосфат натрия — одна из важных формул, которая используется для многих целей. Он может быть использован в медицинских целях или может быть использован в пищевых целях и для консервирования.
Натриевой фосфат
Рецепт
1 м натриевой фосфатный буфер (рН 6,0–7,2)
Смешивание 1 м 2 PO 4 (DOBASIC) и 1 M NA 2 HPO 4 (DIBASIC) и 1 M NA 2 HPO 4 (DIBASIC) и 1 M NA 2 HPO 4 (DIBASIC) и 1 M NA 2 HPO 4 (DIBASIC) и 1 м 2 HPO 4 (DIBASIC) и 1 M NAH 2 HPO 4 (DIBASIC). маточные растворы в объемах, указанных в таблице ниже, дают 1 л 1 М натрий-фосфатного буфера
желаемый рН. Для приготовления исходных растворов растворите 138 г NaH 2 PO 4 •H 2 O (одноосновного; м.м. = 138) в достаточном количестве H 2 O, чтобы получить конечный объем 1 л, и растворить 142 г Na 2 HPO 4 (двухосновный; молекулярная масса = 142) в достаточном количестве H 2 O, чтобы получить конечный объем 1 л.
маточные растворы в объемах, указанных в таблице ниже, дают 1 л 1 М натрий-фосфатного буфера
желаемый рН. Для приготовления исходных растворов растворите 138 г NaH 2 PO 4 •H 2 O (одноосновного; м.м. = 138) в достаточном количестве H 2 O, чтобы получить конечный объем 1 л, и растворить 142 г Na 2 HPO 4 (двухосновный; молекулярная масса = 142) в достаточном количестве H 2 O, чтобы получить конечный объем 1 л.
| Объем (мл) 1 М NaH 2 ПО 4 | Объем (мл) 1 М Na 2 HPO 4 | Конечный рН |
|---|---|---|
| 877 | 123 | 6,0 |
| 850 | 150 | 6,1 |
| 815 | 185 | 6,2 |
| 775 | 225 | 6,3 |
| 735 | 265 | 6,4 |
| 685 | 315 | 6,5 |
| 625 | 375 | 6,6 |
| 565 | 435 | 6,7 |
| 510 | 490 | 6,8 |
| 450 | 550 | 6,9 |
| 390 | 610 | 7,0 |
| 330 | 670 | 7,1 |
| 280 | 720 | 7,2 |
0,1 М натрий-фосфатный буфер (pH 7,4)
Добавить 3,1 г NaH 2 PO 4 •H 2 O и 10,9 г Na 2 HPO 4 (безводного) к дистиллированному объему H 4 9000, чтобы получить 1 л H 2 90. рН конечного раствора будет 7,4. Этот буфер можно хранить до 1 месяца при 4°C.
рН конечного раствора будет 7,4. Этот буфер можно хранить до 1 месяца при 4°C.
0,1 М натрий-фосфатный буфер (из 1 М запасов) при 25°C
Для приготовления 1 л 0,1 М натрий-фосфатного буфера с желаемым значением объем) с H 2 О.
| рН | Объем (мл) 1 М Na 2 HPO 4 | Объем (мл) 1 М NaH 2 PO 4 |
|---|---|---|
| 5,8 | 7,9 | 92,1 |
| 6,0 | 12,0 | 88,0 |
| 6,2 | 17,8 | 82,2 |
| 6,4 | 25,5 | 74,5 |
| 6,6 | 35,2 | 64,8 |
| 6,8 | 46,3 | 53,7 |
| 7,0 | 57,7 | 42,3 |
| 7,2 | 68,4 | 31,6 |
| 7,4 | 77,4 | 22,6 |
| 7,6 | 84,5 | 15,5 |
| 7,8 | 89,6 | 10,4 |
| 8,0 | 93,2 | 6,8 |
« Предыдущая | Следующая статья » Содержание
Эта статья
doi:10.