АТОМНАЯ МАССА | Энциклопедия Кругосвет
Содержание статьи- МЕТОДЫ ОПРЕДЕЛЕНИЯ
- Химические методы.
- Физические методы.
- Плотность газа.
- Масс-спектроскопия.
- Ядерные реакции.
- Рентгенография.
- Уточнение атомных масс.
АТОМНАЯ МАССА. Понятие об этой величине претерпевало длительные изменения в соответствии с изменением представления об атомах. Согласно теории Дальтона (1803), все атомы одного и того же химического элемента идентичны и его атомная масса – это число, равное отношению их массы к массе атома некоего стандартного элемента. Однако примерно к 1920 стало ясно, что элементы, встречающиеся в природе, бывают двух типов: одни действительно представлены идентичными атомами, а у других атомы имеют одинаковый заряд ядра, но разную массу; такие разновидности атомов были названы изотопами. Определение Дальтона, таким образом, справедливо только для элементов первого типа. Атомная масса элемента, представленного несколькими изотопами, есть средняя величина из массовых чисел всех его изотопов, взятых в процентном отношении, отвечающем их распространенности в природе.
В 19 в. в качестве стандарта при определении атомных масс химики использовали водород или кислород. В 1904 за стандарт была принята 1/16 средней массы атома природного кислорода (кислородная единица) и соответствующая шкала получила название химической. Масс-спектрографическое определение атомных масс проводилось на основе 1/16 массы изотопа 16О, и соответствующая шкала называлась физической. В 1920-х годах было установлено, что природный кислород состоит из смеси трех изотопов: 16О, 17О и 18О. В связи с этим возникли две проблемы. Во-первых, оказалось, что относительная распространенность природных изотопов кислорода немного варьирует, а значит, в основе химической шкалы лежит величина, не являющаяся абсолютной константой. Во-вторых, у физиков и химиков получались разные значения таких производных констант, как молярные объемы, число Авогадро и др. Решение вопроса было найдено в 1961, когда за атомную единицу массы (а.е.м.) была принята 1/12 массы изотопа углерода 12С (углеродная единица). (1 а.е.м., или 1D (дальтон), в СИ-единицах массы составляет 1,66057Ч10–27 кг.) Природный углерод также состоит из двух изотопов: 12С – 99% и 13С – 1%, но новые величины атомных масс элементов связаны только с первым из них. В результате была получена универсальная таблица относительных атомных масс. Изотоп 12С оказался удобным и для физических измерений.
(1 а.е.м., или 1D (дальтон), в СИ-единицах массы составляет 1,66057Ч10–27 кг.) Природный углерод также состоит из двух изотопов: 12С – 99% и 13С – 1%, но новые величины атомных масс элементов связаны только с первым из них. В результате была получена универсальная таблица относительных атомных масс. Изотоп 12С оказался удобным и для физических измерений.
МЕТОДЫ ОПРЕДЕЛЕНИЯ
Атомную массу можно определить либо физическими, либо химическими методами. Химические методы отличаются тем, что на одном из этапов в них фигурируют не сами атомы, а их комбинации.
Химические методы.
Согласно атомной теории, числа атомов элементов в соединениях относятся между собой как небольшие целые числа (закон кратных отношений, который открыт Дальтоном). Поэтому для соединения известного состава можно определить массу одного из элементов, зная массы всех других. В некоторых случаях массу соединения можно измерить непосредственно, но обычно ее находят косвенными методами. Рассмотрим оба этих подхода.
Рассмотрим оба этих подхода.
Атомную массу Al недавно определили следующим образом. Известные количества Al были превращены в нитрат, сульфат или гидроксид и затем прокалены до оксида алюминия (Al2O3), количество которого точно определяли. Из соотношения между двумя известными массами и атомными массами алюминия и кислорода (15,9)
нашли атомную массу Al. Однако прямым сравнением с атомной массой кислорода можно определить атомные массы лишь немногих элементов. Для большинства элементов их определяли косвенным путем, анализируя хлориды и бромиды. Во-первых, эти соединения для многих элементов можно получить в чистом виде, во-вторых, для их точных количественных определений в распоряжении химиков имеется чувствительный аналитический метод, основанный на сравнении их масс с массой серебра. Для этого точно определяют массу анализируемых соединений и массу серебра, необходимого для взаимодействия с ними. Атомную массу нужного элемента рассчитывают исходя из атомной массы серебра – эталонной величины в подобных определениях. Атомную массу серебра (107,870) в углеродных единицах определяли косвенным химическим методом.
Атомную массу серебра (107,870) в углеродных единицах определяли косвенным химическим методом.
Физические методы.
В середине 20 в. существовал только один физический метод определения атомных масс, сегодня наиболее широко применяют четыре.
Плотность газа.
Самый первый физический метод основывался на определении плотности газа и на том, что в соответствии с законом Авогадро равные объемы газов при одинаковых температуре и давлении содержат одинаковое число молекул. Следовательно, если определенный объем чистого СО2 имеет массу, в 1,3753 большую, чем такой же объем кислорода в тех же условиях, то молекула СО2 должна быть в 1,3753 раза тяжелее молекулы кислорода (мол. масса О2 = 31,998), т.е. масса молекулы СО2 по химической шкале равна 44,008. Если из этой величины вычесть массу двух атомов кислорода, равную 31,998, мы получим атомную массу углерода – 12,01. Чтобы получить более точное значение, необходимо ввести ряд поправок, что усложняет этот метод. Тем не менее с его помощью были получены некоторые весьма ценные данные. Так, после открытия благородных газов (He, Ne, Ar, Kr, Xe) метод, основанный на измерении плотности, оказался единственно пригодным для определения их атомных масс.
Тем не менее с его помощью были получены некоторые весьма ценные данные. Так, после открытия благородных газов (He, Ne, Ar, Kr, Xe) метод, основанный на измерении плотности, оказался единственно пригодным для определения их атомных масс.
Масс-спектроскопия.
Вскоре после Первой мировой войны Ф.Астон создал первый масс-спектроскоп для точного определения массовых чисел различных изотопов и тем самым открыл новую эру в истории определения атомных масс. Сегодня существует два основных типа масс-спектроскопов: масс-спектрометры и масс-спектрографы (последним является, например, прибор Астона). Масс-спектрограф предназначен для изучения поведения потока электрически заряженных атомов или молекул в сильном магнитном поле. Отклонение заряженных частиц в этом поле пропорционально отношению их масс к заряду, а регистрируют их в виде линий на фотопластинке. Сравнивая положения линий, отвечающих определенным частицам, с положением линии для элемента с известной атомной массой, можно с достаточной точностью определить атомную массу нужного элемента.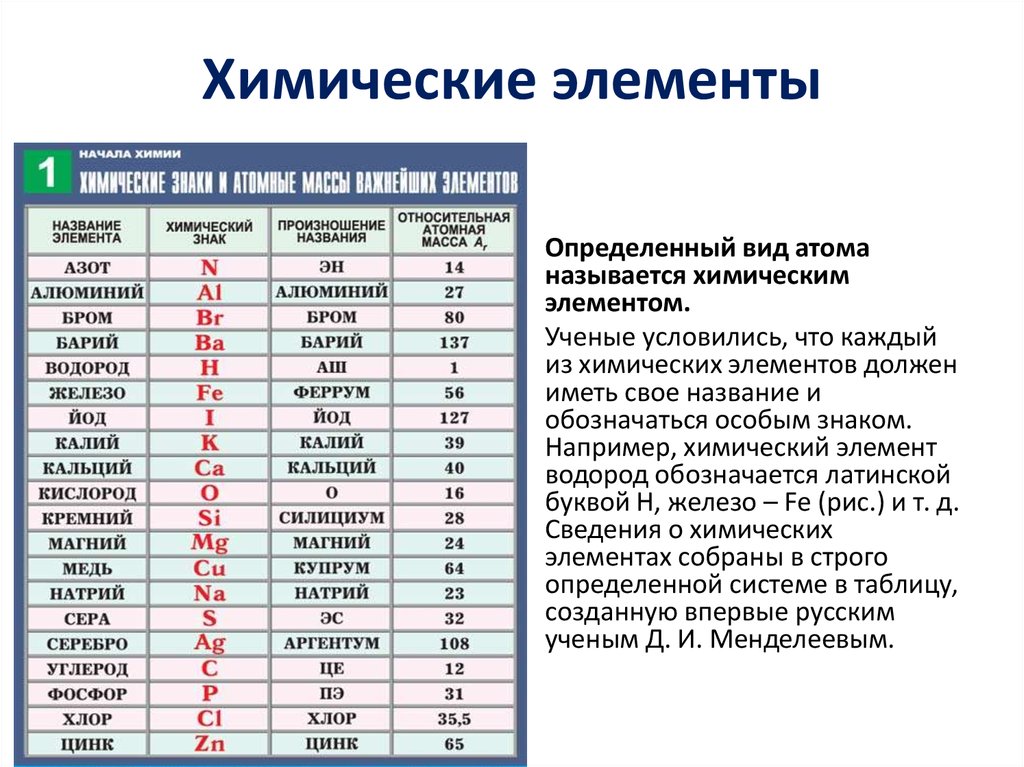 Хорошей иллюстрацией метода является сравнение массы молекулы СН4 (метана) с массовым числом самого легкого изотопа кислорода 16О. Одинаково заряженные ионы метана и 16О одновременно впускают в камеру масс-спектрографа и регистрируют их положение на фотопластинке. Различие в положении их линий отвечает разности масс 0,036406 (по физической шкале). Это значительно более высокая точность, чем может дать любой химический метод.
Хорошей иллюстрацией метода является сравнение массы молекулы СН4 (метана) с массовым числом самого легкого изотопа кислорода 16О. Одинаково заряженные ионы метана и 16О одновременно впускают в камеру масс-спектрографа и регистрируют их положение на фотопластинке. Различие в положении их линий отвечает разности масс 0,036406 (по физической шкале). Это значительно более высокая точность, чем может дать любой химический метод.
Если исследуемый элемент не имеет изотопов, то определение его атомной массы не составляет особого труда. В противном случае необходимо определить не только массу каждого изотопа, но и их относительное содержание в смеси. Эту величину не удается определить с достаточной точностью, что ограничивает применение масс-спектрографического метода для нахождения атомных масс изотопических элементов, особенно тяжелых. Недавно с помощью масс-спектрометрии удалось установить с высокой точностью относительное содержание двух изотопов серебра, 107Ag и 109Ag. Измерения были выполнены в Национальном бюро стандартов США. Используя эти новые данные и более ранние измерения масс изотопов серебра, уточнили значение атомной массы природного серебра. Теперь эта величина считается равной 107,8731 (химическая шкала).
Измерения были выполнены в Национальном бюро стандартов США. Используя эти новые данные и более ранние измерения масс изотопов серебра, уточнили значение атомной массы природного серебра. Теперь эта величина считается равной 107,8731 (химическая шкала).
Ядерные реакции.
Для определения атомных масс некоторых элементов можно использовать соотношение между массой и энергией, полученное Эйнштейном. Рассмотрим реакцию бомбардировки ядер 14N быстрыми ядрами дейтерия с образованием изотопа 15N и обычного водорода 1Н:
14N + 2H = 15N + 1H + Q
В результате реакции выделяется энергия Q = 8 615 000 эВ, которая в соответствии с уравнением Эйнштейна эквивалентна 0,00948 а.е.м. Значит, масса 14N + 2H превышает массу 15N + 1H на 0,00948 а.е.м., и если мы знаем массовые числа трех любых изотопов – участников реакции, то можем найти массу четвертого. Метод позволяет определить разность массовых чисел двух изотопов с большей точностью, чем масс-спектрографический.
Метод позволяет определить разность массовых чисел двух изотопов с большей точностью, чем масс-спектрографический.
Рентгенография.
Этим физическим методом можно определять атомные массы веществ, которые при обычной температуре образуют регулярную кристаллическую решетку. Метод основан на связи между атомной (или молекулярной) массой кристаллического вещества, его плотностью, числом Авогадро и неким коэффициентом, который определяют из расстояний между атомами в кристаллической решетке. Необходимо провести прецизионные измерения двух величин: постоянной решетки рентгенографическими методами и плотности методом пикнометрии. Применение метода ограничивается трудностями получения чистых совершенных кристаллов (без вакансий и дефектов любого рода).
Уточнение атомных масс.
Все измерения атомных масс, которые были выполнены более 20 лет назад, проводились химическими методами или методом, основанным на определении плотности газов. В последнее же время данные, получаемые масс-спектрометрическими и изотопными методами, совпадают с такой высокой точностью, что Международная комиссия по атомным массам решила скорректировать атомные массы 36 элементов, причем 18 из них не имеют изотопов.
См. также АВОГАДРО ЧИСЛО.
Атомная масса Atomic Mass
Что говорит словарь?
Почему бы не заглянуть в словарь? Он описывает «Атомная масса» как:
Средняя масса всех встречающихся в природе атомов химического элемента
Согласно википедии…
Как Получать Пасси…
Please enable JavaScript
Как Получать Пассивный Доход 4000 Долларов В Месяц?
Атомная масса (ma или m) — это масса атома. Хотя единицей массы СИ является килограмм, атомная масса часто выражается в единицах, не относящихся к СИ, единицах атомной массы (а.е.м.) или унифицированной массе (u) или дальтоне, где 1 а.е.м., или 1 ед., Или 1 Да определяется как 1⁄ 12 массы одного атома углерода-12 в состоянии покоя. Протоны и нейтроны ядра составляют почти всю общую массу атомов, а электрон …
А теперь пора поговорить о:
- Определение атомной массы
- Что означает атомная масса
- Какая формула атомной массы
- Где находится атомная масса
- Атомная масса определяется
- Атомная масса измеряется в
- Символ атомной массы
- Как была открыта атомная масса
- Атомная масса и молярная масса
- Атомная масса против атомного веса
- Атомная масса против молекулярной массы
- Атомная масса против молекулярной массы
- Может ли атомная масса элемента меняться
- Чему равна атомная масса
- Как измеряется атомная масса
- Как рассчитывается средняя атомная масса
- Сколько атомных единиц массы в одном грамме
- Как рассчитать атомную массу по изотопам
- Как найти среднюю атомную массу изотопов
Определение атомной массы
Атомная масса — это количество вещества, содержащегося в атоме элемента.
Он выражается как кратное одной двенадцатой массы атома углерода-12, 1,992646547 × 10-23 грамма, что соответствует атомной массе 12 единиц.
На этой шкале 1 атомная единица массы (а.е.м.) соответствует 1,660539040 × 10-24 г.
Что означает Атомная масса
Атомная масса.
Основным физическим свойством материи является масса. Атомная масса называется массой атома или молекулы. Для определения средней массы атомов и молекул и решения задач с использованием стехиометрии используется атомная масса.
Что такое формула Атомная масса
Масса протонов + Масса нейтронов + Масса электронов.
Есть три способа рассчитать атомную массу, в зависимости от обстоятельств каждого.
Где находится атомная масса
Ядро
Более 99.
9 процентов массы атома находится в ядре.
Протоны и нейтроны в центре атома примерно в 2000 раз тяжелее электронов, вращающихся вокруг него.
Атомная масса определяется
массовое число = протоны + нейтроны
Вместе количество протонов и количество нейтронов определяют массовое число элемента: массовое число = протоны + нейтроны.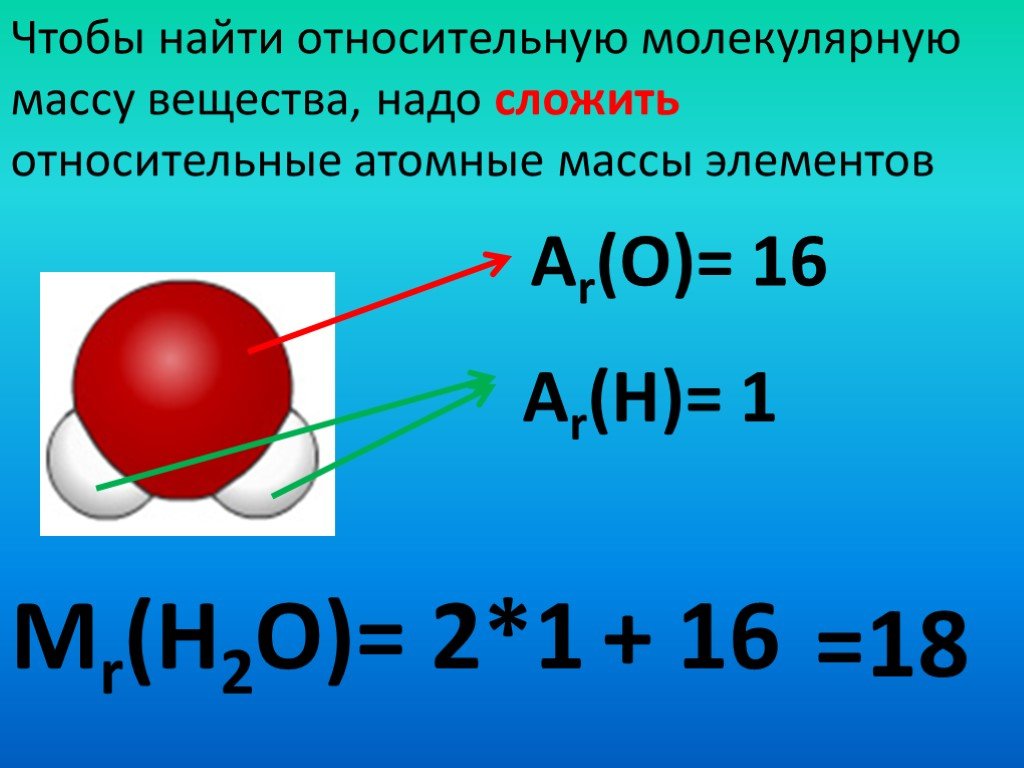
Если вы хотите подсчитать, сколько нейтронов имеет атом, вы можете просто вычесть количество протонов или атомный номер из массового числа.
Атомная масса измеряется в
атомная единица массы (а.е.м., также известная как дальтон, D)
Атомная масса элемента — это средняя масса атомов элемента, измеренная в единицах атомной массы (а.е.м., также известная как дальтон, D).
Атомная масса — это средневзвешенное значение всех изотопов этого элемента, в котором масса каждого изотопа умножается на содержание этого конкретного изотопа.
Символ атомной массы
U (по 3 источникам).
Массовое число (символ A, от немецкого слова Atomgewicht «атомный вес»), также называемое массовым числом атома или числом нуклонов, представляет собой общее количество протонов и нейтронов (вместе известных как нуклоны) в атомном ядре.
Как была открыта атомная масса
1869 г.
Менделеев официально представил свои открытия Русскому химическому обществу в 1869 году.
Менделеев обнаружил, что атомные веса элементов с подобными свойствами либо очень близки (как, например, в случае осмия, иридия и платины), либо увеличиваются через определенные промежутки времени (как в случае кальция, рубидия и цезия).
Джон Далтон
В 1803 году английский ученый Джон Дальтон опубликовал статью, в которой присвоил водороду вес 1, а затем использовал соединения водорода для определения относительного веса других элементов.
Атомная масса и молярная масса
Молярная масса — это масса одного моля вещества.
Молярная масса — это масса одного моля вещества.
Атомная масса — это масса одной отдельной единицы вещества.
атомная масса вещества в а.е.м. Численно эквивалентна массе в граммах одного моля этого вещества.
Атомная масса против атомного веса
Атомная масса — это масса атома, тогда как атомный вес — это средневзвешенное значение встречающихся в природе
Атомный вес — это средневзвешенное значение встречающихся в природе изотопов.
Итак, опять же, мнемоника для запоминания разницы между атомной массой и атомным весом: атомная масса — это масса атома, тогда как атомный вес — это средневзвешенное значение встречающихся в природе изотопов.
Атомная масса против молекулярной массы
Атомная масса — это масса отдельного атома.
Молекулярная масса соединения относится к сумме всех атомных масс атомов, образующих соединение.
Молекулярная масса — это мера массы молекулы.
Его также называют атомным весом.
Атомная масса против молекулярной массы
В качестве еще одного существенного различия между атомной массой и молекулярной массой единицей измерения атомной массы является а.е.м., а единицей измерения молекулярной массы — г / моль.
Более того, существует разница между атомной массой и молекулярной массой в способе вычисления этих двух величин.
Может ли Атомная масса элемента меняться
Количество нейтронов для данного элемента может быть разным.
Напротив, количество нейтронов для данного элемента может варьироваться. Формы одного и того же атома, различающиеся только числом нейтронов, называются изотопами. Вместе количество протонов и количество нейтронов определяют массовое число элемента: массовое число = протоны + нейтроны.
Что Атомная масса равно
Протоны плюс нейтроны.
Атомная масса равна числу. Правильный ответ — протоны плюс нейтроны.
Пояснение: Количество протонов плюс количество нейтронов составляют почти всю массу атома, потому что масса электронов ничтожно мала.
Как измеряется атомная масса
Сложение количества нейтронов и протонов или электронов данного элемента.
Атомная масса элемента — это средняя масса атомов элемента, измеренная в единицах атомной массы (а.е.м., также известная как дальтон, D).
Атомная масса — это средневзвешенное значение всех изотопов этого элемента, в котором масса каждого изотопа умножается на содержание этого конкретного изотопа.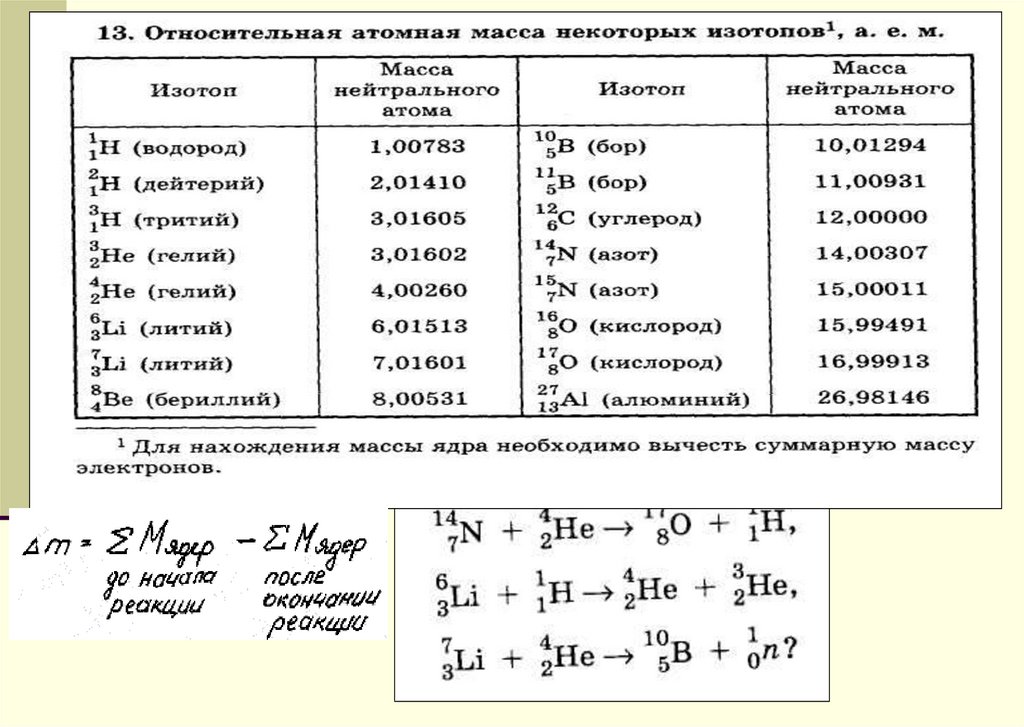
Как рассчитывается средняя атомная масса
Суммируя массы изотопов элемента, каждый из которых умножается на его естественное содержание на Земле.
Средняя атомная масса элемента рассчитывается путем суммирования масс изотопов элемента, каждый из которых умножается на его естественное содержание на Земле.
При любых расчетах массы элементов или соединений всегда используйте среднюю атомную массу, которую можно найти в периодической таблице.
Сколько атомных единиц массы в одном грамме
Один AMU эквивалентен 1,66 x 10-24 грамма.
Один грамм эквивалентен 6.022 x 1023 AMU.
Как рассчитать Атомная масса по изотопам
Вычитание атомного номера из номера изотопа. Наконец, добавьте атомный номер и количество нейтронов.
Чтобы вычислить атомную массу, начните с определения атомного номера элемента, который находится над элементом в периодической таблице.
Затем найдите количество нейтронов в ядре, вычтя атомный номер из номера изотопа.
Наконец, сложите атомный номер и количество нейтронов, чтобы получить атомную массу.
Как найти среднее значение Атомная масса изотопов
умножьте фракцию на массовое число для каждого изотопа, затем сложите их вместе
Чтобы вычислить среднюю атомную массу, умножьте долю на массовое число для каждого изотопа, а затем сложите их вместе.
Всякий раз, когда мы проводим расчеты массы элементов или соединений (комбинаций элементов), мы всегда используем средние атомные массы.
Цитата
Если вам нужно включить факт или информацию в задание или эссе, вы также должны указать, где и как вы нашли эту информацию (Атомная масса).
Это повышает доверие к вашей статье и иногда требуется в высших учебных заведениях.
Чтобы упростить себе жизнь (и цитирование), просто скопируйте и вставьте приведенную ниже информацию в свое задание или эссе:
Luz, Gelson. Атомная масса. Материалы Блог. Gelson Luz.com. дд мм гггг. URL.
Теперь замените дд, мм и гггг на день, месяц и год, когда вы просматриваете эту страницу. Также замените URL-адрес фактическим URL-адресом этой страницы. Этот формат цитирования основан на MLA.
Также замените URL-адрес фактическим URL-адресом этой страницы. Этот формат цитирования основан на MLA.
Как взвесить атом? | Atomic Mass
Когда вы совершаете покупку по ссылкам на нашем сайте, мы можем получать партнерскую комиссию. Вот как это работает.
Копия масс-спектрометра, которым пользовался физик Дж.Дж. Томпсон в 1910-х годах. (Изображение предоставлено: Creative Commons | Джефф Даль)Обновление: Эта статья была обновлена 11 сентября 2017 г. Рэйчел Росс, участником Live Science.
Представьте себе, что атом падает на весы. Когда вы это делаете, клетки кожи толщиной в триллионы атомов отслаиваются от вашей руки и порхают вокруг нее, погребая ее в куче атомных двойников. Между тем, влага и атмосферные частицы летают вокруг, подпрыгивая на шкале и за ее пределами, и посылая чувствительную к атомам иглу, хлещущую туда-сюда, как стеклоочиститель. И кстати, как вам вообще удалось изолировать один атом?
Если подумать, вы не можете взвесить атом на традиционных весах.
Вместо этого физики более века использовали прибор под названием масс-спектрометр. Изобретен в 1912 году физиком Дж.Дж. Томсона и постепенно совершенствуясь, она работает следующим образом: во-первых, физики «ионизируют» газ атомов, стреляя в газ пучком частиц, которые либо добавляют электроны к атомам в нем, либо выбивают несколько их электронов, в зависимости от тип используемого пучка частиц. Это дает атомам — теперь известным как «ионы» — суммарный отрицательный или положительный электрический заряд.
Затем ионы отправляются через трубку, в которой они подвергаются воздействию электрического и магнитного полей. Оба этих поля воздействуют на ионы, и силы этих двух сил пропорциональны заряду ионов (нейтральные атомы не чувствуют сил). Электрическая сила заставляет ионы изменять скорость, а магнитная сила искривляет их траекторию.
Затем ионы собираются в «чашках Фарадея» на конце трубки, создавая ток в проводах, прикрепленных к чашкам. Измеряя, где и когда поток ионов попадает в цилиндры Фарадея, физики могут определить, насколько они должны были ускориться и в каком направлении в результате действия электрических и магнитных сил. Наконец, согласно второму закону Ньютона F=ma, преобразованному в m=F/a, физики делят общую силу, действующую на ионы, на их результирующее ускорение, чтобы определить массу ионов.
Наконец, согласно второму закону Ньютона F=ma, преобразованному в m=F/a, физики делят общую силу, действующую на ионы, на их результирующее ускорение, чтобы определить массу ионов.
Масса электрона также была определена с помощью масс-спектрометра — в этом случае электроны просто сами пропускались через прибор. Это измерение позволяет физикам определить массу атома, когда он имеет правильное количество электронов, а не их недостаток или избыток.
С помощью масс-спектрометра физики определили массу атома водорода как 1,660538921(73) × 10 -27 кг, где цифры в скобках неизвестны с полной уверенностью. Это достаточно точно для большинства целей.
Хорошие вибрации
Другой способ определить массу атома — измерить частоту его вибрации и решить в обратном порядке, согласно статье Джона Р. Пратта 2014 года в Journal of Measurement Science.
Вибрация атома может быть определена несколькими способами, включая атомную интерферометрию, в которой атомные волны когерентно расщепляются, а затем рекомбинируются, по словам Алекса Кронина, доцента кафедры физики Аризонского университета; и частотные гребенки, которые используют спектрометрию для измерения вибраций. Затем частоту можно использовать с постоянной Планка для определения энергии атома (E = hv, где h — постоянная Планка, а v — частота). Затем эту энергию можно использовать со знаменитым уравнением Эйнштейна E = mc 2 , чтобы найти массу атома, когда он преобразован в m = E/c 2 .
Затем частоту можно использовать с постоянной Планка для определения энергии атома (E = hv, где h — постоянная Планка, а v — частота). Затем эту энергию можно использовать со знаменитым уравнением Эйнштейна E = mc 2 , чтобы найти массу атома, когда он преобразован в m = E/c 2 .
Третий способ измерения массы атома описан в статье 2012 года, опубликованной в журнале Nature Nanotechnology J. Chaste, et al. Этот метод предполагает использование углеродных нанотрубок при низких температурах и в вакууме и измерение изменения частоты вибрации в зависимости от массы прикрепленных к ним частиц. Эта шкала может измерять массы до одного йоктограмма, что меньше массы одного протона (1,67 йоктограмма).
Испытание проводилось с 150-нанометровой углеродной нанотрубкой, подвешенной над траншеей. Нанотрубку натягивали, как гитарную струну, и это создавало естественную частоту вибрации, которую затем сравнивали с характером вибрации, когда нанотрубка вступала в контакт с другими частицами. Количество массы, находящейся на нанотрубке, изменит производимую частоту.
Количество массы, находящейся на нанотрубке, изменит производимую частоту.
Ye olde mass
А что было до масс-спектрометров, когда химики не знали, что такое атом? Затем они в первую очередь измеряли веса атомов, составляющих различные элементы, с точки зрения их относительных масс, а не их фактических масс. В 1811 году итальянский ученый Амедео Авогадро понял, что объем газа (при заданном давлении и температуре) пропорционален числу составляющих его атомов или молекул, независимо от того, какой это газ. Этот полезный факт позволил химикам сравнивать относительный вес равных объемов различных газов, чтобы определить относительные массы составляющих их атомов.
Они измерили атомный вес в единицах атомной массы (а.е.м.), где 1 а.е.м. равнялась одной двенадцатой массы атома углерода-12. Когда во второй половине XIX века химики использовали другие средства для приблизительного определения числа атомов в заданном объеме газа — знаменитую постоянную, известную как число Авогадро, — они начали производить грубые оценки массы отдельного атома путем взвешивания объема всего газа и делением на число.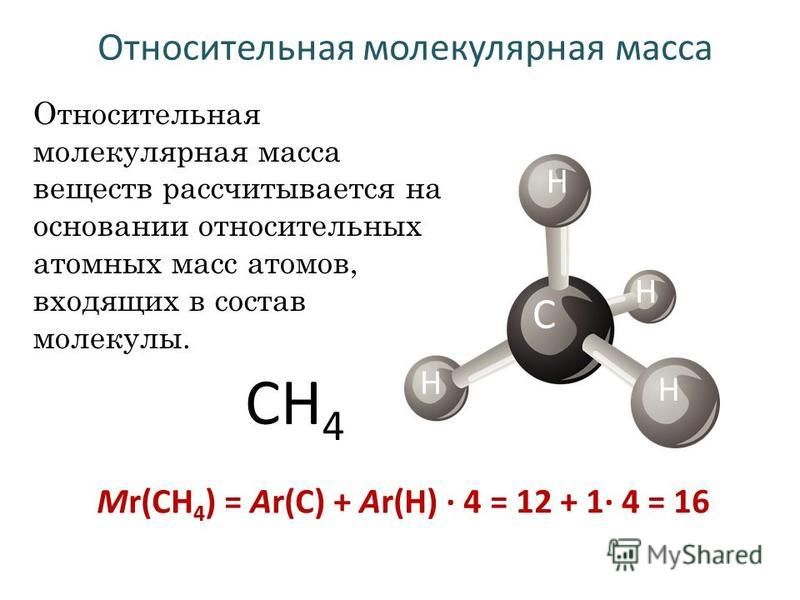
Разница между атомным весом, массой и числом
Многие люди используют термины вес и масса взаимозаменяемо, и даже большинство весов предлагают варианты в таких единицах, как фунты и килограммы. И хотя масса и вес связаны, это не одно и то же. При обсуждении атомов многие люди используют атомный вес и атомную массу как синонимы, хотя это и не совсем одно и то же.
Атомная масса определяется как количество протонов и нейтронов в атоме, где каждый протон и нейтрон имеют массу приблизительно 1 а.е.м. (1,0073 и 1,0087 соответственно). Электроны внутри атома настолько малы по сравнению с протонами и нейтронами, что их масса ничтожно мала. Атом углерода-12, который до сих пор используется в качестве эталона, содержит шесть протонов и шесть нейтронов при атомной массе в двенадцать а.е.м. Различные изотопы одного и того же элемента (один и тот же элемент с разным количеством нейтронов) не имеют одинаковой атомной массы. Углерод-13 имеет атомную массу 13 а.е.м.
Атомный вес, в отличие от веса объекта, не имеет ничего общего с гравитацией. Это безразмерная величина, представляющая собой отношение атомных масс встречающихся в природе изотопов элемента к массе одной двенадцатой массы углерода-12. Для таких элементов, как бериллий или фтор, которые имеют только один встречающийся в природе изотоп, атомная масса равна атомному весу.
Это безразмерная величина, представляющая собой отношение атомных масс встречающихся в природе изотопов элемента к массе одной двенадцатой массы углерода-12. Для таких элементов, как бериллий или фтор, которые имеют только один встречающийся в природе изотоп, атомная масса равна атомному весу.
У углерода есть два встречающихся в природе изотопа – углерод-12 и углерод-13. Атомные массы каждого из них равны 12,0000 и 13,0034 соответственно, и, зная их распространённость в природе (98,89 и 1,110% соответственно), атомная масса углерода составляет около 12,01. Атомный вес очень похож на массу углерода-12 из-за того, что большая часть углерода в природе состоит из изотопа углерода-12.
Атомный вес любого атома можно найти, умножив распространенность изотопа элемента на атомную массу элемента, а затем сложив результаты вместе. Это уравнение можно использовать с элементами с двумя или более изотопами:
- Carbon-12: 0,9889 x 12,0000 = 11,8668
- Carbon-13: 0,0111 x 13,0034 = 0,1443
- 11,8668 + 0,1443 = 12,0111 = атомная весу Carbon
, и там все еще связано с ними.
Дополнительный отчет Рэйчел Росс, автора Live Science.
Дополнительные ресурсы
- Международная национальная конференция лабораторий стандартов: как взвесить все, от атомов до яблок, с использованием пересмотренной SI
- APS Physics: More Power to Atom Interferometry
- Khan Academy: изотопы
Натали Волховер была штатным автором журнала Live Science с 2010 по 2012 год, а в настоящее время является старшим автором статей по физике и редактором журнала Quanta. Она имеет степень бакалавра физики Университета Тафтса и изучала физику в Калифорнийском университете в Беркли. Вместе с сотрудниками Quanta Волховер получила Пулитцеровскую премию 2022 года за пояснения к своей работе по строительству космического телескопа Джеймса Уэбба.
Атомная масса | Безграничная химия |
Средняя атомная масса
Средняя атомная масса элемента представляет собой сумму масс его изотопов, умноженных на их естественное содержание.
Цели обучения
Рассчитайте среднюю атомную массу элемента, зная его изотопы и их распространенность в природе
Ключевые выводы
Ключевые моменты
- В ядре элемента может быть разное количество нейтронов, но всегда одинаковое количество протонов. Варианты элемента с разными нейтронами имеют разную массу и называются изотопами.

- Средняя атомная масса элемента рассчитывается путем суммирования масс изотопов элемента, умноженных на их естественное содержание на Земле.
- При любых расчетах массы элементов или соединений всегда используйте среднюю атомную массу, которую можно найти в периодической таблице.
Ключевые термины
- массовое число : общее количество протонов и нейтронов в атомном ядре.
- природное изобилие : Обилие определенного изотопа, естественным образом присутствующего на планете.
- средняя атомная масса : Масса, рассчитанная путем суммирования масс изотопов элемента, умноженных на их естественное содержание на Земле.
Атомный номер элемента определяет идентичность элемента и означает количество протонов в ядре одного атома. Например, элемент водород (самый легкий элемент) всегда будет иметь в ядре один протон. Элемент гелий всегда будет иметь два протона в своем ядре.
Изотопы
Однако атомы одного и того же элемента могут иметь разное количество нейтронов в ядре. Например, существуют стабильные атомы гелия, которые содержат один или два нейтрона, но оба атома имеют два протона. Эти разные типы атомов гелия имеют разную массу (3 или 4 атомные единицы массы), и их называют изотопами. Для любого данного изотопа сумма числа протонов и нейтронов в ядре называется массовым числом. Это потому, что каждый протон и каждый нейтрон весят одну атомную единицу массы (а.е.м.). Сложив количество протонов и нейтронов и умножив их на 1 а.е.м., можно рассчитать массу атома. Все элементы существуют в виде набора изотопов. Слово «изотоп» происходит от греческих слов «isos» (что означает «один и тот же») и «topes» (что означает «место»), потому что элементы могут занимать одно и то же место в периодической таблице, но иметь разное субатомное строение.
Атом лития : Стилизованный атом лития-7: 3 протона (красный), 4 нейтрона (черный) и 3 электрона (синий). (У лития также есть другой, более редкий изотоп, содержащий всего 2 нейтрона.)
(У лития также есть другой, более редкий изотоп, содержащий всего 2 нейтрона.)
Расчет средней атомной массы
Средняя атомная масса элемента представляет собой сумму масс его изотопов, каждая из которых умножается на его естественное содержание (десятичное число, связанное с процентом атомов этого элемента, принадлежащих к данному изотопу).
Средняя атомная масса = f 1 M 1 + f 2 M 2 +… + f n M n где f – доля, представляющая естественное содержание изотопа, а M – массовое число (масса) изотопа изотоп.
Среднюю атомную массу элемента можно найти в периодической таблице, обычно под символом элемента. Когда доступны данные о естественном содержании различных изотопов элемента, легко вычислить среднюю атомную массу.
- Что касается гелия, то на каждый миллион изотопов гелия-4 приходится примерно один изотоп гелия-3; поэтому средняя атомная масса очень близка к 4 а.
 е.м. (4,002602 а.е.м.).
е.м. (4,002602 а.е.м.). - Хлор состоит из двух основных изотопов: один с 18 нейтронами (75,77% атомов природного хлора), а другой с 20 нейтронами (24,23% атомов природного хлора). Атомный номер хлора 17 (у него в ядре 17 протонов).
Чтобы рассчитать среднюю массу, сначала преобразуйте проценты в дроби (разделите их на 100). Затем рассчитайте массовые числа. Изотоп хлора с 18 нейтронами имеет содержание 0,7577 и массовое число 35 а.е.м. Чтобы вычислить среднюю атомную массу, умножьте дробь на массовое число для каждого изотопа, а затем сложите их вместе.
Средняя атомная масса хлора = (0,7577
⋅ \ CDOT %
35 AMU) + (0,2423
⋅ \ CDOT %
37 AMU) = 35,48 AMU
Другой пример для расчета ATAMIC OF BORON BORON BORON BORON BORON BORON BORON (B), который имеет два изотопа: B-10 с естественным содержанием 19,9% и B-11 с содержанием 80,1%. Следовательно,
Средняя атомная масса бора = (0,199
⋅\cdot⋅
10 а. е.м.) + (0,801
е.м.) + (0,801
⋅\cdot⋅
11 а.е.м.) = 10,80 а.е.м.0003
Всякий раз, когда мы делаем массовые расчеты с участием элементов или соединений (комбинаций элементов), мы всегда используем средние атомные массы.
Масс-спектрометрия для измерения массы
Масс-спектрометрия — это мощный метод характеризации, который идентифицирует элементы, изотопы и соединения на основе отношения массы к заряду.
Цели обучения
Определение основного применения масс-спектрометра
Ключевые выводы
Ключевые моменты
- Масс-спектрометры работают с образцами в газообразном состоянии.
- Образцы газа ионизируются источником ионов, который добавляет или удаляет заряженные частицы (электроны или ионы). Примеры источников ионов включают индуктивно связанную плазму и электронный удар.
- Масс-анализаторы разделяют ионизированные образцы в соответствии с отношением их массы к заряду.
 Времяпролетный и квадрупольный анализаторы являются примерами масс-анализаторов.
Времяпролетный и квадрупольный анализаторы являются примерами масс-анализаторов. - Массу частицы можно очень точно рассчитать на основе таких параметров, как время, необходимое для прохождения определенного расстояния, или угол ее перемещения.
- Масс-спектрометры настолько точны, что могут определять типы элементов в соединениях или измерять разницу между массами разных изотопов одного и того же атома.
Ключевые термины
- ионизация : Любой процесс, приводящий к диссоциации нейтрального атома или молекулы на заряженные частицы (ионы).
- плазма : Состояние вещества, состоящее из частично ионизированного газа, обычно при высоких температурах.
- отношение массы к заряду : Лучший способ разделения ионов в масс-спектрометре. Это число рассчитывается путем деления веса иона на его заряд.
Масс-спектрометрия (МС) — это мощный метод, позволяющий идентифицировать широкий спектр химических соединений. Он используется для определения массы частицы, элементного состава образца и химической структуры более крупных молекул.
Он используется для определения массы частицы, элементного состава образца и химической структуры более крупных молекул.
Масс-спектрометры разделяют соединения на основе свойства, известного как отношение массы к заряду: масса атома, деленная на его заряд. Сначала образец ионизируется. Ионизация — это процесс превращения атома или молекулы в ион путем добавления или удаления заряженных частиц, таких как электроны или ионы. Когда образец ионизируется, его пропускают через какое-либо электрическое или магнитное поле. Массу частицы можно рассчитать на основе таких параметров, как время, необходимое для прохождения определенного расстояния, или угол ее перемещения.
Схема масс-спектрометра : Образец загружается в масс-спектрометр, где он подвергается испарению и ионизации. Компоненты образца ионизируются одним из множества способов, например, с помощью ионизирующей нити. Ионы разделяются при анализе магнитными полями. Их разделяют по соотношению массы к заряду.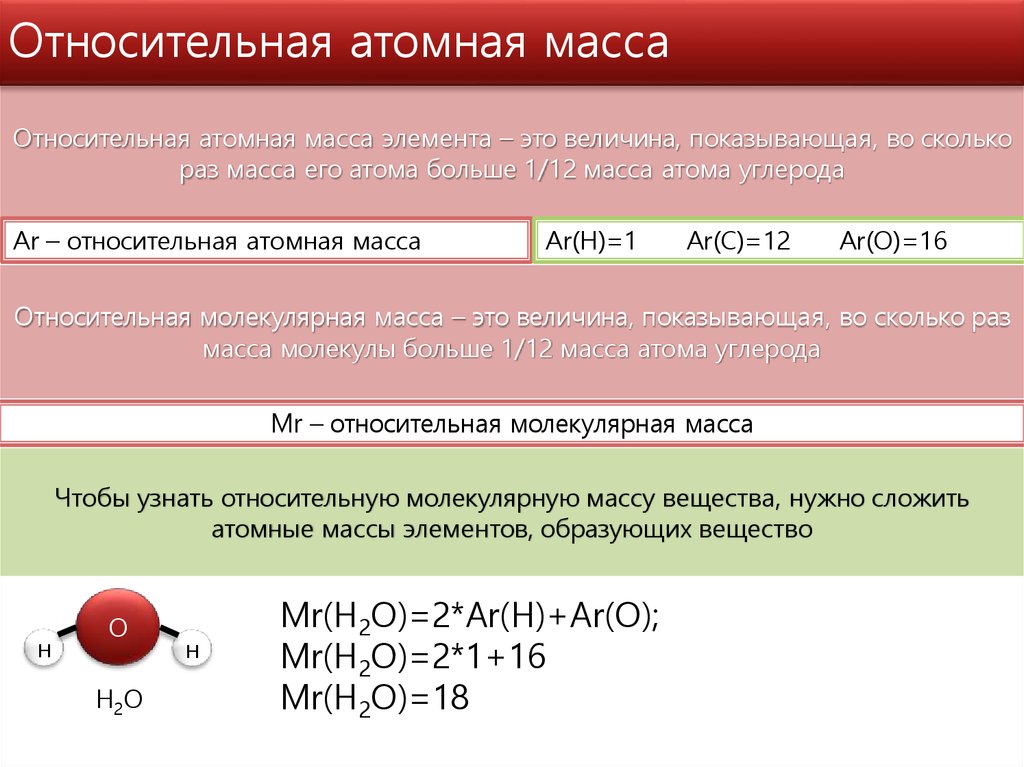 Ионы обнаруживаются, как правило, количественным методом, таким как коллектор Фарадея. Ионный сигнал преобразуется в масс-спектр.
Ионы обнаруживаются, как правило, количественным методом, таким как коллектор Фарадея. Ионный сигнал преобразуется в масс-спектр.
Состав приборов для масс-спектрометрии (МС)
Приборы для МС состоят из двух основных компонентов:
- Источник ионов, который может преобразовывать молекулы образца в ионы
- Масс-анализатор, который сортирует ионы по массе с помощью электромагнитных полей
Существует множество методов ионизации и обнаружения соединений.
Ионизирующие соединения
Пламя с индуктивно связанной плазмой (ICP) : Изображение пламени ICP через зеленое стекло сварщика.
Источник ионов — это часть масс-спектрометра, которая ионизирует соединение. В зависимости от информации, необходимой для масс-спектрометрического анализа, могут использоваться различные методы ионизации. Например, наиболее распространенным источником ионов для анализа элементов является индуктивно-связанная плазма (ИСП). В ICP «пламя» плазменного газа с температурой 10 000 градусов по Цельсию используется для распыления молекул образца и отделения внешних электронов от этих атомов.
В ICP «пламя» плазменного газа с температурой 10 000 градусов по Цельсию используется для распыления молекул образца и отделения внешних электронов от этих атомов.
Плазма обычно генерируется из аргона. Плазменный газ в целом электрически нейтрален, но значительное количество его атомов ионизируются высокой температурой.
Электронный удар (ЭИ) — еще один метод получения ионов. В ЭУ образец нагревается до тех пор, пока он не станет газом. Затем он проходит через пучок электронов. Этот высокоэнергетический луч отрывает электроны от молекул образца, оставляя после себя положительно заряженные радикалы.
Масс-анализаторы
Масс-анализаторы разделяют ионы в соответствии с отношением их массы к заряду. Существует много типов масс-анализаторов. У каждого есть свои сильные и слабые стороны, в том числе:
- насколько точно они могут измерять аналогичные отношения массы к заряду
- диапазон масс и концентраций образцов, которые они могут измерить.

Например, времяпролетный (TOF) анализатор использует электрическое поле для ускорения ионов при том же потенциале, а затем измеряет время, необходимое им для достижения детектора. Поскольку все частицы имеют одинаковый заряд, их скорости зависят только от их масс, и более легкие ионы достигнут детектора первыми.
Времяпролетный масс-анализатор : Схема времяпролетного масс-анализатора.
Другой тип детектора — квадрупольный. Здесь ионы проходят через четыре параллельных стержня, на которые подается переменное электрическое напряжение. При изменении поля ионы реагируют, следуя сложным путям. В зависимости от приложенного напряжения через анализатор будут проходить только ионы с определенным отношением массы к заряду. Все остальные ионы будут потеряны при столкновении со стержнями.
Использование масс-спектрометра для измерения массы
Вот как масс-спектрометр будет анализировать образец хлорида натрия (поваренной соли).
- В источнике ионов образец испаряется (превращается в газ) и ионизируется с образованием ионов натрия (Na + ) и хлорида (Cl — ).
- Атомы и ионы натрия имеют только один изотоп и массу около 23 а.е.м.
- Атомы и ионы хлора бывают двух изотопов с массой приблизительно 35 а.е.м. (при естественном содержании около 75 процентов) и приблизительно 37 а.е.м. (при естественном содержании около 25 процентов).
- Часть масс-анализатора спектрометра содержит электрические и магнитные поля, которые воздействуют на ионы, проходящие через эти поля. Угол, под которым ион движется через поля, зависит от отношения его массы к заряду: более легкие ионы меняют направление сильнее, чем более тяжелые.
- Потоки отсортированных ионов проходят от анализатора к детектору, который регистрирует относительное содержание каждого типа ионов. Эта информация используется для определения химического состава исходного образца (т. е. того, что в образце присутствуют как натрий, так и хлор), а также его изотопного состава (отношение хлора-35 к хлору-37).

Лицензии и авторство
Контент под лицензией CC, совместно используемый ранее
- Курирование и доработка. Предоставлено : Boundless.com. Лицензия : CC BY-SA: Attribution-ShareAlike
Лицензионный контент CC, конкретное указание авторства
- Введение в химию онлайн/Измерения и атомная структура. Предоставлено : Wikibooks. Лицензия : CC BY-SA: Attribution-ShareAlike
- Атомная масса. Предоставлено : Википедия. Лицензия : CC BY-SA: Attribution-ShareAlike
- Средняя атомная масса. Предоставлено : Википедия. Лицензия : CC BY-SA: Attribution-ShareAlike
- естественное изобилие. Предоставлено : Википедия. Лицензия : CC BY-SA: Attribution-ShareAlike
- Безграничный.
 Предоставлено : Безграничное обучение. Лицензия : CC BY-SA: Attribution-ShareAlike
Предоставлено : Безграничное обучение. Лицензия : CC BY-SA: Attribution-ShareAlike - изотоп. Предоставлено : Викисловарь. Лицензия : CC BY-SA: Attribution-ShareAlike
- массовый номер. Предоставлено : Викисловарь. Лицензия : CC BY-SA: Attribution-ShareAlike
- Файл: Stylised Lithium Atom.svg — Википедия, бесплатная энциклопедия. Предоставлено : Википедия. Лицензия : Общественное достояние: Авторское право не известно
- Масс-спектр. Предоставлено : Википедия. Лицензия : CC BY-SA: Attribution-ShareAlike
- Джастин Лоу и Эндрю Р. Бэррон, Принципы масс-спектрометрии и современные приложения. 18 сентября 2013 г. Предоставлено : OpenStax CNX. Расположен по адресу : https://cnx.org/contents/[email protected].
 Лицензия : CC BY: Attribution
Лицензия : CC BY: Attribution - Ионизированный. Предоставлено : Википедия. Лицензия : CC BY-SA: Attribution-ShareAlike
- Безграничный. Предоставлено : Безграничное обучение. Лицензия : CC BY-SA: Attribution-ShareAlike
- плазма. Предоставлено : Викисловарь. Лицензия : CC BY-SA: Attribution-ShareAlike
- ионизация. Предоставлено : Викисловарь. Лицензия : CC BY-SA: Attribution-ShareAlike
- Файл: Stylised Lithium Atom.svg — Википедия, бесплатная энциклопедия. Предоставлено : Википедия. Лицензия : Общественное достояние: неизвестно Copyright
- Схемы масс-спектрометра. Предоставлено : Википедия. Лицензия : CC BY-SA: Attribution-ShareAlike
- Джастин Лоу и Эндрю Р.



 е.м. (4,002602 а.е.м.).
е.м. (4,002602 а.е.м.). Времяпролетный и квадрупольный анализаторы являются примерами масс-анализаторов.
Времяпролетный и квадрупольный анализаторы являются примерами масс-анализаторов.

 Предоставлено : Безграничное обучение. Лицензия : CC BY-SA: Attribution-ShareAlike
Предоставлено : Безграничное обучение. Лицензия : CC BY-SA: Attribution-ShareAlike  Лицензия : CC BY: Attribution
Лицензия : CC BY: Attribution 