1) Укажите окислитель и восстановитель в следующих реакциях: Br2+Ki- KBr+i2; Br2+CL2+h3O- HCl+HBrO3 2) Определите вещества А,В,С и подберите коэффициенты в ОВР методом электронного баланса. i2+h3- A A+NaOH- h3O+B B+CL2- i2+C 3) составьте полные уравнения реакций: Fe+h3SO4- FESO4+? Cu+AgNO3- Cu(NO3)2+? И назовите окислитель и восстановитель в ОВР.
Последние вопросы
Химия
2 минуты назад
Яка маса спирту утвориться при гідролізі 60 л стену з масовою часткою домішок 10%?Химия
47 минут назад
Розмістіть оксиди у порядку зростання ступеня окиснення хімічних елементів,сполучених з Оксигеном А)Li2O Б)CO2 В)B2O3 Г)CaO52 минут назад
Обчисліть масові частки Карбону і Гідрогену в молекулі ацетилену.
Химия
52 минут назад
Вкажіть класи речовин, що є ізомерними між собою: А) спирти та естери Б) естери та кислоти В) кислоти та солі Г) кетони та альдегідиХимия
1 час назад
Составить ионное уравнение для реакции ном5 и уравнять методом электронного баланса уравнен2 N2-Nh4-NO-NO2-HNO3-Zn(NO3)2Химия
1 час назад
Дано маса кисню 48 г. Знайти об*єм, кількість речовини, кількість молекул, атомів СРОЧНО!!!Химия
1 час назад
Тетраборат натрия и гидроксид натрия одно и тоже или нетХимия
2 часа назад
Розташуйте назви простих речовин у послідовності збільшення їхніх молярних мас 1 фтор 2 неон 3 азот 4 озонХимия
2 часа назад
Розташуйте газоподібні речовини послідовно за зменшенням відносної густини за воднем 1 азот 2 неон 3 нітроген(ІІ) оксид NO 4 кисеньХимия
2 часа назад
написати формулу сполуки Алюмінію і Сульфуру IІ (з поясненням як це зробити)Химия
2 часа назад
Напишите уравнения реакций, при помощи которых можно осуществить превращения: Fe → FeO → FeCl2 → Fe(OH)2 →FeSO4 → Fe(OH)2 ПОМОГИТЕ СРОЧНО НУЖНО!!!!Химия
3 часа назад
Для речовини СН3 ─ СН2 ─ С ≡С ─ СН3 написати два ізомери. Назвіть кожну з речовин.
Назвіть кожну з речовин.Химия
3 часа назад
Плотность паров алкана в 50 раз выше, чем у водорода, у этого алкана сколько изомеров. Буду рад за ответХимия
3 часа назад
Химия 7 классХимия
3 часа назад
Химия 9 класс, решение задачи
Все предметы
English
United States
Polski
Polska
Bahasa Indonesia
Indonesia
English
India
Türkçe
Türkiye
English
Philippines
Español
España
Русский
Россия
How much to ban the user?
1 hour 1 day
Как решить реакцию
- Дом
- Органическая химия
- Чистая ионизация
- Кислоты и основания
- Окислительно-восстановительный потенциал
НЕФТЯНАЯ буровая установка!
Окисление — это потеря, восстановление — это приобретение
- Окисление и восстановление можно определить несколькими способами, один из которых — с точки зрения электронов.

- Окислитель – это агент, который способствует окислению, позволяя частицам окисляться, теряя электроны. Они делают это, принимая электроны сами, и в процессе они восстанавливаются.
- Восстановитель – это агент, который способствует восстановлению, позволяя видам восстанавливаться за счет приобретения электронов. Они делают это, отдавая электроны сами, и в процессе они окисляются.
степени окисления
ЧРЕЗВЫЧАЙНО ВАЖНО – КЛЮЧ К РЕШЕНИЮ РЕДОКС-УРАВНЕНИЙ
- Чтобы отслеживать, что теряет электроны, а что приобретает, мы присваиваем степени окисления.
- Если в ходе реакции степень окисления элемента становится более положительной, то элемент окислился, и наоборот.
- Степень окисления — это число электронов, которое атом теряет или имеет тенденцию терять при образовании рассматриваемого вещества.
- Если атом приобретает или имеет тенденцию к присоединению электронов, то степень окисления отрицательна.

важные правила
- Степень окисления элемента в несвязанном состоянии (как свободного элемента) всегда равна нулю.
- Сумма степеней окисления в нейтральном веществе всегда равна нулю.
- В ионе сумма степеней окисления равна заряду иона.
- Некоторые элементы имеют одну и ту же степень окисления многократно:
- Группа IA всегда +1
Группа IIA всегда +2
F всегда -1
O почти всегда -2 (перекиси O равно -1)
H почти всегда +1 (H равно -1 в сочетании с металлами) - В бинарном соединении с металлами
элементы VIIA группы составляют –1
группа VIA составляют –2
группа VA составляют – 3.
полуреакции!
- Это включает рассмотрение (только на бумаге) окисления и восстановления как двух отдельных процессов, уравновешивание этих полуреакций, а затем их объединение для получения сбалансированного уравнения для общей реакции.

- Назначьте степени окисления, чтобы определить, что окисляется, а что восстанавливается.
- Напишите полуреакции окисления и восстановления.
- Уравновешивание каждой полуреакции:
a. Уравновешивание элементов, отличных от H и O.
b. Уравновешивание O добавлением h3O.
c. Баланс Н путем добавления Н+.
d.Уравновешивание заряда путем добавления электронов. - Умножьте полуреакции на целые числа так, чтобы число полученных и потерянных электронов было одинаковым.
- Добавьте полуреакции, вычтя то, что появляется с обеих сторон.
- Убедитесь, что уравнение сбалансировано по массе.
- Убедитесь, что уравнение сбалансировано в зависимости от заряда.
пример задачи
Br2 + KI → KBr + I2
- Числа окисления: Br = 0, K = +1, I = -1 → K = +1, Br-1, K = +1 = 0
- Br восстанавливается, I окисляется
- Полуреакция окисления: 2I- → I2 + 2e-
- Полуреакция восстановления: Br2 + 2e- → 2Br-
- КОНЕЧНАЯ: Br2 + 2I- → I2 + 2KBr
Галогены в водном растворе и реакции их замещения | Эксперимент
- Пять из пяти
Этот классный эксперимент или демонстрация исследует некоторые химические свойства галогенов, сравнивая цвета трех галогенов в водном растворе и в неполярном растворителе, а также наблюдая за их отбеливающими свойствами и реакциями замещения
Галогены в небольшой степени реагируют с водой, образуя кислые растворы с отбеливающими свойствами. Они также вступают в окислительно-восстановительные реакции с галогенидами металлов в растворе, вытесняя менее реакционноспособные галогены из их соединений. Эти реакции замещения используются для установления порядка реакционной способности в группе 17 периодической таблицы Менделеева.
Они также вступают в окислительно-восстановительные реакции с галогенидами металлов в растворе, вытесняя менее реакционноспособные галогены из их соединений. Эти реакции замещения используются для установления порядка реакционной способности в группе 17 периодической таблицы Менделеева.
Эта серия простых экспериментов иллюстрирует некоторые химические свойства галогенов после ознакомления с физическими свойствами элементов группы 17. Это может быть сделано как демонстрация или как эксперимент класса.
Исследование растворимости галогенов в неполярном растворителе может быть опущено или показано только в качестве демонстрации.
Если занятие проводится в виде демонстрации, оно должно занять около 15 минут. Если это делается в качестве эксперимента в классе, вы должны выделить 30 минут.
Оборудование
Аппарат
- Защита глаз
- Штатив для 10 пробирок
- Пробирки x10
- Пробковые или резиновые пробки, 4 шт.

- Пластиковые пипетки-капельницы x 6
- Белая пятнистая плитка
- Белая плитка
- Стеклянный стержень
- Бумажные полотенца или салфетки
Химикаты
- Около 10 см 3 каждого из следующих растворов галогенов в закрытых пробирках (см. примечания 1 и 2):
- Хлорная вода, 0,1% (вес/объем) (ВРЕДНО)
- Бромная вода, 0,1% (вес/объем) (ВРЕДНО)
- Раствор йода, 0,1 М
- Половина пробирки с 0,1 М растворами каждого из следующих веществ:
- Калий хлорид
- Бромид калия
- Калия йодид
- Универсальная индикаторная бумага (полоски около 2 см), 3 шт.
Дополнительный
- Циклогексан (ЛЕГКОВОСПЛАМЕНЯЕМЫЙ, ВРЕДНЫЙ, ОПАСНЫЙ ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ) или другой подходящий неполярный растворитель, около 10 см 3 (см. примечание 1)
Заметки о химических веществах
- Каждая группа учащихся должна быть снабжена закупоренными пробирками, содержащими около 10 см 3 каждого из водных растворов галогенов и один раствор циклогексана (по желанию).

- Растворы галогенов могут быть дополнительно разбавлены, чтобы свести к минимуму количество выделяемых паров хлора или брома, но они не должны быть разбавлены настолько, чтобы их характерные цвета не были четко видны в пробирках (для хлорной воды может потребоваться белый фон).
- По окончании экспериментов все смеси и растворы должны быть возвращены в подходящий контейнер для отходов в вытяжном шкафу для безопасной утилизации.
Примечания по охране труда и технике безопасности
- Прочтите наше стандартное руководство по охране труда и технике безопасности.
- Всегда используйте защитные очки.
- Позаботьтесь о том, чтобы ограничить воздействие паров хлора и бромной воды на учащихся. У некоторых учащихся с респираторными заболеваниями может проявляться аллергическая реакция на хлор, начало которой может быть отсрочено.
- Хлорированная вода, Cl 2 (водн.) – см. карточку опасности CLEAPSS HC022b и книгу рецептов CLEAPSS RB025.
 Сам раствор НИЗКИЙ ОПАСЕН, но газообразный хлор (ТОКСИЧНЫЙ, ОПАСНЫЙ ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ) улетучивается, поэтому маркировка ВРЕДНЫЙ была бы разумной.
Сам раствор НИЗКИЙ ОПАСЕН, но газообразный хлор (ТОКСИЧНЫЙ, ОПАСНЫЙ ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ) улетучивается, поэтому маркировка ВРЕДНЫЙ была бы разумной. - Бромная вода, Br 2 (водн.), (ВРЕДЕН) – см. CLEAPSS Hazcard HC015b и CLEAPSS Сборник рецептов RB017.
- Раствор йода, I 2 (водн.) — см. карту опасности CLEAPSS HC054 и книгу рецептов CLEAPSS RB050. Раствор йода на самом деле представляет собой йод, растворенный в водном растворе йодида калия.
- Растворы хлорида калия, KCl (водн.), бромида калия, KBr (водн.) и йодида калия, KI (водн.) представляют НИЗКУЮ ОПАСНОСТЬ — см. карту опасности CLEAPSS HC047b и книгу рецептов CLEAPSS RB068. Соли натрия можно использовать, если соли калия недоступны. Концентрацию раствора йодида калия следует отрегулировать таким образом, чтобы при добавлении хлорной воды он давал раствор светло-коричневого цвета. Если реагенты слишком концентрированы, вместо коричневого раствора часто образуется черный осадок йода.

- Циклогексан, C 6 H 12 (l), (ЛЕГКО ОГНЕОПАСНО, ВРЕДНО, ОПАСНО ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ) – см. карточку опасности CLEAPSS HC045b.
Процедура
Галогены в воде и углеводородном растворителе (дополнительно)- Налейте около 2 см 3 каждого из водных растворов галогенов в отдельные пробирки. Добавьте в каждую пробирку равные объемы углеводородного растворителя, закройте пробирку и, удерживая большой палец над пробкой, встряхните смесь, несколько раз перевернув пробирку.
- Дайте осесть двум слоям. Наблюдайте и записывайте цвет каждого слоя. Может потребоваться еще раз встряхнуть пробирки, чтобы больше галогена перешло из воды в углеводородный слой.
- Поместите лист универсальной индикаторной бумаги на белую плитку. Перенесите каплю хлорной воды на бумагу с помощью стеклянной палочки.
 Наблюдайте и записывайте цвет бумаги.
Наблюдайте и записывайте цвет бумаги. - Протрите стеклянный стержень и плитку бумажным полотенцем или салфеткой. Положите на плитку свежий лист индикаторной бумаги и с помощью стеклянной палочки перенесите на нее каплю бромной воды. Обратите внимание на цвет бумаги.
- Повторите шаг 2, используя раствор йода.
- Используя пластиковую пипетку, капните по две капли раствора хлора в каждую из трех лунок на пятне, как показано ниже. Таким же образом и с помощью чистой пластиковой пипетки для каждого раствора добавьте в пятнистую плитку бромную воду и раствор йода.
Источник: Королевское химическое общество
С помощью пластиковой пипетки добавьте хлорную воду, бромную воду и раствор йода в углубления на пластинке для пятен.
- Добавьте по две капли раствора хлорида калия в каждую из трех лунок в столбце 1 плитки. Наблюдайте и записывайте любые происходящие изменения цвета.

- Добавьте по две капли раствора бромида калия в каждую из трех лунок в столбце 2 плитки. Наблюдайте и записывайте любые происходящие изменения цвета.
- Добавьте по две капли раствора йодида калия в каждую из трех лунок в столбце 3 плитки. Наблюдайте и записывайте любые происходящие изменения цвета.
Дополнительно
- Для реакций, в которых предполагается образование брома или йода, реакцию можно повторить с 2 см 3 каждого раствора в пробирке, а затем добавить гексан для подтверждения присутствия брома или йод.
Учебные заметки
Для записи результатов можно использовать таблицу результатов, подобную приведенной ниже. Он был завершен с ожидаемыми наблюдениями.
| Colour after shaking with hydrocarbon solvent | Effect on indicator paper | Reaction with potassium chloride solution | Reaction with potassium bromide solution | Reaction with potassium iodide solution | |
|---|---|---|---|---|---|
| Chlorine water | Водный слой: от бледно-желто-зеленого до бесцветного Углеводородный слой: от бесцветного до бледно-желто-зеленого | Краснеет, затем быстро обесцвечивается | Нет реакции | Появляется желто-оранжевый цвет брома | Появляется коричневый цвет йода |
| Бромная вода | Водный слой: от желто-оранжевого до бесцветного Углеводородный слой: от бесцветного до бледно-желто-оранжевого | Краснеет, затем медленно обесцвечивается | Нет реакции | Нет реакции | Цвет темнеет от желто-оранжевого до коричневого |
| Раствор йода | Водный слой: от коричневого до бесцветного Углеводородный слой: от бесцветного до фиолетового | Бумага окрашена в коричневый цвет | Нет реакции | Нет реакции | Нет реакции |
Галогены более растворимы в углеводороде и перемещаются в этот верхний слой при встряхивании с углеводородным растворителем. Для хлора и брома цвет не меняется. Вам может понадобиться белый фон, чтобы увидеть цвет раствора хлора. Однако для йода характерно изменение цвета от коричневого в воде до пурпурного в углеводородном слое.
Для хлора и брома цвет не меняется. Вам может понадобиться белый фон, чтобы увидеть цвет раствора хлора. Однако для йода характерно изменение цвета от коричневого в воде до пурпурного в углеводородном слое.
Если между раствором галогена и раствором галогенида не происходит реакции замещения, может наблюдаться некоторое осветление цвета раствора, что можно объяснить эффектом разбавления.
Позаботьтесь о том, чтобы ограничить воздействие паров хлора и бромной воды на учащихся. У некоторых учащихся с респираторными заболеваниями может проявляться аллергическая реакция на хлор, начало которой может быть отсрочено.
Йод является наименее растворимым из галогенов в воде. Он более растворим в растворе йодида калия, поэтому «раствор йода» здесь на самом деле является йодом в растворе йодида калия.
Обратите внимание учащихся на сходство цвета паров йода с его цветом в неполярном растворителе. Полярные молекулы воды взаимодействуют с молекулами йода, изменяя длину волны света, который они поглощают.
Все три галогена реагируют с водой с образованием сильной кислоты (HX) и слабой кислоты (HOX), которая обладает отбеливающими свойствами и является окислителем.
X 2 (водн.) + H 2 O(ж) → HX(водн.) + HOX(водн.)
Степень реакции уменьшается вниз по группе 17. С йодом она настолько мала, что кислая и отбеливающая свойства раствора в этом эксперименте не проявляются.
В реакциях замещения хлор вытесняет бром и йод из их соединений, а бром вытесняет йод. Например:
Cl 2 (водн.) + 2KI (водн.) → I 2 (водн.) + 2KCl (водн.)
Следовательно, порядок реакционной способности следующий: хлор > бром > йод. Более продвинутая обработка идентифицирует галогены как окислители, принимающие электрон с образованием ионов галогенидов:
Cl 2 (водн.) + 2I — (водн.) → I 2 (водн.) + 2Cl — (aq)
Вопреки мнению многих студентов, эта реакция не имеет ничего общего с реакционной способностью калия, «захватывающего» хлор.


 Назвіть кожну з речовин.
Назвіть кожну з речовин.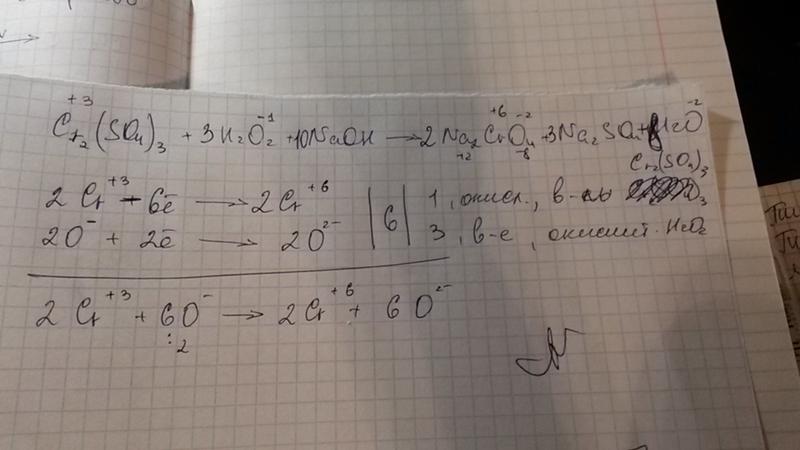



 Сам раствор НИЗКИЙ ОПАСЕН, но газообразный хлор (ТОКСИЧНЫЙ, ОПАСНЫЙ ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ) улетучивается, поэтому маркировка ВРЕДНЫЙ была бы разумной.
Сам раствор НИЗКИЙ ОПАСЕН, но газообразный хлор (ТОКСИЧНЫЙ, ОПАСНЫЙ ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ) улетучивается, поэтому маркировка ВРЕДНЫЙ была бы разумной.
 Наблюдайте и записывайте цвет бумаги.
Наблюдайте и записывайте цвет бумаги.