«Помогите решить тест пожалуйста?» — Яндекс Кью
Популярное
Сообщества
- Кислотным оксидом является
1) I2O5
2) CO 3) ZnO 4) Na2
O
- Массовая доля серы в сульфате натрия равна
1) 22,5% 2) 34,3% 3) 45,1% 4) 66,5%
- Электроотрицательность брома больше, чем электроотрицательность
1) хлора 2) кремния 3) фтора 4) кислорода
- Такую же степень окисления, как и в CuS, сера имеет в соединении
1) h3
SО4
2) h3
S 3) SO3
4) Li2
SO3
- Такую же степень окисления, как и в SO2
, сера имеет в соединении
1) K2
SO4
2) h3
SO3
3) (Nh5
)2
S 4) SO3
- В каком из соединений степень окисления серы равна -2?
1) K2
SO3
2) h3
SO4
3) (Nh5
)2
S 4) Fe2
(SO4
)3
- Одинаковый вид химической связи имеет молекула кислорода и
1) водорода 2) воды 3) сульфида магния 4) оксида магния
- В каких соединениях атомы кислорода и серы имеют одинаковое значение
валентности?
1) h3
S и P2
O5
2) h3
SO3
и NO 3)h3
SO4
и P2
O3
4) CuSO4
и NO2
- Степень окисления, на одну единицу больше, чем сера в соединении SO2
, хлор
имеет в соединении
1) KClO4
2) KClO 3) KClO3
4) KClO2
10 Какой вид химической связи в молекуле оксида йода(VII)?
1) ионная 2) ковалентная полярная
3) ковалентная неполярная 4) металлическая
- Оснόвному и кислотному оксидам соответствуют формулы
1) CaO и Cl2O7 2) CaCl2 и h3SiO3 3) Ca(OH)2 и CO 4)CaO и h3SiO2
Часть 2
- Для качественного определения ионов, находящихся в растворе бромида
меди(II), можно использовать
1) фенолфталеин
2) раствор нитрата серебра
3) раствор хлорида калия
4) раствор гидроксида натрия
5) оксид алюминия
При выполнении заданий 13 и 14 к каждому элементу первого столбца
подберите соответствующий элемент из второго столбца. Выбранные
Выбранные
цифры запишите под соответствующими буквами таблицы. Цифры
в ответе могут повторяться.
- Установите соответствие между молекулярным и сокращённым ионным
уравнением реакции.
МОЛЕКУЛЯРНОЕ УРАВНЕНИЕ РЕАКЦИИ
СОКРАЩЁННОЕ ИОННОЕ
УРАВНЕНИЕ РЕАКЦИИ
А) Fe2O3 + 6HCl = 2FeCl3 + 3h3O
Б) FeBr3 + 3KOH= Fe(OH)3 + 3KBr
В) Fe(OH)2 + 2HBr = Fe(Br)2 +2h3O
1)Fe(OH)2 + 2H+
= Fe2+ +h3O
2)Fe2O3 + 6H+
= 2Fe3+ + 3h3O
3)Fe2+ + 2OH–
= Fe(OH)2
4)К
+
- Cl–
= КCl
5)Fe3+ + 3OH–
= Fe(OH)3
6)Fe2+ + SO4
2 − = FeSO4
14 Установите соответствие между уравнением реакции и формулой вещества, являющегося окислителем в данной реакции.
УРАВНЕНИЕ РЕАКЦИИ ОКИСЛИТЕЛЬ
А)2Fe + F2= 2FeF3
Б) Cl2 + 2KBr= 2KCl + Br2
В)3I2 + 3h3O = 5HI + HIO3
1)Fe
2)F2
3) Cl2
4) KBr
5) I2
Часть 3
- Используя метод электронного баланса, составьте уравнение реакции,
соответствующее схеме превращений
KOH + Cl2 → KCl + KClO3 + h3O
Определите окислитель и восстановитель.
- Дана схема превращений:
Cl2 → HCl → MgCl2 → AgCl
Напишите молекулярные уравнения реакций, с помощью которых можно
осуществить указанные превращения. Для третьего превращения составьте
сокращённое ионное уравнение реакции. Укажите признаки реакций
Домашние задания
·
ОтветитьУточнитьВы знаете ответ на этот вопрос?
Поделитесь своим опытом и знаниями
Войти и ответить на вопрос
Публикация не была найдена — Студопедия
Поделись с друзьями
(включены в коллоквиум и зачетное занятие)
1.Сокращённое ионное уравнение HCO3— + H2O « Н2СО3 + ОН— соответствует гидролизу соли:
1) CH3COOК 2) Nа2CO3 3) КHCO3 4) ZnCO3
2. Формула соответствует гидролизу соли:
Формула соответствует гидролизу соли:
1) KF 2) NаNO3 3) CH3COONH4 4) MgCl2
3.Гидролизу не подвергается соль:
1) ZnSO4 2) K2S 3) NaBr 4) K2HPO4
4.Уравнение для расчёта соли, образованной слабым основанием и слабой одноосновной кислотой это:
1) 2) 3) 4)
5.Усилить гидролиз соли CH
1) NaOH 2) KCN 3) HCl 4) KCl
6.Кислую среду имеет водный раствор:
1) KCl 2) Nа2S 3) NH4CH3COO 4) FeCl3
7.Формула применима для соли:
1) Na2CO3 2) NH4ClO4 3) ZnSO4 4) NH4CN
8.Ослабление гидролиза соли KNO2 происходит при добавлении:
1) NaOH 2) повышение температуры 3) HCl 4) KCl
9.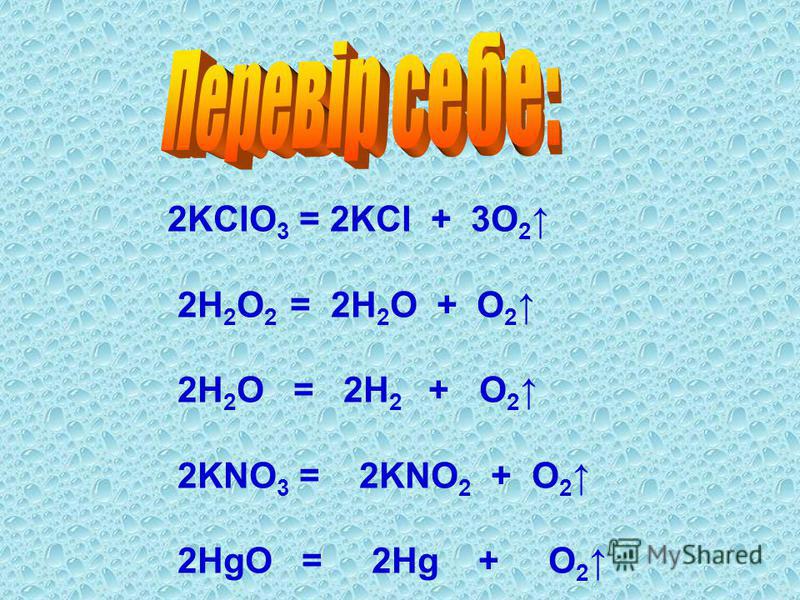 Нейтральную среду имеет водный раствор соли:
Нейтральную среду имеет водный раствор соли:
1) KClO 2) KNO2 3) Mg(NO3)2 4) NH4CH3COO
10.Гидролизу соли, образованной слабой кислотой и сильным основанием, отвечает уравнение:
1) СН3СОО— + Н2О « СН3СООН + ОН — 2) NH4+ + H2O « NH4OH + H+
3) NH4+ + CH3COO— + H2O « NH4OH + CH3COOH 4) Al3+ + H2O « AlOH2+ + H+
11.Уравнение для расчета рН соли образованной слабой одноосновной кислотой и однокислотным сильным основанием (NaCN, CH3COOК, KNO2
1) рН = 7 + ½ рКк + ½lgCc 2) рН = 7 + ½ рКк — ½ pKосн
3) рН = 7 — ½ рКосн — ½ lg Cc 4) рН = 7 + ½ рКк + ½ рКосн — ½ lg2
12. Усилить гидролиз соли KCN можно добавлением:
Усилить гидролиз соли KCN можно добавлением:
1) NaOH 2) KCl 3) HCl 4) CH
13.Гидролиз соли, образованной сильной кислотой и слабым основанием, соответствует уравнению:
1) HCOO— + HOH « OH— + HCOOH 2) NH4+ + HOH « H+ + NH4OH
3) NH4+ + CN— + HOH « NH4OH + HCN 4) Al3+ + 3CH3COO— + HOH « AlOHCH3COO+ + CH3COOH
14.Не подвергается гидролизу соль:
1) Na2S 2) AlCl3 3) NaNO3 4) Na2CO3
15.Гидролиз АТФ в организме — источник:
1) ионов водорода 2) белков 3) воды 4) энергии
16.Ослабить гидролиз соли NH4NO3 можно добавлением:
1) NaOH 2) NaCl 3) HCl 4) NaCN
17.
1) одноосновной сильной кислотой и однокислотным слабым основанием
2) однокислотным сильным основанием и одноосновной слабой кислотой
3) однокислотным слабым основанием и одноосновной слабой кислотой
4) однокислотным слабым основанием и многоосновной сильной кислотой
18.Гидролиз соли NaСN протекает с образованием среды:
1) щелочной 2) нейтральной 3) слабокислой 4) сильнокислой
19.Соль Nа2S гидролизуется:
1) по катиону 2) по аниону 3) по катиону и аниону 4) не протекает
20.При гидролизе кислых солей учитывается:
1) только гидролиз 2) только диссоциация кислого иона
3) гидролиз и диссоциация 4) гидратация ионов
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Является ли KClO2 кислотой, основанием или солью?
Ответ: KClO2 ( Хлорит калия) соль
Что такое кислота, основание, соль?
https://www. thinglink.com/scene/636594447202648065
thinglink.com/scene/636594447202648065
ACID (wikipedia)
образования ковалентной связи с электронной парой (кислота Льюиса).
ОСНОВАНИЕ (wikipedia)
В химии основаниями называются вещества, которые в водном растворе скользкие на ощупь, имеют вяжущий вкус, изменяют цвет индикаторов (например, окрашивают красную лакмусовую бумагу в синий цвет), реагируют с кислотами с образованием соли, способствуют определенным химическим реакциям (основной катализ), принимают протоны от любого донора протонов и/или содержат полностью или частично замещаемые ионы ОН–.
СОЛЬ (википедия)
В химии соль — это ионное соединение, которое может образоваться в результате реакции нейтрализации кислоты и основания. Соли состоят из соотнесенных количеств катионов (положительно заряженных ионов) и анионов (отрицательных ионов), так что продукт является электрически нейтральным (без суммарного заряда).
НЕЙТРАЛЬНЫЙ (wikipedia)
В химии нейтрализация или нейтрализация (см. различия в написании) — это химическая реакция, в которой кислота и основание количественно реагируют друг с другом.
различия в написании) — это химическая реакция, в которой кислота и основание количественно реагируют друг с другом.
Список кислоты
NH5CLO4
NH5CL
HBRO (слабый)
H3PO4-
H4PO3 (слабый)
HNO3 (сильный)
HCL (сильный)
H3S (слабый)
H3SO4 (сильный)
HCL)
H3S (слабый)
H3SO4 (Strong)
HC4PO4PO4. (СЛАБАЯ)
HBr (СИЛЬНАЯ
HI (СИЛЬНАЯ)
HClO4 (СИЛЬНАЯ)
HClO3 (STRONG)
ch4ch3cooh
C2H5OH
Nh5Br
HBrO3
Nh5I
NaHSO4
C2H5COOH (weak)
C6H5COOH (weak)
C6H5OH
ammonium iodide
Ch4COCh4
C5H5NHBr
MgSo4
aspirin (weak)
vitamin C
acetaminophen
NH5NO3
SEO3
CH4CO2-
Оксид магния
NAHSO3
NAH3PO4
H3C2O4
CH4NH4I
KH3PO4
NH5F
KHSO4
CUNO32
.PLO495FO4 9000.9000 9000.9000 9000.9000 9000.9000 9000.9000 9000.9000 9000.9000 .0005 lime
phenol
HClO
HOCl
HCHO2
ammonium bromide
apple juice
grape juice
sprite
HSO3
Cl2O7
urine
ammonium sulfate
nh4cl
vinegar
tomato juice
soda pop
coffee
ch4o-
CuSO4
sulfur dioxide
SO2
Acetone
Coke
NH5+
SO3
HCOOH (слабый)
HC6H5O (слабый)
H4O+
AL (NO3) 3
чай
Arange Muice
P4O10
мг.
 0005 CH4COOH (слабый)
0005 CH4COOH (слабый) Хлорид алюминия (Lewis)
BH4 (Lewis)
FECL3 (Lewis)
ZnCl2 (Lewis)
BCL3 (Lewis)
FECL2 (Lewis)
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . K2SO3
NaC2h4O2
K2CO3
NaOH (СИЛЬНЫЙ)
Ba(OH)2 (СИЛЬНЫЙ)
KOH (СИЛЬНЫЙ)
Mg(OH)2 (СИЛЬНЫЙ)
Nh5OH (СЛАБЫЙ)
Na3PO4 (СИЛЬНЫЙ) 9000 0900 CNaCN №3
NaCN
naocl
Na2S
C6H5Nh3 (слабый)
хлорат натрия
K2O (strong)
NaClO
Na2SO3 (weak)
NaCh4COO
hexane
KHCO3
NaNO2
NO3-
C5H5N (weak)
Ph4 (lewis)
PO4 3-
NaCHO2 (weak)
hydroxide
Nh3OH
Rb2O
Sodium thiosulfate
C2h4O2
Na2HPO4
Sodium hypochlorite
Li2O
CO3-2
Clorox Bleach
potassium hypochlorite
N2h5 (weak)
Na2C2O4
Nh5C2h4o2
oven cleaner
KF
toothpaste
Ch4COO
NAH
BORAX
DETREGNT
CH4COO-
WINDEX
DRANO
CAO
C2H6
мыло для посуды
.

аммиак бытовой
HS-
оксалат натрия
мыло для рук
молочко магнезии
нитрит натрия
ch4
метанол
h3nnh3
hso3-
HCOOK
хлор
NH3CH4 (слабый)
Цитрат натрия
борогидрид натрия
PBR3 (Lewis)
NA2O
NACO3
CLO2 (Bronsted Base)
Аммонный гидроксид
FBOH
LIOH
C2H5H3H3 (слабый)
FE)
(OH)
(OH)
(OH)
(OH)
(OH)
(OH)
LIOH
. Метиламин (слабый)
йод
CH4NH3 (слабый)
Cyanide
NAHCO3
Draine Cleaner
K2S
Сода
CL-
NH3
NH4 (слабый)
NAF
OF2 (LEWIS)
S2- (LEWIS)
CH5 (LEWIS)
S2- (LEWIS)
CH5 (LEWIS)
S2- (LEWIS)
CH5 (LEWIS)
S2- (LEWIS)
CH5 (LEWIS)
S2- (LEWIS)
Ch.
НЕЙТРАЛЬНЫЙ СПИСОК
KClO4
sodium iodide
KClO3
KBr
LiNO3
NaClO4
potassium iodide
CaSO4
NaNO3
LiClO4
CaBr2
NaI
Nh5Ch4COO
potassium bromide
KI
NaClO3
NaBr
sodium bromide
K2SO4
KNO3
sodium perchlorate
licl
MgCl2
хлорид калия
BaCl2
хлорид калия
нитрат калия
хлорид кальция
bacl
хлорид кальция
SrBr2
хлорид бария
C12h32O11
ethyl acetate
sugar
calcium nitrate
carbon monoxide
MgI2
LIST SALT
MgBr2
KClO2
MgF2
FeBr3
KCl
Al(NO3)3
CaCl2
Na2SO4
AgNO3
KClO
KC2h4O2
pb( no3)2
нитрат аммония
нитрат серебра
нитрат бария
фторид калия
SO42
фторид натрия
основание4
Kh3PO4
zn(no3)2
h40BO3 9 9 0
h40BO3 сульфат натрия0005 хлорид натрия
перхлорат аммония
Другое
Ch4Ch4
я получил ответ от
ресурс
www. quora.com
quora.com
com http://www.0s. .com
quizlet.com
socratic.org
www.reference.com
answer.yahoo.com
www.quora.com
https://en.wikipedia.org/wiki/Base_(chemistry)
https:// en.wikipedia.org/wiki/Acid
https://en.wikipedia.org/wiki/Соль_(химия)
https://en.wikipedia.org/wiki/Нейтрализация_(химия)
Если ответ неправильный, пожалуйста, прокомментируйте статью
кислота или основание или соль?
Ответ: KClO2 ( Хлорит калия) соль
Химия
Химия атомной структуры | Wyzant Спросите эксперта
Химия
Ховард Т.
спросил 17.03.20 Подкисленный раствор соли KC1Ox (x = 1, 2 или 3) количественно окисляет Fe2(водн.) до Fe3+(водн.), при этом хлор восстанавливается до Cl-(водн.). При взаимодействии 0,150 г соли KClOx с 0,500 моль дм-3 Fe2+(водн.) в присутствии Н+ (водн.) для завершения реакции потребовалось 11,3 см3 Fe2+(водн. ). Рассчитайте значение x и составьте уравнение реакции между Fe2+(aq) и подкисленным KCIOx
). Рассчитайте значение x и составьте уравнение реакции между Fe2+(aq) и подкисленным KCIOx
Подписаться І 2
Подробнее
Отчет
1 ответ эксперта
Лучший Новейшие Самый старыйАвтор: ЛучшийНовыйСтарый
Дж. Р. С. ответил 17.03.20
Репетитор
5,0 (140)
к.т.н. Профессор университета с более чем 10-летним опытом репетиторства
Об этом репетиторе ›
Об этом репетиторе ›
Возможности будут включать в себя
2FE 2+ + KCLO + 2H + ==> 2FE 3+ + KCL + H 2 O
4FE 2+ + KLIS 9013 + + KLI. → 4Fe 3+ + KCl + 2H 2 O
6Fe 2+ + KClO 3 + 6H 93) = 0,00565 моль Fe 2+
Глядя на 3 возможности выше, мы имеем. ..
..
(0,00565 моль Fe 2+ ) x (1 моль KClO / 2 моль Fe 2+ ) x ( 90,6 г KClO/моль) = 0,256 г KClO
(0,00565 моль Fe 2+ ) x (1 моль KClO 2 / 4 моль Fe 2+ ) x (106,6 г / моль) KClO 909019 2 0,151 г KClO 2
(0,00565 моль Fe 2+ ) x (1 моль KClO 3 / 6 моль Fe 2+ ) x (122,5 г KClO 3 /моль) = 0,115 г KClO 3
Из этих расчетов второй выбор дает массу, эквивалентную массе, указанной в задаче.
The salt would be KClO2 where x = 2
The equation would be 4Fe 2+ + ClO 2 — + 4H + ==> 4Fe 3+ + Cl — + 2H 2 О
Голосовать за 0 Голосовать против
Подробнее
Отчет
Все еще ищете помощи? Получите правильный ответ, быстро.

