Окислительно восстановительные свойства веществ — презентация онлайн
Окислительно восстановительные
свойства веществ
Примеры природных окислительновосстановительных процессов
Колосс Родосский –
статуя из железа и бронзы
Знать наизусть!
Степень окисления – число электронов, отданных или принятых атомом при
образовании химической связи. Принятые электроны показывают знаком минус
(-) перед числом, отданные – знаком плюс (+). Например, S+4O2 h3S-2 S0.
Степень окисления простых веществ равна 0.
Окислительно-восстановительные реакции – реакции, в ходе которых
изменяются степени окисления элементов вследствие перехода
электронов к более электроотрицательному элементу (от
восстановителя к окислителю). h30 + Cl20 = 2H+1Cl-1
Окисление – процесс отдачи электронов атомом, молекулой или
ионом, степень окисления элемента повышается.
N-3 → N+2
Восстановление – процесс принятия электронов атомом, молекулой
или ионом, степень окисления элемента понижается. N+3 → N+2
N+3 → N+2
Окислитель (ок-ль)– вещество, содержащее атомы или ионы,
принимающие электроны.
Восстановитель(в-ль) – вещество, содержащее атомы или ионы,
отдающие электроны.
Окислительно-восстановительные реакции
2е
0
h3
+
0
Cl2
=
+1
-1
2H Cl
Правила определения степени окисления
Знать наизусть!
• 1.У свободных атомов и у простых веществ СО равна 0.
O20, Cl20, Al0, Ca0, Mg0;
• 2.Металлы I и III группы во всех соединениях имеют положительную
СО (ее максимальное значение равно номеру группы):
А) у металлов I группы главной подгруппы СО= +1.
Na+1, K+1, Li+1;
Б) у металлов во II группы главной подгруппы СО= +2.
Ca+2, Mg+2, Ba+2;
В) у Al+3;
3. В соединениях кислород имеет СО= -2.
( исключение
O+2F2-1, h3+1O2-1, K2+1O2-1)
4. В соединениях водорода с неметаллами СО= +1.
H+1Cl-1, h3+1O-2, h3+1S-2;
а с металлами СО= -1.
Na+1H-1, K+1H-1;
• 5.В соединениях сумма степеней окисления всех атомов
равна 0.
Степень окисления на примере соединений азота
Определите степень окисления
• h3S, SO3, SO2, OF2, HF, h3O2, NaH,
MnSO4, KMnO4, Na2O, Na2O2, HCl,
KClO3, KClO4, KClO2, KClO, KCl, Cr2O3,
Na2CrO4, Na2Cr2O7 , Н2SO3, N2O, NO2,
N2O5, НNO2, НNO3
Определите степени окисления атомов в
соединениях
Вариант 1:
Вариант 2:
• а) Ph4, P2O3, h4PO4, Mg3P2 , Р4
• а) CaS, SO3, h3SO3, S8
• б) СaBr2, HBrO, KBrO3, Br2O5, Br2
• б) SiO2 h3SiO3, SiCl4, Si
• в) Cr2O3, K2CrO4, h3Cr2O7, Cr(OH)3
• в) HClO4, HClO2, BaCl2, Cl2O7, Cl2
• г) MnO, KMnO4, MnCl2, K2MnO4
• г) Fe2O3, Fe2S3, FeSO4, h3FeO4
• д) HNO2, Nh4, N2, Ca3N2, N2О
• д) HNO2, Nh4, N2, Ca3N2, N2О
Окислительно-восстановительные реакции
0
h3
+
0
Cl2
=
+1
-1
2H Cl
S+4
S-2
Cr+6
Cl20
O20
h30
S+4
Al0
Fe+2
2Br-1
S+6
-2е
S+6
S0
Cr+3
2Cl-1
2O-2
2H+1
S0
Al+3
Fe+3
Br20
S0
окисление, S+4 — восстановитель
Реакция, уравнение которой
4Nh4 +5O 2 → 4NO + 6h3O
соответствует схема превращения азота
• 1) N+3 → N+2
3) N+3 → N-3
• 2) N-3 → N-2
4) N-3 → N+2
Установите соответствие между изменением степени
окисления атома серы и схемой превращения
вещества.
СХЕМА ПРЕВРАЩЕНИЙ
A) h3S + O2 → SO2 + h3O
Б) h3SO4 + Na → Na2SO4 + h3S + h3O
В) SO2 + Br2 + h3O → h3SO4 + HBr
ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ
1) Э+4 → Э+6
2) Э+6 → Э-2
3) Э+6 → Э+4
4) Э-2 → Э+6
5) Э-2 → Э+4
Расстановка коэффициентов в
уравнениях реакций методом
электронного баланса
Метод электронного баланса
Смесь бертолетовой соли с красным фосфором подожгли.
Взаимодействие идёт по схеме:
KClO3 + P → KCl + P2O5
1. Определяем степени окисления элементов до и
после реакции. Находим элементы её поменявшие:
• K+1Cl+5O-23 + P0 → K+1Cl-1 + P+52O-25
2. Для элементов, поменявших степень окисления, составляем уравнения
полуреакций процессов окисления и восстановления. Определяем
окислитель и восстановитель:
• Cl+5 + 6e → Cl-1 5 (Cl+5 — окислитель, восстановление)
• P0 -5e → P+5 6 (P0 — восстановитель, окисление)
3. Переносим дополнительные коэффициенты в уравнение реакции:
• 5 KClO3 + 6 P0 = 5 KCl + 3 P2O5
Смесь бертолетовой соли с красным фосфором
подожгли:
KClO3 + P → KCl + P2O5
• K+1Cl+5O-23 + P0 → K+1Cl-1 + P+52O-25
• Cl+5 + 6e → Cl-1 5 (Cl+5 — окислитель, восстановление)
• P0 -5e → P+5 6 (P0 — восстановитель, окисление)
В итоге получаем:
• 5 KClO3 + 6 P0 = 5 KCl + 3 P2O5
МЕТОД ЭЛЕКТРОННОГО БАЛАНСА
Записать схему реакции
Определить СО элементов
Определить число отданных и принятых электронов
Составить электронный баланс
Определить коэффициенты
Перенести коэффициенты в уравнение реакции
Расставьте коэффициенты в следующих схемах реакций
методом электронного баланса:
• С + HNO3 → h3О + NO2 + СО2
• Cu + HNO3(разб) = Cu(NO3)2 + NO + h3O
• S + HNO3 → h3SO4 + NO
Помогите с химиейСоставьте ионно-электронные схемы и закончите уравнениеа) Кислая средаFeSO4+KCLO3+h3SO4=>Fe2(SO4)3+KCL+ — Спрашивалка
Помогите с химиейСоставьте ионно-электронные схемы и закончите уравнениеа) Кислая средаFeSO4+KCLO3+h3SO4=>Fe2(SO4)3+KCL+ — СпрашивалкаОГ
Оксана Григорьева
Составьте ионно-электронные схемы и закончите уравнение
а) Кислая среда
FeSO4+KCLO3+h3SO4=>Fe2(SO4)3+KCL+h3O
б) Щелочная среда
P+KIO3+NaOH=>Na3PO4+KI+h3O
в) Нейтральная среда
Mn(OH)2+O2+h3O=>Mn(OH)4
- схема
Ир
Ирина
6FeSO4 + KClO3 + 3h3SO4 → 3Fe2(SO4)3 + KCl + 3h3O
Метод электронно-ионного баланса
Fe(2+) – e = Fe(3+) | 6 – окисление
ClO3(-) + 6Н (+) + 6е = Cl(-) + 3Н2О | 1 – восстановление
Суммарно
6Fe(2+) + ClO3(-) + 6Н (+) = 6Fe(3+) + Cl(-) + 3Н2О
В левую и правую части уравнения добавляем 9 ионов SO4(2-) и один ион К (+)
Получаем
6FeSO4 + KClO3 + 3h3SO4 → 3Fe2(SO4)3 + KCl + 3h3O
6P + 5KIO3 + 18NaOH → 6Na3PO4 + 5KI + 9h3O
Метод электронно-ионного баланса
P + 8OH(-) – 5e = PO4(3-) + 4h3O | 6 – окисление
IO3(-) + 6Н (+) + 6е = I(-) + 3Н2О | 5– восстановление
Суммарно
6P + 48OH(-) + 5IO3(-) + 30Н (+) = 6PO4(3-) + 24h3O + 5I(-) + 15Н2О
6P + 18OH(-) + 5IO3(-) + 30Н2O = 6PO4(3-) + 5I(-) + 39Н2О
6P + 18OH(-) + 5IO3(-) = 6PO4(3-) + 5I(-) + 9Н2О
В левую и правую части уравнения добавляем 18 ионов Na(+) и 5 ионов К (+)
Получаем
6P + 5KIO3 + 18NaOH → 6Na3PO4 + 5KI + 9h3O
2Mn(OH)2 + O2 + 2h3O → 2Mn(OH)4
При расстановке коэффициентов в данном уравнении можно воспользоваться только методом электронного баланса, поскольку ни один из реагентов не диссоциирует на ионы. Метод электронного баланса
Метод электронного баланса
Mn(2+) – 2е = Mn(4+) | 2 — окисление
О2 + 4е = 2О (2-) | 1 – восстановление
Суммарно
2Mn(2+) + О2 = 2Mn(4+) + 2О (2-)
Похожие вопросы
помогите написать степени окисления! кто умеет пожалуйста) Cu(NO3)2, N2O, h3SO4, Fe2(SO4)3, SO2.
Среди веществ: KCI, AICI3, BaO, Fe2O3, Fe2(SO4)3, h3SO4, C2H5ONa, C6H5ONa, SiO2, Nh4, найти соединения с ионными решетка
Co(OH)3 + h3SO4 = Co + SO4 + h3O определите коэффициенты электронно-ионным методом
овр ионно-электронным методом MnO2+KClO3+KOH=K2MnO4+KCl+h3O буду очень благодарна
h3SO4+Fe(OH)3=FE2(SO4)+
Составте реакцию ионного обмена в молекулярном и ионном виде. Fe2(SO4)3+KOH->
метод электронного баланса FeSO4+K2Cr2O7+h3SO4=Fe2(SO4)3+Cr(SO4)3+K2SO4+h3O Cr2O3+Na2CO3+O2=Na2CrO4+CO2
Химия электронный баланс. Fe2SO4+Br2 -> Fe2(SO4)3+FeBr3 Помогите пожалуйста электронный баланс сделать!
Fe2(SO4)3 + SO2 + 2h3O =. Fe2(SO4)3 + SO2 + 2h3O = 2FeSO4 + 2h3SO4????
Химия Cr2(SO4)3 + KClO3 + NaOH = Na2CrO4 + KCl + h3O + Na2SO4
KClO3 P = KCl P2O5
- Транг Чо
- Kclo3 P
- KClO3 P = KCl P2O5 | Калькулятор химических уравнений
Hệ thống tự động chuyển đến trang sau 60 giay
Thời gian con lại
00:00:00
Bài viết liên quan:
Kclo3 p edu.vn/chuyen-trang/potassium-chlorate-kclo3-pubchem»> Хлорат калия | KClO3 — PubChemХлорат калия | KClO3 или ClKO3 | CID 6426889 — структура, химические названия, физические и химические свойства, классификация, патенты, литература, биологические…
Xem : pubchem.ncbi.nlm.nih.gov Чи Тит
Хлорат калия — Википедия
Хлорат калия представляет собой соединение, содержащее калий, хлор и кислород, с молекулярной формулой KClO 3. В чистом виде это белое кристаллическое вещество. После хлората натрия это номер
. Xem them : en.wikipedia.org Чи Тит
Получение хлората калия — Metal Lab
Хлорат калия KClO 3 (также называемый Potassii Chloras или Kalii Chloras или Chloras Kalicus/Potassicus) представляет собой калиевую соль хлористоводородной кислоты и является окислителем, используемым в химии для получения кислорода, b
Xem : www. metallab.net
Чи Тит
metallab.net
Чи Тит
KClO3 + P = KCl + P2O5
Алгебраически сбалансируйте химическое уравнение: KClO_3 + P KCl + P2O5 Добавьте стехиометрические коэффициенты c_i к реагентам и продуктам: c_1 KClO_3 + c_2 P c_3 KCl + c_4 P2O5 Установите число атомов в
Xem : chemisthunter.com Чи Тит
P + KClO3 → KCl + P2O5 — P ra P2O5 — VnDoc.com
P KCLO3: P Tác dụng với Kclo3 1. phương trình phản ứng p ra p2o5 6p + 5kclo3 → 5kcl + 3p2o5 2. cân bằng phản ứng p + kclo3 → kcl + p2o5 2. đi đ đ wng wng wg wg wng. 3. Кау Хой Ван Донг л
Кем тем : vndoc.com Чи Тит
P + KClO3 — YouTube
О нас Пресса Авторское право Связаться с нами Создатели Реклама Разработчики Условия Политика конфиденциальности и безопасности Как работает YouTube Тестировать новые функции Пресса Авторское право Связаться с нами Авторы .
Xem the : www.youtube.com Чи Тит
PDF Эксперимент 10 Анализ KClO3 — Лабораторные руководства для Ventura College
Закон идеального газа связывает давление (P), объем (V), температуру (T) и количество молей (n) любого газа в терминах постоянной идеального газа R, как показано в уравнении. 2: R = PV нТл. 2 R имеет стандартизированное значение
Чи Тит
Bạn có những câu hỏi hoặc những thắc mắc cần mọi người trợ giúp hay giup đỡ hay gửi câu hỏi và vấn chôn đỻông đón. Để chúng tôi gửi vấn đề mà bạn đang gặp phải tới mọi người cùng tham gia đóng gop ý kiếm giúp bạn…
Gửi Câu hỏi & Ý kiến đóng góp »Có thể bạn quan tâm
Чап ан Тхи Иоэ Луп 11 Вонг 4
Ань Трай Дой Эм Гай Ан Чуи
Нге Док Труйен Дам Дык
Những Câu Noi Hay Của Mc Trong Bar
Nội Dung Bài Hội Thổi Cơm Thi ở đồng Vân
Truyện Tranh Gay Sm
Диен Ван Кхай Мак Лу Монг Тхо Нги Цао Туи
ep đồ X Hero Siege 3. 2 мл при нормальных условиях. Сколько процентов исходной смеси составлял KClO3, который разлагается следующим образом:
2 мл при нормальных условиях. Сколько процентов исходной смеси составлял KClO3, который разлагается следующим образом:
2KClO3 (т) —-> 2KCl (т) + 3O2 (г)
(A) 28,4%
(B) 37,2%
( C) 42,6%
(D) 63,8%
(E) 72,6%
(A) 4,87 K
(B) 78,1 K (ОТВЕТ)
(C) 46,3 K
(D) 275 K
(A) 562 торр
(B) 580 торр
(C) 598 торр
(D ) 616 торр
(E) 634 торр
Определить количество молей газообразного водорода, присутствующего в образце.
(A) 42 моль
(B) 0,82 моль
(C) 1,3 моль
(D) 0,056 моль
(E) 22 моль
(A) 0,0790 моль
(B) 0,119 моль
(C) 0,0527 моль (ОТВЕТ: Требуется объяснение.)
(D) 0,0813 моль
(D) ничего из перечисленного
ncp/nO2 = ?
(A) 0,19
(B) 0,23
(C) 0,30
(D) 0,39
(E) 0,46
 Каково парциальное давление CO2?
Каково парциальное давление CO2?(A) 1,8 атм
(B) 2,1 атм
(D) 4,9 атм
(E) 2,5 атм
Образец A Образец B
S2 (г) O2 (г)
n = 1 моль n = 2 моль
T = 800 K T = 400 K
P = 0,20 атм P = 0,40 атм< /p>
Какое из следующих утверждений неверно?
(A) Объем образца A в два раза превышает объем образца B.
(B) Среднее значение KE молекул в образце А в два раза превышает среднюю КЕ молекул в образце В.
(C) Доля молекул в образце А, имеющих КЕ выше некоторого высокого фиксированного значения, больше, чем доля молекул в образце В, имеющих КЕ выше то же самое высокое фиксированное значение.
(D) Средняя квадратичная скорость молекул в образце A в два раза больше, чем средняя квадратичная скорость молекул в образце B.
(E) Предполагая одинаковые IMF в двух образцах, образец A должен быть более близок к идеальному, чем образец B .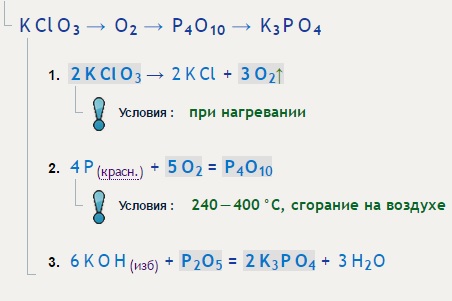
(A) He
(B) CO
(C) HF
(D) HBr
(E) F2
(A) Большая часть массы частиц газа сосредоточена в ядре атома. (ОТВЕТ)
(B) Движущиеся частицы испытывают совершенно упругие столкновения со стенками сосуда.
(С) Силы притяжения и отталкивания между частицами незначительны.
(D) Средняя КЭ частиц прямо пропорциональна абсолютной температуре.
(E) Все вышеперечисленное является постулатами КМТ.
< p>(A) Газы состоят из мельчайших частиц, находящихся в постоянном хаотическом движении.
(B) Частицы газа очень малы по сравнению со средним расстоянием между частицами.
