Помощь студентам в учёбе от Людмилы Фирмаль
Здравствуйте!
Я, Людмила Анатольевна Фирмаль, бывший преподаватель математического факультета Дальневосточного государственного физико-технического института со стажем работы более 17 лет. На данный момент занимаюсь онлайн обучением и помощью по любыми предметам. У меня своя команда грамотных, сильных бывших преподавателей ВУЗов. Мы справимся с любой поставленной перед нами работой технического и гуманитарного плана. И не важно: она по объёму на две формулы или огромная сложно структурированная на 125 страниц! Нам по силам всё, поэтому не стесняйтесь, присылайте.
Срок выполнения разный: возможно онлайн (сразу пишите и сразу помогаю), а если у Вас что-то сложное – то от двух до пяти дней.
Для качественного оформления работы обязательно нужны методические указания и, желательно, лекции. Также я провожу онлайн-занятия и занятия в аудитории для студентов, чтобы дать им более качественные знания.
Моё видео:
youtube.com/embed/4sKc0lcxi7g» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>Вам нужно написать сообщение в Telegram . После этого я оценю Ваш заказ и укажу срок выполнения. Если условия Вас устроят, Вы оплатите, и преподаватель, который ответственен за заказ, начнёт выполнение и в согласованный срок или, возможно, раньше срока Вы получите файл заказа в личные сообщения.
Сколько может стоить заказ?Стоимость заказа зависит от задания и требований Вашего учебного заведения. На цену влияют: сложность, количество заданий и срок выполнения. Поэтому для оценки стоимости заказа максимально качественно сфотографируйте или пришлите файл задания, при необходимости загружайте поясняющие фотографии лекций, файлы методичек, указывайте свой вариант.
Какой срок выполнения заказа?Минимальный срок выполнения заказа составляет 2-4 дня, но помните, срочные задания оцениваются дороже.
Сначала пришлите задание, я оценю, после вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Какие гарантии и вы исправляете ошибки?В течение 1 года с момента получения Вами заказа действует гарантия. В течении 1 года я и моя команда исправим любые ошибки в заказе.
Качественно сфотографируйте задание, или если у вас файлы, то прикрепите методички, лекции, примеры решения, и в сообщении напишите дополнительные пояснения, для того, чтобы я сразу поняла, что требуется и не уточняла у вас. Присланное качественное задание моментально изучается и оценивается.
Теперь напишите мне в Telegram или почту и прикрепите задания, методички и лекции с примерами решения, и укажите сроки выполнения. Я и моя команда изучим внимательно задание и сообщим цену.
Если цена Вас устроит, то я вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.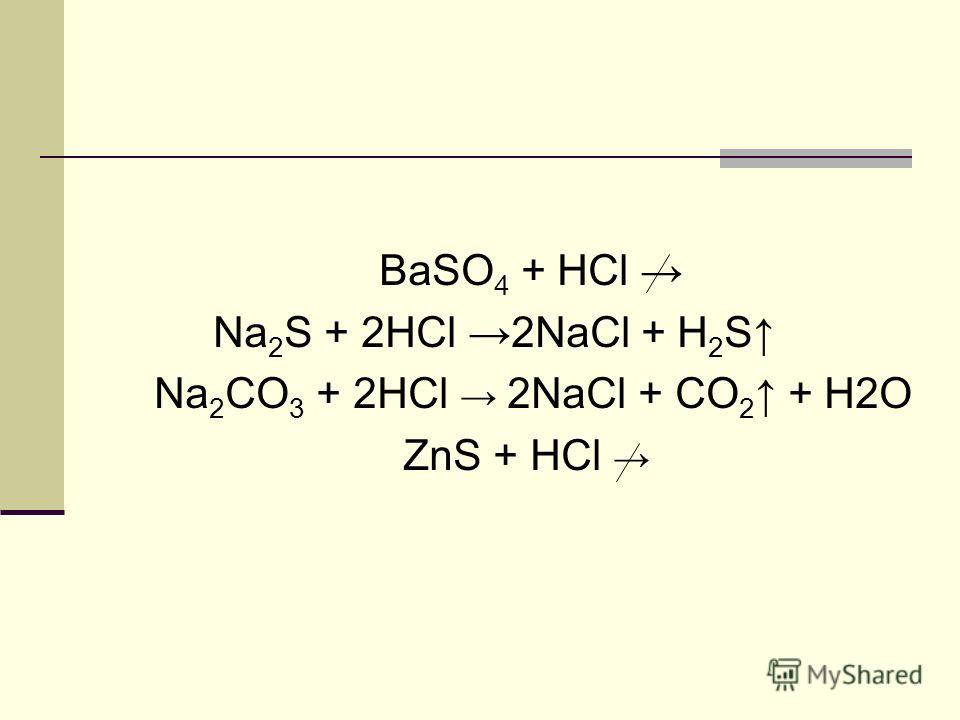
Мы приступим к выполнению, соблюдая указанные сроки и требования. 80% заказов сдаются раньше срока.
После выполнения отправлю Вам заказ в чат, если у Вас будут вопросы по заказу – подробно объясню. Гарантия 1 год. В течении 1 года я и моя команда исправим любые ошибки в заказе.
youtube.com/embed/g4ioDc7sLwU» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
youtube.com/embed/zW5JhiZ4140″ frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
Можете смело обращаться к нам, мы вас не подведем. Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
В заключение хочу сказать: если Вы выберете меня для помощи на учебно-образовательном пути, у вас останутся только приятные впечатления от работы и от полученного результата!
Жду ваших заказов!
С уважением
Пользовательское соглашение
Политика конфиденциальности
учебное пособие по фармацевтической химии
%PDF-1.5 % 1 0 obj > /Metadata 4 0 R >> endobj 5 0 obj /Title >> endobj 2 0 obj > endobj 3 0 obj > endobj 4 0 obj > stream
 58 595.38]
/Contents 125 0 R
/Group >
/Tabs /S
/StructParents 11
>>
endobj
18 0 obj
>
/ExtGState >
/XObject >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 419.58 595.38]
/Contents 130 0 R
/Group >
/Tabs /S
/StructParents 12
>>
endobj
19 0 obj
>
/XObject >
/ExtGState >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 419.58 595.38]
/Contents 135 0 R
/Group >
/Tabs /S
/StructParents 13
>>
endobj
20 0 obj
>
/ExtGState >
/XObject >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 419.58 595.38]
/Contents 140 0 R
/Group >
/Tabs /S
/StructParents 14
>>
endobj
21 0 obj
>
/XObject >
/ExtGState >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 419.58 595.38]
/Contents 146 0 R
/Group >
/Tabs /S
/StructParents 15
>>
endobj
22 0 obj
>
/ExtGState >
/XObject >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 419.
58 595.38]
/Contents 125 0 R
/Group >
/Tabs /S
/StructParents 11
>>
endobj
18 0 obj
>
/ExtGState >
/XObject >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 419.58 595.38]
/Contents 130 0 R
/Group >
/Tabs /S
/StructParents 12
>>
endobj
19 0 obj
>
/XObject >
/ExtGState >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 419.58 595.38]
/Contents 135 0 R
/Group >
/Tabs /S
/StructParents 13
>>
endobj
20 0 obj
>
/ExtGState >
/XObject >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 419.58 595.38]
/Contents 140 0 R
/Group >
/Tabs /S
/StructParents 14
>>
endobj
21 0 obj
>
/XObject >
/ExtGState >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 419.58 595.38]
/Contents 146 0 R
/Group >
/Tabs /S
/StructParents 15
>>
endobj
22 0 obj
>
/ExtGState >
/XObject >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 419.
 58 595.38]
/Contents 171 0 R
/Group >
/Tabs /S
/StructParents 21
>>
endobj
28 0 obj
>
/ExtGState >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 419.58 595.38]
/Contents 172 0 R
/Group >
/Tabs /S
/StructParents 22
>>
endobj
29 0 obj
>
/XObject >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 595.38 419.58]
/Contents 177 0 R
/Group >
/Tabs /S
/StructParents 23
>>
endobj
30 0 obj
>
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 595.38 419.58]
/Contents 178 0 R
/Group >
/Tabs /S
/StructParents 24
>>
endobj
31 0 obj
>
/ExtGState >
/XObject >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 595.38 419.58]
/Contents 180 0 R
/Group >
/Tabs /S
/StructParents 25
>>
endobj
32 0 obj
>
/ExtGState >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 595.38 419.58]
/Contents 181 0 R
/Group >
/Tabs /S
/StructParents 26
>>
endobj
33 0 obj
>
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 595.
58 595.38]
/Contents 171 0 R
/Group >
/Tabs /S
/StructParents 21
>>
endobj
28 0 obj
>
/ExtGState >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 419.58 595.38]
/Contents 172 0 R
/Group >
/Tabs /S
/StructParents 22
>>
endobj
29 0 obj
>
/XObject >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 595.38 419.58]
/Contents 177 0 R
/Group >
/Tabs /S
/StructParents 23
>>
endobj
30 0 obj
>
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 595.38 419.58]
/Contents 178 0 R
/Group >
/Tabs /S
/StructParents 24
>>
endobj
31 0 obj
>
/ExtGState >
/XObject >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 595.38 419.58]
/Contents 180 0 R
/Group >
/Tabs /S
/StructParents 25
>>
endobj
32 0 obj
>
/ExtGState >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 595.38 419.58]
/Contents 181 0 R
/Group >
/Tabs /S
/StructParents 26
>>
endobj
33 0 obj
>
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 595. 38 419.58]
/Contents 184 0 R
/Group >
/Tabs /S
/StructParents 27
>>
endobj
34 0 obj
>
/ExtGState >
/XObject >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 595.38 419.58]
/Contents 186 0 R
/Group >
/Tabs /S
/StructParents 28
>>
endobj
35 0 obj
>
/ExtGState >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 595.38 419.58]
/Contents 187 0 R
/Group >
/Tabs /S
/StructParents 29
>>
endobj
36 0 obj
>
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 595.38 419.58]
/Contents 188 0 R
/Group >
/Tabs /S
/StructParents 30
>>
endobj
37 0 obj
>
/ExtGState >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 595.38 419.58]
/Contents 189 0 R
/Group >
/Tabs /S
/StructParents 31
>>
endobj
38 0 obj
>
/ExtGState >
/XObject >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 595.38 419.58]
/Contents 191 0 R
/Group >
/Tabs /S
/StructParents 32
>>
endobj
39 0 obj
>
/ExtGState >
/XObject >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 595.
38 419.58]
/Contents 184 0 R
/Group >
/Tabs /S
/StructParents 27
>>
endobj
34 0 obj
>
/ExtGState >
/XObject >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 595.38 419.58]
/Contents 186 0 R
/Group >
/Tabs /S
/StructParents 28
>>
endobj
35 0 obj
>
/ExtGState >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 595.38 419.58]
/Contents 187 0 R
/Group >
/Tabs /S
/StructParents 29
>>
endobj
36 0 obj
>
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 595.38 419.58]
/Contents 188 0 R
/Group >
/Tabs /S
/StructParents 30
>>
endobj
37 0 obj
>
/ExtGState >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 595.38 419.58]
/Contents 189 0 R
/Group >
/Tabs /S
/StructParents 31
>>
endobj
38 0 obj
>
/ExtGState >
/XObject >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 595.38 419.58]
/Contents 191 0 R
/Group >
/Tabs /S
/StructParents 32
>>
endobj
39 0 obj
>
/ExtGState >
/XObject >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 595. 38 419.58]
/Contents 194 0 R
/Group >
/Tabs /S
/StructParents 33
>>
endobj
40 0 obj
>
/ExtGState >
/XObject >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 595.38 419.58]
/Contents 196 0 R
/Group >
/Tabs /S
/StructParents 34
>>
endobj
41 0 obj
>
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 419.58 595.38]
/Contents 197 0 R
/Group >
/Tabs /S
/StructParents 35
>>
endobj
42 0 obj
>
/ExtGState >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 419.58 595.38]
/Contents 198 0 R
/Group >
/Tabs /S
/StructParents 36
>>
endobj
43 0 obj
>
/ExtGState >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 419.58 595.38]
/Contents 199 0 R
/Group >
/Tabs /S
/StructParents 37
>>
endobj
44 0 obj
>
/ExtGState >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 419.58 595.38]
/Contents 200 0 R
/Group >
/Tabs /S
/StructParents 38
>>
endobj
45 0 obj
>
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 419.
38 419.58]
/Contents 194 0 R
/Group >
/Tabs /S
/StructParents 33
>>
endobj
40 0 obj
>
/ExtGState >
/XObject >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 595.38 419.58]
/Contents 196 0 R
/Group >
/Tabs /S
/StructParents 34
>>
endobj
41 0 obj
>
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 419.58 595.38]
/Contents 197 0 R
/Group >
/Tabs /S
/StructParents 35
>>
endobj
42 0 obj
>
/ExtGState >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 419.58 595.38]
/Contents 198 0 R
/Group >
/Tabs /S
/StructParents 36
>>
endobj
43 0 obj
>
/ExtGState >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 419.58 595.38]
/Contents 199 0 R
/Group >
/Tabs /S
/StructParents 37
>>
endobj
44 0 obj
>
/ExtGState >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 419.58 595.38]
/Contents 200 0 R
/Group >
/Tabs /S
/StructParents 38
>>
endobj
45 0 obj
>
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 419.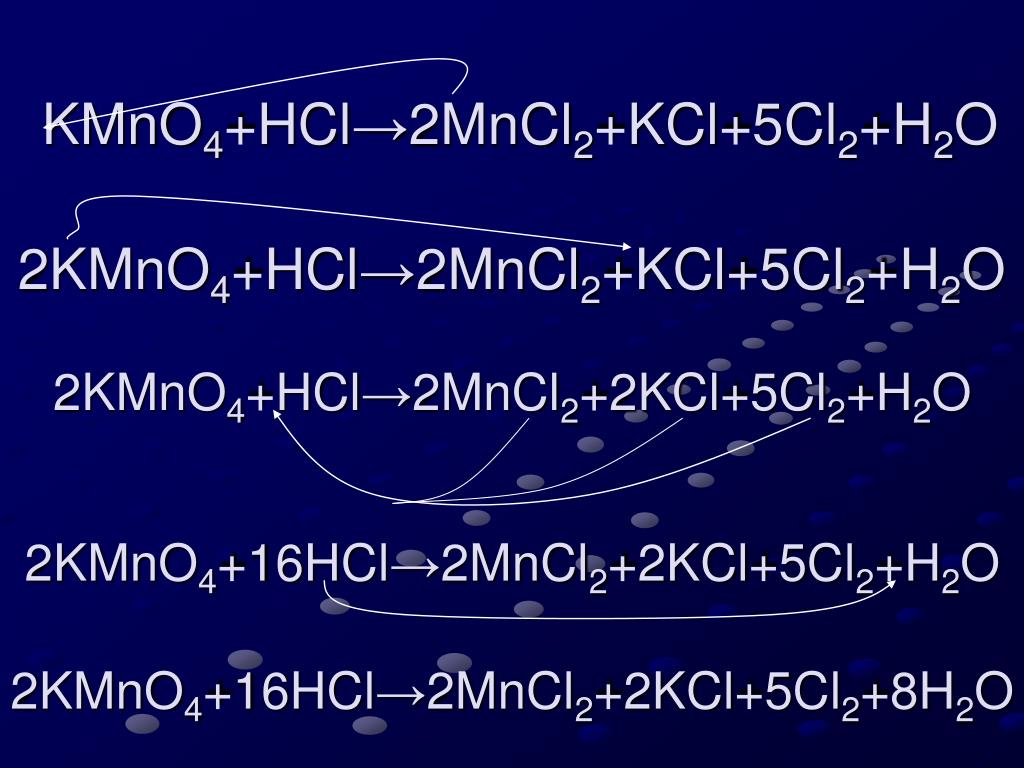 58 595.38]
/Contents 201 0 R
/Group >
/Tabs /S
/StructParents 39
>>
endobj
46 0 obj
>
/ExtGState >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 419.58 595.38]
/Contents 202 0 R
/Group >
/Tabs /S
/StructParents 40
>>
endobj
47 0 obj
>
/ExtGState >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 419.58 595.38]
/Contents 203 0 R
/Group >
/Tabs /S
/StructParents 41
>>
endobj
48 0 obj
>
/ExtGState >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 419.58 595.38]
/Contents 204 0 R
/Group >
/Tabs /S
/StructParents 42
>>
endobj
49 0 obj
>
/ExtGState >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 419.58 595.38]
/Contents 205 0 R
/Group >
/Tabs /S
/StructParents 43
>>
endobj
50 0 obj
>
/ExtGState >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 419.58 595.38]
/Contents 206 0 R
/Group >
/Tabs /S
/StructParents 44
>>
endobj
51 0 obj
>
/ExtGState >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 419.
58 595.38]
/Contents 201 0 R
/Group >
/Tabs /S
/StructParents 39
>>
endobj
46 0 obj
>
/ExtGState >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 419.58 595.38]
/Contents 202 0 R
/Group >
/Tabs /S
/StructParents 40
>>
endobj
47 0 obj
>
/ExtGState >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 419.58 595.38]
/Contents 203 0 R
/Group >
/Tabs /S
/StructParents 41
>>
endobj
48 0 obj
>
/ExtGState >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 419.58 595.38]
/Contents 204 0 R
/Group >
/Tabs /S
/StructParents 42
>>
endobj
49 0 obj
>
/ExtGState >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 419.58 595.38]
/Contents 205 0 R
/Group >
/Tabs /S
/StructParents 43
>>
endobj
50 0 obj
>
/ExtGState >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 419.58 595.38]
/Contents 206 0 R
/Group >
/Tabs /S
/StructParents 44
>>
endobj
51 0 obj
>
/ExtGState >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 419. 58 595.38]
/Contents 207 0 R
/Group >
/Tabs /S
/StructParents 45
>>
endobj
52 0 obj
>
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 419.58 595.38]
/Contents 208 0 R
/Group >
/Tabs /S
/StructParents 46
>>
endobj
53 0 obj
>
/ExtGState >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 419.58 595.38]
/Contents 209 0 R
/Group >
/Tabs /S
/StructParents 47
>>
endobj
54 0 obj
>
/ExtGState >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 419.58 595.38]
/Contents 210 0 R
/Group >
/Tabs /S
/StructParents 48
>>
endobj
55 0 obj
>
/ExtGState >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 419.58 595.38]
/Contents 211 0 R
/Group >
/Tabs /S
/StructParents 49
>>
endobj
56 0 obj
>
/ExtGState >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 419.58 595.38]
/Contents 212 0 R
/Group >
/Tabs /S
/StructParents 50
>>
endobj
57 0 obj
>
/ExtGState >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 419.
58 595.38]
/Contents 207 0 R
/Group >
/Tabs /S
/StructParents 45
>>
endobj
52 0 obj
>
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 419.58 595.38]
/Contents 208 0 R
/Group >
/Tabs /S
/StructParents 46
>>
endobj
53 0 obj
>
/ExtGState >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 419.58 595.38]
/Contents 209 0 R
/Group >
/Tabs /S
/StructParents 47
>>
endobj
54 0 obj
>
/ExtGState >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 419.58 595.38]
/Contents 210 0 R
/Group >
/Tabs /S
/StructParents 48
>>
endobj
55 0 obj
>
/ExtGState >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 419.58 595.38]
/Contents 211 0 R
/Group >
/Tabs /S
/StructParents 49
>>
endobj
56 0 obj
>
/ExtGState >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 419.58 595.38]
/Contents 212 0 R
/Group >
/Tabs /S
/StructParents 50
>>
endobj
57 0 obj
>
/ExtGState >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 419. 58 595.38]
/Contents 213 0 R
/Group >
/Tabs /S
/StructParents 51
>>
endobj
58 0 obj
>
/ExtGState >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 419.58 595.38]
/Contents 214 0 R
/Group >
/Tabs /S
/StructParents 52
>>
endobj
59 0 obj
>
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 419.58 595.38]
/Contents 215 0 R
/Group >
/Tabs /S
/StructParents 53
>>
endobj
60 0 obj
>
/ExtGState >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 419.58 595.38]
/Contents 216 0 R
/Group >
/Tabs /S
/StructParents 54
>>
endobj
61 0 obj
>
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 419.58 595.38]
/Contents 217 0 R
/Group >
/Tabs /S
/StructParents 55
>>
endobj
62 0 obj
>
endobj
63 0 obj
>
endobj
64 0 obj
>
endobj
65 0 obj
>
endobj
66 0 obj
>
endobj
67 0 obj
>
endobj
68 0 obj
>
endobj
69 0 obj
>
endobj
70 0 obj
>
endobj
71 0 obj
>
endobj
72 0 obj
>
endobj
73 0 obj
>
endobj
74 0 obj
>
endobj
75 0 obj
>
stream
x
58 595.38]
/Contents 213 0 R
/Group >
/Tabs /S
/StructParents 51
>>
endobj
58 0 obj
>
/ExtGState >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 419.58 595.38]
/Contents 214 0 R
/Group >
/Tabs /S
/StructParents 52
>>
endobj
59 0 obj
>
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 419.58 595.38]
/Contents 215 0 R
/Group >
/Tabs /S
/StructParents 53
>>
endobj
60 0 obj
>
/ExtGState >
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 419.58 595.38]
/Contents 216 0 R
/Group >
/Tabs /S
/StructParents 54
>>
endobj
61 0 obj
>
/ProcSet [/PDF /Text /ImageB /ImageC /ImageI]
>>
/MediaBox [0 0 419.58 595.38]
/Contents 217 0 R
/Group >
/Tabs /S
/StructParents 55
>>
endobj
62 0 obj
>
endobj
63 0 obj
>
endobj
64 0 obj
>
endobj
65 0 obj
>
endobj
66 0 obj
>
endobj
67 0 obj
>
endobj
68 0 obj
>
endobj
69 0 obj
>
endobj
70 0 obj
>
endobj
71 0 obj
>
endobj
72 0 obj
>
endobj
73 0 obj
>
endobj
74 0 obj
>
endobj
75 0 obj
>
stream
x2,3-диметилбутен-2, структурная формула, химические свойства
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
{2-}}$Чего я не понимаю: Как там могут появиться $\ce{MnCl2}$ и $\ce{Cl2}$?
Кто-нибудь, пожалуйста, объясните мне эту реакцию шаг за шагом?
- неорганическая химия
- редокс
$\endgroup$
2
$\begingroup$
Как уже отмечали другие, у вас не «нормальная» реакция, у вас есть окислительно-восстановительная реакция (если вы хотите звучать особенно вызывающе, назовите их реакциями RedOx (произносится как «ри-докс»). 92+ + 8 ч3О + 2К+}$$ Похоже, нам чего-то не хватает, чтобы сбалансировать расходы. Мы можем добавить больше ионов хлорида-спектатора к обеим частям уравнения. Они не являются частью окислительно-восстановительного потенциала, поскольку они представляют собой $\ce{Cl-}$ с обеих сторон уравнения: $$\ce{10HCl + 6HCl + 2KMnO4 -> 5Cl2 + 2MnCl2 + 8h3O + 2KCl}$$ Соберите термины в последний раз, и мы закончили: $$\ce{16HCl + 2KMnO4 -> 5Cl2 + 2MnCl2 + 8h3O + 2KCl}$$
$\endgroup$
2
$\begingroup$
9{-}}$, единственное, от чего нужно избавляться, это хлорид.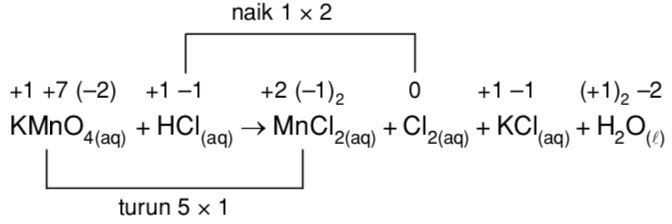 2-}$ после начала реакции, но окончательный эффект такой же, как если бы он разлетелся.
2-}$ после начала реакции, но окончательный эффект такой же, как если бы он разлетелся.
Окислительно-восстановительные реакции часто имеют продукты, которые трудно предсказать без значительного опыта в области химии. Уравновешивание этих реакций часто требует некоторых новых методов (вне проверки), таких как уравновешивание по степени окисления и уравновешивание по половинным реакциям.
$\endgroup$
0
$\begingroup$
Если вас интересует механизм, он должен выглядеть примерно так (вместо $\ce{HBr}$ использовалось $\ce{HBr}$):
$$\begin{выравнивание} \ce{2H+ + Br- + MnO4- &<-> h3MnO4Br} \tag{$K$ быстро}\\ \ce{h3MnO4Br + H+ + Br- &-> h4MnO4 + Br2} \tag{$k$ предельное}\\ \ce{h4MnO4 &-> \text{продукты}} \tag{быстро} \end{align}$$
Я полагаю, что первые два шага можно разделить на несколько шагов.
$\endgroup$
Зарегистрируйтесь или войдите в систему
Зарегистрируйтесь с помощью Google
Зарегистрироваться через Facebook
Зарегистрируйтесь, используя электронную почту и пароль
Опубликовать как гость
Электронная почта
Требуется, но никогда не отображается
Опубликовать как гость
Электронная почта
Требуется, но не отображается
Нажимая «Опубликовать свой ответ», вы соглашаетесь с нашими условиями обслуживания, политикой конфиденциальности и политикой использования файлов cookie
Что происходит, когда conc hcl добавляется к kmno4?
KMnO 4 + HCl | Реакция перманганата калия и соляной кислоты. Водная соляная кислота (HCl) реагирует с перманганатом калия (KMnO 4 ) с образованием хлорида калия (KCl), хлорида марганца (MnCl 2 ), воды (H 2 O) и газообразного хлора (Cl 2 ). ) .
Водная соляная кислота (HCl) реагирует с перманганатом калия (KMnO 4 ) с образованием хлорида калия (KCl), хлорида марганца (MnCl 2 ), воды (H 2 O) и газообразного хлора (Cl 2 ). ) .
Что происходит при взаимодействии KMnO4 с HCl?
KMnO4 + HCl → KCl + MnCl2 + Cl2 + h3O .
.Реклама. ПРОДОЛЖИТЕ ЧИТАТЬ НИЖЕ
Почему HCl не реагирует с KMnO4?
Поскольку окисление означает удаление электронов, KMnO4 не может окислять HCl, потому что удаление электронов с внутренних орбиталей затруднено .
Может ли HCl восстанавливать KMnO4?
HBr и HI восстанавливают серную кислоту, HCl может восстанавливать KMnO4 и H.
Что является продуктом K HCl?
Как сбалансировать K + HCl = KCl + h3 | Калий + соляная кислота (разбавленная)
youtube.com/embed/4-TnpPusOI0?feature=oembed» frameborder=»0″ allow=»accelerometer; autoplay; clipboard-write; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»>Как k2cr2o7 реагирует с конц. HCl?
дихромат калия + соляная кислота дает хлорид калия + хлорид хрома + вода + хлор .
Почему HCl можно использовать для подкисления KMnO4?
KMnO 4 является сильным окислителем и окисляет HCl. Перманганат реагирует с соляной кислотой с выделением хлора . Следовательно, HCl не используется для подкисления раствора перманганата волюметрически.
Что произойдет, если HCl будет использоваться вместо серной кислоты при потенциометрическом титровании?
HCl и HNO3 не используются при титровании соли Мора вместо серной кислоты, потому что: HCl является мягким восстановителем и реагирует с некоторым индикатором, которым является раствор KMnO4 , поэтому окончательное значение используемого индикатора быть больше фактического значения, мешающего эксперименту.
Почему HCl нельзя использовать для подкисления среды в реакциях окисления KMnO4 в кислой среде?
Почему HCl не используется для подкисления среды в реакции окисления KMnO4 в кислой среде? … OKMnO4 является более слабым окислителем, чем HCl . KMnO4 действует как восстановитель в присутствии HCl.
Может ли HCl окисляться?
Соляная кислота не является окислителем, но может быть окислена очень сильными окислителями с выделением газообразного хлора. В разбавленных растворах кислоты хлористый водород почти полностью диссоциирует на ионы водорода и хлора.
При восстановлении KMnO4 щавелевой кислотой в кислом растворе степень окисления Mn изменяется с?
При восстановлении KMnO4 щавелевой кислотой в кислом растворе степень окисления Mn изменяется с +7 до +2 .
Что не реагирует с раствором KMnO4?
Перманганат калия не будет реагировать с алканами , так как они являются насыщенными.
Как K реагирует с HCl?
Реакция между калием и соляной кислотой заканчивается очень быстро. Калий мгновенно воспламеняется при контакте с кислотой, образуя ярко-лиловое пламя, которое быстро растет, пока калий не сгорит .
Калий мгновенно воспламеняется при контакте с кислотой, образуя ярко-лиловое пламя, которое быстро растет, пока калий не сгорит .
Что происходит, когда калий реагирует с серной кислотой?
При взаимодействии калия с разбавленной серной кислотой образуются сульфат калия и газообразный водород .
Что происходит, когда карбонат кальция реагирует с соляной кислотой?
Как и все карбонаты металлов, карбонат кальция реагирует с кислыми растворами до производить углекислый газ . Именно эта реакция отвечает за шипение известняка при попадании на его поверхность разбавленной соляной кислоты.
Какая из следующих смесей получается реакцией концентрированной HCl и KCl * O _{ 3?
При нагревании KClO 3 с конц. HCl получается смесь хлора и диоксида хлора [называемая Euchlorine].
Может ли K2Cr2O7 окислять HCl?
K2Cr2O7 + HCl→ KCl + CrCl3 + h3O + Cl2 .
Что происходит при нагревании бихромата калия с конц.
 HCl?
HCl?Реакция взаимодействия хлороводорода и дихромата калия с образованием хлора, хлорида хрома(III), хлорида калия и воды .
Почему HCl не используется для подкисления среды?
HCl не используется для подкисления среды в реакциях окисления KMnO4 в кислой среде. Причина в том, что если используется HCl, кислород, полученный из KMnO4 + HCl, частично используется при окислении HCl до Cl , который сам действует как окислитель и частично окисляет восстановитель.
Почему для подкисления нельзя использовать соляную кислоту?
Так как HCl является концентрированной кислотой и если мы попытаемся использовать ее для подкисления воды и добавим часть ее в воду, то она нас обожжет, так как пары будут высвобождаться внезапно, что не даст нам возможности спастись от них. Таким образом, рекомендуется не использовать Hcl для этой цели.
Почему HCl нельзя использовать для подкисления k2cr2o7?
HCl не используется, поскольку часть KMnO4 окисляет ионы хлорида до газообразного хлора . Азотную кислоту использовать нельзя, так как она сама по себе является сильным окислителем и может окислять восстановитель, тем самым внося ошибку в анализ.
Азотную кислоту использовать нельзя, так как она сама по себе является сильным окислителем и может окислять восстановитель, тем самым внося ошибку в анализ.
Почему при титровании KMnO4 не используют концентрированную H3SO4?
В этой реакции изменяется степень окисления марганца и кислорода. Как правило, при создании кислой среды для титрования KMnO4 предпочтительной кислотой является h3SO4, как .S находится в степени окисления +6 и не может быть дополнительно окислен 90–116 . HCl не используется, так как Cl- можно окислить с образованием Cl2.
Что произойдет, если вместо серной кислоты использовать соляную кислоту?
Поскольку HCl немного менее кислая, чем h3SO4, она будет действовать как основание и примет протон . А поскольку HCl в растворе состоит из h4O+ и Cl-, Cl- будет протонироваться, превращаясь в HCl(г).
Что произойдет, если разбавленную H3SO4 не использовать в KMnO4?
KMnO4 является окислителем, который окисляет щавелевую кислоту. H3SO4 гарантирует, что вся щавелевая кислота останется кислотой для ускорения реакции .
H3SO4 гарантирует, что вся щавелевая кислота останется кислотой для ускорения реакции .
Почему HCl не является окислителем?
, потому что в HCl степень окисления хлора равна -1. хлор принимает один электрон и образует Cl — теперь электронная конфигурация становится 2,8,8 и не имеет возможности принять новый электрон, поэтому Cl- никогда не действует как окислитель .
Сколько зарождающихся атомов кислорода образуется, когда KMnO4 находится в основных условиях?
По реакции 1 моль перманганата калия дает 5 моль од выделяющегося кислорода.
Что из следующего является хорошим окислителем?
Галогены, перекись и кислород являются хорошими окислителями.
Какова роль конц. HCl?
Концентрированная соляная кислота (HCl) является наиболее часто используемой галогеновой кислотой для растворения геологических проб . В отличие от HNO 3 , HCl является слабой восстановительной кислотой и обычно не используется для разложения органических материалов. Это отличный растворитель для карбонатов, фосфатов, многих оксидов металлов и металлов.
Это отличный растворитель для карбонатов, фосфатов, многих оксидов металлов и металлов.
Что является восстановителем в концентрированной HCl?
H+ в HCl является реагентом-восстановителем, а HCl является окислителем. … HCl является окисляющим соединением, так как 2H+ + 2e- –>, h3 (St. E.P. = 0,00 В) и Ионы хлорида являются очень слабым восстановителем (2Cl- –>, Cl2 + 2e- при St.
Почему растворяется соляная кислота?
Хлористый водород (HCl) диссоциирует в воде , что позволяет ему «растворяться». Ионы водорода (протоны) реагируют с водой с образованием ионов гидроксония (H 3 O), а ионы хлорида в растворе находятся в свободном состоянии.
Как изменится степень окисления Mn, когда KMnO4 превратится в Mn 2?
2 KMnO 4 → K 2 MnO 4 + MnO 2 (s) + O. Здесь степень окисления марганца изменяется по мере того, как перманганат калия (степень окисления +7) разлагается до манганата калия (степень окисления +6) и диоксид марганца (степень окисления +4).
Какова роль иона Mn 2 при окислительно-восстановительном титровании KMnO4 щавелевой кислотой?
Щавелевая кислота действует как восстановитель, а KMnO4 действует как окислитель, KMnO4 действует как индикатор того, где ионы перманганата имеют темно-фиолетовый цвет . При этом окислительно-восстановительном титровании MnO4– восстанавливается до бесцветных ионов марганца (Mn2+) в кислой среде.
Как изменяется степень окисления Mn в KMnO4, реагирующем в кислой среде?
Степень окисления атома Mn в KMnO4 равна +7 . Как видите, Mn отдает 5 электронов. (Делая его окислителем.)
Как KMnO4 реагирует с алкеном?
Когда фиолетовый раствор окислителя KMnO4 добавляют к алкену, алкен окисляется до диола, а KMnO4 превращается в коричневый MnO2 . Таким образом, если в этой реакции фиолетовый цвет меняется на коричневый, это положительная реакция.
Какие соединения не будут подвергаться дальнейшему окислению KMnO4?
Но в наддисерной кислоте [{{text{H}}_2}{{text{S}}_2}{{text{O}}_7}] сера находится в максимальной степени окисления, равной +6, и поэтому его дальнейшее окисление невозможно, потому что его степень окисления не может быть увеличена дальше. Таким образом, правильный вариант А.
Таким образом, правильный вариант А.
Что из перечисленного не окисляется KMnO4?
Ионы F- не могут быть окислены даже сильными окислителями, такими как KMnO4.
Стандартизация перманганата калия за 7 шагов – PraxiLabs
Нурхан Эссам 6 декабря 2020 г. Химия, статьи для виртуального обучения Комментарии к записи Стандартизация перманганата калия за 7 шагов отключены 32 612 просмотров
Если вы изучаете химию, то наверняка имели дело с веществом, характеризующимся своим пурпурным цветом, которое всегда находится в бутылке темного цвета, а также может испачкать руки и одежду.
Да, это перманганат калия, так что это за вещество? Его свойства? Его использование? А цель его стандартизации и как? Это то, что мы обсудим в этой статье и сосредоточимся на стандартизации перманганата калия.
попробовать Стандартизация перманганата калия с помощью праксилабс
Table of Contents
Overview Properties of Potassium Permanganate Physical Properties:| Appearance | – Темно-фиолетовые или черные кристаллы. – Ярко-фиолетовый в растворе. (можно найти в виде таблеток, порошка или кристаллов, как показано на рис. 1,2) |
| Фаза | Твердый
|
| Запах | Без запаха, но со сладким вкусом.
|
| Точка кипения | 100°С |
| Плотность | 2,703 г/см³ |
| Растворимость | – Растворим во многих органических соединениях; также концентрированными кислотами с выделением кислорода. — Растворим в ацетоне, метаноле, уксусной кислоте, трифторуксусной кислоте, уксусном ангидриде, пиридине, бензонитриле, сульфолане. |
| Растворимость в воде | 6,38 г/100 мл (20 °C) |
| Температура плавления | 270 °C разл. |
- Перманганат калия представляет собой неорганическое химическое соединение.
 Он также известен как перманганат калия и кристаллы Конди.
Он также известен как перманганат калия и кристаллы Конди. - Это сильный окислитель с химической формулой KMnO4, образующий темно-коричневый диоксид марганца Mno2, окрашивающий все органическое вещество.
формула перманганата калия
- Молекулярная масса/молярная масса KMnO4 составляет 158,034 г/моль.
- Производится (в химической промышленности) из двуокиси марганца.
- Практически во всех областях применения KMnO4 используются его окислительные свойства.
- Бурно реагирует с серной кислотой, что приводит к взрыву.
- Немедленно реагирует с глицерином и простыми спиртами с образованием пламени и дыма.
- Действует как очень сильный окислитель в кислых, нейтральных и щелочных средах.
Уравнения, представляющие окисление в этих средах, следующие:
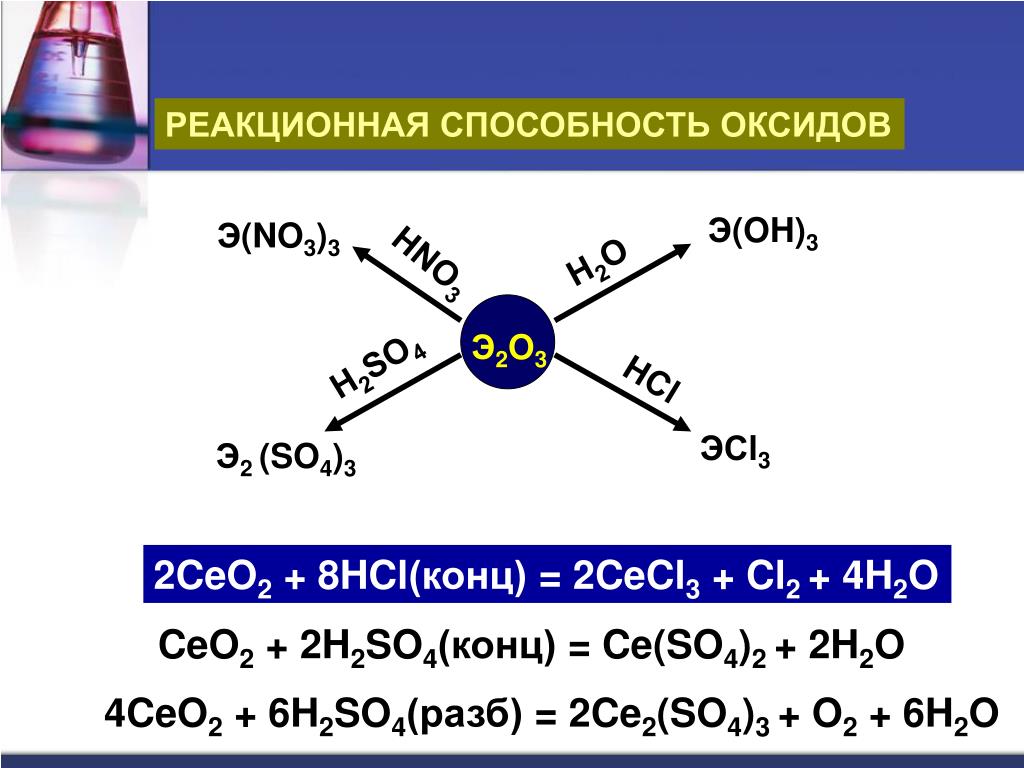
1) в кислой среде:-
2KMNO4 + 5NA2SO3 + 3H3SO4 → K2SO4 + 2MNSO4 + 5NA2SO4 + 3H3O4 3.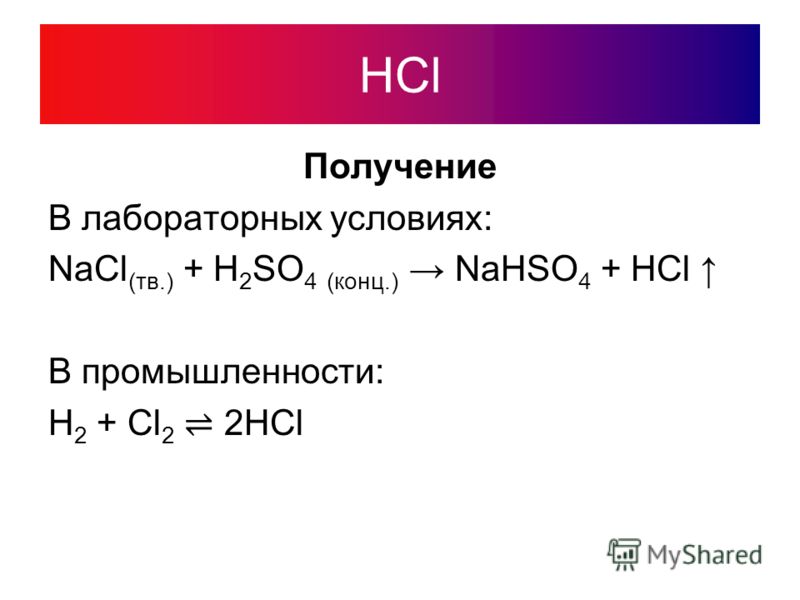 163. 29000 2 9000 3
163. 29000 2 9000 3
(Концентрированная соляная кислота образует хлор)
Примечание: Марганецсодержащие продукты окислительно-восстановительных реакций зависят от PH. Кислые растворы перманганата восстанавливаются до бледно-розового иона Mn2+, как и в хлориде марганца(II).
2) В нейтральной среде:-
2KMnO4 +3K2SO3+ h3O → 3K2SO3+2MnO2 + 2KOH
4 степени окисления. Оксид марганца(IV) окрашивает кожу, когда на нее наносят KMnO4. KMnO4 самопроизвольно восстанавливается в щелочном растворе до манганата калия зеленого цвета, где марганец находится в степени окисления +6.
3) В щелочной среде:-
2KMnO4+Na2SO3+2KOH → 2K2Mno4+Na2SO4+h3O
(MnO42- восстанавливается)
При нагревании кристаллы перманганата разлагаются с выделением кислорода.
2KMno4 → K2Mno4 + Mno2 + O2
При разбавлении кристаллы перманганата разлагаются с выделением кислорода.
2KMno4 + 2h3O Солнечный свет → 4KOH + 4MnO4+ 3O2
Использование перманганата калия:- Одним из наиболее важных промышленных применений KMnO4 является химический синтез многих важных соединений в качестве окислителя.
- Широко используется в водоочистке. Он используется в качестве регенерирующего реагента для удаления железа и сероводорода (запах тухлых яиц) из колодезной воды.
- Он используется в качестве дезинфицирующего средства для очистки ран и лечения некоторых кожных заболеваний, таких как грибковые инфекции стопы и дерматит.
- Другим важным применением KMnO4 является лечение бактериальных инфекций.
- Используется для набивки тканей и дубления кожи.
- Используется как отбеливатель, пестицид и антисептик.
- В технологии топливных элементов он используется в качестве приемника электронов в микробном топливном элементе.
- В органической и аналитической химии KMnO4 из-за его сильного цвета и окисляющей природы используется в химических лабораториях в качестве реагента для расчета количества вещества, которое может быть окислено в образце.
 В качественном анализе это значение называется перманганатным числом.
В качественном анализе это значение называется перманганатным числом.
- В концентрированной форме KMnO4 вызывает раздражение глаз и кожи человека. Он может реагировать со многими восстановителями или органическими материалами, потому что он легко воспламеняется.
- Антибактериальное действие KMnO4 зависит от процесса окисления белков бактерий или тканей этим соединением. Оставляет пятна на коже или тканях.
- Поскольку он действует путем разрушительного процесса окисления на все органические вещества, его использование ограничено только для внешних целей.
- Действует как противоядие при отравлении барбитуратами, хлоралгидратом и алкалоидами. Раствор перманганата 1:5000 при промывании желудка окисляет яды и препятствует их всасыванию.
- Это соединение обычно хранится в плотно закрытых контейнерах. С KMnO4 следует обращаться осторожно, так как при контакте с легко окисляющимися веществами может произойти взрыв.

Что произойдет при употреблении перманганата калия?
Проглатывание KMnO4 может вызвать повреждение верхних отделов желудочно-кишечного тракта. Также он может вызывать системные токсические эффекты, такие как респираторный дистресс-синдром взрослых, коагулопатия, печеночно-почечная недостаточность, панкреатит и даже смерть в тяжелых случаях.
Опасность перманганата калия- Твердый перманганат калия является сильным окислителем и, как правило, его следует хранить отдельно от восстановителей.
- Для некоторых реакций требуется немного воды. Например, порошок KMnO4 и сахарная пудра загорятся (но не взорвутся) через несколько секунд после добавления капли воды.
- Разбавленные растворы KMnO4 не опасны. KMnO4 образует опасные продукты при смешивании с концентрированными кислотами.
- KMnO4 окрашивает кожу и одежду, и с ним следует обращаться осторожно. Пятна на одежде можно смыть уксусной кислотой.
 Пятна на коже исчезают в течение 48 часов.
Пятна на коже исчезают в течение 48 часов.
Посетите наши виртуальные лаборатории и окунитесь в виртуальный мир научного образования
Попробуйте эксперименты PraxiLabs БЕСПЛАТНО!
Как приготовить раствор перманганата калия в лаборатории?
Получение перманганата калия – KMnO4
Перманганат калия промышленно получают путем смешивания раствора гидроксида калия KOH и порошкообразного оксида марганца MnO2 с окислителями, такими как хлорат калия. Смесь кипятят и выпаривают, а остаток нагревают в железных сковородах до тех пор, пока он не приобретет пастообразную консистенцию.
6KOH + 3MnO2 + 6KClO3 → 3K2MnO9 + 6KCl + 3h3O
Образовавшийся манганат калия (зеленый) кипятят с большим количеством воды и током хлора, углекислого газа CO2 и озонированного воздуха пропускают в жидкость до полного растворения. превращается в перманганат. Образовавшийся MnO2 непрерывно удаляют, чтобы предотвратить его разрушение.
6K2MnO4 + 3Cl2 → 6KMnO4 (перманганат калия) + 6KCl
Раствор KMnO4 отбирают из любого осадка MnO2, концентрируют и кристаллизуют. Кристаллы центрифугируют и сушат.
Стандартизация перманганата калия – KMno 4 с щавелевой кислотой Что означает стандартизация перманганата калия? (Цель)Означает определение крепости перманганата калия стандартным раствором щавелевой кислоты. Эта реакция помогает изучить теорию окисления и восстановления.
Инструменты и реагенты для стандартизации kmno4:- Бюретка.
- Дистиллированная вода.
- Пипетка.
- Воронка.
- Горячая плита.
- Коническая колба 250 мл.
- Стакан на 250 мл.
- Раствор перманганата калия.
- Стандартный раствор щавелевой кислоты (0,1 М).
- Серная кислота.
1. Очистите бюретку дистиллированной водой, затем слейте воду, затем промойте бюретку раствором перманганата калия, а затем опорожните бюретку.
Очистите бюретку дистиллированной водой, затем слейте воду, затем промойте бюретку раствором перманганата калия, а затем опорожните бюретку.
2.Наполните бюретку раствором перманганата калия и возьмите начальную точку.
3. Перенести 10 мл щавелевой кислоты с помощью пипетки в чистую коническую колбу; затем добавить 5 мл разбавленной серной кислоты; затем нагрейте раствор до 70°С с помощью плитки, чтобы ускорить реакцию между щавелевой кислотой и перманганатом калия.
4.Начать титрование (Фтитрование щавелевой кислоты с kmno4), постепенно добавляя перманганат калия из бюретки при постоянном встряхивании колбы до изменения цвета с фиолетового на бесцветный.
5. Продолжайте добавлять перманганат калия, пока цвет раствора снова не изменится с бесцветного на пурпурный, и определите конечную точку.
6. Запишите объем перманганата калия, использованного при титровании.
7. Повторите предыдущие шаги три раза; затем рассчитайте средний объем перманганата калия, использованного при титровании; затем рассчитать концентрацию перманганата калия.
Присоединяйтесь к praxilabs сейчас бесплатно
Экспериментальные данные:
| Испытание 1 | Испытание 2 | Испытание 3 | |
| Исходный объем KMnO4 мл | |||
| Конечный объем KMnO4 мл | |||
| Используемый объем KMnO4 мл | |||
| Средний объем KMnO4 мл |
Reaction:
2KMnO4 + 5h3C2O4 + 3h3SO4 → 2MnSO4 + 10CO2 + 18h3O + K2SO4
Calculations:a2M1V1 = a1M2V2
where
M1 (concentration of potassium permanganate) = — ——— молярная
V1 (средний объем перманганата калия) = ————мл
M2 (концентрация щавелевой кислоты) = 0,1 молярная
V2 (объем щавелевой кислоты) = 10 мл
а1 (количество электронов, полученных на формульную единицу перманганата калия в сбалансированном химическом уравнении полуклеточной реакции) =2
a2 (количество электронов, потерянных на формульную единицу щавелевой кислоты в сбалансированном химическом уравнении реакции полуэлемента) = 5
Подстановкой в уравнение
a2M1V1 = a1M2V2
получаем M1= ———– молярная
Затем, подставив в предыдущее уравнение можно рассчитать прочность перманганата калия.
Прочность = молярность*молекулярная масса
Молярность=M1=————молярная
Молекулярная масса перманганата калия = 158
Следовательно, прочность = ———-грамм/литр
Заключение :Из приведенного выше эксперимента видно, что перманганат калия можно эффективно стандартизировать с помощью щавелевой кислоты. решение. После проведения расчета крепость приготовленного раствора перманганата калия составила … грамм/литр
Примечания:- Окраска перманганата калия изменяется в зависимости от реакции; в этом эксперименте не используется дополнительный индикатор для определения конечной точки, поскольку перманганат калия является самоиндикатором.
- Колбу для титрования, содержащую щавелевую кислоту, нагревают примерно до 60-70 градусов Цельсия, а затем титруют KMnO4. Если температура слишком низкая (ниже 55 градусов Цельсия), взаимодействие между щавелевой кислотой и перманганатом калия будет протекать слишком медленно.
 Выше 70 градусов по Цельсию щавелевая кислота начинает разлагаться, поэтому важно оставаться в этом диапазоне.
Выше 70 градусов по Цельсию щавелевая кислота начинает разлагаться, поэтому важно оставаться в этом диапазоне. - Реакцию между щавелевой кислотой и перманганатом калия проводят в кислой среде, так как перманганат-ион в кислой среде является очень сильным окислителем. Кислотность вводится добавлением разб. раствор серной кислоты.
- В этом эксперименте перманганат калия является аналитом, а щавелевая кислота является титрантом. Здесь перманганат калия является окислителем, а щавелевая кислота является восстановителем.
- Ион перманганата (MnO4-) имеет темно-фиолетовый цвет. В кислой среде MnO4 восстанавливается до бесцветных ионов марганца (Mn2+). При достижении конечной точки добавление последней капли перманганата придает раствору светло-фиолетовый цвет.
- С реагентами и инструментами следует обращаться очень осторожно.
Стандартизация перманганата калия применяют для определения прочности перманганата калия стандартным раствором щавелевой кислоты.

 Он также известен как перманганат калия и кристаллы Конди.
Он также известен как перманганат калия и кристаллы Конди.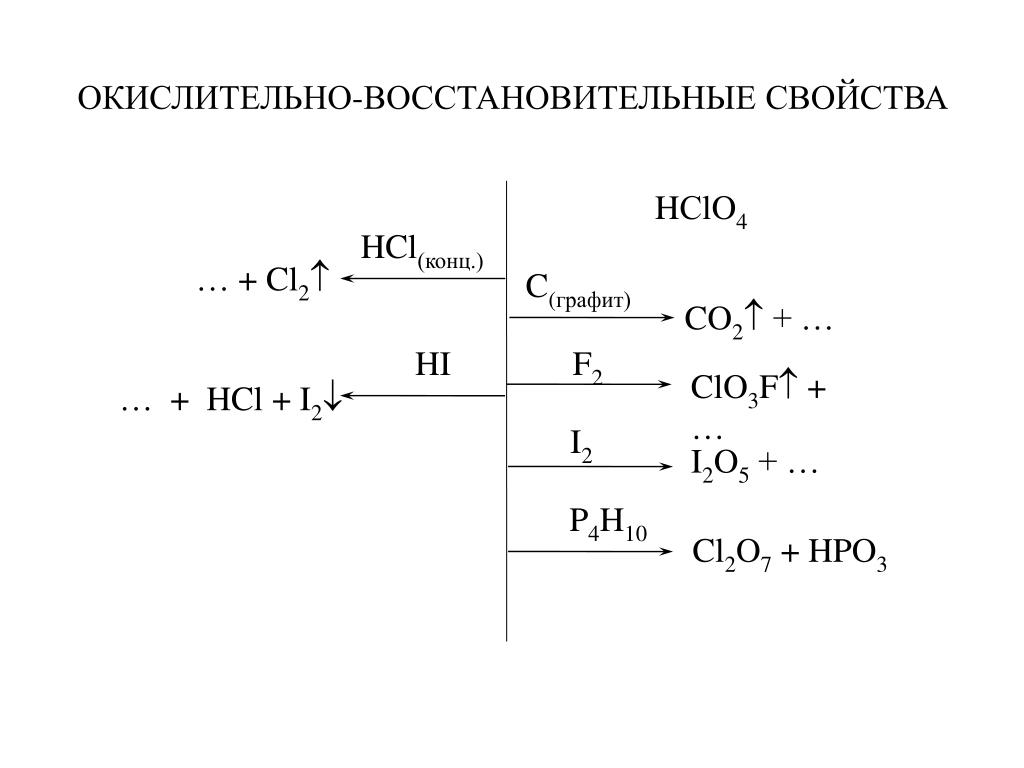 В качественном анализе это значение называется перманганатным числом.
В качественном анализе это значение называется перманганатным числом.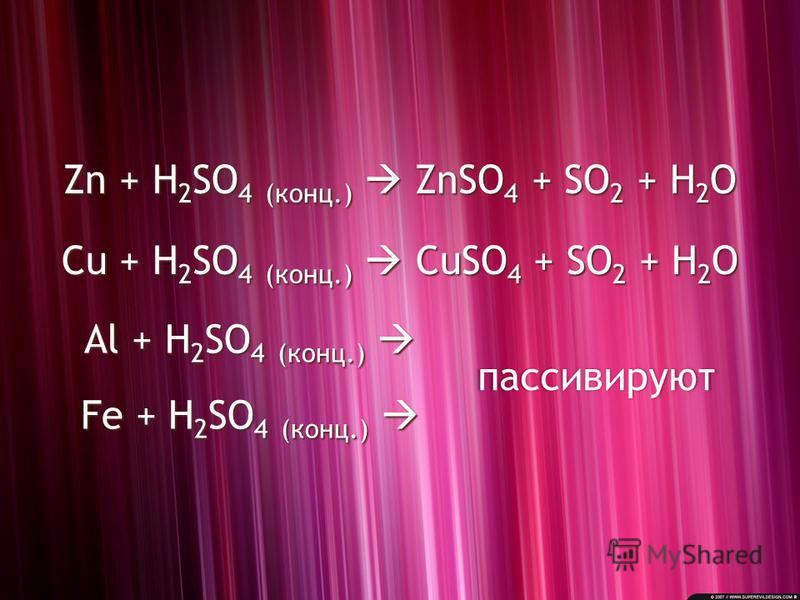
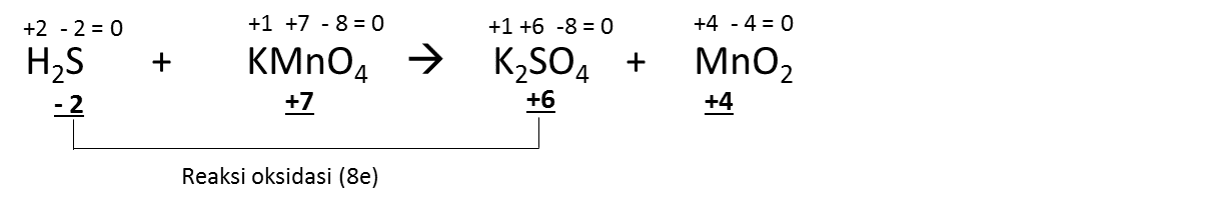 Пятна на коже исчезают в течение 48 часов.
Пятна на коже исчезают в течение 48 часов.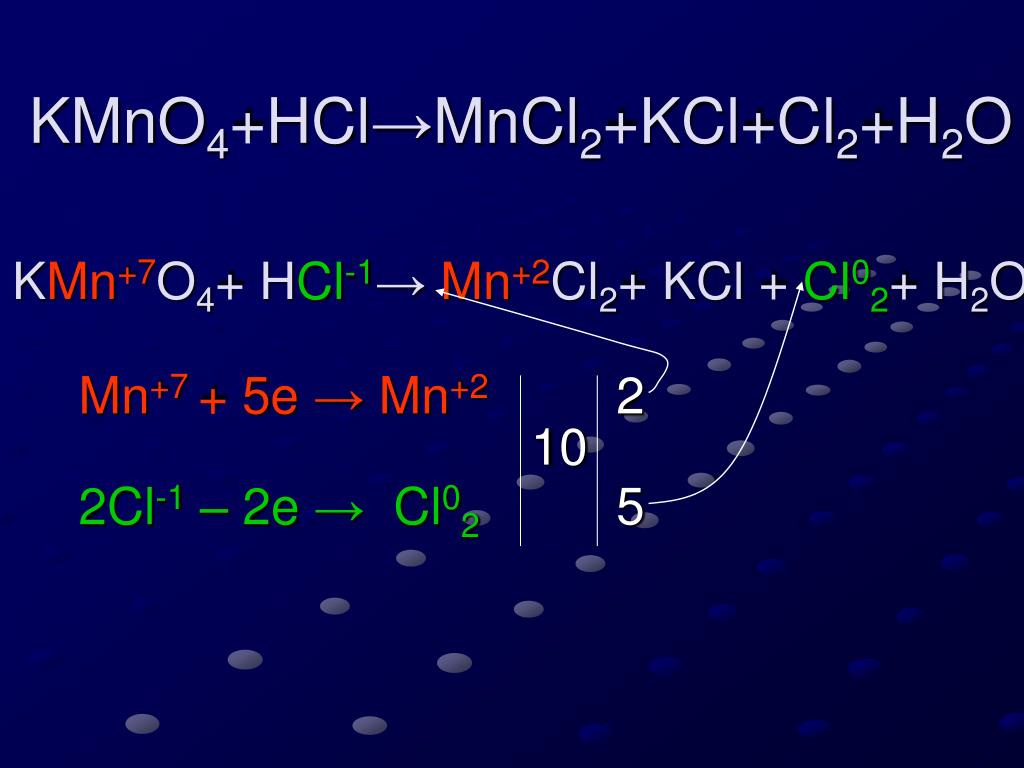 Выше 70 градусов по Цельсию щавелевая кислота начинает разлагаться, поэтому важно оставаться в этом диапазоне.
Выше 70 градусов по Цельсию щавелевая кислота начинает разлагаться, поэтому важно оставаться в этом диапазоне.