Окисление органических веществ перманганатом калия
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Окислительно-восстановительные реакции
Окислительно-восстановительные
реакции (ОВР) — это реакции, сопровождающиеся
изменением степени окисления элементов
вследствие смещения или полного перехода
электронов от одних атомов или ионов к
другим. Окисление
– процесс отдачи электронов атомом,
молекулой или ионом; восстановление —
процесс присоединения электронов
атомом, молекулой или ионом. Окисление
и восстановление — это взаимосвязанные
процессы, протекающие одновременно.
Окислителями могут быть атомы и молекулы
некоторых неметаллов; сложные ионы и
молекулы, содержащие атомы элементов
в высшей или в одной из высших степеней
окисления MnO4—, NO3—, SO42-, Cr2O72-, ClO3—, PbO2 и др. ; положительно заряженные ионы
металлов (Fe3+, Au3+, Ag+, Sn4+, Hg2+ и др.). Типичными восстановителями
являются почти все металлы и некоторые
неметаллы (С, Н2 и др.) в свободном состоянии; отрицательно
заряженные ионы неметаллов (S2-, I— и др.), катионы, степень окисления которых
может возрасти (Sn2+, Fe2+, Cu+ и др.). Если вещество содержит элемент
в промежуточной степени окисления, то
в зависимости от условий проведения
реакции оно может быть и окислителем и
восстановителем. Например, нитрит калия
в присутствии сильного окислителя
проявляет восстановительные свойства,
окисляясь при этом до нитрата
; положительно заряженные ионы
металлов (Fe3+, Au3+, Ag+, Sn4+, Hg2+ и др.). Типичными восстановителями
являются почти все металлы и некоторые
неметаллы (С, Н2 и др.) в свободном состоянии; отрицательно
заряженные ионы неметаллов (S2-, I— и др.), катионы, степень окисления которых
может возрасти (Sn2+, Fe2+, Cu+ и др.). Если вещество содержит элемент
в промежуточной степени окисления, то
в зависимости от условий проведения
реакции оно может быть и окислителем и
восстановителем. Например, нитрит калия
в присутствии сильного окислителя
проявляет восстановительные свойства,
окисляясь при этом до нитрата
3KNO2 + K2Cr2O7 + 4H2SO4 = 3KNO3 + Cr2(SO4)3 + K2SO4 + 4H2O
При взаимодействии с восстановителем, наоборот проявляет окислительные свойства
2KNO2 + 2KI + 2H2SO4 = 2NO + I2 + 2K2SO4 + 2H2O
Такая
окислительно-восстановительная
двойственность характерна также для
Н2О2, H2SO3 (и ее солей) и т. д.
д.
Составление уравнений ОВР.
Метод электронного баланса основан на сравнении степеней окисления атомов в исходных и конечных веществах. В основе его лежит правило, что число электронов, отданных восстановителем, должно равняться числу электронов, присоединенных окислителем.
Рассмотрим данный метод на реакции взаимодействия сероводорода с перманганатом калия в кислой среде.
H2S + KMnO4 + H2SO4 = S + MnSO4 + K2SO4 + H2O
Затем определяем изменение степеней окисления атомов
H2S-2 + KMn+7O4 + H2SO4 = S0 + Mn+2SO4 + K2SO4 + H2O
Отсюда видно, что степень окисления изменяется у серы и марганца
Далее
составляем электронные уравнения, т. е.
изображаем процессы отдачи и присоединения
электронов:
е.
изображаем процессы отдачи и присоединения
электронов:
S-2 – 2e = S5
Mn+7 + 5e = Mn+2 2
Находим коэффициенты при окислителе и восстановителе, а затем при других реагирующих веществах. Из электронных уравнений видно, что надо взять 5 молекул H2S и 2 молекулы KMnO4, тогда получим 5 атомов S и 2 молекулы MnSO4. Кроме того, из сопоставления атомов в левой и правой частях уравнения найдем, что образуется также 1 молекула K2SO4 и 8 молекул воды.
Окончательное уравнение реакции будет иметь вид:
5H2S + 2KMnO4 + 3H2SO4 = 5S + 2MnSO4 + K2SO4 + 8H2O
Правильность
написания уравнения проверяется путем
подсчета атомов каждого элемента в
левой и правой частях уравнения.
Лабораторная работа. Окислительно-восстановительные реакции Опыт 1. Окислительные свойства kMnO4 в различных средах.
В три конические колбы поместить по 3 капли раствора KMnO4. Затем в первую добавить 2 капли раствора 2 н. H2SO4, во вторую — 2 капли дистиллированной воды, в третью -2 капли раствора NaOH, после чего добавлять по каплям в каждую пробирку раствор Na2SO3 до изменения цвета раствора. Как ведет себя KMnO4 в кислой, нейтральной и щелочной среде ?
KMnO4 + Na2SO3 + H2SO4 MnSO4 + Na2SO4 + K2SO4 + H2O
KMnO4 + Na2SO3 + H2O MnO2 + Na2SO4 + KOH
KMnO4 + Na2SO3 + NaOH Na2MnO4 + К2SO4 + H2O
Определить
степень окисления для всех элементов,
расставить коэффициенты в уравнениях
реакций.
Опыт 2. Окислительные свойства дихромата калия.
Налейте в две пробирки по 3-4 капли раствора K2Cr2O7, добавьте в одну из пробирок 3-4 капли 2 н. раствора H2SO4, в другую — 3-4 капли 2 н. раствора щелочи. Обратите внимание на изменение цвета раствора во второй пробирке. Добавьте во все пробирки сульфита натрия. Дайте объяснения наблюдаемым явлениям.
К2Cr2O7+ H2SO4 + Na2SO3Cr2 (SO4) 3 + К2SO4+ Na2SO4+ H2O
Определите
степень окисления для всех элементов,
расставьте коэффициенты в уравнениях
реакций.
Опыт 3.Восстановление дихромата калия.
В пробирку налить 5-6 капель раствора дихромата калия, добавить 2-3капли серной кислоты и внести несколько кристалликов сульфида калия. Встряхнуть содержимое пробирки. Наблюдать изменение окраски.
Опыт 4. Окислительно–восстановительные свойства соединений железа (III)
В пробирку налить 4-5 капель раствора KMnO4 и 1-2 капли H2SO4 по каплям добавить раствор сульфата железа (II) до обесцвечивания раствора.
В
пробирку налить 4-5 капель раствора
хлорида железа и 1-2 капли раствора иодида
калия. Отметить изменение окраски
раствора. В пробирку с 7-8 каплями крахмала
внести 1-2 капли полученного раствора.
Определить степень окисления для всех
элементов, расставить коэффициенты в
уравнениях реакций.
KMnO4 + FeSO4 + H2SO4 MnSO4 + Fe2 (SO4 ) 3 + K2SO4 + H2O
FeCl3 +KI FeCl2+KCl+I2
Опыт 5. Самоокисление и самовосстановление (диспропорционирование) сульфита натрия.
В
две цилиндрические пробирки поместить
по 2-3 кристаллика Na2SO3.
Одну пробирку оставить в качестве
контрольной. Вторую закрепить в штативе
и нагревать в течение 5-6 мин. Дать пробирке
остыть. В обе пробирки внести по 2-3 мл
дистиллированной воды, размешать
стеклянными палочками до растворения
солей, находящихся в пробирках. Добавить
в каждую пробирку по 2-3 мл раствора CuSO4.
Отметить окраску осадков в пробирках.
Как объяснить различие окраски? Черный
осадок, полученный во второй пробирке,
представляет собой сульфид меди. Какой
продукт прокаливания сульфита натрия
дал с сульфатом меди этот осадок? Написать
уравнение реакции разложения сульфита
натрия, учитывая, что вторым продуктом
прокаливания является сульфит натрия.
Добавить
в каждую пробирку по 2-3 мл раствора CuSO4.
Отметить окраску осадков в пробирках.
Как объяснить различие окраски? Черный
осадок, полученный во второй пробирке,
представляет собой сульфид меди. Какой
продукт прокаливания сульфита натрия
дал с сульфатом меди этот осадок? Написать
уравнение реакции разложения сульфита
натрия, учитывая, что вторым продуктом
прокаливания является сульфит натрия.
Na2SO3 + H2O +CuSO4 H2SO4+ Cu2O + NaOH
Определить степень окисления для всех элементов, расставить коэффициенты в уравнениях реакций.
Опыт 6. Окислительные свойства пероксида водорода.
В
пробирку с 5-6 каплями раствора KI прибавить 3-4 капли 2 н H2SO4 и затем по каплям прибавлять раствор H2O2 до появления желтой окраски. Для
обнаружения в растворе йода внести в
пробирку несколько капель хлороформа
или бензола. Составьте уравнение реакции.
Для
обнаружения в растворе йода внести в
пробирку несколько капель хлороформа
или бензола. Составьте уравнение реакции.
KI + H2O2 + H2SO4I2 + H2O + K2SO4
Определить степень окисления для всех элементов, расставить коэффициенты в уравнениях реакций.
Опыт 7. Восстановительные свойства пероксида водорода.
В
пробирку с 5-6 каплями KMnO4 прибавить 3-4 капли 2 н H2SO4,
5-6 капель пероксида водорода и подогреть.
Что происходит? Составить уравнение
реакции, учитывая, что пероксид водорода
окисляется до кислорода.
KMnO4 + H2O2 + H2SO4 MnSO4 + O2 + K2SO4 + H2O
Определить степень окисления для всех элементов, расставить коэффициенты в уравнениях реакций.
Опыт 8. Окисление меди азотной кислотой.
В пробирку поместить кусочек медной проволоки и прибавить 5-6 капель 0,2 н HNO3. Отметить выделение газа, растворение меди и изменение цвета раствора. Составить электронные уравнения реакции, указав окислитель и восстановитель. Определить степень окисления для всех элементов, расставить коэффициенты в уравнениях реакций.
Cu + HNO3 Cu(NO3)2 + NO + H2O
Контрольные вопросы
1. Какие из
следующих реакций являются
окислительно-восстановительными:
Какие из
следующих реакций являются
окислительно-восстановительными:
a) Na2CO3 + SiO2 = Na2SiO3 + CO2 б) Fe2O3 + CO = 2FeO + CO2
в) K2Cr2O7 + 2KOH = 2K2CrO4 + H2O
2. Определить окислитель и восстановитель и подобрать коэффициенты в следующих реакциях окисления-восстановления:
a) Na2SO3 + I2 + H2O = Na2SO4 + HI б) S + HNO3 = H2SO4 + NO
3. Степень
окисления +2 в соединениях имеют металлы:
Cu,
Al, Zn,
Sn,
Pb,
Cr, Fe,
Mn
Степень
окисления +2 в соединениях имеют металлы:
Cu,
Al, Zn,
Sn,
Pb,
Cr, Fe,
Mn
4.Степень окисления +3 в соединениях имеют металлы: Cu, Al, Zn, Sn, Pb, Cr, Fe, Mn
5.Степень окисления +1 в соединениях имеют металлы: Cu, Al, Zn, Sn, Pb, Cr, Fe, Mn, Na, Ca, Ag
Какова степень окисления Mn в $KMn{{O}_{4}}$ и S в $N{{a}_{2}}{{S}_{2}}{{O}_ {3}}$?
Дата последнего обновления: 14 апреля 2023 г.
•
Всего просмотров: 282,3 тыс.
•
Просмотров сегодня: 2,52 тыс.
Подсказка: Степень окисления или степень окисления состояние — это заряд, полученный атомом элемента, когда он теряет или приобретает электроны при переходе из своего свободного состояния в связанное состояние с атомами других элементов. Он может быть положительным, отрицательным или нулевым.
Полный ответ:
> Степень окисления щелочных металлов (например, Na, K, Li и т. д.) всегда принимается равной +1.
д.) всегда принимается равной +1.
> Степень окисления кислорода равна -2 во всех его соединениях, за некоторыми исключениями. Степень окисления O в пероксидах (например, $N{{a}_{2}}{{O}_{2}}$, ${{H}_{2}}{{O}_{2}}$ ), супероксид (например, $K{{O}_{2}}$) и $O{{F}_{2}}$ равны -1, $-\dfrac{1}{2}$ и +2, соответственно.
Степень окисления Mn в перманганате калия $KMn{{O}_{4}}$ рассчитывается следующим образом:
Пусть степень окисления Mn равна ‘’. Окисление К равно +1, а О равно -2. $KMn{{O}_{4}}$ — нейтральное соединение, поэтому суммарный заряд на нем принимается равным нулю.
1(+1)+x+4(-2)=0
1+x-8=0
x=7
Следовательно, степень окисления Mn в +7.
Степень окисления S в тиосульфате натрия, $N{{a}_{2}}{{S}_{2}}{{O}_{3}}$ можно рассчитать как:
Для расчета степени окисления S in $N{{a}_{2}}{{S}_{2}}{{O}_{3}}$, мы должны сначала взглянуть на его структуру.
Имеет два атома серы в разных степенях окисления. Так как сера ${{S}_{2}}$ связана с серой ${{S}_{1}}$ координационной двойной связью. Известно, что ${{S}_{1}}$ отдает свою электронную пару ${{S}_{2}}$. Следовательно, степень окисления ${{S}_{2}}$ равна -2.
Так как сера ${{S}_{2}}$ связана с серой ${{S}_{1}}$ координационной двойной связью. Известно, что ${{S}_{1}}$ отдает свою электронную пару ${{S}_{2}}$. Следовательно, степень окисления ${{S}_{2}}$ равна -2.
Пусть теперь степень окисления серы ${{S}_{1}}$ равна ‘$x$’. Оба атома Na имеют степень окисления +1, а все три атома O находятся в степени окисления -2. Общий заряд соединения равен 0. Таким образом, степень окисления другого атома серы можно рассчитать как:
2(+1)+x+1(-2)+3(-2)=0
2+x-2-6=0
x-6=0
x=6
Следовательно, степень окисления S в $N{{a}_{2}}{{S}_{2}}{{O}_{3}}$ это +6.
Следовательно, степень окисления Mn в $KMn{{O}_{4}}$ равна +7, а S в $N{{a}_{2}}{{S}_{2} {{O}_{3}}$ равно +6.
Примечание: Обычно мы допускаем ошибку при расчете степени окисления S в $N{{a}_{2}}{{S}_{2}}{{O}_{3}} $. Мы можем просто вычислить его равным +2, как показано ниже, что неверно.
2+2x+3(-2)=0
2x-4=0
x=2
Два атома серы находятся в разных степенях окисления в $N{{a}_{2}}{{S}_ {2}}{{O}_{3}}$.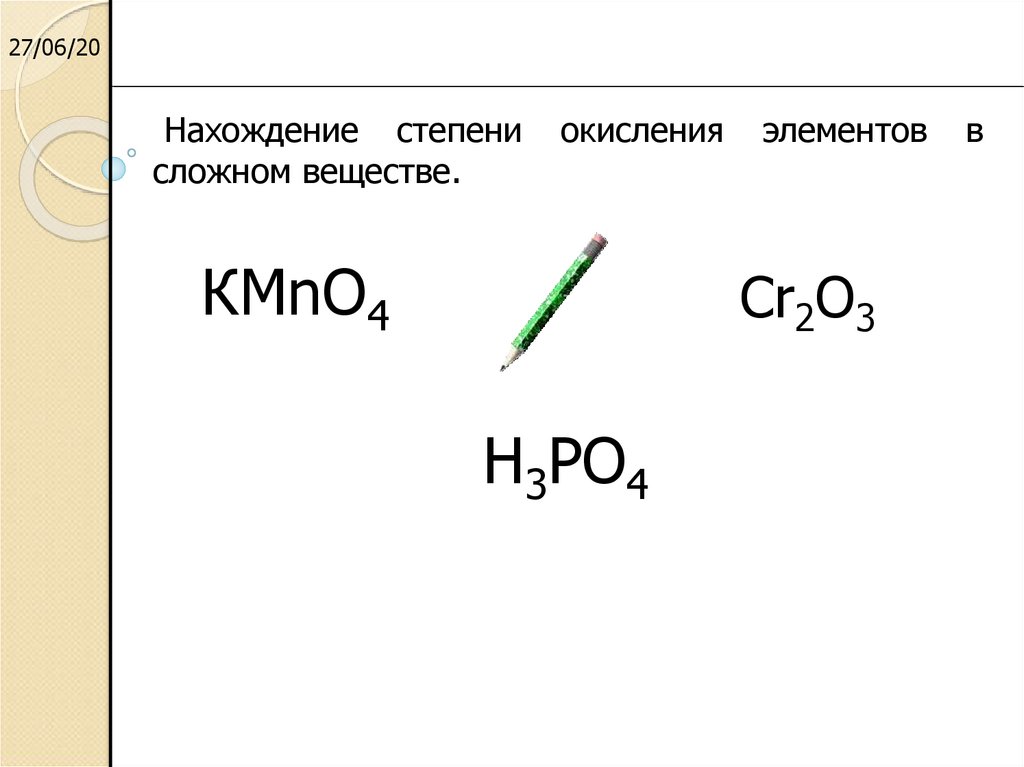
Недавно обновленные страницы
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть организованы 12 класса химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал Химический класс 12 JEE_Main
Что из перечисленного ниже является истинным пероксидом A rmSrmOrm2 Химический класс 12 JEE_Main
Какой элемент обладает наибольшим атомным радиусом А 11 класс химии JEE_Main
Фосфин получают из следующей руды Кальций 12 класс химии JEE_Main
В Индии по случаю бракосочетания фейерверки 12 класса химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть расположены химический класс 12 JEE_Main
Что из следующего имеет самый высокий электродный потенциал химический класс 12 JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 химический класс 12 JEE_Main
Какой элемент обладает наибольшим атомным радиусом Химический класс 11 JEE_Main
Фосфин получают из следующей руды Химический класс кальция 12 JEE_Main
Тенденции сомнения
Oxidations 01
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 15387
Перманганат калия, KMnO 4 , является сильным окислителем и имеет множество применений в органической химии. o = 1,68\,V\] 9o = 0,6\, V\]
o = 1,68\,V\] 9o = 0,6\, V\]
Общая реакционная способность с органическими молекулами
KMnO 4 способен окислять атомы углерода, если они содержат достаточно слабые связи, в том числе
- Атомы углерода с \(\pi\) связями, как в алкенах и алкинах
- Атомы углерода со слабыми связями C-H, такие как
- С-Н связи в альфа-положениях замещенных ароматических колец
- С-Н связей в атомах углерода, содержащих связи С-О, включая спирты и альдегиды
- Углерод с исключительно слабыми связями С-С, такие как
- С-С связи в гликоле
- С-С связи рядом с ароматическим кольцом И кислородом
KMnO 4 также окисляет фенол до парабензохинона.
Пример
Примеры неокисленных углеродов
- Алифатические углероды (кроме тех, которые находятся в альфа-положении к ароматическому кольцу, как указано выше)
- Ароматические углеводороды (кроме фенола, указанного выше)
- Углерод без связи С-Н, за исключением пункта (3) выше
Исчерпывающее окисление органических молекул KMnO 4 будет происходить до образования карбоновых кислот. Следовательно, спирты будут окисляться до карбонилов (альдегидов и кетонов), а альдегиды (и некоторые кетоны, как в (3) выше) будут окисляться до карбоновых кислот.
Следовательно, спирты будут окисляться до карбонилов (альдегидов и кетонов), а альдегиды (и некоторые кетоны, как в (3) выше) будут окисляться до карбоновых кислот.
Реакции со специфическими функциональными группами
Используя приведенные выше принципы, мы ожидаем, что KMno 4 будет реагировать с алкенами, алкинами, спиртами, альдегидами и ароматическими боковыми цепями. Примеры приведены ниже. Легче всего начать сверху.
Альдегиды
Альдегиды RCHO легко окисляются до карбоновых кислот.
Если не предпринимать больших усилий для поддержания нейтрального значения pH, окисление KMnO 4 имеет тенденцию происходить в щелочных условиях. Фактически, наиболее эффективные условия для окисления альдегидов KMnO 4 включают t -бутанол в качестве растворителя с буфером NaH 2 PO 4 . 2 Приведенные выше реакции намеренно не сбалансированы. Уравновешивание реакций потребует использования методов, изученных в общей химии, требующих полуреакций для всех процессов.
Спирты
Первичные спирты, такие как октан-1-ол, могут быть эффективно окислены KMnO 4 в присутствии основных солей меди. 3 Однако продукт представляет собой преимущественно октановую кислоту с небольшим количеством альдегида, образующегося в результате переокисления.
Хотя чрезмерное окисление представляет меньшую проблему для вторичных спиртов, KMnO 4 по-прежнему не считается подходящим для превращения спиртов в альдегиды или кетоны.
Алкены
4В мягких условиях перманганат калия может влиять на превращение алкенов в гликоли. Однако он способен к дальнейшему окислению гликоля с разрывом углерод-углеродной связи, поэтому необходим тщательный контроль условий реакции. Циклический диэфир марганца является промежуточным продуктом в этих окислениях, что приводит к образованию гликолей при добавлении syn .
С добавлением тепла и/или более концентрированного KMnO 4 , гликоль может быть дополнительно окислен, разрывая связь С-С.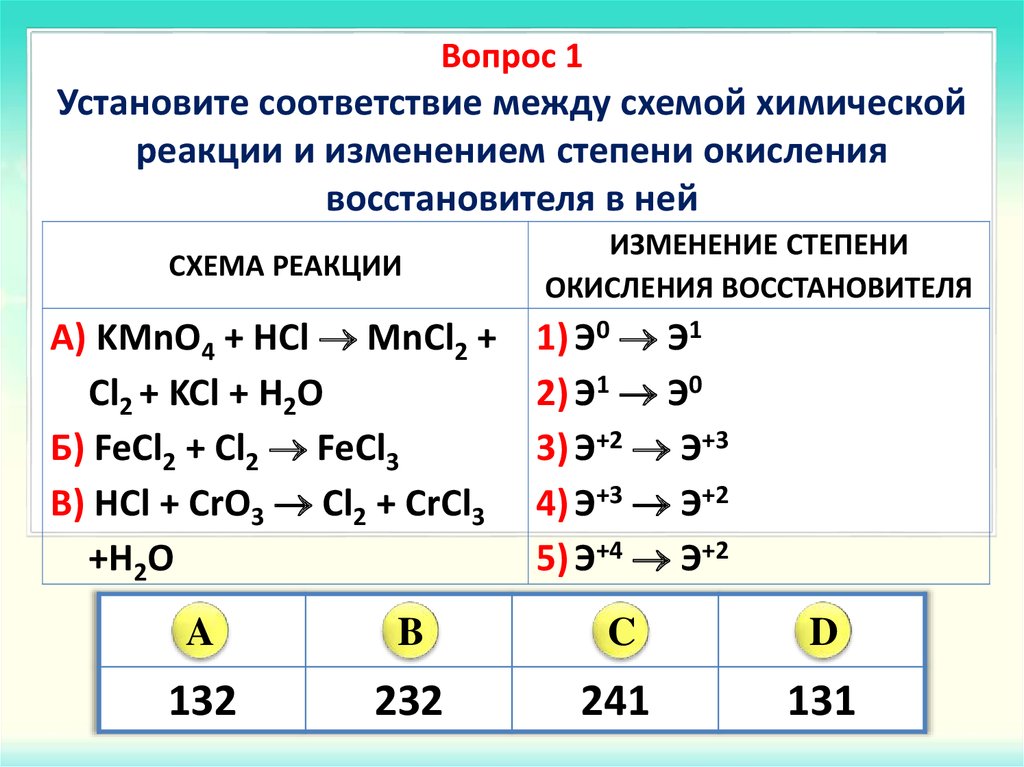
Более замещенные олефины будут заканчиваться кетоном
Окислительное расщепление диола можно проводить более мягко, используя IO 4 в качестве окислителя.
Расщепление алкенов до кетонов/карбоновых кислот можно использовать для определения положения двойных связей в органических молекулах. 5
Алкины
4Вместо бисгидроксилирования, происходящего с алкенами, перманганатное окисление алкинов сначала приводит к образованию дионов.
В более жестких условиях дион расщепляется с образованием двух карбоновых кислот.
Ароматические боковые цепи
6Обработка алкилбензола перманганатом калия приводит к окислению с образованием бензойной кислоты.
Примечание
Положение, непосредственно примыкающее к ароматической группе, называется «бензильным» положением.
Реакция работает, только если к углероду присоединен хотя бы один водород. Однако, если есть хотя бы один водород, окисление продолжается до карбоновой кислоты.
Однако, если есть хотя бы один водород, окисление продолжается до карбоновой кислоты.
Примеры:
Примечания: Обратите внимание, что в примере 2 лишние атомы углерода отщепляются с получением того же продукта, что и в примере 1. А в примере 3 образуются две бензойные кислоты. Наконец, когда на бензиловом углероде нет атомов водорода, реакция не происходит (пример 4).
Окисление алкильных боковых цепей с образованием бензойных кислот исторически использовалось в качественном анализе для определения положения алкильных групп в замещенных ароматических системах. Алкилзамещенные кольца могут быть преобразованы в поликислоты, которые можно отличить по их pKas
Дополнительная информация
- Окисление хромовой кислотой (H 2 CrO 4 )
- Озонолиз
- Окислительное расщепление двойных связей
- Окисление алкенов
Источники
- http://www.
 epa.gov/ogwdw/mdbp/pdf/alter/chapt_5.pdf
epa.gov/ogwdw/mdbp/pdf/alter/chapt_5.pdf - Абико, Ацуши; Робертс, Джон С .; Такемаса, Тоширо; Масамунэ, Сатору, Tetrahedron Letters (1986), 27 (38), 4537-40
- Джеффорд, Чарльз В.; Ван, Ин, Журнал химического общества, Chemical Communications (1988), (10), 634-5.
- Кэри, Ф.А.; Sundberg, R. J. Advanced Organic Химия
- Даунинг, Дональд Т.; Грин, Ричард С., Journal of Investigative Dermatology (1968), 50(5), 380-6.
- http://www.masterorganicchemistry.co…boxylic-acids/
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- нет на стр.


 epa.gov/ogwdw/mdbp/pdf/alter/chapt_5.pdf
epa.gov/ogwdw/mdbp/pdf/alter/chapt_5.pdf