Вопрос А1. Строение атома. Строение электронных оболочек атомов первых 20 элементов Периодической системы Д.И. Менделеева.+ТЕСТ
ВОПРОС А1.
СТРОЕНИЕ АТОМА. СТРОЕНИЕ ЭЛЕКТРОННЫХ ОБОЛОЧЕК АТОМОВ ПЕРВЫХ 20 ЭЛЕМЕНТОВ ПЕРИОДИЧЕСКОЙ СИСТЕМЫ Д.И. МЕНДЕЛЕЕВА.
Вопрос А1. Строение атома. Строение электронных оболочек атомов первых 20 элементов Периодической системы Д.И. Менделеева.
Во многих справочниках для подготовки дается несколько определений по данной теме пару примеров. Я считаю правильней дать кластер по этой теме, тем более тема эта объясняется в 8 –м классе, но повторяем её практически каждый урок в 9 классе.
АТОМ Содержит: ЯДРО и ЭЛЕКТРОННАЯ ОБОЛОЧКА.
Протоны – «р+» определяются порядковым номером химического элемента электроны «е—».
Нейтроны «n0» = относительная атомная масса – порядковый номер.
Электроны в атоме расположены упорядоченно – слоями (энергетическими уровнями)
Число слоев определяется номер периода, в котором стоит элемент.
\ 2е— \ 8е— \ 16е—
Но у элементов в 3-м периоде максимально может быть до 8 электронов на последнем слое (уровне).
Если атом отдает электроны, он превращается в положительно заряженный ион (катион), а принимает в отрицательно заряженный ион (анион).
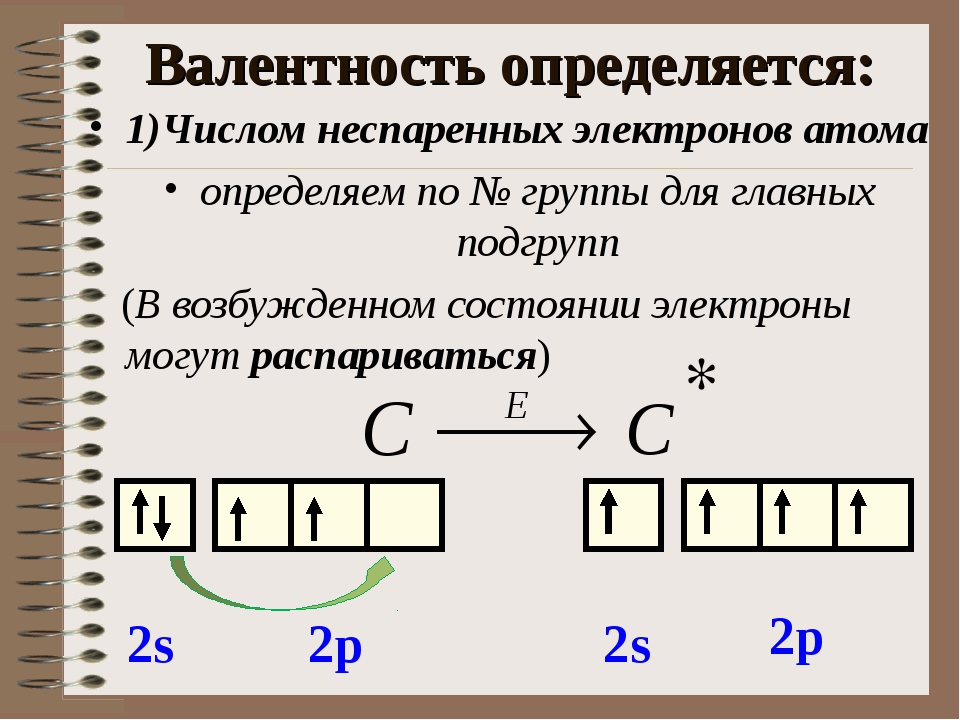
Число свободных неспаренных электронов определяется по формуле 8-n, где n – номер группы, в которой стоит химический элемент.
Пример 1. Сколько электронов содержит атом алюминия?
- 27 2) 13 3)14 4) 3
Решение: найдем в ПСХЭ алюминий, его порядковый номер 13, следовательно, электронов -13.
Пример 2. В атоме калия распределение электронов по электронным слоям соответствует ряду чисел:
- 2;8;6; 3 3) 8;8;2;2
- 2;8;1 4) 2;8;8;1
Решение: элемент калий стоит в 4-м периоде, в главной подгруппе 1-ой группе. Его порядковый номер 19, следовательно, 19 электронов распределены по 4-м слоям, на последнем 1 электрон, схема строения атома калия будет 2;8;8;1.
Его порядковый номер 19, следовательно, 19 электронов распределены по 4-м слоям, на последнем 1 электрон, схема строения атома калия будет 2;8;8;1.
ПРИЛОЖЕНИЕ 1
Вопрос А1. Строение атомов первых 20 химических элементов периодической системы Д.И. Менделеева.
1. Заряд ядра атома равен числу 1) протонов 2) электронов во внешнем электронном слое 3) нейтронов 4) энергетических уровней
2. Число протонов в атоме равно 1) числу электронов 2) относительной атомной массе 3) числу нейтронов 4) заполненных электронных слоев
3. Четыре электрона во внешнем электронном слое находятся у атома 1) серы 2) кислорода 3) азота 4) кремния
4. Какое количество электронов содержит атом фосфора? 1) 31 2) 16 3) 15 4) 5
5. Число заполняющихся электронных слоёв в атоме равно 1) порядковому номеру элемента 2) номеру группы 3) заряду ядра атома 4) номеру периода
6. 1) числу нейтронов 2) номеру периода 3) заряду ядра атома 4) номеру группы
7. Атомы химических элементов одной главной подгруппы имеют 1) одинаковые радиусы атомов 2) одинаковые заряды ядер атомов 3) одинаковое число валентных электронов 4) одинаковую электроотрицательность
8. Атомы азота и фтора имеют одинаковое 1) значение радиусов атомов 2) значение зарядов ядер атомов 3) число электронов во внешнем электронном слое 4) число заполненных электронных слоёв
| 9. Порядковый номер химического элемента равен 1) заряду ядра атома 2) атомной массе 3) числу нейтронов в ядре атома 4) числу валентных электронов атома
10. Атомы углерода и кремния имеют одинаковое 1) число нейтронов в ядре атома 2) значение относительной атомной массы 3) число протонов в ядре атома 4) число валентных электронов
11. 1) хлора 2) фтора 3) кислорода 4) серы
12. Схема распределения электронов по электронным Слоям 2, 8, 3 соответствует атому 1) магния 2) алюминия 3) кремния 4) фосфора
13. У химических элементов одной главной подгруппы одинаковое число 1) нейтронов в ядре 2) протонов в ядре 3) валентных электронов 4) электронов в атоме
14. У атомов 2311 Na и 2412 Mg одинаковое число 1) нейтронов в ядре атома 2) протонов в ядре атома 3) валентных электронов 4) электронов в атоме
15. В атоме фосфора число заполняющихся электронных слоёв равно 1) 5 2) 2 3) 3 4) 4
16. Завершенный внешний электронный слой имеет атом 1) аргона 2) водорода 3) магния 4) кислорода
|
Как происходит заполнение электронами энергетических уровней у атомов калия, азота, кальция и хлора?
РЕШЕНИЕ
1. Калий:
Калий:
1) Химический символ — K, порядковый номер — № 19, название элемента — калий, атомная масса Ar=39
2) Группа — 1, подгруппа главная, четвертый период Заряд ядра атома калия +19 (в ядре 19 протона- p⁺ и 20 нейтрона — n⁰)
Вокруг ядра атома 4 энергетических уровня, на которых располагаются 19 электрона.
3) Исходя из вышеизложенного напишем строение атома калия.
Строение атома калия:
₊₁₉K )₂)₈)₈)₁
Электронная формула калия ₊₁₉ K 1s²2s²2p⁶3s²3p⁶4s¹
2. Азот:
1) Химический символ — N, порядковый номер — № 7, название элемента — азот, атомная масса Ar=14
2) Группа — 5, подгруппа главная, второй период Заряд ядра атома азот +7 (в ядре 7 p⁺ протонов и 7 n⁰ нейтронов )
Вокруг ядра атома 2 энергетических уровня, на которых располагаются 7 электрона.
3) Исходя из вышеизложенного напишем строение атома азота:
Строение атома азота:
₊₅N 1s²2s²2p³
Электронная формула азота ₊₇N 1s²2s²2p³
3. Кальций:
1) Химический символ — Ca, порядковый номер — № 20, название элемента — кальций, атомная масса Ar=40
2) Группа — 2, подгруппа главная, четвертый период.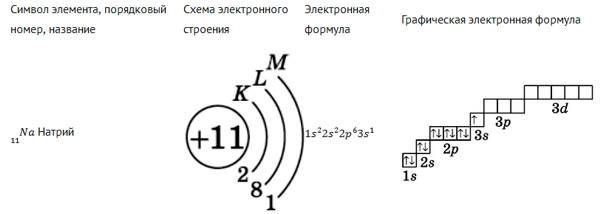 Заряд ядра атома кальция +20 (в ядре 20 p⁺ протонов и 20 n⁰ нейтронов )
Заряд ядра атома кальция +20 (в ядре 20 p⁺ протонов и 20 n⁰ нейтронов )
Вокруг ядра атома 2 энергетических уровня, на которых располагаются 20 электрона.
3) Исходя из вышеизложенного напишем строение атом кальция:
Строение атом ₊₂₀Ca )₂)₈)₈)₂
Электронная формула кальций:
₊₂₀Ca 1s²2s²2p⁶3s²3p⁶4s²
4. Хлор:
1) Химический символ — CI, порядковый номер — № 17, название элемента — хлор, атомная масса Ar=35,5
2) Группа — 7, подгруппа- главная, третий период. Заряд ядра атома хлора +17 (в ядре 17 p⁺ протонов и 18 n⁰, нейтронов )
Вокруг ядра атома 3 энергетических уровня, на которых располагаются 17 электрона.
3) Исходя из вышеизложенного напишем строение атом.
₊₁₇CI 1s²2s²2p⁶3s²3p⁵3d⁰
У атома хлора есть 3d подуровень на котором нет электронов. При определенных условиях у атома хлора может произойти перераспределение(распаривание электронов из s- и p — подуровней на d- подуровень и тогда атомы хлора могут проявлять степени окисления в соединениях от -1 до +7
общая характеристика, строение; свойства и получение простых веществ — урок.
 Химия, 8–9 класс.
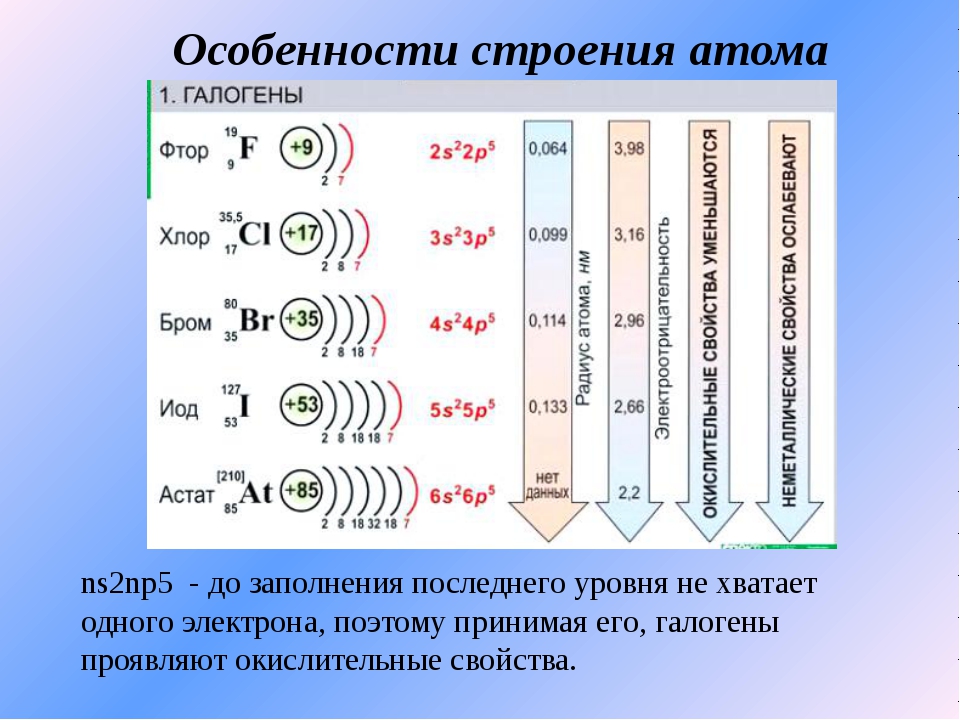
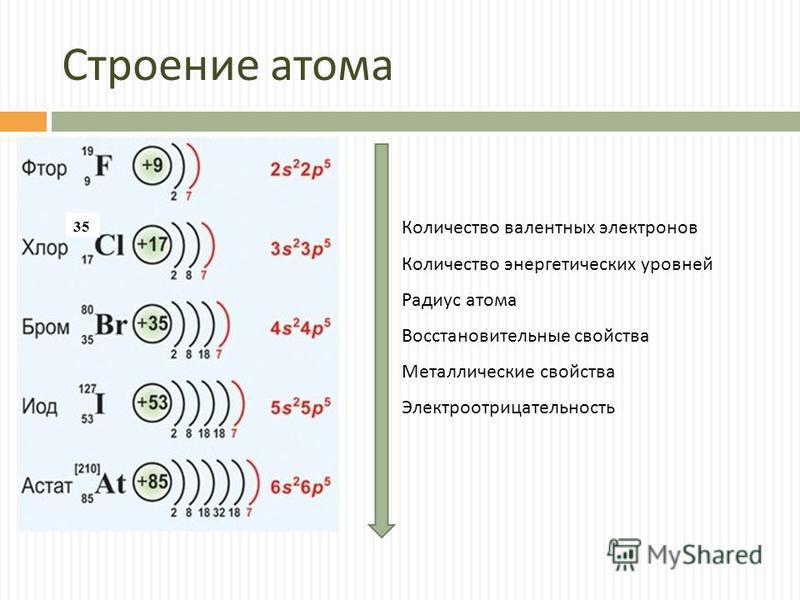
Химия, 8–9 класс.Щелочными металлами называются химические элементы-металлы \(IA\) группы Периодической системы Д. И. Менделеева: литий \(Li\), натрий \(Na\), калий \(K\), рубидий \(Rb\), цезий \(Cs\) и франций \(Fr\).
Электронное строение атомов. На внешнем энергетическом уровне атомы щелочных металлов имеют один электрон ns1. Поэтому для всех металлов группы \(IA\) характерна степень окисления \(+1\).
Этим объясняется сходство свойств всех щелочных металлов.
Для них (сверху вниз по группе) характерно:
- увеличение радиуса атомов;
- уменьшение электроотрицательности;
- усиление восстановительных, металлических свойств.
Нахождение в природе. Из щелочных металлов наиболее широко распространены в природе натрий и калий. Но из-за высокой химической активности они встречаются только в виде соединений.
Основными источниками натрия и калия являются:
- каменная соль (хлорид натрия \(NaCl\)),
- глауберова соль, или мирабилит — декагидрат сульфата натрия Na2SO4 \(·\) 10h3O,
- сильвин — хлорид калия \(KCl\),
- сильвинит — двойной хлорид калия-натрия \(KCl\) \(·\)\(NaCl\) и др.

Соединения лития, рубидия и цезия в природе встречаются значительно реже, поэтому их относят к числу редких и рассеянных.
Физические свойства простых веществ. В твёрдом агрегатном состоянии атомы связаны металлической связью. Наличие металлической связи обусловливает общие физические свойства простых веществ-металлов: металлический блеск, ковкость, пластичность, высокую тепло- и электропроводность.
В свободном виде простые вещества, образованные элементами \(IA\) группы — это легкоплавкие металлы серебристо-белого (литий, натрий, калий, рубидий) или золотисто-жёлтого (цезий) цвета, обладающие высокой мягкостью и пластичностью.
Рис. \(1\). Литий
Рис. \(2\). Натрий
Наиболее твёрдым является литий, остальные щелочные металлы легко режутся ножом и могут быть раскатаны в фольгу.
Только у натрия плотность немного больше единицы ρ=1,01 г/см3, у всех остальных металлов плотность меньше единицы.
Химические свойства. Щелочные металлы обладают высокой химической активностью, реагируя с кислородом и другими неметаллами.
Поэтому хранят щелочные металлы под слоем керосина или в запаянных ампулах. Они являются сильными восстановителями.
Все щелочные металлы активно реагируют с водой, выделяя из неё водород.
Пример:
2Na+2h3O=2NaOH+h3↑.
Взаимодействие натрия с водой протекает с выделением большого количества теплоты (т. е. реакция является экзотермической). Кусочек натрия, попав в воду, начинает быстро двигаться по её поверхности. Под действием выделяющейся теплоты он расплавляется, превращаясь в каплю, которая, взаимодействуя с водой, быстро уменьшается в размерах. Если задержать её, прижав стеклянной палочкой к стенке сосуда, капля воспламенится и сгорит ярко-жёлтым пламенем.
Получение. Металлический натрий в промышленности получают главным образом электролизом расплава хлорида натрия с инертными (графитовыми) электродами.
В расплаве хлорида натрия присутствуют ионы:
NaCl⇄Na++Cl−.
При электролизе
на катоде восстанавливаются катионы Na+, а на аноде окисляются анионы Cl−:
катод (\(–\)): 2Na++2e=2Na,
анод (\(+\)): 2Cl−−2e=Cl2↑.
Суммарное уравнение реакции при электролизе расплава хлорида натрия:
2NaCl→2Na+Cl2↑.
Почему не канадский скандий (2+) с электролитом калия?
Это очень интересный вопрос, я тоже испытал эту ошибку, поэтому будьте осторожны, отвечая на такие вопросы. Вы соглашаетесь с ответом @ Allison W, который он хорошо объяснил, и я стараюсь дать вам технику, чтобы ответить на такой вопрос очень осторожно, не допуская в будущем.
1.First you should write the electron configuration of the element which gives you.**
Sc — 1s2 2s2 2p6 3s2 3p6 3d1 4s2
2.Then you should understand how many electrons are left for the given ion.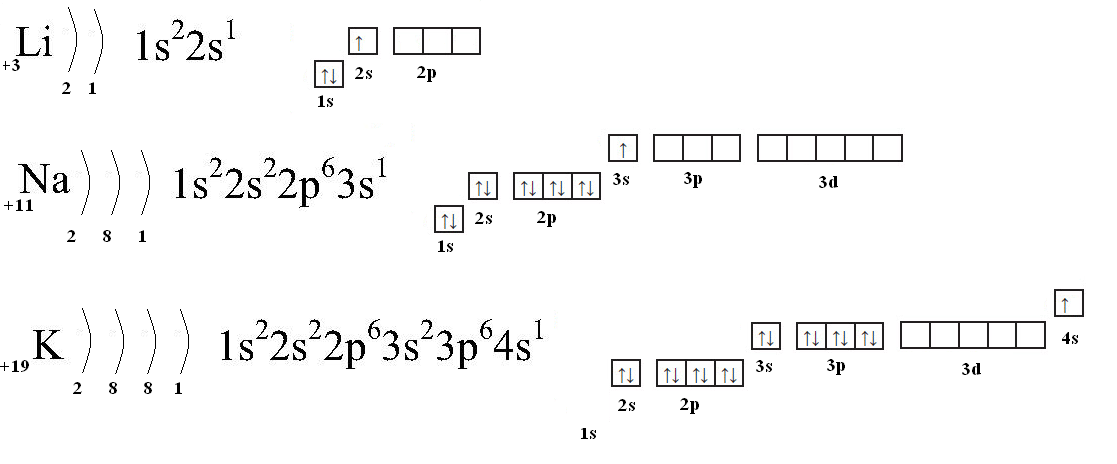 According to this question it should be 2. Then you should leave them from the outer energy level. That means they are in 4s.
According to this question it should be 2. Then you should leave them from the outer energy level. That means they are in 4s.
Не поймите это неправильно, поскольку электроны заполняются. Когда атом строится по принципу Ауфбау, первые заполняющие электроны являются 4s-электронами, а затем 3d. Таким образом, последний электрон, который заполняется, представляет собой 3d-электрон. Но вы должны понять, что не самый электронный элемент атома. Когда ионы образуют уходящие электроны, которые имеют наименьшее притяжение ядра. Это означает, что большинство внешних электронов.
3. Затем вы должны увидеть стабильность сделанной конфигурации.
Это не влияет на этот вопрос, но вы можете столкнуться с такими вопросами. Например,
Sc + -1s2 2s2 2p6 3s2 3p6 3d1 4s1
Но это не происходит, пока есть более стабильная конфигурация ниже.
Sc + -1s2 2s2 2p6 3s2 3p6 3d2 4s0
Итак, вы должны обратить ваше внимание в такой ситуации, чтобы изменить подобное. (В первичной химии, если вы не изменились, это не случай, но заранее вы должны быть осторожны либо в этой точке.)
(В первичной химии, если вы не изменились, это не случай, но заранее вы должны быть осторожны либо в этой точке.)
4. После написания новой электронной конфигурации иона теперь сравните его с конфигурацией данного элемента.
K-1s2 2s2 2p6 3s2 3p6 4s1
Sc2 + 1s2 2s2 2p6 3s2 3p6 3d1
Обобщите эти шаги, и вы не будете повторять этот вопрос еще раз.
Вопрос 1 § 1 Химия 9 класс Габриелян Дайте характеристику элементов
А) Характеристика фосфора.
1. Фосфор— элемент пятой группы и третьего периода, Z = 15,
Аr(Р) = 31.
Соответственно, атом фосфора содержит в ядре 15 протонов,
16 нейтронов и 15 электронов. Строение его электронной оболочки
можно отразить с помощью следующей схемы:
Атомы фосфора проявляют как окислительные свойства (принима-
ют недостающие для завершения внешнего уровня три электрона, получая при этом степень окисления -3, например, в соединениях с менее электроотрицательными элементами— металлами, водородом и т.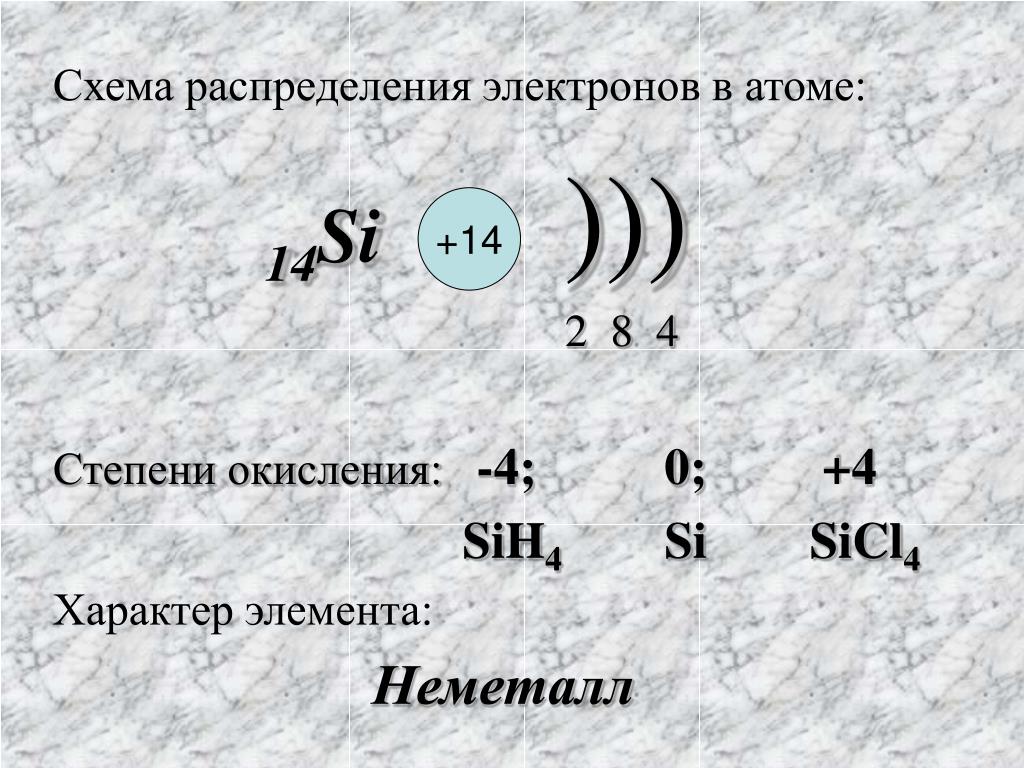 п.) так и восстановительные свойства (отдают 3 или 5 электронов более электроотрицательным элементам — кислороду, галогенам и т.п., приобретая при этом степени окисления +3 и +5.)
п.) так и восстановительные свойства (отдают 3 или 5 электронов более электроотрицательным элементам — кислороду, галогенам и т.п., приобретая при этом степени окисления +3 и +5.)
Фосфор менее сильный окислитель, чем азот, но более сильный, чем мышьяк, что связано с ростом радиусов атомов от азота к мышьяку. По этой же причине восстановительные свойства, наоборот, усиливаются.
2. Фосфор — простое вещество, типичный неметалл. Фосфору свойственно явление аллотропии. Например, существуют аллотропные модификации фосфора такие, как белый, красный и черный фосфор, которые обладают разными химическими и физическими свойствами.
3. Неметаллические свойства фосфора выражены слабее, чем у азота, но сильнее, чем у мышьяка (соседние элементы в группе).
4. Неметаллические свойства фосфора выражены сильнее, чем у
кремния, но слабее, чем у серы (соседние элементы в периоде).
5. Высший оксид фосфора имеет формулу Р2O5. Это кислотный оксид.
Он проявляет все типичные свойства кислотных оксидов.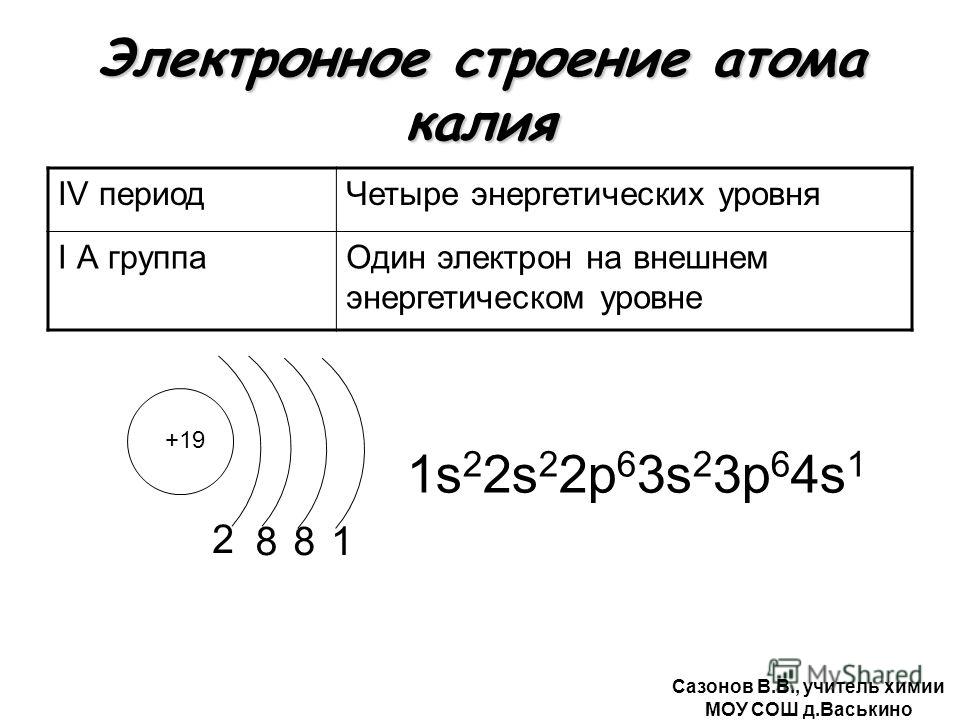 Так, например, при взаимодействии его с водой получается фосфорная кислота.
Так, например, при взаимодействии его с водой получается фосфорная кислота.
Р2O5 + 3Н2O => 2Н3РO4.
При взаимодействии его с основными оксидами и основаниями он
дает соли.
Р2O5 + 3MgO = Mg3(PO4)2; Р2O5 + 6КОН = 2К3РO4+ 3Н2O.
6. Высший гидроксид фосфора— фосфорная кислота Н3РO4, рас-
твор которой проявляет все типичные свойства кислот: взаимодействие с основаниями и основными оксидами:
Н3РO4 + 3NaOH = Na3PO4 + 3Н2O. 2Н3РO4 + 3СаО = Са,(РO4)2↓ + 3Н2O.
7. Фосфор образует летучее соединение Н3Р — фосфин.
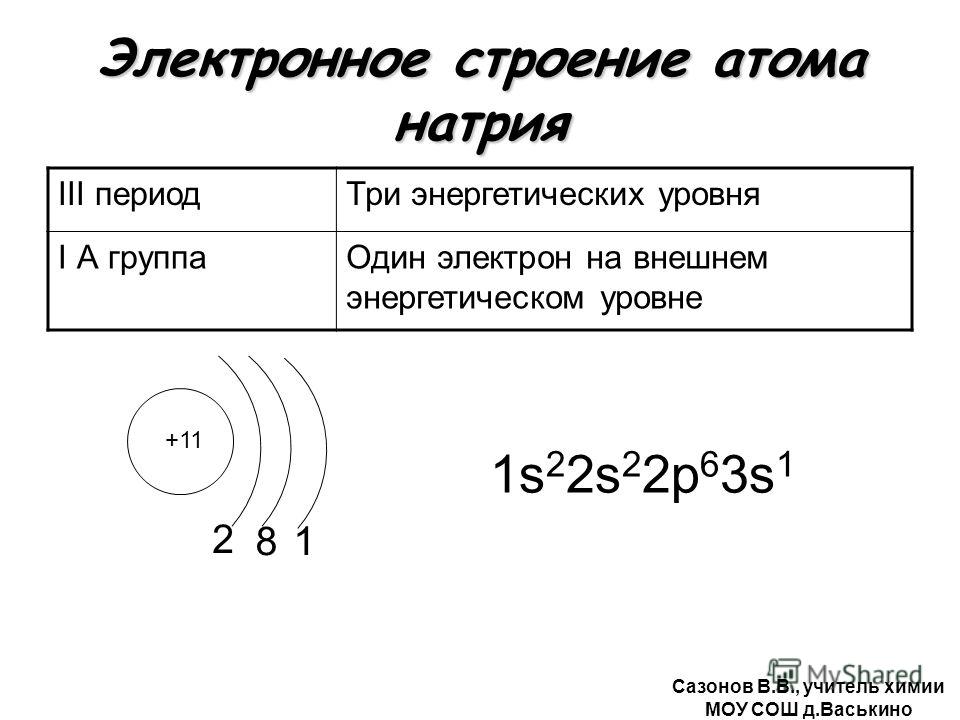
Б) Характеристика калия.
1. Калий имеет порядковый номер 19, Z = 19 и относительную атомную массу Аr(К) = 39. Соответственно заряд ядра его атома +19 (равен числу протонов). Следовательно, число нейтронов в ядре равно 20. Так как атом электронейтрален, то число электронов, содержащихся в атоме калия, тоже равно 19. Элемент калий находится в четвертом периоде периодической системы, значит, все электроны располагаются на четырех энергетических уровнях. Таким образом, строение атома калия записывается так:
Следовательно, число нейтронов в ядре равно 20. Так как атом электронейтрален, то число электронов, содержащихся в атоме калия, тоже равно 19. Элемент калий находится в четвертом периоде периодической системы, значит, все электроны располагаются на четырех энергетических уровнях. Таким образом, строение атома калия записывается так:
Исходя из строения атома, можно предсказать степень окисления
калия в его соединениях. Так как в химических реакциях атом калия отдает один внешний электрон, проявляя восстановительные свойства, следовательно, он приобретает степень окисления +1.
Восстановительные свойства у калия выражены сильнее, чем у на-
трия, но слабее, чем у рубидия, что связано с ростом радиусов от Na к Rb.
2. Калий— простое вещество, для него характерна металлическая
кристаллическая решетка и металлическая химическая связь, а отсюда — и все типичные для металлов свойства.
3. Металлические свойства у калия выражены сильнее, чем у на-
трия, но слабее, чем у рубидия, т. к. атом калия легче отдает электрон, чем атом натрия, но труднее, чем атом рубидия.
к. атом калия легче отдает электрон, чем атом натрия, но труднее, чем атом рубидия.
4. Металлические свойства у калия выражены сильнее, чем у кальция, т.к. один электрон атома калия легче оторвать, чем два электрона
атома кальция.
5. Оксид калия К2O является основным оксидом и проявляет все типичные свойства основных оксидов. Взаимодействие с кислотами и кислотными оксидами.
К2O + 2НСl = 2КСl +Н2O; К2O + SO3 = K2SO4.
6. В качестве гидроксида калию соответствует основание (щелочь) КОН, которое проявляет все характерные свойства оснований: взаимодействие с кислотами и кислотными оксидами.
KOH+HNO3 = KNO3+H2O; 2KOH+N2O5 = 2KNO3+H2O.
7. Летучего водородного соединения калий не образует, а образует гидрид калия КН.
Химики создали полностью металлический аналог карбоната
Структура K5[SnBi3]·9(NH3), красные шарики — олово, синие — висмут.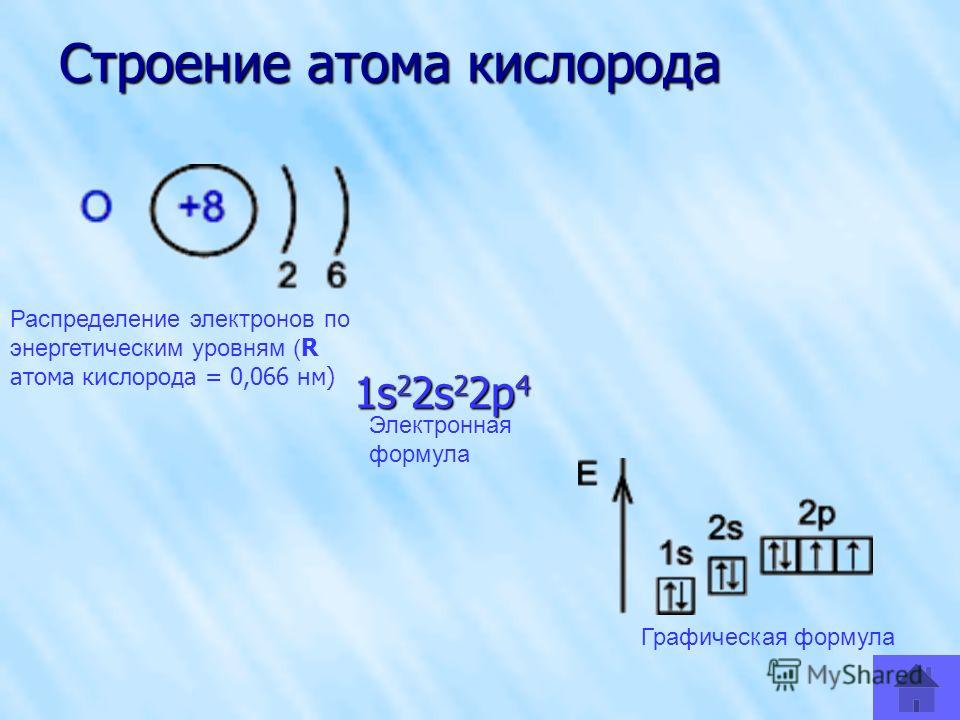 Треугольники из атомов висмута изоэлектронны карбонату.
Треугольники из атомов висмута изоэлектронны карбонату.
Kerstin Mayer et al. / Angew. Chem. Int. Ed., 2017
Изоэлектронные аналоги — соединения, в молекулах которых содержатся одинаковое количество атомов и совпадающие наборы валентных электронов. Например, изоэлектронными аналогами являются угарный газ (CO) и азот (N2). В атоме углерода ровно на один валентный электрон меньше, чем в азоте, а в кислороде — на один больше, суммарное число валентных электронов в азоте и в угарном газе совпадает. Другие примеры — анионы серной и хлорной кислот (SO 42- и ClO4—), графен и нитрид бора. Изоэлектронные частицы оказываются очень близки по своим физическим свойствам: одинаковая структура, похожие температуры плавления и кипения, сходные энергии химической связи.
Например, изоэлектронными аналогами являются угарный газ (CO) и азот (N2). В атоме углерода ровно на один валентный электрон меньше, чем в азоте, а в кислороде — на один больше, суммарное число валентных электронов в азоте и в угарном газе совпадает. Другие примеры — анионы серной и хлорной кислот (SO 42- и ClO4—), графен и нитрид бора. Изоэлектронные частицы оказываются очень близки по своим физическим свойствам: одинаковая структура, похожие температуры плавления и кипения, сходные энергии химической связи.
Авторы новой работы обнаружили рекордно тяжелый изоэлектронный аналог карбонат-аниона в рамках исследования висмутидов — соединений, в которых висмут несет на себе отрицательный заряд. Химики растворили в жидком аммиаке висмутид калия (K3Bi2) и станнид калия (K4Sn9) и оставили получившуюся красную жидкость более чем на полгода. В результате, через семь месяцев ученые обнаружили в сосуде черные пластинчатые кристаллы K5[SnBi3]·9(NH3) — калиевой соли необычного аниона.
Строение аниона [SnBi3]5- и его резонансные структуры
Kerstin Mayer et al. / Angew. Chem. Int. Ed., 2017
Структурный анализ показал, что [SnBi3]5- — не часть полимерной цепочки из атомов металлов, а анион в форме правильного треугольника, геометрически совпадающий с карбонат-анионом (CO32-). Как и карбонат, новый анион содержит 24 валентных электрона, все атомы висмута в нем абсолютно идентичны (заряд делокализован между резонансными структурами). В отличие от карбонатов, стабильных в водных растворах, [SnBi3]5- быстро разлагается в присутствии воды — соединение устойчиво лишь в растворах жидкого аммиака.
У карбоната есть и более простые изоэлектронные аналоги — например, анион азотной кислоты (NO3—).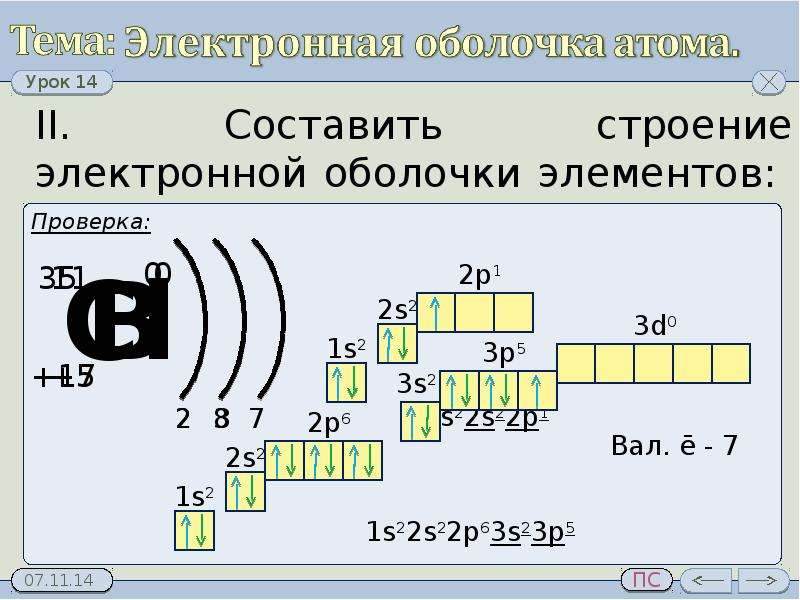 Ранее химики синтезировали другие аналоги карбонатов — комплексные пниктиды кремния и германия (Cs5SiP3 и другие), пниктиды алюминия и индия (Cs6InAs3). Поиск соединений с необычными электронными свойствами и нестандартных изоэлектронных аналогов позволяет проверить границы применимости современных теорий в химии.
Ранее химики синтезировали другие аналоги карбонатов — комплексные пниктиды кремния и германия (Cs5SiP3 и другие), пниктиды алюминия и индия (Cs6InAs3). Поиск соединений с необычными электронными свойствами и нестандартных изоэлектронных аналогов позволяет проверить границы применимости современных теорий в химии.
Ранее мы сообщали о синтезе новых классов «неорганических бензолов» — веществ, электронное строение которых напоминает ароматические органические вещества, но которые при этом не содержат в себе атомов углерода.
Владимир Королёв
Моль. Количество вещества.
|
№ |
Какое количество вещества содержится
|
Задача 2Сколько частиц (атомов или молекул) содержит: |
||
|
а |
а |
в |
||
|
|
12 · 1023молекул |
44,5 · 1023атомов |
О,5 моль железа |
2 моль серы |
|
|
6· 1023молекул |
0,9·1023атомов |
2 моль алюминия |
4 моль кислорода |
|
12·1023молекул |
0,15·1023атомов |
3 моль натрия |
0,5 моль азота |
|
|
|
18·1023молекул |
0,21·1023атомов |
1,5 моль углерода |
3 моль натрия |
|
|
24·1023молекул |
0,27·1023атомов |
2 моль углерода |
5 моль азота |
|
|
30·1023моллекул |
0,33·1023атомов |
10 моль азота |
0,1 моль цинка |
|
|
39·1023молекул |
36·1023атомов |
5 моль хлора |
4 моль алюминия |
|
|
36·1023молекул |
0,45·1023атомов |
3 моль кислорода |
2 моль цинка |
|
|
42·1023молекул |
0,51·1023атомов |
4 моль азота |
1,. |
|
|
48·1023молекул |
0,57·1023атомов |
2 моль кальция |
6 моль брома |
|
|
0,.6·1023молекул |
9·1023атомов |
12 моль брома |
2 моль серебра |
|
|
0,12·1023молекул |
15·1023атомов |
10 моль хлора |
1,5 моль меди |
|
|
0,18·1023молекул |
21·1023атомов |
5 моль водорода |
3 моль железа |
|
|
0,24·1023молекул |
27·1023атомов |
3 моль водорода |
2 моль воды |
|
|
0,3·1023молекул |
33·1023атомов |
4 моль серебра |
3 моль хлора |
|
|
0,36·1023молекул |
39·1023атомов |
2 моль воды |
0,5 моль железа |
|
|
0,42·1023молекул |
45·1023атомов |
4 моль серебра |
2 моль кислорода |
|
|
0,48·1023молекул |
51·1023атомов |
0. |
3 моль серебра |
|
|
0,54·1023молекул |
0,6·1023атомов |
3 моль серы |
1,5 моль цинка |
|
|
9·1023молекул |
42·1023атомов |
5 моль натрия |
2 моль углерода |
|
|
15·1023молекул |
0,12·1023атомов |
0,1 моль хлора |
10 моль меди |
|
|
21·1023молекул |
0,18·1023атомов |
4 моль меди |
5 моль хлора |
|
|
27·1023молекул |
0,24·1023атомов |
2 моль кислорода |
3 моль цинка |
|
|
33·1023молекул |
0,3·1023атомов |
1,5 моль азота |
4 моль ртути |
|
|
39·1023молекул |
0,36·1023атомов |
6 моль магния |
2 моль водорода |
|
|
45·1023молекул |
0,42·1023атомов |
2 моль брома |
12 моль меди |
|
|
51·1023молекул |
0,48·1023атомов |
1. |
10 моль натрия |
|
|
0,6·1023молекул |
54··1023атомов |
3 моль водорода |
5 моль калия |
|
|
24·1023молекул |
9·1023атомов |
3 моль цинка |
2 моль воды |
|
|
3·1023молекул |
3· 1023атомов |
4 моль фтора |
6 моль кальция |
2.
 1 Электроны, протоны, нейтроны и атомы — Физическая геология
1 Электроны, протоны, нейтроны и атомы — Физическая геологияВся материя, включая минеральные кристаллы, состоит из атомов, и все атомы состоят из трех основных частиц: протонов, , нейтронов, и электронов, . Как показано в Таблице 2.1, протоны заряжены положительно, нейтроны не заряжены, а электроны заряжены отрицательно. Отрицательный заряд одного электрона уравновешивает положительный заряд одного протона. И протоны, и нейтроны имеют массу 1, а электроны почти не имеют массы.
| Элементарная частица | Заряд | Масса |
|---|---|---|
| Протон | +1 | 1 |
| нейтрон | 0 | 1 |
| Электрон | -1 | ~ 0 |
Элемент водород состоит из простейших атомов, каждый из которых состоит только из одного протона и одного электрона. Протон образует ядро, а электрон вращается вокруг него. У всех других элементов в ядре есть нейтроны, а также протоны, такие как гелий, как показано на рис. 2.2. Положительно заряженные протоны имеют тенденцию отталкиваться друг от друга, а нейтроны помогают удерживать ядро вместе. Число протонов — это атомный номер , а число протонов плюс нейтроны — это атомная масса . Для водорода атомная масса равна 1, потому что есть один протон и нет нейтронов.Для гелия это 4: два протона и два нейтрона.
Протон образует ядро, а электрон вращается вокруг него. У всех других элементов в ядре есть нейтроны, а также протоны, такие как гелий, как показано на рис. 2.2. Положительно заряженные протоны имеют тенденцию отталкиваться друг от друга, а нейтроны помогают удерживать ядро вместе. Число протонов — это атомный номер , а число протонов плюс нейтроны — это атомная масса . Для водорода атомная масса равна 1, потому что есть один протон и нет нейтронов.Для гелия это 4: два протона и два нейтрона.
Для большинства из 16 легчайших элементов (до кислорода) количество нейтронов равно количеству протонов. Для большинства остальных элементов нейтронов больше, чем протонов, потому что дополнительные нейтроны необходимы, чтобы удерживать ядро вместе, преодолевая взаимное отталкивание растущего числа протонов, сосредоточенных в очень маленьком пространстве. Например, в кремнии 14 протонов и 14 нейтронов. Его атомный номер 14, а атомная масса 28.Самый распространенный изотоп урана состоит из 92 протонов и 146 нейтронов.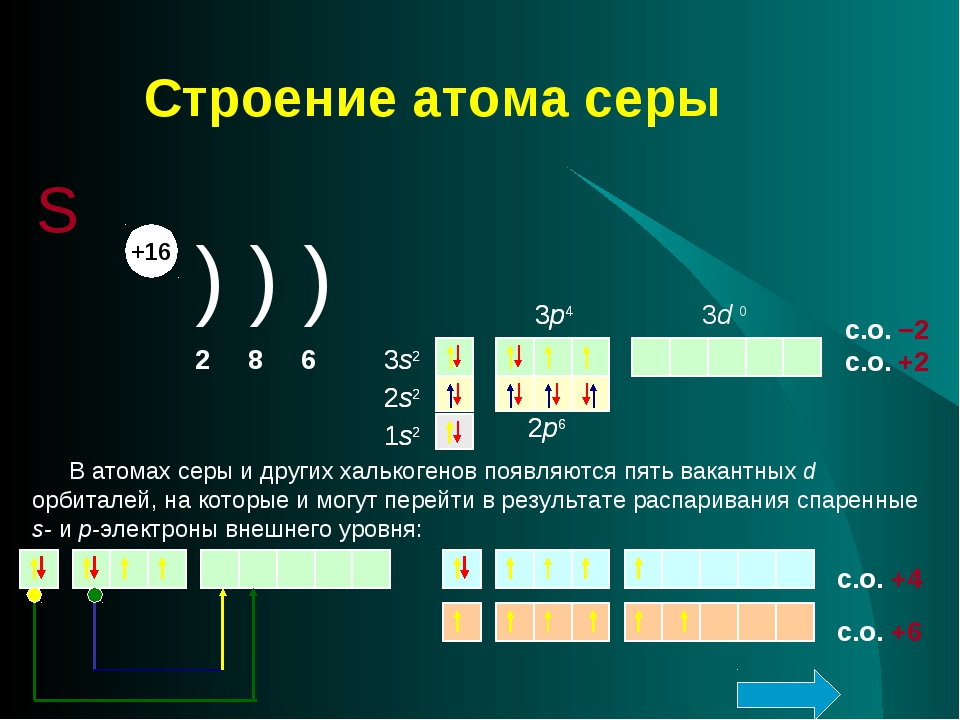 Его атомный номер 92, а атомная масса 238 (92 + 146).
Его атомный номер 92, а атомная масса 238 (92 + 146).
Точка посередине — это ядро, а окружающее облако обозначает, где два электрона могут быть в любой момент. Чем темнее оттенок, тем больше вероятность того, что там будет электрон. Ангстрем (Å) составляет 10 -10 м. Фемтометр (фм) 10 -15 м. Другими словами, электронное облако атома гелия примерно в 100 000 раз больше его ядра.
Электроны, вращающиеся вокруг ядра атома, расположены в оболочках, также известных как «энергетические уровни». Первая оболочка может содержать только два электрона, а следующая оболочка может содержать до восьми электронов. Последующие оболочки могут содержать больше электронов, но самая внешняя оболочка любого атома вмещает не более восьми электронов. Электроны в самой внешней оболочке играют важную роль в связи между атомами. Элементы с полной внешней оболочкой инертны в том смысле, что они не вступают в реакцию с другими элементами с образованием соединений. Все они появляются в крайнем правом столбце периодической таблицы: гелий, неон, аргон и т. Д. Для элементов, не имеющих полной внешней оболочки, самые внешние электроны могут взаимодействовать с самыми внешними электронами соседних атомов, создавая химические связи. Конфигурации электронных оболочек 29 из первых 36 элементов перечислены в таблице 2.2.
Все они появляются в крайнем правом столбце периодической таблицы: гелий, неон, аргон и т. Д. Для элементов, не имеющих полной внешней оболочки, самые внешние электроны могут взаимодействовать с самыми внешними электронами соседних атомов, создавая химические связи. Конфигурации электронных оболочек 29 из первых 36 элементов перечислены в таблице 2.2.
| Число электронов в каждой оболочке | ||||||
|---|---|---|---|---|---|---|
| Элемент | Условное обозначение | Атомный № | Первая | Второй | Третий | Четвертый |
| Водород | H | 1 | 1 | |||
| Гелий | He | 2 | 2 | |||
| Литий | Li | 3 | 2 | 1 | ||
| Бериллий | Be | 4 | 2 | 2 | ||
| Бор | B | 5 | 2 | 3 | ||
| Углерод | С | 6 | 2 | 4 | ||
| Азот | N | 7 | 2 | 5 | ||
| Кислород | O | 8 | 2 | 6 | ||
| фтор | F | 9 | 2 | 7 | ||
| Неон | Ne | 10 | 2 | 8 | ||
| Натрий | Na | 11 | 2 | 8 | 1 | |
| Магний | мг | 12 | 2 | 8 | 2 | |
| Алюминий | Al | 13 | 2 | 8 | 3 | |
| Кремний | Si | 14 | 2 | 8 | 4 | |
| фосфор | P | 15 | 2 | 8 | 5 | |
| сера | S | 16 | 2 | 8 | 6 | |
| Хлор | Класс | 17 | 2 | 8 | 7 | |
| Аргон | Ар | 18 | 2 | 8 | 8 | |
| Калий | К | 19 | 2 | 8 | 8 | 1 |
| Кальций | Ca | 20 | 2 | 8 | 8 | 2 |
| Скандий | SC | 21 | 2 | 8 | 9 | 2 |
| Титан | Ti | 22 | 2 | 8 | 10 | 2 |
| Ванадий | В | 23 | 2 | 8 | 11 | 2 |
| Хром | Cr | 24 | 2 | 8 | 13 | 1 |
| Марганец | Мн | 25 | 2 | 8 | 13 | 2 |
| Утюг | Fe | 26 | 2 | 8 | 14 | 2 |
. | . | . | . | . | . | . |
| Селен | SE | 34 | 2 | 8 | 18 | 6 |
| Бром | руб. | 35 | 2 | 8 | 18 | 7 |
| Криптон | Кр | 36 | 2 | 8 | 18 | 8 |
Атрибуции
Рисунок 2.2
Атом гелия от Yzmo находится под CC-BY-SA-3.0
Периодическая таблица и модели уровней энергии | Глава 4: Периодическая таблица и связь
Познакомьте студентов с идеей о том, что электроны окружают ядро атома в областях, называемых энергетическими уровнями.
Повторите со студентами, что на втором уроке они сосредоточились на количестве протонов, нейтронов и электронов в атомах каждого элемента.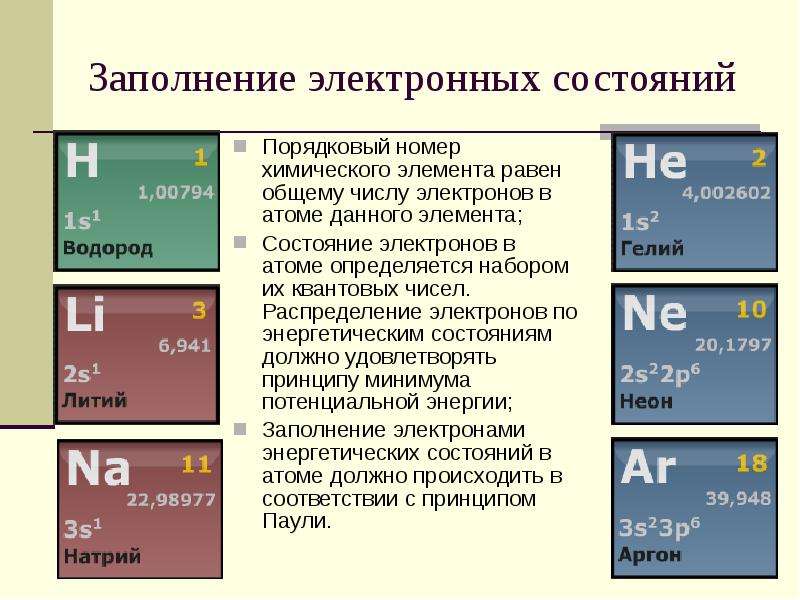 В этом уроке они сосредоточатся на расположении электронов в каждом элементе.
В этом уроке они сосредоточатся на расположении электронов в каждом элементе.
Спроецировать изображение Поперечное сечение уровня энергии.
Объясните студентам, что электроны окружают ядро атома в трех измерениях, делая атомы сферическими. Они могут думать об электронах как о находящихся на разных энергетических уровнях, подобных концентрическим сферам вокруг ядра. Поскольку эти сферы очень сложно показать, уровни энергии обычно отображаются в двух измерениях.
Подробнее о моделях уровня энергии читайте в разделе «Информация о учителе».
Спроецировать изображение Атом кислорода.
Скажите студентам, что эта модель энергетического уровня представляет атом. Ядро представлено точкой в центре, которая содержит как протоны, так и нейтроны. Меньшие точки, окружающие ядро, представляют электроны на энергетических уровнях. Сообщите учащимся, что они узнают больше об электронах и уровнях энергии позже на этом уроке.
Попросите учащихся взглянуть на Периодическую таблицу элементов 1–20, которые они использовали в уроке 2, чтобы ответить на следующий вопрос:
- Можете ли вы определить, какой атом представляет эта модель?
- Если учащиеся не могут ответить на этот вопрос, укажите, что существует 8 электронов.
 Поскольку нейтральные атомы в периодической таблице имеют такое же количество электронов, что и протоны, у атома должно быть 8 протонов. Число протонов такое же, как и атомный номер, поэтому атом — это кислород.
Поскольку нейтральные атомы в периодической таблице имеют такое же количество электронов, что и протоны, у атома должно быть 8 протонов. Число протонов такое же, как и атомный номер, поэтому атом — это кислород.
Попросите группы работать вместе, чтобы разместить каждую карту с ее правильным атомом.
Покажите учащимся, что у вас есть 80 карточек (по 4 на каждый из первых 20 элементов). Прежде чем раздавать карточки, объясните, что каждая карточка содержит информацию об электронах и уровнях энергии первых 20 элементов таблицы Менделеева.Задача учеников — внимательно прочитать карточку, выяснить, какой элемент она описывает, и положить карточку в то место в комнате, где находится этот элемент. Напомните учащимся, что им нужно будет подсчитать электроны, чтобы идентифицировать каждый атом. Как только учащиеся поймут свое задание, раздайте карточки группам.
Обсудите размещение карт для двух или трех атомов.
После того, как все карты были размещены на 20 различных атомах, выберите два или три атома и проверьте, правильно ли были размещены карты. Этот обзор поможет укрепить представления о структуре атомов и поможет студентам определить количество протонов и электронов в каждом атоме.
Этот обзор поможет укрепить представления о структуре атомов и поможет студентам определить количество протонов и электронов в каждом атоме.
Раздайте каждому ученику лист с заданием «Периодическая таблица уровней энергии». Эта таблица содержит модели уровней энергии для первых 20 элементов. Электроны включены только для атомов в начале и в конце каждого периода.
Спроецируйте Периодическую таблицу уровней энергии и обсудите расположение электронов, когда учащиеся будут заполнять свой рабочий лист.
Спроецировать изображение Периодическая таблица уровней энергии.
Изображение, которое вы проецируете, содержит все электроны для элементов 1–20. Однако периодическая таблица в таблице активности содержит электроны только для элементов в начале и в конце каждого периода. Обсудите расположение электронов на энергетических уровнях этих атомов и попросите студентов заполнить электроны для других атомов.
Примечание. На диаграммах уровней энергии электроны равномерно распределены по уровням.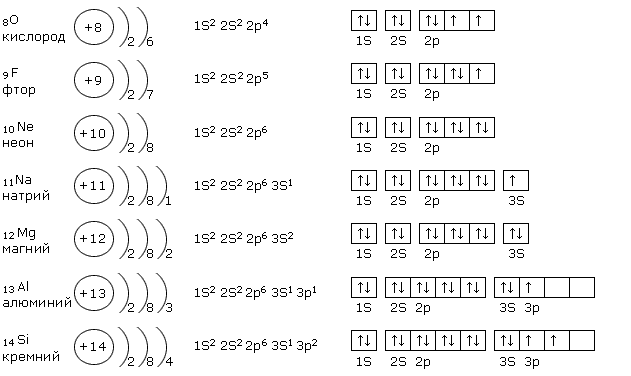 В некоторых книгах они показаны таким образом, а в других — парами. Спаривание электронов означает, что электроны находятся на отдельных орбиталях в пределах каждого энергетического уровня. На уровне средней школы учащимся не обязательно изучать электронные орбитали. Эта информация предлагается для того, чтобы вам было понятнее, почему электроны часто показаны парами на диаграммах уровней энергии и на точечных диаграммах, используемых в качестве дополнения в конце этой главы. Орбиталь определяет область на уровне энергии, где высока вероятность обнаружения пары электронов.На каждой орбитали может быть максимум два электрона. Вот почему электроны часто изображаются парами на уровне энергии.
В некоторых книгах они показаны таким образом, а в других — парами. Спаривание электронов означает, что электроны находятся на отдельных орбиталях в пределах каждого энергетического уровня. На уровне средней школы учащимся не обязательно изучать электронные орбитали. Эта информация предлагается для того, чтобы вам было понятнее, почему электроны часто показаны парами на диаграммах уровней энергии и на точечных диаграммах, используемых в качестве дополнения в конце этой главы. Орбиталь определяет область на уровне энергии, где высока вероятность обнаружения пары электронов.На каждой орбитали может быть максимум два электрона. Вот почему электроны часто изображаются парами на уровне энергии.
Скажите студентам, что строки в периодической таблице называются периодами.
Период 1
- Водород
- Объясните, что водород имеет 1 протон и 1 электрон. 1 электрон находится на первом энергетическом уровне.
- Гелий
- Объясните, что гелий имеет 2 протона и 2 электрона.
 2 электрона находятся на первом энергетическом уровне.
2 электрона находятся на первом энергетическом уровне.
Период 2
- Литий
- Объясните, что у лития 3 протона и 3 электрона. На первом энергетическом уровне 2 электрона, а на втором — 1 электрон. Объясните, что первый энергетический уровень может иметь только 2 электрона, поэтому следующий электрон в литии находится на следующем (втором) уровне.
- Неон
- Объясните, что у неона 10 протонов и 10 электронов.На первом уровне энергии 2 электрона, а на втором — 8 электронов.
- Бериллий-фтор
- Помогите студентам указать правильное количество электронов на энергетических уровнях для остальных атомов в периоде 2.
Период 3
- Натрий
- Объясните, что у натрия 11 протонов и 11 электронов. Есть 2 электрона на первом уровне энергии, 8 электронов на втором уровне и 1 электрон на третьем уровне энергии.Объясните, что второй энергетический уровень может иметь только 8 электронов, поэтому следующий электрон в натрия должен находиться на следующем (третьем) уровне.

- Аргон
- Объясните, что аргон имеет 18 протонов и 18 электронов. Есть 2 электрона на первом уровне энергии, 8 электронов на втором уровне и 8 электронов на третьем уровне энергии. Попросите учащихся заполнить модель энергетического уровня аргона в своей периодической таблице.
- Магний-хлор
- Помогите студентам указать правильное количество электронов на энергетических уровнях для остальных атомов в периоде 3.
Период 4
- Калий
- Объясните, что у калия 19 протонов и 19 электронов. Есть 2 электрона на первом уровне энергии, 8 электронов на втором уровне, 8 электронов на третьем уровне энергии и 1 на четвертом уровне энергии. Объясните: после того, как на третьем энергетическом уровне будет 8 электронов, следующий электрон перейдет на четвертый уровень.
- Кальций
- Помогите студентам указать правильное количество электронов в энергетических уровнях кальция.
Примечание: учащиеся могут задаться вопросом, почему энергетический уровень может удерживать только определенное количество электронов. Ответ на этот вопрос выходит далеко за рамки химического подразделения средней школы. Он включает в себя представление об электронах как о трехмерных волнах и о том, как они будут взаимодействовать друг с другом и с ядром.
Ответ на этот вопрос выходит далеко за рамки химического подразделения средней школы. Он включает в себя представление об электронах как о трехмерных волнах и о том, как они будут взаимодействовать друг с другом и с ядром.
Попросите учащихся найти закономерности в строках и столбцах первых 20 элементов периодической таблицы.
Продолжайте проецировать изображение Периодическая таблица уровней энергии для элементов 1–20 и попросите учащихся просмотреть свои листы действий, чтобы найти закономерности в количестве электронов на каждом уровне энергии.
Попросите учащихся взглянуть на точки (пересекающиеся строки).
Количество уровней энергии за каждый период
- Атомы в первом периоде имеют электроны на одном энергетическом уровне.
- Атомы во втором периоде имеют электроны на двух уровнях энергии.
- Атомы в третьем периоде имеют электроны на трех уровнях энергии.
- Атомы в четвертом периоде имеют электроны на 4 уровнях энергии.

Как электроны заполняют энергетические уровни
- Первый уровень энергии = 1, 2
- Второй энергетический уровень = 1, 2, 3,… 8
- Третий энергетический уровень = 1, 2, 3,… 8
- Четвертый энергетический уровень = 1, 2
Узнайте больше о таблице Менделеева в разделе «История учителя».
Определенное количество электронов переходит на уровень до того, как на следующем уровне могут быть электроны.После того, как первый энергетический уровень содержит 2 электрона (гелий), следующие электроны переходят на второй энергетический уровень. После того, как второй энергетический уровень имеет 8 электронов (неон), следующие электроны переходят на третий энергетический уровень. После того, как на третьем энергетическом уровне будет 8 электронов (аргон), следующие 2 электрона переходят на четвертый энергетический уровень.
Примечание. Третий энергетический уровень может фактически содержать до 18 электронов, поэтому он не заполняется, когда на нем 8 электронов. Но когда третий уровень содержит 8 электронов, следующие 2 электрона переходят на четвертый уровень.Затем, хотите верьте, хотите нет, еще 10 электронов продолжают заполнять остаток третьего уровня. Студентам не обязательно это знать.
Но когда третий уровень содержит 8 электронов, следующие 2 электрона переходят на четвертый уровень.Затем, хотите верьте, хотите нет, еще 10 электронов продолжают заполнять остаток третьего уровня. Студентам не обязательно это знать.
Попросите учащихся посмотреть на группы (столбцы вниз).
Скажите студентам, что вертикальные столбцы в периодической таблице называются группами или семьями.
Попросите учащихся сравнить количество электронов на внешнем энергетическом уровне атомов в группе. Студенты должны понимать, что каждый атом в группе имеет одинаковое количество электронов на внешнем энергетическом уровне.Например, водород, литий, натрий и калий имеют 1 электрон на внешнем энергетическом уровне. Сообщите учащимся, что эти электроны на внешнем энергетическом уровне называются валентными электронами. Это электроны, отвечающие за связывание, которые студенты изучат на следующем уроке.
Сравните химическую реакцию различных элементов и соотнесите это с их расположением в таблице Менделеева.
Скажите студентам, что атомы в периодической таблице в одном столбце, называемом группой, обладают определенными характеристиками и могут реагировать аналогичным образом.
Спроецировать видео «Натрий в воде и калий в воде».
www.middleschoolchemistry.com/multimedia/chapter4/lesson3#sodium_in_water
www.middleschoolchemistry.com/multimedia/chapter4/lesson3#potasium_in_water
Студенты увидят, что, хотя калий реагирует более энергично, чем натрий, реакции аналогичны. Попросите учащихся взглянуть на периодическую таблицу, чтобы увидеть, где находятся натрий и калий по отношению друг к другу.
Спроецировать видео «Кальций в воде».
www.middleschoolchemistry.com/multimedia/chapter4/lesson3#calcium_in_water
Студенты увидят, что эта реакция отличается от реакции натрия и калия. Попросите их найти кальций в периодической таблице и указать, что он находится в другой группе, чем натрий и калий.
Спроецировать видео «Натрий в кислоте и калий в кислоте».

www.middleschoolchemistry.com/multimedia/chapter4/lesson3#sodium_in_acid
www.middleschoolchemistry.com/multimedia/chapter4/lesson3#potassium_in_acid
Покажите, что натрий реагирует с кислотой, а затем калий реагирует с кислотой. HCl — это соляная кислота. HNO3 — это азотная кислота. Каждая кислота используется в двух разных концентрациях. Убедитесь, что учащиеся понимают, что натрий и калий реагируют аналогичным образом, хотя калий реагирует более энергично.
Спроецировать видео «Кальций в кислоте».
www.middleschoolchemistry.com//multimedia/chapter4/lesson3#calcium_in_acid
Укажите, что кальций реагирует иначе, чем натрий и калий.
Спросите студентов:
- Обладают ли элементы в одной группе схожими свойствами и одинаково ли реагируют?
- Студенты должны понимать, что натрий и калий находятся в одной группе и реагируют одинаково. Кальций находится рядом с ними в периодической таблице, но находится в другой группе, поэтому он реагирует по-разному.

Валентность калия | Сколько валентных электронов у калия (K)?
Калий, химический элемент с символом K, является одним из химически активные щелочные металлы группы 1 с атомным номером 11 в периодической таблице. Калий не встречается в природе в свободном состоянии из-за его высокой реакционной способности, так что он извлекается из различных соединений (в основном из солей).
Как мы знаем, сколько калия используется в мире химии, поэтому у нас должна быть очень хорошая достоверная информация о ее электронных свойствах, чтобы выжить в мире химии, и именно поэтому вы здесь, чтобы знаете, что такое валентные электроны и валентность натрия, не так ли? Но для этого вы должны знать, что это за два термина, поэтому, не теряя времени, пойдем за это,
Разница между валентными электронами и валентностью
Валентные электроны — общее количество присутствующих электронов
во внешней оболочке атома (т.е. на самой внешней орбите). Валентность
электронов для нейтрального атома всегда определен, его нельзя варьировать (больше или
меньше) в любых условиях для конкретного атома и может быть или не быть равным его
валентность.
Валентность
электронов для нейтрального атома всегда определен, его нельзя варьировать (больше или
меньше) в любых условиях для конкретного атома и может быть или не быть равным его
валентность.
Валентные электроны калия (K)
Чтобы узнать валентные электроны атома калия, нужно выполнить четыре простых шага:
Шаг 1. Найдите атомный номер
Чтобы узнать атомный номер калия, мы можем использовать периодический Таблица. С помощью таблицы Менделеева мы можем легко увидеть, что атомный номер калия равен 19. Поскольку его атомный номер равен 19, в нем всего 19 протонов, а для нейтральный калий, количество протонов всегда равно количеству электронов я.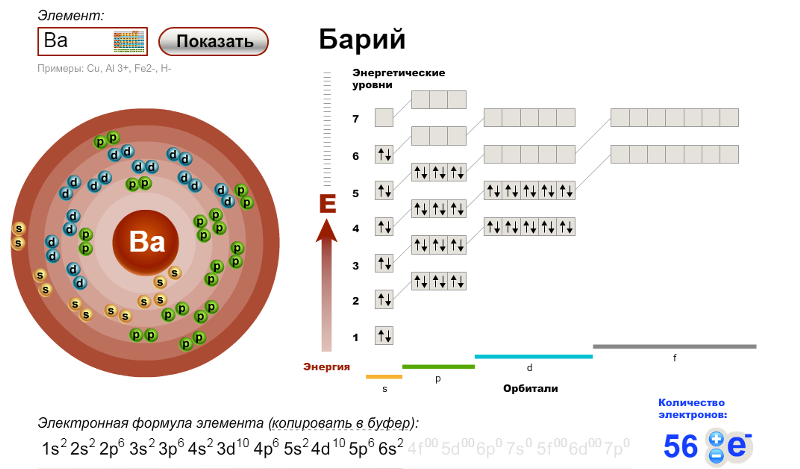 е. 19 электронов в ядре.
е. 19 электронов в ядре.Шаг 2: Запись электронной конфигурации
Электронная конфигурация — это расположение электронов на орбитали. У атома калия 19 электронов, поэтому мы должны положить 11 электроны на орбиталях. Первые два электрона перейдут на 1s-орбиталь как S орбиталь может содержать максимум два электрона. Следующие два уйдут через 2 с. орбитали, и следующие шесть электронов перейдут на 2p-орбиталь, поскольку P-орбиталь может только удерживают максимум 6 электронов.Снова два электрона в 3s и шесть в 3p, а оставшийся один электрон будет двигаться по 4s орбитали. Сейчас мы имеют,Электронная конфигурация калия K (19) = 1s22s22p63s23p64s1 (полная конфигурация) или [Ar] 4 с 1 (сжатая конфигурация).
Шаг 3: Определение оболочки валентности
Как мы знаем, валентную оболочку атома можно найти по наибольшему количеству главных квантовых чисел, которое выражается в члене n, а в 1s22s22p63s23p64s1 наибольшее значение n равно 4, так что валентная оболочка K равна 4 с 1 .
Шаг 4. Найдите валентные электроны
Общее количество электронов, присутствующих в валентной оболочке. атома называется валентными электронами, и присутствует только один электрон в валентной оболочке калия (4 с 1 ). Таким образом, калий имеет только одну валентность. электрон.
Валентность калия (K)
Есть много разных способов узнать валентность атом, который отражает способность атома связываться с другими атомами.Валенсия описывает насколько легко атом или свободный радикал могут соединяться с другими химическими соединениями. В Валентность атома определяется на основе количества электронов, потерянных, полученных или разделенных с другим атомом.
Атом считается стабильным, если его внешние оболочки имеют
восемь электронов (кроме H и He). Если общее количество электронов в
внешние оболочки от одного до четырех, атом имеет положительную валентность, и если
электронов от четырех до восьми, валентность рассчитывается путем вычитания
от восьми и валентность отрицательная. Атомы с четырьмя крайними электронами
обладают как положительной, так и отрицательной валентностью, а атомы имеют восемь внешних
электроны имеют нулевую валентность (т.е. благородные газы).
Атомы с четырьмя крайними электронами
обладают как положительной, так и отрицательной валентностью, а атомы имеют восемь внешних
электроны имеют нулевую валентность (т.е. благородные газы).
Щелочные металлы , такие как калий, достигли стабильного (ближайшего инертного газовая конфигурация), потеряв один крайний электрон. Таким образом, валентность калия (K) равна 1.
Валентность калия также можно определить с помощью таблицы Менделеева. поскольку натрий является элементом группы 1, которая указывает щелочь Группа металлов и валентность щелочных металлов всегда равны 1.
Валентные электроны и валентность K +
Ион калия K + означает, что он потерял один электрон и имеет только
18 электронов на орбиталях. Электронная конфигурация нейтрального K — 1s22s22p63s23p64s1, но в K + он теряет один электрон, поэтому он имеет новую электронную конфигурацию 1s22s22p63s23p6, что означает, что K + имеет только (2 + 6 = 8) крайних электронов, что делает его стабильным. Таким образом, ион калия (K +) имеет восемь валентных электронов.
Таким образом, ион калия (K +) имеет восемь валентных электронов.
K + валентность не равна нулю, как благородный газ, как их крайний край. Оболочка имеет восемь электронов.когда атом калия теряет один электрон, образуется ион K +, и это валентность. Таким образом, валентность K + равна +1, а не нулю.
Химические свойства
Атом калия (K)| Атомный номер | 19 | |||||
| Число протонов | 19 | |||||
| Число электронов | 19 | |||||
| Электронная конфигурация | 1s22s22p63s23p64s14 | 30 | 30 | 30 | 30 Электроны валентности | 1 |
| Валентность / валентность | 1 |
Ион калия (K +)
| Число электронов | 18 |
| Электронная конфигурация | 900p29 1s22ps|
| Валентные электроны | 8 |
| Валентность / валентность | +1 |
Калий — Информация об элементе, свойства и использование
Расшифровка:
Химия в ее элементе: калий
(Promo)
Вы слушаете Химию в ее элементе, представленную вам Chemistry World , журналом Королевского химического общества.
(Конец промо)
Крис Смит
Привет, на этой неделе рассказывается история о первом выделенном щелочном металле, почему это вообще щелочной металл и почему его символ начинается с буквы K. Вот Питер Уотерс.
Питер Уотерс
Калий — единственный элемент, названный в честь кухонной утвари. Он был назван в 1807 году Хамфри Дэви в честь соединения, из которого он выделил металл, калий или гидроксид калия.
Выдержка из 1730-х годов голландского химика Германа Бурхааве описывает, как калий получил свое название:
«Калий или горшечная зола ежегодно в большом количестве привозится торговыми судами из Корланда (ныне часть Латвии и Литвы), Россия. Он готовится там из древесины зеленой пихты, сосны, дуба и тому подобного, из которых делают большие кучи в настоящих траншеях и сжигают их до тех пор, пока они не обратятся в пепел … Затем этот пепел растворяется в кипящей воде, и когда верхний ликер, содержащий соль, очищается, т.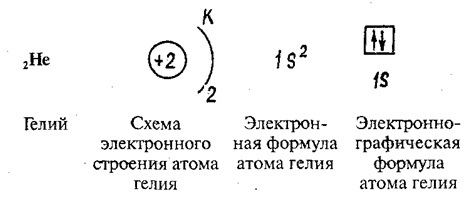 е.е. освобожденный от примесей, при стоянии он сливается прозрачным. Затем его немедленно помещают в большие медные горшки и варят там в течение трех дней, с помощью которых они добывают соль, которую они называют Potas (что означает горшечный пепел), поскольку она таким образом была сделана в горшках. .
е.е. освобожденный от примесей, при стоянии он сливается прозрачным. Затем его немедленно помещают в большие медные горшки и варят там в течение трех дней, с помощью которых они добывают соль, которую они называют Potas (что означает горшечный пепел), поскольку она таким образом была сделана в горшках. .
Еще раньше, в 16 веке, Конрад Геснер сказал нам, что «Из херба по имени Кали, лань сертайне готовят соль»
Он описывает это растение, Кали , латинское название которого Сальсола кали , но больше широко известный как Saltwort:
« Kali состоит из двух Cubites heygth, не имеет колючек или шипов и иногда очень красный, соленый на вкус, с глубоким запахом, найденный и собранный в соленых местах: из которых , можно купить соль щелочи »
Его метод производства этой соли щелочи очень похож на тот, который описал Бургаве, причем оба процесса фактически дают нечистую смесь того, что мы теперь назвали бы карбонатом калия и натрия; метод древесной золы, дающий больше карбоната калия, поташа, соленых трав, дающих больше карбоната натрия, соды. Однако именно от травы кали мы обязаны словом, которое описывает оба — ал-кали или щелочь; префикс «al» — это просто арабский определенный артикль «the».
Однако именно от травы кали мы обязаны словом, которое описывает оба — ал-кали или щелочь; префикс «al» — это просто арабский определенный артикль «the».
Неочищенный калий можно сделать более едким или «чистым» путем обработки его раствора известковой водой, гидроксидом кальция. Растворы карбоната калия и гидроксида кальция вступают в реакцию с небольшой химической заменой партнеров: нерастворимый карбонат кальция или мел выпадает в осадок, оставляя раствор гидроксида калия. Именно из этого чистого гидроксида Дэви впервые выделил металлический калий.Для этого он использовал относительно новую силу электричества.
После безуспешной попытки электролиза водных растворов поташа, во время которой ему удалось только разбить воду, он решил, что ему нужно избавиться от воды и попытаться электролизовать расплавленный гидроксид калия. Он сделал это шестого октября 1807 года, используя большую вольтовскую сваю, которую он построил в Королевском институте в Лондоне. Его младший двоюродный брат, Эдмунд Дэви, помогал Хамфри в то время, и он рассказывает, как, когда Хэмфри впервые увидел, что «крошечные шарики калия прорвались сквозь корку поташа и загорелись при входе в атмосферу, он не смог сдержать свою радость» .
Дэви имел полное право восхищаться этим удивительным новым металлом: он выглядел так же, как другие яркие, блестящие металлы, но его плотность была меньше, чем у воды. Это означало, что металл будет плавать по воде — по крайней мере, так будет, если он не взорвется при контакте с водой. Калий настолько реактивен, что даже прореагирует и прожигает дыру во льду. Это был первый выделенный щелочной металл, но Дэви продолжил выделение натрия, кальция, магния и бария.
В то время как Дэви назвал свой новый металл калием в честь поташа, Берцелиус, шведский химик, который изобрел международную систему химических символов, используемых ныне химиками во всем мире, предпочел для металла название калий, лучше отражающее его истинное происхождение, думал он. . Следовательно, из-за небольшой соленой травы мы теперь получаем символ K для элемента зола, калия.
Крис Смит
Кембриджский химик Питер Уотерс. В следующий раз красиво, но смертельно — вот название игры.
Bea Perks
Мышьяк получил свое название от персидского слова, обозначающего желтый пигмент, ныне известный как арипимент. Для увлеченных лексикографов, очевидно, персидское слово Зарних, о котором идет речь, впоследствии было заимствовано греками для своего слова арсеникон, что означает мужской род или могущественный. Что касается пигментации, то обои Наполеона незадолго до его смерти, как сообщается, имели так называемый зеленый цвет Шееле, который источал пары мышьяка, когда становился влажным.
Крис Смит
Настолько мощно это или нет, но облизывать обои в квартирах Наполеона определенно не стоит.Это Беа Перкс, которая будет с нами в следующий раз, чтобы рассказать нам смертельную историю о мышьяке. Надеюсь, вы присоединитесь к нам. Я Крис Смит, спасибо за внимание и до свидания.
(промо)
(конец промо)
Периодическая таблица
Периодическая таблица
«Если все элементы расположены в порядке их атомного веса, получается периодическое повторение свойств. Это выражается законом периодичности.»
Это выражается законом периодичности.» Дмитрий Менделеев, Основы химии, Vol. 2, 1902, П. Ф. Кольер, стр. 17. «У нас есть доказательство того, что в атоме есть фундаментальная величина, которая постепенно увеличивается при переходе от одного элемента к другому. Эта величина может быть только зарядом центрального положительного ядра, существование которого у нас уже есть определенное доказательство ».
Генри Мозли, Philosophical Magazine, Vol. 26, 1913, стр. 1030. «Химический состав атома зависит только от количества электронов, которое равно количеству протонов и называется атомным номером.Химия — это просто числа, идея, которая понравилась бы Пифагору. Если вы атом с одним протоном, вы водород; два, гелий; ….. »
Карл Саган, Космос, 1980, Рэндом Хаус, стр. 223. Фото: НАСА.
Электронные оболочки
У атома лития два электрона вращаются во внутренней оболочке, и только один электрон вращается вокруг его внешней оболочки. Внешняя оболочка неполная, а значит, нестабильная. Атомы Li легко отдают один электрон с образованием положительно заряженных ионов Li + .Эти ионы имеют ту же стабильную электронную конфигурацию, что и благородный газ гелий.
Все атомы группы 1 могут потерять один электрон с образованием положительно заряженных ионов. Например, атомы калия делают это, чтобы образовать ионы с одним и тем же электроном. конфигурация как благородный газ аргон.
Атомы группы 2 теряют два электрона, образуя положительно заряженные ионы. Например, атомы магния образуют ионы Mg 2+ . Они имеют ту же электронную конфигурацию, что и благородный газ неон.
Большинство элементов в группе 3 теряют три электрона с образованием ионов 3+.Однако бор мало склонен к образованию ионов. Он получает структуру благородного газа, разделяя электроны с другими атомами. Это называется ковалентным связыванием.
Элементам в группах 15, 16 и 17 легче получить электроны, чем потерять их. Например, атомы кислорода получают два электрона с образованием ионов O 2-. Они имеют ту же электронную конфигурацию, что и благородный газ неон.
Элементы в группе 14 могут потерять четыре или получить четыре электрона, чтобы получить структуру благородного газа.Фактически, если они собираются образовывать ионы, элементы группы 14 образуют положительные ионы. Углерод и кремний образуют ковалентные связи. Все миллионы органических соединений углерода основаны на общих электронах в ковалентных связях.
Многие элементы могут образовывать ковалентные связи в зависимости от обстоятельств. Например, связь в воде H 2 0 в основном ковалентна; и хотя хлор ионно связан с натрием в хлориде натрия, он связывается с углеродом ковалентно в четыреххлористом углероде.
Автор: Dr.Дуг Стюарт
Периодическая таблица, которую мы используем сегодня, основана на таблице, разработанной и опубликованной Дмитрием Менделеевым в 1869 году.
Менделеев обнаружил, что может расположить 65 элементов, известных на тот момент, в сетке или таблице так, чтобы каждый элемент имел:
1. Более высокий атомный вес, чем тот, что слева. Например, магний (атомный вес 24,3) помещен справа от натрия (атомный вес 23,0):
Менделеев понял, что стол перед ним лежит в самом сердце химии.Более того, Менделеев увидел, что его таблица неполная — были места, где должны были быть элементы, но их никто не обнаружил.
Точно так же, как можно сказать, что Адамс и Леверье открыли планету Нептун на бумаге, Менделеев можно было сказать, что он открыл германий на бумаге. Он назвал этот новый элемент эка-кремний , после наблюдения зазора в периодической таблице между кремнием и оловом:
Аналогичным образом Менделеев открыл на бумаге галлий ( эка -алюминий) и скандий ( эка -бор), потому что он предсказал их существование и их свойства еще до их фактических открытий.
Хотя Менделеев совершил решающий прорыв, он почти не продвинулся дальше. Оглядываясь назад, мы знаем, что периодическая таблица Менделеева была основана на ложных рассуждениях. Менделеев ошибочно полагал, что химические свойства определяются атомным весом. Конечно, это было совершенно разумно, если принять во внимание научное знание 1869 года.
В 1869 году сам электрон не был открыт — это произошло 27 лет спустя, в 1896 году.
Фактически, потребовалось 44 года, чтобы найти правильное объяснение закономерностей в периодической таблице Менделеева.
Объяснение найдено
Объяснение было дано в 1913 году Генри Мозли, который стрелял электронами по атомам, что привело к испусканию рентгеновских лучей. Мозли обнаружил, что каждый элемент, который он изучал, излучает рентгеновские лучи с уникальной частотой.
Когда он посмотрел на частоты, излучаемые рядом элементов, он обнаружил закономерность, которая лучше всего объяснялась, если положительный заряд в ядре увеличивался ровно на одну единицу от элемента к элементу.
График, обобщающий результаты Мозли
Другими словами, Мозли обнаружил, что элементы отличаются друг от друга, потому что их атомы имеют разное количество протонов.Он обнаружил, что положение элементов в периодической таблице лучше предсказывается их атомным номером , чем их атомным весом. (Атомный номер элемента равен количеству протонов и, следовательно, электронов в одном из его атомов.)
Открытие Мозли прояснило проблемы кобальт-никеля и аргона-калия.
Что касается проблемы аргона и калия, было известно, что аргон имеет более высокий атомный вес, чем калий. Согласно аргументам Менделеева, аргон следует поместить после калия в периодической таблице.Но делать это не имело смысла с точки зрения химических свойств.
Работа Мозли показала, что атомный номер аргона 18, а калия 19. Поэтому аргон следует поставить перед калием в периодической таблице на основе атомных номеров. Химики всего мира вздохнули с облегчением, потому что это соответствовало наблюдаемым химическим свойствам этих элементов.
Мозли также подражал достижению Менделеева открытия новых элементов на бумаге, обнаружив четыре атомных номера без совпадающих элементов.Он предсказал существование элементов с атомными номерами 43, 61, 72 и 75. Эти элементы действительно были обнаружены; теперь мы называем их технецием, прометием, гафнием и рением.
Сегодня химические элементы по-прежнему расположены в порядке возрастания атомного номера (Z), если смотреть на периодическую таблицу слева направо. Мы называем горизонтальные ряды периодами . Например, вот период 4:
.Мы называем вертикальные ряды группами .
Например, вот группа 2:
Теперь мы также знаем, что химический состав элемента определяется тем, как расположены его электроны — его электронная конфигурация .
Электроны в атомах можно представить как занимающие слои или оболочки, окружающие атомное ядро. Это показано на схеме атома лития в левой части этой страницы. Мы представляем электроны как маленькие планеты, вращающиеся вокруг солнечного ядра, в котором расположены протоны и нейтроны. Это называется боровским представлением атома. На самом деле это приблизительное значение, но это хорошая отправная точка для понимания химических свойств элементов.
Если мы исключим элементы переходных металлов, мы можем сказать, что атомы, которые занимают одну и ту же группу периодической таблицы, имеют одинаковое количество внешних электронов.Например, все элементы в группе 2, показанные слева, имеют два внешних электрона.
Эти внешние электроны называются валентными электронами .
Валентные электроны
Именно валентные электроны вызывают химическую реактивность.
Все элементы в группе 1 имеют один валентный электрон; Группа 2 — два валентных электрона; Группа 13 — три валентных электрона; Группа 14 — четыре валентных электрона; Группа 15 — пять валентных электронов; Группа 16 — шесть валентных электронов; Группа 17, семь валентных электронов; и Группа 18 — восемь валентных электронов, за исключением гелия, у которого их два.
Группа 18 — это группа благородных газов, группа инертных элементов. Нежелание благородных газов вступать в химическую реакцию является ключом к нашему пониманию того, почему другие элементы действительно реагируют.
Нереактивные частицы: если атом имеет электронную конфигурацию благородного газа, он будет химически неактивным или будет реагировать с трудом. Реактивные частицы: если атом не имеет той же электронной конфигурации, что и благородный газ, он будет иметь тенденцию реагировать, чтобы достичь этого.
Благородные газы неактивны, потому что их внешние электронные оболочки заполнены. Полная оболочка внешних электронов — особенно стабильное устройство. Это означает, что атомы благородных газов не легко приобретают и не теряют электроны; они реагируют с другими атомами с большим трудом или не реагируют вовсе.
Другие атомы теряют электроны, приобретают электроны или делятся электронами, чтобы достичь той же электронной конфигурации, что и благородный газ — при этом они образуют химические связи и производят новые вещества.
Атом натрия реагирует с атомом хлора с образованием хлорида натрия
Например, на диаграмме выше атом натрия теряет свой единственный валентный электрон в пользу атома хлора. Когда атом теряет или приобретает один или несколько электронов, его уже нельзя описать как атом — он называется ионом .
Все ионы заряжены положительно или отрицательно.
Поскольку наш атом натрия потерял отрицательно заряженный электрон, он становится положительно заряженным ионом натрия: Na + .Этот ион натрия, у которого на один электрон меньше, чем у атома натрия, имеет ту же электронную конфигурацию, что и благородный газ неон, и химически стабилен.
Атом хлора, который начинается с семи валентных электронов, получает один электрон и становится отрицательно заряженным ионом хлора: Cl — . Этот ион имеет ту же электронную конфигурацию, что и благородный газ аргон, и, следовательно, этот ион также химически стабилен.
Положительно заряженный ион натрия и отрицательно заряженный ион хлора электростатически притягиваются друг к другу, образуя стабильное химическое соединение, хлорид натрия.Эти электростатические связи называются ионными связями .
Для переходных металлов ситуация немного сложнее, чем описанная выше, потому что электроны из нижних оболочек в атомах переходных металлов могут стать валентными электронами. Вот почему, например, мы можем получить разные типы ионов меди, Cu + и Cu 2+ , и ионы железа, Fe 2+ и Fe 3+ .
Число валентных электронов в атомах является основой регулярных закономерностей, наблюдаемых Менделеевым в 1869 году, закономерностей, которые в конечном итоге дали нам нашу современную периодическую таблицу.
Энергии ионизации элементов — энергия, необходимая для удаления одного электрона.
Эти измерения были невозможны во времена Менделеева.
Они иллюстрируют периодическое (регулярное) поведение элементов.
ионов
ионовИоны
Посмотрите на атом, показанный ниже. Он имеет по 3 протона, нейтрона и электронов и представляет собой литий (Li). Если бы мы писали символически это будет 6 Li.
Литиевый атом
Литий имеет только один электрон во внешней оболочке. Что бы произошло, если бы мы удалили этот электрон?
Без внешнего электрона у атома лития было бы больше положительные заряды (+3), чем отрицательные (-2). Атом с другим Число электронов в протоны будет называться ион . Такие элементы, как литий, которые теряют свои электроны, образуют положительные ионы. Символически мы можем представить это как Li +1 . Прочие элементы стремятся получить электроны. Кислород — хороший пример одного из них:
Атом кислорода
Кислород обычно имеет в общей сложности 8 электронов, но только 6 из них. находятся в самой внешней оболочке или на орбите. Элементы предпочитают иметь полную внешнюю снаряды. Они также предпочитают максимально легко попасть в это состояние. Выше литию было легче потерять один электрон, чем получить 7 электроны.Точно так же кислороду легче получить 2 электрона вместо потери 6 электронов:
Ион кислорода
Два полученных электрона (фиолетовые точки) означают, что этот кислород ион имеет 10 электронов (заряд -10) и только 8 протонов (заряд +8), что дает иону чистая плата -2. Символически мы можем представить этот ион кислорода как O -2 .
Периодическая таблица может использоваться, чтобы помочь предсказать, сколько электроны находятся во внешней оболочке, и, следовательно, какой тип иона они будут форма.Вот та же диаграмма с предыдущей страницы, но с некоторыми к нему добавлена дополнительная информация:
Черные числа выше представляют количество электронов в внешняя оболочка. Обратите внимание, что в каждом столбце больше электронов в крайнем оболочки, когда вы идете вправо, и что последний ряд (возглавляемый He или Helium) имеет полная внешняя оболочка. {Особое примечание: гелий имеет только 2 электрона в крайняя оболочка, но она заполнена для первой оболочки.} Красный числа представляют тип иона, который образовал бы атом, начиная с +1 иона слева и заканчивая без ионов («0») на верно. Элементы с полной внешней оболочкой не образуют ионы . Желтая секция с надписью «Переходные элементы» — это элементы, которые имеют тенденцию терять электроны из оболочек, отличных от внешней оболочки, и образуют положительные ионы. Например, железо (Fe) образует два разных положительных иона, Fe +2 ( двухвалентное железо ) и Fe +3 ( трехвалентное железо утюг). Понимание того, почему существуют разные ионы железа, сложно и сложно. выходит за рамки этого курса. Однако вы сможете определить ионное состояние атомов из других групп с использованием Периодической таблицы.
Quick Quiz: Используйте таблицу выше, чтобы ответить на следующие вопросы:
Какой ион образует атом хлора (Cl)?
Какой ион образует атом алюминия (Al)?
Какой ион образует атом магния (Mg)?
Какой ион образовал бы атом калия (K)?
Ответы:
Хорин находится в седьмой колонке и, следовательно, имеет 7 электроны в его внешней оболочке.Было бы стремиться получить один электрон и образуют -1 ион .
Алюминий находится в пятой колонке и, следовательно, имеет 5 электроны в его внешней оболочке. Было бы потеряно три электронов и образуют ион +3 .
Магний находится во втором столбце и, следовательно, имеет 2 электроны в его внешней оболочке. Он потерял бы два электрона. и образуют ион +2 .
Калий находится в первом столбце и, следовательно, имеет 1 электрон в своей внешней оболочке.Он потерял бы один электрон и образуют ион +1 .
Продолжите и узнайте о склеивании.
Вернуться в главное меню.
Вернуться на страницу вводного курса наук о Земле.
5.2: Электроны и валентность — Chemistry LibreTexts
На химическом уровне важным ключом к разгадке электронной структуры атомов является существование благородных газов, которые почти полностью не могут образовывать химические соединения. Это отсутствие реакционной способности предполагает, что атомы этих элементов имеют структуры, которые не допускают взаимодействия со структурами других атомов.Вторая подсказка — это тесное соответствие между валентностью элемента и степенью, в которой его атомный номер отличается от атомного номера ближайшего благородного газа. Элементы с валентностью 1 , например, имеют атомные номера на один больше или на один меньше , чем у благородного газа. Таким образом, атомы щелочных металлов Li, Na, K, Rb и Cs содержат на один электрон больше, чем соответствующие благородные газы He, Ne, Ar, Kr и Xe, а атомы водорода H и галогены F, Cl, Br и I содержат на один электрон меньше.Аналогичные замечания относятся к валентности 2 . Атомы щелочноземельных металлов Be, Mg, Ca, Sr и Ba содержат на два электрона больше, чем атом благородного газа, в то время как элементы O, S, Se и Te содержат на два электрона меньше. Точно такая же модель поведения распространяется и на элементы с валентностью 3 или 4.
Еще в 1902 году Льюис начал предлагать (в своих лекциях для студентов общей химии, не меньше), что только что описанное поведение можно объяснить, если предположить, что электроны в атомах расположены в оболочках , причем все электроны находятся в одной оболочке. находясь примерно на таком же расстоянии от ядра.Рисунки, которые он в конечном итоге развил для атомов гелия, хлора и калия, проиллюстрированы ниже. В атоме гелия два электрона занимают только одну оболочку, в атоме хлора 17 электронов расположены в трех оболочках, а в атоме калия 19 электронов занимают четыре оболочки. Льюис предположил, что каждая оболочка может вместить только определенное количество электронов. Как только это число будет достигнуто, оболочку следует рассматривать как , заполненную , и любые лишние электроны размещаются в следующей оболочке, несколько дальше от ядра.Более того, когда оболочка заполнена, предполагается, что она имеет особенно стабильную структуру, которая предотвращает любое взаимодействие электронов в оболочке с другими атомами. Таким образом, химическое значение имеют только электроны в внешней не полностью заполненной оболочке (называемые валентными электронами ). Более того, если самая внешняя оболочка заполнена, то образовавшийся атом будет иметь небольшую тенденцию или вообще не будет реагировать с другими атомами и образовывать с ними соединения. Поскольку именно такое поведение проявляют благородные газы, Льюис пришел к выводу, что характерной чертой атома благородного газа является заполненная на внешняя оболочка из электронов.
Рисунок \ (\ PageIndex {1} \) Оболочечная структура атомов He, Cl и K, предложенная Льюисом. Обратите внимание на валентные электроны красного цвета.Предполагая, что все благородные газы содержат внешнюю заполненную оболочку, теперь довольно просто вычислить, сколько электронов может быть размещено в каждой оболочке. Поскольку первый благородный газ гелий имеет два электрона, мы знаем, что только два электрона необходимы для заполнения первой оболочки. Еще восемь электронов приводят нас к следующему благородному газу неону ( Z = 10).Соответственно, мы делаем вывод, что вторая оболочка может вместить максимум восемь электронов. Аналогичный аргумент приводит к выводу, что для третьей оболочки также требуется восемь электронов, чтобы заполнить ее, и что атом аргона имеет два электрона в первой оболочке, восемь во второй и восемь в третьей, всего 18 электронов.

 Для элементов главных подгрупп число электронов во внешнем электронном слое атома равно
Для элементов главных подгрупп число электронов во внешнем электронном слое атома равно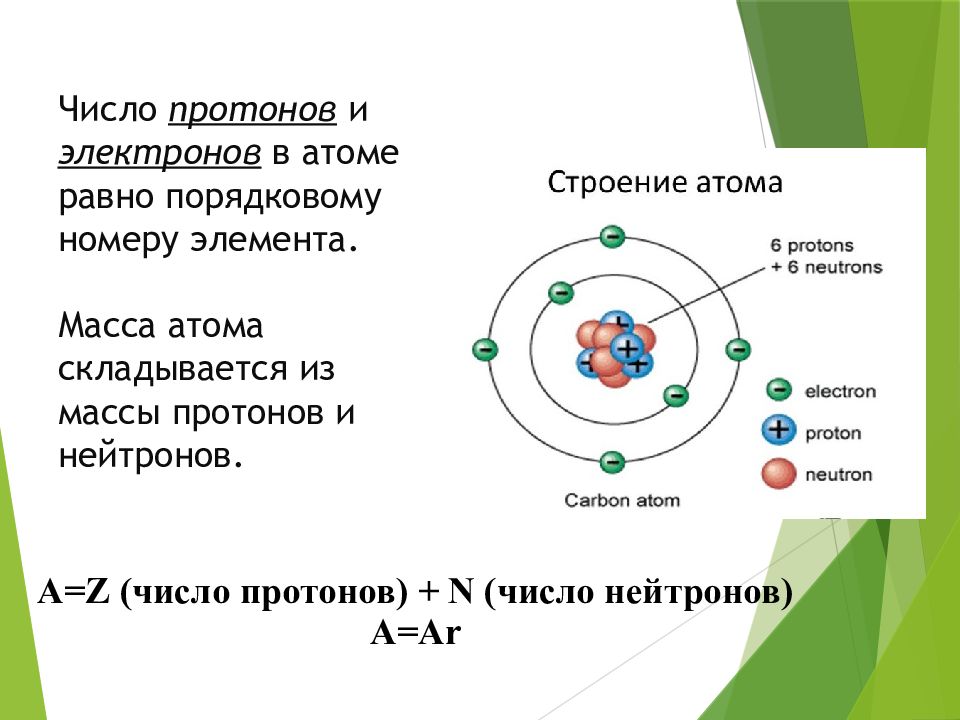 Схема распределения электронов по электронным слоям 2, 8, 7 соответствует атому
Схема распределения электронов по электронным слоям 2, 8, 7 соответствует атому
 5 моль меди
5 моль меди ,5 моль азота
,5 моль азота 5 моль хлора
5 моль хлора Поскольку нейтральные атомы в периодической таблице имеют такое же количество электронов, что и протоны, у атома должно быть 8 протонов. Число протонов такое же, как и атомный номер, поэтому атом — это кислород.
Поскольку нейтральные атомы в периодической таблице имеют такое же количество электронов, что и протоны, у атома должно быть 8 протонов. Число протонов такое же, как и атомный номер, поэтому атом — это кислород. 2 электрона находятся на первом энергетическом уровне.
2 электрона находятся на первом энергетическом уровне.

