4) Элемент относится к группе неметаллов. Его простое вещество при обычных условиях находится в газообразном агрегатном состоянии. Формула простого вещества N2\mathrm{N_2}N2.
5) Валентность азота в высшем оксиде равна V, так как это элемент V группы. Валентность в летучем водородном соединении равна III.
6) Формула высшего оксида — N2O5\mathrm{N_2O_5}N2O5. Он принадлежит к кислотным оксидам. Гидроксид, соответствующий ему, предел являет собой кислоту HNO3\mathrm{HNO_3}HNO3.
7) Формула летучего водородного соединения — Nh4\mathrm{NH_3}Nh4.
в) Алюминий
1) Название химического элемента — алюминий, химический знак Al, относительная масса 27.
2) Атомный (порядковый) номер в периодической системе 13, элемент 3-го периода (малого), IIIA-группы (главной).
3) Заряд ядра атома 13+, оно содержит 13 протонов; в ядре нуклида 1327Al  14\mathrm{_{13}^{27}Al\,\, 14}1327Al14 нейтронов.
4) Элемент относится к группе неметаллов. Его простое вещество при обычных условиях находится в газообразном агрегатном состоянии. Формула простого вещества — Cl2\mathrm{Cl_2}Cl2.
5) Валентность хлора в высшем оксиде равна VII, так как это элемент VII-А группы. Валентность в летучем водородном соединении равна I.
6) Формула высшего оксида — Cl2O7\mathrm{Cl_2O_7}Cl2O7. Он принадлежит к кислотным оксидам. Гидроксид, соответствующий ему, представляет собой кислоту — HClO4\mathrm{HClO_4}HClO4.
7) Формула летучего водородного соединения — HCl\mathrm{HCl}HCl.
zadachi_5
Задачи на изотопы
Уровень А
1. Рассчитать
изотопный состав (в %) водорода (средняя
относительная атомная масса Ar =
1,008) и лития (Ar =
6,9), предполагая, что каждый элемент
состоит только из двух изотопов,
относительные атомные массы которых
отличаются на единицу.
Ответ. Водород: 1Н – 99,2% и 2Н – 0,8%; литий: 6Li – 10% и 7Li – 90%.
2. Относительная атомная масса природного водорода составляет 1,00797. Этот водород является смесью изотопов протия (Ar = 1,00782) и дейтерия (Ar = 2,0141). Какой процент дейтерия в природном водороде?
Ответ. 0,015%.
3.
Среди приведенных символов элементов укажите изотопы и изобары:Ответ. У изотопов одинаковые химические символы, у изобаров одинаковые атомные массы.
4. Природный литий (Ar = 6,9) состоит из изотопов с массовыми числами 6 и 7. Сколько процентов первого изотопа он содержит?
Ответ. 10%.
10%.
5. Масса атома изотопа магния равна 4,15•10–23 г. Определите число нейтронов, которое содержит ядро этого атома.
Ответ. 13.
6. Медь имеет два изотопа с массовыми числами 63 и 65. Массовая доля их в природной меди составляет соответственно 73% и 27%. На основании этих данных рассчитайте среднюю относительную атомную массу природной меди.
Ответ. 63,54.
7. Средняя относительная атомная масса природного хлора равна 35,45. Вычислите массовые доли двух его изотопов, имеющих массовые числа 35 и 37.
Ответ. 77,5% и 22,5%.
8. Определите
относительную атомную массу бора, если
известны массовые доли его изотопов
(10В)
= 19,6% и (11В)
= 80,4%.
Ответ. 10,804.
9. Литий состоит из двух природных изотопов с массовыми числами 6 (1 = 7,52%) и 7 (2
= 92,48%). Рассчитайте относительную атомную массу лития.Ответ. 6,9248.
10. Рассчитайте относительную атомную массу кобальта, если известно, что в природе существуют два его изотопа: с массовыми числами 57 (1 = 0,17%) и 59 (2 = 99,83%).
Ответ. 58,9966.
11. Относительная атомная масса бора составляет 10,811. Определите процентное содержание в природном боре изотопов с массовыми числами 10 и 11.
Ответ. 18,9% и 81,1%.
12. Галлий
имеет два природных изотопа с массовыми
числами 69 и 71. В каком количественном
соотношении находятся между собой числа
атомов этих изотопов, если относительная
атомная масса элемента 69,72.
В каком количественном
соотношении находятся между собой числа
атомов этих изотопов, если относительная
атомная масса элемента 69,72.
Ответ. 1,78:1.
13. Природный бром имеет два изотопа с массовыми числами 79 и 81. Относительная атомная масса брома 79,904. Определите массовую долю каждого из изотопов в природном броме.
Ответ. 54,8% и 45,2%.
Уровень Б
1. Кремний имеет три стабильных изотопа – 30Si (3,05 %(мол.)), 29Si и 28Si. Вычислите содержание (в %(мол.)) самого распространенного изотопа кремния. Как будут отличаться молярные массы диоксида кремния, имеющего разный изотопный состав, если учесть, что кислород имеет три стабильных изотопа с массовыми числами 16, 17 и 18?
Ответ. 94,55%;
18 видов молекул диоксида кремния.
2. Образец состоит из смеси двух изотопов одного элемента; 30% составляет изотоп, в ядре атома которого – 18 нейтронов; 70% составляет изотоп, в ядре атома которого – 20 нейтронов. Определите порядковый номер элемента, если средняя относительная атомная масса элемента в смеси изотопов составляет 36,4.
Ответ. 17.
3. Химический элемент состоит из двух изотопов. В ядре атома первого изотопа – 10 протонов и 10 нейтронов. В ядре атома второго изотопа – нейтронов на 2 больше. На 9 атомов более легкого изотопа приходится один атом более тяжелого изотопа. Вычислите среднюю относительную атомную массу элемента.
Ответ. 20,2.
4. Изотоп 137Cs
имеет период полураспада 29,7 лет. 1 г
этого изотопа прореагировал со взрывом
с избытком воды. Каков период полураспада
цезия в образовавшемся соединении?
Ответ обоснуйте.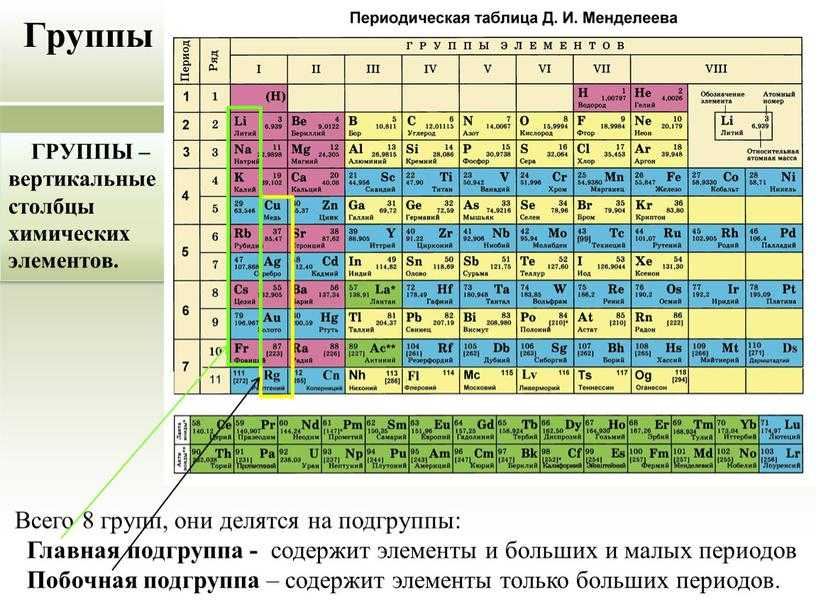
Ответ. T1/2 = 29,7 лет.
5. Через сколько лет количество радиоактивного стронция-90 (период полураспада 27 лет), выпавшего с радиоактивными осадками в результате ядерного взрыва, станет менее 1,5% от того количества, которое было обнаружено в момент после ядерного взрыва?
Ответ. 163,35 лет.
6. В методе меченых атомов радиоактивные изотопы используют для того, чтобы «проследить маршрут» некоторого элемента в организме. Так, пациенту с больной поджелудочной железой вводят препарат радиоактивного изотопа йода-131 (претерпевает –-распад), что позволяет врачу проследить за прохождением йода по организму больного. Напишите уравнение радиоактивного распада и рассчитайте, через какое время количество радиоактивного йода, введенного в организм, уменьшится в 10 раз (период полураспада 8 сут).
Ответ.
7. Сколько времени потребуется для того, чтобы три четверти никеля превратились в медь в результате –-распада, если период полураспада изотопа 6328Ni составляет 120 лет?
Ответ. 240 лет.
8. Найдите массу изотопа 81Sr (период полураспада 8,5 ч), оставшуюся после 25,5 ч хранения, если первоначальная масса составляла 200 мг.
Ответ. 25 мг.
9.
Ответ. 1,5625%.
10. Период
полураспада –-радиоактивного
изотопа 24Na
равен 14,8 ч. Напишите уравнение реакции
распада и вычислите, сколько граммов
дочернего продукта образуется из 24 г
этого изотопа за 29,6 ч.
Напишите уравнение реакции
распада и вычислите, сколько граммов
дочернего продукта образуется из 24 г
этого изотопа за 29,6 ч.
Ответ.
11. Изотоп 210Ро, излучающий -частицы, используется в смеси с бериллием в нейтронных источниках. Через какое время интенсивность таких источников уменьшится в 32 раза? Период полураспада изотопа равен 138 дням.
Ответ. 690 сут.Упражнения на ядерные реакции
1. Сколько — и –-частиц должно было потерять ядро 226Ra для получения дочернего элемента с массовым числом 206, принадлежащего IV группе периодической системы элементов? Назовите этот элемент.
Ответ. 5, 4–, 20682Pb.
2. Ядро
атома изотопа 23892U
в результате радиоактивного распада
превратилось в ядро 22688Ra.
Сколько —
и –-частиц
испустило при этом исходное ядро?
Ядро
атома изотопа 23892U
в результате радиоактивного распада
превратилось в ядро 22688Ra.
Сколько —
и –-частиц
испустило при этом исходное ядро?
Ответ. 3, 2–.
Ответ. Образуется изотоп 12С по уравнению ядерной реакции:
4. Атомы 238U
испускают -частицы.
Получающиеся при этом атомы другого
элемента испускают –-частицы,
при этом образуются атомы нового
элемента, испускающие –-частицы. Определите, изотоп какого элемента
образуется в результате этих
последовательных превращений.
Определите, изотоп какого элемента
образуется в результате этих
последовательных превращений.
Ответ. 23492U.
5. Первой в истории искусственной ядерной реакцией была реакция изотопа 14N с -частицами, получаемыми при распаде 210Po. В результате ядерной реакции азот превратился в изотоп кислорода 17О. Напишите уравнения происходящих ядерных превращений.
Ответ. .
* В настоящее время в научной литературе для обозначения вида атомов с определенным числом в его ядре протонов и нейтронов используется термин «нуклид». Нуклиды одного элемента – это изотопы. Использовать термин «изотоп» в единственном числе ИЮПАП и ИЮПАК не рекомендуют.
Атомный вес лития | Комиссия по изотопному содержанию и атомному весу
id=»header-top»>
- Прочие элементы
| Isotope | Atomic mass (Da) | Isotopic abundance (amount fraction) |
|---|---|---|
| 6 Li | 6. 015 122 89(1) 015 122 89(1) | [0.019, 0.078] |
| 7 Li | 7,016 003 44(3) | [0,922, 0,981] |
Хотя Li встречается в различных геологических ассоциациях и хотя относительная разность масс изотопов велика, проявляется изменчивость значений атомного веса лития в большинстве земных источников быть меньше 0,002. Наименьшее содержание лития 7 , зарегистрированное для естественного образца получен из растворенного лития в подземных водах прибрежного водоносного горизонта в Южной Каролине с x ( 7 Li) = 0,9227 и А r (Li) = 6,9387. Наибольшее содержание 7 Li, зарегистрированное в природном образце, связано с литием. в поровой воде из керна морских отложений с х ( 7 Li) = 0,9278 и A r (Li) = 6,9438.
Второстепенный изотоп 6 Li представляет собой потенциально ценный ядерный исходный материал для производства трития. важный компонент водородных бомб и поглотитель нейтронов для реакции ядерного синтеза.
Литий обеднен 6 Li может продаваться в коммерческих целях с содержанием 6 Li всего 2 % и
атомные массы свыше 6,99. Это оправдание для аннотации «m». В 1993 году
Комиссия выразила обеспокоенность наличием на коммерческом рынке таких истощенных материалов.
и решил поместить значение атомного веса и неопределенность в квадратные скобки и добавить крестик
символ, предупреждающий о том, что если требуется более точное значение, оно должно быть определено на образце
соответствующий материал.
важный компонент водородных бомб и поглотитель нейтронов для реакции ядерного синтеза.
Литий обеднен 6 Li может продаваться в коммерческих целях с содержанием 6 Li всего 2 % и
атомные массы свыше 6,99. Это оправдание для аннотации «m». В 1993 году
Комиссия выразила обеспокоенность наличием на коммерческом рынке таких истощенных материалов.
и решил поместить значение атомного веса и неопределенность в квадратные скобки и добавить крестик
символ, предупреждающий о том, что если требуется более точное значение, оно должно быть определено на образце
соответствующий материал.
В 1995 году Комиссия рекомендовала сообщать все значения δ ( 7 Li) относительно эталонного материала карбоната лития LSVEC.
ИСТОЧНИКИ Атомный вес элементов: обзор 2000 г., подготовленный John R de Laeter et al. Чистое приложение. хим. 2003 (75) 683-800Атомные массы элементов 2009 М.Е. Визера и Т.Б. Коплен. Чистое приложение. хим. 2011 (83) 359-396
CIAAW
Литий
A r (Li) = [6,938, 6,997] с 2009 г.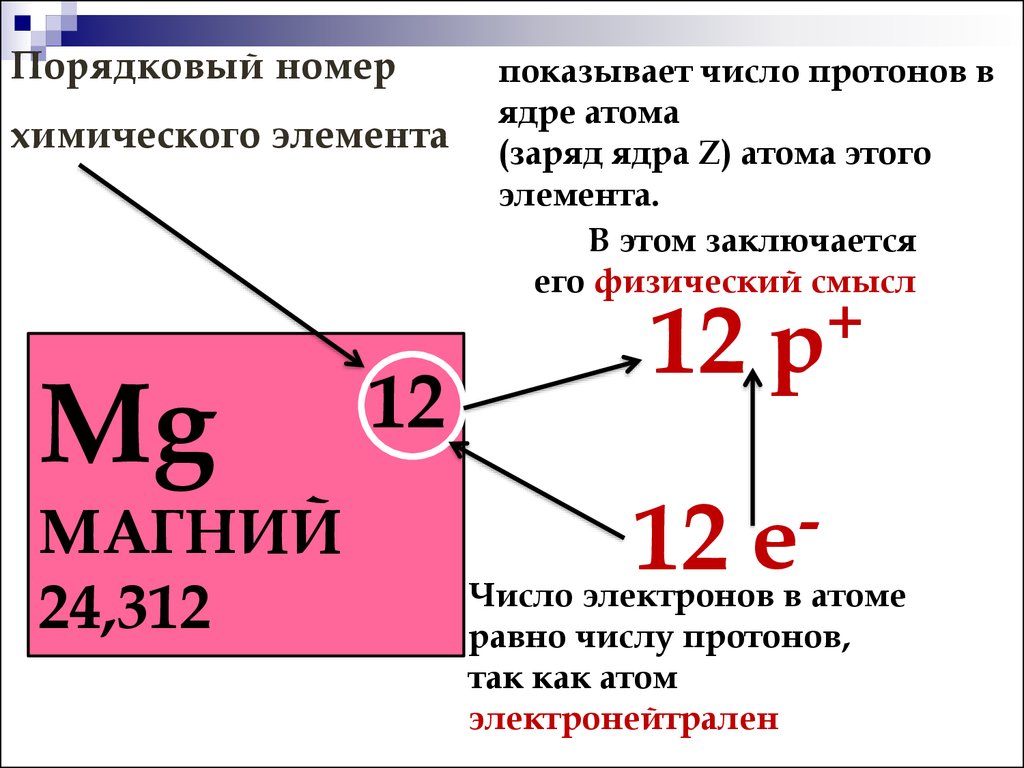
Название происходит от латинского lithos , что означает «камень», поскольку считалось, что литий существует только в минералах. в это время. Открыт шведским минералогом Йоханом Августом Арфведсоном в 1818 г. минерал петалит LiAl(Si 2 O 5 ) 2 . Литий был выделен в 1855 году немецким химиком Робертом Вильгельмом Бунзеном. и Август Маттиссен.
Естественные вариации изотопного состава лития
Изотопные эталонные материалы лития.
id=»контент поддержки»>
идентификатор = «содержание»>
Lithium — Atomic Number — Atomic Mass — Density of Lithium
by Author
Atomic Number of Lithium
Lithium is a chemical element with atomic number 3 which means there are 3 protons and 3 электрона в атомной структуре. Химический символ для лития равен 9.0087 Ли .
Химический символ для лития равен 9.0087 Ли .
Поскольку количество электронов отвечает за химическое поведение атомов, атомный номер идентифицирует различные химические элементы.
Как атомный номер определяет химическое поведение атомов?
Атомная масса лития
Атомная масса лития составляет 6,941 ед.
Обратите внимание, что каждый элемент может содержать больше изотопов. Следовательно, эта результирующая атомная масса рассчитывается на основе встречающихся в природе изотопов и их распространенности.
Единицей измерения массы является атомная единица массы (а.е.м.) . Одна атомная единица массы равна 1,66 х 10 -24 грамма. Одна единая атомная единица массы составляет приблизительно массы одного нуклона (либо отдельного протона, либо нейтрона) и численно эквивалентна 1 г/моль.
Для 12 C атомная масса точно равна 12u, так как по ней определяется единица атомной массы. Для других изотопов изотопная масса обычно отличается и обычно находится в пределах 0,1 ед от массового числа. Например, 63 Cu (29 протонов и 34 нейтрона) имеет массовое число 63, а изотопная масса в основном ядерном состоянии составляет 62,91367 ед.
Для других изотопов изотопная масса обычно отличается и обычно находится в пределах 0,1 ед от массового числа. Например, 63 Cu (29 протонов и 34 нейтрона) имеет массовое число 63, а изотопная масса в основном ядерном состоянии составляет 62,91367 ед.
Различие между массовым числом и изотопной массой, известное как дефект массы, объясняется двумя причинами: Это увеличивает массу ядер с большим количеством нейтронов, чем протонов, относительно шкалы единиц атомной массы, основанной на 12 C с равным количеством протонов и нейтронов.

Число атомной массы определяет прежде всего атомную массу атомов. Массовое число различно для каждого изотопа химического элемента.
Как атомная масса определяет плотность материалов?
Плотность лития
Плотность лития 0,535 г/см 3 .
Типичные плотности различных веществ при атмосферном давлении.
Плотность определяется как масса на единицу объема . Это интенсивное свойство , которое математически определяется как масса, деленная на объем:
ρ = m/V
Другими словами, плотность (ρ) вещества равна общей массе (m) этого вещества, деленной на общий объем (V), занимаемый этим веществом. Стандартная единица СИ составляет кг на кубический метр ( кг/м 3 ). Стандартная английская единица измерения – масса 90 087 фунтов на кубический фут ( фунтов/фут 3 ).
См. также: Что такое плотность
См. также: Самые плотные материалы Земли
Литий – сводка свойств
| Element | Lithium |
|---|---|
| Atomic Number | 3 |
| Symbol | Li |
| Element Category | Alkali Metal |
| Phase at STP | Solid |
| Атомная масса [а.е.м.] | 6,941 |
| Плотность при стандартной температуре [г/см3] | 0,535 |
| Электронная конфигурация | [HE] 2S1 |
| Возможные состояния окисления | +1 |
| Электронный аффинность [KJ/MOL] | 59,6 |
| Электронегитируемость [Pauling Scale] | |
| Electronegativity [Pauling Scale] | |
| . EV] | 5.3917 |
| Год открытия | 1817 |
| Discoverer | Arfvedson, Johan August |
| Thramal Properties | |
| Thramal Properties | 777777 |
Печата плавления. |
