Какая производная от ln 2? – Обзоры Вики
Производная y=ln(2) равна 0 . Помните, что одно из свойств производных состоит в том, что производная от константы всегда равна 0.
Что такое лнкс? Чай функция натурального логарифма ln(x) — обратная функция экспоненциальной функции ex. При x>0 f (f –1(х)) = еln(x) = х. Или. ф –1(f (x)) = ln(ex) = х.
Во-вторых, как вы находите Lnx? Естественный журнал просто позволяет людям, читающим задачу, узнать, что вы берете логарифм числа по основанию e. x, каким бы ни был x.
x, каким бы ни был x.
Возможен ли журнал 0?
журнал 0 не определен. Это ненастоящее число, потому что вы никогда не получите ноль, возведя что-либо в степень чего-либо другого. Вы никогда не сможете достичь нуля, вы можете приблизиться к нему только с помощью бесконечно большой и отрицательной силы. … Это потому, что любое число, увеличенное до 0, равно 1.
Что такое Антилоги? Определение антилогарифма: Антилогарифм, также известный как «антилогарифм» числа, представляет собой обратный метод нахождения логарифма того же числа. Учтите, что если x является логарифмом числа y по основанию b, то мы можем сказать, что y является антилогарифмом x по основанию b. Он определяется по. Если журналb y = x Тогда y = антилогарифм x.
Как упростить Lnx?
Какова ценность LNX? Натуральный логарифм числа — это его логарифм по основанию математической константы e, которая является иррациональным и трансцендентным числом, приблизительно равным 2. 718281828459. Натуральный логарифм x обычно записывается как ln x, loge x, а иногда, если основание e неявно, просто log x.
718281828459. Натуральный логарифм x обычно записывается как ln x, loge x, а иногда, если основание e неявно, просто log x.
Каково значение log2?
Значение log 2 по основанию 10 равно 0.301. Функция журнала или функция логарифма используется в большинстве математических задач, которые содержат экспоненциальные функции.
Что означает log2?
База бревна 2 также известна как двоичный логарифм. Обозначается как (log2n). Логарифм по основанию 2 или двоичный логарифм — это логарифм по основанию 2. Это функция, обратная степени двух функций. Двоичный логарифм — это степень, в которую нужно возвести число 2, чтобы получить значение n.
Что такое log2 на калькуляторе? Логарифм по основанию 2, также известный как двоичный логарифм, равен логарифм по основанию 2.
Как упростить ln?
com/embed/wRXdiePi5-0″ frameborder=»0″ allowfullscreen=»allowfullscreen» data-original-w=»720″ data-original-h=»520″>Как я могу решить свою бывшую?
Что такое е бесконечность? Это означает, что е увеличивается с очень высокой скоростью, когда е возводится в бесконечную степень, и, таким образом, приводит к очень большому числу, поэтому мы заключаем, что е возводится в бесконечную степень. это бесконечность. Теперь рассмотрим, когда e возводится в степень отрицательной бесконечности. ⇒ е–∞
Что такое бесконечность?
Ответ на этот вопрос ∞ . Естественная логарифмическая функция строго возрастает, поэтому она всегда растет, хотя и медленно. Производная y’=1x, поэтому она никогда не равна 0 и всегда положительна. Следовательно, n должно быть большим.
Производная y’=1x, поэтому она никогда не равна 0 и всегда положительна. Следовательно, n должно быть большим.
Существует ли log0 с основанием 10? Невозможно найти значение х, еслиx = 0, т. Е. 10x = 0, где x не существует. Так, основание 10 логарифма нуля не определено. Натуральная логарифмическая функция 0 обозначается как «loge 0 «.
от записей в блокноте до менеджеров браузеров
Алихан Исрапилов
устал восстанавливать пароли
Профиль автора
В последние годы появляется все больше различных сервисов, сайтов и приложений, требующих регистрации и паролей.
Мы спросили у читателей Тинькофф Журнала, как им удается не путаться и не терять ни одного пароля. Собрали пять надежных способов их хранения — от традиционных с записью в блокнот или заметки до необычных с использованием специальной карты.
Это комментарии читателей из Сообщества. Собраны в один материал, бережно отредактированы и оформлены по стандартам редакции.
Способ № 1
📝 Записывать или запоминать Ховард Моржовый
восстанавливает пароли
Пароли храню в голове, а для забытых пользуюсь функцией восстановления 🙂
Системный инженер
придумал секретный шифр
Пароли стараюсь запоминать. Пин-коды самых часто используемых карт запоминаю, но и все пин-коды записываю, зашифровав их по одному мне известной системе. Естественно, шифрую и сам факт того, что это записаны пин-коды.
T Kartseva
забывает пароли
Я из тех людей, кто вечно забывает свои пароли. Часто оказываюсь в ситуации, когда на кассе не могу расплатиться картой, потому что пин-код не подходит. Часть паролей записана по старинке на бумажке, часть запоминаю, но, как показывает практика, плохо.
Авторка
ведет каталог
Паролей под сотню, просто записываю, ведь невозможно все запомнить. Два-три пин-кода и номера карты держать в голове — это одно, а под сотню разных паролей, разной длины… Да я логины-то не всегда помню 🙂
Андрей Ротарев
обладает хорошей памятью
Не поверите. Все до единого — в голове. Круто, да?
Все до единого — в голове. Круто, да?
Способ № 2
📱 Использовать менеджеры паролей Свинья Апокалипсиса
советует KeePass
Имею дело с тысячами различных паролей. Упомнить все невозможно. Выписывать на бумагу — будет несколько увесистых томов. Храню пароли в различных базах на платформе KeePass. Сама софтина с открытым исходным кодом, есть офлайновые десктопные и мобильные версии, без всяких облаков или онлайн-сервисов. Для шифрования базы паролей используются одновременно алгоритмы AES-256 и Twofish: первый сертифицирован АНБ для использования Госдепом США, второй — один из самых замороченных алгоритмов шифрования в принципе.
Для параноиков есть различные варианты хранения базы данных: холодное хранение, распределение прав доступа, защита от записи, логирование всех действий внутри программы, вход в ложные базы по определенному паролю. В плане доступа есть двухфакторная аутентификация, в том числе по брелоку генерации кодов или датчику отпечатка пальца.
6 приемов, которые помогут легко запоминать пароли и пины
Nikita S
доволен функциями
Использую KeePassX. Когда паролей стало много, оценил удобство использования. Удобно, что в списке не нужно заходить непосредственно в учетку, по Ctrl + B копируется логин, по Ctrl + С — пароль и вставляется куда надо.
Dmitry Chusovitin
перечислил плюсы и минусы
Пользуюсь Bitwarden больше двух лет, все отлично работает, гораздо лучше, чем все схожие сервисы.
Из плюсов:
- есть дополнительные, альтернативные клиенты;
- можно поднять собственный сервер, если очень надо;
- есть генератор 2FA-кодов в платной подписке.
Хотя есть и небольшие минусы — скорее особенности, не очень влияющие на качество:
- нужна платная подписка для генерации 2FA-кодов.
 Может быть проблемой, если нет возможности оплатить, хотя можно криптой;
Может быть проблемой, если нет возможности оплатить, хотя можно криптой; - прикрепленные файлы хранятся только на сервере и в бэкап не попадают;
- кривая система автозаполнения на Android, хотя это относится только к самому Android. Bitwarden не виноват.
/list/unblock-the-phone/
Как разблокировать телефон, если вы забыли пароль, пин или графический ключ
поделился лайфхаком
Пользуюсь приложением Dashlane на Android уже года три. Очень удобно, избавляет от необходимости запоминать пароли, которых у меня хоть отбавляй.
Крайне советую установить четырехзначный код для входа в приложение, иначе придется вместо этого каждый раз вводить очень длинный пароль аккаунта.
Roman Belyaev
приобрел ключ безопасности
Использую LastPass и YubiKey 5 на связке ключей к нему. По итогу получаю самую безопасную двухфакторную аутентификацию на текущий момент и сплю спокойно.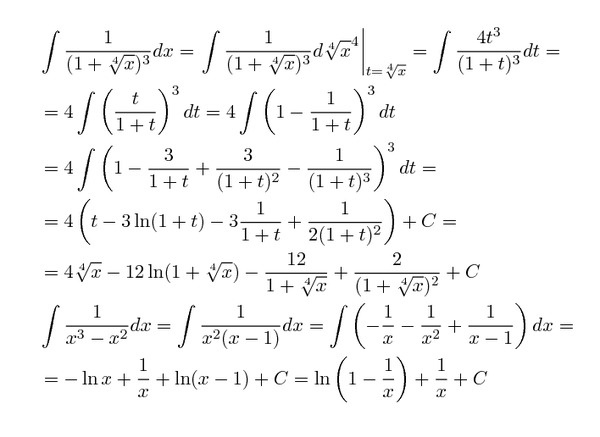
Дмитрий Кузнецов
отказался от расширения браузера
Раньше хранил в расширении к браузеру LastPass, потом услышал, что его несколько раз… В общем, ненадежен оказался, а в плане удобства — 10 баллов.
Неделю назад спросил у своего админа, что посоветует. Он ответил, что пользуется KeePass. Поставил, пользуюсь — норм. Интерфейс немного устарелый, но в целом сойдет.
/bezopasnost-uchebnik/
Курс: как защититься от мошенников
Egor Mokeev
купил безлимит в приложении
Использую Enpass. Купил безлимит еще до того, как они перешли на модель подписки. Симпатичный дизайн, есть поддержка, главное, что не сервис. Пароли хранятся только на клиентах, синхронизируются с помощью облака — у меня через «Яндекс-диск».
Способ № 3
🌐 Сохранять пароли в браузере Денис Леонов
использует двухэтапную аутентификацию
Один мастер-пароль от ключевой электронной почты — в голове, ведь это единственное надежное место. А остальное, с поправкой на двухэтапную аутентификацию, как мне кажется, можно доверить браузеру, периодически проверяя базы данных на предмет обнаружения утечек: сейчас даже браузеры это делают. Хранить «секретную» информацию на незащищенном носителе — это так себе занятие.
А остальное, с поправкой на двухэтапную аутентификацию, как мне кажется, можно доверить браузеру, периодически проверяя базы данных на предмет обнаружения утечек: сейчас даже браузеры это делают. Хранить «секретную» информацию на незащищенном носителе — это так себе занятие.
Даниил Попов
хранит пароли в браузере
Пароль уровня qwerty для всякой шляпы типа торрент-сайтов или форумов, пароли Steam, Windows — в блокнотике, их проще посмотреть, чем восстанавливать. Пароль от «Гугл-почты» помню наизусть. Часть паролей запомнена в аккаунте браузера. Ну и много где логин по аккаунту соцсети или «Гугла».
Способ № 4
🛡 Применять вариации одного пароля Евгений Логвиненко
поделился уникальным способом
Рассказываю лайфхак, который я прочитал в методичке по безопасности от какого-то криптоэнтузиаста.
У вас каждый пароль должен быть максимально надежным и длинным. Помнить его не обязательно, достаточно фиксировать в менеджере паролей.
Пример. Что хранится в менеджере паролей: 12345, 54321, 88996. Секретная часть у нас в голове: skazka. Реальные пароли от сайта: 12345skazka, 54321skazka, 88996skazka.
/qwerty/
Как правильно: надежный пароль
Таким образом, даже при полной утечке всех паролей из менеджера паролей вы остаетесь в полной безопасности.
Ну и для дополнительной защиты рекомендую пароль от основной почты, которую вы указываете при всех регистрациях, хранить тоже только у вас в голове. Ведь если получить доступ к почте, можно восстановить пароль от любого другого приложения.
Валерия Сиротина
благодарна «Игромании»
Лет 15 у меня один пароль — длинное слово с разным регистром и цифрой. Допустим, Zhopo4kA. И на каждом сайте я добавляю к концу этого слова первые три буквы адреса сайта. Например, Zhopo4kAvko, Zhopo4kAins и так далее.
Допустим, Zhopo4kA. И на каждом сайте я добавляю к концу этого слова первые три буквы адреса сайта. Например, Zhopo4kAvko, Zhopo4kAins и так далее.
Никогда не подводил, ни разу не забыла. Увидела этот гениальный способ в журнале «Игромания».
Способ № 5
🔒 Сгенерировать через карту паролей Viktor Platonov
не доверяет популярным способам хранения паролей
Приложения — это дыры, фактически отдаешь пароли кому попало. Записывать — так себе. Пока что парольная карта — это единственный сколь-либо защищенный способ хранения паролей.
3-8
Обратите внимание, что в этом посте мы рассмотрим дифференцирование ln(x 2 ), которое равно , а не , то же самое, что и дифференцирование ln 2 (x) или ln(2x).
. Существует два метода, которые можно использовать для вычисления производной ln(x 2 ).
Первый метод заключается в использовании цепного правила для производных.
Второй метод заключается в использовании свойств журналов для записи ln(x 2 ) в форму, которая дифференцируема без необходимости использования цепного правила.
Нахождение производной от ln(x
2 ) с использованием цепного правила выражение, которое также можно было бы дифференцировать, если бы оно стояло само по себе.В этом случае:
- Мы знаем, как дифференцировать x 2 (ответ 2x)
- Мы знаем, как дифференцировать ln(x) (ответ 1/x)
Это означает, что цепное правило позволит нам провести дифференцирование функции ln(x 2 ).
Чтобы выполнить дифференцирование, цепное правило говорит, что мы должны дифференцировать выражение, как если бы оно было выражено только в терминах x, если мы затем умножаем этот результат на производную того, чем на самом деле выражено выражение (в данном случае производная x 2 ). 2)
2)
ln(x 2 ) имеет форму стандартной функции натурального логарифма ln(x), за исключением того, что в качестве аргумента не используется x, а вместо этого используется другая функция от x (x 2 ).
Назовем функцию в аргументе g(x), что означает:
g(x) = x 2
Отсюда следует, что:
ln(x 2 ) = ln(g( x))
Итак, если функция f(x) = ln(x) и функция g(x) = x 2 , то функция ln(x 2 ) можно записать как составную функцию.
f(x) = ln(x)
f(g(x)) = ln(g(x)) (но g(x) = x 2 )
f(g(x)) = ln(x 2 )
Определим эту составную функцию как F(x):
F(x) = f(g(x)) = ln(x 2 )
Мы можем найти производную из ln(x 2 ) (F'(x)) с использованием цепного правила.
Цепное правило:
Для двух дифференцируемых функций f(x) и g(x)
Если F(x) = f(g(x))
Тогда производная F(x) равна F'(x) = f'(g(x)). g'(x)
g'(x)
Теперь мы можем просто подставить f(x) и g(x) в цепное правило. Но прежде чем мы это сделаем, просто вспомним производную натурального логарифма.
Производная ln(x) по x равна (1/x)
Производная ln(s) по s равна (1/s)
Аналогичным образом производная ln(x 2 ) относительно x 2 (1/х 2 ).
Мы будем использовать этот факт как часть цепного правила, чтобы найти производную ln(x 2 ) относительно x .
Как найти производную от ln(x 2 ) с помощью цепного правила: Определение правила цепи0930
(The derivative of ln(x 2 ) with respect to x 2 is (1/x 2 ))
Используя цепное правило, мы находим, что производная от ln(x 2 ) равна 2/x
. производная согласно приведенным выше расчетам). Просто имейте в виду, что не все приведенные ниже формы математически правильны. 92 = 2/x
производная согласно приведенным выше расчетам). Просто имейте в виду, что не все приведенные ниже формы математически правильны. 92 = 2/x
Нахождение производной от ln(x
2 ) с использованием свойств логарифмаПоскольку ln — натуральный логарифм, применяются обычные свойства логарифма.
Свойство мощности журналов утверждает, что ln(x y ) = y.ln(x). Другими словами, возведение логарифма х в степень равносильно умножению логарифма х на эту степень.
Таким образом, мы можем использовать правило степеней журналов, чтобы переписать ln(x 2 ) как: производная от ln(x 2 ) с использованием степенной логарифмической формулы
| f(x) | = 2ln(x) | |
| f'(x) 90 (10004 90/05) | x) | Производная от ln(x) равна 1/x |
| = 2/x |
Вторая производная от ln(x
2 ) Чтобы вычислить вторую производную функции, нужно просто продифференцировать первую производную.
Исходя из вышеприведенного, мы нашли, что первая производная от ln(x 2 ) = 2/x. Таким образом, чтобы найти вторую производную от ln(x 2 ), нам просто нужно продифференцировать 2/x
. Если мы продифференцируем 2/x, мы получим ответ (-2/x 2 ).
► Вторая производная ln(x 2 ) = -2/х 2
Опубликовано в Естественные логарифмические функцииОпубликовано DerivativeIt
Просмотреть все сообщения DerivativeIt
Белки LNX1/LNX2: функции в передаче сигналов нейронами и не только | Нейрональная сигнализация
Пропустить пункт назначения
Обзорная статья| 07 июня 2018 г.
Пол В. Янг
Нейронный сигнал (2018) 2 (2): NS20170191.
https://doi.org/10.1042/NS20170191
История статьи
Received:
April 02 2018
Revision Received:
May 02 2018
Accepted:
May 08 2018
Accepted Manuscript online:
May 08 2018
- Разделенный экран
- Просмотры
- Содержание артикула
- Рисунки и таблицы
- Видео
- Аудио
- Дополнительные данные
- Экспертная оценка
- PDF ПДФ+СИ
- Делиться
- MailTo
- Твиттер
Иконка Цитировать Цитировать
Получить разрешения
Цитата
Пол В. Янг; Белки LNX1/LNX2: функции в передаче сигналов нейронов и не только. Нейрональный сигнал 29 июня 2018 г.; 2 (2): NS20170191. doi: https://doi.org/10.1042/NS20170191
Янг; Белки LNX1/LNX2: функции в передаче сигналов нейронов и не только. Нейрональный сигнал 29 июня 2018 г.; 2 (2): NS20170191. doi: https://doi.org/10.1042/NS20170191
Скачать файл цитирования:
- Рис (Зотеро)
- Менеджер ссылок
- EasyBib
- Подставки для книг
- Менделей
- Бумаги
- Конечная примечание
- РефВоркс
- Бибтекс
Расширенный поиск
Лиганд белков NUMB X1 и X2 (LNX1 и LNX2) представляет собой убиквитинлигазы E3, названные в честь их способности взаимодействовать с определяющим судьбу клетки белком NUMB и способствовать его деградации. На этом основании считается, что они играют роль в модуляции передачи сигналов NUMB/NOTCH во время таких процессов, как корковый нейрогенез. Однако белки LNX1/2 могут связываться через свои четыре PDZ (PSD95, DLGA, ZO-1), к чрезвычайно большому количеству других белков, помимо NUMB.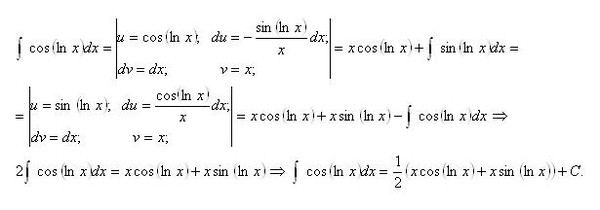 Многие из этих взаимодействий указывают на дополнительную роль белков LNX1/2 в нервной системе в таких областях, как формирование синапсов, нейротрансмиссия и регуляция функции нейроглии. Спустя двадцать лет после их первоначального открытия я обсуждаю здесь предполагаемые нейронные функции белков LNX1/2 в свете связанного с тревогой фенотипа мышей с двойным нокаутом, лишенных LNX1 и LNX2 в центральной нервной системе (ЦНС). Я также рассматриваю то, что известно о не-нейрональных ролях белков LNX1/2, включая их роль в формировании эмбрионального паттерна и развитии поджелудочной железы у рыбок данио и их возможное участие в колоректальном раке (CRC), дифференцировке остеокластов и иммунной функции у млекопитающих. Возникающая картина показывает, что белки LNX1/2 являются потенциальными регуляторами множественных клеточных сигнальных процессов, но во многих случаях физиологическое значение таких ролей подтверждается лишь частично и должно рассматриваться в контексте жесткого контроля уровней белков LNX1/2 в естественных условиях .
Многие из этих взаимодействий указывают на дополнительную роль белков LNX1/2 в нервной системе в таких областях, как формирование синапсов, нейротрансмиссия и регуляция функции нейроглии. Спустя двадцать лет после их первоначального открытия я обсуждаю здесь предполагаемые нейронные функции белков LNX1/2 в свете связанного с тревогой фенотипа мышей с двойным нокаутом, лишенных LNX1 и LNX2 в центральной нервной системе (ЦНС). Я также рассматриваю то, что известно о не-нейрональных ролях белков LNX1/2, включая их роль в формировании эмбрионального паттерна и развитии поджелудочной железы у рыбок данио и их возможное участие в колоректальном раке (CRC), дифференцировке остеокластов и иммунной функции у млекопитающих. Возникающая картина показывает, что белки LNX1/2 являются потенциальными регуляторами множественных клеточных сигнальных процессов, но во многих случаях физиологическое значение таких ролей подтверждается лишь частично и должно рассматриваться в контексте жесткого контроля уровней белков LNX1/2 в естественных условиях .
Ключевые слова:
LNX, сигнальный путь Notch, нейрогенез, Онемевший, убиквитинлигазы
Субъекты:
Рак, Молекулярные взаимодействия, неврология, Signaling
Семейство белков LNX (лиганд NUMB Protein-X) произошло от общего предкового белка, который содержал домен RING (действительно интересный новый ген) и четыре PDZ (PSD9).5, DLGA, ZO-1) [1]. RING-домены являются наиболее распространенным типом каталитических доменов, обнаруженных в убиквитинлигазах E3 [2]. Эти ферменты катализируют окончательное присоединение убиквитина к белку-субстрату во время убиквитинирования белка, процесс, в котором также участвуют ферменты Е1 (убиквитин-активирующий) и Е2 (убиквитин-конъюгирующий). Домены PDZ опосредуют белок-белковые взаимодействия, обычно путем связывания с мотивами карбоксильных концевых последовательностей их партнеров по взаимодействию. Комбинация доменов RING и PDZ в одном полипептиде уникальна для белков LNX и отражена в альтернативном названии этого семейства: PDZRN (от PDZ и RING). LNX1 и LNX2 млекопитающих были названы за их способность взаимодействовать с NUMB и сохранили предковую структуру RING плюс четыре домена PDZ [3]. LNX3, -4 и -5 (чаще называемые PDZRN3, PDZRN4 и PDZK4/PDZRN4L соответственно) имеют только один или два домена PDZ, имеют общий уникальный домен гомологии LNX3 и, как известно, не взаимодействуют с NUMB [1]. Таким образом, хотя LNX1/LNX2 и PDZRN3/PDZRN4/PDZK4 представляют собой две ветви одного и того же семейства белков, они, вероятно, значительно отличаются друг от друга в функциональном плане. Основное внимание в этом обзоре уделяется LNX1 и LNX2 млекопитающих, а также родственному белку LNX2b, который обнаруживается у позвоночных, отличных от плацентарных млекопитающих. Двадцать лет спустя после клонирования Lnx1 McGlade et al., этот фокус позволяет мне всесторонне обобщить опубликованную литературу об этих интригующих, но не до конца изученных белках [3].
Комбинация доменов RING и PDZ в одном полипептиде уникальна для белков LNX и отражена в альтернативном названии этого семейства: PDZRN (от PDZ и RING). LNX1 и LNX2 млекопитающих были названы за их способность взаимодействовать с NUMB и сохранили предковую структуру RING плюс четыре домена PDZ [3]. LNX3, -4 и -5 (чаще называемые PDZRN3, PDZRN4 и PDZK4/PDZRN4L соответственно) имеют только один или два домена PDZ, имеют общий уникальный домен гомологии LNX3 и, как известно, не взаимодействуют с NUMB [1]. Таким образом, хотя LNX1/LNX2 и PDZRN3/PDZRN4/PDZK4 представляют собой две ветви одного и того же семейства белков, они, вероятно, значительно отличаются друг от друга в функциональном плане. Основное внимание в этом обзоре уделяется LNX1 и LNX2 млекопитающих, а также родственному белку LNX2b, который обнаруживается у позвоночных, отличных от плацентарных млекопитающих. Двадцать лет спустя после клонирования Lnx1 McGlade et al., этот фокус позволяет мне всесторонне обобщить опубликованную литературу об этих интригующих, но не до конца изученных белках [3].
Белки LNX1, -2 и -2b позвоночных имеют доменную архитектуру, включающую аминоконцевой домен RING, окруженный с каждой стороны мотивами цинковых пальцев (ZnF), NUMB-связывающий мотив NPAY/F, четыре домена PDZ и карбоксильный концевой PDZ связывающий мотив [3–6] (рис. 1). Множественное выравнивание последовательностей белков LNX1, LNX2 и LNX2b мыши и рыбок данио, указывающее расположение белковых доменов и мотивов, представлено в качестве дополнительных данных (дополнительная фигура S1). Пориферан Amphimedon queenslandica имеет ортолог LNX1/2, который имеет ту же организацию домена, за исключением отсутствия мотива NPAY/F [1]. Существование этого губчатого ортолога в самой базовой линии многоклеточных животных указывает на раннее многоклеточное происхождение LNX1/LNX2-подобного белка. PDZ-домены LNX1/2 тесно связаны с четырьмя карбоксильными концевыми доменами из нескольких доменов PDZ, содержащих белок-1 (MUPP1), и эти белки, вероятно, имели общего предка. Действительно, LNX1 и LNX2 млекопитающих взаимодействуют с некоторыми из тех же лигандов, что и MUPP1, что указывает на возможное сохранение специфичности связывания [1].
Close modal
LNX1/2 -подобный ген присутствует в некоторых, но не во всех линиях беспозвоночных [1]. Например, виды Platyhelminthes и Mollusca имеют явных ортологов LNX1/2 , а виды Nematoda и Arthropoda — нет. Это указывает на то, что белки LNX1/2 не являются необходимыми для всех линий беспозвоночных. В линии позвоночных дупликация предкового LNX1/2 -подобного гена дала начало LNX1, LNX2 и LNX2b 909:30 . Эти три гена, по-видимому, сохраняются во всех линиях позвоночных, за исключением потери LNX2b у плацентарных млекопитающих. Эта потеря LNX2b весьма интересна тем, что псевдоген LNX2b внес несколько экзонов в некодирующую Xist РНК, которые контролируют инактивацию Х-хромосомы у плацентарных млекопитающих [7].
Эти три гена, по-видимому, сохраняются во всех линиях позвоночных, за исключением потери LNX2b у плацентарных млекопитающих. Эта потеря LNX2b весьма интересна тем, что псевдоген LNX2b внес несколько экзонов в некодирующую Xist РНК, которые контролируют инактивацию Х-хромосомы у плацентарных млекопитающих [7].
Поддержание по крайней мере двух LNX1/2 -подобных генов во всех линиях позвоночных предполагает приобретение основных специфических для позвоночных функций. Интересно, что белки LNX1/2 позвоночных имеют либо NPAY (LNX1), либо NPAF (LNX2, LNX2b) NUMB-связывающий мотив, тогда как у белков беспозвоночных этот мотив отсутствует [1]. Таким образом, можно предположить, что способность взаимодействовать с NUMB и регулировать его представляет собой важную функцию, лежащую в основе присутствия LNX1/2 ортологи у всех позвоночных. С другой стороны, это же наблюдение говорит нам о том, что предковый белок LNX1/2, вероятно, эволюционировал для выполнения клеточных функций, не связанных с взаимодействием с NUMB. Кажется вероятным, что белки LNX1/2 позвоночных также сохраняют некоторые из этих функций. Таким образом, важный урок из изучения истории эволюции белков LNX1/2 заключается в том, что, несмотря на их название, их не следует рассматривать как «пони с одним трюком» и, вероятно, они обладают значительными функциями, независимыми от их регуляции передачи сигналов NOTCH посредством NUMB.
Кажется вероятным, что белки LNX1/2 позвоночных также сохраняют некоторые из этих функций. Таким образом, важный урок из изучения истории эволюции белков LNX1/2 заключается в том, что, несмотря на их название, их не следует рассматривать как «пони с одним трюком» и, вероятно, они обладают значительными функциями, независимыми от их регуляции передачи сигналов NOTCH посредством NUMB.
 Вместе эти данные указывают на то, что амино-конец ZnF с незакрашенным кольцом по отношению к домену RING характерен для белков LNX1/LNX2 и имеет функциональное значение.
Вместе эти данные указывают на то, что амино-конец ZnF с незакрашенным кольцом по отношению к домену RING характерен для белков LNX1/LNX2 и имеет функциональное значение. Использование аутоубиквитинирования LNX2 в качестве показателя активности убиквитинлигазы E3 Nayak и Sivaraman [4] увидели, что UbcH5b является предпочтительным убиквитин-конъюгирующим ферментом E2 для LNX2 (как было показано для LNX1 [9–11]). Интересно, что образование всех семи форм цепных связей убиквитина может быть катализировано LNX2/UbcH5b в in vitro анализах убиквитинирования. Они также впервые показали, что LNX2 действительно может убиквитинировать NUMB, что ранее было показано только для LNX1. Автоубиквитинирование LNX2 уменьшало, но не отменяло эту активность. Еще один вывод их исследования заключался в том, что конструкция ZnF-RING-ZnF LNX2 присутствовала в виде димера как в кристаллической структуре, так и в растворе. Однако димеризация не требовалась для аутоубиквитинирующей активности LNX2.
Определив структуру домена RING LNX2 с фланкирующими мотивами ZnF, Наяк и Сивараман [5] недавно предприняли дальнейший шаг к выяснению подробного каталитического механизма белков LNX1/2 путем решения структуры домена ZnF-RING LNX1. Область -ZnF в комплексе с убиквитин-нагруженным Ubc13. Было показано, что Ubc13 действует как убиквитин-конъюгирующий фермент E2 для LNX1, который способствует образованию K63-связанных полиубиквитиновых цепей — первая демонстрация белков LNX1/2, использующих убиквитин-конъюгирующий фермент E2, отличный от UbcH5b. Структура LNX1 в комплексе с Ubc13, конъюгированным с убиквитином, показала, что оба мотива ZnF в LNX1 участвуют в формировании контактов с Ubc13 и оба необходимы для каталитической активности LNX1. Это контрастирует с LNX2, в котором амино, но не карбоксильный концевой ZnF необходим для активности [4]. Как и LNX2, область ZnF-RING-ZnF LNX1 является димерной, и структура показывает, как димеризация LNX1 стабилизирует закрытую конформацию фермента, конъюгирующего убиквитин E2, и убиквитина, который, как считается, усиливает перенос убиквитина на субстраты. Вместе эти два исследования Наяка и Сиварамана [4,5] выявили уникальные особенности каталитических механизмов белков LNX1/2. Основываясь на этих выводах, будущие исследования LNX1/2-опосредованного убиквитинирования в клеточных контекстах должны будут тщательно рассмотреть тип цепных связей убиквитина, которые связаны с данным субстратом LNX1/2, конкретный убиквитин-конъюгирующий фермент E2, который участвует, и роли аутоубиквитинирования и димеризации в регуляции активности убиквитинлигазы и узнавании субстрата.
Вместе эти два исследования Наяка и Сиварамана [4,5] выявили уникальные особенности каталитических механизмов белков LNX1/2. Основываясь на этих выводах, будущие исследования LNX1/2-опосредованного убиквитинирования в клеточных контекстах должны будут тщательно рассмотреть тип цепных связей убиквитина, которые связаны с данным субстратом LNX1/2, конкретный убиквитин-конъюгирующий фермент E2, который участвует, и роли аутоубиквитинирования и димеризации в регуляции активности убиквитинлигазы и узнавании субстрата.
В ряде исследований изучалась общая специфичность связывания и потенциальные внутри- и межмолекулярные взаимодействия белков LNX1/2 через их домены PDZ. Эти исследования описаны в этом разделе, тогда как отдельные PDZ-опосредованные взаимодействия с другими белками обсуждаются позже.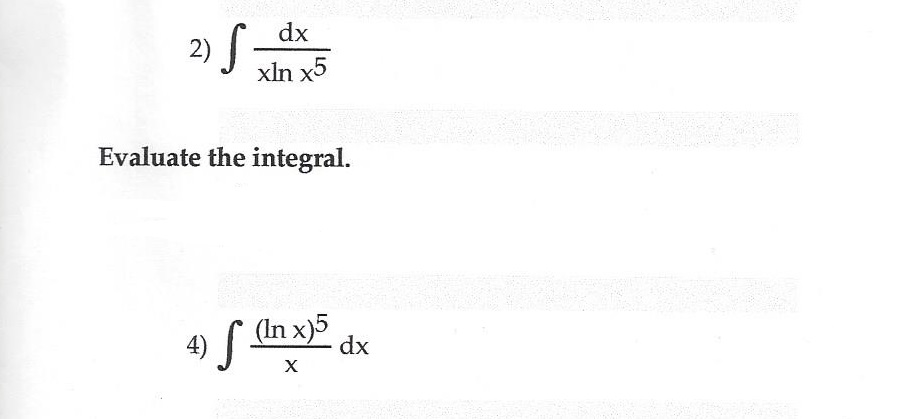 Гао и др. изучили консенсусные свойства связывания PDZ-доменов LNX1 и LNX2 млекопитающих посредством двухгибридного скрининга дрожжевых библиотек случайных карбоксильных концевых пептидов, что затем позволило им идентифицировать и проверить белки-кандидаты, взаимодействующие [9].,15]. Специфичность связывания доменов PDZ с карбоксиконцевыми последовательностями можно разделить на четыре класса на основе последних четырех аминокислот связывающих пептидов [16]. LNX1 PDZ1 соответствует консенсусу для доменов PDZ класса I, -x-[Ser/Thr]-x-Φ* (где x — любая аминокислота, а Φ — гидрофобный остаток) [9]. Интересно, что как LNX1, так и LNX2 имеют карбоксильные концевые мотивы (-Gly-Thr-Phe-Leu* и -Gly-Ser-Leu-Val* соответственно), которые соответствуют этому консенсусу (рис. 1). Действительно, карбоксильные концевые 33 аминокислоты LNX2 могут связываться с LNX1 и LNX2 [6] и с обоими LNX1 [9].] и LNX2 [6], это карбоксиконцевое взаимодействие было сопоставлено с PDZ1. LNX1 PDZ1 также может взаимодействовать с конструкциями, кодирующими PDZ4 и карбоксильный конец как LNX1, так и LNX2, хотя опосредовано ли это взаимодействие связыванием PDZ1 с карбоксиконцевыми последовательностями LNX1/2 или взаимодействием PDZ-PDZ, окончательно не установлено [3].
Гао и др. изучили консенсусные свойства связывания PDZ-доменов LNX1 и LNX2 млекопитающих посредством двухгибридного скрининга дрожжевых библиотек случайных карбоксильных концевых пептидов, что затем позволило им идентифицировать и проверить белки-кандидаты, взаимодействующие [9].,15]. Специфичность связывания доменов PDZ с карбоксиконцевыми последовательностями можно разделить на четыре класса на основе последних четырех аминокислот связывающих пептидов [16]. LNX1 PDZ1 соответствует консенсусу для доменов PDZ класса I, -x-[Ser/Thr]-x-Φ* (где x — любая аминокислота, а Φ — гидрофобный остаток) [9]. Интересно, что как LNX1, так и LNX2 имеют карбоксильные концевые мотивы (-Gly-Thr-Phe-Leu* и -Gly-Ser-Leu-Val* соответственно), которые соответствуют этому консенсусу (рис. 1). Действительно, карбоксильные концевые 33 аминокислоты LNX2 могут связываться с LNX1 и LNX2 [6] и с обоими LNX1 [9].] и LNX2 [6], это карбоксиконцевое взаимодействие было сопоставлено с PDZ1. LNX1 PDZ1 также может взаимодействовать с конструкциями, кодирующими PDZ4 и карбоксильный конец как LNX1, так и LNX2, хотя опосредовано ли это взаимодействие связыванием PDZ1 с карбоксиконцевыми последовательностями LNX1/2 или взаимодействием PDZ-PDZ, окончательно не установлено [3]. 9]. Фактически, последующее исследование показало, что LNX2 PDZ1 может связываться с мотивами внутренней последовательности [17], и считается, что LNX1 PDZ1 связывает внутреннюю последовательность в домене NUMB PTB (связывание фосфотирозина) [10]. Т.о., вопрос о том, действительно ли взаимодействия доменов LNX1 и LNX2 PDZ1 затрагивают карбоксильный конец др. белков, нуждается в тщательном изучении. В любом случае, независимо от точного способа связывания, вышеупомянутые взаимодействия LNX-LNX могут: (i) позволить LNX1 и LNX2 образовывать гомо- и гетеродимеры или (ii) привести к образованию карбоксиконцевого конца индивидуального LNX1/2. белок сворачивается назад, чтобы взаимодействовать со своим первым доменом PDZ, в зависимости от того, происходят ли они меж- или внутримолекулярно.
9]. Фактически, последующее исследование показало, что LNX2 PDZ1 может связываться с мотивами внутренней последовательности [17], и считается, что LNX1 PDZ1 связывает внутреннюю последовательность в домене NUMB PTB (связывание фосфотирозина) [10]. Т.о., вопрос о том, действительно ли взаимодействия доменов LNX1 и LNX2 PDZ1 затрагивают карбоксильный конец др. белков, нуждается в тщательном изучении. В любом случае, независимо от точного способа связывания, вышеупомянутые взаимодействия LNX-LNX могут: (i) позволить LNX1 и LNX2 образовывать гомо- и гетеродимеры или (ii) привести к образованию карбоксиконцевого конца индивидуального LNX1/2. белок сворачивается назад, чтобы взаимодействовать со своим первым доменом PDZ, в зависимости от того, происходят ли они меж- или внутримолекулярно.
В отличие от PDZ1, LNX1 PDZ2 и PDZ3, а также LNX2 PDZ2 способны связывать пептиды, принадлежащие к нескольким классам мотивов связывания PDZ (класс I и II ± класс III) [9]. Эта широкая специфичность может объяснить, почему большинство лигандов LNX1/2, идентифицированных в литературе на сегодняшний день, связываются с этими доменами PDZ. Для LNX2 PDZ1 и PDZ3 не удалось определить четкую консенсусную специфичность связывания последовательностей карбоксильных концевых пептидов, и не было идентифицировано ни одного пептида, связывающегося с PDZ4 ни из LNX1, ни из LNX2 [9].]. Таким образом, только для PDZ2 были определены консенсусные связывающие последовательности как для LNX1, так и для LNX2. Интересно, что хотя специфичность связывания PDZ2 из двух белков LNX1/2 млекопитающих перекрывается, она не идентична. Консенсусная последовательность: -x—x-Ψ-[Val/Ile/Leu/Cys]* для LNX1 PDZ2 по сравнению с -Φ—[Val/Ile/Leu/Ser/Thr]-[Val/Ile/Leu]-[ Val/Ile/Leu]* для LNX2 PDZ2 (где Ψ — ароматический остаток). Это указывает на возможность дифференциального связывания LNX1 и LNX2 с определенными лигандами. Действительно, впоследствии это было показано в протеомных исследованиях, в которых было отмечено предпочтительное связывание LNX1 PDZ2 с лигандами, в частности с карбоксильными концевыми остатками цистеина [13,14,18]. Такие LNX1- или LNX2-специфические взаимодействия могут лежать в основе специализированных функций паралогов LNX1/2 у позвоночных.
Для LNX2 PDZ1 и PDZ3 не удалось определить четкую консенсусную специфичность связывания последовательностей карбоксильных концевых пептидов, и не было идентифицировано ни одного пептида, связывающегося с PDZ4 ни из LNX1, ни из LNX2 [9].]. Таким образом, только для PDZ2 были определены консенсусные связывающие последовательности как для LNX1, так и для LNX2. Интересно, что хотя специфичность связывания PDZ2 из двух белков LNX1/2 млекопитающих перекрывается, она не идентична. Консенсусная последовательность: -x—x-Ψ-[Val/Ile/Leu/Cys]* для LNX1 PDZ2 по сравнению с -Φ—[Val/Ile/Leu/Ser/Thr]-[Val/Ile/Leu]-[ Val/Ile/Leu]* для LNX2 PDZ2 (где Ψ — ароматический остаток). Это указывает на возможность дифференциального связывания LNX1 и LNX2 с определенными лигандами. Действительно, впоследствии это было показано в протеомных исследованиях, в которых было отмечено предпочтительное связывание LNX1 PDZ2 с лигандами, в частности с карбоксильными концевыми остатками цистеина [13,14,18]. Такие LNX1- или LNX2-специфические взаимодействия могут лежать в основе специализированных функций паралогов LNX1/2 у позвоночных.
Тот факт, что двухгибридные скрининги дрожжей не смогли идентифицировать какие-либо пептиды, которые связываются с PDZ4 из LNX1 или LNX2 [9], заслуживает внимания, и, насколько нам известно, в литературе имеется только одно сообщение о белках, связывающихся с LNX1/2 PDZ4. домены [18]. Недостаток белков, взаимодействующих с PDZ4, можно объяснить обнаружением того, что этот домен PDZ, по крайней мере, в LNX1, может связываться с фосфолипидами [18]. Это связывание было специфичным для фосфатидилинозитолфосфатных липидов по сравнению с другими распространенными мембранными липидами. Таким образом, LNX1 PDZ4 и, возможно, LNX2 PDZ4 могут взаимодействовать в первую очередь с липидами, а не с белками, и потенциально могут играть роль в локализации белков LNX1/2 в специфических областях мембраны в клетках, хотя в настоящее время это остается спекулятивным.
Хотя мы многое узнали из изучения отдельных доменов LNX1/2, структура полноразмерного белка LNX1/2 теперь будет чрезвычайно информативной. Такая структура должна разрешить природу PDZ1-опосредованных внутри- и/или межмолекулярных взаимодействий белков LNX1/2. Мы также надеемся, что это покажет, как трехмерное расположение доменов PDZ в полноразмерном белке LNX1/2 может ориентировать лиганды специфических доменов PDZ в качестве потенциальных субстратов для убиквитинирования доменом ZnF-RING-ZnF.
Такая структура должна разрешить природу PDZ1-опосредованных внутри- и/или межмолекулярных взаимодействий белков LNX1/2. Мы также надеемся, что это покажет, как трехмерное расположение доменов PDZ в полноразмерном белке LNX1/2 может ориентировать лиганды специфических доменов PDZ в качестве потенциальных субстратов для убиквитинирования доменом ZnF-RING-ZnF.
» data-legacyid=»sec4-1″> LNX1/2 Экспрессия мРНК
В этом разделе я сосредоточусь на млекопитающих LNX1 и LNX2 , экспрессия lnx2b у рыбок данио обсуждается отдельно ниже. Нозерн-блот-анализ выявил экспрессию мышиной Lnx1 мРНК в сердце, головном мозге, легких, скелетных мышцах и почках взрослого человека с небольшим сообщением или его отсутствием в селезенке, печени и яичках [3]. Человеческая мРНК LNX1 была также обнаружена в сердце, мозге и почках взрослых, а также в плаценте и поджелудочной железе, тогда как гораздо более низкие уровни были обнаружены в легких, печени и скелетных мышцах [19]. ]. Таким образом, мРНК Lnx1 , по-видимому, экспрессируется во многих тканях взрослого организма. Примечательно, что и эти, и последующие исследования [20] показали, что разные транскрипты Lnx1 экспрессируются в головном и спинном мозге по сравнению с другими тканями. Предполагается, что эти транскрипты будут давать белки массой 70 и 62 кДа, в которых отсутствует домен ZnF-RING-ZnF, присутствующий в белке массой 80 кДа, который экспрессируется в других тканях (рис. 1 и дополнительная фигура S1). Райс и др. [6] показали, что Lnx2 мРНК также широко экспрессируется в тканях взрослых мышей, и исследовали эмбриональную экспрессию как Lnx1, так и Lnx2 мРНК с помощью гибридизации in situ . На E11.5 Lnx2 , но не Lnx1 , экспрессировался в нейроэпителии развивающегося переднего мозга. У эмбрионов E14.5 Lnx2 сильно экспрессируется в переднем мозге и во многих других областях развивающегося эмбриона, в то время как экспрессия Lnx1 ограничена головным и спинным мозгом на этой стадии.
]. Таким образом, мРНК Lnx1 , по-видимому, экспрессируется во многих тканях взрослого организма. Примечательно, что и эти, и последующие исследования [20] показали, что разные транскрипты Lnx1 экспрессируются в головном и спинном мозге по сравнению с другими тканями. Предполагается, что эти транскрипты будут давать белки массой 70 и 62 кДа, в которых отсутствует домен ZnF-RING-ZnF, присутствующий в белке массой 80 кДа, который экспрессируется в других тканях (рис. 1 и дополнительная фигура S1). Райс и др. [6] показали, что Lnx2 мРНК также широко экспрессируется в тканях взрослых мышей, и исследовали эмбриональную экспрессию как Lnx1, так и Lnx2 мРНК с помощью гибридизации in situ . На E11.5 Lnx2 , но не Lnx1 , экспрессировался в нейроэпителии развивающегося переднего мозга. У эмбрионов E14.5 Lnx2 сильно экспрессируется в переднем мозге и во многих других областях развивающегося эмбриона, в то время как экспрессия Lnx1 ограничена головным и спинным мозгом на этой стадии. Оба 9Экспрессия мРНК 0921 Lnx1 и Lnx2 сохраняется в головном мозге после рождения, при этом экспрессия Lnx2 особенно заметна в мозжечке [6]. Было показано, что экспрессия Lnx1 и Lnx2 в мозге мышей преимущественно нейрональная, хотя некоторая экспрессия в олигодендроцитах наблюдалась в мозжечке [20]. В целом эти исследования показывают, что обе мРНК Lnx1 и Lnx2 довольно широко экспрессируются постнатально, причем самая ранняя эмбриональная экспрессия обоих генов происходит в ЦНС. Эта ранняя экспрессия в эмбриональном головном и спинном мозге намекает на потенциальные функции в развитии нервной системы, возможно, посредством регуляции белков NUMB.
Оба 9Экспрессия мРНК 0921 Lnx1 и Lnx2 сохраняется в головном мозге после рождения, при этом экспрессия Lnx2 особенно заметна в мозжечке [6]. Было показано, что экспрессия Lnx1 и Lnx2 в мозге мышей преимущественно нейрональная, хотя некоторая экспрессия в олигодендроцитах наблюдалась в мозжечке [20]. В целом эти исследования показывают, что обе мРНК Lnx1 и Lnx2 довольно широко экспрессируются постнатально, причем самая ранняя эмбриональная экспрессия обоих генов происходит в ЦНС. Эта ранняя экспрессия в эмбриональном головном и спинном мозге намекает на потенциальные функции в развитии нервной системы, возможно, посредством регуляции белков NUMB.
В ряде исследований сообщается о дифференциальной экспрессии мРНК Lnx1 в определенных ситуациях, что дает потенциальные намеки на функцию LNX1. Например, мРНК Lnx1 относительно обильна в шишковидной железе по сравнению с другими тканями и демонстрирует изменения в дневное время по сравнению с уровнями экспрессии в ночное время [21,22]. Однако об анализе функции LNX1 в шишковидной железе не сообщалось. Интересно, что в нескольких сообщениях описывается высокая относительная экспрессия Lnx1 в различных популяциях стволовых клеток/клеток-предшественников, включая покоящиеся мышечные сателлитные клетки [23], клетки-предшественники олигодендроцитов [24] и лимбальные стволовые клетки глаза [25]. Однако уровни белка LNX1 в этих исследованиях не изучались, и поэтому функциональное значение этих наблюдений остается неясным.
Однако об анализе функции LNX1 в шишковидной железе не сообщалось. Интересно, что в нескольких сообщениях описывается высокая относительная экспрессия Lnx1 в различных популяциях стволовых клеток/клеток-предшественников, включая покоящиеся мышечные сателлитные клетки [23], клетки-предшественники олигодендроцитов [24] и лимбальные стволовые клетки глаза [25]. Однако уровни белка LNX1 в этих исследованиях не изучались, и поэтому функциональное значение этих наблюдений остается неясным.
Другой в значительной степени неизученной областью вопроса является то, как регулируется транскрипция генов Lnx1 и Lnx2 . Альтернативные промоторы вызывают строгую дифференциальную экспрессию транскриптов, кодирующих LNX1p70 и p62, в нейронах по сравнению с LNX1p80, кодирующим мРНК 9.0921 s в других тканях, но факторы транскрипции, действующие на любой из промоторов, не описаны. Кон и др. [26] сообщили о коррелированной экспрессии LNX1 с компонентами плотных контактов в линиях раковых клеток человека, что свидетельствует об общей эпителиальной функции для LNX1 с этим набором белков плотных контактов. Однако возможные механизмы, координирующие экспрессию этого набора белков, не описаны. Фактор транскрипции RUNX2 играет роль в контроле 9Экспрессия 0921 Lnx2 в остеобластах [27] и транскрипционный репрессор GLI3 могут подавлять экспрессию Lnx2 во время дифференцировки нейронов на основании повышенных уровней Lnx2 , наблюдаемых у мышей Gli3 -/- [28]. В целом наше понимание регуляции транскрипции генов LNX1/2 млекопитающих очень неполное.
Однако возможные механизмы, координирующие экспрессию этого набора белков, не описаны. Фактор транскрипции RUNX2 играет роль в контроле 9Экспрессия 0921 Lnx2 в остеобластах [27] и транскрипционный репрессор GLI3 могут подавлять экспрессию Lnx2 во время дифференцировки нейронов на основании повышенных уровней Lnx2 , наблюдаемых у мышей Gli3 -/- [28]. В целом наше понимание регуляции транскрипции генов LNX1/2 млекопитающих очень неполное.
» data-legacyid=»sec4-2″> Экспрессия белка LNX1/2
Несмотря на широкую экспрессию LNX1/2 мРНК, белки LNX1/2 присутствуют in vivo в относительно низких количествах. Обнаружение эндогенных белков LNX1/2 с помощью Вестерн-блоттинга обычно требует иммунопреципитации из лизатов тканей [13,20,29–33], хотя LNX2 можно обнаружить непосредственно в лизатах мозга мышей на эмбриональной и ранней постнатальной стадиях, но не во взрослом состоянии [13,28]. ]. Как LNX1, так и LNX2 могут быть обнаружены непосредственно вестерн-блоттингом в клеточных линиях колоректального рака (CRC) [34,35], но об их обнаружении в других клеточных линиях широко не сообщалось. Сообщалось об иммуноокрашивании эндогенного белка LNX1 в перисинаптических шванновских клетках нервно-мышечных соединений [33], в то время как белок LNX2 широко обнаруживался в большинстве органов эмбриональных мышей 16,5 дня [30]. LNX1 и LNX2 были обнаружены иммуноокрашиванием в акросоме сперматозоидов мышей [36].
]. Как LNX1, так и LNX2 могут быть обнаружены непосредственно вестерн-блоттингом в клеточных линиях колоректального рака (CRC) [34,35], но об их обнаружении в других клеточных линиях широко не сообщалось. Сообщалось об иммуноокрашивании эндогенного белка LNX1 в перисинаптических шванновских клетках нервно-мышечных соединений [33], в то время как белок LNX2 широко обнаруживался в большинстве органов эмбриональных мышей 16,5 дня [30]. LNX1 и LNX2 были обнаружены иммуноокрашиванием в акросоме сперматозоидов мышей [36].
Иммунопреципитация из лизатов головного мозга мышей подтвердила экспрессию белков LNX1p62 и p70, хотя и на низком уровне [20]. Частично это может быть объяснено наличием ORF выше по течению и других элементов последовательности, которые подавляют трансляцию белка в пределах 5′-UTR мРНК, кодирующих эти изоформы [20]. Выходящие ORF в мРНК могут отклонять рибосомы от трансляции основной кодирующей последовательности [37]. Такие механизмы, по-видимому, не регулируют трансляцию LNX1p80 (или LNX2), но на уровни белка LNX1p80 может влиять быстрый оборот белка посредством протеасомной деградации [20]. Вместе эти механизмы могут объяснить, по крайней мере частично, низкие уровни обнаруженных белков LNX1 в естественных условиях . Постнатальное снижение уровня белка LNX2 в головном мозге [13], несмотря на продолжающуюся экспрессию мРНК LNX2 [6], предполагает, что либо высокая скорость оборота белка, либо другие механизмы, действующие на уровне трансляции белка, могут контролировать взрослый LNX2. уровень белка. Возможные регуляторные механизмы могут включать репрессию трансляции некодирующими РНК, и в одном отчете была идентифицирована микроРНК, miR-939 , которая может нацеливаться на Lnx2 909.30 сообщение [38].
Вместе эти механизмы могут объяснить, по крайней мере частично, низкие уровни обнаруженных белков LNX1 в естественных условиях . Постнатальное снижение уровня белка LNX2 в головном мозге [13], несмотря на продолжающуюся экспрессию мРНК LNX2 [6], предполагает, что либо высокая скорость оборота белка, либо другие механизмы, действующие на уровне трансляции белка, могут контролировать взрослый LNX2. уровень белка. Возможные регуляторные механизмы могут включать репрессию трансляции некодирующими РНК, и в одном отчете была идентифицирована микроРНК, miR-939 , которая может нацеливаться на Lnx2 909.30 сообщение [38].
Интригует эксклюзивная экспрессия в ЦНС изоформ белка LNX1 (p62 и p70), в которых отсутствует каталитическая область ZnF-RING-ZnF. Изоформа р70 обнаружена у различных видов позвоночных, а короткая концевая аминопоследовательность, уникальная для этой изоформы, высоко консервативна [1]. Поскольку они не обладают каталитической активностью, но сохраняют домены взаимодействия мотива NPAY и белка PDZ, можно ожидать, что эти экспрессируемые нейронами изоформы будут оказывать действие, противоположное LNX1p80 или LNX2, по отношению к белкам-субстратам, взаимодействуя с ними, но не убиквитинируя их, и, возможно, защищая их от убиквитинирования с помощью LNX2. в ситуациях, в которых они со-выражены. Однако в некоторых случаях оказывается, что LNX1p70, несмотря на отсутствие каталитического домена, тем не менее может способствовать убиквитинированию некоторых взаимодействующих белков (LIPRIN-α1 и KLHL11), скорее всего, действуя как каркас для рекрутирования других убиквитинлигаз [14]. Кроме того, нейрональные изоформы LNX1 могут иметь функции каркаса, не связанные с убиквитинированием. Например, LNX1p70 был способен способствовать эндоцитозу соединительной молекулы адгезии (JAM) 4 (JAM4), возможно, опосредуя образование тройного комплекса с NUMB [39].]. Точно так же было показано, что роль LNX1p80 в сенсибилизации клеток HK-2 к TGF-β-индуцированному переходу эпителия в мезенхиму (EMT) не зависит от его активности убиквитинлигазы. Хотя эти примеры не относятся к нейронному контексту, они подчеркивают потенциал независимых от убиквитинирования функций нейрональных изоформ p70 и p62 LNX1.
в ситуациях, в которых они со-выражены. Однако в некоторых случаях оказывается, что LNX1p70, несмотря на отсутствие каталитического домена, тем не менее может способствовать убиквитинированию некоторых взаимодействующих белков (LIPRIN-α1 и KLHL11), скорее всего, действуя как каркас для рекрутирования других убиквитинлигаз [14]. Кроме того, нейрональные изоформы LNX1 могут иметь функции каркаса, не связанные с убиквитинированием. Например, LNX1p70 был способен способствовать эндоцитозу соединительной молекулы адгезии (JAM) 4 (JAM4), возможно, опосредуя образование тройного комплекса с NUMB [39].]. Точно так же было показано, что роль LNX1p80 в сенсибилизации клеток HK-2 к TGF-β-индуцированному переходу эпителия в мезенхиму (EMT) не зависит от его активности убиквитинлигазы. Хотя эти примеры не относятся к нейронному контексту, они подчеркивают потенциал независимых от убиквитинирования функций нейрональных изоформ p70 и p62 LNX1.
В целом низкие уровни экспрессии белков LNX1 и LNX2 и возможное отсутствие корреляции между LNX1/2 уровнями мРНК и белка in vivo имеют важное значение для интерпретации отчетов о роли белков LNX1/2 в заболевании и физиологической значимости многих взаимодействий белков LNX1/2, которые были идентифицированы на сегодняшний день. По-видимому, жесткий контроль уровней белка LNX1/2 предполагает, что белки LNX1/2 (i) могут выполнять общие функции во многих типах клеток, но они необходимы только при очень низких уровнях или (ii) играют очень специфическую роль в определенных клетках. типы, в которых они экспрессируются на более высоких уровнях, но ограничены во времени или пространстве. Тот факт, что белки LNX1/2 в норме присутствуют in vivo на относительно низких уровнях следует учитывать при интерпретации экспериментов, которые в значительной степени зависят от сверхэкспрессии LNX1/2.
По-видимому, жесткий контроль уровней белка LNX1/2 предполагает, что белки LNX1/2 (i) могут выполнять общие функции во многих типах клеток, но они необходимы только при очень низких уровнях или (ii) играют очень специфическую роль в определенных клетках. типы, в которых они экспрессируются на более высоких уровнях, но ограничены во времени или пространстве. Тот факт, что белки LNX1/2 в норме присутствуют in vivo на относительно низких уровнях следует учитывать при интерпретации экспериментов, которые в значительной степени зависят от сверхэкспрессии LNX1/2.
Убиквитинлигазная активность LNX1 была подтверждена, и было показано, что NUMB является субстратом для LNX1-опосредованного убиквитинирования [11]. Убиквитинирование NUMB с помощью LNX2 впоследствии было показано как для белков млекопитающих, так и для белков рыбок данио [4,32]. Как LNX1, так и LNX2-опосредованное убиквитинирование, по-видимому, нацелено на протеасомную деградацию NUMB [11,32]. В случае LNX1 было обнаружено, что первый домен PDZ необходим для убиквитинирования NUMB [11]. Существуют четыре основные изоформы NUMB млекопитающих (p65, p66, p71 и p72). Хотя все изоформы NUMB могут связываться с LNX1, LNX1 убиквитинирует только изоформы p66 и p72, которые содержат 11-аминокислотную вставку в своем домене PTB [10]. Было показано, что эта область взаимодействует с областью PDZ1 LNX1, и это взаимодействие, в дополнение к каноническому связыванию PTB с мотивом NPAY LNX1, по-видимому, необходимо для убиквитинирования NUMB p66 и p72 с помощью LNX1. Четыре изоформы NUMB проявляют онтогенетические и тканеспецифические паттерны экспрессии [40]. Учитывая изоформную специфичность убиквитинирования NUMB, при изучении функции LNX1 важно знать, какие изоформы NUMB экспрессируются в интересующем типе клеток или тканей. В NUMB-подобном отсутствует инсерция PTB, обнаруженная в NUMB p66 и p72, что позволяет предположить, что он может не быть субстратом LNX1, несмотря на то, что было показано, что он взаимодействует с LNX1 [3].
Как LNX1, так и LNX2-опосредованное убиквитинирование, по-видимому, нацелено на протеасомную деградацию NUMB [11,32]. В случае LNX1 было обнаружено, что первый домен PDZ необходим для убиквитинирования NUMB [11]. Существуют четыре основные изоформы NUMB млекопитающих (p65, p66, p71 и p72). Хотя все изоформы NUMB могут связываться с LNX1, LNX1 убиквитинирует только изоформы p66 и p72, которые содержат 11-аминокислотную вставку в своем домене PTB [10]. Было показано, что эта область взаимодействует с областью PDZ1 LNX1, и это взаимодействие, в дополнение к каноническому связыванию PTB с мотивом NPAY LNX1, по-видимому, необходимо для убиквитинирования NUMB p66 и p72 с помощью LNX1. Четыре изоформы NUMB проявляют онтогенетические и тканеспецифические паттерны экспрессии [40]. Учитывая изоформную специфичность убиквитинирования NUMB, при изучении функции LNX1 важно знать, какие изоформы NUMB экспрессируются в интересующем типе клеток или тканей. В NUMB-подобном отсутствует инсерция PTB, обнаруженная в NUMB p66 и p72, что позволяет предположить, что он может не быть субстратом LNX1, несмотря на то, что было показано, что он взаимодействует с LNX1 [3]. В настоящее время неизвестно, проявляет ли LNX2 ту же изоформную специфичность к убиквитинированию NUMB, что и LNX1. Это важные вопросы, касающиеся взаимодействия белков LNX1/2 с NUMB и NUMB-подобными, которые необходимо решить.
В настоящее время неизвестно, проявляет ли LNX2 ту же изоформную специфичность к убиквитинированию NUMB, что и LNX1. Это важные вопросы, касающиеся взаимодействия белков LNX1/2 с NUMB и NUMB-подобными, которые необходимо решить.
Важно отметить, что совсем недавно появились некоторые доказательства того, что потеря функции LNX1/2 может приводить к изменению передачи сигналов NOTCH. У эмбрионов рыбок данио, экспрессирующих доминантно-негативную форму LNX2, было обнаружено, что уровни NUMB были увеличены, а количество клеток, демонстрирующих передачу сигналов NOTCH, было уменьшено, что оценивалось с использованием репортера на основе трансгенного флуоресцентного белка [32]. В другом исследовании нокдаун LNX2 в макрофагах костного происхождения приводил к увеличению уровней белка NUMB, снижению уровней NOTCh3 и снижению экспрессии целевого гена NOTCH 9.0921 Hes1 [42]. Однако в некоторых других исследованиях не наблюдалось изменений в передаче сигналов NOTCH как следствие измененных уровней LNX1/2. У мышей с нокаутом Gli3 активация LNX2 связана с резкой потерей NUMB, но авторы отмечают, что экспрессия гена-мишени NOTCH Hes5 не затрагивается, и скорее указывают на другие функции NUMB для объяснения фенотипов, наблюдаемых у этих мышей. [28]. В другом сообщении нокдаун LNX2 в клеточной линии рака поджелудочной железы не влиял на передачу сигналов NOTCH, а скорее изменял активность передачи сигналов MAPK/ERK [43].
У мышей с нокаутом Gli3 активация LNX2 связана с резкой потерей NUMB, но авторы отмечают, что экспрессия гена-мишени NOTCH Hes5 не затрагивается, и скорее указывают на другие функции NUMB для объяснения фенотипов, наблюдаемых у этих мышей. [28]. В другом сообщении нокдаун LNX2 в клеточной линии рака поджелудочной железы не влиял на передачу сигналов NOTCH, а скорее изменял активность передачи сигналов MAPK/ERK [43].
Эти наблюдения проясняют, что связь повышенной или пониженной экспрессии белка LNX1/2 с изменениями в передаче сигналов NOTCH в данном контексте не является прямой. Во-первых, LNX1/2 может влиять или не влиять на уровни NUMB в зависимости от конкретной изоформы (изоформ) присутствующего NUMB; во-вторых, необходимо учитывать избыточность функций между изоформами LNX1/2 и между NUMB и NUMB-подобными и, в-третьих, даже если уровни NUMB изменены, это может повлиять на пути, отличные от передачи сигналов NOTCH. Наконец, возможно, что LNX1/2 может модулировать NUMB и/или NUMB-подобную функцию независимо от запуска их деградации, например, путем изменения субклеточной локализации NUMB или NUMB-подобной. Тем не менее, белки LNX1/2 определенно могут действовать как активаторы передачи сигналов NOTCH посредством убиквитинирования NUMB, но этот механизм должен быть тщательно изучен в каждом клеточном контексте по причинам, изложенным выше.
Тем не менее, белки LNX1/2 определенно могут действовать как активаторы передачи сигналов NOTCH посредством убиквитинирования NUMB, но этот механизм должен быть тщательно изучен в каждом клеточном контексте по причинам, изложенным выше.
При исследовании мышей с нокаутом, у которых отсутствует сигнальный компонент Sonic hedgehog GLI3, Wang et al. [28] обнаружили потенциальную роль LNX2 в нейрогенезе в субвентрикулярной зоне (SVZ) — нейрогенной области как у эмбрионов, так и у взрослых млекопитающих. В СВЗ эпендимальные клетки, как и нейральные стволовые клетки, происходят из радиальных глиальных клеток, но у мышей Gli3 -/- наблюдались дефекты в спецификации эпендимальных клеток. У этих мышей резко снижены уровни белка NUMB, что может, по крайней мере, частично объяснить наблюдаемый фенотип. Интересно, что Gli3 9Мыши 0922 -/- имеют повышенные уровни LNX2, особенно в SVZ, что привело авторов к предположению, что избыточная экспрессия LNX2 у мышей Gli3 -/- может нацеливаться на NUMB для протеолитической деградации. Хотя этот механизм кажется правдоподобным, причинно-следственная связь между уровнями LNX2 и NUMB окончательно не продемонстрирована. Тем не менее, это интересное открытие, которое ставит вопрос о том, играет ли LNX2 роль в нормальном развитии СВЗ помимо этой предполагаемой роли в Gli3 -/- животных.
Было также предположено, что взаимодействие контактин-ассоциированного белка-4 (CASPR4) с LNX2 играет роль в дифференцировке нейронов [45]. CASPR4 представляет собой трансмембранный белок, который является членом надсемейства белков нейрексинов. Он экспрессируется в развивающейся коре и нервных клетках-предшественниках в СВЗ. Было обнаружено, что LNX2 связывается с цитоплазматическим доменом CASPR4, и было обнаружено, что оба белка ингибируют пролиферацию и способствуют дифференцировке культивируемых нейральных клеток-предшественников на основе siRNA и экспериментов со сверхэкспрессией. Коэкспрессия CASPR4 и LNX2 в SVZ была показана с помощью иммунного окрашивания. Экспрессия LNX2 может восстанавливать дефицит дифференцировки нейронов, вызванный нокдауном CASPR4, что привело авторов к гипотезе, что LNX2 функционирует ниже CASPR4, способствуя дифференцировке нейронов. Однако механизм, выходящий за рамки этого, не был исследован, и поэтому еще предстоит выяснить, включает ли он модуляцию LNX2 передачи сигналов NUMB или NOTCH.
Определенная роль белков LNX1/2 в корковом нейрогенезе была предложена на основании их взаимодействия с SHOOTIN1 [46]. SHOOTIN1 локализуется на апикальной поверхности желудочковой зоны в делящихся радиальных глиальных клетках, которые служат предшественниками кортикальных нейронов. Сверхэкспрессия SHOOTIN1 смещает делящиеся клетки в сторону симметричных делений, которые генерируют две клетки-предшественники, тогда как нокдаун SHOOTIN1 приводит к клеточным делениям, которые дают начало большему количеству нейронов. Кроме того, мыши с нокаутом по SHOOTIN1 обнаруживают значительные дефекты в развитии коры головного мозга. Известно, что NUMB контролирует баланс между поддержанием пулов предшественников и дифференцировкой нейронов. Следовательно, регуляция передачи сигналов NUMB и NOTCH белками LNX1/2 была исследована как потенциальный механизм для объяснения этих результатов. Белки LNX1 и LNX2 совместно локализовались с SHOOTIN1 в желудочковой зоне и могли подвергаться иммунопреципитации в комплексе с NUMB и SHOOTIN1 из лизатов головного мозга. Примечательно, что SHOOTIN1 повышал способность LNX1 убиквитинировать NUMB и усиливал передачу сигналов NOTCH при сверхэкспрессии в эмбриональном мозге, в то время как мыши с нокаутом SHOOTIN1 имели повышенные уровни NUMB и снижение передачи сигналов NOTCH, что оценивалось с помощью репортерного анализа NOTCH. Вместе эти данные приводят к модели, в которой SHOOTIN1, усиливая активность ubiquitin ligase белков LNX1/2, способствует деградации NUMB и тем самым усиливает передачу сигналов NOTCH.
Примечательно, что SHOOTIN1 повышал способность LNX1 убиквитинировать NUMB и усиливал передачу сигналов NOTCH при сверхэкспрессии в эмбриональном мозге, в то время как мыши с нокаутом SHOOTIN1 имели повышенные уровни NUMB и снижение передачи сигналов NOTCH, что оценивалось с помощью репортерного анализа NOTCH. Вместе эти данные приводят к модели, в которой SHOOTIN1, усиливая активность ubiquitin ligase белков LNX1/2, способствует деградации NUMB и тем самым усиливает передачу сигналов NOTCH.
Приведенные выше примеры указывают на несколько потенциальных ролей белков LNX1/2 в регуляции нейрогенеза и дифференцировки нейронов и согласуются с хорошо известной ролью NUMB в таких процессах. Однако ни один из них не может считаться окончательным доказательством такой роли in vivo при нормальном развитии мозга. Примечательно, что общая морфология мозга оказалась нормальной, и у мышей, у которых в нервной системе отсутствовали как LNX1, так и LNX2, не наблюдалось изменений в уровнях NUMB [13]. Более того, дифференцировка эпендимальных клеток в SVZ у этих мышей оказалась нормальной. Эти наблюдения указывают на то, что роль, которую играют белки LNX1/2 в нейрогенезе и дифференцировке нейронов, должна быть относительно тонкой или может быть компенсирована каким-то образом в отсутствие белков LNX1/2. Более подробный анализ мышей LNX1/LNX2 DKO, основанный на результатах вышеупомянутых исследований, должен дополнительно прояснить эту роль.
Более того, дифференцировка эпендимальных клеток в SVZ у этих мышей оказалась нормальной. Эти наблюдения указывают на то, что роль, которую играют белки LNX1/2 в нейрогенезе и дифференцировке нейронов, должна быть относительно тонкой или может быть компенсирована каким-то образом в отсутствие белков LNX1/2. Более подробный анализ мышей LNX1/LNX2 DKO, основанный на результатах вышеупомянутых исследований, должен дополнительно прояснить эту роль.
Несколько сотен белков были описаны как потенциально взаимодействующие с белками LNX1/2, и подавляющее большинство этих взаимодействий опосредуется доменами LNX1/2 PDZ [9,13,18,20]. Некоторые из этих предполагаемых взаимодействий были идентифицированы в ходе высокопроизводительного скрининга с использованием двухгибридной системы дрожжей или химически синтезированных пептидов [9].,15,18,49,50]. Кластерный анализ белков, взаимодействующих с LNX1, основанный на аннотациях генной онтологии, дал некоторое представление о потенциально новых функциях LNX1 [9,18]. Совсем недавно аффинную очистку в сочетании с MS использовали для характеристики интерактома LNX1 в клеточной линии HEK293 и белков, взаимодействующих с LNX1 и LNX2 PDZ2, из лизатов головного мозга мыши [13,14]. Учитывая присущие этим высокопроизводительным подходам ограничения, ниже я сосредоточусь на тех взаимодействиях, которые, по крайней мере, были подтверждены с использованием полноразмерных белков, экспрессируемых в клетках млекопитающих (таблица 1). Кроме того, я попытался сгруппировать эти взаимодействия в соответствии с их клеточным контекстом (рис. 2). 9Рисунок 2 ( A ) Плотные контакты эпителиальных клеток; ( B ) Пресинаптический цитоматрикс комплекса активной зоны (CAZ) в нейронах; ( C ) Взаимодействие белков LNX1/2 с сигнальными молекулами цитоплазмы и плазматической мембраны, а также с ядерными белками, участвующими в регуляции транскрипции. Только одно или несколько из изображенных взаимодействий могут происходить в клетках любого типа в данный момент времени. «Ub» указывает на взаимодействующие белки, которые, как известно, являются субстратами для убиквитинирования белками LNX1/2. Дополнительные сведения и ссылки см. в основном тексте и в Таблице 1.
Кроме того, я попытался сгруппировать эти взаимодействия в соответствии с их клеточным контекстом (рис. 2). 9Рисунок 2 ( A ) Плотные контакты эпителиальных клеток; ( B ) Пресинаптический цитоматрикс комплекса активной зоны (CAZ) в нейронах; ( C ) Взаимодействие белков LNX1/2 с сигнальными молекулами цитоплазмы и плазматической мембраны, а также с ядерными белками, участвующими в регуляции транскрипции. Только одно или несколько из изображенных взаимодействий могут происходить в клетках любого типа в данный момент времени. «Ub» указывает на взаимодействующие белки, которые, как известно, являются субстратами для убиквитинирования белками LNX1/2. Дополнительные сведения и ссылки см. в основном тексте и в Таблице 1.
Рисунок 2
Просмотреть большой Загрузить слайд
Взаимодействия белков LNX1/2
Некоторые из наиболее хорошо охарактеризованных белков, взаимодействующих с LNX1/2, сгруппированы в соответствии с их внутриклеточной локализацией. ( A ) Плотные контакты эпителиальных клеток; ( B ) Пресинаптический цитоматрикс комплекса активной зоны (CAZ) в нейронах; ( C ) Взаимодействие белков LNX1/2 с сигнальными молекулами цитоплазмы и плазматической мембраны, а также с ядерными белками, участвующими в регуляции транскрипции. Только одно или несколько из изображенных взаимодействий могут происходить в клетках любого типа в данный момент времени. «Ub» указывает на взаимодействующие белки, которые, как известно, являются субстратами для убиквитинирования белками LNX1/2. Дополнительные сведения и ссылки см. в основном тексте и в Таблице 1. 9
( A ) Плотные контакты эпителиальных клеток; ( B ) Пресинаптический цитоматрикс комплекса активной зоны (CAZ) в нейронах; ( C ) Взаимодействие белков LNX1/2 с сигнальными молекулами цитоплазмы и плазматической мембраны, а также с ядерными белками, участвующими в регуляции транскрипции. Только одно или несколько из изображенных взаимодействий могут происходить в клетках любого типа в данный момент времени. «Ub» указывает на взаимодействующие белки, которые, как известно, являются субстратами для убиквитинирования белками LNX1/2. Дополнительные сведения и ссылки см. в основном тексте и в Таблице 1. 9
Известные взаимодействия белков LNX1/2 .

 Co-L
Co-L ; протеасомная деградация
; протеасомная деградация Co-IP(h)
Co-IP(h)| Взаимодействующий белок . | Описание/функция . | Связывается с: . | Задействованные домены
. | Используемые методы . | Субстрат для убиквитинирования . | Ссылки . | |||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Numb | Детерминантура судьбы клеток | LNX1, LNX2 | NPAY/F, PDZ1 | Y2H, GST-PD, CO-IP (H) | Да; Да; Да; Да; Да; протеасомная деградация | [3,4,6,10,11] | |||||||||||||||||||||||||||
| NUMB-подобный | Детерминант клеточной судьбы | LNX1, LNX2 | NPAY/F MOTIF | Y2H, GST-PD, CO-IP (H) | N/D | [3,6] | |||||||||||||||||||||||||||
| Shootin | 40004 | 40009 | 4 , LNX2 | PDZ2,3,4 | МАССОВЫЙ МАСЕР, CO-IP (H, E) | N/D | [46] | ||||||||||||||||||||||||||
| CASPR4 | Семейный белксин. | Y2H, GST-PD, Co-IP(h), Co-L | н/д | [45] | |||||||||||||||||||||||||||||
| Claudin-1, 2, 17 | Груг-соединение | LNX1 | PDZ1, PDZ2 | Y2H, GST-PD, CO-IP (H) | Да; Да; Да; Эндоцитоз | [9,51] | |||||||||||||||||||||||||||
| JAM4 | Груг-соединение | LNX1 | PDZ2 | Y2H, CO-IP (H), Co-Local | N/D | 40004 | . | ||||||||||||||||||||||||||
| CAR | Плотное соединение | LNX1, LNX2 | PDZ2 | Y2H, GST-PD, Co-IP(h) | n/d | [30,36,52] | |||||||||||||||||||||||||||
| ERC1, ERC2 | Presynaptic | LNX1, LNX2 | PDZ2 | Y2H, Co-IP (H), GFP-PD, CO-L | Да | [13,14,56] | |||||||||||||||||||||||||||
| Liprin-α1, -α3 | Пресинаптический | LNX1, не-2 | PDZ2 | Co-IP(h) GFP-PD | Да; не деградировал | [13,14] | |||||||||||||||||||||||||||
| ERBB2 | Рецептор тирозинкиназа | LNX1 | PDZ1-4 | Y2H, Co-IP (H, E) | N/D | . | |||||||||||||||||||||||||||
| CD8-α | Т-клеточный корецептор | LNX1, LNX2 | PDZ1/2 | Y2H, Co-IP(e), GST-PD9004, Co-L0 Да; лизосомная деградация | [29] | ||||||||||||||||||||||||||||
| KCNA4 | K + channel | LNX1, LNX2 | PDZ1 | Y2H, Co-IP(h) | n/d | [15,18] | |||||||||||||||||||||||||||
| EPHA7 | Receptor Tyrosine kinase | LNX1, LNX2 | PDZ1-4 | Y2H, GFP-PD | n/d | [1,14,50] | |||||||||||||||||||||||||||
| Bozozok | Transcription factor | LNX2b | n/d | Co-IP(h) | Да; деградация | [69] | |||||||||||||||||||||||||||
| E4F1 | Транскрипционный фактор | LNX1, -2, -2B | N/D | CO -IP (H), GST -PD | Да; not degraded | [71] | |||||||||||||||||||||||||||
| TCF3 | Transcription factor | LNX2b | n/d | Co-IP(h) | n/d | [71] | |||||||||||||||||||||||||||
| TLE3 | Транскрипционный фактор | LNX2b | n/d | Co-IP(h) | n/d | [71] | |||||||||||||||||||||||||||
| HDAC1 | Histone deactylase | LNX2b | n/d | Co-IP(h) | N/D | [71] | |||||||||||||||||||||||||||
| NP9 | Ядерный белок | LNX1 | PDZ2-4 | Y2H, GST-PD, CON | N/D | . | |||||||||||||||||||||||||||
| ПРОПУСТИТЬ | Ядерный белок | LNX1 | N/D | Y2H, Co-IP (H), CO-L | N/D | [61] | |||||||||||||||||||||||||||
| HOXA1 | Фактор транскрипции | Lnx1 | 9915 | Lnx1 | 9 | 40005 9000 4000 | 915 | 4 d | Y2H, Co-IP(h), BiFC | n/d | [63] | ||||||||||||||||||||||
| KLHL11 | Kelch-like | LNX1, LNX2 | PDZ2 | GFP-PD | Да | [14] | |||||||||||||||||||||||||||
| KIF7 | Kinesin | LNX1, NOT -2 | PDZ1-4 | GFP-PD | Да | [14] | |||||||||||||||||||||||||||
| SYNGAP1 | |||||||||||||||||||||||||||||||||
| SYNGAP1915 | |||||||||||||||||||||||||||||||||
| SYNGAP1 9000 | . PDZ1, PDZ2 | Y2H, GFP-PD | n/d | [1,14] | |||||||||||||||||||||||||||||
| SRGAP2 | GTPase activating protein | LNX1, LNX2 | PDZ2 | GFP-PD | Да (слабый) | [13,14] | |||||||||||||||||||||||||||
| MID2 | Убиквитин лигаза | LNX1, не -2 | PDZ1-4 | GFP-PD | 40004 PDZ1-4 | GFP-PD | 9000 4000 40004 40004 4000 4000 4000 4000 40004 40004 40004 4000 4000 4000 4000 4000 40004. ] ] | ||||||||||||||||||||||||||
| AKAP13 | БЕЗОВЛЯЕТСЯ | LNX1, NOT -2 | PDZ2 | 9000. | N/D | [14] | N/D | [14] | N/D | [14] | . | LNX1, LNX2 | PDZ1 или PDZ1-4 | Y2H, Co-IP(h) | Да; proteasomal degradation | [9,15,18] | |||||||||||||||||
| BCR | GTPase activating protein | LNX1 | PDZ3 | Y2H | Yes, proteasomal degradation | [9] | |||||||||||||||||||||||||||
| c- SRC | Тирозинкиназа | LNX1 | PDZ3, PDZ1 | Матрица PDZ, Co-IP(h,e), Co-L | Да, протеасомная деградация | [31] | |||||||||||||||||||||||||||
| RHO-C | GTPase | LNX1 | PDZ1 | Y2H, Co-IP (H), CO-L | N/D | [59] | |||||||||||||||||||||||||||
| N/D | [59] | ||||||||||||||||||||||||||||||||
| N/D | [59] | ||||||||||||||||||||||||||||||||
| N/D | [59] | ||||||||||||||||||||||||||||||||
| N/D | [59] | ||||||||||||||||||||||||||||||||
| н/D | [59] | ||||||||||||||||||||||||||||||||
| N/D | . | PAK6 | SER/THR KINASE | LNX, LNX2 | PDZ2,4 | Y2H, Co-IP (H) | N/D | [15,18] | |||||||||||||||||||||||||
| Белок RhoGEF | LNX1, LNX2 | PDZ1,3 | Protoarray, Co-IP (H) | N/D | [18] | ||||||||||||||||||||||||||||
| PKCα | Ser/Thr Kinase | LNX1, LNX2 | PDZ2,4 | PEPTID4, CO-ARIDIDE, LNX2 | . IP(h) | n/d | [18,50] | ||||||||||||||||||||||||||
| TYK2 | Non-receptor Tyrosine kinase | LNX1, LNX2 | PDZ2 | Y2H, Co-IP(h) | н/д | [15,18] | |||||||||||||||||||||||||||
| RNase-L | Endoribonuclease | LNX1 | PDZ1-4 | Y2H, Co-IP(h) | No | [84] | |||||||||||||||||||||||||||
| MAGEB18 | Tumour antigen | LNX1 | — | TAP, Co-IP(h) | n/d | [66] |
Перечислены только те взаимодействия, которые были подтверждены с использованием полноразмерных белков, экспрессированных в клетках млекопитающих. Для взаимодействующих белков, являющихся субстратами LNX1/2, указывается последствие убиквитинирования (если оно известно). Сокращения: BCR, белок кластерной области точки разрыва; Co-IP(h) или Co-IP(e), коиммунопреципитация гетерологически экспрессируемых или эндогенных белков соответственно; Co-L, совместная локализация в клетках или тканях; GFP-PD или GST-PD, «вытягивающий» эксперимент с использованием тега GFP или GST соответственно; н/д, не определено; PBK, PDZ-связывающая киназа; SKIP, лыжно-взаимодействующий белок; Y2H, дрожжи двухгибридные.
Для взаимодействующих белков, являющихся субстратами LNX1/2, указывается последствие убиквитинирования (если оно известно). Сокращения: BCR, белок кластерной области точки разрыва; Co-IP(h) или Co-IP(e), коиммунопреципитация гетерологически экспрессируемых или эндогенных белков соответственно; Co-L, совместная локализация в клетках или тканях; GFP-PD или GST-PD, «вытягивающий» эксперимент с использованием тега GFP или GST соответственно; н/д, не определено; PBK, PDZ-связывающая киназа; SKIP, лыжно-взаимодействующий белок; Y2H, дрожжи двухгибридные.
Просмотреть большой
Эти исследования обсуждаются ниже. CLAUDIN включают большое семейство трансмембранных белков, участвующих в формировании плотных контактов, поддерживающих барьерные функции эпителия и эндотелия. Было обнаружено, что цитоплазматический домен CLAUDIN-1 взаимодействует с LNX1 через его карбоксильный концевой PDZ-связывающий мотив [51]. Сверхэкспрессия LNX1 в эпителиальных клетках MDCK вызывала резкое удаление CLAUDIN из плотных контактов, тогда как другие компоненты плотных контактов не затрагивались. Сверхэкспрессия LNX1 также вызывала дефекты в морфологии плотных контактов и неблагоприятно влияла на функцию эпителиального барьера. LNX1 был способен убиквитинировать CLAUDIN-1, -2 и -4, а LNX1-опосредованное убиквитинирование CLAUDIN-1 в клетках MDCK усиливалось в присутствии ингибитора лизосом хлорохина. Это указывает на то, что перераспределение CLAUDIN при сверхэкспрессии LNX1 является следствием запускаемого убиквитинированием эндоцитоза и последующей лизосомальной деградации. В целом это исследование подчеркивает потенциал LNX1 в отношении мощной регуляции CLAUDIN в плотных соединениях, хотя существенная оговорка заключается в том, что этот вывод в значительной степени основан на сверхэкспрессии LNX1, и поэтому необходимо изучить степень этой регуляции на физиологических уровнях экспрессии LNX1/2.
В целом это исследование подчеркивает потенциал LNX1 в отношении мощной регуляции CLAUDIN в плотных соединениях, хотя существенная оговорка заключается в том, что этот вывод в значительной степени основан на сверхэкспрессии LNX1, и поэтому необходимо изучить степень этой регуляции на физиологических уровнях экспрессии LNX1/2.
JAM4 является членом суперсемейства иммуноглобулинов молекул адгезии, локализующихся в плотных контактах. Было показано, что JAM4 взаимодействует через свой карбоксильный концевой PDZ-связывающий мотив с PDZ2 LNX1, и было замечено, что LNX1 частично ко-локализуется с JAM4 и другими компонентами плотных контактов в эпителиальных клетках [39]. Было показано, что LNX1p70, в котором отсутствует каталитический домен RING, способствует эндоцитозу JAM4, и этот эффект зависел от присутствия NUMB. Кроме того, было показано, что LNX1, NUMB и JAM4 образуют трехчастный комплекс, что приводит к модели, согласно которой LNX1 действует как каркас для связи NUMB и JAM4, тем самым способствуя эндоцитозу JAM4 независимо от LNX1-опосредованного убиквитинирования NUMB.
CAR, подобный JAM4, является членом суперсемейства иммуноглобулинов, который может взаимодействовать с LNX1 через его цитоплазматический хвост [52]. CAR назван на основании того, что он является рецептором как для вируса Коксаки, так и для аденовируса, но его нормальная функция, по крайней мере частично, связана с поддержанием целостности плотных контактов, где он может действовать как гомофильная молекула адгезии [54,55]. Было показано, что цитоплазматический хвост CAR связывается как с LNX1, так и с LNX2 через PDZ2 [30,52]. При совместной экспрессии с CAR LNX1 рекрутировался в межклеточные соединения, где он локализовался совместно с CAR. In vivo оба белка CAR и LNX2 присутствуют в нескольких тканях эмбриональных мышей 16,5 дня, и, в частности, коэкспрессия обоих белков была отмечена в подмножестве кровеносных сосудов [30]. Белки CAR и LNX1/2 были обнаружены в сперматозоидах из семенников мышей, где LNX2, но не LNX1, локализовался совместно с CAR в акросоме [36]. Демонстрация совместной локализации эндогенного белка LNX2 с CAR in vivo является основным преимуществом этих исследований, но функциональные последствия взаимодействия белков LNX1/2 с CAR либо в эпителиальных клетках, либо в сперматозоидах еще предстоит установить. Примечательно, что мыши, лишенные LNX2, по-видимому, имеют нормальную фертильность, что позволяет предположить, что LNX2 в любом случае не является абсолютно необходимым для развития сперматозоидов и оплодотворения [13]. Точно так же нулевая мутация LNX2 не влияла на репродуктивную функцию у рыбок данио [32].
Примечательно, что мыши, лишенные LNX2, по-видимому, имеют нормальную фертильность, что позволяет предположить, что LNX2 в любом случае не является абсолютно необходимым для развития сперматозоидов и оплодотворения [13]. Точно так же нулевая мутация LNX2 не влияла на репродуктивную функцию у рыбок данио [32].
Эти исследования позволяют предположить, что белки LNX1/2 могут участвовать в формировании или ремоделировании плотных контактов в эпителиальных клетках. Это может иметь значение в контексте ЕМТ, которые возникают в процессе развития и также способствуют развитию опухоли и метастазированию [39]. Интересно, что LNX1, как было показано, делает эпителиальные клетки проксимальных канальцев почек более чувствительными к EMT, индуцированному TGF-β, эффект, который не зависит от активности убиквитинлигазы E3 [53]. Экспрессия LNX1 усиливала индуцированное TGF-β снижение транскрипции эпителиального маркера E-кадгерина и повышение активности виментина. Кроме того, клетки, экспрессирующие LNX1, показали повышенную скорость миграции. Эти находки иллюстрируют др. способ, которым белки LNX1/2 могут модулировать функцию эпителиальных клеток.
Эти находки иллюстрируют др. способ, которым белки LNX1/2 могут модулировать функцию эпителиальных клеток.
Протеомный анализ интерактома LNX1 выявил взаимодействие LNX1 с белками LIPRIN-α [13,14]. Это взаимодействие не характерно для LNX2 и зависит от карбоксиконцевого мотива –YSC LIPRIN-α1. LIPRIN-α1 является субстратом для убиквитинирования с помощью LNX1p80, и неожиданно экспрессируемый нейронами LNX1p70, в котором отсутствует каталитический RING-домен, способен способствовать убиквитинированию LIPRIN-α1, возможно, за счет рекрутирования другой убиквитинлигазы E3 [14]. В любом случае убиквитинирование LIPRIN-α1 с помощью LNX1 в HEK293 не вызывали значительного изменения уровней белка LIPRIN-α1, что позволяет предположить, что LNX1 не нацелен на протеосомную или лизосомную деградацию LIPRIN-α1, по крайней мере, в этом контексте. Т.о., хотя и ERCs, и LIPRIN-αs являются субстратами для убиквитинирования белками LNX1/2, функциональные последствия этого еще предстоит выяснить.
Также сообщалось, что ряд других белков, которые играют важную роль в формировании и функционировании синапсов, взаимодействуют с белками LNX1/2. К ним относятся MYCBP2 (PAM/HIGHWIRE/RPM-1), хорошо известный регулятор образования синапсов [14] и CASPR2, который регулирует созревание и функцию ГАМКергических и дофаминергических синапсов [57], хотя его взаимодействие с LNX1/2 было изучено. характеризуется в контексте нейрогенеза [45]. Белки, которые регулируют пресинаптические функции, могут быть хорошими кандидатами на участие в фенотипе, связанном с тревогой, наблюдаемом у мышей LNX1/LNX2 DKO (см. ниже) [13].
система. Было обнаружено, что ERBB2 взаимодействует с областью домена PDZ LNX1, и эндогенный ERBB2 может ко-иммунопреципитироваться с LNX1 из лизата головного мозга мыши [33]. Иммуноокрашивание на LNX1 в периферической нервной системе показало поразительную локализацию LNX1 в перисинаптических шванновских клетках в нервно-мышечных соединениях с небольшим окрашиванием или отсутствием окрашивания в миелинизирующих шванновских клетках вдоль двигательных аксонов. Передача сигналов от происходящего из аксона лиганда ERBB2 нейрегулина способствует дифференцировке миелинизирующих шванновских клеток. Специфическая локализация LNX1 в персисинаптических шванновских клетках позволяет предположить, что он может играть роль в модуляции передачи сигналов нейрегулина/ERBB2 для установления и/или поддержания их немиелинизирующего статуса. По-видимому, изоформа LNX1p80, содержащая RING-домен, присутствует в перисинаптических шванновских клетках [20], однако о том, может ли LNX1 убиквитинировать ERBB2, не сообщалось. Тем не менее, очень ограниченная локализация белка LNX1 интригует, поскольку известно очень мало маркеров, специфичных для перисинаптических шванновских клеток. Взятые вместе, эти результаты предполагают, что, по крайней мере, при сверхэкспрессии LNX1 и LNX2 могут вызывать убиквитинирование CD8-α, тем самым запуская его эндоцитоз и нацеливая на лизосомную деградацию. Пока 9мРНК 0921 Lnx1 и Lnx2 была обнаружена в очищенных Т-клетках, уровни белков LNX1 или LNX2 не оценивались и, вероятно, они значительно ниже, чем достигаются при гетерологичной экспрессии. Поэтому будет важно показать, что эндогенные уровни белков LNX1/2 в Т-клетках могут влиять на уровни CD8-α и/или субклеточную локализацию, возможно, путем изучения Т-клеток в условиях нокдауна LNX1/2 или потери функции. В нескольких сообщениях описывается, что LNX1 частично локализован в ядре [31, 58, 59], и LNX1 участвует в контроле клеточного цикла и модуляции транскрипции [53, 59, 60]. Эти наблюдения указывают на функции LNX1 в ядре.
Тем не менее, очень ограниченная локализация белка LNX1 интригует, поскольку известно очень мало маркеров, специфичных для перисинаптических шванновских клеток. Взятые вместе, эти результаты предполагают, что, по крайней мере, при сверхэкспрессии LNX1 и LNX2 могут вызывать убиквитинирование CD8-α, тем самым запуская его эндоцитоз и нацеливая на лизосомную деградацию. Пока 9мРНК 0921 Lnx1 и Lnx2 была обнаружена в очищенных Т-клетках, уровни белков LNX1 или LNX2 не оценивались и, вероятно, они значительно ниже, чем достигаются при гетерологичной экспрессии. Поэтому будет важно показать, что эндогенные уровни белков LNX1/2 в Т-клетках могут влиять на уровни CD8-α и/или субклеточную локализацию, возможно, путем изучения Т-клеток в условиях нокдауна LNX1/2 или потери функции. В нескольких сообщениях описывается, что LNX1 частично локализован в ядре [31, 58, 59], и LNX1 участвует в контроле клеточного цикла и модуляции транскрипции [53, 59, 60]. Эти наблюдения указывают на функции LNX1 в ядре.Ски-взаимодействующий белок (SKIP/SNW1) был идентифицирован в двухгибридном скрининге дрожжей с использованием PDZ1 LNX1 в качестве приманки [61]. Используя экзогенную экспрессию обоих белков, взаимодействие было подтверждено коиммунопреципитацией, и оба белка были обнаружены в ядре. SKIP/SNW1 функционирует как регулятор транскрипции, который может модулировать транскрипцию, связанную с несколькими сигнальными путями. Хотя взаимодействие SKIP-LNX1 далее не охарактеризовано, интересно отметить, что SKIP посредством взаимодействия с внутриклеточным доменом NOTCH играет роль в сборке комплексов активации транскрипции NOTCH [62]. Это указывает на возможный механизм, с помощью которого LNX1 может регулировать передачу сигналов NOTCH независимо от NUMB.
Армбрустер и др. [58] описали взаимодействие LNX1 с ядерным белком NP9 эндогенного ретровируса К человека. NP9 представляет собой белок из 74 аминокислот, который преимущественно экспрессируется в опухолях, но функциональная значимость его взаимодействия с LNX1 еще предстоит определить. Описано также взаимодействие фактора транскрипции HOXA1 мыши с LNX2 [63]. Эта ассоциация была обнаружена с помощью двухгибридного скрининга дрожжей и подтверждена коиммунопреципитацией и бимолекулярной флуоресцентной комплементацией в культивируемых клетках, но что касается NP9, функциональное значение взаимодействия неизвестно.
[58] описали взаимодействие LNX1 с ядерным белком NP9 эндогенного ретровируса К человека. NP9 представляет собой белок из 74 аминокислот, который преимущественно экспрессируется в опухолях, но функциональная значимость его взаимодействия с LNX1 еще предстоит определить. Описано также взаимодействие фактора транскрипции HOXA1 мыши с LNX2 [63]. Эта ассоциация была обнаружена с помощью двухгибридного скрининга дрожжей и подтверждена коиммунопреципитацией и бимолекулярной флуоресцентной комплементацией в культивируемых клетках, но что касается NP9, функциональное значение взаимодействия неизвестно.
PDZ-связывающая киназа (PBK/TOPK) — еще один ядерный белок, для которого было показано взаимодействие с LNX1 [9,15,18]. PBK функционирует как митоген-активируемая протеинкиназа-киназа, которая может подавлять белок-супрессор опухоли p53 и активируется при многих видах рака человека [64,65]. PBK можно коиммунопреципитировать с LNX1, используя экзогенную экспрессию обоих белков [18]. В отдельном исследовании было показано, что PBK убиквитинируется с помощью LNX1, что вызывает его протеасомно-зависимую деградацию [9].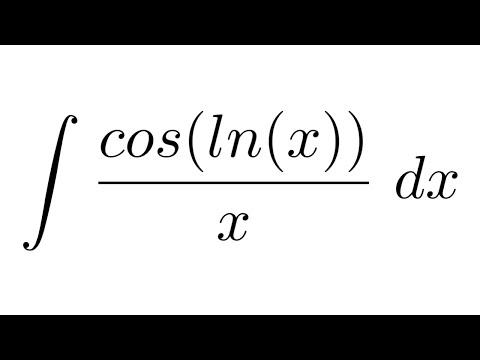 ]. Нокдап экспрессии LNX1 в клетках HEK293T с помощью siRNA приводил к повышению уровней PBK и усилению клеточного роста. И наоборот, сверхэкспрессия LNX1 снижала уровни PBK и замедляла рост клеток. Кроме того, нокдаун LNX1 сенсибилизирует клетки к доксорубицин-индуцированному апоптозу, в то время как сверхэкспрессия LNX1 защищает их [9]. Вместе эти данные свидетельствуют о том, что убиквитинирование с помощью LNX1 может смягчить ростостимулирующие и антиапоптотические эффекты PBK, нацеливая его на протеасомную деградацию.
]. Нокдап экспрессии LNX1 в клетках HEK293T с помощью siRNA приводил к повышению уровней PBK и усилению клеточного роста. И наоборот, сверхэкспрессия LNX1 снижала уровни PBK и замедляла рост клеток. Кроме того, нокдаун LNX1 сенсибилизирует клетки к доксорубицин-индуцированному апоптозу, в то время как сверхэкспрессия LNX1 защищает их [9]. Вместе эти данные свидетельствуют о том, что убиквитинирование с помощью LNX1 может смягчить ростостимулирующие и антиапоптотические эффекты PBK, нацеливая его на протеасомную деградацию.
Чжэн и др. [59]. обнаружили взаимодействие LNX1-PDZ1 с RHO-C — членом суперсемейства малых ГТФаз, играющих ключевую роль в регуляции актинового цитоскелета. Они обнаружили, что LNX1/2 рекрутирует RHO-C в ядро и что RHO-C может обратить вспять опосредованное LNX1 усиление транскрипционной активности AP-1, хотя механизмы, лежащие в основе этих эффектов, не были исследованы. Гуо и др. [9] описали белок кластерной области точки разрыва (BCR) в качестве субстрата для убиквитинирования с помощью LNX1. BCR представляет собой RHOGAP (белок, активирующий RHO GTPase) для малых GTPases RAC1 и CDC42. Экспрессия LNX1 вызывала снижение уровней белка BCR, которое могло быть обращено вспять протеасомным ингибитором, предполагая, что убиквитинирование с помощью LNX1 нацелено на деградацию BCR. Уолтинг и др. описывают несколько других цитоплазматических сигнальных белков, которые связываются с LNX1, включая серин/треонинкиназы PAK6 и PKCα, RHOGEF (фактор обмена гуаниновых нуклеотидов RHO) PLEKHG5 и нерецепторную тирозинкиназу TYK2 [18]. Также было описано взаимодействие LNX1 с белком опухолевого антигена MAGE-B18, и сайт взаимодействия на LNX1 был картирован в области между доменами ZnF/RING и первым доменом PDZ [66]. Однако эти взаимодействия не были дополнительно охарактеризованы. Наконец, протеомный анализ идентифицировал заякоривающий белок A-киназы AKAP13 и членов семейства TRIM убиквитинлигазы E3 (MID2/TRIM1 и TRIM27) в интерактоме LNX1 [14].
Экспрессия LNX1 вызывала снижение уровней белка BCR, которое могло быть обращено вспять протеасомным ингибитором, предполагая, что убиквитинирование с помощью LNX1 нацелено на деградацию BCR. Уолтинг и др. описывают несколько других цитоплазматических сигнальных белков, которые связываются с LNX1, включая серин/треонинкиназы PAK6 и PKCα, RHOGEF (фактор обмена гуаниновых нуклеотидов RHO) PLEKHG5 и нерецепторную тирозинкиназу TYK2 [18]. Также было описано взаимодействие LNX1 с белком опухолевого антигена MAGE-B18, и сайт взаимодействия на LNX1 был картирован в области между доменами ZnF/RING и первым доменом PDZ [66]. Однако эти взаимодействия не были дополнительно охарактеризованы. Наконец, протеомный анализ идентифицировал заякоривающий белок A-киназы AKAP13 и членов семейства TRIM убиквитинлигазы E3 (MID2/TRIM1 и TRIM27) в интерактоме LNX1 [14].
Из приведенных выше примеров ясно, что LNX1 обладает способностью взаимодействовать с ключевыми компонентами внутриклеточных сигнальных путей и в некоторых случаях убиквитинировать их.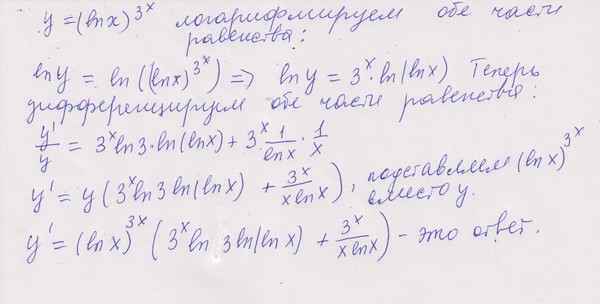 В дальнейшем будет интересно определить, в каких клеточных контекстах in vivo эти взаимодействия и потенциальное модулирующее влияние белков LNX1/2 на клеточную передачу сигналов имеют значение.
В дальнейшем будет интересно определить, в каких клеточных контекстах in vivo эти взаимодействия и потенциальное модулирующее влияние белков LNX1/2 на клеточную передачу сигналов имеют значение.
Затем в моей лаборатории была получена мышь с нокаутом LNX2 [13,20]. Поскольку эта мышь не проявляла какого-либо явного фенотипа, ее скрещивали с линией LNX1 экзон3-/- , упомянутой выше, для получения мышей с двойным нокаутом (DKO) LNX1/LNX2, у которых LNX2 полностью элиминируется во всех тканях, в то время как потеря Ожидается, что LNX1 будет ограничен изоформами p70 и p62 LNX1, содержащими экзон 3, в ЦНС. Таким образом, эти мыши представляют собой модель потери функции для изучения нейронных функций LNX1 и LNX2 млекопитающих. Мыши LNX1/LNX2 DKO жизнеспособны, здоровы и плодовиты и не имеют серьезных нейроанатомических дефектов [13]. Корковая организация и слоистость кажутся нормальными, что позволяет предположить, что общие процессы нейрогенеза и дифференцировки нейронов существенно не нарушены. Уровни белка NUMB в лизатах головного мозга не изменились, а развитие нейрогенной СВЗ, включая дифференцировку эпендимальных клеток, казалось нормальным. Это указывает на то, что в то время как активация LNX2 в Gli3 -/- мышей были связаны со сниженными уровнями NUMB и аномалиями в формировании SVZ [28] (см. выше), экспрессия LNX2 во время нормального развития, по-видимому, не влияет на функцию NUMB при формировании SVZ. Кроме того, не наблюдалось никаких дефектов клеточной организации в мозжечке мышей LNX1/LNX2 DKO, области с заметной экспрессией мРНК Lnx1 и Lnx2 .
Уровни белка NUMB в лизатах головного мозга не изменились, а развитие нейрогенной СВЗ, включая дифференцировку эпендимальных клеток, казалось нормальным. Это указывает на то, что в то время как активация LNX2 в Gli3 -/- мышей были связаны со сниженными уровнями NUMB и аномалиями в формировании SVZ [28] (см. выше), экспрессия LNX2 во время нормального развития, по-видимому, не влияет на функцию NUMB при формировании SVZ. Кроме того, не наблюдалось никаких дефектов клеточной организации в мозжечке мышей LNX1/LNX2 DKO, области с заметной экспрессией мРНК Lnx1 и Lnx2 .
При поведенческом тестировании мышей LNX1/LNX2 DKO показали нормальную обучаемость, двигательную и сенсорную функции [13]. Координация движений и обучение двигательным навыкам не были нарушены по результатам теста с вращающимся стержнем, несмотря на то, что 9мРНК 0921 Lnx1 и Lnx2 экспрессируются в моторной коре, спинном мозге и мозжечке — областях, которые участвуют в двигательной функции [6,20]. Основным выводом поведенческого анализа было то, что мыши LNX1/LNX2 DKO демонстрировали сниженное поведение, связанное с тревогой, в определенных поведенческих парадигмах (открытое поле и приподнятый крестообразный лабиринт), но не в других (светло-темный ящик) [13]. Эти тесты можно рассматривать как измеряющие перекрывающиеся, но частично различные аспекты поведения, связанного с тревогой. Таким образом, сниженное тревожное поведение, наблюдаемое у мышей DKO, по-видимому, является очень специфическим фенотипом, который наблюдается только в подмножестве парадигм тестирования, связанных с тревогой. В настоящее время молекулярные механизмы и дефект нейронной схемы, которые могут лежать в основе этого фенотипа, остаются неясными. Хотя уровни NUMB в общем лизате головного мозга кажутся неизменными, потеря белков LNX1/2 может изменять уровни NUMB ограниченным в пространстве или во времени образом. В качестве альтернативы, другие аспекты функции NUMB, такие как его субклеточная локализация, могут быть нарушены, не влияя на общий уровень NUMB.
Основным выводом поведенческого анализа было то, что мыши LNX1/LNX2 DKO демонстрировали сниженное поведение, связанное с тревогой, в определенных поведенческих парадигмах (открытое поле и приподнятый крестообразный лабиринт), но не в других (светло-темный ящик) [13]. Эти тесты можно рассматривать как измеряющие перекрывающиеся, но частично различные аспекты поведения, связанного с тревогой. Таким образом, сниженное тревожное поведение, наблюдаемое у мышей DKO, по-видимому, является очень специфическим фенотипом, который наблюдается только в подмножестве парадигм тестирования, связанных с тревогой. В настоящее время молекулярные механизмы и дефект нейронной схемы, которые могут лежать в основе этого фенотипа, остаются неясными. Хотя уровни NUMB в общем лизате головного мозга кажутся неизменными, потеря белков LNX1/2 может изменять уровни NUMB ограниченным в пространстве или во времени образом. В качестве альтернативы, другие аспекты функции NUMB, такие как его субклеточная локализация, могут быть нарушены, не влияя на общий уровень NUMB. Однако, учитывая, что у мышей LNX1/LNX2 DKO отсутствуют очевидные аномалии, связанные с NUMB, необходимо рассмотреть возможность того, что их сниженное поведение, связанное с тревогой, может быть следствием потери взаимодействия LNX1 и/или LNX2 с белками, отличными от NUMB. Кандидаты на эту роль включают взаимодействующие белки с известными синаптическими или нейронными сигнальными функциями, такие как составляющие пресинаптической активной зоны ERC1, ERC2 и LIPRIN-αs, а также FCHSD2 (гомолог нервного крушения), SRGAP2, SYNGAP1 и EPHA7 (см. Таблицу 1). ). В будущем, мы надеемся, будут выяснены молекулярные механизмы и области мозга, лежащие в основе этой неожиданной функции белков LNX1/2 в регуляции поведения, связанного с тревогой.
Однако, учитывая, что у мышей LNX1/LNX2 DKO отсутствуют очевидные аномалии, связанные с NUMB, необходимо рассмотреть возможность того, что их сниженное поведение, связанное с тревогой, может быть следствием потери взаимодействия LNX1 и/или LNX2 с белками, отличными от NUMB. Кандидаты на эту роль включают взаимодействующие белки с известными синаптическими или нейронными сигнальными функциями, такие как составляющие пресинаптической активной зоны ERC1, ERC2 и LIPRIN-αs, а также FCHSD2 (гомолог нервного крушения), SRGAP2, SYNGAP1 и EPHA7 (см. Таблицу 1). ). В будущем, мы надеемся, будут выяснены молекулярные механизмы и области мозга, лежащие в основе этой неожиданной функции белков LNX1/2 в регуляции поведения, связанного с тревогой.
Единственным другим важным фенотипом, наблюдаемым у этих LNX1/2 DKO, было то, что они весили примерно на 10% меньше, чем животные дикого типа во взрослом возрасте [13]. Эта разница в весе стала очевидной в возрасте отъема. Хотя эта разница в весе может быть вызвана нервной аномалией, влияющей, например, на аппетит или физические упражнения, она также может быть следствием потери LNX2 за пределами ЦНС у этих мышей.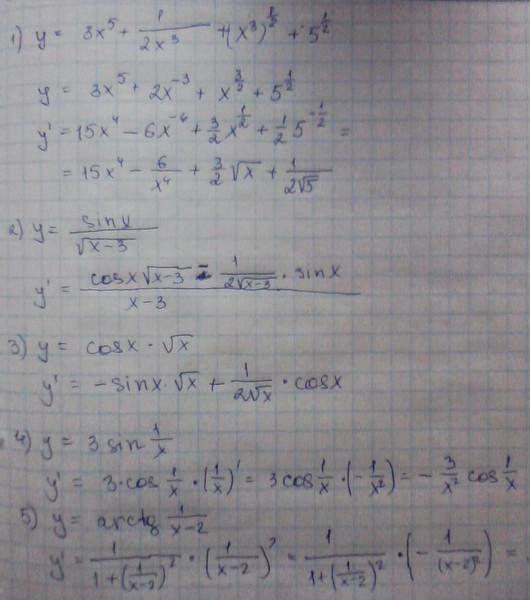 LNX2 играет роль в развитии поджелудочной железы у рыбок данио (см. ниже) [32]. Аномальная функция поджелудочной железы, вероятно, может влиять на увеличение веса, хотя роль LNX2 в кишечнике или в регуляции некоторых аспектов метаболизма также может быть ответственной. Интересно, что полногеномное ассоциативное исследование (GWAS) связало LNX2 на прибавку в весе у крупного рогатого скота [67], а в другом исследовании LNX2 был идентифицирован как связанный с ростом локус количественных признаков у китайского мохнатого краба [68]. Более тщательный анализ функции органов за пределами ЦНС может прояснить причину снижения веса, наблюдаемого у мышей LNX1/2 DKO.
LNX2 играет роль в развитии поджелудочной железы у рыбок данио (см. ниже) [32]. Аномальная функция поджелудочной железы, вероятно, может влиять на увеличение веса, хотя роль LNX2 в кишечнике или в регуляции некоторых аспектов метаболизма также может быть ответственной. Интересно, что полногеномное ассоциативное исследование (GWAS) связало LNX2 на прибавку в весе у крупного рогатого скота [67], а в другом исследовании LNX2 был идентифицирован как связанный с ростом локус количественных признаков у китайского мохнатого краба [68]. Более тщательный анализ функции органов за пределами ЦНС может прояснить причину снижения веса, наблюдаемого у мышей LNX1/2 DKO.
 Взятые вместе, эти данные поддерживают модель, согласно которой Lnx2b материнского происхождения противодействует функции BOZ во время гаструляции в эмбриональном развитии рыбок данио, нацеливая его на протеасомную деградацию. Как следствие этого сдерживающего эффекта на BOZ, Lnx2b предотвращает экспансию экспрессии генов дорсального организатора в эктодермальные ткани и, таким образом, играет существенную роль в формировании дорсо-вентрального паттерна.
Взятые вместе, эти данные поддерживают модель, согласно которой Lnx2b материнского происхождения противодействует функции BOZ во время гаструляции в эмбриональном развитии рыбок данио, нацеливая его на протеасомную деградацию. Как следствие этого сдерживающего эффекта на BOZ, Lnx2b предотвращает экспансию экспрессии генов дорсального организатора в эктодермальные ткани и, таким образом, играет существенную роль в формировании дорсо-вентрального паттерна. Также была показана отчетливая роль Lnx2b в модуляции экспрессии каудального гомеобоксного гена cdx4 во время эмбриогенеза рыбок данио [71]. Cdx/каудальные факторы транскрипции, включая Cdx4, функционируют в формировании паттерна каудальных эмбриональных структур. Экспрессия Cdx4 репрессируется с помощью Tcf3 в отсутствие передачи сигналов Wnt, тогда как регулятор транскрипции E4f1, как было показано, дерепрессирует cdx4 . Lnx2b может взаимодействовать с E4f1, но способствует репрессии cdx4 — противодействие действию E4f1.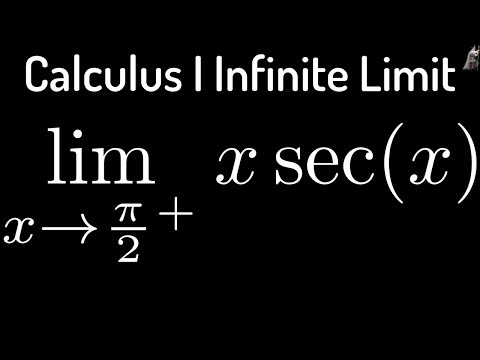 В то время как Lnx2b может убиквитинировать E4f1 в клеточных анализах убиквитинирования, это не приводит к деградации E4f1, и его убиквитинлигазная активность E3 не требуется для противодействия дерепрессии cdx4 с помощью E4f1. Таким образом, взаимодействия Lnx2b с E4f1 оказывается достаточно для модуляции репрессионного комплекса Tcf3 на промоторе cdx4 , хотя взаимодействия Lnx2b с другими компонентами комплекса могут играть роль.
В то время как Lnx2b может убиквитинировать E4f1 в клеточных анализах убиквитинирования, это не приводит к деградации E4f1, и его убиквитинлигазная активность E3 не требуется для противодействия дерепрессии cdx4 с помощью E4f1. Таким образом, взаимодействия Lnx2b с E4f1 оказывается достаточно для модуляции репрессионного комплекса Tcf3 на промоторе cdx4 , хотя взаимодействия Lnx2b с другими компонентами комплекса могут играть роль.
Третья функция белков Lnx2 и -2b во время развития рыбок данио также была обнаружена Dawid et al. [32]. В этом исследовании была выявлена дублирующая роль Lnx2b и Lnx2 (Lnx2a) в дифференцировке экзокринных клеток в поджелудочной железе. Эмбрионы, в которых экспрессия как Lnx2, так и Lnx2b была нарушена, или эмбрионы, экспрессирующие предполагаемую доминантно-негативную форму Lnx2 без домена RING, имели заметную потерю экзокринных клеток поджелудочной железы, что оценивалось по экспрессии Ptf1a 9.0930 фактор транскрипции, необходимый для дифференцировки этих клеток.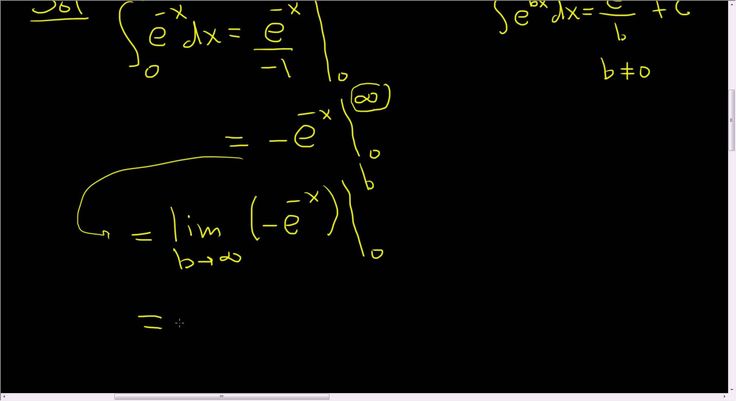 Другие экзокринные маркеры, такие как трипсин, также были резко снижены, в то время как дифференцировка эндокринных клеток, по-видимому, не пострадала. Специфичность этого фенотипа связана с экспрессией lnx2 мРНК в вентральном зачатке поджелудочной железы, из которого происходят экзокринные клетки, но не в дорсальном зачатке, из которого возникают эндокринные клетки. Механизм, лежащий в основе этого фенотипа, по-видимому, включает LNX2/2b-опосредованную регуляцию передачи сигналов Notch через Numb, основываясь на наблюдениях, что нокдаун Numb существенно спасает фенотип и что повышенные уровни Numb и снижение передачи сигналов Notch наблюдались в клетках поджелудочной железы эмбрионов, экспрессирующих доминантный отрицательный Lnx2. Предполагается, что дестабилизация Numb с помощью Lnx2 и Lnx2b способствует передаче сигналов Notch в клетках, происходящих из вентральных зачатков, что, по-видимому, важно для спецификации и/или пролиферации популяции экзокринных клеток-предшественников [32].
Другие экзокринные маркеры, такие как трипсин, также были резко снижены, в то время как дифференцировка эндокринных клеток, по-видимому, не пострадала. Специфичность этого фенотипа связана с экспрессией lnx2 мРНК в вентральном зачатке поджелудочной железы, из которого происходят экзокринные клетки, но не в дорсальном зачатке, из которого возникают эндокринные клетки. Механизм, лежащий в основе этого фенотипа, по-видимому, включает LNX2/2b-опосредованную регуляцию передачи сигналов Notch через Numb, основываясь на наблюдениях, что нокдаун Numb существенно спасает фенотип и что повышенные уровни Numb и снижение передачи сигналов Notch наблюдались в клетках поджелудочной железы эмбрионов, экспрессирующих доминантный отрицательный Lnx2. Предполагается, что дестабилизация Numb с помощью Lnx2 и Lnx2b способствует передаче сигналов Notch в клетках, происходящих из вентральных зачатков, что, по-видимому, важно для спецификации и/или пролиферации популяции экзокринных клеток-предшественников [32].
Вместе эти исследования на модели рыбок данио представляют собой наилучшее механистическое описание функции белка LNX1/2 in vivo. Ключевой вопрос заключается в том, являются ли эти функции общими для других линий, особенно у плацентарных млекопитающих, у которых отсутствует LNX2b. Отсутствие четкого ортолога Bozozok у млекопитающих указывает на то, что эта функция белков Lnx в очень раннем формировании эмбрионального паттерна может быть специфичной для рыб. Напротив, Ro и Dawid [71] продемонстрировали, что человеческие LNX1 и LNX2 могут взаимодействовать с человеческим E4F1 и убиквитинировать его, указывая на потенциально более широкую роль семейства LNX1/2 в модуляции функции E4F1 помимо рыбок данио. Это и вопрос о том, играют ли LNX2 и/или LNX1 роль в модуляции передачи сигналов NOTCH во время развития поджелудочной железы млекопитающих, таким образом, являются важными темами для будущих исследований.
» data-legacyid=»sec8-1″> Потенциальная роль LNX1 в опухолях головного мозга, контроле клеточного цикла и злокачественной трансформации
В ряде сообщений подчеркивается измененная экспрессия LNX1 в контексте опухолей головного мозга, хотя в большинстве случаев причинная роль LNX1 в развитии онкогенеза не была продемонстрирована . Снижение экспрессии мРНК LNX1 было отмечено в глиомах по сравнению со здоровой тканью головного мозга [71], хотя это может отражать тот факт, что мРНК LNX1 и LNX2 экспрессируются преимущественно в нейронах [20] и, как таковые, присутствуют. на более низких уровнях в глиомах, происходящих из глии. Напротив, другие сообщения демонстрируют амплификацию хромосомной области (4q12), содержащей ген LNX1 в опухолях головного мозга и ксенотрансплантатах остеосаркомы [72–74]. Следует отметить, однако, что эта область содержит ряд генов, кодирующих рецепторную тирозинкиназу, потенциально способствующую развитию рака (c- KIT, PDGFR-α и VEGFR2 ), и поэтому амплификация LNX1 может быть случайной. Сообщалось о нескольких случаях специфической амплификации LNX1 [73] и обнаружении некоторых миссенс-мутаций LNX1 [72], однако сверхэкспрессия LNX1 на уровне мРНК или белка в этих исследованиях не была показана.
Снижение экспрессии мРНК LNX1 было отмечено в глиомах по сравнению со здоровой тканью головного мозга [71], хотя это может отражать тот факт, что мРНК LNX1 и LNX2 экспрессируются преимущественно в нейронах [20] и, как таковые, присутствуют. на более низких уровнях в глиомах, происходящих из глии. Напротив, другие сообщения демонстрируют амплификацию хромосомной области (4q12), содержащей ген LNX1 в опухолях головного мозга и ксенотрансплантатах остеосаркомы [72–74]. Следует отметить, однако, что эта область содержит ряд генов, кодирующих рецепторную тирозинкиназу, потенциально способствующую развитию рака (c- KIT, PDGFR-α и VEGFR2 ), и поэтому амплификация LNX1 может быть случайной. Сообщалось о нескольких случаях специфической амплификации LNX1 [73] и обнаружении некоторых миссенс-мутаций LNX1 [72], однако сверхэкспрессия LNX1 на уровне мРНК или белка в этих исследованиях не была показана. Чжэн и др. (2011) [60] подчеркнули потенциальную роль LNX1 как регулятора клеточного цикла. Нокдаун 9Экспрессия мРНК 0921 LNX1 в клетках НЕК с использованием миРНК приводила к остановке клеточного цикла и вызывала изменения уровней экспрессии нескольких генов, связанных с раком. Ни и др. [53] сообщили, что сверхэкспрессия LNX1 может способствовать индуцированной TGF-β EMT в культивируемых эпителиальных клетках, активность, которая не требует активности убиквитинлигазы LNX1 E3. Это представляет собой еще один потенциальный механизм, с помощью которого LNX1 может способствовать образованию опухолей. Однако в отсутствие данных, демонстрирующих повышенную экспрессию LNX1 мРНК и, в частности, белок LNX1 в опухолях, вопрос о том, действительно ли LNX1 способствует раковому фенотипу in vivo , остается неясным, и необходимы дополнительные доказательства, чтобы продемонстрировать убедительную причинную роль LNX1 в опухолях головного мозга.
Чжэн и др. (2011) [60] подчеркнули потенциальную роль LNX1 как регулятора клеточного цикла. Нокдаун 9Экспрессия мРНК 0921 LNX1 в клетках НЕК с использованием миРНК приводила к остановке клеточного цикла и вызывала изменения уровней экспрессии нескольких генов, связанных с раком. Ни и др. [53] сообщили, что сверхэкспрессия LNX1 может способствовать индуцированной TGF-β EMT в культивируемых эпителиальных клетках, активность, которая не требует активности убиквитинлигазы LNX1 E3. Это представляет собой еще один потенциальный механизм, с помощью которого LNX1 может способствовать образованию опухолей. Однако в отсутствие данных, демонстрирующих повышенную экспрессию LNX1 мРНК и, в частности, белок LNX1 в опухолях, вопрос о том, действительно ли LNX1 способствует раковому фенотипу in vivo , остается неясным, и необходимы дополнительные доказательства, чтобы продемонстрировать убедительную причинную роль LNX1 в опухолях головного мозга.
 Точно так же уровни NOTCH и лиганда NOTCH JAG1, а также нескольких генов-мишеней NOTCH были значительно снижены. Таким образом, LNX2 обладает способностью одновременно регулировать два сигнальных пути, которые, как известно, играют решающую роль в онкогенезе CRC. Неожиданно снижение уровня белка NUMB наблюдалось при нокдауне LNX2 — противоположное тому, что можно было бы ожидать от NUMB в качестве субстрата для LNX2-опосредованного убиквитинирования и ингибитора передачи сигналов NOTCH. Таким образом, наблюдаемые изменения в передаче сигналов NOTCH нельзя объяснить просто тем, что LNX2 модулирует уровни NUMB. Тем не менее, результаты предполагают надежную модель, согласно которой избыточная экспрессия LNX2 является следствием 9Амплификация гена 0921 LNX2 способствует передаче сигналов NOTCH и WNT/β-катенина, что стимулирует пролиферацию клеток и предотвращает апоптоз в клетках CRC [34].
Точно так же уровни NOTCH и лиганда NOTCH JAG1, а также нескольких генов-мишеней NOTCH были значительно снижены. Таким образом, LNX2 обладает способностью одновременно регулировать два сигнальных пути, которые, как известно, играют решающую роль в онкогенезе CRC. Неожиданно снижение уровня белка NUMB наблюдалось при нокдауне LNX2 — противоположное тому, что можно было бы ожидать от NUMB в качестве субстрата для LNX2-опосредованного убиквитинирования и ингибитора передачи сигналов NOTCH. Таким образом, наблюдаемые изменения в передаче сигналов NOTCH нельзя объяснить просто тем, что LNX2 модулирует уровни NUMB. Тем не менее, результаты предполагают надежную модель, согласно которой избыточная экспрессия LNX2 является следствием 9Амплификация гена 0921 LNX2 способствует передаче сигналов NOTCH и WNT/β-катенина, что стимулирует пролиферацию клеток и предотвращает апоптоз в клетках CRC [34]. В более позднем исследовании LNX1 также был вовлечен в CRC [35]. Здесь авторы наблюдали, что мРНК и белок LNX1 подавлялись в популяции предполагаемых раковых стволовых клеток (клетки боковой популяции), выделенных из клеточной линии CRC HT29. Предполагается, что раковые стволовые клетки в опухолях дают клетки с высокопролиферативным и инвазивным фенотипом. 9Нокдаун 0921 LNX1 увеличивал количество раковых стволовых клеток и приводил к образованию большего количества колоносфер в анализах с крайне ограниченным разведением, а также большему количеству опухолей у мышей, которым вводили LNX1 нокдаун клеток HT29. Это предполагает, что LNX1 является негативным регулятором стволовости рака при CRC. В поисках механизма этого эффекта авторы исследовали белки, взаимодействующие с LNX1, и обнаружили, что нокдаун CAR, известного лиганда LNX1 [52], вызывает уменьшение количества раковых стволовых клеток в той же системе. Нокдаун LNX1 приводит к повышению уровня белка CAR, что позволяет предположить, что CAR может быть вовлечен в опосредование эффекта LNX1 на стволовость рака, хотя механизм, с помощью которого LNX1 регулирует уровни CAR, и участвует ли он в LNX1-опосредованном убиквитинировании CAR, не изучался.
Предполагается, что раковые стволовые клетки в опухолях дают клетки с высокопролиферативным и инвазивным фенотипом. 9Нокдаун 0921 LNX1 увеличивал количество раковых стволовых клеток и приводил к образованию большего количества колоносфер в анализах с крайне ограниченным разведением, а также большему количеству опухолей у мышей, которым вводили LNX1 нокдаун клеток HT29. Это предполагает, что LNX1 является негативным регулятором стволовости рака при CRC. В поисках механизма этого эффекта авторы исследовали белки, взаимодействующие с LNX1, и обнаружили, что нокдаун CAR, известного лиганда LNX1 [52], вызывает уменьшение количества раковых стволовых клеток в той же системе. Нокдаун LNX1 приводит к повышению уровня белка CAR, что позволяет предположить, что CAR может быть вовлечен в опосредование эффекта LNX1 на стволовость рака, хотя механизм, с помощью которого LNX1 регулирует уровни CAR, и участвует ли он в LNX1-опосредованном убиквитинировании CAR, не изучался. Наконец, это исследование показало, что тамоксифен увеличивает экспрессию генов LNX1 и может ингибировать образование колоносферы в клетках HT29. В целом эти результаты свидетельствуют о том, что LNX1 может действовать как супрессор опухоли и что активация экспрессии LNX1 может представлять собой новую терапевтическую стратегию для негативной регуляции стволовости рака при CRC.
Наконец, это исследование показало, что тамоксифен увеличивает экспрессию генов LNX1 и может ингибировать образование колоносферы в клетках HT29. В целом эти результаты свидетельствуют о том, что LNX1 может действовать как супрессор опухоли и что активация экспрессии LNX1 может представлять собой новую терапевтическую стратегию для негативной регуляции стволовости рака при CRC.
Интересно, что в предыдущем исследовании раковых стволовых клеток при глиобластоме сообщалось, что мРНК LNX1 активируется в CD133- по сравнению со стволовыми клетками CD133+, что позволяет предположить, что участие LNX1 в формировании стволовых клеток рака может быть неспецифическим для CRC [75]. . Кроме того, GWAS идентифицировал однонуклеотидный полиморфизм (SNP) в промоторной области LNX2 , который был связан с повышенной восприимчивостью к диффузной крупноклеточной В-клеточной лимфоме [76], а другой GWAS связал SNP в гена LNX2 к дифференциальному ответу лимфобластоидных клеток на химиотерапевтический препарат цитозинарабинозид [43].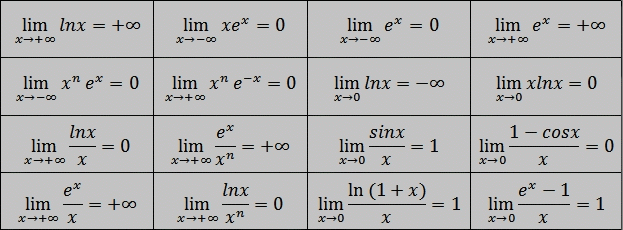 Эти исследования намекают на возможную роль LNX2 в гематологических опухолях.
Эти исследования намекают на возможную роль LNX2 в гематологических опухолях.
» data-legacyid=»sec8-1-3″> Ассоциации генов LNX1/2 при различных заболеваниях
Дифференциальная экспрессия LNX2 Экспрессия мРНК в плацентарной ткани связана с преэклампсией во время беременности [79], в то время как исследование ассоциации в масштабах всего эпигенома выявило сайт CpG в пределах 9Ген 0921 LNX2 гипометилирован у курильщиков [80]. Функциональное значение этих результатов еще предстоит установить.
Два десятилетия исследований выявили множество потенциальных функций белков LNX1/2, в основном основанных на их способности взаимодействовать со многими партнерами по связыванию (рис. 2 и таблица 1). Однако физиологическое значение большинства этих предполагаемых функций еще предстоит подтвердить in vivo (за заметным исключением исследований белков Lnx1/2 рыбок данио). Хотя наше понимание некоторых основных аспектов работы LNX1/2 все еще неполное, оно улучшается. В настоящее время установлено, что уровни белка LNX1/2 жестко регулируются. Мы начинаем понимать дифференциальные функции LNX1, LNX2 и LNX2b, а также нейрональные и ненейрональные изоформы LNX1. В последние несколько лет появилось фантастическое структурное понимание механизмов активности убиквитинлигазы LNX1/2. Интерактом LNX1/2 был тщательно исследован с использованием множества взаимодополняющих подходов. Были опубликованы анализы потери функции белков LNX1/2 млекопитающих как на клеточных, так и на мышиных моделях. Многие части головоломки встают на свои места.
2 и таблица 1). Однако физиологическое значение большинства этих предполагаемых функций еще предстоит подтвердить in vivo (за заметным исключением исследований белков Lnx1/2 рыбок данио). Хотя наше понимание некоторых основных аспектов работы LNX1/2 все еще неполное, оно улучшается. В настоящее время установлено, что уровни белка LNX1/2 жестко регулируются. Мы начинаем понимать дифференциальные функции LNX1, LNX2 и LNX2b, а также нейрональные и ненейрональные изоформы LNX1. В последние несколько лет появилось фантастическое структурное понимание механизмов активности убиквитинлигазы LNX1/2. Интерактом LNX1/2 был тщательно исследован с использованием множества взаимодополняющих подходов. Были опубликованы анализы потери функции белков LNX1/2 млекопитающих как на клеточных, так и на мышиных моделях. Многие части головоломки встают на свои места.
Вооружившись этими знаниями и новыми доступными исследовательскими инструментами, исследователи в этой области могут с оптимизмом смотреть на то, как собрать воедино больше кусочков этой головоломки. Доступные в настоящее время и недавно созданные мыши с нокаутом LNX1 и LNX2 могут быть использованы для изучения значения предполагаемых функций белков LNX1/2 in vivo. Молекулярная основа тонких фенотипов, уже наблюдаемых у мышей, лишенных белков LNX1 и LNX2 в ЦНС, может быть проанализирована более точно. Поколение мышей, лишенных как LNX1, так и LNX2 во всех тканях, прояснит предполагаемую роль белков LNX1/2 в иммунной функции и костном гомеостазе и позволит изучить роль белков LNX1/2 в дифференцировке поджелудочной железы у млекопитающих. Дальнейшие структурные исследования, как мы надеемся, выявят структуры полноразмерных белков LNX1/2 и/или структуры комплексов LNX: субстрат. Также потребуются трансляционные исследования, чтобы выявить ассоциации белков LNX1/2 с заболеваниями, особенно при CRC, где участвуют как LNX1, так и LNX2. Эти исследования определят, стоит ли рассматривать белки LNX1/2 в качестве потенциальных мишеней для лекарственных средств, особенно по мере разработки методов ингибирования как убиквитинлигазы E3, так и взаимодействия домена PDZ с малыми молекулами [81–83].
Доступные в настоящее время и недавно созданные мыши с нокаутом LNX1 и LNX2 могут быть использованы для изучения значения предполагаемых функций белков LNX1/2 in vivo. Молекулярная основа тонких фенотипов, уже наблюдаемых у мышей, лишенных белков LNX1 и LNX2 в ЦНС, может быть проанализирована более точно. Поколение мышей, лишенных как LNX1, так и LNX2 во всех тканях, прояснит предполагаемую роль белков LNX1/2 в иммунной функции и костном гомеостазе и позволит изучить роль белков LNX1/2 в дифференцировке поджелудочной железы у млекопитающих. Дальнейшие структурные исследования, как мы надеемся, выявят структуры полноразмерных белков LNX1/2 и/или структуры комплексов LNX: субстрат. Также потребуются трансляционные исследования, чтобы выявить ассоциации белков LNX1/2 с заболеваниями, особенно при CRC, где участвуют как LNX1, так и LNX2. Эти исследования определят, стоит ли рассматривать белки LNX1/2 в качестве потенциальных мишеней для лекарственных средств, особенно по мере разработки методов ингибирования как убиквитинлигазы E3, так и взаимодействия домена PDZ с малыми молекулами [81–83].
Автор заявляет об отсутствии конкурирующих интересов, связанных с рукописью.
BCR
breakpoint cluster region protein
BOZ
Bozozok
CAR
coxsackievirus and adenovirus receptor
CASPR4
contactin-associated protein-4
CNS
центральная нервная система
CRC
colorectal cancer
DKO
double knockout
EMT
epithelial to mesenchyme transition
GWAS
genome-wide association study
JAM
junctional adhesion molecule
JNK
c-Jun N-концевая киназа
LNX
лиганд белка X NUMB
M-CSF
колониестимулирующий фактор макрофагов0911
MDCK
Madin-Darby Canine Kidney cells
MUPP1
multiple PDZ domain containing protein-1
NF-κB
nuclear factor kappa B
PBK
PDZ-binding kinase
PDB
Protein Data Bank
PDZ
PSD95, DLGA, ZO-1
PDZRN
PDZ and RING
PTB
phosphotyrosine binding
RANKL
receptor activator of nuclear factor kappa B ligand
RING
really interesting new gene
SKIP
Ski interacting protein
SHC
Src гомология 2 домен-содержащий
SNP
однонуклеотидный полиморфизм
СВЗ
субвентрикулярная зона
TGF-β
fransforming growth factor β
ZnF
zinc finger motif
1
Flynn
M.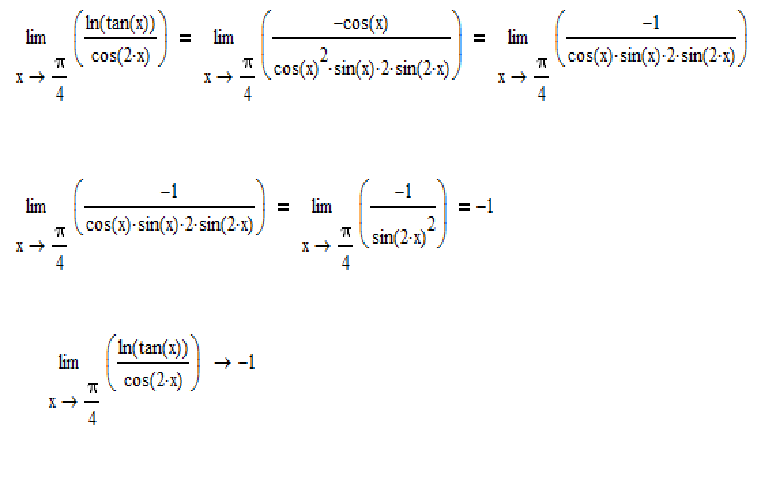
,
Saha
O.
and
Young
P.
(
2011
)
Молекулярная эволюция семейства генов LNX
.
BMC Evol. биол.
11
,
235
https://doi.org/10.1186/1471-2148-11-235
[В паблике]
2
de bie
P.
и
Ciechanover
A.
(
2011
)
aRegINITINIT механизмы
.
Гибель клеток Отличие.
18
,
1393
–
1402
https://doi.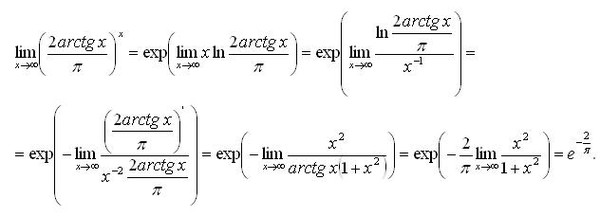 org/10.1038/cdd.2011.16
org/10.1038/cdd.2011.16
[В паблике]
3
Дхо
ЮВ
,
Джейкоб
С.
,
Вольтинг
К.Д.
,
Французский
М.Б.
,
Роршнайдер
Л.Р.
и
McGlade
CJ
(
1998
)
Онемевший фосфотирозин-связывающий домен млекопитающих. Характеристика специфичности связывания и идентификация нового белка связывания numb, содержащего домен PDZ, LNX
.
J. Biol. хим.
273
,
9179
–
9187
https://doi.org/10.1074/jbc. 273.15.9179
273.15.9179
[В паблике]
4
Наяк
Д.
и
Sivaraman
J.
(
2015
)
Структурная основа незаменимой роли уникального мотива цинкового пальца в повсеместном распространении LNX2
11 .Онкотарджет
6
,
34342
–
34357
https://doi.org/10.18632/oncotarget.5326
[В паблике]
5
Наяк
Д.
и
Sivaraman
J.
(
2018
)
Структура LNX1: UBC13249991111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111111119НИНСКИЙ ЭКСПОРТИТЕЛЬ111111111111111111911 гг. Раскрывает роль дополнительных мотива для E3 LIGASE LIGASE.
Раскрывает роль дополнительных мотива для E3 LIGASE LIGASE.
Дж. Мол. биол.
430
,
1173
–
1188
https://doi.org/10.1016/j.jmb.2018.02.016
[В паблике]
6
Рис
Д.С.
,
Норткатт
Г.М.
и
Kurschner
C.
(
2001
)
Белки семейства Lnx функционируют как молекулярные каркасы для белков семейства Numb
912.Мол. Клетка. Неврологи.
18
,
525
–
540
https://doi.org/10.1006/mcne.2001.1024
[В паблике]
7
Duret
L.
,
Chureau
C.
,
Samain
S.
,
Weissenbach
J.
and
Avner
P.
(
2006
)
Ген РНК Xist развился у плацентарных путем псевдогенизации гена, кодирующего белок
.
Наука
312
,
1653
–
1655
https://doi.org/10.1126/science.1126316
[В паблике]
8
Мукерджи
М.
,
Чоу
С.Я.
,
Yusoff
P.
,
Seetharaman
J.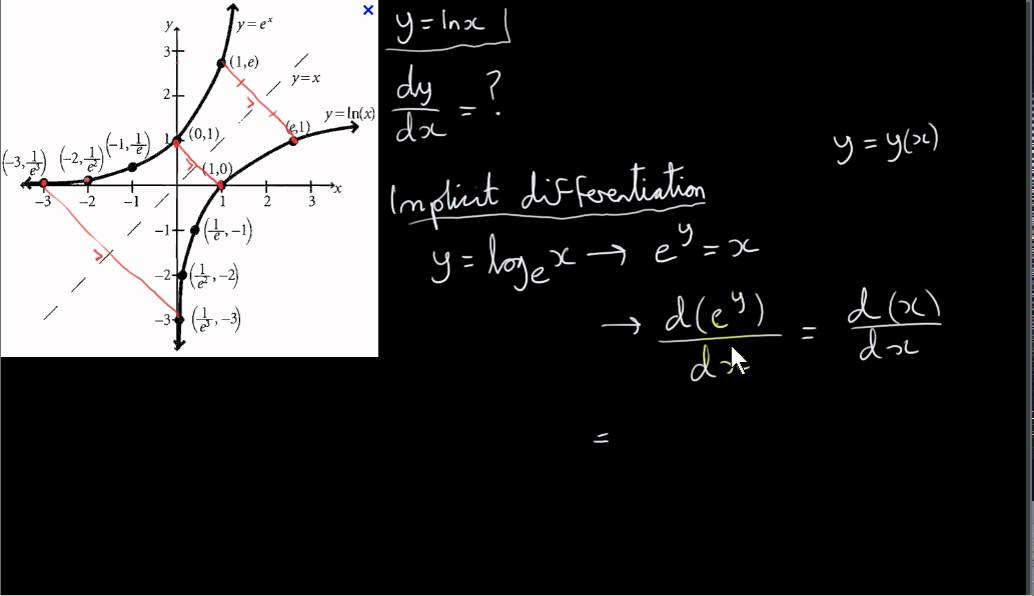
,
,
Sinniah
S.
et al
(
2012
)
Структура нового связывающего фосфотирозин домена в Hakai, нацеленного на Е-кадгерин
.
EMBO J.
31
,
1308
–
1319
https://doi.org/10.1038/emboj.2011.496
[В паблике]
9
,
Песня
Е.
,
,
Ван
Х.
9 , 19094, 9124
Shao
C.
et al
(
2012
)
Стратегия протеомики для идентификации субстратов LNX, убиквитинлигазы Е3, содержащей домен PDZ 92 191 90 90
J. Proteome Res.
Proteome Res.
11
,
4847
–
4862
https://doi.org/10.1021/pr300674c
[В паблике]
10
,
Ли
Нержавеющая сталь
и
McGlade
CJ
(
2004
)
Новое взаимодействие доменов PTB-PDZ опосредует убиквитинирование изоформы 9291 Numb у млекопитающих.
J. Biol. хим.
279
,
20807
–
20815
https://doi.org/10.1074/jbc.M3113
[В паблике]
11
,
Макгилл
Массачусетс
,
Дермер
М.
,
Дхо
ЮВ
,
Вольтинг
К.Д.
и
MCGLADE
C.J.
(
2002
)
LNX FUNCTIONS в качестве DEBITININATION LIGASE
.
EMBO J.
21
,
93
–
102
https://doi.org/10.1093/emboj/21.1.93
[В паблике]
12
Хекстра
Д.Р.
,
Белый
К.И.
,
Socolich
M.A.
,
Henning
R.W.
,
Srajer
V.
and
Ranganathan
R.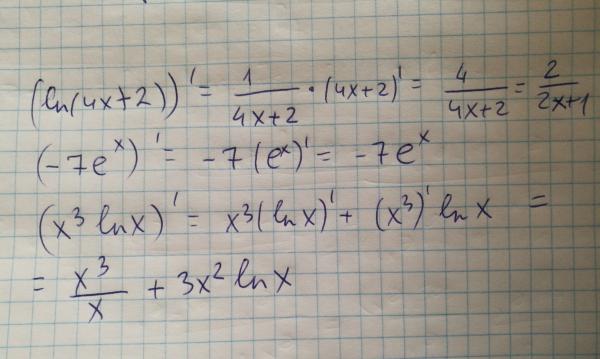
(
2016
)
Белковая механика, стимулируемая электрическим полем
.
Природа
540
,
400
–
405
https://doi.org/10.1038/nature20571
[В паблике]
13
Ленихан
Дж.А.
,
Саха
О.
,
Хаймер-МакГинн
В.
,
Крайан
Дж. Ф.
,
Фэн
Г.
и
Янг
П.В.
(
2017
)
Снижение поведения, связанного с тревогой, но, по-видимому, невозмущенная функция NUMB у лиганда белка NUMB-X (LNX) 1/2 мышей с двойным нокаутом
.
Мол. Нейробиол.
54
,
8090
–
8109
https://doi.org/10.1007/s12035-016-0261-0
[В паблике]
14
Ленихан
Дж.А.
,
Саха
О.
и
Янг
П.В.
(
2017
)
Протеомный анализ выявил новые лиганды и субстраты для убиквитинлигазы LNX1 E3
.
PLoS ONE
12
,
e0187352
https://doi.org/10.1371/journal.pone.0187352
[В паблике]
15
Song
E.
,
,
Tian
R.
,
,
Huang
H.
,
et al
(
2006
)
Высокоэффективная стратегия для определения свойств связывания пептидсвязывающих доменов
.
Мол. Клетка. Протеомика
5
,
1368
–
1381
https://doi.org/10.1074/mcp.M600072-MCP200
[В паблике]
16
BEZPROSVANNY
I.
и
Maximov
A.
(
2001
)
90 ФЭБС Письмо.
509
,
457
–
462
https://doi.org/10.1016/S0014-5793(01)03214-8
[В паблике]
17
,
,
,
и
(
2014
)
.
PLoS ONE
9
,
e88286
https://doi.org/10.1371/journal.pone.0088286
[В паблике]
18
Вольтинг
К.Д.
,
Гриффитс
Е.К.
,
Сарао
Р.
,
Прево
до н. э.
э.
,
Wybenga-Groot
L.E.
и
McGlade
CJ
(
2011
)
Биохимический и компьютерный анализ белков, взаимодействующих с LNX1
.
PLoS ONE
6
,
e26248
https://doi.org/10.1371/journal.pone.0026248
[В паблике]
19
,
Zhao
W.
,
Wang
W.
,
Zhao
S.
,
Tang
R.
,
Ying
К.
и др.
(
2001
)
Идентификация белка LNX человека, содержащего несколько доменов PDZ
.
Биохим. Жене.
39
,
117
–
126
https://doi.org/10.1023/A:10102698
[В паблике]
20
Ленихан
Дж.А.
,
Саха
О.
,
Мэнсфилд
LM
и
Young
P.W.
(
2014
)
Жесткий, специфичный для типа клеток контроль экспрессии LNX в нервной системе на уровне транскрипции, трансляции и стабильности белка
.
Гена
552
,
39
–
50
https://doi.org/10.1016/j.gene.2014.09.011
[В паблике]
21
Бейли
М.Дж.
,
Кун
С.Л.
,
Картер
Д.А.
,
Хамфрис
А.
,
Ким
Дж.С.
,
и др.
(
2009
)
Ночные/дневные изменения экспрессии >600 генов в пинеальной железе: центральная роль передачи сигналов адренергического/цАМФ
.
J. Biol. хим.
284
,
7606
–
7622
https://doi. org/10.1074/jbc.M8083
org/10.1074/jbc.M8083
[В паблике]
22
Vriend
J.
,
и
Reiter
R.J.
(
2017
)
Шишковидная железа: модель адренергической модуляции убиквитинлигазы
.
ПЛОС ОДИН
12
,
e0172441
https://doi.org/10.1371/journal.pone.0172441
[В паблике]
23
Pallafacchina
G.
,
Francois
S.
,
Regnault
B.
,
Czarny
B.
,
Dive
V.
,
Кумано
А.
и др.
(
2010
)
Взрослая тканеспецифичная стволовая клетка в своей нише: анализ профиля генов покоящихся и активированных мышечных сателлитных клеток in vivo
.
Рез. стволовых клеток.
4
,
77
–
91
https://doi.org/10.1016/j.scr.2009.10.003
[В паблике]
24
Кахой
JD
,
Эмери
Б.
,
Каушал
А.
,
Фу
Л.К.
,
Заманян
Дж. Л.
Л.
,
Кристоферсон
К.С.
и др.
(
2008
)
База данных транскриптомов астроцитов, нейронов и олигодендроцитов: новый ресурс для понимания развития и функционирования мозга
.
Дж. Неврологи.
28
,
264
–
278
https://doi.org/10.1523/JNEUROSCI.4178-07.2008
[В паблике]
25
Akinci
M.A.
,
Turner
H.
,
Taveras
M.
and
Wolosin
J.M.
(
2009
)
Differential экспрессия генов в лимбальной популяции свиней: значение для цикла стволовых клеток, репликации и выживания
.
Инвест. Офтальмол. Вис. науч.
50
,
5630
–
5638
https://doi.org/10.1167/iovs.09-3791
[В паблике]
26
Кон
К.В.
,
Зееберг
Б.М.
,
Райнхольд
У.К.
и
Поммье
Y.
(
2014
)
Корреляции экспрессии генов в линиях раковых клеток человека определяют сети молекулярных взаимодействий для эпителиального фенотипа
.
PLoS ONE
9
,
e
https://doi.org/10.1371/journal.pone.00
[В паблике]
27
Прегайзер
С.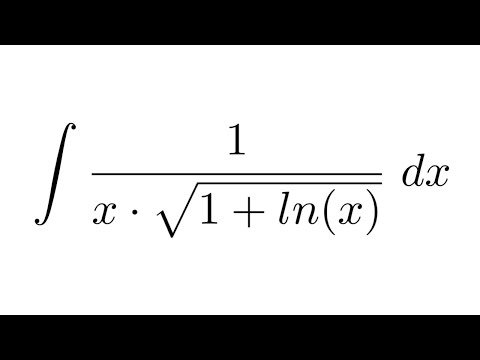
,
Барски
А.
,
Герсбах
К.А.
,
Гарсия
А.Дж.
и
Frenkel
B.
(
2007
)
Идентификация новых мишеней Runx2 в остеобластах: клеточная специфичность BMP-зависимая регуляция
190 Tram2Дж. Сотовый. Биохим.
102
,
1458
–
1471
https://doi.org/10.1002/jcb.21366
[В паблике]
28
Ван
Х.
,
Кейн
А.В.
,
и
(
2014
)
Репрессор Gli3 контролирует судьбы клеток и клеточную адгезию для правильного формирования нейрогенной ниши
.
Товарный номер ячейки
8
,
1093
–
1104
https://doi.org/10.1016/j.celrep.2014.07.006
[В паблике]
29
Д’Агостино
М.
,
Торнильо
Г.
,
Капорасо 9.G.09011
,
Бароне
М.В.
,
Ghigo
E.
,
Bonatti
S.
et al
(
2011
)
Ligand of Numb proteins LNX1p80 and LNX2 interact with the human glycoprotein CD8alpha and promote его убиквитилирование и эндоцитоз
.
J. Cell Sci.
124
,
3545
–
3556
https://doi.org/10.1242/jcs.081224
[В паблике]
30
Mirza
M.
,
Raschperger
E.
,
Philipson
L.
,
Pettersson
R.F.
и
Соллербрант
K.
(
2005
)
Рецептор белка Коксаки и аденовируса (CAR) на клеточной поверхности напрямую связан с белком-лигандом Numb Protein-X2 (LNX2)
.
Расшир. Сотовый рез.
309
,
110
–
120
https://doi.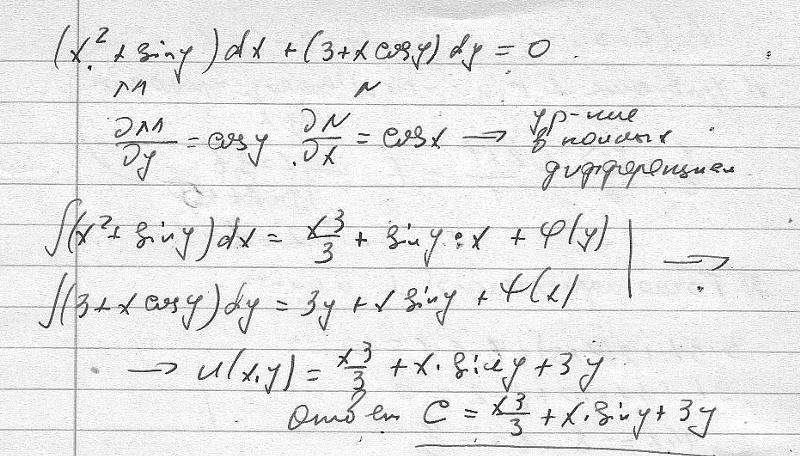 org/10.1016/j.yexcr.2005.05.023
org/10.1016/j.yexcr.2005.05.023
[В паблике]
31
Вайс
А.
,
Baumgartner
M.
,
Radziwill
G.
,
Dennler
J.
and
Moelling
K.
(
2007
)
c-Src является партнером по взаимодействию с PDZ и субстратом убиквитинлигазы E3 Ligand-of-Numb, белка X1
.
ФЭБС Письмо.
581
,
5131
–
5136
https://doi.org/10.1016/j.febslet.2007.09.062
[В паблике]
32
,
и
Давид
И.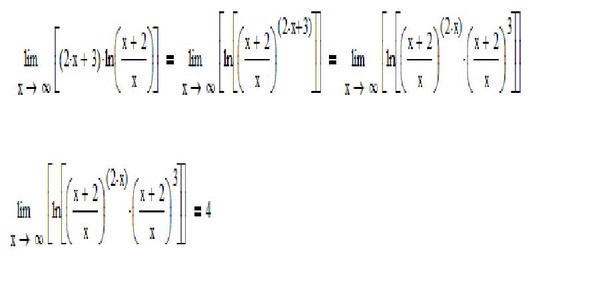 Б.
Б.
(
2015
)
Убиквитинлигаза Lnx2 необходима для дифференцировки экзокринных клеток в ранней поджелудочной железе рыбок данио
.
Проц. Натл. акад. науч. США
112
,
12426
–
12431
https://doi.org/10.1073/pnas.1517033112
33
Young
P.
,
,
Wang
X.
,
McGlade
C.J.
,
Рич
М.М.
и
Feng
G.
(
2005
)0911
.
Мол. Клетка. Неврологи.
30
,
238
–
248
https://doi.org/10.1016/j.mcn.2005.07.015
[В паблике]
34
Лагеря
Дж.
,
Питт
Дж.Дж.
,
Эмонс
Г.
,
Хаммон
А.Б.
,
Кейс
C.M.
,
Grade
M.
и др.
(
2013
)
Genetic Amplifition Modulator LNX2.
Рак Res.
73
,
2003
–
2013
https://doi.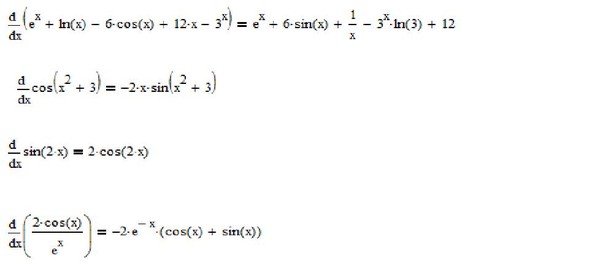 org/10.1158/0008-5472.CAN-12-3159
org/10.1158/0008-5472.CAN-12-3159
[В паблике]
35
,
Wang
L.
,
Shan
Y.
,
Nafees
M.
,
Ihab
E.
,
Zhang
R
и др.
(
2017
)
Подавление стволовости рака путем активизации белка Ligand-of-Numb X1 при колоректальной карциноме
.
ПЛОС ОДИН
12
,
e0188665
https://doi.org/10.1371/journal.pone.0188665
[В паблике]
36
Мирза
M.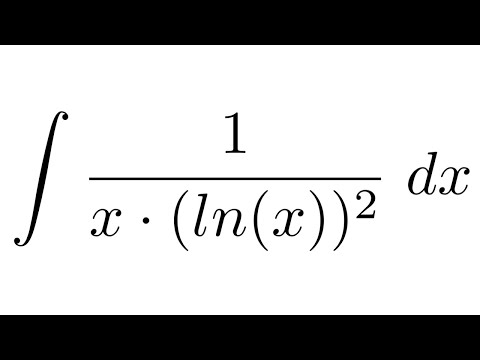
,
Hreinsson
J.
,
Strand
M.L.9006
,
Hovatta
O.
,
SODER
O.
,
Philipson
L.
11 и аль.0911
2006
)
Рецептор вируса Коксаки и аденовируса (CAR) экспрессируется в мужских половых клетках и образует комплекс с фактором дифференцировки JAM-C в семенниках мышей
.
Расшир. Сотовый рез.
312
,
817
–
830
https://doi.org/10.1016/j.yexcr.2005.11.030
[В паблике]
37
Ветмар
К.
,
Сминка
Дж. Дж.
Дж.
и
Leutz
A.
(
2010
)
Открытые рамки считывания вверх по течению: молекулярные переключатели в (пато)физиологии
.
Биоэссе
32
,
885
–
893
https://doi.org/10.1002/bies.201000037
[В паблике]
38
Чен
G.
,
,
Shen
Z.
,
Peng
L.
,
,
Zang
R.
et al
(
2017
)
МикроРНК-939 ингибирует пролиферацию клеток путем нацеливания на LRSAM1 при болезни Гиршпрунга
.
Старение (Олбани, штат Нью-Йорк)
9
,
2471
–
2479
[В паблике]
39
Kansaku
A.
,
Hirabayashi
S.
,
Mori
H.
,
Fujiwara
N.
,
Kawata
A.
,
Ikeda
M.
и др.
(
2006
)0911
.
Онкоген
25
,
5071
–
5084
https://doi.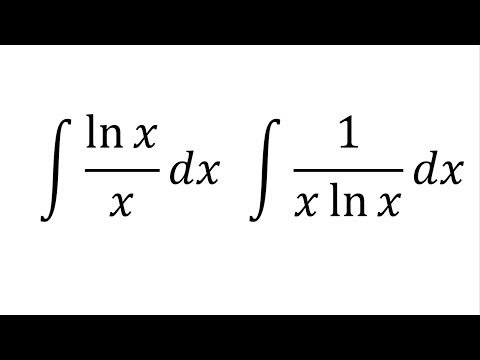 org/10.1038/sj.onc.1209468
org/10.1038/sj.onc.1209468
[В паблике]
40
Дхо
ЮВ
,
Французский
М.Б.
,
Woods
S.A.
и
McGlade
CJ
(
1999 9 2911 911
Характеристика четырех изоформ онемевшего белка млекопитающих. Идентификация цитоплазматических и ассоциированных с мембраной вариантов фосфотирозинсвязывающего домена
.
J. Biol. хим.
274
,
33097
–
33104
https://doi.org/10.1074/jbc.274.46.33097
[В паблике]
41
Кандачар
В.
и
Рогирс
F.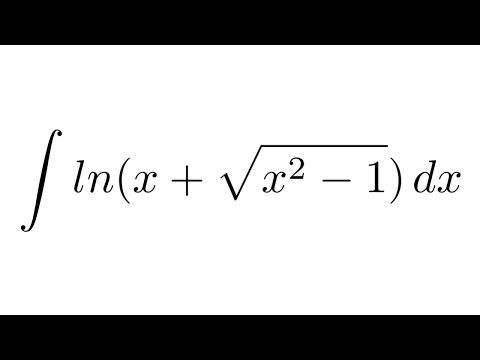
(
2012
)
Эндоцитоз и контроль передачи сигналов Notch
.
Текущ. мнение Клеточная биол.
24
,
534
–
540
https://doi.org/10.1016/j.ceb.2012.06.006
[В паблике]
42
Чжоу
Дж.
,
Фудзивара
Т.
,
,
and
Zhao
H.
(
2015
)
Ubiquitin E3 ligase LNX2 is critical for osteoclastogenesis in vitro by regulating M-CSF/RANKL signaling and Notch3
.
Кальцин. Ткань внутр.
96
,
465
–
475
https://doi.org/10.1007/s00223-015-9967-7
[В паблике]
43
,
Фридли
Б.Л.
,
Kalari
K.
,
,
Jenkins
G.
,
Batzler
A.
et al
(
2014
)
Discovery of генетические биомаркеры, влияющие на вариабельность лекарственной реакции аналогов цитидина с использованием линий лимфобластоидных клеток человека
.
BMC Genomics
15
,
93
https://doi. org/10.1186/1471-2164-15-93
org/10.1186/1471-2164-15-93
[В паблике]
44
Gulino
A.
,
Di Marcotullio
L.
and
Screpanti
I.
(
2010
)
The multiple functions of Numb
.
Расшир. Сотовый рез.
316
,
900
–
906
https://doi.org/10.1016/j.yexcr.2009.11.017
[В паблике]
45
Инь
Ф.Т.
,
Футагава
Т.
,
,
Ма
Y.X.
,
Лу
М.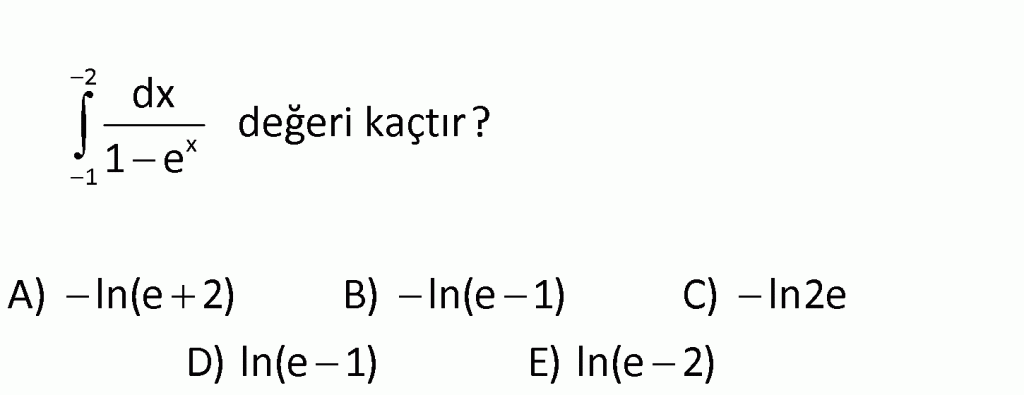 Х.
Х.
,
и др.
(
2015
)
Взаимодействие Caspr4 с LNX2 модулирует пролиферацию и дифференцировку нейронов нейронных клеток-предшественников мыши
.
Стволовые клетки Dev.
24
,
640
–
652
https://doi.org/10.1089/scd.2014.0261
[В паблике]
46
Sapir
T.
,
Levy
T.
,
Kozer
N.
,
Shin
I.
,
Zamor
V.
,
Haffner-Krausz
R.
et al
(
2017
)
Активация Notch за счет действия стрелкового 1 19 19 90 убиквитина, противостоящего 2 убиквитину
Церебр. Кортекс
,
https://doi.org/10.1093/cercor/bhx180
47
Engin
F.
and
(
2010
)
NOTCHing the bone: insights into multi-functionality
.
Кость
46
,
274
–
280
https://doi.org/10.1016/j.bone.2009.05.027
[В паблике]
48
REGAN
J.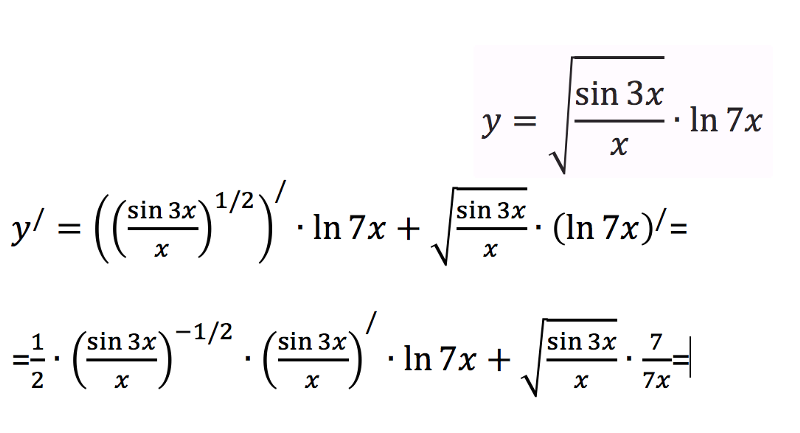
и
LONG
F.
(
2013
)
NOTCH NOTCH. NOTCH NOTCH NOTCH. NOTCH NOTCH.
Текущ. Остеопорос. Респ.
11
,
126
–
129
https://doi.org/10.1007/s11914-013-0145-4
[В паблике]
49
Rual
J.F.
,
Venkatesan
K.
,
,
Hirozane-Kishikawa
T.
,
Dricot
A.
,
et ал
(
2005
)
На пути к протеомной карте сети межбелковых взаимодействий человека
.
Природа
437
,
1173
–
1178
https://doi.org/10.1038/nature04209
[В паблике]
50
Стиффлер
М.А.
,
Чен
Д.Р.
,
Гранчарова В.П.
,
,
Fuchs
D.
,
Allen
J.E.
et al
(
2007
)
PDZ domain binding selectivity is optimized across the mouse proteome
.
Наука
317
,
364
–
369
https://doi. org/10.1126/science.1144592
org/10.1126/science.1144592
[В паблике]
51
Takahashi
S.
,
Iwamoto
N.
,
Sasaki
H.
,
Ohashi
M.
,
,
Tsukita
S.
и др.
(
2009
)
Убиквитинлигаза E3 LNX1p80 способствует удалению клаудинов из плотных контактов в клетках MDCK
J. Cell Sci.
122
,
985
–
994
https://doi.org/10.1242/jcs.040055
[В паблике]
52
Sollerbrant
K.
,
Raschperger
E.
,
Mirza
M.
,
Engstrom
U.
,
Philipson
L.
,
Юнгдаль
Почтовый индекс
и др.
(
2003
)
Рецептор вируса Коксаки и аденовируса (CAR) образует комплекс с белком-лигандом-белком-X, содержащим домен PDZ (LNX)
9124.J. Biol. хим.
278
,
7439
–
7444
https://doi.org/10.1074/jbc.M205
[В паблике]
53
,
,
,
,
,
Zhou
Q.
и соавт. эпителиально-мезенхимальный переход эпителиальных клеток проксимальных канальцев
.
Биохим. Биофиз. Acta
1792
,
122
–
131
https://doi.org/10.1016/j.bbadis.2008.11.013
[В паблике]
54
Коэн
CJ
,
Ши
Дж.Т.
,
Соленья
Р.Дж.
,
Окегава
Т.
,
Се
Дж.Т.
и
Bergelson
J.M.
(
2001
)
Рецептор вируса Коксаки и аденовируса представляет собой трансмембранный компонент плотного соединения
.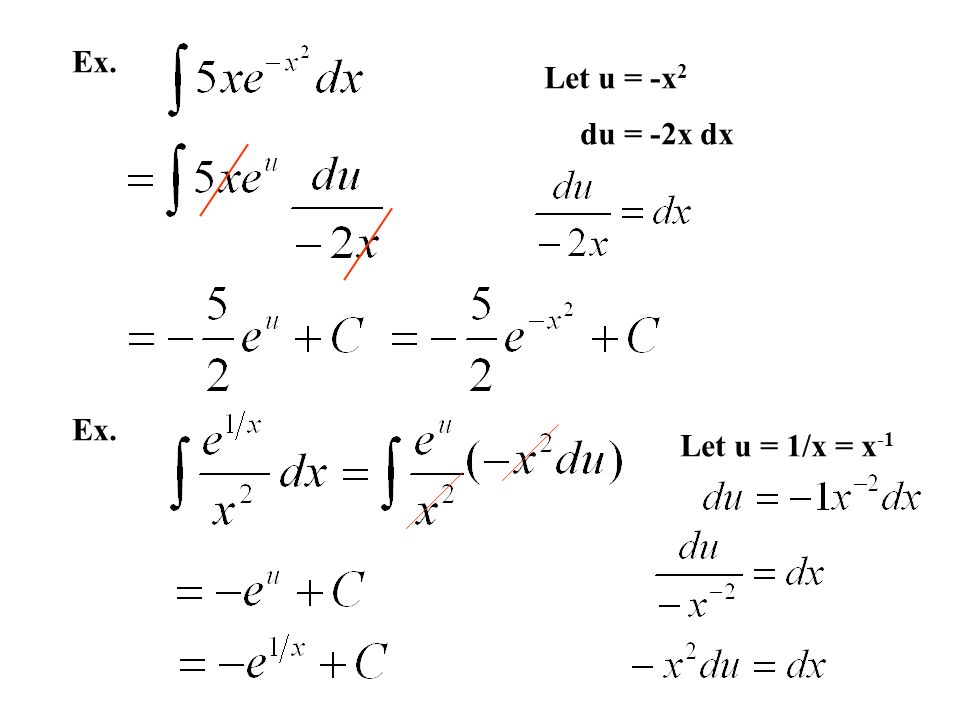
Проц. Натл. акад. науч. США
98
,
15191
–
15196
https://doi.org/10.1073/pnas.261452898
55
Honda
T.
,
Saitoh
H.
,
Masuko
M.
,
Katagiri- Абэ
Т.
,
Томинага
К.
,
Kozakai
I.
и др.
(
2000
)
Коксакивирус-аденовирусный рецепторный белок в качестве молекулы клеточной адгезии в развивающемся мозге мыши 9,24
Мозг Res. Мол. Мозг Res.
77
,
19
–
28
https://doi. org/10.1016/S0169-328X(00)00036-X
org/10.1016/S0169-328X(00)00036-X
[В паблике]
56
Higa
S.
,
Tokoro
T.
,
Inoue
E.
,
Kitajima
I.
and
Ohtsuka
T.
(
2007
)
Белок активной зоны CAST напрямую связывается с белком Ligand-of-Numb X
.
Биохим. Биофиз. Рез. коммун.
354
,
686
–
692
https://doi.org/10.1016/j.bbrc.2007.01.036
[В паблике]
57
Karayannis
T.
,
,
Patel
J. C.
C.
,
Kruglikov
I.
,
Markx
S.
,
Delorme
Р.
и др.
(
2014
)
Cntnap4 по-разному способствует ГАМКергической и дофаминергической синаптической передаче
.
Природа
511
,
236
–
240
https://doi.org/10.1038/nature13248
[В паблике]
58
Armbruester
V.
,
Sauter
M.
,
Roemer
K.
111111111111111111111111111111111111111111111111111111119н. 0906 Best
0906 BestB.
,
HAHN
S.
,
и др.
(
2004
)

 Может быть проблемой, если нет возможности оплатить, хотя можно криптой;
Может быть проблемой, если нет возможности оплатить, хотя можно криптой;