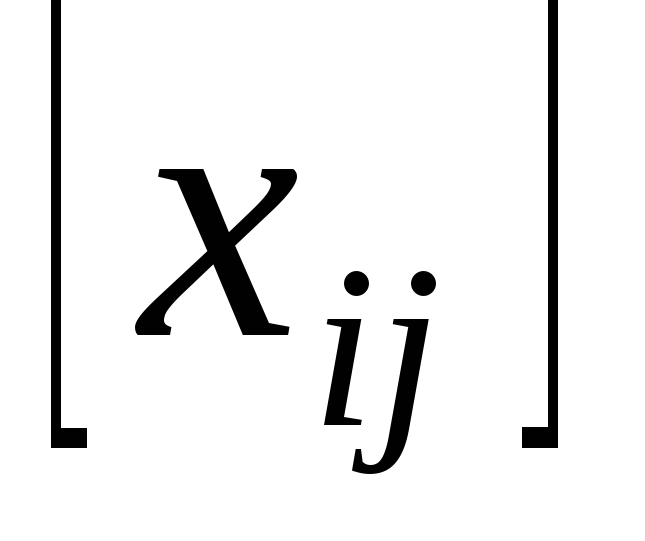Метод Гомори. Решение задач и контрольных работ по линейному программированию онлайн
Краткая теория
Метод Гомори является одним из методов решения задач целочисленного линейного программирования. Идея метода Гомори заключается в следующем.
Отбрасывается условие целочисленности и полученная задача линейного программирования решается симплекс-методом. Если оптимальное решение задачи является целочисленным, то оно является и решением исходной задачи. Если оптимальное решение задачи не является целочисленным, то к основным ограничениям добавляется новое линейное ограничение, обладающее следующими свойствами:
1) оптимальный нецелочисленный план задачи ему не удовлетворяет;
2) любой целочисленный план задачи ему удовлетворяет.
Затем решается расширенная
задача. Процесс повторяется до получения целочисленного решения. Способы
построения дополнительного линейного ограничения различны для полностью и
частично целочисленных задач линейного программирования.
Если задача разрешима в целых числах, то через конечное число итераций оптимальный целочисленный план будет найден.
Если в процессе решения появится строка с нецелым свободным членом и целыми остальными коэффициентами, то соответствующее уравнение не имеет решения в целых числах. В таком случае и исходная задача неразрешима в целых числах.
Несмотря на точность метода Гомори, он имеет ограниченное применение. С его помощью целесообразно решать задачи небольшой размерности, поскольку число итераций может быть очень большим.
Алгоритм метода Гомори рассмотрим на конкретном примере.
Пример решения задачи
Решить задачу целочисленного программирования методом Гомори.
– целые
Решение
Приведем задачу к каноническому виду.
Решаем задачу симплекс-методом.
Заполняем симплексную таблицу 0-й итерации.
| БП |
Симплексные отношения |
|||||||
| 7 | -9 | 0 | 0 | |||||
| 0 | 9 | 2 | 1 | 1 | 0 | 0 | 9/2 | |
| 0 | 7 | 0 | 3 | 0 | 1 | 0 | — | |
| 0 | 5 | 4 | 5 | 0 | 0 | 1 | 5/4 | |
| 0 | -7 | 9 | 0 | 0 | 0 | |||
Переходим к таблице 1-й итерации:
| БП |
Симплексные отношения |
|||||||
| 7 | -9 | 0 | 0 | 0 | ||||
| 0 | 13/2 | 0 | -3/2 | 1 | 0 | -1/2 | ||
| 0 | 7 | 0 | 3 | 0 | 1 | 0 | ||
| 7 | 5/4 | 1 | 5/4 | 0 | 0 | 1/4 | ||
| 35/4 | 0 | 71/4 | 0 | 0 | 7/4 | |||
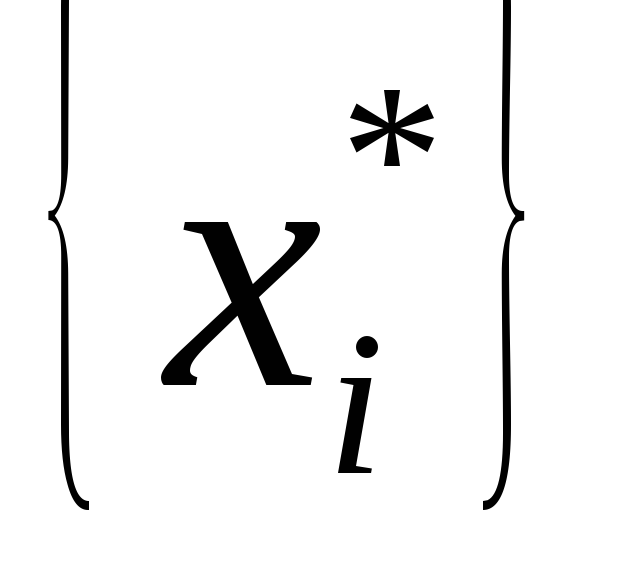
В индексной строке все члены неотрицательные, поэтому получено следующее решение задачи линейного программирования (выписываем из столбца свободных членов):
Так как оптимальное решение не удовлетворяет условию целочисленности, продолжим решение, используя алгоритм
Гомори.
Выбираем базисную переменную с наибольшей дробной частью.
По 1-й строке строим дополнительное ограничение:
Ограничение принимает вид:
Введем в ограничение дополнительную переменную:
Домножим последнее ограничение на -1:
Припишем это ограничение к последней симплексной таблице, и, следуя методу Гомори, выполним симплексные преобразования:
| БП |
Симплексные отношения | ||||||||
| 7 | -9 | 0 | 0 | 0 | 0 | ||||
| 0 | 13/2 | 0 | -3/2 | 1 | 0 | -1/2 | 0 | — | |
| 0 | 7 | 0 | 3 | 0 | 1 | 0 | 0 | 7/3 | |
| 7 | 5/4 | 1 | 5/4 | 0 | 0 | 1/4 | 0 | 1 | |
| 0 | -1/2 | 0 | -1/2 | 0 | 0 | -1/2 | 1 | 1 | |
| 35/4 | 0 | 71/4 | 0 | 0 | 7/4 | 0 | |||
Просматриваем строку, содержащую отрицательное число в столбце
свободных членов, и выбираем любое отрицательное число в этой строке.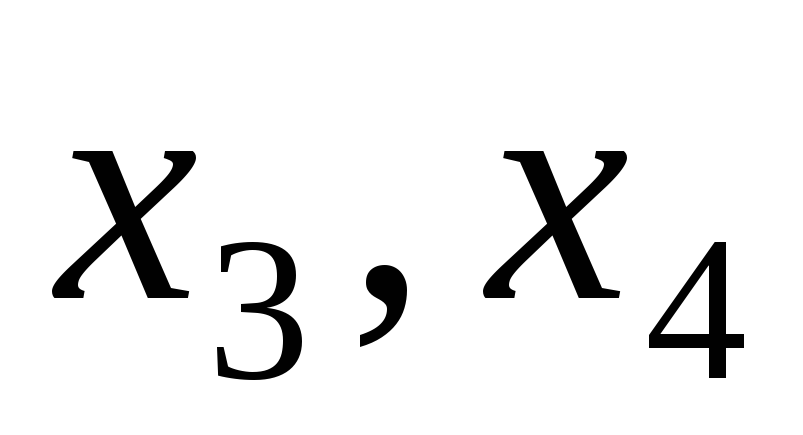 Выбранное
число будет определять разрешающий столбец.
Выбранное
число будет определять разрешающий столбец.
Ключевой столбец соответствует .
Находим ключевую строку, для этого определяем:
На пересечении ключевого столбца и ключевой строки находим разрешающий элемент, т.е. 5/4.
Вектор выводим из базиса и вводим вектор .
На сайте можно заказать решение контрольной или самостоятельной работы, домашнего задания, отдельных задач. Для этого вам нужно только связаться со мной:
ВКонтакте
WhatsApp
Telegram
Мгновенная связь в любое время и на любом этапе заказа. Общение без посредников. Удобная и быстрая оплата переводом на карту СберБанка. Опыт работы более 25 лет.
Подробное решение в электронном виде (docx, pdf) получите точно в срок или раньше.
Переходим к таблице 1-й итерации:
| БП |
Симплексные отношения |
||||||||
| 7 | -9 | 0 | 0 | 0 | 0 | ||||
| 0 | 8 | 6/5 | 0 | 1 | 0 | -1/5 | 0 | 20/3 | |
| 0 | 4 | -12/5 | 0 | 0 | 1 | -3/5 | 0 | — | |
| -9 | 1 | 4/5 | 1 | 0 | 0 | 1/5 | 0 | 5/4 | |
| 0 | 0 | 2/5 | 0 | 0 | 0 | -2/5 | 1 | 0 | |
| -9 | -71/5 | 0 | 0 | 0 | -9/5 | 0 | |||
Переходим к таблице 2-й итерации:
| БП |
Симплексные отношения |
||||||||
| 7 | -9 | 0 | 0 | 0 | 0 | ||||
| 0 | 8 | 0 | 0 | 1 | 0 | 1 | -3 | 8 | |
| 0 | 4 | 0 | 0 | 0 | 1 | -3 | 6 | — | |
| -9 | 1 | 0 | 1 | 0 | 0 | 1 | -2 | 1 | |
| 7 | 0 | 1 | 0 | 0 | 0 | -1 | 5/2 | — | |
| -9 | 0 | 0 | 0 | 0 | -16 | 71/2 | |||
Переходим к таблице 3-й итерации:
| БП |
Симплексные отношения |
||||||||
| 7 | -9 | 0 | 0 | 0 | 0 | ||||
| 0 | 7 | 0 | -1 | 1 | 0 | 0 | -1 | ||
| 0 | 7 | 0 | 3 | 0 | 1 | 0 | 0 | ||
| 0 | 1 | 0 | 1 | 0 | 0 | 1 | -2 | ||
| 7 | 1 | 1 | 1 | 0 | 0 | 0 | 1/2 | ||
| 7 | 0 | 16 | 0 | 0 | 0 | 7/2 | |||
В индексной строке все члены неотрицательные, поэтому получено следующее решение задачи линейного программирования (выписываем из столбца свободных членов):
Найденное оптимальное решение удовлетворяет условию целочисленности и является решением исходной задачи.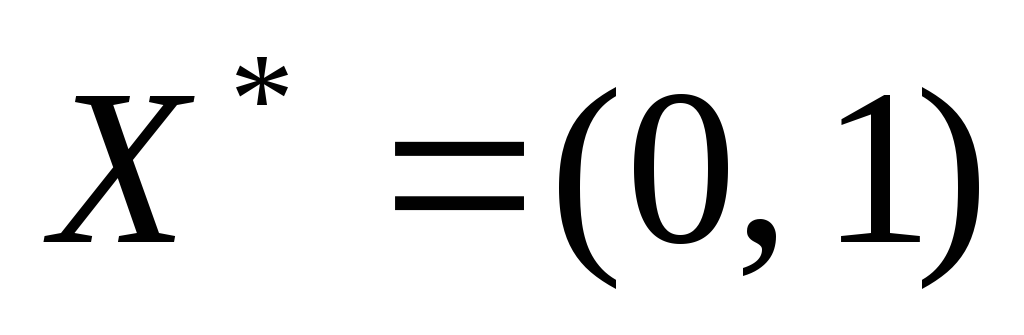
Метод Гомори решения задач ЦЛП. Лекция 8
Похожие презентации:
Симплекс-метод для решения задач линейного программирования
Методы решения комбинаторно-оптимизационных задач. (Тема 4)
Симплекс-метод решения задач линейного программирования
Симплекс-метод
Решение задачи «О рюкзаке» методом динамического программирования
Симплексный метод линейного программирования
Общие положения и симплекс метод
Теория принятия решений принятие оптимальных решений методами динамического программирования
Использование методов типа ветвей и границ для решения экстремальных задач на графах
Транспортная задача. Метод потенциалов
1. Метод Гомори решения задач ЦЛП
Лекция 81
2. План лекции
I Постановка задачи ЦЛП в общем видеII Алгоритм метода Гомори
III Пример реализации
2
3. Общая постановка ЗЦЛП
Целевая функцияn
F x с jx j max 1
j 1
Система ограничений
n
a ijx j bi , i 1, m 2
j 1
x j 0, j 1, n
3
x j Z (целые) j 1, k , k n 4
Если k<n задача частичноцелочисленная
Если k=n задача полностью целочисленная
3
4.
 ПримерДано
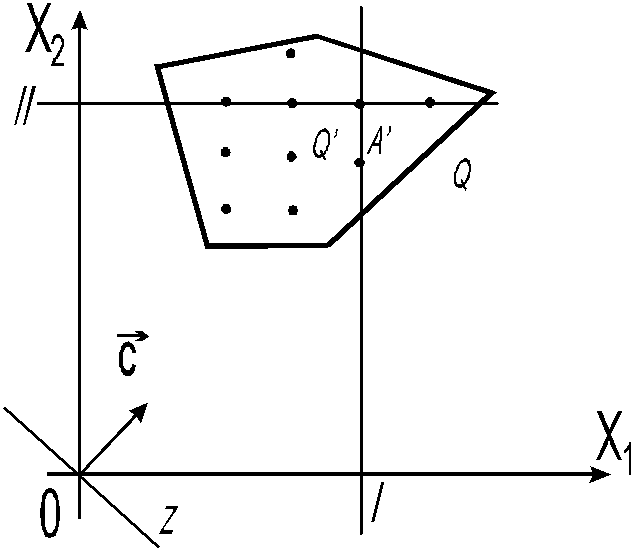
ПримерДаноF x1 1.5x 2 max
2 x1 4 x 2 17
10 x1 4 x 2 45
x1 0, x 2 0.
x1, x 2 Z
Решим геометрически
2 x1 4 x 2 17
10 x1 4 x 2 45
x1 3.5
x 2 2 .5
4
5. Алгоритм метода Гомори
1. Решаем задачу ЛП (1- 3) симплекс-методом.2. Полученное оптимальное решение задачи (1-3), если оно
существует, проверяем на целочисленность:
если все xj, допустимые целые, то, полученное оптимальное
решение задачи ЛП является оптимальным решением задачи
целочисленного программирования, конец алгоритма;
если задача ЛП решения не имеет, то не имеет решения и задача
целочисленного программирования;
наконец, если хотя бы одна координата не удовлетворяет условию
(4), то переходим к шагу 3.
3. Строим дополнительное линейное ограничение, с помощью
которого отсекается та часть допустимой области,
определяемой условиями (2-3), в которой содержится
оптимальное решение задачи ЛП (1-3), но нет ни одного
допустимого решения, удовлетворяющего условию (4) и вновь
выполняем пункт 1 для задачи ЛП с дополнительным
ограничением.
5
6. Построение отсечения
Гомори показал, что при «k-м» возвращении к решениюзадачи ЛП, “k-е» дополнительное ограничение имеет
вид:
x n k 1 x i0 x i0
x ij x ij x j ,
j I s
k 0,1,2,…, x n k 1 0
5
где [xi0], [xij] – целая часть соответствующей величины;
xi0 – нецелая координата оптимального плана задачи (13) у которой нецелая часть самая большая;
xij – координаты разложения векторов Аj, не попавших в
базис;
Is – множество векторов, не попавших в базис
6
7. Блок-схема алгоритма метода Гомори
НачалоРешение
задачи
лин.прогр.
K=0
Ввод
данных
K=k+1
–
Выбираем
строку i для
отсечения
–
x i0 -целые
+
Вывод
результатов
Конец
7
Задача
лин. прогр.
неразрешима ?
+
Задача целочисл. прогр.
неразрешима
8. Расчетные формулы для построения отсечения
Ограничение (5) может быть записано в виде:1) отсечение для целочисленной задачи ЛП
x ij x j x i0 (6)
j I s
2) отсечение для частично целочисленной задачи
ijx j x i0 (7)
j I s
где коэффициенты зависит от типа переменной:
а) для переменных, которые могут быть нецелыми
x ij ,
ij x i 0
1 x x ij ,
i0
8
x ij 0
x ij 0
8
б) для переменных, которые должны быть целые
x ij x i 0
x ij ,
ij 1 x ij
1 x x i 0 , x ij x i 0
i0
9.
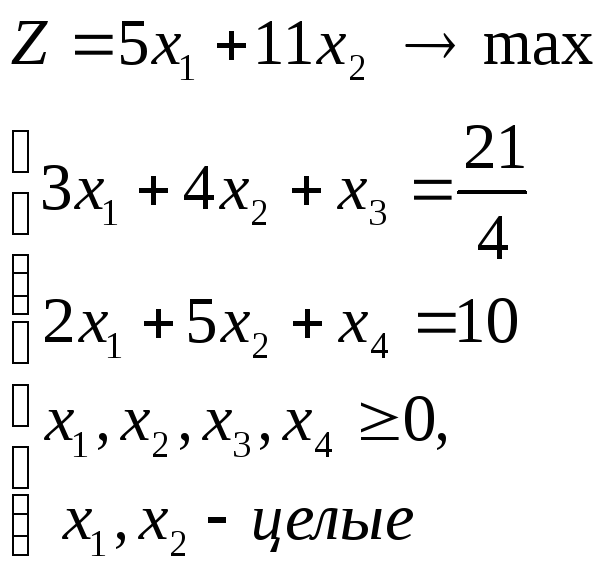 ПримерДано
ПримерДаноF x1 x 2 max
x 1 2 .5
x 2 2 .5
x1 0, x 2 0.
x1 , x 2 Z
Канонический вид
F x1 1x 2 max
x1 x 3 2,5
x 2 x 4 2,5
x1 0, x 2 0, x 3 0, x 4 0
x1 , x 2 Z
9
10. Решение методом Гомори
Решение симплекс-методом без учета требованияцелочисленности
Базис
А1
А2
Сбаз.
1
1
b опор.
2,5
2,5
F=5
А1
А2
1
0
0
А3
0
1
0
А4
1
0
1
0
1
1
Решение
x* 2,5 2,5 0 0
В частично целочисленной задаче отсечения строятся
по переменной, на которую наложено требование
целочисленности. Отсечение строиться по
переменной с наибольшей дробной частью, в нашем
случае выберем первую строку:
1x 3 0x 4 2,5
x 3 0 .5
10
11. Решение методом Гомори. Вторая итерация
Выразим фиктивную переменную x3 из первогоограничения и подставим его в полученное отсечение:
2.5 x1 0,5
x1 2
F x1 x 2 max
F x1 1x 2 max
x1 2,5
x 2 2,5
x 2
1
x1 0, x 2 0.
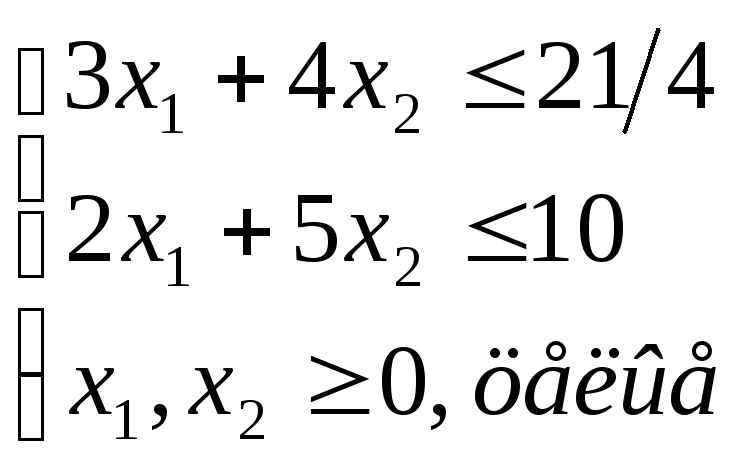
x1 x 3 2
x 2 x 4 2,5
x1 0, x 2 0, x 3 0, x 4 0
x1 , x 2 Z
x1, x 2 Z
Решаем симплекс-методом
Базис
А1
А2
11
Сбаз.
1
1
b опор.
2
2,5
F=4,5
А1
1
0
0
x* 2 2,5 0 0
А2
0
1
0
А3
1
0
1
А4
0
1
1
12. Решение методом Гомори. Третья итерация
Построение отсечения0 x 3 1x 4 2,5
x 4 0 .5
Выражаем фиктивную переменную
2.5 x 2 0,5
x2 2
F x1 x 2 max
F x1 1x 2 max
x1 2
x 2 2,5
x 2
2
x1 0, x 2 0.
x1 x 3 2
x 2 x 4 2
x1 0, x 2 0, x 3 0, x 4 0
x1 , x 2 Z
x1, x 2 Z
Базис
А1
А2
12
Сбаз.
1
1
b опор.
2
2
F=4
А1
1
0
0
А2
0
1
0
А3
1
0
1
А4
0
1
1
13. Задание на практику
Решить методом Гомори примерF x1 1.5x 2 max
2 x1 4 x 2 17
10 x1 4 x 2 45
x1 0, x 2 0.
x1, x 2 Z
13
English Русский Правила
Введение в стандартное и специальное окрашивание в гистопатологии
Джеймс Андерсон , менеджер по глобальному маркетингу
Geoffrey Rolls , BAppSc, FAIMS
Обычное окрашивание H&E и специальные окрашивания играют решающую роль в диагностике или исследовании тканей. Окрашивая в противном случае прозрачные участки ткани, эти красители позволяют высококвалифицированным патологам и исследователям просматривать под микроскопом морфологию (структуру) ткани или искать присутствие или преобладание определенных типов клеток, структур или даже микроорганизмов, таких как бактерии.
Окрашивая в противном случае прозрачные участки ткани, эти красители позволяют высококвалифицированным патологам и исследователям просматривать под микроскопом морфологию (структуру) ткани или искать присутствие или преобладание определенных типов клеток, структур или даже микроорганизмов, таких как бактерии.
В гистопатологической лаборатории термин «рутинное окрашивание» относится к окрашиванию гематоксилином и эозином (H&E), которое «обычно» используется со всеми образцами тканей для выявления структур и состояний подлежащих тканей. Термин «специальные красители» уже давно используется для обозначения большого количества альтернативных методов окрашивания, которые используются, когда H&E не дает всей информации, необходимой патологоанатому или исследователю.
Получайте обновления Knowledge Path прямо на свой почтовый ящик.
Подпишитесь сегодня!
Если вы просмотрели этот образовательный веб-семинар, тренинг или учебное пособие по пути к знаниям и хотели бы подать заявку на получение зачетных единиц непрерывного образования в вашей сертифицирующей организации, загрузите форму, которая поможет вам добавить оценочные зачетные единицы в вашу стенограмму.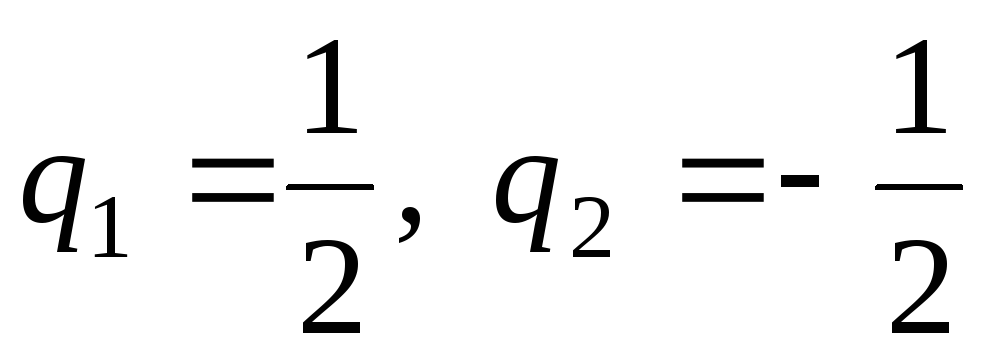
Подготовка ткани к окрашиванию
Перед окрашиванием и просмотром ткани ее необходимо подготовить таким образом, чтобы можно было сделать очень тонкий срез толщиной всего в одну клетку и поместить его на предметное стекло микроскопа. Это включает в себя фиксацию ткани (чтобы она не разлагалась), а затем ее затвердевание и поддержку, чтобы ее можно было разрезать на очень тонкие срезы (обычно 2–7 мкм). Для этого используются два основных метода: замороженные срезы и срезы, залитые парафином.
Замороженные срезы используются, когда ответы нужны быстро, как правило, во время операции, когда хирургу необходимо знать край иссечения при удалении опухоли. Они быстро изготавливаются, но, как правило, не обеспечивают того же качества срезов, что и парафиновая техника. Процесс приготовления замороженных срезов выглядит следующим образом:
- Ткань быстро замораживают, чтобы сохранить и укрепить ее.
- Замороженную ткань делают в криостате (микротом для секционирования в морозильной камере) и помещают на предметное стекло для окрашивания.

- Срез фиксируется непосредственно перед тем, как он начнет распадаться, а затем окрашивается.
При подготовке парафиновых срезов образец сначала консервируют фиксатором, а затем поддерживают структуру ткани путем инфильтрации образца парафиновым воском. Этот процесс требует больше времени, чем создание замороженных срезов, но в большинстве случаев обеспечивает более качественное окрашивание, а полученные образцы (называемые блоками) можно хранить практически неограниченное время. Процесс парафинового сечения выглядит следующим образом:
- Фиксация сохраняет ткань (обычно с использованием раствора на основе формальдегида).
- Grossing изолирует конкретную область ткани, которую нужно разрезать.
- При обработке тканей используется последовательность реагентов для замены водной среды (на водной основе) гидрофобной средой, позволяющей пропитывать элементы ткани парафиновым воском.
- Заливка позволяет ориентировать образец и закрепляет образец в блоке воска для вырезания срезов и хранения.

- Срезы делаются на микротоме , который делает очень тонкие срезы, которые выплывают на водяную баню, а затем собирают и помещают на предметные стекла микроскопа.
- Затем предметные стекла высушивают в печи или на горячей плите для удаления влаги и лучшего прилипания ткани к предметному стеклу.
- Теперь ткань на предметном стекле готова для окрашивания.
- Первым этапом окрашивания является депарафинизация, при которой используется растворитель для удаления парафина с предметного стекла перед окрашиванием. Это всегда делается как часть процесса окрашивания. Когда окрашивание завершено, срез накрывают покровным стеклом, что делает препарат постоянным.
Изображение
Рисунок 1: Микротомист создает «ленту» из очень тонких срезов для окрашивания.
Почему окрашивание гематоксилином и эозином (H&E) является обычным делом
Окрашивание гематоксилином и эозином (H&E) обычно используется в гистопатологических лабораториях, поскольку оно дает патологу/исследователю очень подробное представление о ткани.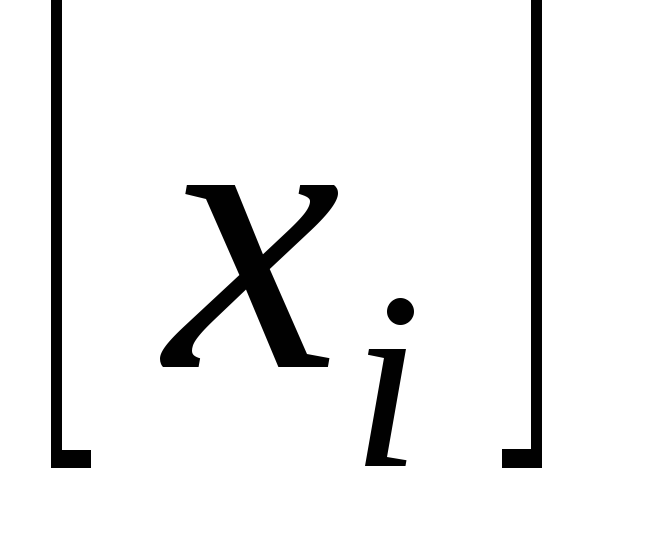 Это достигается за счет четкого окрашивания клеточных структур, включая цитоплазму, ядро, органеллы и внеклеточные компоненты. Этой информации часто бывает достаточно, чтобы диагностировать заболевание на основе организации (или дезорганизации) клеток, а также показать любые аномалии или конкретные индикаторы в реальных клетках (например, ядерные изменения, обычно наблюдаемые при раке). Даже при использовании передовых методов окрашивания окрашивание H&E по-прежнему составляет важную часть диагностической картины, поскольку оно отображает морфологию подлежащей ткани, что позволяет патологоанатому/исследователю правильно интерпретировать расширенное окрашивание.
Это достигается за счет четкого окрашивания клеточных структур, включая цитоплазму, ядро, органеллы и внеклеточные компоненты. Этой информации часто бывает достаточно, чтобы диагностировать заболевание на основе организации (или дезорганизации) клеток, а также показать любые аномалии или конкретные индикаторы в реальных клетках (например, ядерные изменения, обычно наблюдаемые при раке). Даже при использовании передовых методов окрашивания окрашивание H&E по-прежнему составляет важную часть диагностической картины, поскольку оно отображает морфологию подлежащей ткани, что позволяет патологоанатому/исследователю правильно интерпретировать расширенное окрашивание.
В лаборатории клинической гистологии все образцы сначала окрашивают гематоксилин-эозином, а специальное или расширенное окрашивание заказывают только в том случае, если необходима дополнительная информация для проведения более подробного анализа, например, для дифференциации двух морфологически сходных типов рака.
Из-за необходимого объема окрашивания гематоксилин-эозином большинство клинических лабораторий используют полностью автоматизированные системы, а ручное окрашивание в настоящее время используется редко.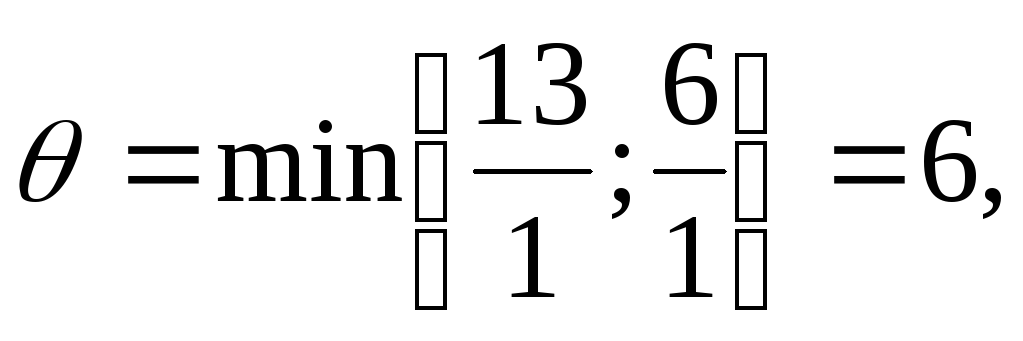
Изображение
Рисунок 2. На этом срезе слизистой оболочки тонкой кишки хорошо видны гетерохроматин и ядрышки в эпителиальных клетках и плазматических клетках в собственной пластинке.
Изображение
Рис. 3. Митотические фигуры резко окрашиваются внутри железистого эпителия на срезе тонкой кишки.
Изображение
Рис. 4. В этом поле со стороны собственной пластинки тонкой кишки цитоплазма плазматических клеток окрашена гематоксилином, за исключением бледной околоядерной области, которая соответствует хорошо развитому аппарату Гольджи
Изображение
Рис. 5. Этот вегетативный ганглий из мышечно-кишечного сплетения, расположенный между гладкомышечными слоями наружной мышечной оболочки тонкой кишки, содержит ганглиозные нейроны, в цитоплазме которых обнаруживается четко выраженное базофильное вещество Ниссля (агрегации эндоплазматического ретикулума и рибосомной РНК).
H&E Chemistry
В окраске H&E используются два красителя: гематоксилин и эозин. Эта комбинация используется, так как красители окрашивают различные элементы ткани.
Гематоксилин реагирует как основной краситель с пурпурно-синим цветом. Он окрашивает кислые или базофильные структуры, включая клеточное ядро (которое содержит ДНК и нуклеопротеин) и органеллы, содержащие РНК, такие как рибосомы и шероховатый эндоплазматический ретикулум.
Эозин — это кислый краситель , который обычно имеет красноватый или розовый цвет. Он окрашивает основные или ацидофильные структуры, включая цитоплазму, клеточные стенки и внеклеточные волокна.
Происхождение красителей
Гематоксилин извлекают из кедрового дерева и очищают. Затем его окисляют и смешивают с протравой (обычно алюминием), чтобы он мог прикрепиться к клеточным структурам. Из многих препаратов гематоксилина, используемых в гистологии, наиболее популярны гематоксилин Гилла, гематоксилин Харриса и гематоксилин Майера.
Эозин образуется в результате реакции между бромом и флуоресцеином. В гистологии обычно используются два варианта эозина: эозин Y, слегка желтоватый, и эозин В, слегка голубоватый. Эозин Y наиболее популярен.
Изображение
Рисунок 6: Химическая структура гематоксилина.
Изображение
Рисунок 7: Химическая структура эозина Y.
Специальные красители
Термин «специальные красители» традиционно относится к любому окрашиванию, кроме H&E. Он охватывает широкий спектр методов, которые можно использовать для визуализации определенных тканевых структур, элементов или даже микроорганизмов, не идентифицируемых с помощью окрашивания гематоксилин-эозином.
В других методах окрашивания используется иммуногистохимия или гибридизация in situ для нацеливания на определенные белки или последовательности ДНК/РНК. Эти методы иногда также включались в семейство «особых пятен».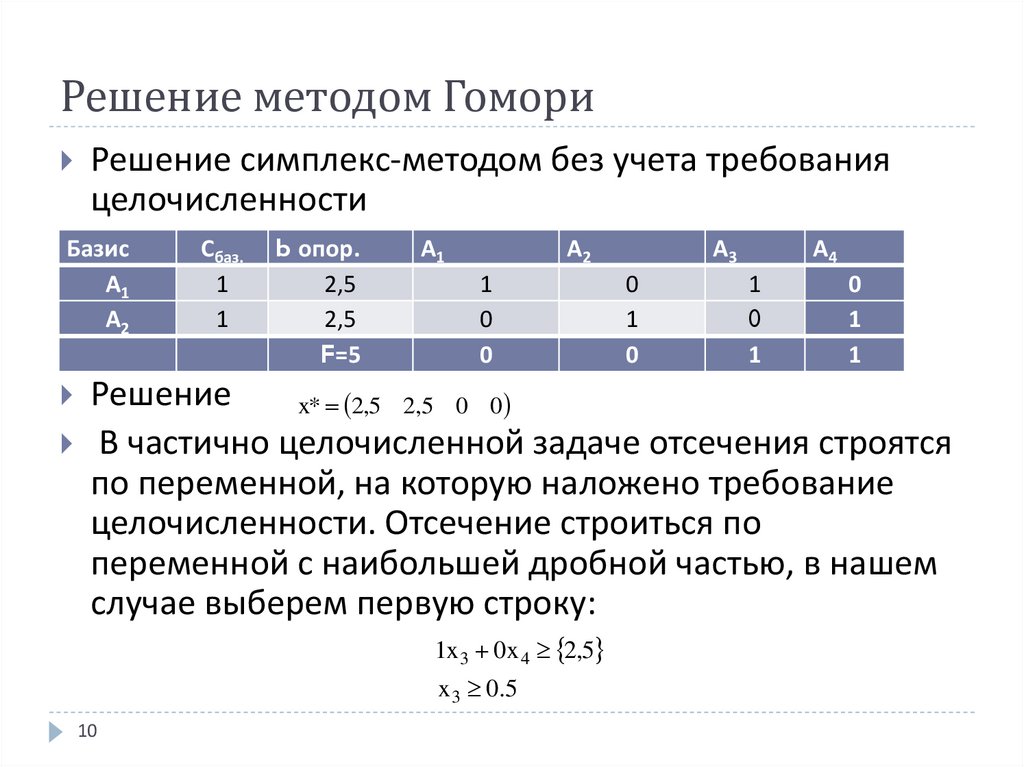 Однако они сильно различаются по методу и назначению и в настоящее время обычно выделяются в третью категорию, известную как «продвинутые пятна».
Однако они сильно различаются по методу и назначению и в настоящее время обычно выделяются в третью категорию, известную как «продвинутые пятна».
Хотя существуют буквально сотни специальных красителей для самых разных целей, лишь немногие из них регулярно используются в клинической гистологии. Разнообразие красителей также означает, что специальное окрашивание не так автоматизировано, как окрашивание H&E. Хотя многие крупные лаборатории используют автоматические инструменты для более распространенных пятен, у них все еще есть место для окрашивания вручную. Сложность некоторых пятен также работает против использования автоматизации.
Некоторые распространенные специальные красители
На изображениях ниже показаны некоторые распространенные специальные красители и способы их применения.
Изображение
Рисунок 8: Трихром Массона (кожа). Это окрашивание предназначено для использования при гистологическом исследовании коллагеновых волокон соединительной ткани в образцах тканей. Он используется для помощи в дифференциации коллагена и гладких мышц в опухолях и помогает в обнаружении заболеваний или изменений в соединительной/мышечной ткани.
Он используется для помощи в дифференциации коллагена и гладких мышц в опухолях и помогает в обнаружении заболеваний или изменений в соединительной/мышечной ткани.
Изображение
Рисунок 9: Модифицированное серебристое окрашивание GMS (слева: пневмоцистоз, легкое) (справа: аспергиллезная инфекция, легкое). Окрашивание Modified GMS Silver предназначено для гистологического исследования грибков, базальной мембраны и некоторых условно-патогенных организмов, таких как pneumocystis carinii, в образцах тканей.
Изображение
Рисунок 10: Периодическая кислота Шиффа (почка). Окрашивание PAS в основном используется для окрашивания структур, содержащих большое количество углеводов, таких как гликоген, гликопротеины, протеогликаны, обычно присутствующие в соединительных тканях, слизи и базальных мембранах. Часто используется для окрашивания биопсий почек, биопсий печени, некоторых болезней накопления гликогена в поперечно-полосатых мышцах и подозрении на грибковые инфекции.
Изображение
Рисунок 11: Железо берлинской лазури Перлза (печень). Это окрашивание используется для обнаружения и идентификации трехвалентного железа (Fe3+) в препаратах тканей, мазках крови или мазках костного мозга. Небольшие количества трехвалентного железа (гемосидерин) обычно обнаруживаются в костном мозге и селезенке. Аномальное количество железа может указывать на гемохроматоз и гемосидероз.
Изображение
Рисунок 12: Ziehl Neelsen (кислотоустойчивые бациллы, легкие). Это окрашивание используется для обнаружения и идентификации кислотоустойчивых бацилл в тканях. Бациллы представляют собой палочковидные бактериальные организмы. Основная функция этого окрашивания — выявление туберкулеза в легочной ткани.
Изображение
Рисунок 13: Alcian Blue (кишечник). Alcian Blue обычно готовят при рН 2,5 и используют для идентификации кислых мукополисахаридов и кислых муцинов. Избыточное количество несульфатированных кислых слизистых веществ наблюдается при мезотелиомах, определенное количество в норме встречается в стенках кровеносных сосудов, но увеличивается при ранних поражениях атеросклероза.
Избыточное количество несульфатированных кислых слизистых веществ наблюдается при мезотелиомах, определенное количество в норме встречается в стенках кровеносных сосудов, но увеличивается при ранних поражениях атеросклероза.
Изображение
Рисунок 14: Alcian Blue и PAS (кишечник). Краситель, который сочетает в себе свойства окрашивания альциановым синим и периодической кислотой Шиффа.
Изображение
Рисунок 15: Трихром Гомори (синий) (подслизистая основа). Окрашивание трихромом используется для окрашивания и идентификации мышечных волокон, коллагена и ядер. Их можно использовать для контрастирования скелетных, сердечных или гладких мышц. Трихром по Гомори представляет собой упрощенную версию более сложного трихромного окрашивания по Массону и сочетает в себе окрашивание плазмы (хромотроп 2R) и окрашивание соединительной ткани для получения яркого контрастного изображения.
Изображение
Рисунок 16: Трихром Гомори (зеленый) (подслизистая оболочка). Окрашивание трихромом используется для окрашивания и идентификации мышечных волокон, коллагена и ядер. Их можно использовать для контрастирования скелетных, сердечных или гладких мышц. Трихром по Гомори представляет собой упрощенную версию более сложного окрашивания по Массону и сочетает в себе окрашивание плазмы (хромотроп 2R) с окрашиванием соединительной ткани для получения яркого контрастного изображения.
Шаги к лучшим специальным красителям
В Leica Biosystems мы стремимся улучшить диагностику рака и улучшить качество жизни. Один из способов достичь этого видения — помочь улучшить качество окрашивания. Поскольку мы понимаем, что качество IHC и ISH не начинается с красителя, в этой серии статей рассматривается множество различных аспектов качества окрашивания и рассматривается, как будущие тесты повлияют на улучшение диагностики.
Понять пятно
Знайте, что вы пытаетесь продемонстрировать с помощью окрашивания.
Простое «следование методу» и незнание того, что должно быть видно в готовом разделе, приведет к плохим результатам.
Изображение
Срез печени, окрашенный PAS. Липофусцин и гликоген являются PAS-положительными, в то время как следы желчи и гемосидерина являются PAS-отрицательными и имеют свой естественный цвет (желтый и коричневый соответственно). B В этом разделе показана оппортунистическая грибковая инфекция легких (Aspergillus), окрашенная по методу Грокотта-Гомори. Грибковые гифы черные, как и неокрашенный углерод, что характерно для легких курильщиков и большинства горожан.
Используйте положительный контроль
Всегда используйте контрольное стекло, о котором известно, что оно содержит структуру/вещество, которое вы пытаетесь продемонстрировать.
«Если структура/вещество, которые мы окрашиваем, не видны на предметном стекле, мы предполагаем, что их нет».
Изображение
Срез печени с циррозом, окрашенный методом Перла для демонстрации железосодержащего гемосидера (синий). Это сделало бы удовлетворительный контрольный блок для пятен железа.
Использовать точное время
Используйте точное время.
Время всегда приблизительное. Неточный расчет времени приводит к противоречивым результатам.
Изображение
Оба этих среза кожи из одного блока были окрашены методом PAS. Секцию А обрабатывали йодной кислотой (этап окисления) в течение 5 минут, а секцию В — всего 30 секунд (ошибка). Обратите внимание, что вследствие этого базальная мембрана очень плохо окрашивается в секции B.
Учитывать стабильность реагентов
Помните о сроке годности используемых реагентов. Некоторые реагенты или растворы красителей портятся медленно, в то время как другие очень нестабильны и должны быть приготовлены свежими и использованы немедленно. Другие должны быть оставлены на некоторое время для окисления (созревания), прежде чем их вообще можно будет использовать.
Другие должны быть оставлены на некоторое время для окисления (созревания), прежде чем их вообще можно будет использовать.
Мы предполагаем, что все реагенты можно использовать в течение неопределенного периода времени.
Изображение
Гематоксилин Мадди Вейгерта из-за переокисления. Обратите внимание на коричневое окрашивание коллагена.
Правильно храните реагенты
Правильно храните реагенты. Некоторым требуется охлаждение, потому что они склонны поддерживать рост грибков или плесени. Другие чувствительны к свету и требуют хранения в темноте.
«Все наши реагенты хранятся на полке над столом для окрашивания. Иногда мы видим бродячие организмы в наших секциях».
Изображение
На этом срезе видны большие отложения посторонних микроорганизмов, которые выросли в растворе для окрашивания (в данном случае гематоксилин), а затем отложились поверх среза.
Придерживайтесь метода
Точно следуйте протоколу.
Сотрудники достигают разных результатов, предположительно используя один и тот же протокол.
Изображение
Эти срезы фиксированной формалином подслизистой оболочки окрашивали трихромным красителем по Массону. Раздел A показывает красную гладкую мышцу. В этом случае окрашивание было выполнено правильно, следуя лабораторному протоколу и включая предварительную стадию хромовой кислоты (сенсибилизация или вторичное протравление). Этот шаг был пропущен при окрашивании секции B. Обратите внимание на отсутствие дифференцированной окраски мышц в секции B (кишечник).
Записывайте любые изменения
Документируйте любые отклонения от используемого вами метода.
Иногда, когда результаты неудовлетворительные, трудно или невозможно определить причину, поскольку изменения протокола не были зарегистрированы.
Изображение
В этой окраске с пропиткой серебром для ретикулина волокна плохо видны и на предметном стекле имеется фоновая пена (осадок). Очень сложно определить причину такой проблемы, если метод не был точно соблюдён (метод Гордона и Свитса, почки).
Очень сложно определить причину такой проблемы, если метод не был точно соблюдён (метод Гордона и Свитса, почки).
Стандартизация этапов стирки
Будьте особенно внимательны при выполнении этапов стирки. Стандартизируйте их, насколько это возможно, поскольку они часто являются причиной переменных результатов.
Сотрудники лаборатории используют разные методы мытья – одни используют сильное перемешивание, другие гораздо более щадящие.
Изображение
Эти срезы печени окрашивали тем же методом. Единственная разница между ними заключалась в технике промывки между пропиткой и восстановлением. Волокна ретикулина имеют черный цвет и лучше определяются в секции А (метод Гордона и Свитса).
Аккуратно настройте микроскоп
Используйте микроскопический контроль на важнейших этапах, таких как этапы дифференциации. Помните о влиянии настройки микроскопа на появление непокрытых (влажных) срезов; это может привести к появлению ложного фонового окрашивания.
Для всех методов уровень окрашивания оценивают, глядя на предметное стекло невооруженным глазом.
Изображение
A: Влажный срез (без покровного стекла) под микроскопом с закрытой диафрагмой конденсора. Обратите внимание на ложный фон. B: Влажный срез (без покровного стекла) под микроскопом с открытой диафрагмой конденсора. Обратите внимание на чистый фон.
Содержимое Leica Biosystems Knowledge Path регулируется условиями использования веб-сайта Leica Biosystems, доступными по адресу: Официальное уведомление. Контент, включая веб-семинары, обучающие презентации и сопутствующие материалы, предназначен для предоставления общей информации по конкретным темам, представляющим интерес для медицинских работников, и не предназначен и не должен толковаться как медицинская, нормативная или юридическая консультация. Взгляды и мнения, выраженные в любом стороннем контенте, отражают личные взгляды и мнения докладчика(ов)/автора(ов) и не обязательно представляют или отражают взгляды или мнения Leica Biosystems, ее сотрудников или агентов.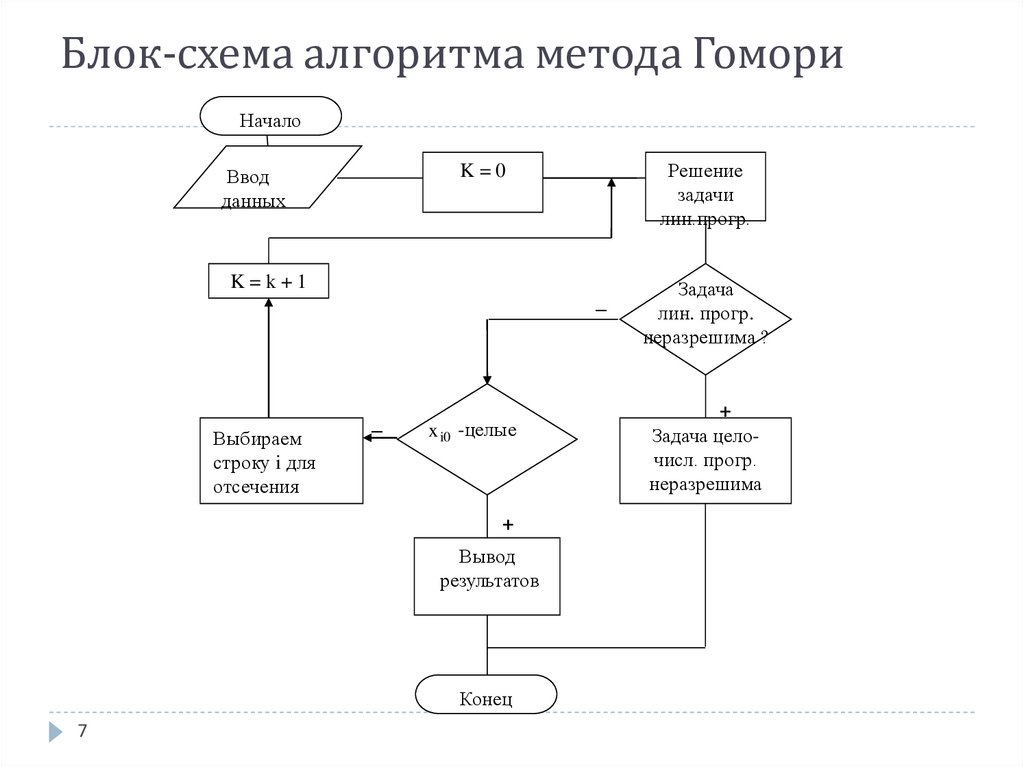 Любые ссылки, содержащиеся в контенте, которые обеспечивают доступ к сторонним ресурсам или контенту, предоставляются только для удобства.
Любые ссылки, содержащиеся в контенте, которые обеспечивают доступ к сторонним ресурсам или контенту, предоставляются только для удобства.
При использовании любого продукта следует обращаться к соответствующей документации по продукту, включая информационные руководства, вкладыши и руководства по эксплуатации.
Copyright © 2023 Leica Biosystems, подразделение Leica Microsystems, Inc. и ее дочерние компании Leica Biosystems. Все права защищены. LEICA и логотип Leica являются зарегистрированными товарными знаками Leica Microsystems IR GmbH.
Джеймс Андерсон , менеджер по глобальному маркетингу
Джеймс Андерсон является менеджером по глобальному маркетингу в Leica Biosystems с опытом работы в гистологии и научно-технических и маркетинговых коммуникациях.
Джеффри Роллс , BAppSc, FAIMS
Джеффри Роллс — консультант по гистологии с многолетним опытом работы в этой области.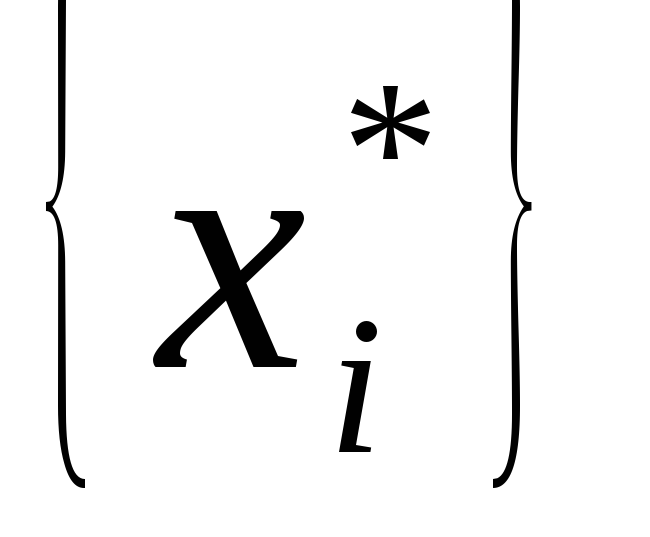 Он бывший старший преподаватель гистопатологии на кафедре лабораторной медицины Университета RMIT в Мельбурне, Австралия.
Он бывший старший преподаватель гистопатологии на кафедре лабораторной медицины Университета RMIT в Мельбурне, Австралия.
Фазово-контрастная микроскопия реакции Гомори на щелочную фосфатазу
- Опубликовано:
- Н. М. ХЭНКОКС 1 и
- ЭВЕЛИН НИКОЛАС 1
Природа том 173 , страницы 951–952 (1954)Цитировать эту статью
49 доступов
1 Цитаты
Сведения о показателях
Abstract
В стандартном методе Гомори для гистохимической демонстрации щелочной фосфатазы отложения фосфата кальция образуются в срезах предположительно в местах ферментативной активности. Эти отложения, считавшиеся невидимыми, должны быть обнаружены с помощью дополнительной процедуры. Кальций может быть превращен в кобальт, и последний визуализируется как черный сульфид; можно использовать серебряную технику фон Косса; или для окрашивания отложений можно использовать образующие озера красители.
Эти отложения, считавшиеся невидимыми, должны быть обнаружены с помощью дополнительной процедуры. Кальций может быть превращен в кобальт, и последний визуализируется как черный сульфид; можно использовать серебряную технику фон Косса; или для окрашивания отложений можно использовать образующие озера красители.
Это предварительный просмотр содержимого подписки, доступ через ваше учреждение
Варианты доступа
Подписка на этот журнал
Получите 51 печатный выпуск и онлайн-доступ
199,00 € в год
всего 3,90 € за выпуск
Подробнее
Арендуйте или купите эту статью
Получите только эту статью столько, сколько вам нужно
$39,95
Узнайте больше
Цены могут облагаться местными налогами, которые рассчитываются при оформлении заказа
Ссылки
Danielli, J.F., « Cytochemistry » (Chapman and Hall, Ltd., London, 1953).