Эл. диссоц. -2 ХИмические св-ва неорг. соед. в свете ЭД и ОВР_ (9 класс)
Похожие презентации:
Химические свойства основных неорганических соединений в свете ЭД и ОВР
Строение и химические свойства кислот
Классификация неорганических соединений
Классификация. Неорганических соединений
Соединения серы
Ионные уравнения реакций
Ионные уравнения реакции
Кислоты, их классификация и свойства
Соединения серы
Реакции ионного обмена. Свойства ионов
1. Химические свойства основных неорганических соединений в свете ЭД и ОВР 9 класс
2. Девиз урока
3. Цель урока
Повторитьхимические свойства оксидов,
кислот, оснований , солей.
Рассмотреть уравнения реакций в свете
окислительной-восстановительной
реакции и электролитической
диссоциации;
Уметь писать полные и сокращенные
уравнения реакций.
4. Химические свойства оксидов
Вспомните, с какими веществами взаимодействуютоксиды?
Основные оксиды
1) С кислотами
2) С водой
3) С кислотными оксидами
Кислотные оксиды
1) С растворимыми основаниями (щелочами)
2) С водой
3) С основными оксидами
Приведем примеры и рассмотрим в свете ЭД и ОВР
5.
 Химические свойства основных оксидов1)
Химические свойства основных оксидов1)Взаимодействуют с кислотами
+2 -2
+1 +6 -2
t
+2 +6 -2
+1 -2
CuO + h3SO4 = CuSO4 +h3O – не является ОВР
CuO + 2H+ + SO42- = Cu2+ + SO42- +h3O — РИО
CuO + 2H+ = Cu2+ +h3O
2) с водой
+1 -2
+1 -2
+1 -2 +1
Na2O + h3O = 2NaOH — не является ОВР и не РИО
3) с кислотными оксидами
+2 -2
+4 -2
+2 +4 -2
CaO + CO2 = CaCO3 — не является ОВР и не РИО
6. Химические свойства кислотных оксидов
1) с растворимы основаниями (щелочами)+2 -2
+1 -2 +1
+1
+4 -2
+1 -2
CO2 + 2NaOH = Na2CO3 + h3O – не является ОВР
CO2 + 2Na+ + 2OH- = 2Na+ + CO32- + h3O — РИО
CO2 + 2OH- = CO32- + h3O
2) с водой
+5
-2
+1 -2 t
+1 +5 -2
Р2O5 + 3h3O = 2h4PO4
3) — // —
— не является ОВР и не РИО
7. Химические свойства кислот
Вспомните, с какими веществами взаимодействуюткислоты ?
1) с металлами
2) с основными оксидами
3) с основаниями
4) с солями
5) разлагаются при нагревании
1) с металлами
0
+1 -1
+2 -1
0
Zn +2HCl = ZnCl2 + h3↑ — ОВР
Zn + 2H+ + 2Cl- = Zn2+ + 2Cl- + h3↑ — РИО
Zn + 2H+ = Zn2+ + h3↑
2) с основными оксидами
+2 -2
+1 +6 -2 t
+2 +6 -2
+1 -2
CuO + h3SO4 = CuSO4 +h3O – не является ОВР
CuO + 2H+ + SO42- = Cu2+ + SO42- +h3O — РИО
CuO + 2H+ = Cu2+ +h3O
9.
 +1 -2 -1 +1 -1 +1 -1 +1 -2 NaOH + HCl = NaCl + h3O – не является ОВР3) с основаниями
+1 -2 -1 +1 -1 +1 -1 +1 -2 NaOH + HCl = NaCl + h3O – не является ОВР3) с основаниями+1 -2 -1
+1 -1
+1 -1
+1 -2
NaOH + HCl = NaCl + h3O – не является ОВР
Na+ + OH- + H+ + Cl- = Na+ + Cl- + h3O — РИО
OH- + H+ = h3O
4) с солями
+1 +4 -2
+1 -1
+1 -1
+1 -2
+4 -2
Na2CO3 + 2HCl = 2NaCl + h3O + CO2↑ — не является ОВР
2Na+ + CO32- + 2H+ + 2Cl- = 2Na+ + 2Cl- + h3O + CO2↑
CO32- + 2H+ = h3O + CO2↑
— РИО
5) Некоторые разлагаются при нагревании
+1 +4 -2
t
+1 -2
+4 -2
h3SiO3 = h3O + SiO2 – не является ОВР и РИО
10. Вариант 1 Fe + h3SO4 = HNO3+ CuO = HCl + Zn (OH)2 = h3SO4 + K2 CO3 = Вариант 2 Al + HCl = BaO + h3SO4 = Cu(OH)2 + HNO3 = h4PO4
h3SO4 + K2 CO3Вариант 1
Fe + h3SO4 =
HNO3+ CuO =
HCl + Zn (OH)2 =
h3SO4 + K2 CO3 =
Вариант 3
Cu+HCl =
HNO3 +MgO =
Ca(OH)2 + HNO3 =
h3S + Ba(NO3)2 =
Вариант 2
Al + HCl =
BaO + h3SO4 =
Cu(OH)2 + HNO3 =
h4PO4 + Al Cl3 =
Вариант 4
Al + h3SO4 =
HCL+ Fe2O3 =
NaOH + h4PO4 =
HNO3 + K2 CO3 =
11.
 Вариант 1 Fe + h3SO4 = FeSO4 + h3 HNO3+ CuO = Cu(NO3)2 + h3O HCl + Zn (OH)2 = ZnCl2 + h3O h3SO4 + K2 CO3 = K2SO4 + h3CO3Вариант 2
Вариант 1 Fe + h3SO4 = FeSO4 + h3 HNO3+ CuO = Cu(NO3)2 + h3O HCl + Zn (OH)2 = ZnCl2 + h3O h3SO4 + K2 CO3 = K2SO4 + h3CO3Вариант 2Al + HCl = AlCl3+ h3
BaO + h3SO4 = BaSO4 + h3O
Cu(OH)2 + HNO3 = Cu(NO3)2 + h3 O
h4PO4 + Al Cl3 = AlPO4 + HCl
Вариант 3
Cu +HCl = CuCl2+ h3
HNO3 + MgO = Mg (NO3)2 + h3O
Ca(OH)2 + HNO3 = Ca(NO3)2 + h3O
h3S + Ba(NO3)2 = BaS + HNO3
Вариант 4
Al + h3SO4 = Al2(SO4)3 + h3
HCL+ Fe2O3 = FeCl3 + h3O
NaOH + h4PO4 = Na3PO4+ h3O
HNO3 + K2 CO3 =KNO3 + h3CO3
12. Химические свойства оснований
13. Цель урока
Повторитьхимические свойства
оснований.
Рассмотреть уравнения реакций в свете
электролитической диссоциации;
Уметь писать полные и сокращенные
уравнения реакций.
14. Химические свойства оснований
Вспомните, с какими веществами взаимодействуютоснования?
1) с кислотами
2) растворимые основания (щелочи) с солями
3) Растворимые основания (щелочи) с кислотными
оксидами
4) нерастворимые разлагаются при нагревании
15.
 Химические свойства оснований1) с кислотами
Химические свойства оснований1) с кислотами+1 -2 +1
+1 +6 -2
+1 +6 -2
+1 -2
2КOH + h3SO4 = K2SO4 +2h3O — не является ОВР
2К+ + 2OH- + 2H+ + SO42- =2K+ + SO42- +2h3O — РИО
2OH- + 2H+ = 2h3O
2) растворимые основания (щелочи) с растворами солей
+1 -2 +1
+2 +6 -2
+1 +6 -2
+2 -2 +1
2КOH+ CuSO4 = K2SO4 + Cu(OH)2 — не является ОВР
2К+ +2OH- + Cu2+ +SO42- = 2K+ +SO42- +Cu(OH)2 — РИО
2OH- + Cu2+ = Cu(OH)2
16. Химические свойства оснований
3) Растворимые основания (щелочи) с кислотными оксидами+1 -2 +1
+6 -2
+1 +6 -2
+1 -2
2КOH+ SO3= K2SO4 +h3O — не является ОВР
2К+ + 2OH- + SO3= 2K+ + SO42- + h3O — РИО
2OH- + SO3= SO42- + h3O
4) нерастворимые разлагаются при нагревании
+2 -2 +1
t
+2 -2
+1 -2
Сu(OH)2 = CuO + h3O – не является ОВР и РИО
Li OH
+ h3SO4
Li OH + Al 2 (SO4)3
Li OH + CO2
Sn(OH)2
t
18. Химическая свойства солей
Вспомните, с какими веществами взаимодействуютсоли?
1) с металлами
2) с кислотами
3) с растворимыми основаниями (щелочами)
4) с растворами солей
5) нерастворимые при нагревании разлагаются
19.
 Химические свойства солей1) с металлами
Химические свойства солей1) с металлами0
+2 +6 -2
+2 +6 -2
0
Fe + CuSO4 = FeSO4 + Cu — ОВР
Fe + Cu2+ + SO42- = Fe2+ + SO42- + Cu — РИО
Fe + Cu2+ = Fe2+ + Cu
2) с кислотами
+1
+4 -2
+1 -1
+1 -1
+1 +4 -2
Na2SiO3 + 2HCl = 2NaCl + h3SiO3 — не является ОВР
2Na+ +SiO32- +2H+ + 2Cl- = 2Na+ + 2Cl- +h3SiO3 — РИО
SiO32- + 2H+ = h3SiO3
20. Химические свойства солей
3) с растворимыми основаниями (щелочами)+2
-1
+1 -2 +1
+1 -1
+2 -2 +1
ZnCl2 + 2KOH = 2KCl + Zn(OH)2 -не является ОВР
Zn2+ + 2Cl- + 2K+ +2OH- = 2K+ + 2Cl- + Zn(OH)2 — РИО
Zn2+ + 2OH- = Zn(OH)2
4) с растворами солей
+1 +5 -2
+1 -1
+1 +5 -2
+1 -1
AgNO3 + NaCl = NaNO3 + AgCl — не является ОВР
Ag+ + NO3- +Na+ +Cl- =Na+ +NO3- +AgCl — РИО
Ag+ + Cl- = AgCl
21. Химические свойства солей
5) с кислотными оксидами+2 +4 -2
+4 -2 t
+2 +4 -2
+4 -2
CaCO3 +SiO2 = CaSiO3 + CO2↑ — не является ОВР и РИО
6) нерастворимые при нагревании разлагаются
+2 +4 -2
+2 -2
+4 -2
СaCO3 = CaO + CO2↑ — не является ОВР и РИО
22.
 ГИА-9 (№22)Даны вещества:
ГИА-9 (№22)Даны вещества:Mg, HNO3, Ba(NO3)2, HCl,
AgNO3 . Используя воду и необходимые
вещества только из этого списка, получите в
две стадии нитрат магния. Опишите признаки
реакции. Для второй реакции напишите
сокращенное ионное уравнение реакции.
23. Самопроверка
1) Mg + 2HCl = MgCl2 + h3↑2) MgCl2 + 2 AgNO3 = Mg(NO3)2 + 2AgCl
Mg2+ +2Cl- +2Ag+ +2NO3- =Mg2+ +2NO3+2AgCl
2Cl- + 2 Ag+ = 2AgCl
24. ГИА (№21)
Какая масса осадка образуется привзаимодействии избытка раствора
хлорида бария с 200 г раствора
сульфата алюминия с массовой долей
соли 10,4%?
Запишите подробное решение задачи
и ответ.
25. Самопроверка
Дано:Решение:
mр-ра(Al2(SO4)3)= 200г
ω (Al2(SO4)3) =10,4%
Al2(SO4)3 + 3BaCl2 = 3BaSO4 + 2AlCl3
20,8 г
342 г
хг
699г
m( BaSO4 ) — ?
1) m= mр-ра · ω = 200 г · 0,104 = 20,8 г (Al2(SO4)3)
2) М(Al2(SO4)3)= 27·2 +32·3+16·12=54+96+192= 342г/моль
3) М(BaSO4)= 137+ 32+16·4= 137+32+64 = 233г/моль
4) 342 г – 699 г
20,8 г – х г
20,8 г · 699 г
х= _____________= 42,5 г
342 г
Ответ: m(BaSO4)=42,5 г
26.
 Домашнее заданиеПовторить химические свойства
Домашнее заданиеПовторить химические свойстванеорганических соединений,
§9, зад.6
Дополнительно для желающих (раздать
карточки)
27. МОЛОДЦЫ!
Вы успешносправились с работой!
28. Дополнительное д/з
1) Бесцветный прозрачный раствор способенизменить окраску фенолфталеина на малиновую. И
пропускание через раствор углекислого газа, и
обработка его содой (Na2CO3) приведут к выпадению
белого осадка, «способного раствориться» в соляной
кислоте с выделением углекислого газа. Определите
состав исследуемого вещества и запишите его
название. Составьте три уравнения описанных
реакций.
29. Дополнительное задание (ОГЭ-2020, №23)
В трех колбах находятся растворы веществ: хлоридажелеза (II), хлорида магния и сульфата магния. Из
одной колбы было отобрано небольшое количество
раствора. Подтвердите, что отобранное вещество
является сульфатом магния. Для этого:
1) назовите два реактива необходимые для
подтверждения наличия в растворе именно сульфата
магния.
 Сформулируйте обоснование своего выбора.
Сформулируйте обоснование своего выбора.2) составьте уравнения реакций, которые позволяют
подтвердить наличие каждого из ионов в составе
раствора сульфата магния.
30. Правильный ответ
1) определен реактив, необходимый для подтверждения наличия ввыданном растворе сульфат-иона, и сформулировано обоснование
выбора этого реактива, например: для подтверждения наличия в растворе
сульфат-иона требуется хлорид бария (BaCl2), т.к. при взаимодействии с
ионом бария сульфат-иона образуется белый осадок сульфата бария
(BaSO4). (1б)
2) составлено уравнение реакции, которое позволяет подтвердить
наличие сульфат-иона в растворе сульфата магния:
MgSO4 + BaCl2 = BaSO4 + MgCl2
3) определен реактив, необходимый для подтверждения наличия в
выданном растворе иона магния, и сформулировано обоснование выбора
этого реактива, например: для подтверждения наличия в растворе иона
магния можно использовать раствор гидроксида натрия (NaOH), т.
 к. при
к. привзаимодействии иона магния с гидроксид- ионом образуется
нерастворимый осадок гидроксида магния (Mg(OH)2). (1б)
4) составлено уравнение реакции, которое позволяет подтвердить
наличие иона магния в растворе сульфата магния:
MgSO4 + 2NaOH = Mg(OH)2 + Na2SO4 (1б)
English Русский Правила
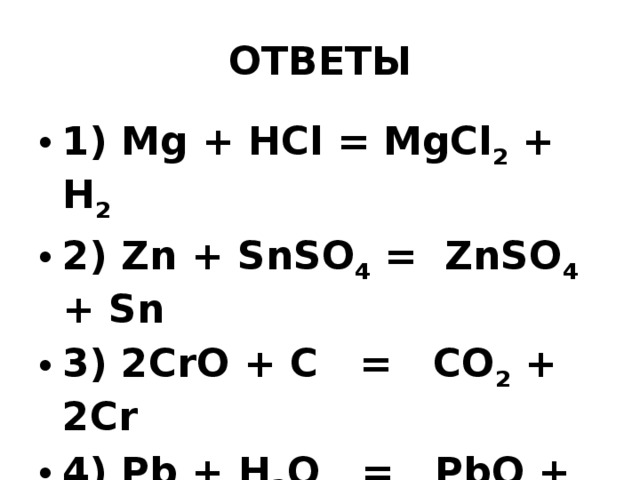
Как сбалансировать ${\\text{Mg + HCl}} \\ до {\\text{MgC}}{{\\text{l}}_{\\text{2}}}{\\text { + }}{{\\text{H}}_{\\text{2}}}$?
Последняя обновленная дата: 09 -й февраля 2023
•
Общее представление: 231,9K
•
Просмотры сегодня: 6,22K
Ответ
Проверено
231,9K+ виды
HINT: 202022 231,9K+ виды
HINT: 202020202 231,9K+ Views
HINT: 20202020202 231,9K+ виды
. уравнения, мы должны поддерживать одинаковую молекулярность каждого атома, присутствующего на стороне реагента, а также на стороне продукта данной химической реакции.
Полный пошаговый ответ:
Учитывая это, магний реагирует с соляной кислотой с образованием хлорида магния и газообразного водорода, и химическая реакция для этого показана следующим образом:
\text{MgC}}{{\text{l}}_{\text{2}}}{\text{ + }}{{\text{H}}_{\text{2}}}$
Для уравновешивая приведенное выше уравнение, мы должны учитывать следующие моменты:
— Сначала мы вычисляем количество каждого атома в левой и правой частях данного химического уравнения.
— Таким образом, в левой части или стороне реагента и в правой части или стороне продукта химической реакции присутствует только один атом магния (${\text{Mg}}$), что верно.
— В левой части присутствует один атом хлора (${\text{Cl}}$), а в правой — два атома хлора, что неверно.
— Точно так же слева присутствует только один атом водорода (${\text{H}}$), а справа два атома водорода (${\text{H}}$), что неверно.
Итак, мы уравновесим приведенную выше реакцию следующим образом, чтобы каждый атом имел одинаковую молекулярность как на стороне реагента, так и на стороне продукта реакции. И уравновешенное уравнение показано как:
И уравновешенное уравнение показано как:
}{{\text{H}}_{\text{2}}}$
— В приведенном выше сбалансированном уравнении один атом магния (${\text{Mg}}$), два атома водорода (${\text{ H}}$) и два атома хлора (${\text{Cl}}$) присутствуют как в левой, так и в правой части химической реакции.
Примечание: Здесь некоторые из вас могут подумать, что порядок реакции и молекулярность реакции — это одно и то же, но это будет верно только для элементарных (одностадийных) реакций.
Недавно обновленные страницы
Рассчитать изменение энтропии, связанное с конверсией класса 11 химии JEE_Main
Закон, сформулированный доктором Нернстом, является первым законом термодинамики класса 11 химии JEE_Main
Для реакции при rm0rm0rmC и нормальном давлении класса A 11 химия JEE_Main
Двигатель, работающий между rm15rm0rm0rmC и rm2rm5rm0rmC класс 11 химии JEE_Main
Для реакции rm2Clg в rmCrmlrm2rmg знаки химии класса 11 JEE_Main химия класса 11 JEE_Main
Закон, сформулированный доктором Нернстом, есть Первый закон термодинамики химия класса 11 JEE_Main
Для реакции при rm0rm0rmC и нормальном давлении Химия класса 11 JEE_Main
Двигатель, работающий между RM15RM0RM0RMCand RM2RM5RM0RMC Class 11 Chemistry Jee_Main
для реакции RM2CLG на RMCRMLRM2RMG Знаки CHIMISTIOR CHEMISTION_MAISMISTIORS 9000
.
= | Сбалансированное уравнение химической реакции
| Поиск |
Результаты поиска по химическому уравнению
Новости Только 5% НАСЕЛЕНИЯ знают
Реклама
1 результат найдено
Отображение уравнения от 1
Уравнение Результат #1
Нажмите, чтобы увидеть более подробную информацию и рассчитать вес/моль >>
Окислительно-восстановительная реакция Реакция одиночного замещения
| 2HCl | + | 30500 ± 0.00060″> Mg | → | H 2 | + | |||
| hydrogen chloride | магний | водород | хлорид магния | |||||
| (dd) | 0079 | (khí) | (dd) | |||||
| (không màu) | (trắng bạc) | (không màu) | (trắng) | |||||
| 2 | 1 | 1 | 1 | Hệ số | ||||
| Nguyên — Phân tử khối (g/mol) | ||||||||
| Số mol | ||||||||
| Khối lượng (g) |
Реклама
Дополнительная информация об уравнении 2HCl + Mg → H
2 + MgCl 2В каких условиях HCl (хлороводород) реагирует с Mg (магнием)?
Для этого химического уравнения не найдено информации
Объяснение: идеальные условия окружающей среды для реакции, такие как температура, давление, катализаторы и растворитель.
