Лучший ответ по мнению автора | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||
Другие ответы
| ||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
| Похожие вопросы |
Решено
тезнолог
Напишите изомеры пентановой кислоты изомеры пентаналя
Установите молекулярную формулу предельной карбоновой кислоты натриевой соли, которая содержит 37,5% углерода по массе
Решено
1,2-диметилбензол +KMnO4 ->? уравнение реакции
В промышленности азотную кислоту синтезируют в три этапа:
t, кат-р + О2 Н2О + О2
Nh4 = NO = NO2 = НNO3
При производстве азотной кислоты образуются нитрозные газы, пред-
ставляющие собой
смесь оксидов азота: NO, N2O, N2O3, N2O4.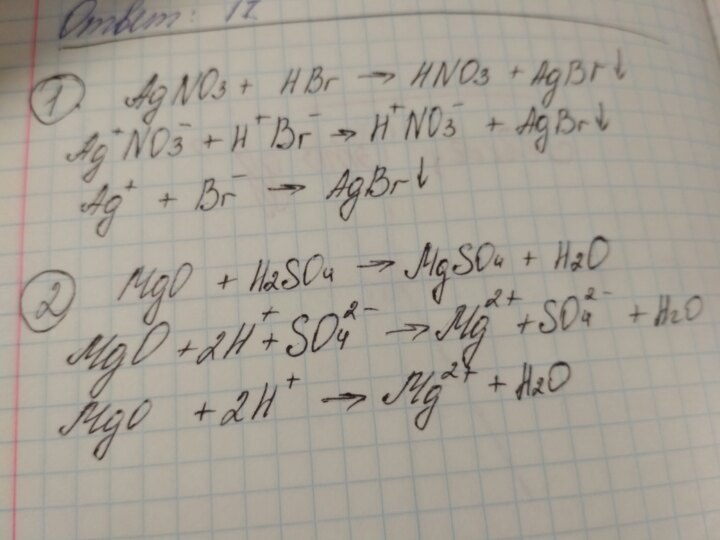 При
контак-
При
контак-
те этих с влажной поверхностью легких образуются азотистая и азотная68
кислоты, поражающие легкие, что приводит к отеку и сложным расстрой-
ствам. Кроме того, в крови образуются нитриты и нитраты. Под воздейст-
вием нитритов гемоглобин теряет способность связывать и переносить ки-
слород, таким образом, нитриты вызывают кислородную недостаточность.
В то же время в очень небольших количествах некоторые неорганические
нитриты(NаNO2) и органические нитраты (нитроглицерин) улучшают ко-
ронарное кровообращение и применяются для профилактики при ишеми-
ческой болезни сердца и снятия приступов стенокардии.
В лаборатории азотную кислоту получают по реакции при слабом нагре-
вании:
NaNO3 + h3SO4 (конц.)=НNO3↑ + NaHSO4
НNO3 – сильная кислота, соли азотной кислоты гидролизу не подверга-
ются: НNO3 = Н + + NO3-
Азотная кислота – достаточно сильный окислитель.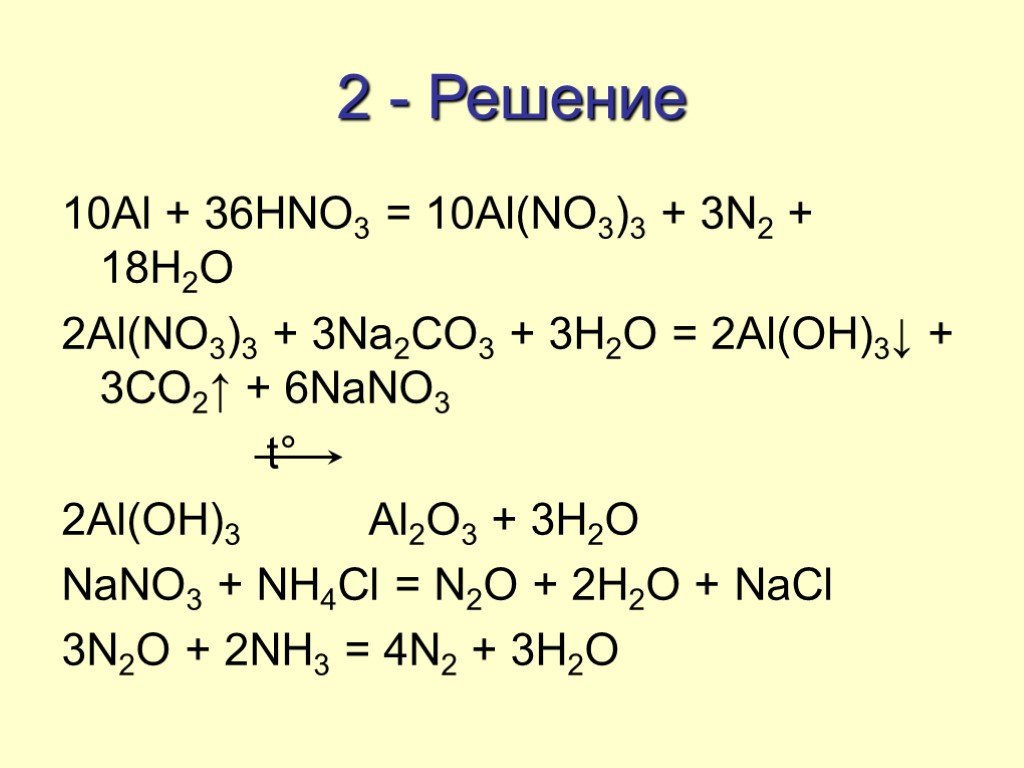 Продуктами вос-
Продуктами вос-
становления одновременно могут быть: NO2, NO2-, NO, N2O, N2, NН4+.
Причем доля продуктов с низкими степенями окисления азота возрастает
по мере разбавления кислоты и активности восстановителя. Запись уравне-
ний окислительно-восстановительных реакций с НNO3 условна, так как
указывают только один продукт восстановления, который преобладает при
данных условиях протекания реакции.
Азотная кислота взаимодействует со многими неметаллами:
3 Р + 5 НNO3 (конц.) + 2 Н2О → 3 Н3РО4 + 5 NO
3 С + 4 НNO3 (конц.)→ 3 СО2 + 4 NO + 2 Н2О
Au, Pt, Rh, Ir – не взаимодействуют с НNO3, Fe, Al, Со, Ni, Cr, Be – пас-
сивируются азотной концентрированной кислотой в результате образова-
ния плотной оксидной пленки.
Взаимодействие НNO3 с малоактивными металлами:
3 Ag + 4 НNO3 (разб.)= 3 AgNO3 + NO + 2 Н2О
Ag + 2 НNO3 (конц.)= AgNO3 + NO2 + Н2О
Взаимодействие НNO3 с активными металлами:
4 Zn + 10 НNO3 (разб. )
= 4 Zn(NO3)2 + N2O + 5 Н2О
)
= 4 Zn(NO3)2 + N2O + 5 Н2О
4 Mg + 10 НNO3 (оч. разб.)= 4 Mg(NO3)2 + Nh5NO3 + 3 Н2О
Взаимодействие «царской водки» с металлами (смесь концентрирован-
ных НNO3 и НС1 в соотношении 1 : 3)
НNO3 + 3 НС1 = С12 + 2 Н2О + NOС1
NOС1 = NO + ½ С12
«С1» в момент выделения состоит из атомов, это и обуславливает высо-
кую окислительную способность царской водки
3 Pt + 4НNO3 + 12 НС1 = PtС14 + 4 NO + 8 Н2О
PtС14 + 2 НС1 = Н2[PtС16]
Au + НNO3 + 3 НС1 = AuС13 + NO + 2 Н2О
AuС13 + НС1 = Н[AuС14] 69
Растворы солей азотистой и азотной кислот обладают незначительными
окислительными свойствами (с наиболее сильными восстановителями)
КNO2 + 2А1 + КОН + 5Н2О = Nh4 + 2 К[A1(ОН)4](при нагревании)
3 КNO3 + 8 А1 + 5 КОН + 18 Н2О = 3 Nh4 + 8 К[A1(ОН)4]
4 Zn + KNO3 + 7 KOH = 4 K2ZnO2 + Nh4↑ + h3O
Свойства солей
азотной кислоты.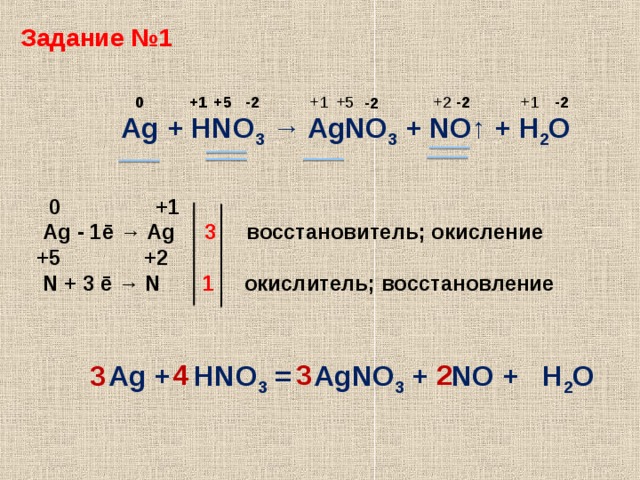 Соли азотной кислоты – нитраты –
Соли азотной кислоты – нитраты –
белого цвета, хорошо растворимы в воде. Соли щелочных и щелочно-
земельных металлов называют селитрами.
Характер разложения солей зависит от металла, образующего данную соль:
1. Соли наиболее активных металлов (до магния)
2 КNO3 = 2 КNO2 + О2
На этом свойстве основано использование нитрата калия в пиротехнике
и для получения черного или дымного пороха, который представляет смесь
КNO3 , древесного угля и серы.
2 КNO3 + 3 С + S = К2S + 3 СО2 + N2
(могут еще образовываться К2SО4, К2СО3 — дым)
2.Соли металлов, расположенных в ряду напряжений правее магния вклю-
чая медь:
2 Mg(NO3)2 = 2 MgO + 4 NO2 + O2
3. Соли малоактивных металлов (правее меди):
2 AgNO3= 2 Ag + 2 NO2 + О2
4HNO3 4NO2 + 2h3O+O2↑ (комн., на свету).
2. HNO3 +h3O NO−3 +h4O+.
3. HNO3(разб.)+NaOH = NaNO3 +h3O,
HNO3(разб. )+Nh4
· h3O = Nh5NO3 +h3O.
)+Nh4
· h3O = Nh5NO3 +h3O.
4. 2HNO3(2–3%-я) + 8H0(Zn, разб. h3SO4) = Nh5NO3 + 3h3O,
2HNO3(5%-я) + 8H0(Mg, разб. h3SO4) = N2O↑ +5h3O,
HNO3(30%-я) + 3H0(Zn, разб. h3SO4) = NO+2h3O,
HNO3(60%-я) + 2H0(Zn, разб. h3SO4) = HNO2 +h3O (кат. Pd).
5. 2HNO3(конц.)+Ag = AgNO3 +NO2↑ +h3O.
6. 8HNO3(разб.)+3Cu = 3Cu(NO3)2 + 2NO↑ +4h3O,
10HNO3(разб.)+4Mg = 4Mg(NO3)2 +N2O↑ +5h3O (примесь h3),
12HNO3(разб.)+5Sn τ −−→ 5Sn(NO3)2 +N2↑ +6h3O (примесь NO).
7. 30HNO3(оч. разб.)+8Al = 8Al(NO3)3 + 3Nh5NO3 + 9h3O (примесь h3).
8. 12HNO3(оч. разб.)+5Fe = 5Fe(NO3)2 +N2↑ +6h3O (0–10◦ C),
4HNO3(разб.)+Fe = Fe(NO3)3 +NO↑ +2h3O.
9. 4HNO3(конц., гор.)+Hg = Hg(NO3)2 + 2NO2↑ +2h3O,
8HNO3(разб., хол.)+6Hg = 3Hg2(NO3)2 + 2NO↑ +4h3O.
10. 4HNO3(конц.)+Ge τ −−→ GeO2↓ +4NO2↑ +2h3O.
11. 6HNO3(конц.)+S = h3SO4 + 6NO2↑ +2h3O (кип.),
5HNO3(конц.)+P(красн.)= h4PO4 + 5NO2↑ +h3O (кип.).
12.
10HNO3(конц.,
гор.)+I2
= 2HIO3 + 10NO2↑ +4h3O.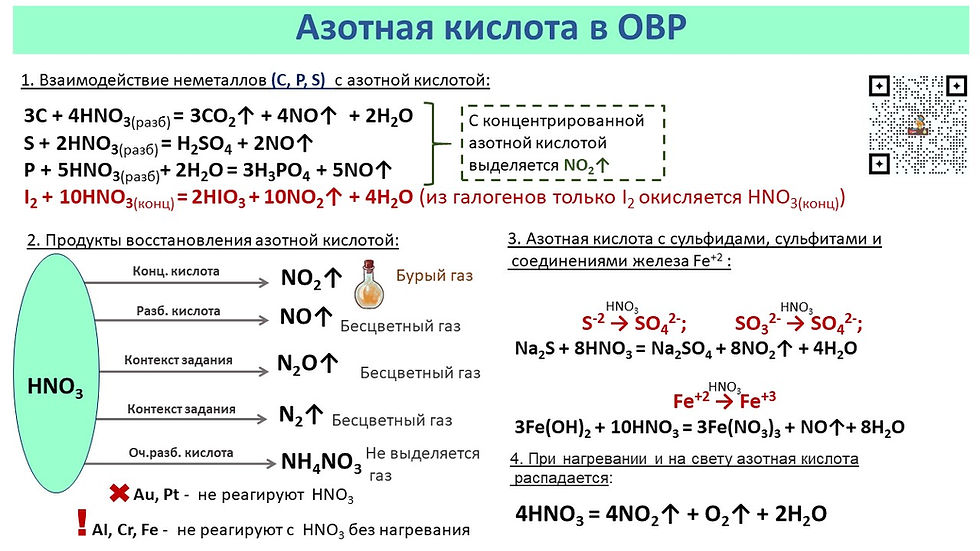
13. 2HNO3(разб.)+MgO = Mg(NO3)2 +h3O.
14. 2HNO3(разб.)+Cu(OH)2 = Cu(NO3)2 + 2h3O.
15. 4HNO3(конц.)+Na2[Zn(OH)4] = Zn(NO3)2 + 2NaNO3 + 4h3O,
2HNO3(разб.)+Na2[Zn(OH)4] = Zn(OH)2↓ +2NaNO3 + 2h3O.
16. 2HNO3 +Na2CO3 = 2NaNO3 +CO2↑ +h3O,
2HNO3(оч. разб.)+CaSO3 = Ca(NO3)2 +SO2↑ +h3O.
17. HNO3(конц.)+KF(т) = KNO3 +HF↑.
18. 3HNO3(разб.)+[Ag(Nh4)2]OH = AgNO3 + 2Nh5NO3 +h3O,
6HNO3(конц.)+[Ni(Nh4)6](NO3)2 = Ni(NO3)2 + 6Nh5NO3.
19. HNO3(конц.)+h3O2(конц.) HNO2(O2− 2 ) + h3O.
20. 2HNO3(конц., гор.)+SO2 = h3SO4 + 2NO2↑.
21. 2HNO3(конц.)+As2O3 + 2h3O = 2h4AsO4 +N2O3↑ (0◦ C),
4HNO3(конц.)+As2O3 +h3O = 2h4AsO4 + 4NO2↑ (кип.).
22. 6HNO3(60%-я) + HI = HIO3 + 6NO2↑ 3h3O (кип.),
4HNO3(конц.)+3KI(т) = K[I(I2)] + 2NO2↑ +2h3O+2KNO3 (комн.).
23. 2HNO3(разб., хол.)+3H(Ph3O2) τ −−→ 3h3(PHO3) + 2NO↑ +h3O.
160
24. 4HNO3(конц.)+MCl2 =M(NO3)2 + 2HCl + NO2↑ +h3O (M= Fe, Cr).
25.
2HNO3(конц.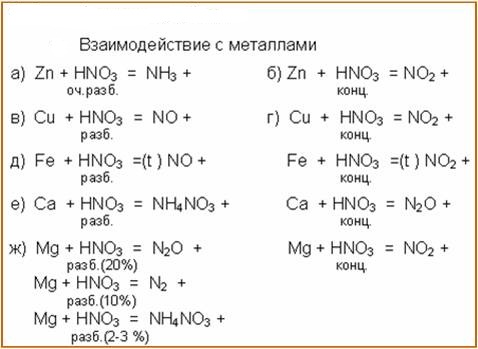 ,
хол.)+h3S(насыщ.)
τ
−−→ S↓ +2NO2 + 2h3O,
,
хол.)+h3S(насыщ.)
τ
−−→ S↓ +2NO2 + 2h3O,
4HNO3(конц.)+Na2S = 2NaNO3 + 2NO2↑ +S↓ +2h3O,
8HNO3(конц.)+CuS(т) = CuSO4 + 8NO2↑ +4h3O (кип.).
26. HNO3(конц.)+Na(SO3Nh3) = NaHSO4 + (NO+2 )NH−2 .
27. HNO3(конц.)+3HCl(конц.) (NO)Cl + 2Cl0 + 2h3O (комн.),
2HNO3(конц.)+6HCl(конц.)= 2NO↑ +3Cl2↑ +4h3O (100–150◦ C).
28. HNO3(конц.)+4HCl(конц.)+Au = H[AuCl4] +NO↑ +2h3O.
29. 4HNO3(конц.)+18HCl(конц.)+3Pt = 3h3[PtCl6] + 4NO↑ +8h3O.
30. 4HNO3(конц.)+18HF(конц.)+3Si = 3h3[SiF6] + 4NO↑ +8h3O,
2HNO3(конц., гор.)+4HF(конц.)+W τ −−→ h3[WO2F4] + 2NO↑ +2h3O.
31. 2HNO3(разб.)+3h3SO4(разб.)+6Hg = 2NO↑ +3Hg2SO4↓ +4h3O.
32. 2HNO3(конц.)+h3SO4(конц.)+2h3O электролиз
−−(−на−H−g-к−ат−од−е)→
(Nh4OH)2SO4(катод) +
+3O2↑(анод) [до 15◦ C].
33. 4NO3(дымящ.)+P4O10 = 2N2O5 + 4HPO3 (в атмосфере O2 +O3).
34. HNO3(безводн.)+F2 = (NO2)OF + HF (комн.).
35. HNO3(безводн.)+HSO3Cl = (NO2)Cl↑ +h3SO4 (0◦ C).
36.


 S. Не забывайте выбирать лучший ответ по мнению автора!
S. Не забывайте выбирать лучший ответ по мнению автора!