СУНЦ УрФУ
Расписание
Электронный журнал
Поступающим
Олимпиады, турниры, конкурсы
Планы работы
Подготовительные курсы
Новости:
24.10.2022
СУНЦ на конкурсе «Университетская книга»
Издания СУНЦ УрФУ получили высокую оценку на межрегиональном конкурсе.
20.10.2022
УрКОП: шаг вперёд сделан!
Учащийся СУНЦ в составе команды стал победителем командной олимпиады по программированию.
19.10.2022
«Любите общагу!»
Лицеисты, живущие в интернате, поздравили воспитателей.
14.10.2022
СУНЦ как кузница ученых будущего
Лицеист СУНЦ стал победителем международного конкурса в номинации «Математика».
07.10.2022
Все учителя СУНЦ — бриллианты!
Под этим девизом пятого октября в СУНЦ прошел концерт в честь Дня учителя.
29.09.2022
Лицеисты СУНЦ покорили хребет Зюраткуль!
В последние выходные сентября учащиеся СУНЦ побывали в национальном парке «Зюраткуль».
Больше новостей
Видеогалерея:
Концерт к Дню учителя (2022)
Репортаж ТРК «Вести-Урал» о гаджетах у школьника (2022)
Концерт, посвященный Дню Победы (5 мая 2022 года)
Больше видео
О нас:
Специализированный учебно-научный центр (СУНЦ) — структурное подразделение ФГАОУ ВО «УрФУ имени первого Президента России Б.Н. Ельцина», созданное в 1990 году как нетиповое структурное подразделение вуза, осуществляющее углубленное дифференцированное обучение по программам основного общего и среднего общего образования. Всего в России 10 СУНЦев. До мая 2011 года СУНЦ работал в составе Уральского государственного университета имени А. М. Горького (УрГУ).
В настоящее время СУНЦ имеет в своем составе 8 кафедр, укомплектованных профессорско-преподавательским составом УрФУ и учителями. Обучение производится по авторским программам, разработанным в соответствии с федеральными государственными образовательными стандартами; в составе СУНЦ — 8–11 классы различных профилей.
Иногородние обучающиеся проживают в уютном общежитии.
Прием производится в 8, 9 и 10 классы. Работают подготовительные курсы.
Подробнее о правилах приема в СУНЦ можно узнать в отделе конкурсного отбора
по телефону +7 343 367-82-22 и в разделе нашего сайта «Поступающим».
Как нас найти:
Данилы Зверева ул., 30, Екатеринбург. N56°52´4˝ E60°39´16˝
Проезд:
- автобусами № 48, 52, 81 до остановки «Фирма Авангард»;
- автобусами № 28, 58 до остановки «Данилы Зверева», далее 7 минут пешком по улице Данилы Зверева;
- троллейбусом № 18 до остановки «Данилы Зверева», далее 14 минут пешком по улицам Сулимова, Данилы Зверева;
- троллейбусами № 4 до остановки «Сулимова», № 12, 19 до остановки «Боровая», далее 15 минут пешком по улицам Боровая, Вилонова, Данилы Зверева.
ЕГЭ. Электролитическая диссоциация солей, кислот, щелочей. Реакции ионного обмена. Гидролиз солей 11 класс
Тема 5: Растворы и их концентрация, дисперсные системы, электролитическая диссоциация, гидролиз
Урок 4: ЕГЭ.
 Электролитическая диссоциация солей, кислот, щелочей. Реакции ионного обмена. Гидролиз солей
Электролитическая диссоциация солей, кислот, щелочей. Реакции ионного обмена. Гидролиз солей- Видео
- Тренажер
- Теория
Заметили ошибку?
Задания с выбором ответов А1-А15
I. Выбор одного правильного варианта из 4 предложенных.
|
Вопрос |
Комментарий |
|
А1. Сильными электролитами являются: 1. CO2 2. H2S 3. O2 4. H2SO4 |
По определению, сильные электролиты – это вещества, которые в водном растворе полностью распадаются на ионы. СО2 и О2 сильными электролитами являться не могут. Правильный ответ 4. |
|
А2. Вещества, которые диссоциируют только на ионы металла и гидроксид ионы, являются: 1. кислотами 2. щелочами 3. солями 4. амфотерными гидроксидами |
По определению, соединение, которое при диссоциации в водном растворе образует только гидроксид-анионы, называется основанием. Под данное определение подходит только щелочь и амфотерный гидроксид. Но в вопросе звучит, что соединение должно диссоциировать только на катионы металла и гидроксид-анионы. Амфотерный гидроксид диссоциирует ступенчато, и поэтому в растворе ионы гидроксометалла. Правильный ответ 2. |
|
А3. Реакция обмена происходит до конца с образованием нерастворимого в воде вещества между: 1. 2. NaCl и CuSO4 3. CaCO3 и HCl (р-р) 4. KOH и HNO3 |
Для ответа нужно написать эти уравнения и посмотреть в таблице растворимости, есть ли среди продуктов нерастворимые вещества. Это в первой реакции гидроксид магния Mg(OH)2
Правильный ответ 1. |
|
А4. Сумма всех коэффициентов в полном и сокращенном ионном виде в реакции между Fe(NO3)2 +2NaOH равна: 1. 10 и 3 2. 12 и 3 3. 10 и 4 4. 12 и 4 |
Fe(NO3)2 +2NaOH Fe(OH)2↓ +2Na NO3 молекулярное Fe2++2NO3— +2Na+2OH— Fe(OH)2↓ +2Na++2 NO3— полное ионное уравнение, сумма коэффициентов равна 12 Fe2+ + 2OH— Fe(OH)2↓ сокращенное ионное, сумма коэффициентов равна 4 Правильный ответ 4. |
|
А5. Сокращенное ионное уравнение реакции Н++ОН—→Н2О соответствует взаимодействию: 1. Н2 + О2 2. NaOH(Р-Р)+HNO3 3. Cu(OH)2+ HCl 4. CuO + H2SO4 |
Это сокращенное уравнение отражает взаимодействие между сильным основанием и сильной кислотой. Основание есть в 2 и 3 вариантах, но Cu(OH)2 – это нерастворимое основание
Правильный ответ 2. |
|
А6. Реакция ионного обмена протекает до конца при сливании растворов: 1. нитрата натрия и сульфата калия 2. сульфата калия и соляной кислоты 4. |
Напишем, как долны были бы проходить реакции ионного обмена между каждой парой веществ. NaNO3+K2SO4→Na2SO4 +KNO3 K2SO4 +HCl→H2SO4 +KCl CaCl2+2AgNO3 → 2AgCl↓ + Ca(NO3)2 Na2SO4+ KCl → K2SO4+ NaCl По таблице растворимости видим, что AgCl↓ Правильный ответ 3. |
|
А7. В водном растворе ступенчато диссоциирует: 1. K2SO4 2. K2S3. H2S 4. Na2SO4 |
Ступенчатой диссоциации в водном растворе подвергаются многоосновные кислоты.
Правильный ответ 3. |
|
А8. Уравнению реакции СuCl2+2KOH→Cu(OH)2↓+2KCl соответствует сокращенное иооное уравнение: 1. СuCl2+2OH—→Cu2++2OH—+2Cl— 2. Сu2++KOH→Cu(OH)2↓+K 3. Cl—+K+→KCl 4. Сu2++2OH—→Cu(OH)2↓ |
Напишем полное ионное уравнение: Сu 2++2Cl—+2К++2OH—→ Cu(OH)2↓+2K+ +2Cl— Исключаем несвязанные ионы, получаем сокращенное ионное уравнение Сu2++2OH—→Cu(OH)2↓
Правильный ответ 4. |
|
А9. Практически до конца идет реакция: 1. Na2SO4+ KCl→ 2. Н2SO4+ ВаCl2→ 3. КNO3+NaOH→ 4. Na2SO 4+ CuCl2→ |
Напишем предположительные реакции ионного обмена: Na2SO4+ KCl→ К2SO4+ Na Cl Н2SO4+ ВаCl2→ ВаSO4↓ + 2НCl КNO3+NaOH→ NaNO3 + KOH Na2SO4+ CuCl2→ CuSO4 + 2NaCl По таблице растворимости видим ВаSO4↓ Правильный ответ 2. |
|
А10. Нейтральную среду имеет раствор: 1. 3. FeSO4 4. Na2S |
Нейтральную среду имеют только водные растворы солей, образованных сильным основанием и сильной кислотой. NaNO3 – это соль, образованная сильным основанием NaOH и сильной кислотой HNO3. Правильный ответ 1. |
|
А11. Кислотность почвы можно увеличить введением раствора: 1. NH4NO3 2. NaNO3 3. NaCl 4. Na2SO4 |
Нужно определить, какая соль будет давать кислую реакцию среды. Это должна быть соль, образованная сильной кислотой и слабым основанием. Это NH4NO3.
Правильный ответ 1. |
|
А12. Гидролиз протекает при растворении в воде: 1. СaBr2 2. Ba(NO3)2 3. Na2SO4 4. AlCl3 |
Гидролизу не подвергаются только соли, образованные сильным основанием и сильной кислотой. Во всех приведенных солях содержатся анионы сильных кислот. Только AlCl3 содержит катион слабого основания. Правильный ответ 4. |
|
А 13. Гидролизу не подвергается: 1. уксусная кислота 2. этиловый эфир уксусной кислоты 3. крахмал 4. белок |
Гидролиз имеем большое значение в органической химии. Эфиры, крахмал и белок подвергаются гидролизу.
Правильный ответ 1. |
|
А14. Какой цифрой обозначен фрагмент молекулярного уравнения химической реакции, соответствующей кратному ионному уравнению Сu2++2OH—→Cu(OH)2↓? 1. Cu(OH)2+ HCl→ 2. CuCO3+ H2SO4→ 3. CuO + HNO3→ 4. CuSO4 +KOH→ |
По сокращенному уравнению следует, что нужно взять любое растворимое соединение, содержащее ион меди и гидроксид-ион. Из всех приведенных соединений меди только CuSO4 растворим, и только в водной реакции есть ОН—.
Правильный ответ 4. |
|
А15. При взаимодействии каких веществ выделится оксид серы: 1. Na2SO3и HCl 2. AgNO3и K2SO4 3. BaCO3и HNO3 4. Na2S и HCl
|
В первой реакции получается нестойкая кислота Н2SO3, которая распадается на воду и оксид серы (IV)
Правильный ответ 1. |
Задания с кратким ответом и на соответствие В1-В6
II. Задания с кратким ответом и на соответствие.
|
В1. Общая сумма всех коэффициентов в полном и сокращенном ионном уравнении реакции между нитратом серебра и гидроксидом натрия равна… |
Напишем уравнение реакции: 2AgNO3 +2NaOH→Ag2O↓+ 2NaNO3+H2O Полное ионное уравнение: 2Ag++2NO3— +2Na++2OH—→Ag2O↓+ 2Na++2NO3—+H2O Сокращенное ионное уравнение: 2Ag++2OH—→Ag2O↓+H2O Правильный ответ: 20 |
|||||||||||
|
В2.
|
КOH + Al(OH)3↓→ K[Al(OH)4] Полное ионное уравнение: К++OH— + Al(OH)3↓ → K++[Al(OH)4]—
Правильный ответ: 4 иона. |
|||||||||||
|
В3. Установите соответствие между названием соли и отношением её к гидролизу:
|
Для ответа на вопрос нужно проанализировать, какими по силе основанием и кислотой образованы эти соли.
Правильный ответ: А4 Б3 В4 Г3 |
|||||||||||
|
В4. Раствор одного моль сульфата натрия содержит 6,02ионов натрия. Рассчитайте степень диссоциации соли. |
Напишем уравнение электролитической диссоциации сульфата натрия: Na2SО4↔ 2Na++SО42- Распалось на ионы 0,5 моль сульфата натрия. |
|||||||||||
|
В5. Установите соответствие между реагентами и сокращенными ионными уравнениями:
Правильный ответ: В1 А2 Б3 Г4 |
||||||||||||
|
В6. Составьте полное ионное уравнение, соответствующее сокращенному: СO32-+2H+ → CO2 ↑+H2O. |
Нужно взять любой растворимый карбонат и любую растворимую сильную кислоту. Молекулярное: Na2СO3+2HCl→ CO2 ↑+H2O +2NaCl; Полное ионное: 2Na++СO32-+2H++2Cl—→ CO2 ↑+H2O +2Na++2Cl—;
|
Задания с развернутым ответом С1-С2
III.Задания с развернутым ответом
|
Вопрос |
Комментарий |
|
С1. |
При химических реакциях происходит образование соединений. При растворении белого безводного сульфата меди в воде образуется голубой раствор.См. Рис. 1. При сольватации ионов меди, образующихся при диссоциации соли, образуются гидроксокомплексы, которые имеют голубую окраску. Кроме того, при этом выделяется тепло. СuSO4→ Сu2++SO42-; Сu2++n(H2O)→ [Сu (H2O) n]2+ Физическую составляющую процесса можно подтвердить тем, что в растворе данное соединение не имеет четкого состава. Из получившегося раствора, исходный сульфат меди можно получить при нагревании, т. е. нехимическим способом.
|
|
С2. Объясните, что общего в растворах соляной кислоты, хлорида натрия, хлорида кальция и хлорида алюминия. |
Формулы этих соединений: HCl, NaCl, CaCl2, AlCl3. В состав каждого из этих соединений входит хлорид-ион, который при добавлении раствора нитрата серебра образует осадок нитрата серебра. Ag++Cl— → AgCl↓ |
Подведение итогов урока
На уроке рассматривалось решение задач из ЕГЭ по теме «ЕГЭ. Электролитическая диссоциация солей, кислот, щелочей. Реакции ионного обмена. Гидролиз солей». Вы рассмотрели решение задач из ЕГЭ группы А, В и С на различные темы: «Растворы и их концентрации», «Электролитическая диссоциация», «Реакции ионного обмена и гидролиз». Для решения этих задач, помимо знания рассматриваемых тем, также было проверено умение пользоваться таблицей растворимости веществ, знание метода электронного баланса и представление о обратимости и необратимости реакций.
Список литературы
- Рудзитис Г. Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф. Г. Фельдман. – 14-е изд. – М.: Просвещение, 2012.
- Попель П. П. Химия: 8 кл.: учебник для общеобразовательных учебных заведений / П. П. Попель, Л. С.Кривля. – К.: ИЦ «Академия», 2008. – 240 с.: ил.
- Учебно-тренировочные материалы для подготовки к единому государственному экзамену. Химия/ Каверина А. А., Добротин Д. Ю., Медведев Ю. Н., Корощенко А. С. – М.: Интеллект- Центр, 2011.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
- Интернет-портал «internerurok.ru» (Источник)
- Официальный информационный портал Единого Государственного Экзамена (Источник)
- Интернет-портал «chemport.ru» (Источник)
- Химик (Источник)
Домашнее задание
- №№ 9-11 (с.
 68) Рудзитис Г. Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф. Г. Фельдман. – 14-е изд. – М.: Просвещение, 2012.
68) Рудзитис Г. Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф. Г. Фельдман. – 14-е изд. – М.: Просвещение, 2012. - При полном окислении 4 г простого вещества образуется 36 г оксида состава Э2О. Найти молярную массу простого вещества.
- В какой цвет окрасится лакмус в растворе хлорида алюминия? Почему индикатор изменяет окраску?
Заметили ошибку?
Расскажите нам об ошибке, и мы ее исправим.Видеоурок: ЕГЭ. Электролитическая диссоциация солей, кислот, щелочей. Реакции ионного обмена. Гидролиз солей по предмету Химия за 11 класс.
Реакции нейтрализации | Введение в химию – 1-е канадское издание
Цели обучения
- Определение кислоты и основания.
- Определите реакцию нейтрализации и предскажите ее продукты.
В главе 3 «Атомы, молекулы и ионы», раздел 3.5 «Кислоты», мы определили кислоту как ионное соединение, содержащее H + в качестве катиона.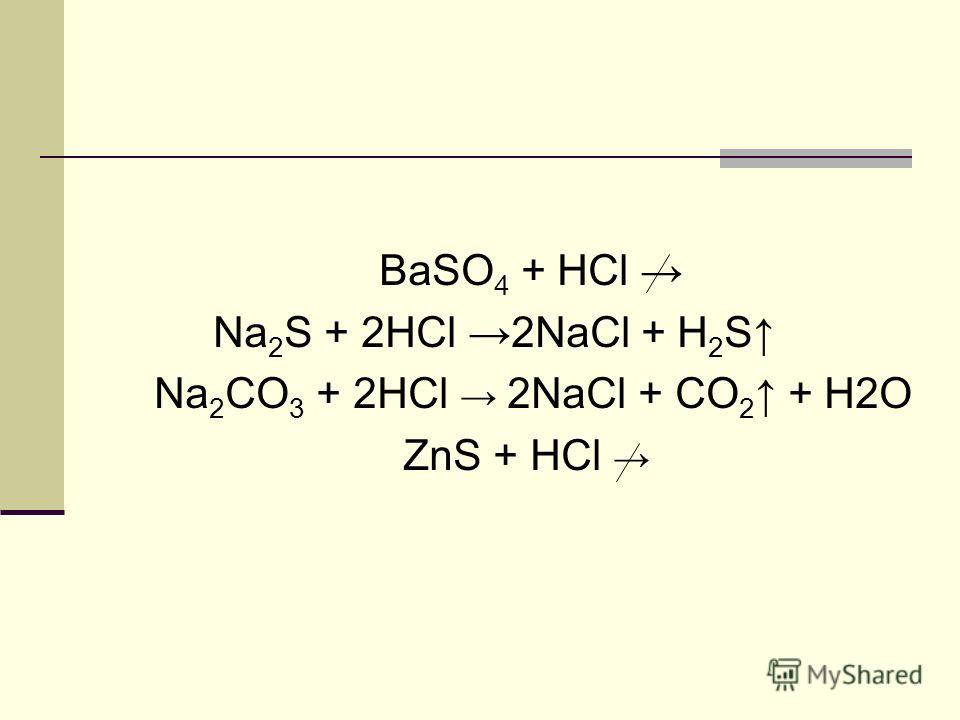 Это немного неверно, но пока не были разработаны дополнительные понятия, нужно было подождать лучшего определения. Теперь мы можем дать новое определение кислоте: кислота – это любое соединение, которое увеличивает количество ионов водорода (H + ) в водном растворе. Химической противоположностью кислоты является основание. Эквивалентное определение основания состоит в том, что основание – это соединение, которое увеличивает количество гидроксид-иона (OH — ) в водном растворе. Эти первоначальные определения были предложены Аррениусом (тот же человек, который предложил диссоциацию ионов) в 1884 году, поэтому они называются определением по Аррениусу кислоты и основания соответственно.
Это немного неверно, но пока не были разработаны дополнительные понятия, нужно было подождать лучшего определения. Теперь мы можем дать новое определение кислоте: кислота – это любое соединение, которое увеличивает количество ионов водорода (H + ) в водном растворе. Химической противоположностью кислоты является основание. Эквивалентное определение основания состоит в том, что основание – это соединение, которое увеличивает количество гидроксид-иона (OH — ) в водном растворе. Эти первоначальные определения были предложены Аррениусом (тот же человек, который предложил диссоциацию ионов) в 1884 году, поэтому они называются определением по Аррениусу кислоты и основания соответственно.
Вы можете понять, что, основываясь на описании атома водорода, H 9Ион 0011 + — это атом водорода, потерявший свой одинокий электрон; то есть H + — это просто протон. Действительно ли у нас есть голые протоны, движущиеся в водном растворе? Нет. Более вероятно, что ион H + присоединился к одной (или нескольким) молекулам воды. Чтобы представить это химически, мы определяем ион гидроксония H 3 O + (водный раствор), молекулу воды с присоединенным к ней дополнительным ионом водорода. как H 3 O + , что представляет собой дополнительный протон, присоединенный к молекуле воды. Мы используем ион гидроксония как более логичный способ появления иона водорода в водном растворе, хотя во многих химических реакциях H + и H 3 O + обрабатываются одинаково.
Более вероятно, что ион H + присоединился к одной (или нескольким) молекулам воды. Чтобы представить это химически, мы определяем ион гидроксония H 3 O + (водный раствор), молекулу воды с присоединенным к ней дополнительным ионом водорода. как H 3 O + , что представляет собой дополнительный протон, присоединенный к молекуле воды. Мы используем ион гидроксония как более логичный способ появления иона водорода в водном растворе, хотя во многих химических реакциях H + и H 3 O + обрабатываются одинаково.
Реакция кислоты и основания называется реакцией нейтрализации. Хотя кислоты и основания имеют свой собственный уникальный химический состав, кислота и основание нейтрализуют химический состав друг друга, образуя довольно безобидное вещество — воду. Фактически, общая реакция между кислотой и основанием представляет собой
кислота + основание → вода + соль
, где термин соль обычно используется для определения любого ионного соединения (растворимого или нерастворимого), которое образуется в результате реакции между кислотой и база. (В химии слово соль относится не только к поваренной соли.) Например, сбалансированное химическое уравнение для реакции между HCl (водн.) и KOH (водн.) имеет вид
(В химии слово соль относится не только к поваренной соли.) Например, сбалансированное химическое уравнение для реакции между HCl (водн.) и KOH (водн.) имеет вид
HCl (водн.) + KOH (водн.) → H 2 O (л) + KCl (водн.)
, где солью является KCl. Подсчитав количество атомов каждого элемента, мы находим, что в качестве продукта образуется только одна молекула воды. Однако в реакции между HCl(водн.) и Mg(OH) 2 (водн.) требуются дополнительные молекулы HCl и H 2 O, чтобы сбалансировать химическое уравнение:
2 HCl(водн.) + Mg(OH) 2 (водн.) → 2 H 2 O(л) + MgCl 2 (водн.)
Здесь соль MgCl 2 . (Это одна из нескольких реакций, которые происходят, когда тип антацида — основание — используется для лечения желудочной кислоты.)
Пример 11
Напишите реакции нейтрализации каждой кислоты и основания.
- HNO 3 (водн.) и Ba(OH) 2 (водн.
 )
) - H 3 PO 4 (водный) и Ca(OH) 2(водн.)
Решение
Сначала мы напишем химическое уравнение с формулами реагентов и ожидаемых продуктов; тогда мы сбалансируем уравнение.
Ожидаемыми продуктами являются вода и нитрат бария, поэтому начальная химическая реакция
.HNO 3 (водн.) + Ba(OH) 2 (водн.) → H 2 O(л) + Ba(NO 3 ) 2 (водн.)
Чтобы сбалансировать уравнение, нам нужно понять, что будет два H 2 молекул O, поэтому требуются две молекулы HNO 3 :
2HNO 3 (водн.) + Ba(OH) 2 (водн.) → 2H 2 O(л) + Ba(NO 3 ) 2 (водн.)
Это химическое уравнение теперь сбалансировано.
Ожидаемыми продуктами являются вода и фосфат кальция, поэтому исходное химическое уравнение имеет вид
.H 3 PO 4 (водн.
 ) + Ca(OH) 2 (водн.) → H 2 O(л) + Ca 3 (ПО 4 ) 2 (с)
) + Ca(OH) 2 (водн.) → H 2 O(л) + Ca 3 (ПО 4 ) 2 (с)Согласно правилам растворимости, Ca 3 (PO 4 ) 2 нерастворим, поэтому он имеет метку фазы (s). Чтобы сбалансировать это уравнение, нам нужны два иона фосфата и три иона кальция; мы получаем шесть молекул воды, чтобы сбалансировать уравнение:
2 H 3 PO 4 (водн.) + 3 Ca(OH) 2 (водн.) → 6 H 2 O(л) + Ca 3 (PO 4 2 8 2 с)
Это химическое уравнение теперь сбалансировано.
Проверь себя
Напиши реакцию нейтрализации между H 2 SO 4 (водн.) и Sr(OH) 2 (водн.).
Answer
H 2 SO 4 (aq) + Sr(OH) 2 (aq) → 2 H 2 O(ℓ) + SrSO 4 (aq)
Neutralization реакции — это один тип химической реакции, которая протекает, даже если один реагент не находится в водной фазе. Например, химическая реакция между HCl(aq) и Fe(OH) 3 (т) все еще протекает в соответствии с уравнением
Например, химическая реакция между HCl(aq) и Fe(OH) 3 (т) все еще протекает в соответствии с уравнением
3 HCl(водн.) + Fe(OH) 3 (т) → 3 H хотя Fe(OH) 3 не растворяется. Когда известно, что Fe(OH) 3 (s) является компонентом ржавчины, это объясняет, почему некоторые чистящие растворы для пятен ржавчины содержат кислоты — в результате реакции нейтрализации образуются растворимые и смываемые продукты. (Одним из способов удаления ржавчины и пятен ржавчины является промывка кислотами, такими как HCl, но HCl следует использовать с осторожностью!)
Полные и суммарные ионные реакции для реакций нейтрализации будут зависеть от того, растворимы ли реагенты и продукты, даже если кислота и основание реагируют. Например, в реакции HCl(водн.) и NaOH(водн.),
HCl(водн.) + NaOH(водн.) → H 2 O(л) + NaCl(водн.)
полная ионная реакция
H + (водн.) + Cl — (водн.) + Na + (водн. ) + OH — (водн.) → H 2 O(л) + Na + (водн.) Кл — (водн.)
) + OH — (водн.) → H 2 O(л) + Na + (водн.) Кл — (водн.)
Ионы Na + (водн.) и Cl − (водн.) являются ионами-спектаторами, поэтому мы можем удалить их, чтобы получить
H + (водн.) + OH ) → H 2 O(ℓ)
в виде результирующего ионного уравнения. Если бы мы хотели записать это с точки зрения иона гидроксония, H 3 O + (водн.), мы бы записали это как
H 3 O + (водн.) + OH − (водн. ) → 2H 2 O(ℓ)
За исключением введения дополнительной молекулы воды, эти два суммарных ионных уравнения эквивалентны.
Однако для реакции между HCl(aq) и Cr(OH) 2 (s), поскольку гидроксид хрома(II) нерастворим, мы не можем разделить его на ионы для полного ионного уравнения:
2 H + (водн.) + 2 Cl — (водн.) + Cr(OH) 2 (т) → 2 H 2 O(л) + Cr 2+ (водн. ) + 2 Cl — (водн.)
) + 2 Cl — (водн.)
Ионы хлорида являются здесь единственными ионами-спекторами, поэтому итоговое ионное уравнение имеет вид
2 H + (водн.) + Cr(OH) 2 (т) → 2 H 2 O(л) + Cr 2+ (водн.)
Пример 12
Щавелевая кислота, H 2 C 2 O (s), и Ca 4 (OH) 2 (s) реагируют очень медленно. Каково общее ионное уравнение между этими двумя веществами, если образовавшаяся соль нерастворима? (Анион в щавелевой кислоте представляет собой оксалат-ион, C 2 O 4 2− .)
Раствор
Продуктами реакции нейтрализации будут вода и оксалат кальция:
H 2 C 2 O 4 (т) + Ca(OH) 2 (т) → 2 H 2 O(л) + CaC 2 O 4 9 O 4
Поскольку ничего не растворяется, нет веществ, которые можно разделить на ионы, поэтому суммарное ионное уравнение представляет собой уравнение трех твердых тел и одного жидкого.
Проверь себя
Какое суммарное ионное уравнение между HNO 3 (водн.) и Ti(OH) 4 (тв.)?
Ответить
4 H + (водн.) + Ti(OH) 4 (тв.) → 4 H 2 O(ℓ) + Ti 4+ (водн.)
Ключевые выводы кислоты — это вещество, которое увеличивает количество H
+ в водном растворе.4.5: Написание суммарных ионных уравнений
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 169967
Цели обучения
- Определить, какие вещества действительно присутствуют в водном растворе.

- Укажите возможные продукты: нерастворимое ионное соединение, вода, слабый электролит
- Напишите суммарные ионные уравнения для реакций, протекающих в водном растворе.
НАПИСАНИЕ СИСТЕМНЫХ ИОННЫХ УРАВНЕНИЙ ДЛЯ CHEM 101A
Химические реакции, протекающие в растворе, наиболее точно описываются с помощью сводных ионных уравнений. Чистое ионное уравнение является наиболее точным представлением реального происходящего химического процесса. Написание этих уравнений требует знакомства с правилами растворимости, кислотно-щелочной реакционной способностью, слабыми электролитами и особыми реакциями карбонатов и бикарбонатов. Ниже представлена стратегия, которой мы предлагаем придерживаться при написании суммарных ионных уравнений в Chem 101A.
Этап 1: Определите реально присутствующие частицы с учетом диссоциации любых сильных электролитов. (Нерастворимые ионные соединения не ионизируются, но вы должны учитывать возможность того, что ионы нерастворимого соединения все еще могут участвовать в реакции. )
)
Этап 2: Определите продукты, которые будут образовываться при объединении реагентов. Наиболее распространенными продуктами являются нерастворимые ионные соединения и вода. Для получения дополнительной информации см. раздаточный материал «Реакционная способность неорганических соединений».
Шаг 3: Напишите сбалансированное уравнение для реакции, которую вы определили на шаге 2, убедившись, что в вашем уравнении указаны основные виды. Это чистое ионное уравнение реакции.
Пример \(\PageIndex{1}\): Написание суммарных ионных уравнений
Напишите суммарное ионное уравнение для описания реакции, происходящей при смешивании 0,100 M K 3 PO 4 раствора с 0,100 M Ca(NO 3 ) 2 раствор
Этап 1: Фактически присутствующие виды:
Из К 3 Заказ на покупку 4 | Из Ca(№ 3 ) 2 |
К + | Ca 2+ |
Заказ на поставку 4 3- | № 3 — |
Шаг 2: Существуют две возможные комбинации ионов здесь: K + + № 3 — (образуя KNO 3 ) и CA 2 + PO 3 ) и CA 2 + PO 3 ) и CA 2 + PO 3 ) и CA 2 + PO 3 ) и CA 2 + PO 3 ) и CA 2 . {3-}(водн.) \rightarrow Ca3(PO4)2(s)}\]
{3-}(водн.) \rightarrow Ca3(PO4)2(s)}\]
Пример \(\PageIndex{2}\): Написание суммарных ионных уравнений
Напишите суммарное ионное уравнение для описания реакции, происходящей при смешивании 0,1 M раствора HC 2 H 3 O 2 с 0,1 M раствора Раствор КОН
Этап 1: Фактически присутствующие виды:
Из HC 2 H 3 O 2 | От КОН |
Н + | К + |
С 2 Н 3 О 2 — | ОХ — |
Уксусная кислота, HC 2 H 3 O 2 , является слабой кислотой. Думайте о молекулах кислоты как о «потенциальных» ионах H + и C 2 H 3 O 2 – , однако эти «потенциальные» ионы удерживаются вместе ковалентной связью. Небольшой процент молекул кислоты действительно ионизируется (распадается на ионы) при растворении в воде, но большинство молекул слабых кислот не ионизируются.
Думайте о молекулах кислоты как о «потенциальных» ионах H + и C 2 H 3 O 2 – , однако эти «потенциальные» ионы удерживаются вместе ковалентной связью. Небольшой процент молекул кислоты действительно ионизируется (распадается на ионы) при растворении в воде, но большинство молекул слабых кислот не ионизируются.
Шаг 2: Реакция кислоты (источник H + ) и основания (источник OH — ) приводит к образованию воды. H + от HC 2 H 3 O 2 CAN CAN COMBINE с OH — с образованием H 2 O. Обратите внимание, что KC 2 H 3 O 2 IS IS IS IS IS IS IS IS IS IS IS IS IS IS IS IS IS IS IS IS IS IS IS IS IS IS IS IS IS IS IS IS IS IS. водорастворимое соединение, поэтому оно не образуется.
Стадия 3: Для образования воды в качестве продукта ковалентная связь между H + и C 2 9- (водн. )}\]
)}\]
Пример \(\PageIndex{3}\): Написание суммарных ионных уравнений
Напишите суммарное ионное уравнение для описания реакции, происходящей между твердым Mg(OH) 2 и избытком 0,1 М раствора HCl
Этап 1: На самом деле присутствуют следующие виды:
Из Mg(OH) 2 твердый | Из HCl |
Мг 2+ | Н + |
ОХ — | Класс — |
Обратите внимание, что гидроксид магния представляет собой твердое вещество; он не растворяется в воде. Ионы магния и ионы гидроксида будут удерживаться вместе ионными связями, даже если они находятся в присутствии полярных молекул воды. Однако эти отдельные ионы следует рассматривать как возможные реагенты. Думайте о твердом ионном соединении как о возможном источнике Mg 9.0011 2+ и ионы ОН – . Если возможна химическая реакция, то ионные связи между Mg 2+ и ОН – разорвутся.
Ионы магния и ионы гидроксида будут удерживаться вместе ионными связями, даже если они находятся в присутствии полярных молекул воды. Однако эти отдельные ионы следует рассматривать как возможные реагенты. Думайте о твердом ионном соединении как о возможном источнике Mg 9.0011 2+ и ионы ОН – . Если возможна химическая реакция, то ионные связи между Mg 2+ и ОН – разорвутся.
Стадия 2: Реакция кислоты (источник H + ) и основания (источник OH — ) приводит к образованию воды. H + из HCl могут соединяться с OH – из твердого Mg(OH) 2 с образованием H 2 O. Обратите внимание, что MgCl 2 является водорастворимым соединением, поэтому он не форма.
Этап 3: Для образования воды в качестве продукта необходимо разорвать ионную связь между ионами магния и гидроксида. OH – и H + образуют воду. Ион магния высвобождается в раствор при разрыве ионной связи. Не забудьте указать основные виды, которые существуют в растворе, когда будете писать уравнение. Гидроксид магния является твердым реагентом, поэтому вы должны написать полную формулу в своем уравнении. Сбалансированное уравнение для этой реакции: 92+ (водн.)}\]
Не забудьте указать основные виды, которые существуют в растворе, когда будете писать уравнение. Гидроксид магния является твердым реагентом, поэтому вы должны написать полную формулу в своем уравнении. Сбалансированное уравнение для этой реакции: 92+ (водн.)}\]
Пример \(\PageIndex{4}\): Написание суммарных ионных уравнений
Напишите суммарное ионное уравнение для описания реакции, происходящей при смешивании 0,1 М раствора KHCO 3 с избытком 0,1 М раствора HNO 3
Этап 1: На самом деле присутствуют следующие виды:
Из KHCO 3 | Из HNO 3 |
К + | Н + |
ОХС 3 — | № 3 — |
Шаг 2: Из раздаточного материала «Реакционная способность неорганических соединений» мы знаем, что когда ионы карбоната или бикарбоната реагируют с кислотами, углекислый газ и вода являются нормальными продуктами. Обязательно обратитесь к раздаточному материалу для получения подробной информации об этом процессе.
Обязательно обратитесь к раздаточному материалу для получения подробной информации об этом процессе.
Этап 3: Реакция представляет собой комбинацию ионов бикарбоната и ионов водорода, которая сначала образует угольную кислоту (H 2 CO 3 ). Однако угольная кислота может существовать только в очень низких концентрациях. В нормальных условиях угольная кислота разлагается на CO 9+ (водн.) \rightarrow h3O(л) + CO2(г)}\]
Дополнительные упражнения: Написание суммарных ионных уравнений
Для каждого из следующих элементов напишите суммарное ионное уравнение реакции, которая будет происходить при смешивании двух веществ. Если реакции нет, напишите «нет реакции». Примечание. Реакции сгруппированы в соответствии с трудностями, которые возникают у обычных учащихся. Наши группировки могут не соответствовать вашему собственному опыту и способностям. (Ответы доступны ниже.)
Легкая реакция:
1) 0,1 М Agno 3 и 0,1 м KBR
2) 0,1 M CACL 2 и 0,1 М NANO 3
3) 0,1 м Fe (№ 3 888878
3) 0,1 м Fe (NO 3 8888888888777777777777777777777777777778
3) 0,1 м. Fe (№ 3 888)
Fe (№ 3 888)
3) 0,1 м. 3 и 0,1 м NA 2 CO 3
4) 0,1 м KOH и 0,1 М COBR 2
5) 0,1 М HNO 3 и 0,1 М BA (OH) 2
61110 61110 61110 61110 61110 61110 61110 61110 61110 61110 61110 61110 10
61110 61110 10
61110 61110 61110 61110 61110 61110 61110 6. и 0,1 м (OH) 2 3 и 0,1 м (OH) 2 3 . ) 0,1 М Pb(NO 3 ) 2 и 0,1 М MgSO 4
7) 0,1 М Na 2 S and 0.1 M MnI 2
8) 0.1 M K 3 PO 4 and 0.1 M CuCl 2
9) 0.1 M HCl and 0.1 M NaC 2 H 3 O 2
10) 0.1 M NiSO 4 and 0.1 M FeCl 3
Harder reactions:
1) 0.1 M HC 2 H 3 O 2 and 0.1 M KOH
2) 0,1 М NH 3 и 0,1 М HBr
3) 1 М HCl и твердый Mn(OH) 2
4) Избыток 1 м HNO 3 и сплошной Alpo 4
5) 0,1 M Agno 3 и 0,1 M NaOH
6) 0,1 м. (без образования осадка)
(без образования осадка)
Еще более жесткие реакции:
1) 0,1 М Na 2 HPO 4 и 0,1 М HI (равные объемы)
2 M 7NH 2 M 7 0 8 и 9002 М NH 3 9002 М 7 0 8 9 0,1 М NH (NO 3 ) 2
3) 0,1 М NaHCO 3 и 0,1 М HCl
4) 0,1 M K 2 CO 3 и 0,1 м HNO 3 (равные объемы)
5) 0,1 м 3 PO 4 и 0,1 м 3 (равный volumes)
.10101019 1000111011101 100019 10001101101 100019.1019 100019.1019 100019.1019 100019.1019 100019 и 0,1 м 3 . Very tricky reactions:1) 0.1 M AgNO 3 and 0.1 M NH 3
2) solid BaCO 3 and excess 2 M HC 2 H 3 O 2
3) твердый Cu(OH) 2 и 1 M H 2 SO 4 (равное количество молей)
4) твердое Ag 2 O и избыток 2 M HCl
5) 0,1 M H 3 PO 4 и избыток 1 M KOH
9042
Легкие реакции:
1) Ag + (водн. ) + Br – (водн.) —> AgBr(s)
) + Br – (водн.) —> AgBr(s)
2) нет реакции
91 13 20 20 2010 3) (водн.) + 3 CO 3 2– (водн.) —> Fe 2 (CO 3 ) 3 (т)4) 2 OH – (водн.) + Co 2+ (водн.) —> Co(OH) 2 (т)
1 H 5) + (водн.) + OH – (водн.) —> H 2 O(ж)6) Pb 2+ (водн.) + SO 4 2– (водн.) — > PbSO 4 (т)
7) S 2– (водн.) + Mn 2+ (водн.) —> MnS(т)
8) 2 PO 4 3 – 2 ( водн.) + 3 Cu 2+ (водн.) —> Cu 3 (PO 4 ) 2 (s)
9) H + (aq) + C 2 H 3 O 2 – (aq) —> HC 2 H 3 O 2 (AQ)
10) Нет реакции
Случайные реакции:
1) HC 2 H 3 O 2 (AQ) + OH — O 2 (AQ) + OH — ( ( ( ( ( ( ( ( ( ( ( — ( ( ( — ( ( — ( — ( — ( — ( — . ) —> C 2 H 3 O 2 – (водн.) + H 2 O(ж)
) —> C 2 H 3 O 2 – (водн.) + H 2 O(ж)
2) NH 3 (водн.) + H + (водн.) —> NH 4 + (водн.)
3) 2 H + (водн.) + Mn(OH) 2 (тв.) — > Mn 2+ (водн.) + 2 H 2 O(ж)
4) 3 H + (водн.) + AlPO 4 (т) —> Al 3+ (водн.) + H 3 PO 4 (водн.)
5) 2 Ag + (водн.) + 2 OH – (водн.) —> Ag 2 O(s) + H 8 O (м)
6) HClO(водн.) + OH – (водн.) —> ClO – (водн.) + H 2 O(ж)
Еще более жесткие реакции:
1) HPO 4 2– (водн.) + H (водн.) —> H + 900 2 PO 4 – (водн.)
2) Fe 2+ (водн.) + 2 NH 3 (водн.) + 2 H 2 Fe OOH(ж) —> ) 2 (т) + 2 NH 4 + (водн. )
)
3) HCO 3 – (водн.) + H + (водн.) 2 8 O( H 9 O() —> л) + СО 2 (g)
4) CO 3 2– (AQ) + H + (AQ) -> HCO 3 — (AQ)
5) H 3 PO 4 (водн.) + NH 3 (водн.) —> H 2 PO 4 – (водн.) + NH 4 + (109водн.) 6 очень хитрых реакций:
1) 2 Ag + (водн.) + 2 NH 3 (водн.) + H 2 O(ж) —> Ag 2 O(т) + 2 NH 4 + (водн.)
2) BaCO 3 (тв.) + 2 HC 2 H 3 O 2 (водн.) —> Ba 2+ 7 2 2 C20 + 2 90 + 2 H 3 O 2 – (водн.) + H 2 O(ж) + CO 2 (г)
3) Cu(OH) + 2 901 H29O (тв.) (водн.) + HSO 4 – (водн.) —> Cu 2+ (водн.

 Н2S – слабый электролит.
Н2S – слабый электролит. NaOH и MgCl2
NaOH и MgCl2
 сульфата натрия и хлорида калия
сульфата натрия и хлорида калия Среди указанных веществ кислотой является только Н2S.
Среди указанных веществ кислотой является только Н2S.
 NaNO3
NaNO3


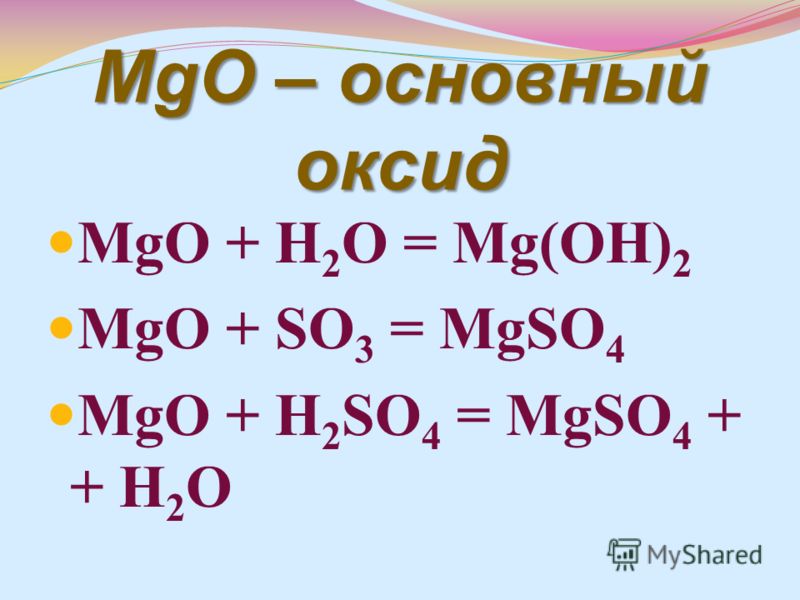 Составьте полное ионное уравнение взаимодействия 1 моль гидроксида калия с 1 моль гидроксида алюминия. Укажите число ионов в уравнении.
Составьте полное ионное уравнение взаимодействия 1 моль гидроксида калия с 1 моль гидроксида алюминия. Укажите число ионов в уравнении. по катиону и аниону
по катиону и аниону Сa(OH)2+HCl
Сa(OH)2+HCl  Укажите сумму коэффициентов в молекулярном и полном ионном уравнении.
Укажите сумму коэффициентов в молекулярном и полном ионном уравнении. Докажите, что процесс растворения сульфата меди – физико-химический. Приведите уравнения химических реакций.
Докажите, что процесс растворения сульфата меди – физико-химический. Приведите уравнения химических реакций. Какие процессы происходят в этих растворах при добавлении нитрата серебра? Ответы подтвердите записями сокращенных ионных уравнений реакций.
Какие процессы происходят в этих растворах при добавлении нитрата серебра? Ответы подтвердите записями сокращенных ионных уравнений реакций. 68) Рудзитис Г. Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф. Г. Фельдман. – 14-е изд. – М.: Просвещение, 2012.
68) Рудзитис Г. Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф. Г. Фельдман. – 14-е изд. – М.: Просвещение, 2012. )
) ) + Ca(OH) 2 (водн.) → H 2 O(л) + Ca 3 (ПО 4 ) 2 (с)
) + Ca(OH) 2 (водн.) → H 2 O(л) + Ca 3 (ПО 4 ) 2 (с)