Ответы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
| Похожие вопросы |
CaC2->C2h3->C6H6->C6H6-NO2->C6H6-Nh3
В каком году была сформулирована теория — предшественница кислородной теории горения.
Структурная формула всех изомеров С7Н16
Fe HNO3(конц ) → Fe2O3…
Решено
FeSO4+KClO3+h3SO4=Fe2(SO4)3+KCl+h3O
Пользуйтесь нашим приложением
Соединения химических элементов. Валентность и степень окисления элементов
Похожие презентации:
Валентность химических элементов (8 класс)
Химическая связь. Валентность элементов в ковалентных соединениях. Степень окисления элементов
Степень окисления. Ряд напряжений. (Лекция 2.1)
Соединения химических элементов
Степень окисления. Определение степени окисления в соединениях
Валентность химических элементов
Валентность и степень окисления
Химическая связь
Валентность и степень окисления
Основные классы химических соединений
1. Соединения химических элементов
Валентность и степеньокисления элементов
2.
 Валентность элементовВалентность – это способность атома
Валентность элементовВалентность – это способность атомаобразовывать химические связи.
Валентность для элементов бывает
постоянная и переменная.
Элементы с постоянной валентностью:
I – H, Li, Na, K, Rb, Cs, Ag
II – O, Be, Mg, Ca, Sr, Ba, Zn
III – B, Al
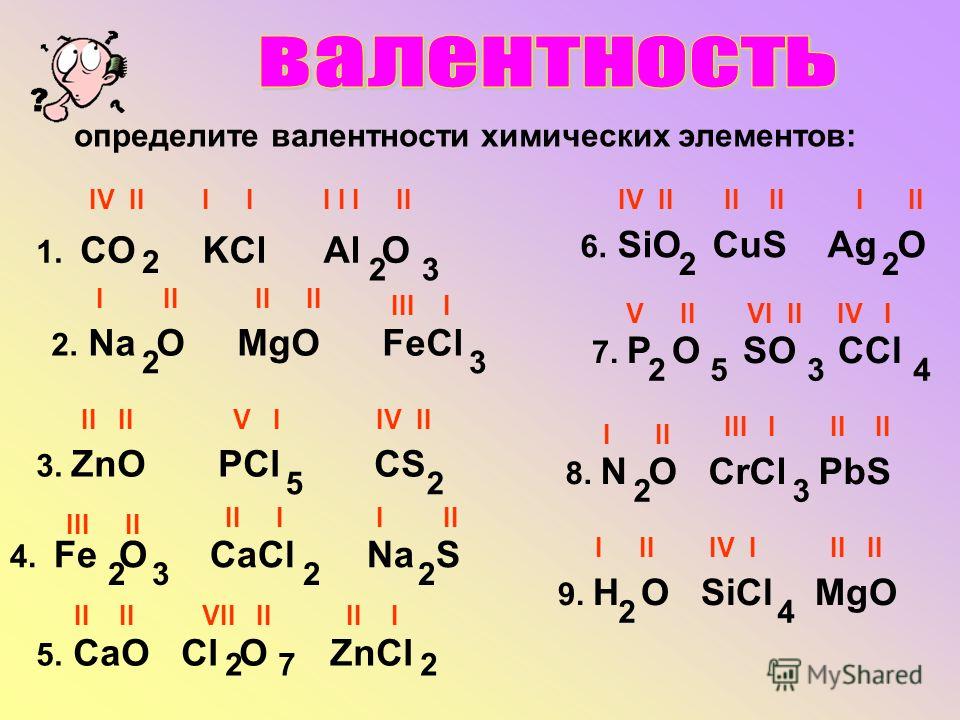
3. Определите валентности элементов в следующих соединениях:
P2O5FeO
AlCl3
CaO
h3S
SO3
FeS
N2O3
Nh4
NaH
P2S3
CuO
K 2O
SeO3
FeF3
AlP
SnO2
HCl
Sih5
Mg3N2
4. Степень окисления элементов
Степень окисления – условный заряд атомаэлемента, вычисленный из предположения, что
вещество состоит из ионов.
Для вычисления степени окисления элемента
следует учитывать следующие положения:
1. Степени
окисления атомов в простых
веществах равны нулю. Простыми называются
вещества, состоящие из одного элемента.
2. Алгебраическая сумма степеней окисления
всех атомов, входящих в состав молекулы
сложного вещества, всегда равна нулю.

Сложными называются вещества, состоящие
из нескольких элементов.
5. Степень окисления элементов
Постоянную степень окисления имеют атомы:водорода
(+1)
(исключение
гидриды
щелочных и щелочноземельных металлов –
NaH-1), кислорода (-2) (исключения: Н2О2-1
(пероксид водорода и его соли), О+2F2
(фторид кислорода).
4. Степень
окисления
металлов
всегда
положительна и численно равна валентности.
Металлы с постоянной валентностью и СО:
+1 – Li, Na, K, Rb, Cs, Ag
+2 – Be, Mg, Ca, Sr, Ba, Zn
+3 – Al
3.
6. Степень окисления элементов
Дляэлементов
главных
подгрупп
положительная степень окисления не может
превышать величину, равную номеру группы
периодической системы, а отрицательная
степень окисления вычисляется по формуле:
номер группы – 8.
6. Степень окисления элемента в кислотном
оксиде,
соответствующей
кислоте
и
образующейся соли одинакова.

5.
7. Степень окисления элементов
Определите СО каждого элемента в следующих соединениях:1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
P2O5
Cu
Fe
Cu(OH)2
Al(ClO4)3
K2CO3
Ca(OH)2
SO3
H 2S
h4PO3
11.
12.
13.
14.
15.
16.
17.
18.
19.
20.
h3Cr2O7
O2
Na2SO3
Sn(OH)2
N2
HClO4
Nh5OH
Sih5
HNO3
Zn(NO3)2
Дополнительное задание:
Определите СО каждого элемента в следующих соединениях:
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
Al(NO3)3
h3
Mg3N2
Nh4
Cu
K2Cr2O7
Cr(OH)3
Nh5OH
HClO4
Fe2O3
O3
12. NO2
13. h4AsO4
14. Ca(OH)2
15. CaSO4
16. N2
17. RbNO2
18. KMnO4
19. SO3
20. h3S
11.
9. Определите валентности элементов в следующих соединениях:
Определитесоединениях:
валентности
элементов
в
следующих
Вариант 1
P2O5
FeCl3
Li3N
CaS
Sih5
Nh4
SiO2
MgS
K3P
CdCl2
Вариант 2
Ch5
NaCl
Al4C3
AlCl3
CoS
BaBr2
Cr2S3 Cl2O7
Ph4
SO3
10.
 Определите степени окисления элементов в следующих соединениях: ВАРИАНТ 1
Определите степени окисления элементов в следующих соединениях: ВАРИАНТ 1ВАРИАНТ 2
Na3PO4
Cr(OH)3
h4PO4
HClO4
Ph4
Fe
SiO2
P
Zn(OH)2
Al2(SO4)3
h3Cr2O7
HNO2
N2
Fe2O3
O3
Ch5
Fe(OH)2
Mg(OH)2
Ca(NO3)2 Zn3(PO4)2
English Русский Правила
Рисунки, Гибридизация, Форма, Заряды, Пары – Lambda Geeks
Автор Aparna Devin Chemistry
В этой статье мы обсуждаем Mg 3 N 2 Структуру Льюиса и все другие факты, такие как его гибридизация, валентные электроны.
Mg 3 N 2 , нитрид магния представляет собой порошок желтого цвета при комнатной температуре. Это соединение, содержащее магний и азот.
Как рисовать Mg 3 N 2 структуры Льюиса ? Валентных электронов у магния 2, а у азота 5. Здесь 3 атома магния и 2 атома азота. 3 атома Mg делят свои 2 валентных электронов с двумя присутствующими атомами азота, образуя ионное соединение.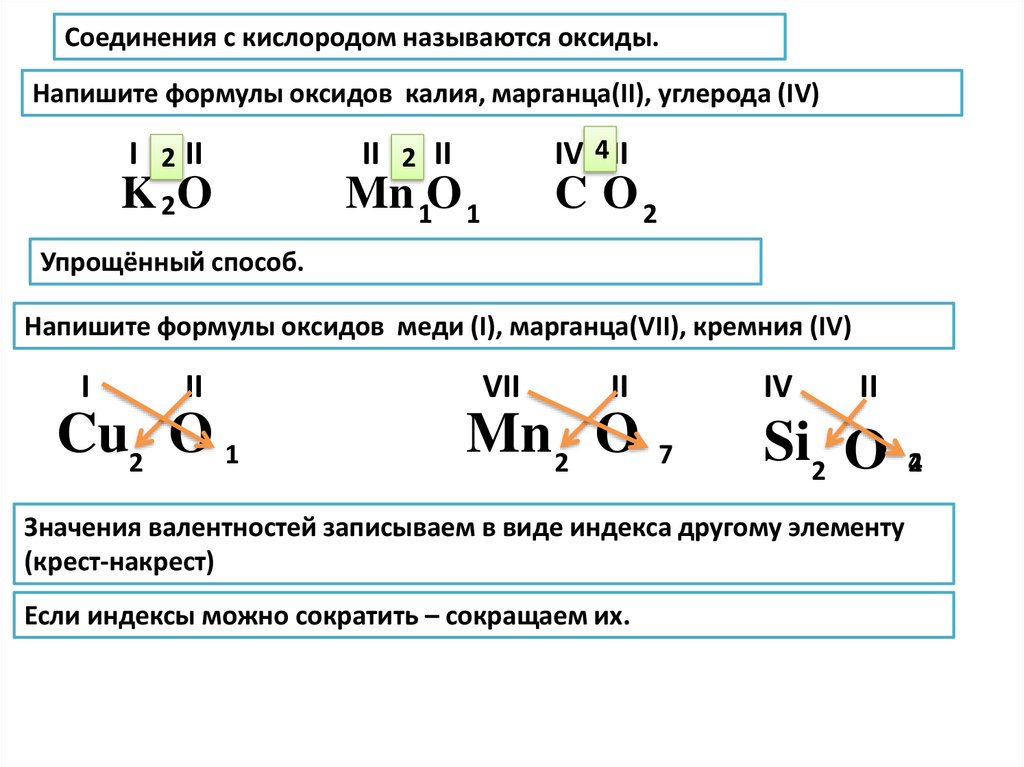 Когда Mg делит свои 2 электрона, он становится положительно заряженным ионом Mg 2+ .
Когда Mg делит свои 2 электрона, он становится положительно заряженным ионом Mg 2+ .
Азот принимает 3 электрона от 2 атомов Mg и становится отрицательно заряженным, N 3- ион. Таким образом, положительно заряженный Mg 2+ и отрицательно заряженный N 3- притягиваются друг к другу и образуют ионную связь. So the lewis structure of Mg3N2 can be drawn as
Mg 3 N 2 shape shape of Mg 3 N 2 Mg 3 N 2 formal chargeФормальный заряд каждого атома в соединении Mg 3 N 2 (нитрид магния) можно определить с помощью простого уравнения.
Формальный заряд атома = количество валентных электронов – количество неподеленной пары электронов – количество образованных связей
Здесь формальный заряд каждого атома в Mg быть найденным.
Формальный заряд Mg = 2 -0 -2
= 0
Формальный заряд азота = 5 -2 -3
= 0
, поэтому общий заряд Mg 3 N 2 is found to be 0.
Mg 3 N 2 octet rule| K | L | M | N | ||
| Magnesium | 2 | 8 | 2 | ||
| Nitrogen | 2 | 5 |
Здесь азоту нужно еще 3 электрона, чтобы выполнить свой октет. Но магнию нужно либо получить 6 электронов, либо потерять 2 электрона, чтобы выполнить свой октет.
Поскольку легко потерять 2 электрона, Mg теряет 2 электрона на один атом азота. Когда азот получает 2 электрона от одного Mg и еще 1 электрон от другого Mg, его октет заполняется. Итак, в нитриде магния Mg 3 N 2 октет обоих атомов подчиняется правилу октета.
Итак, в нитриде магния Mg 3 N 2 октет обоих атомов подчиняется правилу октета.
Неподеленную пару электронов, присутствующую в каждом атоме в молекуле, можно определить с помощью следующего уравнения.
Количество одинокой пары электронов. Неподеленная пара электронов присутствует в N = (5-3)/2
= 1
Таким образом, одинокие пары электронов, присутствующих в мг, равны 0, а 2 азота составляет 2.
мг 3 N 2 Электроны валентностиВесь номер валентности электроны
Весь номер валентности электронов
Весь номер. существующих в Mg 3 N 2 представляет собой сумму валентных электронов, присутствующих в 3 атомах Mg, и валентных электронов, присутствующих в 2 атомах N.
Общее количество валентных электронов в Mg 3 N 2 = 3*2 + 5*2
= 6 + 10
= 16
Таким образом, целое количество валентных электронов, существующих в MG 3 N 2 — 16.
Mg 3 N 2 ГибридизацияГибридизация – это концепция, которую мы фактически применяем для соединений с ковалентной связью. Начиная с мг 3 N 2 представляет собой ионное соединение. Так что концепция гибридизации здесь не работает.
Mg 3 N 2 Применение Порошок нитрида магния используется для синтеза многих нитридных соединений с высокой износостойкостью, твердостью, теплопроводностью, антикоррозионными свойствами. Его устойчивость к высоким температурам делает его более полезным во многих областях. Он также используется для подготовки керамического материала и в качестве вспенивателя специального сплава.
Mg отдает свои 2 валентных электрона и становится Mg 2+ . Азот принимает 3 электрона от двух Mg и становится N 3-. Положительные ионы Mg 2+ и отрицательные ионы N 3- притягиваются друг к другу, образуя ионную связь.
Последние сообщения
ссылка на май в пассивном залоге: 5 фактов (когда, как и примеры)май в пассивном залоге: 5 фактов (когда, как и примеры)
В английском языке глагол may относится к модальным вспомогательным глаголам. Давайте здесь узнаем, как глагол «может» может быть изменен в пассивный залог. Модальный вспомогательный глагол…
Продолжить чтение
ссылка на Является ли электрическое поле вектором? 5 фактов, которые вы должны знатьЯвляется ли электрическое поле вектором? 5 фактов, которые вы должны знать
Электрическое поле создается заряженной частицей.
Продолжить чтение
Порошок нитрида магния Mg3N2 высокой чистоты CAS 12057-71-5, 99%
Главная > Порошок нитрида
Порошок нитрида
Что такое нитрид магния?
Нитрид магния с химической формулой Mg3N2 представляет собой неорганическое соединение магния и азота. При комнатной температуре и давлении это зелено-желтый порошок. Нитрид магния представляет собой неорганическое соединение, состоящее из азота и магния, с молекулярной формулой Mg3N2 и молекулярной массой 100,9.494. Относится к кубической кристаллической системе. Нитрид магния , как и многие нитриды металлов, реагирует с водой с образованием аммиака. Для получения нитрида магния магниевую ленту можно обжечь в азоте.
Технические характеристики нитрида магния
| Синоним(ы): | Динитрид тримагния |
| Линейная формула: | Mg3N2 |
| Номер CAS: | 12057-71-5 |
| Молекулярный вес: | 100,93 |
| Номер ЕС: | 235-022-1 |
| Номер в леях: | MFCD00016205 |
| Идентификатор вещества PubChem: | 24865976 |
| НАКРЕС: | НО.23 |
Mg имеет 2 валентных электрона и теряет эти 2 валентных электрона, образуя ион Mg2+. Он получает 3 валентных электрона, образуя ион N3-. Чтобы сбалансировать заряды, 3 иона Mg2+ объединяются с двумя ионами N3–, образуя Mg3N2.
Чтобы сбалансировать заряды, 3 иона Mg2+ объединяются с двумя ионами N3–, образуя Mg3N2.
Нитрид магния растворим в кислоте, мало растворим в этаноле и эфире. Нитрид магния, как и многие нитриды металлов, реагирует с водой с образованием аммиака. Реагирует с кислотами или водосодержащими оксидами неметаллов с образованием солей аммония и магния. Поскольку нитрид магния легко соединяется с водой (h3O) для разложения, его необходимо хранить в герметичном, водонепроницаемом и влагонепроницаемом помещении. TRUNNANO — надежный глобальный Поставщик нитрида магния . Не стесняйтесь в любое время отправить запрос о последней цене на порошок Mg3N2 нитрида магния . Нитрид магния мало вреден для водоемов. Не допускайте попадания неразбавленного или большого количества продукта в грунтовые воды, водные пути или канализационные системы, а также не сбрасывайте материалы в окружающую среду без разрешения.

Mg3N2(т)+ 6 h3O(ж)→3 Mg(OH)2(водн.)+ 2 Nh4(г)
На самом деле, когда магний сжигается на воздухе, в дополнение к основному продукту оксиду магния будет образовываться некоторое количество нитрида магния.
При термическом разложении нитрида магния образуются магний и азот (при 700-1500°С). Как образуется Mg3N2? Mg имеет 2 валентных электрона и теряет эти 2 валентных электрона с образованием иона Mg2+. Он получает 3 валентных электрона, образуя ион N3-. Чтобы сбалансировать заряды, 3 иона Mg2+ объединяются с двумя ионами N3–, образуя Mg3N2.
Характеристики порошка нитрида магния Mg3N2:
Нитрид магния имеет широкую прямую запрещенную зону, прочные атомные связи, высокую теплопроводность, хорошую химическую стабильность
(почти без кислотной коррозии) и другие свойства и сильная антирадиационная способность в оптоэлектронике, высокой температуре и
применение устройств высокой мощности и высокочастотных микроволновых устройств имеет широкие перспективы.
Технические параметры порошка нитрида магния Mg3N2:
| Название продукта | МФ | Чистота | Размер частиц | Точка плавления | Плотность | Цвет |
| нитрид магния | Mg3N2 | 99% | 5-10 мкм | 800℃ | 2,712 г/мл | желто-коричневый |
Химический состав порошка нитрида магния Mg3N2:
| Mg3N2 | Н | мг | Си | О | С | Фе |
| 99% | 11% | баланс | 0,002% | 0,2% | 0,05% | 0,15% |
Как производится порошок нитрида магния Mg3N2 ?
Для получения нитрида магния магниевую ленту можно обжечь в азоте.
Что делают магний и азот? Твердый магний реагирует с газообразным азотом с образованием твердого нитрида магния.
В приведенной выше реакции, если азот не является чистым, легко получить продукты, содержащие оксид магния. Метод реакции в сухом газе Nh4 лучше.
Поместите отходы магния в фарфоровую лодочку или лодочку из спеченного магнезии. Лодка установлена в фарфоровой трубке. Один конец фарфоровой трубки соединен с Т-образной трубкой. Один конец Т-образной трубки может быть заполнен сухим газообразным аммиаком, а другой конец может быть заполнен азотом. Конец фарфоровой трубки соединен с U-образной трубкой, и трубка заполнена влагопоглотителем, половина которого состоит из мелких хлопьев СаО, а другая половина — из мелких хлопьев КОН. Газ, выходящий из реакционной трубы, поглощается абсорбционным устройством, представляющим собой две конические колбы, содержащие разбавленную серную кислоту. Во избежание обратного всасывания не вставляйте трубку первой абсорбционной бутыли ниже поверхности разбавленной серной кислоты.
Наливайте сухие Nh4 и N2 в фарфоровую пробирку до тех пор, пока вторая абсорбционная бутыль не перестанет выделять пузырьки, указывая на то, что воздух в фарфоровой пробирке удален. Поднимите температуру до 800~850 ℃, нагревайте порошок магния в течение 4 часов, порошок магния становится горячим, что означает начало реакции, и в то же время должен образоваться h3. Во время реакции давление Nh4 должно быть больше, чем внешнее атмосферное давление, чтобы избежать обратного всасывания. Когда реакция завершится, выключите Nh4, поддерживайте первоначальную температуру и продолжайте пропускание N2 в течение 1,5 ч для удаления Nh4·Mg3N2, адсорбированного на Mg3N2, который очень расплывается и должен храниться в сухом контейнере. Если магниевую ленту сжигать на воздухе, помимо оксида магния также образуется некоторое количество нитрида магния.
Применение Порошок нитрида магния Mg3N2 :
Порошок нитрида магния (Mg3N2) является хорошо известным твердым катализатором и используется в качестве добавки в ряде приложений, включая изготовление специальных сплавов и керамики, катализ реакций сшивания полимеров и материалов для хранения водорода.
Для чего используется нитрид магния?
1. Нитрид магния используется в качестве катализатора при получении нитридов других элементов, обладающих высокой твердостью, высокой теплопроводностью, коррозионной стойкостью, износостойкостью и жаростойкостью. Когда кубический нитрид бора был впервые успешно синтезирован, в качестве катализатора использовался нитрид магния;
2. Добавки нитрида магния, применяемые при выплавке высокопрочной стали. Нитрид магния (Mg3N2) заменяет десульфурированный магний при выплавке конструкционной стали, что полезно для повышения плотности, прочности, предела прочности на растяжение и выносливости стали. Кроме того, использование нитрида магния (Mg3N2) для десульфурации может уменьшить количество других добавок в соответствующем количестве, что поможет снизить себестоимость производства конструкционной стали;
3. Приготовление специальных керамических материалов;
4. Пенообразователь для изготовления спецсплавов;
5. Нитрид магния для производства специального стекла;
Нитрид магния для производства специального стекла;
6. Каталитическая полимерная сшивка;
7. Переработка ядерных отходов;
8. Нитрид магния, используемый в качестве материала катализатора для синтеза синтетического алмаза и кубического нитрида бора.
Упаковка и доставка порошка нитрида магния Mg3N2:
У нас есть много различных видов упаковки, которые зависят от количества порошка нитрида магния Mg3N2.
Упаковка порошка нитрида магния Mg3N2: вакуумная упаковка, 100 г, 500 г или 1 кг/мешок, 25 кг/баррель или по вашему запросу.
Доставка порошка нитрида магния Mg3N2: может быть отправлена морским, воздушным транспортом, экспресс-доставкой в кратчайшие сроки после получения оплаты.

 11.16
11.16