Оксид марганца (MnO2) Химическая структура, свойства и применение / химия | Thpanorama
оксид марганца (MnO2) представляет собой неорганическое химическое соединение, образованное элементом марганец с степенью окисления +4 и кислородом, которое при образовании оксидов имеет степень окисления -2. Он также известен под названиями оксида марганца (IV) и ангидрида марганца..
Это твердое вещество от темного до черного кофе. Он в природе как минерал пиролузит, черный и кристаллизуется, образуя дендриты (разветвленные удлинения). Его можно получить в виде черного остатка в реакции между этиленом и перманганатом калия после образования гликоля в результате окислительного действия перманганата калия..
Это очень важно в стекольной промышленности из-за его характера окислителя, так как он устраняет зеленый цвет, исходящий от соединений железа, и превращает их в железо..
индекс
- 1 Химическая структура
- 2 свойства
- 3 использования
- 3.
 1 В качестве катализатора
1 В качестве катализатора
- 3.
- 4 Влияние на здоровье
- 5 ссылок
Химическая структура соединения соответствует структуре ангидрида, а не основного оксида, как и следовало ожидать, поскольку оно состоит из металла и неметалла..
Этот особый случай обусловлен поведением марганца в различных состояниях окисления, которые он имеет. Таким образом, для состояний окисления +2 и +3 образуются оксиды MnO и Mn2О3 соответственно, что при взаимодействии с водой они образуют гидроксид марганца и гидроксид марганца, соответственно.
Тем не менее, Mn2О3 в слабокислой среде он ведет себя как ангидрид. При степени окисления +4, +6 и +7, MnO2, МНО3 и MnO4 они образуют кислоты при реакции с водой.
В слабокислой среде MnO2 он ведет себя как основной оксид, поэтому может образовывать соответствующий гидроксид.
Следует иметь в виду, что в этом случае нет упоминания об амфотерных свойствах, согласно которым соединение может вести себя как кислота или основание. Это частный случай поведения Mn.
Это частный случай поведения Mn.
— Используется в качестве источника марганца
— В качестве окислителя в щелочных батареях
— Краски для стекла, керамики и фарфора.
— При получении хлора и йода.
— При разложении перекиси водорода для образования газообразного кислорода и воды.
— В реакции разложения хлората калия для производства газообразного кислорода и хлорида калия.
— Растворяется в ацетоне или дихлорметане, окисляет первичные спирты до альдегидов и вторично по отношению к кетонам.
— Производство щелочных батарей.
В качестве катализатораЭто относится к реакциям восстановления оксидов, для удаления сульфидов, таких как H2S и катионы, такие как Fe+2 и Mn+2 , Мышьяк и радио найдены в подземных водах, которые загрязнены этим типом соединений.
Это загрязнение может быть вызвано неконтролируемым сбросом токсичных материалов, промывкой загрязненной почвы или присутствием химических элементов во время извлечения воды. .
.
МНО2 Высокая чистота, полученная из пиролузита, используемого в качестве фильтра (Filox), является наиболее эффективным средством для удаления этого класса примесей из подземных вод..
Влияние на здоровье— Избегать контакта с кожей.
— В случае контакта помойте соответствующую зону.
— Не вдыхать порошки.
— Раздражение и покраснение можно увидеть при попадании в глаза. Промойте большим количеством воды, дайте воде протечь через глаза и в случае серьезного вызова обратитесь за медицинской помощью..
— При попадании на кожу наблюдается раздражение и покраснение. Промойте пораженный участок большим количеством воды и мыла.
— Длительный контакт с кожей удаляет ваш естественный жир, вызывая дерматит.
— Вдыхание может вызвать гриппоподобное состояние (металлические пары). Состояние характеризуется высокой температурой, ознобом, сухостью во рту и горле, мышечной болью и головной болью.
— Это может раздражать дыхательные пути и увеличивать частоту респираторных инфекций (пневмония). Интоксикация при абсорбции неорганических солей марганца через легкие маловероятна, но может возникнуть хроническое отравление.
Интоксикация при абсорбции неорганических солей марганца через легкие маловероятна, но может возникнуть хроническое отравление.
— Хроническое воздействие пыли или паров двуокиси марганца в течение длительного периода может повлиять на центральную нервную систему и привести к развитию болезни Паркинсона, затруднений при ходьбе, мышечных спазмов и изменений в поведении..
— Проглатывание может вызвать боль в животе и тошноту.
— Это не огнеопасно, но это помогает распространить огонь в раскаленных материалах. При нагревании до температуры выше 535 ° С вещество разлагается до оксида марганца (III) Mn2О3 и кислород, который является легковоспламеняющимся и увеличивает опасность возгорания. В этом случае пожар следует потушить пеной или углекислым газом..
— В случае утечки, не манипулируйте составом без надлежащей личной защиты.
— Храните состав в плотно закрытых контейнерах, в холодном и сухом месте, вдали от несовместимых веществ, таких как органический материал и горючий материал. .
.
— Место хранения должно быть сухим и иметь полы, устойчивые к кислотной коррозии и с хорошим дренажом..
— Следует использовать средства индивидуальной защиты, такие как перчатки, защитные очки, маски против паровых фильтров, пыль и дым.
ссылки- B, (2015), двуокись марганца, Королевское химическое общество — мир химии, получено с chemworld.com
- Karal, (2014), двуокись Мангнесо, паспорт безопасности, восстановлено с, karal.com.mx
- Ваш виртуальный учитель (2/25/2015). Марганцевые неорганические соединения (особый случай 1) — теоретический урок), взято с сайта youtube.com
- Ecured, (s.f), двуокись марганца, восстановлена из ecured.cu
- Angarita G, Johnny., (2017), диоксид марганца: исключительная технология. Hidroteco, восстановлено от hydrotecocr.com
- Фернандес, Г., (2015), MnO диоксид марганца2/ ацетон, Органическая химия, Восстановлено с quimicaorganica.net
- Tronox, (2011), диоксид марганца, паспорт безопасности, восстановлено, tronox.
 com
com
Фазообразование в системах La2 O3 — MO — оксиды марганца, M = Mg, Ca, Sr, Ba, Cd, Pb
Список источников диссертации и автореферата по химии, кандидата химических наук, Владимирова, Елена Владимировна, Екатеринбург
1. Jonker С.Н., van Santen J.H. Ferromagnetic compounds of manganese with perovskite structure. // Physica. 1950. V.16. № 3. P. 337-349.
2. Jonker G.H. Magnetic compounds with perovskite structure IV. // Physica. 1956. V. 22. P. 707-722.
3. Jin S., Tiefel Т.Н., McCormak M. et al. Thousandfold change in resistivity in magnetoresistive La Ca — Mn — О films. // Sciense. 1994. V. 264. P.413-415.
4. Fullerton E., Conover M.J., Mattson J.E. et al. 150% magnetoresistance in sputtered Fe/Cr (100) superlattices. //Appl. Phys. Lett. 1993. V. 63. P. 1699-1701.
5. Горбенко О.Ю., Демин P.B., Кауль A.P. и др. Магнитные, электрические и кристаллографические свойства тонких пленок Lai. xPbxMn03 (х = 0.1-0.6). // Неорган, материалы. 1994. Т.30. №11. С.1457-1460.
xPbxMn03 (х = 0.1-0.6). // Неорган, материалы. 1994. Т.30. №11. С.1457-1460.
8. Esaka Т., Kamata М., Ohnishi М. Control of oxigen deficiency in Cai.xLaxMn03 and its cathodic properties in alkaline solytion. // J. Appl. Elektrochem.,1996. V. 26. P. 439-442.
9. Saracco G., Geobaldo F., Baldi G. Methane combustion on Mg-doped LaMn03 perovskite catalysts. // Appl. Catal. B. 1999. V. 20. P.277-288.
10. Родэ Е.Я. Кислородные соединения марганца. Изд-во Академии наук СССР, М. 1952.398 с.
11. Левинский Ю.В. Р-Т-х- диаграммы состояния двойных металлических систем. Справочник. М.: Металлургия. 1990. Кн.2 400 с.
12. Рубинчик Я.С., Прокудина С.А., Павлюченко М.М. Синтез и кинетика образования LaMn03 в твердой фазе. // Изв. АН СССР, Неорган, материалы.-1973. Т.9. №11. С.1951-1956.
13. Van Roosmalen J.A.M., van Vlaaderen P., Cordfunke E.H.P. Phase in the perovskite-type Lai.xMn03+s solid solution and the La203 Mn203 phase diagram. // J. Solid State Chemistry. 1995. V.114. p.516-523.
V.114. p.516-523.
14. Van Roosmalen J.A.M., Cordfunke E.H.P., Helmhold R.B., Zandbergen H.W. The defect chemistry of LaMn03±s. Part 2. // J. Solid State Chem. 1994. V. 110. P. 100-105.
15. Van Roosmalen J.A.M., Cordfunke E.H.P. The defect chemistry of LaMn03±s. Part 3. The density of (La, A)Mn03+s. // J. Solid State Chem. 1994. V. 110. P. 106-108.
16. Van Roosmalen J.A.M., Cordfunke E.H.P. The defect chemistry of LaMn03±5. Part 4. Defect model for LaMn03±8. // J. Solid State Chem. 1994. V. 110. P. 109-112.
17. Ferris V., Brohan L., Ganne M., Tournoux M. Structural aspects, density measurements and susceptibility behavior of the defect perovskite ~LaMn03 with 0.8< La/Mn<l and 2.80<0/Mn<3.58. // Eur. J. Solid State Inorg.Chem. 1995. V.32. P. 131144.
18. Manoharan S.S., Kumar D., Hegde M.S., Satyakarshmi K.M., Prasad V., Subramanyam S.V. Giant magnetoresistance in selfdoped LaixMn035 thin films. // J. Solid State Chem. 1995. V.l 17. P.420-423.
19. Hervieu M., Mahesh R., Rao C.N.R. Defect structure of LaMn03 // Eur. J. Solid State Inorg.Chem. 1995. V.32. p.79-94.
Hervieu M., Mahesh R., Rao C.N.R. Defect structure of LaMn03 // Eur. J. Solid State Inorg.Chem. 1995. V.32. p.79-94.
20. Tofield B.C., Scott W.R. Oxidative nonstoichiometry in perovskites; an experimental survey; the defect structure of an oxidizes lanthanum manganite by powder neutron diffraction. // J. Solid State Chem. 1974. V. 10. P. 183-194.
21. Nasuko S., Helmer F. Effect of non-stoichiometry onproperties of Lai.xMn03+5. // Acta Cem. Scand. 1996. V.50. P.580-586.
22. Taguchi H., Yoshioka H., Matsuda D., Nagao M. Crystal Structure of LaMn03+s synthesized using poly(acrylic acid). // J. Solid State Chem. 1993. V.104. P.460-463.
23. Bogush A.K., Pavlov V.I., Balyko L.V. Structural phase transitions in the LaMn03+5 system. // Crystal Res.& Technol. 1983. V.18. P.589-598.
24. Митин A.B., Кузьмичева Г.М., Новикова С.И. Сложные оксиды на основе марганца со структурой перовскита и производной от нее. // ЖНХ. 1997. Т.42. №12. С. 1953-1959.
25. Toussaint H. Solidstate reaction of Mn02 and Mn203 with CaO, ZnO, MgO and CdO. //Rev. Chem. Minerale. 1964. V. 1. P. 141-195.
Solidstate reaction of Mn02 and Mn203 with CaO, ZnO, MgO and CdO. //Rev. Chem. Minerale. 1964. V. 1. P. 141-195.
26. Chamberland B.L., Sleight A.W., Weiher J.F. Preparation and characterization of MgMn03 and ZnMn03. // J. Solid State Chem. 1970. V.l. P.512-514.
27. Riboud P.V., Muan A. Melting relations of CaO-manganese oxide and MgO-manganese oxide mixtures in air. // J. American Ceramic Soc. 1963. V.46. P.33-36.
28. Бархатов В.П., Голиков Ю.В., Залазинский А.Г., Балакирев И.Ф., Чуфаров Г.И. Диаграмма состояния системы Mg Мп — О. // ДАН 1980. Т.252. С.383.
29. Ю.В.Голиков, В.П.Бархатов, В.Ф.Балакирев, Г.И.Чуфаров. Диаграммы «давление кислорода состав» системы Mg — Мп — О. // ДАН 1982, Т.262, № 5, С. 1165.
30. Wollan Е.О., Koehler W.C. Neutron diffraction study of the magnetic properties of the series of perovskite -type compounds (l-x)La,xCa.Mn03. // Phys. Rev. 1955. V.100. P.545-563.
31. Brisi C., Lucco-Borlera M. A new compoundin the system CaO Mn02. // J. Inorgan. Nucl. Chem. V.27. P.2129-2132.
// J. Inorgan. Nucl. Chem. V.27. P.2129-2132.
32. Brisi C. A new phase belonging to the system Sr Fe — O. // Ann. Chem. (Rome). 1961. V. 51. P. 1399-1401.
33. Ruddlesden S.N., Popper P. New compounds of the K2NiF4 type. // Acta Cryst. 1957. V. 10. P.538-542.
34. Powder Diffraction File JCPDSD-ICDD PDF2 (set’s 1-49, Relase 1999).
35. Yokokawa H., Sakaki N., Kawada T. Dokiya M. Chemical thermodynamic conderations on chemical stability of Lai.xSrxMn03 perovskite air electrode agiants reaction with Zr02 electrolyte in SOFC. // Denki Kagaku 1990. V.58. P. 162-166.
36. Negas T. The SrMn03.x Mn304 system. // J. Solid State Chem. 1973. V.7. P.85.
37. Bouloux J.-C., Soubeyroux J.-L., Le Flem G.,Hagenmuller P. Bidimensional magnetic properties p-Sr2Mn04. //J. Solid State Chem. 1981. V.38. P.34-39.
38. Mizutani N., Katazawa A., Ohkuma N., Kato M. Manganese double oxides. I. Synthesis of strontium-manganese double oxides. // J. Chem. Soc. (Jpn) Jnd. Ed. 1970. Oi3. // ЖНХ. 1977. Т.22. №8. С.2238-2244.
Oi3. // ЖНХ. 1977. Т.22. №8. С.2238-2244.
42. Latourrette В., Devalette М., Guillen F., Fouassier С. Les oxydes doubles de plomb et demanganese. //Mater. Res. Bull. 1978. V.13. P. 567-574.
43. Li Y.D., Duan X.F., Zhang J.H., Wang H.R., Qian Y.T., Huang Z., Zhou J., Yuan S.L., Liu W., Zhu C.F. Giant magnetoresistance in bulk La0.6Mg0.4MnO3. // J. Mater. Res. 1997. V.12. P.2648-2650.
44. Majewski P., Epple L., Aldinger F. Phase-diagram studies in the La203 SrO — CaO -Mn304 system at 1200°C in air. // J. Am. Ceram. Soc. 2000. V. 83. P. 1513-1517.
45. Wang Y.X., Du Y., Qin R.W., Han В., Du J., Lin J.H. Phase equilibrium of the La -Ca Mn — О system. // J. Solid State Chem. 2001. V. 156. P. 237-241.
46. Harry 1., Yakel Jr. On the structures of some compounds of the perovskite type. // Acta Cryst. 1955. V.8. P. 394-398.
47. Mahesh R., Mahendiran R., Raychaudhuri A.K., Rao C.N.R. Giant magnetoresistance in bulk samples of LabxAxMn03 (A=Sr or Ca). // J. Solid State Chem. 1995. V.114. P.297-299.
1995. V.114. P.297-299.
48. Van Santen J.H., Johker G.H. Electrical conductivity of ferromagnetic compounds of manganese with perovskite structure. // Physica. 1950. V. 16. P. 599-600.
49. Chahara K., Ohno Т., Kasai M., Kozono Y. Magnetoresistance in magnetic manganese oxide with intrinsic antiferromagnetic spin structure. // Appl. Phys. Lett. 1993. V.63. P. 1990-1992.
50. Pavlov V.I., Bychkov G.L., Bogush A.K. Concentration magnetic phase transitions in the LaixCaxMn03 system. // Cryst. Res. Technol. 1986. V.21. P.487-494.
51. Faaland S., Knudsen K.D., Einarsrud M.A., Rormark L., Hoier R., Grande T. Structure, stoichiometry and phase purity of calcium substituted lanthanum manganite powders. //J. Solid State Chem. 1998. V.140. P.320-330.
52. Hundley M.F., Neumeier J.J. Thermoelectric power of LaixCaxMn03+8: Inadequacy of the nominal Mn3+/4+ valence approach. //Phys. Rev. B. 1997. V.55. P. 11 511-11 514.
53. Taguchi H. Relationshin between crystal structure and electrical properties of the Ca-rich region in (Lai. xCax)Mn02,97. // J- Solid State Chem. 1996. V. 124. P.360-365.
xCax)Mn02,97. // J- Solid State Chem. 1996. V. 124. P.360-365.
54. Raddlesden S.N., Popper P. The compound Sr3Ti207 and its structure. // Acta Cryst. 1958. V. 11. P. 54-56.
55. Asano H., Hayakawa J., Matsui M. Two-dimensional ferromagnetic ordering and magnetoresistance in the layered perovskite La22xCai+2xMn207. // Phys. Rev. B. 1997. V.56. P.5395-5403.
56. Asano H., Hayakawa J., Matsui M. Preparation and properties of triple perovskite La3 3xCa1+3xMn3Oio ferromagnetic thin films. //Appl. Phys. Lett. 1997. V.71. P.844-846.
57. Asano H., Hayakawa J., Matsui M. Magnetoresistance in thin films and bulks of layered-perovskite La2.2xCai+2xMn207. // Appl. Phys. Lett. 1997. V.70. P.2303-2305.
58. Asano H., Hayakawa J., Matsui M. Giant magnetoresistance of a two-dimensional ferromagnetLa2.2xCai+2xMn207. //Appl. Phys. Lett. 1996. V.68. P.3638-3640.
59. Suryanarayanan R., Zelenay I., Berthon J. Ferromagnetism and thermoelectric power ofLai.5Cai.5Mn207. //Mater. Res. Bull. 1997. V.32. P.595-601.
Res. Bull. 1997. V.32. P.595-601.
60. Benabad A., Daodi A., Salmon R., Le Flem G. Les phases SrLnMnC>4 (Ln=La, Nd, Sm, Gd), BaLnMn04(Ln=La,Nd) et Mi+xLai.xMn04 (M=Sr, Ba). // J. Solid State Chem. 1977. V.22. P. 121-126.
61. Mohan Ram R.A., Ganguey P., Rao C.N.R. Magnetic properties of quasi-two-dimensional LaixSrxMn04 and evolution of itinerant electron ferromagnetism in the Sr0-(Lai.xSrxMn03)„ system. //. Solid State Chem. 1987. V.70. P.82-87.
62. Moritomo Y., Tomioka Y., Asamitsu A., TokuraY., Matsui Y. Magnetic and electronic properties in holedoped manganeso oxides with layered slruktures : LaixSri+xMn04.// Phys. Rev. B. 1995. V.51. P.3297-3300.
63. Moritomo Y., Asamitsu A., Kuwahara H., Tokura Y. Giant magnetoresistance of manganese oxides with a layered perovskite structure. // Nature. 1996. V. 380, p. 141144.
64. Seshadri R., Maignan A., Hervieu M., Nguyen N., Raveau B. Complex magnetotransport in LaSr2Mn207. // Solid State Comm. 1997. V. 101. P. 453-457.
453-457.
65. Mahesh R., Mahendiran R., Raychaudhuti A.K., Rao C.N.R. Effect of dimensionality on the giant magnetoresistance of the manganates: A study of the (La,Sr)n+iMnn03n+i family. // J. Solid State Chem. 1996. V. 122. P.448
66. Sloan J., Battle P.D., Green M.A., Rosseinsky M.J., Vente J.F. A HRTEM study of the Ruddlesden-Popper compositions Sr2LnMn207 (Ln=Y, La, Nd, Eu, Ho). // J. Solid State Chem. 1998. V.138. P. 135-140.
67. Hirota H., Moritomo Y., Fujioka H., Kubota M., Yoshizawa H., Endoh Y. Neutron-diffraction studies on the magnetic ordering process in the layered Mn perovskite La2. 2xSr1+2xMn207 (x=0.40, 0.45 and 0.48). //J. Phys. Soc. Jap. 1998. V.67. P.3380-3383.
68. Mitchell J.F., Argyriou D.N., Jorgensen J.D., Hinks D.G., Potter C.D., Bader S.D. Charge delocalisattion and structural response in layered La12Srij8Mn207: enhanced distortion in the metallic regime. // Phys. Rev. B. 1997. V.55. P.63-66.
69. Potter C.D., Swiatek M., Bader S.D., Argyriou D. N., Mitchell J.F., Miller D.J., Hinks D.G., Jorgensen J.D. Two-dimensional intrinsic and extrinsic ferromagnetic behavior of layeredLaj.2SrL8Mn207 single crystals. //Phys. Rev. B. 1998. V.57. P.72-75.
N., Mitchell J.F., Miller D.J., Hinks D.G., Jorgensen J.D. Two-dimensional intrinsic and extrinsic ferromagnetic behavior of layeredLaj.2SrL8Mn207 single crystals. //Phys. Rev. B. 1998. V.57. P.72-75.
70. Cherepanov V.A., Barkhatova L. Yu., Voronin V.I. Phase equilibria in the La-Sr-Mn-0 system. // J. Solid State Chem. 1997. V. 134. P. 38-44.
71. Urushibara A., Moritomo Y., Arima Т., Asamitsu A., Kido G., Tokura Y. Insulator-metal transition and giant magnetoresistance in Lai.xSrxMn03. // Physical Review B. 1995. V. 51. P. 14103-14109.
72. Krogh Anderson I.G., Krogh Anderson E., Norby P., Skou E. Determination of stoichiometry in lanthanum strontium manganates (III) (IV) by wet chemical methods. // J. Solid State Chem. 1994. V. 113. P. 320-326.
73. Kawano H., Kajimoto R., Kubota M., Yoshizawa H. Ferromagnetism-induced reentrant structural transition and phase diagram of the lightly doped insulator Lai.xSrxMn03 (x<0.17). //Phys. Rev. B. 1996. V. 53. №22. P.R 14709-14712.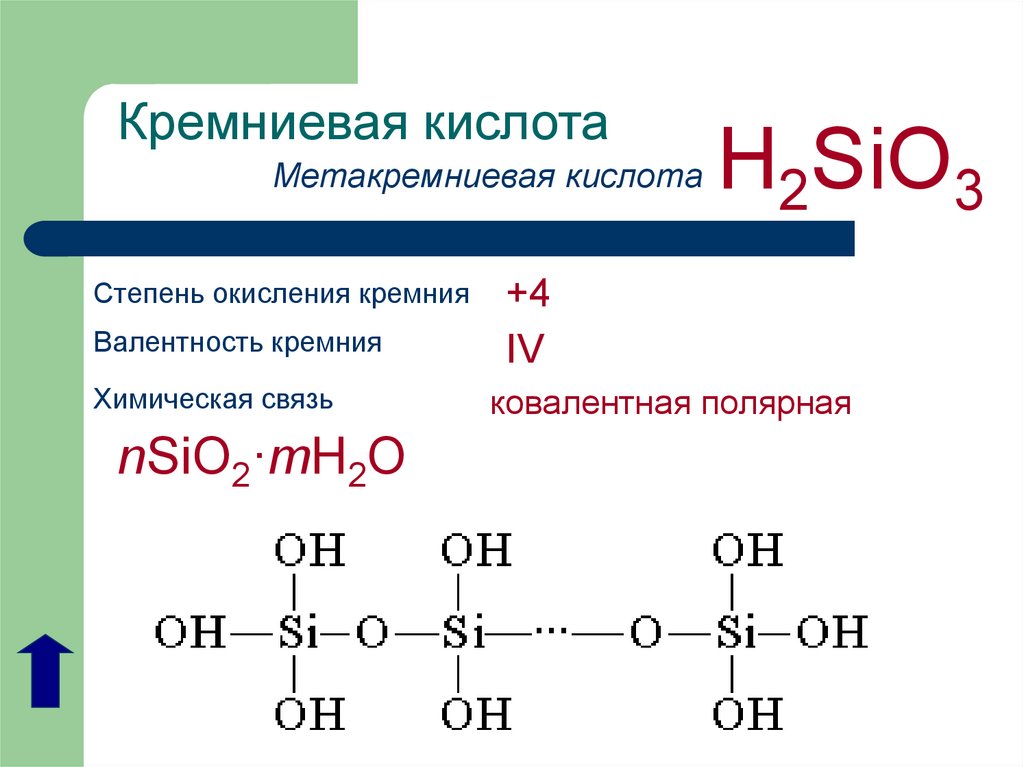
74. Kuo J.H., Anderson H.U., Sparlin D.M. Oxidation-reduction behavior of undoped and Sr-doped LaMn03 nonstoichiometry and defect structure. // J. Solid State Chem. 1989. V.83. P. 52-60.
75. Yasuda I., Hishinuma M. Electrical conductivity and chemical diffusion coefficient of strontium-doped lanthanum manganites. // J. Solid State Chem. 1996. V.123. P.382-390.
76. Newotny J., Rekas M. Defect chemistry of (La,Sr)Mn03. // J. American Ceramic Soc. 1998. V.81. P.67-80.
77. Chakraboity A., Sujatha Devi P., Maiti H.S. Low temperature synthesis and some physical properties of barium-substituted lanthanum manganite (LaiJBaJVInCb). // J. Mater. Res. 1995. V. 10. P. 918-925.
78. Rou C., Budhani R.C. Raman, intrared and X-ray diffraction study of phase stability in Lai.xBaxMn03 doped manganites. // J. Appl. Phys. 1999. V.85. P.3124-3131.
79. Van Santen J.H., Jonker G.H. Electrical conductivity of ferromagnetic compounds of manganese with perovskite structure. //Physica. 1950. V. 16. № 7-8. P. 599-600.
1950. V. 16. № 7-8. P. 599-600.
80. Dabrovski В., Rodacki K., Xiong X., Klamut P.W., Dybzinski R., Shaffer J., Jorgensen J.D. Synthesis and properties of the vacancy-free Lai.xBaxMn03. // Phys. Rev. B. 1998. V.58. P.2716-2723.
81. Sahana M., Satyalakshmi K.M., Hegde M.S., Prasad V., Subramanyam S.V. Giant magnetoresistance in Lao,6Pbo,4MnixTix03 films: enhancement magnetoresistance due to Ti4+ substitution in Mn4+ sites. // Mater. Res. Bull. 1997. V.32. P.831-837.
82. Warzee M.N., Maurice M., Halla F., Ruston W.R. Phases in the binary systems PbO -La203, Gd203, and Sm203. // J. Am. Ceram. Soc. 1965. V. 48. P. 15.
83. Morrish A.H., Evans B.J., Eaton J.A., Leung L.K. Studies of the ionic ferromagnet (LaPb)Mn03. I. Growth and characterisistics of single crystals. // Can. J. Phys. 1969. V.47. P.2691-2696.
84. Leung L.K., Morrish A.H., Searle C.W. Studies of the ionic ferromagnet (LaPb)Mn03. II. Static magnetisation properties from 0 to 800 K. // Can. J. Phys. 1969. V.47. P.2697-2702.
V.47. P.2697-2702.
85. Searle C.W., Wang S.T. Studies of the ionic ferromagnet (LaPb)Mn03. 1П. Ferromagnetic resonance studies. // Can. J. Phys. 1969. V.47. P.2703-2708.
86. Searle C.W., Wang S.T. Studies of the ionic ferromagnet (LaPb)Mn03. V. Electric transport and ferromagnetic properties. // Can. J. Phys. 1970. V.48. P.2023-2031.
87. Троянчук И.О., Балыко JI.B., Бычков Г.Л. Магнитные свойства перовскитов Ьаь xAxMn03.x/2 (А=Са2+, РЪ2+, Ва2+). // Физика твердого тела. 1989. Т.31. №4. С.292-293.
88. Troyanchuk I.O., Khalyavin D.D., Szymezak Н. High pressure synthesis and study of magnetic and transport properties of Pb-substituted manganites with perovskite structure. //Mater. Res. Bull. 1997. V. 32. P. 1637-1642.
89. McCormac M., Jin S., Tiefel Т.Н., Fleming R.M., Philips M. Very large magnetoresistanse in perovskite-like La-Ca-Mn-0 thin films. // Appl. Phys. Lett. 1994. V. 64. P.3045-3047.
90. Matsumoto G. Study of Lai.xCaxMn03. I. Magnetic structure of LaMn03. s and Laoj6(Srot7Pboi3)o,4Mn03.5 single crystals. // Phys Rev. B. 1955. V.52. P. 9147-9150.
s and Laoj6(Srot7Pboi3)o,4Mn03.5 single crystals. // Phys Rev. B. 1955. V.52. P. 9147-9150.
92. Ju H.L., Kwon C., Qi Li, Greene R.L., Venkatesan T. Giant magnetoresistance in Lab xSrxMnOz films near room temperature. // Appl. Phys. Lett. 1994. V. 65. P.2108-2110.
93. Ju H.L., Gopalakrishnan J., Peng L. J., Qi Li, Xiong G.C., Venkatesan Т., Greene R.L. Dependence of giant magnetoresistance on oxygen stoichiometry and magnetisation in polycrystalline Lao.67Bao.33MnOz. //Phys. Rev. B. 1995. V.51. P.6143 -6146.
94. Holzapfer В., Hutten A., Eskert D., Muller K.H., Schultz L. Colossal magnetoresistance in Lai„x PbxMn03 thin films prepared by pulsed laser deposition. // J. Phys. IV. 1997. V.7. P.637-638.
95. Park J.H., Chen C.T., Cheong S.W., Bao W„ Meigs G., Chakarian V., Idzerda Y.U. Electronic aspects of the ferromagnetic transition in manganese perovskites. // Phys. Rev. Lett. 1996. V.76. P.4215-4218.
96. Mahendiran R., Mahesh R., Raychaudhuri A.K., Rao C.N.R. СаодМпОз with homogeneous ionic distribution. // Phys. Status Solidi. 1983. V. 80. P. 621-630.
СаодМпОз with homogeneous ionic distribution. // Phys. Status Solidi. 1983. V. 80. P. 621-630.
101. Hashimoto Т., Ishizawa N., Mizutani N., Kato M. Electrical resistivity and Seebek koefficient of Lai.xMxMn03 (M = Ca, Sr) single crystals // J. Mater. Sci. 1988. V.23. P.1102-1105.
102. Mackor A., Koster T.P.M., Kraaijkamp J.G., Carretsem J. Fubluence of La-substitution and substoichiometry on conductivity, thermal expansion and chemical stability of Ca- or Sr-doped manganites as SOFT. Athens. 1991. P. 463-471.
103. Тихонова Л.А., Самаль Г.И., Жук П.П., Тоноян А.А., Вечер А.А. Физикохимические свойства манганита лантана, дотированного стронцием. // Изв. РАН. Неорган, материалы. 1990. Т. 26. № 1. С. 184-188.
104. Hammouche A., Schouler Е.J.L., Henault М. Electrical and thermal properties of Sr-deped lanthanum manganites. // Solid St. Ionics. 1988. V. 28-30, P. 1205-1207.
105. Бычин В.П., Конопелько М.А., Молчанова Н.Г. Изменение электрических и электрохимических свойств La^Sro^MnOs и La0,7Sr0;3MnO3 при взаимодействии с расплавом карбонатов Li и К. // Электрохимия. 1997. Т. 33. № 12. С. 1423-1426.
// Электрохимия. 1997. Т. 33. № 12. С. 1423-1426.
106. Kuo J.H., Anderson H.U., Sparlin D.M. Oxidation-reduction behavior of undoped and Sr-doped LaMn03: defect structure, electrical conductivity, and thermoelectric power. // J. Solid State Chem. 1990. V.87. P.55-63.
107. Takeda Y., Nakai S., Kojima Т., Kanno R., Shen G.Q., YamamotoO., Mori M., Asakawa C., Abe T. Phase relation in the system (Lai.xAx)i.yMn03+z (A = Sr and Ca). //Mater. Res. Bull. 1991. V.26. P. 153-162.
108. Yasuda I., Hishimima M. Electrical conductivity and chemical diffusion coefficient of strontium-doped lanthanum manganites. // J. Solid State Chem. 1996. V.123. P.382-390.
109. Van Heuveln F.H., Bouwmeester H.J.M., Van Berkel F.P.F. Elektrode properties of Sr-doped LaMn03 on yttria-stabilized zirconia. I. Tree-phase boundary area. // J. Electrochem. Soc. 1997. V. 144. P. 126-133.
110. Van Heuveln F.H., Bouwmeester H.J.M., Van Berkel F.P.F. Elektrode properties of Sr-doped LaMn03 on yttria-stabilized zirconia. II. Electrode kinetics. // J. Electrochem. Soc. 1997. V.144. P. 134-140.
II. Electrode kinetics. // J. Electrochem. Soc. 1997. V.144. P. 134-140.
111. Hayashi K., Yamamoto O., Nisigaki Y., Minoura H. Sputtered La0.5Sr0.5MnO3 yttria stabilized zirconia composite film electrodes for SOFC. // Solid State Ionics. 1997. V.98. P.49-55.
112. Kamegashira N., Miyazaki Y., Yamamoto M. Oxygen pressures over LaMn03+x. // Materials Chemistry and Physics. 1984. V. 11. P. 187-194.
113. Mizusaki J., Tagawa H., Naraya K., Sasamoto T. Nonstoichiometry and thermochemical stability of the perovskite-type lanthanum strontium manganrse oxide (Lai.xSrxMn03.s). // Solid State Ionics. 1991. V. 49. P. 111-118.
114. Liu Yuan,Qin Yongning, Han Sen. Synthesis and catalytic properties of LaMn03 and Lai.xSrxMn03 perovskites with particles of nanometer size. // J. Catal. 1998. V.19. P. 173-176.
115. Мазо Г.Н., Кудряшов И.А., Кемнитц Э. Активность фаз Lai.xSrxMn03 и Lai хСох03 в реакциях изотопного обмена и окисления СО и СН4. // Журнал физ.химии. 2001. Т.75. №7. С. 1232-1238.
С. 1232-1238.
116. Слободан Б.В., Васильев В.Г., Носов А.П. Синтез магниторезистивных манганатов Lao.67Cao.33Mn03 и Lao.6Yo.o7Cao.33Mn03. — Журнал неорганической химии, 1997, том 42, №10 с. 1602-1604.
117. Taguchi Н., Matsuura Sh., Nagao М. et al. Synthesis of LaMn03+§ by firing gels using citric acid. // J. Solid State Chem. 1997. V. 129. P. 60-65.
118. Kakihana M., Arima M., Yoshimura et al. Synthesis of high surface area LaMn03+d by a polymerizable complex method. // J. Alloys Сотр. 1999. V. 283. P. 102-105.
119. Taguchi H., Sugita A., Nagao M. Synthesis of LaMn03+s byfiring gels with poly(acrylic acid) in a pure argon stream. // J. Solid State Chem. 1996. V.121. P. 495497.
120. Ляликов Ю.С. и др. Анализ железных марганцевых руд и агломератов. 2-е изд., перераб. — М.: Металлургия, 1966. — 312 с.
121. Gmelin Handbuch der anorganischen Chemie. Mangan. T.C3. Springer Verlag. 1975. 310 S.
122. Кумок В. H., Кулешова О. М. Карабин JI. А. Произведения растворимости. Новосибирск: Наука. 1983. 266 с.
Новосибирск: Наука. 1983. 266 с.
123. Лурье Ю. Ю. Справочник по аналитической химии. -М.: Химия. 1979. 480 с.
124. Фиштик И. Ф. Ватаман И. И. Термодинамика гидролиза ионов металлов. Кишинев. Штиница. 1988. 294 с.
125. Химическая энциклопедия. М.: Изд-во Советская Энциклопедия. 1990. Т.2. С.556.
126. Химическая энциклопедия. М.: Изд-во Большая Российская Энциклопедия. 1995. Т.4. С.599.
127. Курнаков Н.С. Введение в физико-химический анализ. М.: Изд. АН СССР.- 1940. -564 с.
128. Коренман И. М., Новикова А. М. // Труды по химии и хим. технологии. Горький. Вып. 1. 1962. С. 41.
129. Фесенко Е.Г. семейство перовскита и сегнетоэлектричество. М.: Атомиздат.1971. с. 140.
130. Shennon R.D. Revised effective ionic radii and systematic studies of interatomic distances in halides and chalkogenides. // Acta Cryst. 1976. V. A32. P. 751-767.
131. Филонова E.A., Черепанов В .А., Воронин В.И. Исследование фазового состава и кристаллической структуры в ряду твердых растворов ЬаСо1. МпОз. // Физика твердого тела. 1982. Т. 24. С. 3428-3430 .
МпОз. // Физика твердого тела. 1982. Т. 24. С. 3428-3430 .
136. Booth С., Bridges F., Snyder G., Geballe Т. Evidence of magnetization-dependet polaron distortion in LaixAxMn03, A=Ca, Pb. // Phys. Rev. B. 1996. V. 54, P. 1560615609. f
137. Alonso J., Martinez-Lope M., Casais M. High oxigen pressure synthesis of LaMnCb+s with high 5 values (5<0,31). // Eur. J. Solid State Inorg. Chem. 1996. V. 33. P. 331341.
Какова степень окисления Mn в MnO2 A+2 B+4 класс 11 химия CBSE
Ответ
Проверено
228.6k+ просмотров чтобы образовать химическую связь с другим атомом, также называемую степенью окисления. Суммируя степень окисления присутствующего здесь элемента в молекуле $Mn{{O}_{2}}$ и приняв степень окисления марганца за $x$, найдем его степень окисления.
Полный ответ:
Для расчета степени окисления есть некоторые общие правила, которые нам нужно знать в первую очередь, которые приведены ниже:
Когда мы видим нейтральное соединение, мы говорим, что все степени окисления этого соединения должны в сумме составлять нуль. Идентификация нейтрального соединения заключается в том, что они не имеют никакого заряда, например, ${{H}_{2}}O$(вода).
Идентификация нейтрального соединения заключается в том, что они не имеют никакого заряда, например, ${{H}_{2}}O$(вода).
Если взять примерно ион, то вся его степень окисления должна складываться с зарядом иона.
Теперь, если мы говорим о свободных элементах, таких как $Na, Fe$ и ${{H}_{2}}$, они имеют нулевую степень окисления.
Теперь мы рассчитаем степень окисления, учитывая правила, которые мы обсуждали до сих пор.
Здесь мы будем считать, что общая степень окисления будет равна нулю.
И мы примем степень окисления марганца как $x$.
А как мы знаем степень окисления кислорода $-2$.
Теперь, представив данные в виде уравнения, мы получим:
$x+(-4)=0$
Преобразовав уравнение, мы получим
$x=+4$
Таким образом, мы получим степень окисления марганца как $+4$.
Итак, вариант Б — правильный ответ.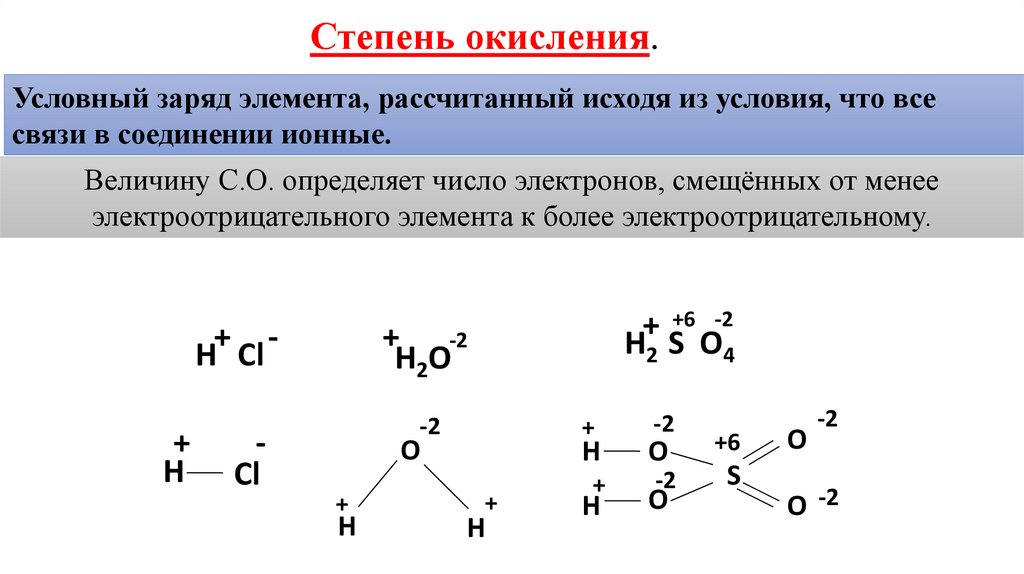
Примечание:
Здесь оксид марганца является нейтральным соединением, степень окисления которого равна нулю, поэтому, когда мы вычислим степень окисления их отдельного элемента, мы получим их сумму как ноль.
Недавно обновленные страницы
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть организованы 12 класса химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал Химический класс 12 JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 Химический класс 12 JEE_Main
Какой элемент обладает наибольшим радиусом атомов Химический класс 11 JEE_Main
Фосфин получают из следующей руды А Кальций класса 12 по химии JEE_Main
В Индии по случаю бракосочетания фейерверков класс 12 по химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть отнесены к классу 12 по химии JEE_Main
Что из нижеперечисленного имеет самый высокий электродный потенциал Химический класс 12 JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 Химический класс 12 JEE_Main
Какой элемент обладает наибольшим атомным радиусом А Химический класс 11 JEE_Main
Фосфин получают из следующей руды A Класс кальция 12 химический JEE_Main
Тенденции сомнения
Настройка степени окисления наночастиц оксида марганца на углеродных нанотрубках, функционализированных кислородом и азотом, для электрокаталитической реакции выделения кислорода 90701 Настройка степени окисления наночастиц оксида марганца на углеродных нанотрубках, функционализированных кислородом и азотом, для электрокаталитической реакции выделения кислорода†
Хендрик Антони, и Вэй Ся, и Только мы Маса, б Вольфганг Шуман б а также Мартин Мюлер * и
Принадлежности автора
* Соответствующие авторы
и Лаборатория промышленной химии, Рурский университет Бохума, Universitätsstr.
Электронная почта: [email protected]
Факс: +49 234 3214115
Тел: +49 234 3228754
б Аналитическая химия – Центр электрохимических наук (CES), Рурский университет Бохума, Universitätsstr. 150, D-44780 Бохум, Германия
Аннотация
Оксиды марганца являются многообещающими электрокатализаторами для реакции выделения кислорода благодаря их универсальным окислительно-восстановительным свойствам. Наночастицы оксида марганца (MnO x ) были синтезированы на углеродных нанотрубках, функционализированных кислородом и азотом (ОУНТ и УНТ), путем прокаливания на воздухе УНТ, импрегнированных марганцем, с загрузкой 10 мас. % Mn. Прокаленные образцы подвергали восстановительным условиям путем термической обработки в H 2 или NH 3 , и к сильно окислительным условиям с использованием паров HNO 3 , что позволило гибко настроить степень окисления Mn от 2+ в MnO до 4+ 9011 в MnO 9011 2 . Образцы были охарактеризованы методами рентгеновской фотоэлектронной спектроскопии, рентгеновской дифракции, просвечивающей электронной микроскопии и термопрограммированного восстановления. Степень окисления Mn легче менялась в MnO
% Mn. Прокаленные образцы подвергали восстановительным условиям путем термической обработки в H 2 или NH 3 , и к сильно окислительным условиям с использованием паров HNO 3 , что позволило гибко настроить степень окисления Mn от 2+ в MnO до 4+ 9011 в MnO 9011 2 . Образцы были охарактеризованы методами рентгеновской фотоэлектронной спектроскопии, рентгеновской дифракции, просвечивающей электронной микроскопии и термопрограммированного восстановления. Степень окисления Mn легче менялась в MnO 

 1 В качестве катализатора
1 В качестве катализатора com
com