Сахароза – формула и состав молекулы, структурная кристаллическая решетка
4.3
Средняя оценка: 4.3
Всего получено оценок: 475.
4.3
Средняя оценка: 4.3
Всего получено оценок: 475.
Привычный сладкий сахар, используемый в быту, называется сахарозой. Это олигосахарид, относящийся к группе дисахаридов. Формула сахарозы – C12H22O11.
Строение
В состав молекулы входят остатки двух циклических моносахаридов – α-глюкоза и β-фруктоза. Структурная формула вещества состоит из циклических формул фруктозы и глюкозы, соединённых атомом кислорода. Структурные единицы связаны вместе гликозидной связью, образующейся между двумя гидроксилами.
Рис. 1. Структурная формула.Молекулы сахарозы образуют молекулярную кристаллическую решетку.
Получение
Сахароза – наиболее распространённый в природе углевод. Соединение входит в состав фруктов, ягод, листьев растений. Большое количество готового вещества содержится в свёкле и сахарном тростнике.
Свёклу или сахарный тростник мелко натирают и помещают в большие котлы с горячей водой. Сахароза вымывается, образуя сахарный раствор. В нём присутствуют различные примеси – красящие пигменты, белки, кислоты. Чтобы отделить сахарозу, в раствор добавляют гидроксид кальция Ca(OH)2. В результате образуется осадок и сахарат кальция С12Н22О11·CaO·2Н2О, через который пропускают диоксид углерода (углекислый газ). В осадок выпадает карбонат кальция, а оставшийся раствор выпаривают до образования кристалликов сахара.
Физические свойства
Основные физические характеристики вещества:
- молекулярная масса – 342 г/моль;
- плотность – 1,6 г/см3;
- температура плавления – 186°С.
Если расплавленное вещество продолжить нагревать, сахароза начнёт разлагаться с изменением окраски.
Попадая в кишечник животных и человека, сахароза под действием ферментов быстро распадается на моносахариды.
Химические свойства
В отличие от глюкозы сахароза не проявляет свойства альдегида за счёт отсутствия альдегидной группы -CHO. Поэтому качественная реакция «серебряного зеркала» (взаимодействие с аммиачным раствором Ag2O) не идёт. При окислении гидроксидом меди (II) образуется не красный оксид меди (I), а ярко-синий раствор.
Основные химические свойства описаны в таблице.
Реакция | Описание | Уравнение |
Качественная реакция на наличие гидроксильных групп | Реагирует с гидроксидом меди (II) с образованием сахарата меди ярко-синего цвета | C12H22O11 + Cu(OH)2 → [Cu(C12H21O11)2] + Н2О |
Гидролиз | Реакция идёт при нагревании в присутствии катализатора (серной или соляной кислоты). | С12Н22О11 + Н2О → C6H12O6 + C6H12O6 |
Сахароза не способна окисляться (не является восстановителем в реакциях) и называется невосстанавливающим сахаром.
Применение
Сахар в чистом виде используется в пищевой промышленности для изготовления искусственного мёда, сладостей, кондитерских изделий, алкоголя. Сахарозу используют для получения различных веществ: лимонной кислоты, глицерина, бутанола.
В медицине сахарозу используют для изготовления микстур и порошков, чтобы скрыть неприятный вкус.
Что мы узнали?
Сахароза или сахар – дисахарид, состоящий из остатков глюкозы и фруктозы. Обладает сладким вкусом, легко растворяется в воде. Вещество выделяют из свёклы и сахарного тростника. Сахароза обладает меньшей активностью, чем глюкоза. Подвергается гидролизу, реагирует с гидроксидом меди (II), образуя сахарат меди, не окисляется. Сахар используют в пищевой, химической промышленности, медицине.
Сахар используют в пищевой, химической промышленности, медицине.
Тест по теме
Доска почёта
Чтобы попасть сюда — пройдите тест.
Кирилл Плотников
10/10
Эля Щербакова
10/10
Оценка доклада
4.3
Средняя оценка: 4.3
Всего получено оценок: 475.
А какая ваша оценка?
Сахароза — Ektpol
Обычный сладкий сахар, используемый в быту, называется сахарозой. Это олигосахарид, принадлежащий к группе дисахаридов. Формула сахарозы C12h32O11.
Содержание
- 1 Строение
- 2 Получение
- 3 Физические свойства
- 4 Химические свойства
- 5 Применение
Строение
Молекула содержит остатки двух циклических моносахаридов: α-глюкозы и β-фруктозы. Структурная формула вещества состоит из циклических формул фруктозы и глюкозы, связанных атомом кислорода.
Рис. 1. Структурная формула.
Молекулы сахарозы образуют молекулярную кристаллическую решетку.
Получение
Сахароза – самый распространенный углевод в природе. Соединение содержится во фруктах, ягодах, листьях растений. Большое количество готового вещества содержится в свекле и тростниковом сахаре. Поэтому сахарозу не синтезируют, а выделяют путем физического воздействия, переваривания и очистки.
Рис. 2. Сахарный тростник.
Свеклу или тростниковый сахар мелко натирают и помещают в большие кастрюли с горячей водой. Сахарозу промывают, образуя сахарный раствор. Он содержит различные примеси: красящие пигменты, белки, кислоты. Для удаления сахарозы к раствору добавляют гидроксид кальция Ca(OH)2. В результате образуется осадок и сахароза кальция С12Н22О11СаО·2Н2О, через которые проходит углекислый газ (углекислый газ). Карбонат кальция выпадает в осадок, а оставшийся раствор выпаривают до образования кристаллов сахара.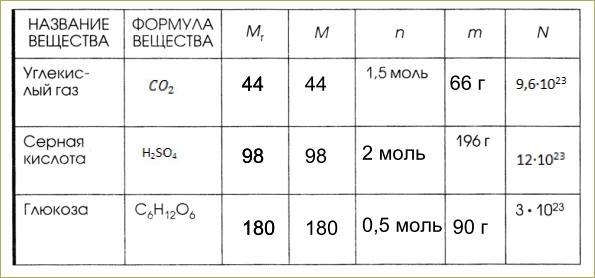
Физические свойства
Основные физические характеристики вещества:
- молекулярная масса — 342 г/моль;
- плотность — 1,6 г/см3;
- температура плавления — 186°С.
Рис. 3. Кристаллы сахара.
Если расплавленное вещество продолжит нагреваться, сахароза начнет разрушаться с изменением цвета. При застывании расплавленной сахарозы образуется карамель — аморфное прозрачное вещество. В 100 мл воды при нормальных условиях можно растворить 211,5 г сахара, при 0 °С — 176 г, при 100 °С — 487 г. В 100 мл этанола при нормальных условиях можно растворить только 0.9 г сахара, который нужно растворить
Попадая в кишечник животных и человека, сахароза под действием ферментов быстро распадается на моносахариды.
Химические свойства
В отличие от глюкозы сахароза не проявляет свойств альдегида из-за отсутствия альдегидной группы -СНО. Поэтому качественной реакции «серебряного зеркала» (взаимодействия с аммиачным раствором Ag2O) не происходит. При окислении гидроксидом меди(II) образует не красный оксид меди(I), а ярко-синий раствор.
При окислении гидроксидом меди(II) образует не красный оксид меди(I), а ярко-синий раствор.
Основные химические свойства описаны в таблице.
Реакция | Описание | Уравнение |
Качественная реакция на наличие гидроксильных групп | Реагирует с гидроксидом меди(II) с образованием сахарозы меди ярко-синего цвета | C12h32O11 + Cu(OH)2 → [Cu(C12h31O11)2] + Н2О |
Гидролиз | Реакция протекает при нагревании в присутствии катализатора (серной или соляной кислоты). Сахароза распадается на молекулы фруктозы и глюкозы | С12Н22О11 + Н2О → C6h22O6 + C6h22O6 |
Сахароза не способна окисляться (не является восстановителем в реакциях) и называется невосстанавливающим сахаром.
Применение
Чистый сахар используется в пищевой промышленности для изготовления искусственного меда, конфет, кондитерских изделий и спирта. Сахарозу используют для получения различных веществ: лимонной кислоты, глицерина, бутанола.
Сахарозу используют для получения различных веществ: лимонной кислоты, глицерина, бутанола.
В медицине сахароза используется для приготовления снадобий и порошков для маскировки неприятного вкуса.
Стехиометрия
| Атомная масса | Изотопы | Атомный вес |
| Крот | Молекулярный вес | Авогадро Константа |
| Преобразование Граммы в моли | ||
Атомная масса
Единицы, в которых выражается масса атома, равны 9.0030 атомный
единицы массы . Когда-то самому легкому атому приписывали
массу 1 а.е.м., а массу любого другого атома выражали в
условия настоящего стандарта. Сегодня атомные единицы массы определяются в
с точки зрения изотопа 12 C, которому присвоена масса
ровно 12. 000… а.е.м.
000… а.е.м.
Изотопы
Изотопы атомы одного и того же элемента с разными
количество нейтронов, таких как
Атомный вес
Атомный вес элемента является средневзвешенным атомных масс различных изотопов элемента. Природный углерод, например, представляет собой смесь двух изотопы 12 С (98,89 %) и 13 С (1,11 %). Таким образом, отдельные атомы углерода имеют массу либо 12 000, либо 13.03354 а.е.м. Но средняя масса различных изотопов углерод составляет 12,011 а.е.м.
Молекулярная масса
Молекулярная масса соединения представляет собой сумму
атомные массы атомов в молекулах, образующих эти
соединения.
Пример: молекулярная масса молекулы сахара, обнаруженная в тростниковый сахар представляет собой сумму атомных весов 12 атомов углерода. атомов, 22 атома водорода и 11 атомов кислорода в C 12 H 22 O 11 молекула.
| 12 атомов углерода = 12(12,011) а.е.м. = | 144,132 а.е.м. |
| 22 атома Н = 22(1,0079) а.е.м. = | 22,174 а.е.м. |
| 11 атомов О = 11(15,9994) а.е.м. = | 175,993 а.е.м. |
| 342 299 а.е.м. |
C 12 H 22 O 11 имеет молекулярную
вес 342,299 а.е.м. Моль C 12 Н 22 О 11 будет иметь массу 342,299 грамма. Эта величина известна как молярных
масса , термин, который часто используется вместо терминов атомный
вес или молекулярный вес.
Крот
Термин крот буквально означает небольшую массу. Это используется как мост между химией на атомном и макроскопический масштаб. Если масса одного 12 атом углерода 12.000 а.е.м., то один моль этих атомов будет иметь массу 12.000 грамм. По определению моль любого вещества содержит столько же элементарных частиц, сколько атомов ровно в 12 граммах 12 C изотоп углерода.
Пример: Один атом 12 C имеет массу 12 а.е.м., и моль этих атомов будет иметь массу 12 граммов.
Моль любых атомов имеет массу в граммах равно атомному весу элемента. Термин родинка может быть применительно к любой частице: атомам, молю атомов, молю ионов, моль электронов или моль молекул. Каждый раз, когда мы используем термин, мы имеем в виду число частиц, равное числу атомов ровно в 12 граммах 12 изотоп С углерод.
| Практическая задача 1: Прогноз
масса моля атомов магния. Нажмите здесь, чтобы проверить ваш ответ на практическое задание 1 |
| Практическая задача 2: Рассчитать молекулярные массы диоксида углерода (CO 2 ) и сахар (C 12 H 22 O 11 ) и масса моля каждого соединения. Нажмите здесь, чтобы проверить свой ответ на практическое задание 2 Нажмите здесь, чтобы увидеть решение практической задачи 2 |
Постоянная Авогадро
Число Авогадро (или постоянная Авогадро)
число элементарных частиц в моле любого вещества Для
большинство расчетов, четыре значащие цифры для Авогадро
констант достаточно: 6. 022 x 10 23 .
022 x 10 23 .
Моль любого вещества содержит Число элементарных частиц Авогадро. Это не имеет значения говорим ли мы о моле атомов, моле молекул, моль электронов или моль ионов. По определению, родинка всегда содержит 6,022 x 10 23 элементарных частиц.
| Практическая задача 3: Опишите разницу между массой из моля атомов кислорода и моля O 2 молекулы. Нажмите здесь, чтобы проверить свой ответ на практическое задание 3 |
| Практическая задача 4: Вычислить масса в граммах одного 12 С атом. Нажмите здесь, чтобы проверить свой ответ на практическое задание 4 Нажмите здесь, чтобы увидеть решение практической задачи 4 |
Перевод граммов в Крот
Крот — мощный инструмент, позволяющий химикам, вооруженным
не более чем таблица атомных весов и весы для
определить количество атомов, ионов или молекул в образце.
Пример: Рассчитаем количество C 12 H 22 O 11 молекул в фунте тростникового сахара.
Для этого вычисления нам нужны две части информации. Мы нужно знать количество граммов в фунте и молекулярную вес или молярная масса этого сахара. Фунт сахара имеет массу 453,6 г, а один моль этого сахара имеет массу 342,3 г. грамм.
Пара единичных факторов может быть построена из молекулярных веса или молярной массы.
Обращая внимание на единицы измерения во время расчета, легко выбрать правильный коэффициент единицы для преобразования граммов сахара в моли сахара.
Затем мы используем число Авогадро для определения числа C 12 H 22 O 11 молекул в нашем образце.
| Практическая задача 5: Что это формула хлорида магния, если 2,55 грамма магний соединяется с 7,45 граммами хлора, образуя 10,0 грамм этого соединения? Нажмите здесь, чтобы проверить свой ответ на практическое задание 5 Нажмите здесь, чтобы увидеть решение практической задачи 5 |
Калькулятор молекулярного веса | Калькулятор молекулярной массы Vulcanchem
| Вулканхем- Дом
- Инструмент
- Калькулятор молекулярной массы
Калькулятор молекулярной массы
Химическая формула соединения
Рассчитать молекулярную массу
Определения молекулярной массы, молекулярной массы, молярной массы и молярной массы
- Молекулярная масса (молекулярная масса) представляет собой массу одной молекулы вещества и выражается в унифицированных атомных единицах массы (u).

- 1 ед равно 1/12 массы одного атома углерода-12
- Молярная масса (молярная масса) представляет собой массу одного моля вещества и выражается в г/моль.
Фон
Молекулярный вес — это мера суммы значений атомного веса атомов в молекуле. Пример: Молекулярная масса молекулы сахара, содержащейся в тростниковом сахаре, представляет собой сумму атомных масс 12 атомов углерода, 22 атомов водорода и 11 атомов кислорода в молекуле C12h32O11. Молекулярная масса используется в химии для определения стехиометрии химических реакций и уравнений. Молекулярная масса обычно обозначается аббревиатурой MW или MW. Молекулярная масса либо безразмерна, либо выражается в единицах атомной массы (а.е.м.) или дальтонах (Да). И атомный вес, и молекулярный вес определяются относительно массы изотопа углерода-12, которому присваивается значение 12 а.е.м. Причина, по которой атомный вес углерода не равен точно 12, заключается в том, что он представляет собой смесь изотопов углерода.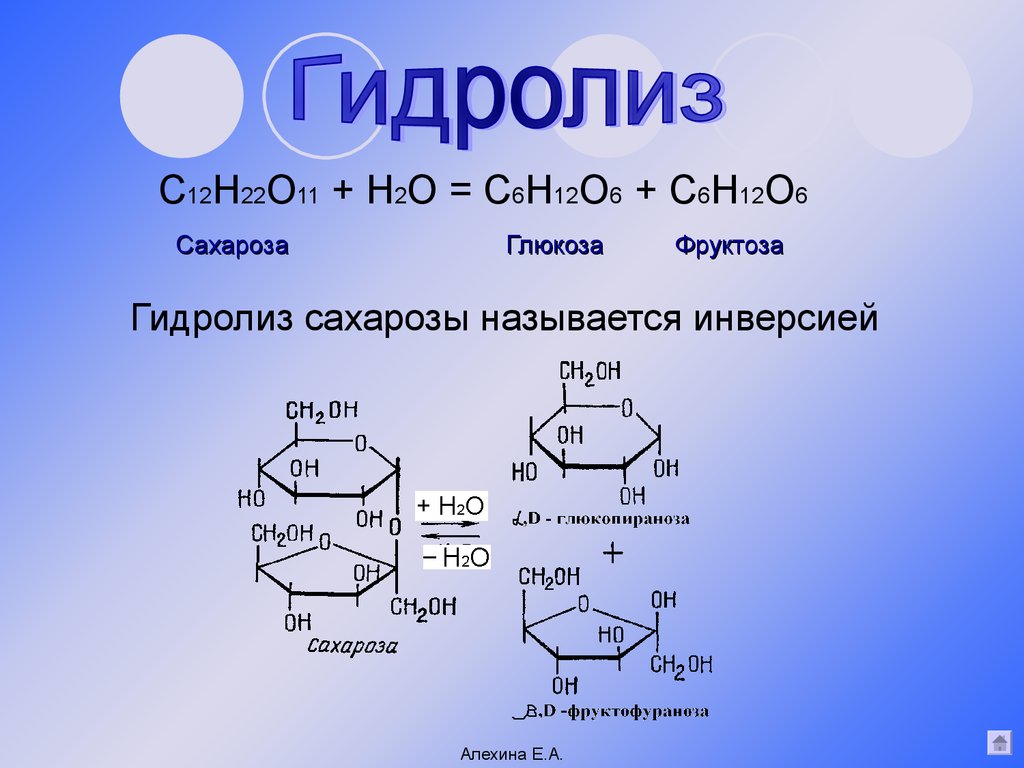
Расчет молекулярной массы основан на молекулярной формуле соединения (т. е. не самой простой формуле, которая включает только соотношение типов атомов, а не количество). Количество атомов каждого типа умножается на их атомный вес, а затем прибавляется к весам других атомов.
Например, молекулярная формула гексана C6h24. Нижние индексы указывают количество атомов каждого типа, поэтому в каждой молекуле гексана 6 атомов углерода и 14 атомов водорода. Атомный вес углерода и водорода можно найти в периодической таблице.
Эмпирические данные о молекулярной массе соединения зависят от размера рассматриваемой молекулы. Масс-спектрометрия обычно используется для определения молекулярной массы молекул малого и среднего размера. Вес более крупных молекул и макромолекул (например, ДНК, белков) определяется с помощью светорассеяния и вязкости.

 Сахароза разлагается на молекулы фруктозы и глюкозы
Сахароза разлагается на молекулы фруктозы и глюкозы