Iнтерактивне навчання
- Час: 00:00/00:40:00
- Питання: 0/20
В честь какого ученого названо число частиц, содержащееся в веществе количеством 1 моль?
(Кількість балів 1.00)
- А
А.-Л. Лавуазье
- Б
Д. И. Менделеев
- В
А. Авогадро
- Г
Э. Резерфорд
- А
В веществе количеством 1 моль содержится столько частиц, сколько содержится атомов в образце простого вещества массой 0,012 кг, образованного элементом:
 00)
00)- А
Карбоном
- Б
Нитрогеном
- В
Оксигеном
- Г
Сульфуром
- А
Отметьте определение молярной массы вещества.
(Кількість балів 1.00)
Отметьте определение молярного объема вещества.
(Кількість балів 1.00)
Каков объем газообразного вещества количеством 1 моль при нормальных условиях?
(Кількість балів 1.
 00)
00)- А
22,4 м3
- Б
11,2 л
- В
22,4 л
- Г
11,2 м3
- А
Отметьте правильное утверждение об относительной плотности газа.
(Кількість балів 1.00)
Относительная плотность газа по водороду равна:
(Кількість балів 1.00)
Отметьте формулировку закона Авогадро.
(Кількість балів 1.00)
Отметьте правильные утверждения о газе ХН4 с относительной плотностью по водороду-8.

(Кількість балів 1.00)
Каков объем газообразного вещества количеством 2 моль при нормальных условиях?
(Кількість балів 1.00)
- А
44,8 л
- Б
11,2 л
- В
22,4 л
- Г
44,8 м3
- А
Чему равна относительная плотность кислорода О2 по водороду Н2?
(Кількість балів 1.00)
- А
32
- Б
2
- В
16
- Г
18
- А
Чему равна молярная масса углекислого газа СО2?
(Кількість балів 1.

- А
28 г/моль
- Б
12 г/моль
- В
14 г/моль
- Г
44 г/моль
- А
Отметьте все правильные утверждения о числе Авогадро.
(Кількість балів 1.00)
Отметьте все правильные утверждения о молярной массе вещества.
(Кількість балів 1.00)
Отметьте все правильные утверждения о молярном объеме газообразных веществ.
(Кількість балів 1.
 00)
00)Отметьте все формулы газов, имеющих одинаковую плотность при одинаковых условиях.
(Кількість балів 1.00)
- А
CH4
- Б
CO
- В
NO
- Г
C2H4
- Д
N2
- Е
N2O
- А
Отметьте все формулы газов, которые легче воздуха.
(Кількість балів 1.00)
- А
SO2
- Б
CO2
- В
СO
- Г
CH4
- Д
NO2
- Е
NH3
- А
Установите соответствие между формулой газа и его относительной плотностью по водороду.

(Кількість балів 1.00)
- 1
СО
- 2
СО2
- 3
SO2
- 4
NH3
- 1
- А
14
- Б
45
32
- Г
22
- Д
8,5
- А
А Б В Г Д 1 2 3 4 Установите соответствие между массой вещества и количеством вещества.

(Кількість балів 1.00)
- 1
196 г H2SO4
- 2
20 г NaOH
- 3
585 г NaCl
- 4
CaCO3
- 1
- А
0,2 моль
- Б
2,0 моль
- В
0,5 моль
- Г
0,1 моль
- Д
10,0 моль
- А
А Б В Г Д 1 2 3 4 Установите соответствие между объемом газа и его массой.

(Кількість балів 1.00)
- 1
224 мл Cl2
- 2
0,448 л O2
- 3
67,2 л N2
- 4
11,2 л NО
- 1
- А
0,34 г
- Б
15,0 г
- В
84,0 г
- Г
0,64 г
- Д
0,71 г
- А
А Б В Г Д 1 2 3 4
Час вичерпано
Объем углекислого газа, его концентрация в воздухе, масса, молекула и физические свойства
Главная » Диоксид углерода
Рубрика: Диоксид углеродаАвтор: admin
Молекула углекислого газа
Углекислый газ представляет собой бесцветный газ, без запаха,который относится к неорганическим веществам. Другие названия вещества — диоксид углерода, двуокись углерода, углекислота, диоксид карбона, угольный ангидрид. Молекула углекислого газа состоит из атома углерода, соединенного двойной ковалентной связью с двумя атомами кислорода.
Другие названия вещества — диоксид углерода, двуокись углерода, углекислота, диоксид карбона, угольный ангидрид. Молекула углекислого газа состоит из атома углерода, соединенного двойной ковалентной связью с двумя атомами кислорода.
Химическая формула — CO2. Молярная масса углекислоты равна 44,01 г/моль. Расстояние от центра центрального атома углерода до каждого центра атома кислорода равно 116,3 пикометров (10 в -12 степени).
Структурная формула молекулыCO2 при низких температурах и нормальном давлении замерзает и кристаллизуется в белую массу, похожую на снег — «Сухой лед». При превышении температуры (-78.5 °C) начинается его испарение (кипение), минуя фазу жидкостного состояния.
В жидкостное состояние газ преобразуется при высоком давлении (73.8 атм.) и средних температурах (+31. 1 °C). Это критическая точка углекислоты. Подъем температуры или давления после нее приводит к образованию сверхкритической жидкости (Отсутствует различие между жидкостной и газовой фазой). При снижении температуры до -56.6 °C и давления до 5.2 атм. он остается в жидкостной фазе. Это предельные значения, при изменении которых углекислота переходит в газообразную или твердую фазу (тройная точка состояний).
1 °C). Это критическая точка углекислоты. Подъем температуры или давления после нее приводит к образованию сверхкритической жидкости (Отсутствует различие между жидкостной и газовой фазой). При снижении температуры до -56.6 °C и давления до 5.2 атм. он остается в жидкостной фазе. Это предельные значения, при изменении которых углекислота переходит в газообразную или твердую фазу (тройная точка состояний).
CO2 не ядовит, но при превышении концентрации в десятки раз, он оказывает удушающее воздействие на живые организмы и вызывает кисловатый вкус и запах (реакция CO2 со слюной и слизистыми образует угольную кислоту).
Читайте также: Углекислый газ в помещении.
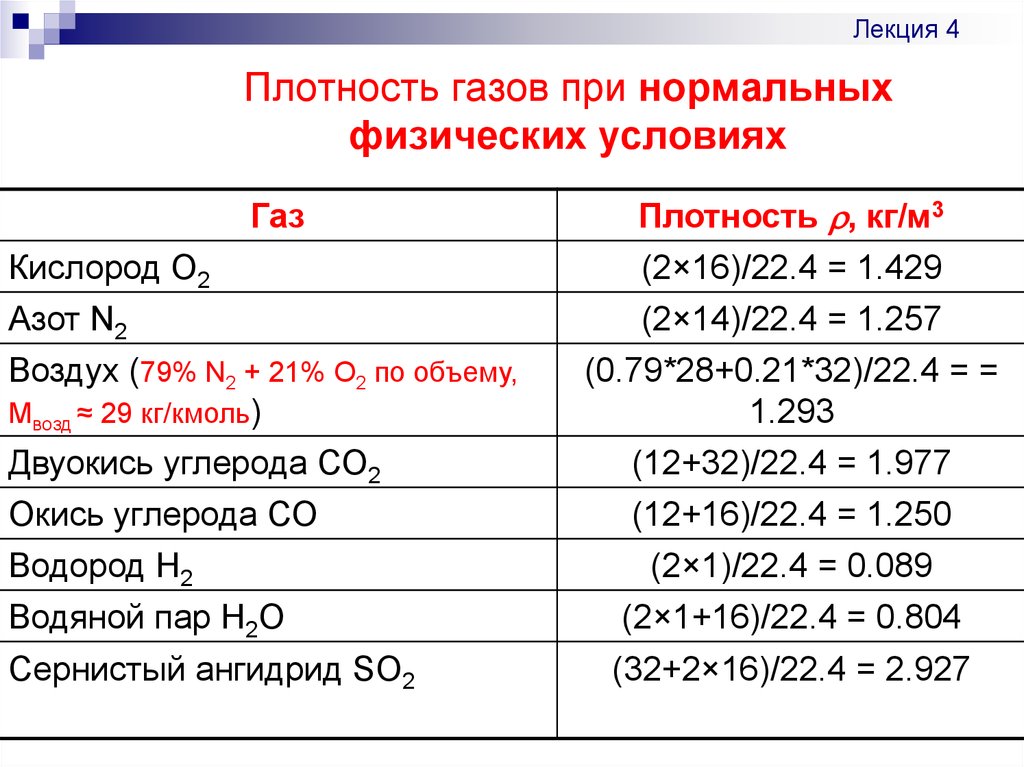
Двуокись углерода превышает по плотности кислород на 37 процентов и равна 1,96 кг/м3 при нормальных условиях среды (температура — 273 К, давление — 101 кПа). Этим физическим свойством объясняется потеря сознания у животных в «Собачьей пещере», расположенной рядом с городом Поццуоли, Италия. Диоксид углерода скапливался из трещин кратеров в нижних слоях пещеры, тем самым достигая больших концентраций. Туристов приводили туда обычно с собакой, которая в пещере с течением времени теряла сознание. Человек обычно не подвергался воздействию CO2, так как дышал воздухом с более высокого уровня.
Диоксид углерода скапливался из трещин кратеров в нижних слоях пещеры, тем самым достигая больших концентраций. Туристов приводили туда обычно с собакой, которая в пещере с течением времени теряла сознание. Человек обычно не подвергался воздействию CO2, так как дышал воздухом с более высокого уровня.
Объем углекислого газа в окружающем нас воздухе, составляет 0,04% (406 ppm – 406 частиц на миллион).
Понравилась статья? Поделиться с друзьями:
Быстрый способ найти молярную массу воздуха
- Воздух — что это такое?
- Как найти молярную массу воздуха?
- Как теоретически рассчитать молярную массу воздуха?
- Как применять эти формулы на практике?
- Какие газы есть в воздухе?
- Плотность воздуха
- Водяной пар
- Свойства воздуха
Воздух окружает нас каждый день, но мы его не замечаем, хотя не можем без него жить. Для человека дыхание является рефлекторным. Мы не думаем о дыхании, и мы делаем это. Вы когда-нибудь задумывались, что вы знаете о воздухе? Если нет, то наша статья станет для вас дверью в мир химии. Вы узнаете, как найти молярную массу сухого воздуха, молекулярную массу воздуха, из чего состоит вещество и много интересных фактов. Если вам сложно справиться с заданием по химии, вы всегда можете получить нашу профессиональную помощь с домашним заданием.
Для человека дыхание является рефлекторным. Мы не думаем о дыхании, и мы делаем это. Вы когда-нибудь задумывались, что вы знаете о воздухе? Если нет, то наша статья станет для вас дверью в мир химии. Вы узнаете, как найти молярную массу сухого воздуха, молекулярную массу воздуха, из чего состоит вещество и много интересных фактов. Если вам сложно справиться с заданием по химии, вы всегда можете получить нашу профессиональную помощь с домашним заданием.
Воздух — что это такое?
Формула воздуха : поскольку воздух представляет собой смесь газов, формулы нет.
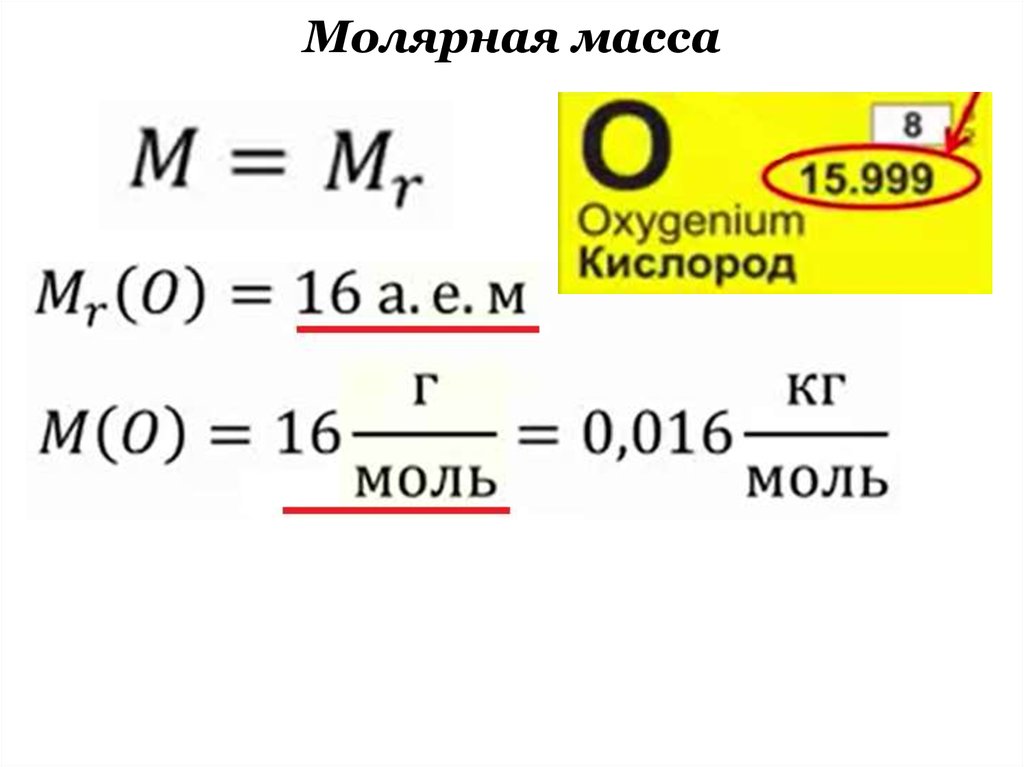
Средняя молярная масса : 28,97 г/моль.
Молекулярная масса : молекулярные массы CO2, h3O и атомная масса кислорода составляют 44, 18 и 16 а.е.м.
Растворимость воздуха в воде: 29,18 см3/л
Как найти молярную массу воздуха?
Если вы впервые сталкиваетесь с такой задачей, есть два метода, которые вы можете использовать, чтобы правильно заполнить химическую бумагу. Рассмотрим первый — можно рассчитать молярную массу воздуха, сложив вес каждого газа. Используя уравнение идеального газа, вы можете определить молярную массу газа. При не слишком высоких давлениях, но достаточно высоких температурах газ можно считать идеальным. Уравнение Менделеева – Клапейрона описывает состояние такого газа:
Рассмотрим первый — можно рассчитать молярную массу воздуха, сложив вес каждого газа. Используя уравнение идеального газа, вы можете определить молярную массу газа. При не слишком высоких давлениях, но достаточно высоких температурах газ можно считать идеальным. Уравнение Менделеева – Клапейрона описывает состояние такого газа:
В этой формуле:
- P — давление газа;
- В – объем газа;
- m — масса газа;
- М — число молей газа;
- R = 8,3145 Дж/(моль∙К) – универсальная газовая постоянная;
- T – абсолютная температура газа.
Из первой формулы получаем выражение для молярной массы газа:
Следовательно, для расчета молярной массы воздуха необходимо знать массу газа — m, температуру — T , давление газа — Р и занимаемый им объем.
Если погрешности измерения P, V и T в любом эксперименте не превышают 1%, то определение массы газа представляет собой сложную задачу. Полное удаление газа из сосуда практически невозможно: даже при наличии самого лучшего современного инженерного инструментария.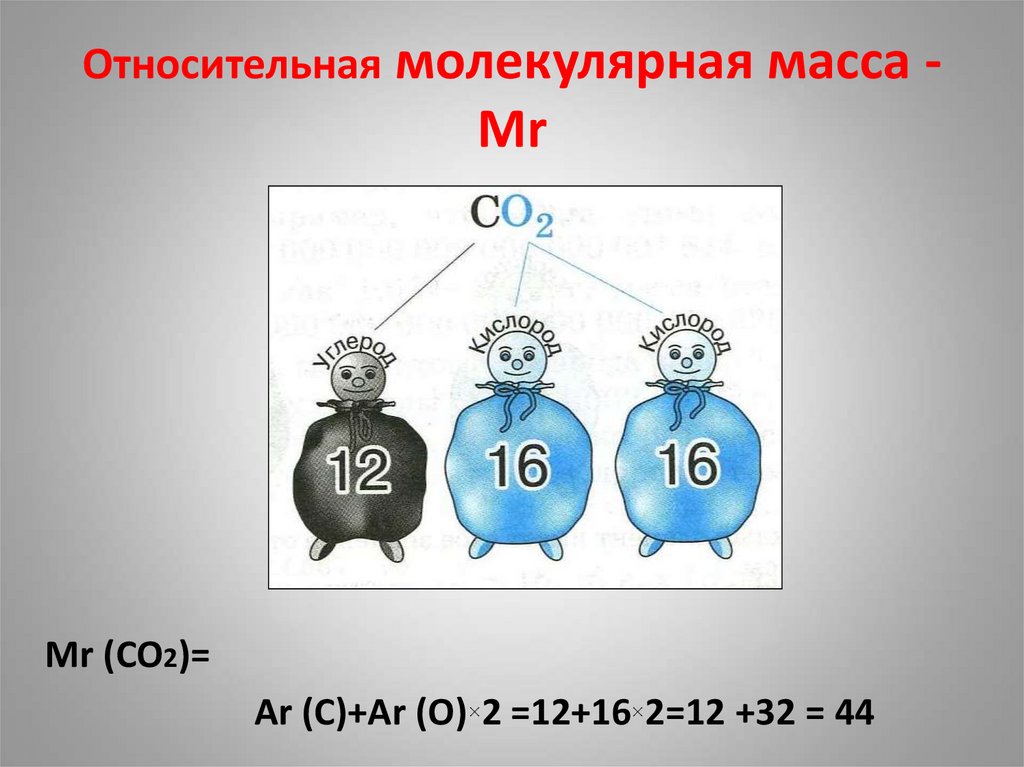
Есть и другой способ определения М, при котором не нужно добиваться полного удаления газа из сосуда — достаточно незначительно изменить его массу. Пусть в сосуде объемом V находится газ массой m1 под давлением P1 и при температуре T. Уравнение состояния для этого газа примет вид:
Откачиваем часть газа из сосуда без изменения его температуры. После вакуумирования масса газа в сосуде и парциальные давления уменьшатся. Обозначим их соответственно m2, P2 и перепишем уравнение состояния:
Из уравнений получим:
Это выражение позволяет определить — М. Если изменение массы газ, давление, температура, объем известны.
В данной работе исследуемым газом является воздух, известный как смесь азота, кислорода, углекислого газа, аргона, паров воды и других газов. Вышеприведенная формула подходит и для определения М смеси газов. В этом случае найденное значение М представляет собой некоторую среднюю или эффективную молярную массу газовой смеси.
Как теоретически рассчитать молярную массу воздуха?
Молярную массу смеси газов (воздуха) можно рассчитать теоретически. Этот метод удобен тем, что известно относительное содержание и молярная масса каждого из газов, входящих в смесь. Формула выглядит так:
В этой формуле:
- м1/м, м2/м — относительные доли содержания каждого газа;
- М1, М — молярные массы газов, входящих в смесь.
Как применять эти формулы на практике?
В домашнем задании по химии учителя дают расширенные данные, процентное содержание газа, атомный вес и различные коэффициенты. Поэтому, имея все данные, можно применять формулы. Возьмем пример:
Задача: Рассчитайте среднюю молярную массу воздуха следующего состава: 21% O2, 78% N2, 0,5% Ar и 0,5% CO2.
Решение: Поскольку объемы газов пропорциональны их количествам (закон Авогадро), средняя молярная масса смеси может быть выражена как через объемы, так и через количества веществ:
Mср = (M1 · V1 + M2 · V2 + M3 · V3 +) / (V1 + V2 + V3 + . ..) (1)
..) (1)
Mср = (M1 ν1 + M2 ν2 + M3 ν3 +) / (ν1 + ν2 + ν3 + …) (2)
Возьмем 1 моль воздуха, тогда v(O2) = 0,21 моль, v(N2) = 0,78 моль, v(Ar) = 0,005 моль и v (CO2) = 0,005 моль. Подставив эти значения в формулу, получим:
Mср (воздух) = (0,21 · 32 + 0,78 · 28 + 0,005 · 40 + 0,005 · 44) / (0,21 + 0,78 + 0,005 + 0,005) = 29 г/моль.
Вот почему в многочисленных вычислительных задачах, связанных с относительной плотностью газов в воздухе, средняя молярная масса воздуха всегда принимается равной 29г/моль.
Ответ: Mav (воздух) = 29 г/моль.
Какие газы находятся в воздухе?
Атмосферный воздух представляет собой смесь газов. Однако это не полное определение, и для его расширения обратимся к истории. В 1754 году шотландский физик и химик Джозеф Блэк при нагревании белой магнезии обнаружил выделение «связанного воздуха». Получив СО2, мистер Блэк сделал еще одно важное открытие — состав воздуха, который раньше считался одним веществом, неоднороден.
Джозеф Блэк указал путь другим ученым, которые один за другим стали все больше и больше расшифровывать состав атмосферы, рассчитывать содержание кислорода в воздухе и других газов. Сформировалось само определение, которое сегодня звучит так: воздух – это смесь газов, образующих атмосферу Земли. Основная функция воздуха — сделать планету пригодной для дыхания и существования живых организмов.
Газообразный азот занимает большую часть воздуха. Однако химический состав оставшейся части интересен и разнообразен. Вкратце список необходимых элементов таков:
- Кислород. Доля газообразного кислорода в воздухе колеблется в пределах 21% по объему и 23% по массе. Вместе с азотом эти два газа составляют 99% всего земного воздуха.
- Аргон. Аргон не имеет запаха, цвета и вкуса. Существенной биологической роли этого газа не выявлено, но он обладает наркотическим действием и даже считается допингом.
- Углекислый газ.
 Углекислый газ составляет атмосферу Венеры и Марса. Его процентное содержание в земном воздухе значительно ниже. В то же время в океане содержится значительное количество углекислого газа. В твердой форме углекислый газ является одним из самых известных хладагентов сухого льда.
Углекислый газ составляет атмосферу Венеры и Марса. Его процентное содержание в земном воздухе значительно ниже. В то же время в океане содержится значительное количество углекислого газа. В твердой форме углекислый газ является одним из самых известных хладагентов сухого льда. - Неон. Неон оказывает на человека наркотическое действие при определенном давлении, но это идеальный газ, используемый при обучении водолазов и других людей, работающих под полным давлением.
- Метан. Сегодня этот газ, добываемый и используемый в качестве топлива и сырья в производстве, не так широко распространен в атмосфере, но все же улетучивается с Земли.
- Гелий. Этот газ не относится к числу наиболее важных с точки зрения важности. Трудно определить биологическое значение этого газа.
- Криптон. Криптон — инертный газ, в три раза тяжелее воздуха, химически инертен, добывается из воздуха, используется в лампах накаливания, лазерах и до сих пор активно изучается.

- Hydroge н. Атомы водорода в воздухе занимают 0,00005 % по объему и 0,00008 % по массе, но при этом являются самыми распространенными элементами во Вселенной.
- Ксенон. В наше время без ксенона не обойтись: производство мощных и импульсных источников света, диагностика и анестезия в медицине, двигатели космических кораблей, ракетное топливо.
Плотность воздуха
Какова плотность воздуха? Плотность газа можно определить аналитически, разделив его массу на объем, который он занимает при данных условиях (давление воздуха, абсолютная температура и влажность). Также можно рассчитать его плотность, используя закон идеального газа: pV = nRT, где n — молекулы газа, R — газовая постоянная. Таким образом, необходимо знать абсолютное давление и температуру воздуха, его газовую постоянную и мольную долю. Это уравнение вычисляет плотность сухого воздуха.
Водяной пар
Из-за испарения воды с поверхности океана в воздухе всегда присутствует влажный воздух. Количество влажного воздуха зависит от температуры воздуха, наличия и скорости ветра, характера рельефа, растительного покрова и цвета почвы.
Количество влажного воздуха зависит от температуры воздуха, наличия и скорости ветра, характера рельефа, растительного покрова и цвета почвы.
Согласно закону Дальтона, давление воздуха, содержащего водяной пар, равно сумме давления сухого воздуха и давления водяного пара. Атмосферное давление: Па = Pda + Pp.
О влажности воздуха можно судить либо по величине давления, создаваемого паром. Количество водяных паров, содержащихся в 1 м3 воздуха, называется абсолютной влажностью. Отношение плотности водяного пара при данной температуре к плотности насыщенного пара при той же температуре называется относительной влажностью.
Свойства воздуха
Воздух обладает многими свойствами, и вам необходимо знать об этих:
- Воздух прозрачен, бесцветен, не имеет запаха и плохо проводит тепло.
- Воздух хорошо проводит солнечный свет.
- Воздух занимает место в окружающем мире.
- Воздух можно сжимать.
- Воздух эластичен.

- Воздух расширяется при нагревании; при охлаждении воздух сжимается.
Теплый воздух легче холодного и стремится вверх.
Влияние молекулярной массы хитозана на переключение между эмульгированием и деэмульгированием под действием CO2
Влияние молекулярной массы хитозана на CO
2 -переключение между эмульгированием и деэмульгированием†Донъин Рен, и Чжисинь Шан, и Мэй Чжан, и Шэнмин Сюй б и Чжэнхэ Сюй* до н.э.
Принадлежности автора
* Соответствующие авторы
и Колледж текстиля и одежды, Университет Дэчжоу, Дэчжоу, КНР
б Институт ядерных и новых энергетических технологий, Университет Цинхуа, Пекин 100084, КНР
с Шэньчжэньская ключевая лаборатория межфазных исследований и инженерии материалов, факультет материаловедения и инженерии, Южный научно-технический университет, Шэньчжэнь 518055, Китай
Электронная почта: xuzh@sustech. edu.cn
edu.cn
Аннотация
Роль молекулярной массы как ключевого физического свойства макромолекул в определении CO 2 — инициируемых характеристик переключения чувствительных эмульсий, приготовленных с использованием CO 2 — переключаемые макромолекулы не изучались и находятся в центре внимания настоящего исследования. В этой работе CO 2 -переключаемый хитозан четырех различных молекулярных масс используется для исследования влияния молекулярной массы на CO 2 -переключение реагирующих на CO 2 эмульсий. Показано, что молекулярная масса хитозана оказывает противоположное влияние на эмульгирование и деэмульгирование CO 2 триггер. Перед барботированием CO 2 хитозан более высокой молекулярной массы образует более стабильную трехмерную сетчатую структуру в непрерывной фазе эмульсий масло-в-воде (М/В), что приводит к образованию более стабильной эмульсия.

 00)
00) 00)
00)

 00)
00)

 Углекислый газ составляет атмосферу Венеры и Марса. Его процентное содержание в земном воздухе значительно ниже. В то же время в океане содержится значительное количество углекислого газа. В твердой форме углекислый газ является одним из самых известных хладагентов сухого льда.
Углекислый газ составляет атмосферу Венеры и Марса. Его процентное содержание в земном воздухе значительно ниже. В то же время в океане содержится значительное количество углекислого газа. В твердой форме углекислый газ является одним из самых известных хладагентов сухого льда.
