Молярная масса. Молярный объём. Решение задач 8 класс онлайн-подготовка на Ростелеком Лицей
Количество вещества и молярная масса
В процессе химических реакций атомы (или молекулы) вещества друг с другом взаимодействуют, образуя новые молекулы. Но определить количество атомов, молекул и других частиц на практике невозможно – они слишком малы и не видны невооруженным глазом. Для определения числа структурных частиц вещества в химии применяют особую величину – количество вещества (n – «эн»).
Единицей количества вещества является моль (от слова «молекула»).
1 моль любого вещества содержит 6,02·1023 частиц (например, молекул). Это число называют числом Авогадро.
Постоянная Авогадро: Nа = 6,02·1023 1/моль.
Используя постоянную Авогадро, можно находить количество вещества, если известно число молекул в нем, и наоборот. Количество вещества равно отношению общего числа его молекул к постоянной Авогадро.
Количество вещества равно отношению общего числа его молекул к постоянной Авогадро.
В равных количествах веществ содержится равное число их структурных частиц (например, молекул).
Установлено, что масса одного моля вещества численно равна его относительной молекулярной массе. Такая величина называется молярной массой вещества, М. Молярная масса измеряется в г/моль. Например, молярная масса азота N2 равна 28 г/моль.
Количество вещества можно вычислить, разделив массу порции вещества на молярную массу этого вещества: n = m/М.
Задача 1
Условие. Какое количество оксида кальция содержится в 112 г этого вещества?
Дано:
m (СаО ) = 112г
Найти:
n (СаО) – ?
Решение.
Химическая формула оксида кальция – СаО.
n (CaO) = m(CaO) / М(СаО)
Mr (CaO) = 40 + 16 = 56
n (CaO) = 112 г / (56г/моль) = 2 моль
Ответ: 2 моль СаО.
Задача 2
Условие. Вычислите массу порции воды, в которой содержится столько же молекул, сколько их в 22 г углекислого газа.
Дано:
m(CO2) = 22 г
n(CO2) = n(H2O)
Найти:
m(H2O) – ?
Алгоритм решения
Зная массу углекислого газа, рассчитывают его количество. Затем находят количество воды (оно будет равно количеству углекислого газа). А потом, зная количество воды, вычисляют ее массу:
m(CO2) → n(CO2) → n(H2O) → m(H2O)
Решение
1. n(CO2) = m(CO2)/М(СО2)
Mr(CO2) = 12 + 16·2 = 44
n(CO2) = 22 г/44 г/моль = 0,5 моль
2. n(H2O) = n(CO2) = 0,5 моль
3. m(H2O) = n(H2O)·M(H2O)
Mr(H2O) = 1·2+16 = 18
m(H2O) = 0,5 моль·18 г/моль = 9 г
Ответ: 9 г Н2О.
Молярный объем
В 1811 году итальянский ученый Амедео Авогадро (рис. 1) сформулировал основной газовый закон, который назвали его именем. Закон Авогадро звучит так:
В равных объемах газов при одинаковых условиях содержится равное число молекул.
Следовательно, при одинаковых условиях равные количества различных газов занимают равные объемы.
При нормальных условиях (при температуре 0 °С и давлении 1 атм.) 1 моль любого газа занимает объем 22,4 л. Эта физическая постоянная – молярный объем газа при н. у.:
Vm = 22,4 л/моль при нормальных условиях.
Количество газообразного вещества равно отношению объема порции газа к молярному объему газа при данных условиях.
Рис. 1. Амедео Авогадро (1776–1856)
Задача 3
Условие. Вычислите массу метана СН4, объем которого при н. у. составляет 67,2 л.
Дано:
V(CН4) = 67,2 л
Найти:
m(CН4) – ?
Решение.
Алгоритм решения
V(CН4) → n(CН4) → m(CН4)
1) n(CН4) = V(CН4)/Vn = 67,2 л/ 22,4 (л/моль) = 3 моль
2) m(CН4) = n(CН4)·M(CН4)
Mr(CН4) = 12 + 1·4 =16
m(CН4) = 3 моль·16 г/моль = 48 г
Ответ: 48 г CН4.
Подведение итогов урока
В ходе урока вы узнали, что такое молярная масса и молярный объем вещества и как использовать эти понятия при решении расчетных задач.
Список литературы
- Оржековский П. А. Химия: 8 класс: учеб для общеобр. учрежд. / П. А. Оржековский, Л. М. Мещерякова, М. М. Шалашова. – М.: Астрель, 2013. (§15)
- Рудзитис Г. Е. Химия: неорган. химия. Орган. химия: учеб.
 для 9 кл. / Г. Е. Рудзитис, Ф. Г. Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2009. (§17)
для 9 кл. / Г. Е. Рудзитис, Ф. Г. Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2009. (§17) - Хомченко И. Д. Сборник задач и упражнений по химии для средней школы. – М.: РИА «Новая волна»: Издатель Умеренков, 2008. (с. 10)
- Энциклопедия для детей. Том 17. Химия / Глав. ред. В. А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
- Интернет-портал «hemi.nsu.ru» (Источник)
- Интернет-портал «hemi.nsu.ru» (Источник)
- Интернет-портал «alhimikov.net» (Источник)
- Интернет-портал «cde.osu.ru» (Источник)
Домашнее задание
- с. 86 №№ 3–5 из учебника П. А. Оржековского «Химия: 8 класс» / П. А. Оржековский, Л. М. Мещерякова, М. М. Шалашова. – М.: Астрель, 2013.
- Какой объем при н. у. займут 5 моль кислорода О2?
- Какая масса соответствует 3,36 л (н.
 у.) хлора Cl2?
у.) хлора Cl2?
КАК РЕШАТЬ ПРОСТЕЙШИЕ ЗАДАЧИ ПО ХИМИИ
КАК РЕШАТЬ ПРОСТЕЙШИЕ ЗАДАЧИ ПО ХИМИИКАК РЕШАТЬ ПРОСТЕЙШИЕ ЗАДАЧИ ПО ХИМИИВ реакцию с соляной кислотой вступило 13 г цинкаНовая страница 1 4.Как решать задачи, где одно из реагирующих веществ дано в избытке?В реакцию с соляной кислотой вступило 13 г цинка. Определите массы израсходованной кислоты и полученной соли, а также объем выделившегося газа.
Решение.
1. Находим количество вещества цинка, разделив его массу на молярную массу:
n(Zn) = m : M = 13 г : 65 г/моль = 0,2 моль
2. Вносим эту величину в уравнение
реакции и с ее помощью определяем
количества всех указанных в задаче веществ
(с учетом коэффициентов):
Вносим эту величину в уравнение
реакции и с ее помощью определяем
количества всех указанных в задаче веществ
(с учетом коэффициентов):
0,2 моль 0,4 моль 0,2 моль 0,2 моль
Zn + 2HCl => ZnCl2 + h3
m(HCl) = M · n = 36,5 г/моль · 0,4 моль = 14,6 г
m(ZnCl2) = M · n = 136 г/моль · 0,2 моль = 27,2 г
Объем водорода находим аналогично:
V(h3) = Vm · n = 22,4 л/моль · 0,2 моль = 4,48 л
ЗАДАЧИ НА ИЗБЫТОК РЕАГЕНТА
Главный
отличительный признак таких расчетов – это
наличие числовых данных (массы, объема,
количества вещества или необходимых
компонентов для их вычисления) по обоим
веществам, реагирующим между собой. Чаще
всего это говорит о том, что одно из этих
веществ находится в избытке и вступит в
реакцию не полностью. Определить же, что
именно в избытке, удобнее всего, когда
известны количества вещества реагентов.
Если они не указаны в условии, их следует
вычислить по исходным данным.
Чаще
всего это говорит о том, что одно из этих
веществ находится в избытке и вступит в
реакцию не полностью. Определить же, что
именно в избытке, удобнее всего, когда
известны количества вещества реагентов.
Если они не указаны в условии, их следует
вычислить по исходным данным.
Задача 1.
8 г серы нагрели с 28 г железа. Определите массу продукта реакции.
Решение.
1. Так как в условии указаны массы железа и серы одновременно, то одно из этих веществ вполне может оказаться в избытке. Для выяснения этого находим количества вещества реагентов:
n(Fe) = m : M = 28 г : 56 г/моль = 0,5 моль
n(S) = m : M = 8 г : 32 г/моль = 0,25 моль
2. Записываем уравнение реакции и по коэффициентам определяем мольные отношения реагентов:
Fe + S ® FeS
3. Так как железа и серы должно
реагировать равное количество молей, то
ясно, что в этой реакции будет
израсходовано по 0,25 моль их, избыток железа
при этом составит 0,5 – 0,25 + 0,25 моль, и в
реакцию не вступит.
Так как железа и серы должно
реагировать равное количество молей, то
ясно, что в этой реакции будет
израсходовано по 0,25 моль их, избыток железа
при этом составит 0,5 – 0,25 + 0,25 моль, и в
реакцию не вступит.
4. Так как сера взята в недостатке, то по ее количеству определяем количество продукта реакции, а затем его массу:
0,25 моль 0,25 моль 0,25 моль
Fe + S ® FeS
m (FeS) = M · n = 88 г/моль · 0,25 моль = 22 г
Задача 2.
Для реакции взято 56 л хлора и 56 г железа. Определите массу полученного продукта.
Решение.
2Fe + 3Cl2 ® 2 FeCl3
В этом случае расчет избытка более сложен, поэтому можно использовать такую хитрость:
|
|
Cl2 |
|
2 |
3 |
|
1 |
|
|
|
2,5 |
В
первой строке пишем формулы реагирующих
веществ, во второй – их мольные отношения
по уравнению реакции (по коэффициентам), а в
двух следующих – количества
этих веществ,
имеющихся в наличии, причем на разных
строках.
| Fe | Cl2 |
|
2 |
3 |
|
1 |
1,5 |
|
1,67 |
2,5 |
Далее анализируем полученные данные.
Железа есть 1 моль, а
для реакции с 2,5 моль хлора его нужно в
полтора раза меньше, это составляет 1,67 моль,
чего у нас нет.
Таким образом, в недостатке железо, и дальнейшие расчеты ведем по его количеству:
1 моль 1,5 моль 1 моль
2Fe + 3Cl2 ® 2 FeCl3
m (FeСl3) = M · n = 162,5 г/моль · 1 моль = 162,5 г
Задача 3.
К раствору, содержащему 26,1 г нитрата бария, добавлен раствор, содержащий 35,5 г сульфата натрия, осадок отфильтрован. Что находится в фильтрате и в каком количестве?
Решение.
n [Ba(NO3)2] = 26,1 г : 261 г/моль = 0,1 моль
n (Na2SO4) = 35,5 г : 142 г/моль = 0,25 моль (избыток 0,15 моль)
0,1 моль 0,1 моль 0,1 моль 0,2 моль
Ba(NO3)2 + Na2SO4 ® BaSO4 + 2HCl
В растворе после реакции окажется 0,2 моль нитрата натрия и остаток сульфата натрия 0,15 моль. При необходимости можно найти массы этих веществ.
Иногда от количеств вещества реагентов может зависеть не только количество продуктов реакции, но и их состав.
Задача 4.
К
раствору, содержащему 49 г серной кислоты,
добавлено 20 г гидроксида натрия. Определите
состав и массу полученной соли.
Решение.
n (h3SO4) = 49 г : 98 г/моль = 0,5 моль
n (NaOH) = 20 г : 40 г/моль = 0,5 моль
Так как серная кислота двухосновна, то она может образовать два ряда солей:
2 NaOH + h3SO4 ® Na2SO4 + 2h3O средняя соль
NaOH + h3SO4 ® NaHSO4 + h3O кислая соль
В нашей задаче оказалось равное мольное количество кислоты и щелочи, поэтому расчет следует вести по второму уравнению реакции:
0,5 моль 0,5 моль 0,5 моль
NaOH + h3SO4 ® NaHSO4 + h3O
m (NaHSO4) = M ·
n =
120 г/моль ·
0,5 моль =
60 г.
Задача 5.
Через раствор, содержащий 60 г гидроксида натрия, пропущен углекислый газ, полученный при действии избытка соляной кислоты на 200 г карбоната кальция. Определите состав и массу полученной соли.
Решение.
1. Определяем количества вещества веществ, указанных в условии задачи:
n (NaOH) = m : M = 60 г : 40 г/моль = 1,5 моль
n (CaCO3) = m : M = 200 г : 100 г/моль = 2 моль
2. Записываем уравнение реакции, в которой был получен углекислый газ, и по количеству вещества СаСО3 определяем, сколько моль газа выделилось:
2 моль 2 моль
CaCO3 + 2HCl ® CaCl2 + h3O + CO2
3. Таким
образом, для второй реакции у нас имеется 2
моль углекислого газа и 1,5 моль гидроксида
натрия. Так как СО2
– ангидрид двухосновной угольной кислоты Н2СО3,
то при его взаимодействии с щелочами могут
образоваться как средние, так и кислые соли:
Таким
образом, для второй реакции у нас имеется 2
моль углекислого газа и 1,5 моль гидроксида
натрия. Так как СО2
– ангидрид двухосновной угольной кислоты Н2СО3,
то при его взаимодействии с щелочами могут
образоваться как средние, так и кислые соли:
NaOH + CO2 ® NaHCO3
2NaOH + CO2 ® Na2CO3 + h3O
Теперь нужно определиться, по какому из двух уравнений реакций нам вести расчет. Для образования средней соли щелочи должно быть вдвое больше, чем газа. У нас же наоборот, газа больше, чем щелочи. Следовательно, реакция пойдет по первому уравнению, с образованием кислой соли, причем СО2 окажется в избытке (0,5 моль):
1,5 моль 1,5 моль 1,5 моль
NaOH + CO2 ® NaHCO3
m
(NaHCO3)
= M ·
n = 84 г/моль
· 1,5 моль
= 126 г.
Решите самостоятельно.
1. 14 г оксида кальция обработали раствором, содержащим 36 г азотной кислоты. Какова масса полученной соли? (41 г).
2. К раствору, содержащему 40 г сульфата меди (II), добавили 12 г железных опилок. Останется ли в растворе сульфат меди после реакции?
3. Хватит ли 15 л кислорода для сжигания 4 г серы?
(да)
4. В раствор, содержащий 16 г сульфата меди (II), пропустили сероводород объемом 5,6 л. Какова масса выпавшего осадка? (9,6 г).
5. К раствору, содержащему 10,4 г хлорида бария, добавили 9,8 г серной кислоты. Определите массу осадка и состав полученного раствора. (11,65 г)
Урок 5.
 Моль и молярная масса – HIMI4KA
Моль и молярная масса – HIMI4KAАрхив уроков › Основные законы химии
В уроке 5 «Моль и молярная масса» из курса «Химия для чайников» рассмотрим моль как единицу измерения количества вещества; дадим определение числу Авогадро, а также научимся определять молярную массу и решать задачи на количество вещества. Базой для данного урока послужат основы химии, изложенные в прошлых уроках, так что если вы изучаете химию с нуля, то рекомендую их просмотреть хотя бы мельком.
Содержание
- Единица измерения количества вещества
- Молярная масса вещества
- Задачи на количество вещества
Единица измерения количества вещества
До этого урока мы обсуждали лишь индивидуальные молекулы и атомы, а их массы мы выражали в атомных единицах массы. В реальной жизни с индивидуальными молекулами работать невозможно, потому что они ничтожно малы. Для этого химики взвешивают вещества ни в а.е.м., а в граммах.
Чтобы перейти от молекулярной шкалы измерения масс в лабораторную шкалу, используют единицу измерения количества вещества под названием моль. 1 моль содержит 6,022·1023 частиц (атомов или молекул) и является безразмерной величиной. Число 6,022·1023 носит название Число Авогадро, которое определяется как число частиц, содержащихся в 12 г атомов углерода 12C. Важно понимать, что 1 моль любого вещества содержит всегда одно и то же число частиц (6,022·1023).
1 моль содержит 6,022·1023 частиц (атомов или молекул) и является безразмерной величиной. Число 6,022·1023 носит название Число Авогадро, которое определяется как число частиц, содержащихся в 12 г атомов углерода 12C. Важно понимать, что 1 моль любого вещества содержит всегда одно и то же число частиц (6,022·1023).
Как уже было сказано, термин «моль» применяется не только к молекулам, но также и к атомам. Например, если вы говорите о моле гелия (He), то это означает, что вы имеет количество равное 6,022·1023 атомов. Точно так же, 1 моль воды (H2O) подразумевает количество равное 6,022·1023 молекул. Однако чаще всего моль применяют именно к молекулам.
Молярная масса вещества
Молярная масса – это масса 1 моля вещества, выраженная в граммах. Молярную массу одного моля любого химического элемента без труда находят из таблицы Менделеева, так как молярная масса численно равна атомной массе, но размерности у них разные (молярная масса имеет размерность г/моль).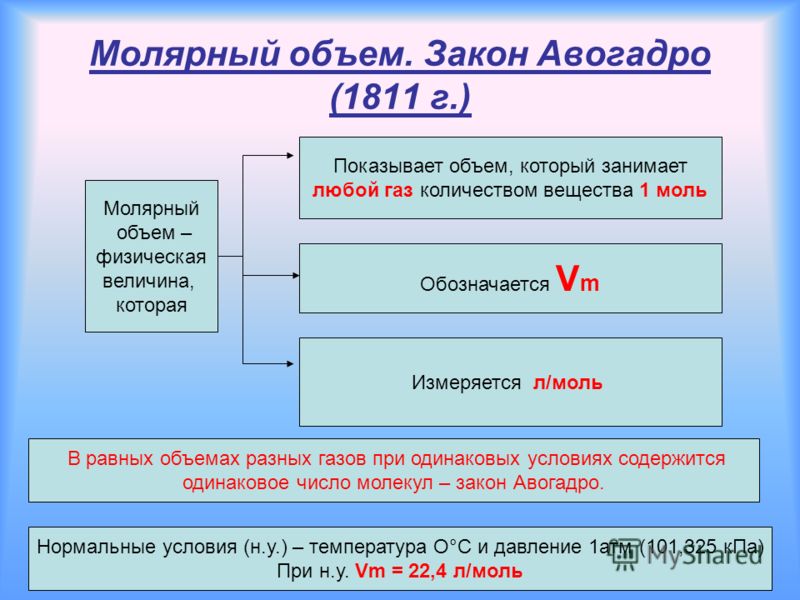 Запишите и запомните формулы для вычисления молярной массы, количества вещества и числа молекул:
Запишите и запомните формулы для вычисления молярной массы, количества вещества и числа молекул:
- Молярная масса формула M=m/n
- Количество вещества формула n=m/M
- Число молекул формула N =NA·n
где m — масса вещества, n — количество вещества (число молей), М — молярная масса, N — число молекул, NA — число Авогадро. Благодаря молярной массе вещества химики могут вести подсчет атомов и молекул в лаборатории просто путем их взвешивания. Этим и удобно использование понятия моль.
На рисунке изображены четыре колбы с различными веществами, но в каждой из них всего 1 моль вещества. Можете перепроверить, используя формулы выше.
Задачи на количество вещества
Пример 1. Сколько граммов Н2, Н2O, СН3ОН, октана (С8Н18) и газа неона (Ne) содержится в 1 моле?
Решение: Молекулярные массы (в атомных единицах массы) перечисленных веществ приведены в таблице Менделеева. 1 моль каждого из названных веществ имеет следующую массу:
1 моль каждого из названных веществ имеет следующую массу:
Поскольку массы, указанные в решении примера 1, дают правильные относительные массы взвешиваемых молекул, указанная масса каждого из перечисленных веществ содержит одинаковое число молекул. Этим и удобно использование понятия моля. Нет даже необходимости знать, чему равно численное значение моля, хотя мы уже знаем, что оно составляет 6,022·1023; эта величина называется числом Авогадро и обозначается символом NA. Переход от индивидуальных молекул к молям означает увеличение шкалы измерения в 6,022·1023 раз. Число Авогадро представляет собой также множитель перевода атомных единиц массы в граммы: 1 г = 6,022·1023 а.е.м. Если мы понимаем под молекулярной массой массу моля вещества, то ее следует измерять в граммах на моль; если же мы действительно имеем в виду массу одной молекулы, то она численно совпадает
с молекулярной массой вещества, но выражается в атомных единицах массы на одну молекулу. Оба способа выражения молекулярной массы правильны.
Оба способа выражения молекулярной массы правильны.
Пример 2. Сколько молей составляют и сколько молекул содержат 8 г газообразного кислорода O2?
Решение: Выписываем из таблицы Менделеева атомную массу атома кислорода (O), которая равна 15,99 а.е.м, округляем до 16. Так как у нас молекула кислорода, состоящая из двух атомов O, то ее атомная масса равна 16×2=32 а.е.м. Хорошо, а теперь переводим ее в молярную массу: 32 а.е.м = 32 г/моль. Это означает, что 1 моль (6,022·1023 молекул) O2 имеет массу 32 грамма. Ну и в заключении по формулам выше находим количество вещества (моль) и число молекул, содержащихся в 8 граммах O2:
- n = m / M = 8г / 32г/моль = 0,25 моль
- N = NA × n = 6,022·1023 × 0,25 = 1,505·1023 молекул
Пример 3. 1 молекула Н2 реагирует с 1 молекулой Сl2, в результате чего образуются 2 молекулы газообразного хлористого водорода НСl. Какую массу газообразного хлора необходимо использовать, чтобы он полностью прореагировал с 1 килограммом (кг) газообразного водорода?
Какую массу газообразного хлора необходимо использовать, чтобы он полностью прореагировал с 1 килограммом (кг) газообразного водорода?
Решение: Молекулярные массы H2 и Cl2 равны 2,0160 и 70,906 г/моль соответственно. Следовательно, в 1000 г H2 содержится
Даже не выясняя, сколько молекул содержится в одном моле вещества, мы можем быть уверены, что 496 моля Cl2 содержат такое же число молекул, как и 496,0 моля, или 1000 г, H2. Сколько же граммов Cl2 содержится в 496 молях этого вещества? Поскольку молекулярная масса Cl2 равна 70,906 г/моль, то
Пример 4. Сколько молекул H2 и Cl2 принимает участие в реакции, описанной в примере 3?
Решение: В 496 молях любого вещества должно содержаться 496 моля × 6,022·1023 молекул/моль, что равно 2,99·1026 молекул.
Чтобы наглядно показать, сколь велико число Авогадро, приведем такой пример: 1 моль кокосовых орехов каждый диаметром 14 сантиметров (см) мог бы заполнить такой объем, какой занимает наша планета Земля. Использование молей в химических расчетах рассматривается в следующей главе, но представление об этом пришлось ввести уже здесь, поскольку нам необходимо знать, как осуществляется переход от молекулярной шкалы измерения масс к лабораторной шкале.
Надеюсь урок 5 «Моль и молярная масса» был познавательным и понятным. Если у вас возникли вопросы, пишите их в комментарии.
Урок 6. Простые ионы →
← Урок 4. Взаимодействие молекул
{23}\) молекулы углекислого газа.Молярную массу любого химического вещества можно рассчитать с помощью периодической таблицы, поэтому всякий раз, когда вам нужно вычислить молярную массу, достаньте периодическую таблицу и калькулятор.
Округление цифр
Прежде чем переходить к примерам, давайте проясним одно заблуждение. Периодические таблицы почти всегда будут содержать молярную массу для каждого элемента, но количество цифр после запятой, которое включено, варьируется от таблицы к таблице. Как правило, всегда используйте значение, округленное до двух знаков после запятой.
Периодические таблицы почти всегда будут содержать молярную массу для каждого элемента, но количество цифр после запятой, которое включено, варьируется от таблицы к таблице. Как правило, всегда используйте значение, округленное до двух знаков после запятой.
Пример 2: В одной периодической таблице молярная масса хлора указана как \(35,453\) граммов на моль. Округлите это число до нужного числа цифр.
Решение: Используйте только две цифры после запятой, чтобы получить значение, которое будет использоваться в вычислениях \(35,45\).
Если вы случайно найдете периодическую таблицу, в которой меньше двух знаков после запятой, значит, у вас либо элемент, точная точность которого неизвестна (включая многие металлы с высокими атомными номерами), либо периодическая таблица, в которой нет точности. В первом случае реальные сценарии, в которых должны использоваться неточные молярные массы, будут редкостью. В последнем случае найдите другую таблицу Менделеева.
Молярные массы элементов
Молярная масса отдельного элемента — это просто число в периодической таблице.
Пример 3: Используйте периодическую таблицу, чтобы найти молярную массу кадмия (Cd).
Решение: С точностью до двух знаков после запятой периодическая таблица покажет вам, что молярная масса кадмия составляет 112,41 грамма на моль.
Для всех расчетов молекулярной массы состояние вещества химического вещества не имеет значения; молярная масса остается неизменной, даже если вещество меняет свое состояние.
Расчет молярной массы молекул
Конечно, большинство веществ состоят из более чем одного типа атомов. В этом случае просто добавьте молярную массу каждого атома (после округления), чтобы получить общую молярную массу.
Пример 4: Какова молярная масса бромида рубидия?
Решение: Сложите молярную массу каждой отдельной молекулы: \(85,47 + 79,90 = 165,37\) граммов на моль.
Если в молекуле имеется более одного атома, то умножьте индивидуальную молярную массу на коэффициент для каждого типа атома, а затем сложите эти значения.
Пример 5: Найдите молярную массу элементарного хлора \(Cl_2\).
Решение: Молярная масса одного атома хлора равна \(35,45\) грамма на моль (округлено). Поскольку атомов два, умножьте это на \(2\), чтобы получить молярную массу \(70,90\) граммов на моль.
Следующий пример немного сложнее, но в нем используется та же концепция.
Пример 6: Найдите молярную массу оксида кобальта \(CoO\).
Решение: Округлите отдельные молярные массы каждого элемента и затем прибавьте их: \(58,93 + 16,00 = 74,93\) граммов на моль.
Следующие два примера также немного усложняются, так что просто держите алгебру под контролем и всегда помните об округлении.
Пример 7: Найдите молярную массу сульфида вольфрама, \(WS_3\).
Решение: Объедините массу каждого атома в правильном соотношении (один вольфрам и три сульфида), чтобы получить \(183,85 + 3(32,07) = 280,06\) граммов на моль.
Пример 8: Найдите молярную массу хлората стронция \(Sr(ClO_3)_2\).
Решение: Как правило, для ионных соединений при расчете молярных масс необходимо отдельно найти молярную массу катиона и аниона, а затем сложить их.
Катион: один атом стронция: \(87,62\) грамм на моль Анион: три атома хлора и шесть атомов кислорода: \(3(35,45) + 6(16,00) = 202,35\)
Сложите их вместе: \(289,97\) граммов на моль
Последний пример в этом разделе включает обратное процесс; вместо того, чтобы использовать химическую формулу для нахождения молярной массы, мы используем молярную массу, чтобы найти химическое вещество.
Пример 9: Двухатомный элемент представляет собой элемент, в стабильной элементарной форме которого два атома элемента связаны вместе. Молекулярная масса какой двухатомной молекулы равна \(32,00 \; г\)?
Молекулярная масса какой двухатомной молекулы равна \(32,00 \; г\)?
Решение: Поскольку два атома этого элемента имеют общую молярную массу \(32,00 \; г\), один атом элемента имеет половину этой молярной массы, \(16,00 \; г\). Мы просматриваем периодическую таблицу, чтобы найти элемент с этой молекулярной массой, и замечаем, что кислород имеет молярную массу \(16,00 \; г\), так что это наш ответ. Химическая формула элементарного кислорода \(O_2\).
Преобразование молярной массы
Итак, теперь, когда вы знаете, как найти молярную массу любого существующего химического вещества, возникает вопрос: для чего используются преобразования молярной массы? Поскольку единицей измерения является грамм на моль, в качестве коэффициента пересчета можно использовать молярную массу.
В задачах преобразования можно использовать два различных преобразования молярной массы.
Если \(M\) является величиной молярной массы, используйте одно из двух преобразований:
A. При преобразовании из граммов в моли используйте преобразование \(\frac{1}{M}\) моль на грамм.
При преобразовании из граммов в моли используйте преобразование \(\frac{1}{M}\) моль на грамм.
B. При преобразовании из молей в граммы используйте преобразование \(\frac{M}{1}\) граммов на моль.
Пример 10: Сколько молей металлического рения содержится в 352 граммах его?
Решение: Согласно периодической таблице молярная масса рения составляет 101,07 грамма на моль. Преобразуйте граммы в моли следующим образом:
$$352 г Rh \times \frac{1 моль Rh}{101,07 г Rh} = 3,48 моль Rh$$
Пример 11: Проба воды имеет массу 34,0 кг. . Сколько родинок имеется?
Решение: В этой задаче есть дополнительный шаг. Поскольку для преобразования молярной массы используются граммы и моли, сначала необходимо преобразовать килограммы в граммы:
$$34,0 кг H_2O \times \frac{1000 г H_2O}{1 кг H_2O} = 34000 г H_2O$$
Теперь найдите молярную массу. масса воды (это то, что вы, возможно, запомнили, так как это обычное вещество в реальных приложениях):
$$2(1,01) + 16,00 = 18,02$$
Это, как обычно, в граммах на крот. Теперь переведем массу воды в моли:
Теперь переведем массу воды в моли:
$$34000 г H_2O \times \frac{1 моль H_2O}{18,02 г H_2O} = 1900 моль H_2O$$
В предыдущем примере также было бы совершенно правильно начать с нахождения молярной массы воды и переведя это в килограммы на моль. Затем вы могли бы использовать это, чтобы преобразовать массу воды в килограммах непосредственно в моли.
Последний пример содержит реальный сценарий, но расчеты по-прежнему выполняются в том же формате.
Пример 12: Геолог извлек большой образец криолита \(Na_3AlF_6\). Он берет его обратно в свою лабораторию и измеряет его массу. Его весы показывают \(12,4\) килограмма. Сколько молей криолита он раскопал?
Решение: Преобразование молярной массы преобразует граммы в моли или моли в граммы, но наша масса выражается в килограммах, поэтому, чтобы использовать преобразование молярной массы, мы должны преобразовать массу в граммы:
$$12,4 \; кг \; Na_3AlF_6 \times \frac{1000\; грамм \; Na_3AlF_6}{1\; кг \; Na_3AlF_6} = 1240 \; грамм \; Na_3AlF_6$$
Теперь мы должны найти молярную массу криолита, чтобы использовать преобразование молярной массы:
$$(22,99(3) + 26,98 + 6(19,00))\;g = 209,95 \; г$$
Мы можем использовать эту молярную массу для преобразования массы криолита в образце в моли:
$$1240 \; грамм \; Na_3AlF_6 \times \frac{1 \; моль \; Na_3AlF_6}{209,95\; грамм \; Na_3AlF_6} = 5,91 \; моль \; Na_3AlF_6$$
Справочник, любезно предоставленный
«Chemical Principles The Quest for Insight», 2-е издание
Аткинс, Питер и Джонс, Лоретта
Моль и молярная масса
ChemTeam: моль и молярная массаКрот и молярная масса
Моль — это стандартный метод в химии для сообщения количества присутствующего вещества.
Вот как Международный союз теоретической и прикладной химии (IUPAC) определяет родинку:
Моль — это количество вещества системы, которая содержит столько элементарных частиц, сколько атомов содержится в 0,012 кг углерода-12. Когда используется моль, должны быть указаны элементарные объекты, которые могут быть атомами, молекулами, ионами, электронами, другими частицами или определенными группами таких частиц.
Это основное определение того, что такое одна родинка. В одном моле содержится столько сущностей, сколько содержится в 12 граммах углерода-12 (или 0,012 кг).
В одном моле содержится 6,022 x 10 23 атомов. Вот еще один способ: в 12 граммах углерода-12 содержится 6,022 x 10 23 атомов углерода.
Я хочу сказать очень ясно: один моль НИЧЕГО содержит 6,022 x 10 23 сущностей.
Слово «сущности» является просто общим словом. Например, если бы мы обсуждали атомы, то мы бы использовали слово «атомы», а если бы предметом обсуждения были молекулы, слово «сущности» в реальном употреблении было бы заменено словом «молекулы».
Например, если бы мы обсуждали атомы, то мы бы использовали слово «атомы», а если бы предметом обсуждения были молекулы, слово «сущности» в реальном употреблении было бы заменено словом «молекулы».
6,022 x 10 23 настолько важен в химии, что у него есть имя. Оно называется числом Авогадро и имеет символ N. Оно названо так в честь Амедео Авогадро, итальянского химика, который в 1811 г. атомные веса. Термин «число Авогадро» впервые был использован примерно в 1906 году, и в последующие десятилетия его очень тщательно измеряли различными способами. На самом деле в нем на несколько цифр больше, чем в части 6.022, но пока достаточно 6.022.
Вот еще раз:
один моль ЛЮБОГО указанного объекта содержит 6,022 x 10 23 этого объекта.
Например:
- Один моль пончиков содержит 6,022 x 10 23 пончиков
- Один моль H 2 O содержит 6,022 x 10 23 молекул
- Одна моль гвоздей содержит 6,022 x 10 23 гвоздей
- Один моль Fe содержит 6,022 x 10 23 атомов
- Один моль кошки содержит 6,022 x 10 23 кошки
- Один моль электронов содержит 6,022 x 10 23 электронов
- Один моль старшеклассников содержит 6,022 x 10 23 бедных, страдающих (имею в виду счастливых, радостных) старшеклассников
Надеюсь, вы уловили идею.
Кстати, моль обозначается как «моль». Почему слово из четырех букв имеет трехбуквенное обозначение? Это действительно неправильный вопрос. Вот почему.
С числом Авогадро связана единица измерения. Это мол¯ 1 , как в 6,022 x 10 23 моль¯ 1 . Минус один в верхнем индексе означает, что единица моль стоит в знаменателе. Есть понятный числитель один, например, 1/моль.
Почему в числителе нет единицы? Может быть, но это будет варьироваться в зависимости от вовлеченной сущности. Если бы мы обсуждали элемент, мы могли бы написать атомы/моль. Если бы мы обсуждали соединение, мы бы сказали «молекулы на моль». Что в числителе, зависит от того, какая «сущность» (атом, молекула, ион, электрон и т. д.) используется в задаче.
Часто бывает так, что имена единиц измерения не используются в числителе, а вместо него используется единица.
Возвращаясь к роли чисел Авогадро в химии; обратите внимание, что подсчет атомов или молекул практически невозможен, поскольку они очень малы. Однако мы можем «сосчитать» атомы или молекулы, взвесив их большое количество на весах.
Однако мы можем «сосчитать» атомы или молекулы, взвесив их большое количество на весах.
Когда мы взвешиваем один моль вещества на весах, это называется «молярной массой» и измеряется в г/моль (грамм на моль). Эта идея очень важна в химии, потому что она используется постоянно.
- Молярная масса – это вес в граммах одного моля.
- Один моль содержит 6,022 x 10 23 объектов.
Следовательно, молярная масса – это масса в граммах 6,022 x 10 23 единиц.
ОК. Как вычислить молярную массу? Приготовьтесь, потому что вы уже должны знать, как рассчитать молярную массу.
Молярная масса вещества – это молекулярная масса, но она выражается в граммах, а не в а.е.м.
Все, что вам нужно сделать, это рассчитать молекулярную массу и вставить единицу «г/моль» (грамм на моль) после числа (вместо а.е.м.), и это будет молярная масса рассматриваемого вещества.
Пример №1: Рассчитайте молярную массу Al(NO 3 ) 3
(1 x 26,98) + (3 x 14,007) + (9 x 16,00) = 213,00 г/моль213,00 грамм – это масса одного моля нитрата алюминия.
213,00 г нитрата алюминия содержит 6,022 x 10 23 единиц Al (NO 3 ) 3
Пример #2: Рассчитайте молярную массу Ba(SCN) 2 .
барий —> 137,33 х 1 = 137,33
сера —> 32,065 х 2 = 64,130
углерода —> 12,011 х 2 = 24,022
азот —> 14,007 х 2 = 28,014Сложите их —> 137,33 + 64,130 + 24,022 + 28,014 = 253,50 г/моль
Пример №3: Рассчитайте молярную массу CO
Это должно быть довольно просто.12,011 + 15,9994 = 28,010 г/моль
Пример #4: Рассчитайте молярную массу N 2 .
14,007 х 2 = 28,014 г/мольОдин моль газообразного азота содержит 6,022 x 10 23 молекул N 2 . В данном случае объект представляет собой молекулу.
Пример #5: Рассчитайте молярную массу Ar.
39,948 х 1 = 39,948 г/мольЕсть Авогадро Число атомов аргона в одном моле аргона.
В данном случае сущность представляет собой атом.
Вычислите некоторые молярные массы
Пример #6: Рассчитайте молярную массу HCl.
Ага! Простой.1,008 + 35,453 = 36,461 г/моль
Имейте в виду, что разные источники дают немного разные ответы. Все зависит от того, насколько округлено было сделано для используемых атомных весов.
Пример №7: Рассчитайте молярную массу CaSO 4 ⋅ 1 ⁄ 2 H 2 O
Точка не означает умножение!Что мы сделаем, так это вычислим CaSO 4 и H 2 O отдельно, а затем разделим значение H 2 O на два. Потом добавим.
CaSO 4 —> 136,139 г/моль (я использовал калькулятор молекулярной массы.
H 2 O —> 18,015 г/моль (Вода — первый пример в видео.)
136,139 + (18,015/2) = 145,146 г/моль
Кстати, оказывается, что этот (с дробным коэффициентом надо делать вручную.
Пример № 8: (Hoocch 2 ) 2 NCH 2 CH 2 N (CH 2 COOH) 2 3 у меня получилось 292,2426 г/моль. Имейте в виду, что ваш учитель может учить простые формулы, а затем задавать вам более сложные на тесте. Пример #9: Ca(C 2 H 3 O 2 ) 2 сум —> 158,166 г/моль Задание для вас: выполните поиск, найдите понравившийся калькулятор молекулярной массы и выполните Ca(C 2 H 3 O 2 ) 2 . Меня это заинтриговало. Его название «Молекулярный вес и молярная масса для задач по химии». Также есть небольшое пояснение относительно молекулярного веса и молярной массы. Пример №10: Рассчитайте молярную массу азота. Посмотрите в правую колонку и найдите «Атомная масса». Рядом с ним будет значение 14,0067 у.е. Будьте осторожны, потому что это вес ОДНОГО атома азота, тогда как азот (как газообразный азот) состоит из ДВУХ атомов азота, связанных вместе. Другими словами, будьте осторожны с двухатомными элементами. Возможно, вам придется использовать контекст, чтобы определить, N или N 2 предназначен. В этом примере контекстом является термин «молярная масса». Более вероятно, что ответ с использованием N 2 является правильным. Возврат к Mole Содержание 6 Диагностические тесты
225 практических тестов
Вопрос дня
Карточки
Learn by Concept ← Предыдущий 1 2 3 Далее → AP Chemistry Help »
Атомная структура и свойства »
Моль и молярная масса Какова масса частиц ? Возможные ответы: Правильный ответ: Пояснение: Сообщить об ошибке Сколько атомов содержится в 1 моле H 2 ? Возможные ответы: Ни один из других ответов 1. 3.626 * 10 47 6.022 * 10 23 6.022 * 10 46 Correct answer: 1.2044 * 10 24 Объяснение: Этот вопрос требует понимания того, что на самом деле представляет собой число авогадро. Число Авогадро, 6,022 * 10 23 — это количество вещей в одном моле. Вопрос указывает на то, что имеется 1 моль H 2 . Таким образом, имеется 6,022 * 10 23 молекул H 2 . Однако вопрос заключается в количестве атомов в 1 моле H 2 . Таким образом, мы должны рассмотреть состав молекулы H 2 , где мы видим, что это двухатомная молекула. Таким образом, мы должны умножить 6,022 * 10 23 на 2, чтобы рассчитать количество отдельных атомов, присутствующих в 1 моле H 2 . Мы находим наш ответ: 1,2044 * 10 24 . Сообщить об ошибке У химика есть . Сколько у нее молекул? Возможные ответы: Правильный ответ: Объяснение: Сообщить об ошибке Сколько атомов водорода содержится в 46,3 г этанола? Возможные ответы: Правильный ответ: Пояснение: Чтобы определить количество атомов водорода, разделите массу этанола на его молярную массу, чтобы получить количество молей этанола. Умножьте это на шесть атомов водорода на молекулу этанола и на число Авогадро, чтобы получить количество атомов водорода. Сообщить об ошибке Сколько атомов водорода содержится в 500 мл воды при комнатной температуре? Возможные ответы: Правильный ответ: Пояснение: Используйте плотность воды, молярную массу воды и число Авогадро, чтобы вычислить количество молекул воды. У нас есть 500 мл воды. Используйте плотность, чтобы преобразовать это в граммы; затем используйте молярную массу воды, чтобы преобразовать ее в моли. На один моль воды приходится два моля атомов водорода. Наконец, умножьте на число Авогадро. Сообщить об ошибке Число Авогадро может преобразовать все следующие единицы в моли и наоборот, кроме __________. Возможные ответы: Атомы Формульные единицы Молекулы Граммы Частицы Правильный ответ: Граммы Пояснение: Число Авогадро может меняться: атомы, молекулы, частицы, формульные единицы и фотоны на моли (и наоборот). Но чтобы перевести граммы в моли или моли в граммы, нужна молярная масса. Сообщить об ошибке Кольцо из бижутерии покрыто серебром, эквивалентным: Возможные ответы: Атомы атомов или атомов Правильный ответ: OR Пояснение: Для решения этой задачи воспользуемся понятием атомной массы и числом Авогадро: И число атомов Ag будет: Сообщить об ошибке 3 для получения большого количества энергии из относительно небольшого количества исходного материала (по сравнению со сжиганием ископаемого топлива). 1 киловатт-час = Потребление энергии в США на душу населения в год = 13246,00 кВтч Энергия, выделяемая при ядерном делении одного атома урана-235, составляет 211,30 МэВ. Естественное содержание урана-235 составляет 0,72% Энергия, выделяемая при делении одного атома тория-232, составляет 191,00 МэВ (включает несколько стадий, известных как ториевый топливный цикл). Торий-232 является наиболее распространенным изотопом тория и для этой проблемы можно считать 100% Предположим, что 100% U-235 и Th-232 могут быть преобразованы в энергию. Сколько граммов тория или урана (из всех изотопов, добываемых из природных источников) необходимо добыть, чтобы обеспечить потребность в энергии одного среднего американца в год (с учетом приведенных выше предположений)? Примечание: решите эту задачу дважды; предполагая, что 100% потребляемой энергии производится из тория в первом случае и урана во втором. Возможные ответы: Thorium = Uranium = Thorium = Uranium = Thorium = Uranium = Thorium = Uranium = Thorium = Uranium = Correct answer: Thorium = Уран = Объяснение: Чтобы решить эту проблему, нам нужно провести стехиометрию. После того, как мы собрали всю необходимую информацию о преобразовании, нужно связать уравнение вместе и убедиться, что наши единицы уравновешиваются, чтобы получить желаемые единицы. Попытка решить эту проблему поэтапно может вскоре привести к путанице, поскольку требуется несколько шагов. Стоит отметить, что это масса урана и не учитывает тот факт, что добытый уран не присутствует в виде чистого элемента, и поэтому в действительности общая масса материала, добытого для получения 75,71 г, намного больше. Масса добытого тория намного меньше, чем масса добытого урана, в основном из-за концепции содержания изотопов. Изотоп тория, используемый в качестве ядерного топлива, составляет практически 100% встречающегося в природе тория, тогда как полезный изотоп урана составляет лишь 0,72% встречающегося в природе урана. Также стоит отметить, что, как и уран, природный торий не присутствует в виде чистого соединения, поэтому в действительности масса материала, добытого для получения этого 0,59g также намного больше. Однако также стоит отметить, что тория гораздо больше, чем урана. Сообщить об ошибке Сколько молекул содержится в ? Возможные ответы: Правильный ответ: Пояснение: Используйте размерный анализ для преобразования молей в молекулы.. калькулятор. Перейдите к нему и рассчитайте молярную массу данного соединения.
кальций —> 40,078 x 1 = 40,078
углерода —> 12,011 х 4 = 48,044
водорода —> 1,008 х 6 = 6,048
кислорода —> 15,999 х 4 = 63,996
Я собираюсь сделать это, введя слово азот в Google.
Моль и молярная масса — AP Chemistry
Все ресурсы AP Chemistry
 2044 * 10 24
2044 * 10 24 

 Ядерное топливо имеет разный выход энергии на единицу массы (как и радиоактивные отходы). Для следующей задачи предположим следующее:
Ядерное топливо имеет разный выход энергии на единицу массы (как и радиоактивные отходы). Для следующей задачи предположим следующее: 
Расчет массы урана, добытого для обеспечения энергетических потребностей 1 американца в год:

Расчет массы тория, добытого для обеспечения энергетических потребностей 1 американца в год:


 для 9 кл. / Г. Е. Рудзитис, Ф. Г. Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2009. (§17)
для 9 кл. / Г. Е. Рудзитис, Ф. Г. Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2009. (§17) у.) хлора Cl2?
у.) хлора Cl2?