Урок 9. Молярная масса и молярный объем – HIMI4KA
Архив уроков › Химия 8 класс
В уроке 9 «Молярная масса и молярный объем» из курса «Химия для чайников» выясним, что подразумевается под молярной массой и молярным объемом; приведем формулы для их вычисления. Напоминаю, что в прошлом уроке «Химическое количество вещества и моль» мы выяснили, что такое химическое количество вещества; рассмотрели моль в качестве единицы количества вещества, а также познакомились с постоянной Авогадро.
Молярная масса
Вы знаете, что одинаковое химическое количество любых веществ содержит одно и то же число структурных единиц. Но у каждого вещества его структурная единица имеет собственную массу. Поэтому и массы одинаковых химических количеств различных веществ тоже будут различны.
Молярная масса — это масса порции вещества химическим количеством 1 моль.
Молярная масса вещества Х обозначается символом M(Х). Она равна отношению массы данной порции вещества m(Х) (в г или кг) к его химическому количеству n(Х) (в моль):
Она равна отношению массы данной порции вещества m(Х) (в г или кг) к его химическому количеству n(Х) (в моль):
В Международной системе единиц молярная масса выражается в кг/моль. В химии чаще используется дольная единица — г/моль.
Определим молярную массу углерода. Масса углерода химическим количеством 1 моль равна 0,012 кг, или 12 г. Отсюда:
Молярная масса любого вещества, если она выражена в г/моль, численно равна его относительной молекулярной (формульной) массе.
Например:
На рисунке 47 показаны образцы веществ (H2O, CaCO3, Zn), химическое количество которых одно и то же — 1 моль. Как видите, массы разных веществ химическим количеством 1 моль различны.
Молярная масса является важной характеристикой каждого отдельного вещества. Она отражает зависимость между массой и химическим количеством вещества. Зная одну из этих величин, можно определить вторую — массу по химическому количеству:
и, наоборот, химическое количество по массе:
а также число структурных единиц:
Взаимосвязь между этими тремя характеристиками вещества в любом его агрегатном состоянии можно выразить простой схемой:
Молярный объем
В отличие от твердых и жидких веществ все газообразные вещества химическим количеством 1 моль занимают одинаковый объем (при одинаковых условиях). Эта величина называется молярным объемом и обозначается Vm.
Эта величина называется молярным объемом и обозначается Vm.
Подобно молярной массе, молярный объем газа равен отношению объема данного газообразного вещества V(Х) к его химическому количеству n(Х):
Так как объем газа зависит от температуры и давления, то при проведении различных расчетов берутся обычно объемы газов при нормальных условиях (сокращенно — н. у.). За нормальные условия принимаются температура 0 °С и давление 101,325 кПа.
Установлено, что при нормальных условиях отношение объема любой порции газа к химическому количеству газа есть величина постоянная и равная 22,4 дм3/моль. Другими словами, молярный объем любого газа при нормальных условиях:
Молярный объем — это объем, равный 22,4 дм3, который занимает 1 моль любого газа при нормальных условиях.
Пример 1. Вычислите химическое количество SiO2, масса которого равна 240 г.
Спойлер
[свернуть]
Пример 2. Определите массу серной кислоты H2SO4, химическое количество которой 2,5 моль.
Спойлер
[свернуть]
Пример 3. Сколько молекул CO2 и сколько атомов кислорода содержится в углекислом газе массой 110 г?
Спойлер
[свернуть]
Пример 4. Какой объем занимает кислород химическим количеством 5 моль при нормальных условиях?
Спойлер
[свернуть]
Краткие выводы урока:
- Масса вещества химическим количеством 1 моль называется его молярной массой. Она равна отношению массы данной порции вещества к его химическому количеству.
- Объем газообразных веществ химическим количеством 1 моль при нормальных условиях одинаков и равен 22,4 дм3.
- Величина, равная 22,4 дм3/моль, называется молярным объемом газов.

Надеюсь урок 9 «Молярная масса и молярный объем» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Данный урок был заключительным в главе «Основные химические понятия».
Урок 10. Признаки химических реакций →
← Урок 8. Химическое количество вещества и моль
что это такое в химии, как найти объемные отношения газов, единица измерения
Молярный объем — что это такое в химии
ОпределениеМолярный объем — является отношением объема вещества к его количеству, численно равен объему одного моля вещества.
Термин «молярный объем» применим по отношению к простым веществам, химическим соединениям и смесям. Величина зависит от следующих факторов:
- температура;
- давление;
- агрегатное состояние вещества.
Молярный объем можно находить путем деления молярной массы M вещества на его плотность p.
ФормулаМолярный объем вычисляют по формуле:
Молярный объем является характеристикой плотности упаковки молекул в рассматриваемом веществе. В случае простых веществ в некоторых ситуациях допустимо использовать понятие атомного объема.
В случае простых веществ в некоторых ситуациях допустимо использовать понятие атомного объема.
Исходя из того, что объем газа определяется температурой и давлением, в процессе расчетов принято использовать объемы газов при нормальных условиях (сокращенно — н. у.). За нормальные условия принимают:
- температура 0 °С;
- давление 101,325 кПа (1 атм.).
Известно, что при нормальных условиях отношение объема любой порции газа к химическому количеству газа есть величина постоянная и равная .
Молярный объем какого-либо газа при нормальных условиях:
Источник: himi4ka.ru
Таким образом, молярный объем при н. у. равен и представляет собой объем, который занимает 1 моль какого-либо газа при нормальных условиях.
Молярный объем смеси
В том случае, когда рассматривается смесь веществ, в процессе вычисления молярного объема за количество вещества принимают сумму количеств всех веществ, входящих в состав смеси. Когда величина плотности смеси , мольные доли компонентов xi и их молярные массы Mi известны, молярный объем смеси допустимо рассчитывать в виде отношения средней молярной массы смеси (суммы молярных масс ее компонентов, умноженных на их мольные доли) к плотности смеси.
Молярный объем смеси:
Молярный объем газов
ОпределениеЗакон Авогадро: одинаковые количества газов при одинаковых условиях занимают одинаковый объем.
Молярный объем идеального газа вычисляют с помощью формулы, которая является выводом из уравнения состояния идеального газа.
ФормулаМолярный объем идеального газа:
При нормальных условиях молярный объем газов . Молярные объемы в случае реальных газов, так или иначе, не совпадают с молярным объемом идеального газа. С другой стороны, нередко в процессе решения практических задач по химии отклонениями от идеальности допустимо пренебрегать.
Молярный объем кристаллов
Объем элементарной ячейки кристалла вычисляют с помощью характеристик кристаллической структуры, которые определяют на основании результатов рентгеноструктурного анализа.
ФормулаЗависимость между объемом ячейки и молярным объемом:
где Z — определяет, сколько формульных единиц в элементарной ячейке.
Значения молярного объема химических элементов
Уточнить величину молярного (атомного) объема, характерного для простых веществ, в , при нормальных условиях (для газообразных простых веществ), либо при температуре конденсации и нормальном давлении, можно в таблице:
Источник: ru.wikipedia.org
Вычисление химического количества газа по его объему
Объем газа можно рассчитать по его химическому количеству. В этом случае необходимо преобразовать формулу молярного объема путем выражения из нее V:
Источник: www.yaklass.ru
Таким образом, объем газа равен произведению его химического количества на молярный объем. Продемонстрировать данное утверждение можно на примере. Допустим, что необходимо определить объем (н. у.) метана с химическим количеством 1,5 моль. Используя уравнение, записанное ранее, проведем вычисления:
Источник: www.yaklass.ru
При известном объеме газообразного вещества можно определить химическое количество рассматриваемого газа. В этом случае следует выразить из уравнения молярного объема n:
В этом случае следует выразить из уравнения молярного объема n:
Источник: www.yaklass.ru
Таким образом, химическое количество газообразного вещества допустимо рассчитывать, как отношение его объема к молярному объему. Данное утверждение можно применить на практическом примере. Предположим, что необходимо вычислить химическое количество водорода, соответствующее при н. у. его объему 11,2 . Выполним расчеты:
Источник: www.yaklass.ru
Определение объема веществ при химических реакциях
Перед тем, как приступить к расчетам объема веществ, следует ввести понятие плотности. Данный показатель определяется отношением массы вещества к его объему. Плотность измеряют в (или г/л, г/мл). В случае газообразных веществ плотность принимает очень маленькие значения. Упростить расчеты химических реакций можно, если рассматривать отношение плотностей газов.
ОпределениеОтносительной плотностью газа В по газу А называют величину, равную отношению плотностей рассматриваемых веществ или отношению молярных масс этих газов.
Данный параметр обозначают и определяют по формуле:
Источник: uahistory.co
В связи с тем, что в расчете относительной плотности используют величины одинаковой размерности, данный параметр является безразмерной величиной. Определить относительную плотность газообразных веществ по некому газу можно с помощью отношения молярных масс этих газов. Например, относительная плотность кислорода по водороду составляет:
Источник: uahistory.co
Согласно закону Авогадро, в равных объемах различных газов, которые существуют при одинаковых температурах и давлениях, содержится одно и то же количество молекул. Данная гипотеза была представлена в 1811 году в Турине профессором физики Амедео Авогадро.
Подтверждение теория нашла во множестве экспериментальных опытах. Закон получил название закона Авогадро и стал в дальнейшем количественной основой современной химии. Закон Авогадро в точности реализуем в случае идеального газа. С увеличением разреженности газообразного вещества повышается точность расчетов по этому закону применительно к данному реальному газу.
Первое следствие из закона Авогадро: один моль (одинаковое количество молей) любого газа при одинаковых условиях занимает одинаковый объем.
Исходя из закона Авогадро, одинаковое число молекул какого-либо газа занимает при одинаковых условиях один и тот же объем. Наряду с тем, 1 моль какого-то вещества включает в себя (согласно определению) одинаковое количество частиц (к примеру, молекул). Таким образом, при определенных температуре и давлении 1 моль любого вещества в газообразном состоянии занимает один и тот же объем.
Если условия соответствуют нормальным, то есть температура равна 0 °C (273,15 К), и давление составляет 101,325 кПа, объем 1 моль газа соответствует 22,413 962(13) л. Данная физическая константа является молярным объемом идеального газа и обозначается Vm.
ФормулаВычислить молярный объем при температуре и давлении, отличных от нормальных условий, можно с помощью уравнения Клапейрона:
где — является универсальной газовой постоянной.
Второе следствие из закона Авогадро: молярная масса первого газа равна произведению молярной массы второго газа на относительную плотность первого газа ко второму.
Благодаря данному положению, наука химия получила активное развитие. Причиной этому является открытие возможности для расчета молекулярной массы веществ, которые обладают способностью к переходу в газообразное или парообразное состояние. В том случае, когда молекулярная масса вещества равна является его относительной плотностью в газообразном состоянии по другому газу, отношение должно быть постоянным для всех веществ, его значение зависит только от вида газа, по которому определяют относительную плотность данного вещества. Из результатов практического опыта можно сделать вывод о том, что для любых известных веществ, которые способны переходить в газообразное состояние без разложения, рассматриваемая постоянная составляет 28,9 а.е.м. (атомных единицы массы), если при определять относительную плотность по воздуху. С другой стороны, данная постоянная будет равна 2 а.е.м. в том случае, когда относительную плотность определяют по водороду.
С другой стороны, данная постоянная будет равна 2 а.е.м. в том случае, когда относительную плотность определяют по водороду.
Как найти объемные отношения газов в смеси
В процессе вычисления объемных отношений газов, участвующих в химических реакциях, используют закон Гей-Люссака (химический закон объемных отношений). В англоязычной литературе данный закон можно встретить под названием закона Шарля.
ОпределениеЗакон Гей-Люссака — закон, демонстрирующий пропорциональную зависимость между объемом газообразного вещества и абсолютной температурой при постоянном давлении (то есть в изобарном процессе).
Закон получил название в честь французского физика и химика Жозефа Луи Гей-Люссака.
ФормулаМатематическое выражение закона Гей-Люссака:
По итогам химических реакций атомы не исчезают и не возникают. В результате таких процессов происходит их перегруппировка. Количество атомов до реакции и после ее протекания не меняется, что отличает их от молекул. Данное условие учитывают, расставляя стехиометрические коэффициенты в уравнениях химических реакций.
Данное условие учитывают, расставляя стехиометрические коэффициенты в уравнениях химических реакций.
Коэффициенты в уравнениях реакций демонстрируют числа объемов газов, которые реагируют и образовываются. К примеру, 2 объема водорода и 1 объем кислорода дают 2 объема пара воды:
В процессе, записанном в виде уравнения , объемы азота и водорода, между которыми протекает реакция, и объем образовавшегося аммиака связаны между собой, что можно выразить с помощью следующего соотношения:
С другой стороны, данные соотношения справедливы лишь в случае веществ, которые участвуют в одной и той же химической реакции. Когда реагент принимает участие в двух параллельных реакциях, его химические количества в данных процессах не связаны и могут принимать любые значения.
Согласно первому следствию из закона Авогадро, при одинаковых условиях 1 моль любого газа занимает одинаковый объем. Объем газа количеством 1 моль в нормальных условиях носит название молярного объема и обозначается . Таким образом:
Таким образом:
Источник: uchitel.pro
В данной таблице использованы следующие обозначения:
.
Объяснение урока: Молярный объем газа
В этом объяснении мы узнаем, как использовать молярный объем газа при стандартных условиях для расчета объема и количества молей газа.
В 1811 году Амедео Авогадро выдвинул гипотезу о том, что газы одинакового объема при одинаковых температурах и давлениях содержат такое же количество частиц газа. Эта гипотеза породила то, что мы теперь называем законом Авогадро. Закон Авогадро гласит, что объем образца газа прямо пропорциональна количеству молей газа при постоянном температура и давление.
Закон: Закон Авогадро
Закон Авогадро гласит, что при постоянной температуре и давлении объем и количество молей газа прямо пропорциональны.
Мы можем представить закон Авогадро с заявлением о пропорциональности
𝑉∝𝑛,
где 𝑉 — объем газа, а 𝑛 — количество
родинки.
Мы всегда должны понимать, что эта пропорция верна только до тех пор, пока температура и давление остаются постоянными. Заявление о пропорциональности показывает, что с увеличением количества молей газа увеличивается и объем, занимаемый газа, и наоборот.
Пример 1. Использование закона Авогадро для определения зависимости между объемом и количеством молей газа
Согласно закону Авогадро, что происходит с объемом, который занимает газ, если количество родинки увеличиваются?
- Остается прежним.
- Увеличивается.
- Уменьшается.
Ответ
Закон Авогадро гласит, что объем и количество молей газа прямо пропорциональны при постоянной температуре и давлении. Мы можем выразить это как 𝑉∝𝑛.
Когда переменные прямо пропорциональны, увеличение количества одной переменной приведет к увеличению количества другой переменной на
постоянная ставка. Следовательно, если количество молей газа увеличивается,
объем газа также увеличится.
Рассмотрим следствие закона Авогадро для следующей реакции при постоянных температуре и давлении: 2H()+O()2HO()222ggg
Согласно уравнению, два моля газообразного водорода и один моль газообразного кислорода соединяется с образованием два моля водяного пара. По количеству молей газа пропорциональна объему газа, уравнение также показывает два объема газообразного водорода (в литрах или миллилитров, например) смешиваются с одним объемом газообразного кислорода для получения двух объемы водяного пара.
Отношение h3 к O2 к HO2 будет 2∶1∶2 независимо от того, выражено ли оно в молях или единицах объема.
В дополнение к заявлению о пропорциональности
𝑉∝𝑛,
Закон Авогадро можно представить в виде пропорционального уравнения
𝑉=𝑛𝑉,
где 𝑉 — молярный объем, константа пропорциональности. Молярный объем обычно выражается в единицах
л/моль и указывает объем, занимаемый
один моль газа при удельном
температура и давление.
Определение: Молярный объем (𝑉
𝑚 )Молярный объем — это объем, занимаемый одним молем газа при определенной температуре и давлении.
Пример 2. Расчет количества молей газа в заданном объеме путем определения молярного объема газа
Баллон объемом 12 л содержит 0,52 моля газообразного гелия. Второй баллон той же температуры и давление имеет объем 18 л.
Сколько молей газообразного гелия содержит второй баллон? Давать ваш ответ с точностью до двух знаков после запятой.
Ответ
Объем и количество молей газа связаны уравнением
𝑉=𝑛𝑉,
где 𝑉 — объем, 𝑛 — количество молей,
𝑉 – молярный объем.
молярный объем — это константа пропорциональности, которая указывает объем одного моля
любого газа при определенной температуре и давлении.
Мы можем заменить объем и количество молей газообразного гелия в первом шар в уравнение, чтобы дать нам 12=0,52⋅𝑉.Lмоль
Тогда мы можем определить молярный объем следующим образом: 120,52=0,52⋅𝑉0,5223,0769…=𝑉.LmolmolmolLmol
Молярный объем газа равен 23,077 л/моль. Поскольку второй воздушный шар находится в том же температура и давление, как в первом баллоне, газ в двух баллонах будет иметь одинаковый молярный объем. Это означает, что мы можем заменить объем второго баллона и молярный объем в уравнение 𝑉=𝑛𝑉 дать нам 18=𝑛⋅23.077.LLмоль
Тогда мы можем определить количество молей гелия во втором баллоне следующим образом: 1823,077=𝑛⋅23,07723,0770,7799…=𝑛.LmolLmolLmolLmol
Число молей газообразного гелия во втором баллоне, округленное до двух знаков после запятой, равно 0,78 моль.
Поскольку объем и, следовательно, плотность газа зависят от температуры и давления, полезно определить стандартную температуру
и давление, которое можно использовать в качестве эталонных условий при сравнении различных газов. Стандартная температура определяется как
0∘C, а стандартное давление определяется как
1 атм. В совокупности стандартная температура и давление обозначаются аббревиатурой STP.
Стандартная температура определяется как
0∘C, а стандартное давление определяется как
1 атм. В совокупности стандартная температура и давление обозначаются аббревиатурой STP.
Определение: Стандартная температура и давление (STP)
Стандартная температура равна 0∘C, стандартное давление равно 1 атмосфера (атм).
Как оказалось, один моль любого газа на СТП будет иметь объем 22,4 литра.
| Газ | O()2g | Ar()g | CH()4g |
|---|---|---|---|
| Температура | 0∘C | 0°C | 0°C |
| Давление | 1 атм | 1 атм | 1 атм |
| Количество | 1 моль | 1 моль | 1 моль |
| 32 г | 40 г | 16 г | |
| Количество частиц | 6.022×10 молекул | 6.022×10 атомов | 6.022×10 молекул |
| Объем | 22,4 л | 22,4 л | 22,4 л |
Пример 3.
 Определение Количество газа займет наибольший объем на ПГУ
Определение Количество газа займет наибольший объем на ПГУКакое из следующих количеств газа займет наибольший объем при стандартной температуре и давлении (STP)? Ответ
При стандартной температуре и давлении (0°C и 1 атм), один моль газа займет 22,4 литра. Это верно независимо от используемого газа. Поскольку объем и количество молей газа напрямую пропорционально, два моля любого газа при нормальных условиях должны иметь удвоить объем как один моль: 22,41×2=44,8,лмольмольл
При STP следующий график объема и количества молей можно построить.
Используя график, мы можем определить объем, занимаемый каждым из вариантов, следующим образом:
- 1 моль Ch34 имеет объем 22,4 л.
- 5 молей h3 имеют объем 112 л.
- 0,5 моля N2 имеют объем 11,2 л.
- 2 моля Cl2 имеют объем 44,8 л.
- 3 моля O2 имеют объем
67,2 л.

Количество газа, которое будет занимать наибольший объем при STP, равно 5 молям h3, что является выбором B.
Для любого газа при стандартной температуре и давлении мы можем заменить объем 22,4 литра и один моль в пропорциональном уравнении 22,4=1⋅𝑉лмоль и определить молярный объем любого газа при нормальных условиях следующим образом: 22,41=1⋅𝑉122,4=𝑉.LmolmolmolLmol
Молярный объем любого газа при нормальных условиях составляет 22,4 л/моль. Это стандартный моляр объем газа. Так, на СТП 𝑉=𝑛⋅22,4.Lмоль
Это уравнение можно использовать для определения объема или количества молей газа при стандартных температуре и давлении. Это важно признать, что стандартный молярный объем может быть использован только тогда, когда газ поддерживается при постоянной температуре 0∘C и постоянное давление 1 атм.
Пример 4: Расчет количества молей молекул газа при STP при заданном объеме
При стандартной температуре и давлении (STP) газ занимает объем 2 л. Сколько имеется молей молекул газа? Дайте ответ с точностью до 2 знаков после запятой.
Сколько имеется молей молекул газа? Дайте ответ с точностью до 2 знаков после запятой.
Ответ
Объем и количество молей газа связаны уравнением 𝑉=𝑛𝑉, где 𝑉 — объем, 𝑛 — количество молей, 𝑉 – молярный объем. Молярный объем – это константа пропорциональности, которая указывает объем один моль любого газа при определенной температуре и давлении.
В этой задаче газ находится при стандартной температуре и давлении (STP). Стандартная температура и давление 0∘С и 1 атм соответственно. Любой газ на СТП будет иметь стандартный молярный объем 22,4 л/моль.
Мы можем подставить объем газа, указанный в вопросе, и стандартный молярный объем в уравнение, чтобы получить 2=𝑛⋅22,4.LLmol
Тогда мы можем найти количество в молях следующим образом: 222,4=𝑛⋅22,422,40,08928…=𝑛.LmolLmolLmolLmol
Два литра газа при СТП будут содержать 0,08928 моль молекул газа. Округляя до двух знаков после запятой, получаем, что наш окончательный ответ равен 0,09 моль.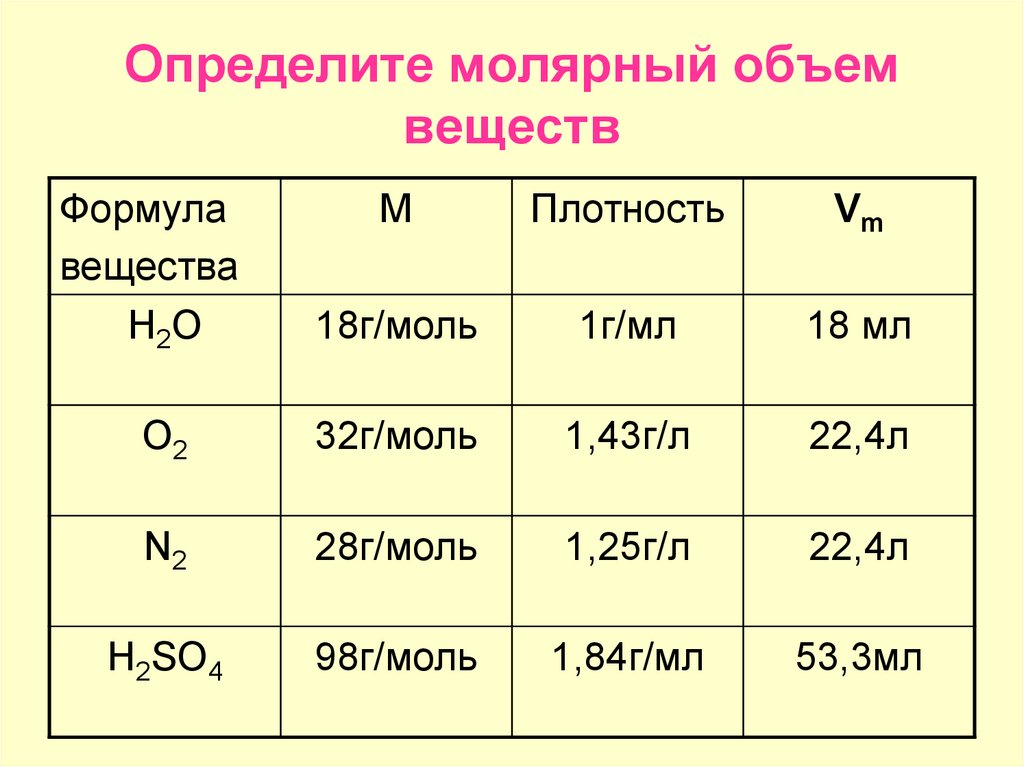 молекул газа.
молекул газа.
Пример 5: Расчет объема газообразного аммиака при нормальных условиях с учетом массы
Какой объем заняли бы 8,5 г газа Nh4 при стандартная температура и давление (СТД), принимая молярный объем газа равным 22,4 л/моль? Дайте ответ в литрах. [N = 14 г/моль, H = 1 г/моль]
Ответ
Объем и число молей газа связаны уравнением 𝑉=𝑛𝑉, где 𝑉 — объем, 𝑛 — количество моли, а 𝑉 – молярный объем. Нам нужно решить за объем аммиака (Nh4). Нам дан молярный объем газа при нормальных условиях, но мы не знаем количество молей аммиака. Однако мы можем преобразовать массу аммиака в моли аммиака по уравнению 𝑛=𝑚𝑀, где 𝑛 представляет количество молей, 𝑚 — масса в граммах, а 𝑀 — молярная масса в г/моль.
Чтобы найти количество молей аммиака, нам нужно определить его
молярная масса. Молярную массу Nh4 можно рассчитать, просуммировав средние молярные массы
составляющие атомы:
𝑀=𝑀+3×𝑀𝑀=14+3×1𝑀=17.()()()()()NHNHNHNh433gmolgmolgmol
Молярную массу Nh4 можно рассчитать, просуммировав средние молярные массы
составляющие атомы:
𝑀=𝑀+3×𝑀𝑀=14+3×1𝑀=17.()()()()()NHNHNHNh433gmolgmolgmol
Массу, указанную в вопросе, и молярную массу можно подставить в уравнение 𝑛=𝑚𝑀 получить 𝑛=8,517,гмоль что дает нам, что количество Nh4 в молях равно 𝑛=0,5.моль
Теперь мы можем подставить число молей и молярный объем в уравнение 𝑉=𝑛𝑉 получить 𝑉=0,5×22,4,моль/моль что дает нам, что объем 𝑉=11.2.L
Объем, занимаемый 8,5 г Nh4 при стандартной температуре и давление 11,2 л.
Ключевые моменты
- Закон Авогадро гласит, что количество молей газа и объем газа прямо пропорциональны.
- Закон Авогадро может быть представлен уравнением
𝑉=𝑛𝑉,
где 𝑉 — объем газа, 𝑛 — количество
моли, а 𝑉 – молярный объем.

- Стандартная температура и давление (STP) равны 0∘C и 1 атм соответственно.
- В STP все газы имеют молярный объем 22,4 л/моль.
Расчет молярного объема газа Учебное пособие по химии
Расчет молярного объема газа Учебное пособие по химииКлючевые понятия
- 1 моль идеального газа (1) занимает определенный объем при определенной температуре и давлении.
- Это называется молярным объемом газа и обозначается символом V м
- Наиболее часто используемые единицы измерения молярного объема газа, V m , это литры на моль, л моль -1
- Примеры молярного объема для идеальных газов (V м ) приведены в таблице ниже:
Температура Давление Молярный объем газа °С (К) кПа (атм) (В м )/л моль -1 0°C (273,15K) 100 кПа (0,987 атм) 22,71 25°C (298,15 К) 100 кПа (0,987 атм) 24,79 0 °C (273,15 K) и 100 кПа (0,987 атм) известны как стандартные температура и давление и часто обозначаются аббревиатурой STP (2)
.
25°C (298,15 K) и 100 кПа (0,987 атм) иногда называют стандартной температурой и давлением окружающей среды, SATP, или даже стандартными лабораторными условиями, SLC. (3)
- Расчеты с использованием молярных объемов газа:
n(газ) = моли идеального газа
V(gas) = объем идеального газа (при определенной температуре и давлении)
В м = молярный объем идеального газа (при определенных температуре и давлении)
Для расчета молей газа: н(газ) = В (газ)
В мДля расчета объема газа: В(газ) = н(газ) × V м
Пожалуйста, не блокируйте рекламу на этом сайте.
Нет рекламы = нет денег для нас = нет бесплатных вещей для вас!
Молярный объем газа (V
м ) Концепция Молярный объем идеального газа, V м , равен , определяемому как объем 1 моля идеального газа при заданных температуре и давлении.
Молярный объем газа, V м , следовательно, представляет собой объем газа на моль газа, поэтому единицы молярного объема газа:
единица объема/моль
или
единица объема ÷ моль
Метрическая единица (4) для объема — литр, л, поэтому молярный объем газа — это объем в л ÷ моль
| В м дюйм л моль -1 | = | объем газа в литрах 1 моль газа | (при указанной температуре и давлении) |
Мы можем использовать это соотношение для молярного объема идеального газа (V м ) написать уравнение для объема (V в литрах) любого количества газа (n в молях)
| В м дюйм л моль -1 | = | объем газа в литрах объем газа в молях | (при указанной температуре и давлении) |
| В м дюйм л моль -1 | = | V (л) n (моль) | (при указанной температуре и давлении) |
Чтобы использовать эту связь, нам нужно знать V m .
Ниже приведен список некоторых способов описания условий, при которых V м составляет 22,71 л.
В м = 22,71 л моль -1 при 0°C и 100 кПа
В м = 22,71 л моль -1 при 273,15 К и 100 кПа
В м = 22,71 л моль -1 при стандартной температуре и давлении
В м = 22,71 л моль -1 при нормальных условиях
Когда V м = 22,71 л моль -1 , соотношение между объемом газа V (л) и количеством газа n (моль) становится следующим:
| В м дюйм л моль -1 | = | V (л) n (моль) | (на СТП) | |
| 22,71 л моль -1 | = | V (л) n (моль) | (на СТП) |
Это математическое уравнение можно преобразовать, чтобы найти объем известного количества газа, умножив обе части уравнения на количество газа в молях, n (моль),
| n ( | = | В (л) × | (на СТП) | |
| n × 22,71 | = | В (Д) | (на СТП) |
Это соотношение показывает нам, что если мы увеличим количество молей газа n, добавив больше газа при сохранении той же температуры и давления, объем газа V также увеличится.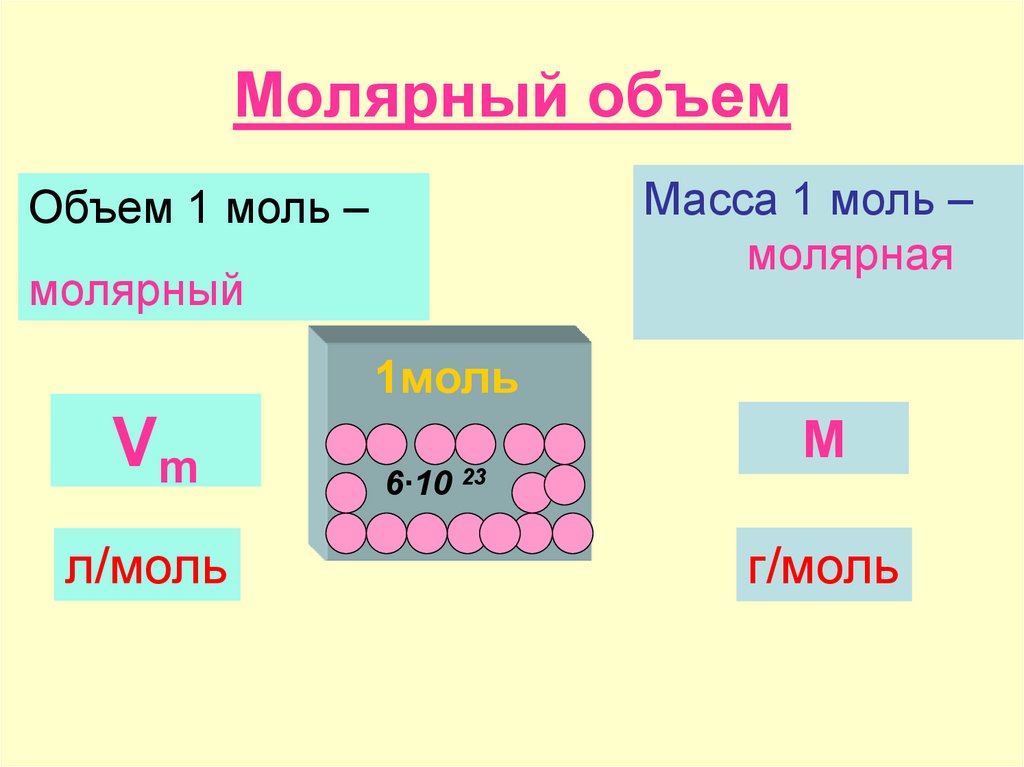
Аналогичным образом, если мы уменьшим количество молей газа n, удалив часть газа при сохранении той же температуры и давления, объем газа V также уменьшится.
Приведенное выше математическое уравнение можно преобразовать, чтобы найти количество газа в молях, учитывая его объем в литрах, путем деления обеих частей уравнения на молярный объем газа (22,71 л моль -1 на СТП),
| n (моль) × | = | В ( 22,71 ( | (на СТП) | ||
| н (моль) | = | В 22,71 | (на СТП) | ||
Это соотношение показывает нам, что единственный способ увеличить объем газа V при сохранении той же температуры и давления — это увеличить количество молей газа n, которые присутствуют, то есть добавить больше газа.
Точно так же единственный способ уменьшить объем газа V при сохранении той же температуры и давления — это уменьшить количество молей газа n, которые присутствуют, то есть удалить часть газа.
Рабочие примеры расчета молей газа с использованием молярного объема газа
Рабочий пример 1. Образец чистого газообразного гелия занимает объем 6,8 л при 0°C и 100 кПа.
Сколько молей газообразного гелия содержится в образце?
- Какой вопрос просит вас сделать?
Рассчитайте количество молей газообразного гелия.
n(He (g) ) = моли газообразного гелия = ? моль
- Какая информация (данные) была дана в вопросе?
V (He (g) ) = объем газообразного гелия = 6,8 л.
Условия: STP (стандартная температура и давление, 0°C и 100 кПа)
So V м = молярный объем газа = 22,71 л моль -1 (имеется в паспорте)
- Проверить согласованность в единицах измерения, все тома в одних и тех же единицах измерения?
V(He (g) ) дается в л
В м дается в л (моль -1 )
Оба объема выражены в одних и тех же единицах измерения, л, поэтому преобразование не требуется.

- Какая связь между молями газообразного гелия и объемом газообразного гелия при заданных температуре и давлении?
н(Не (г) ) (моль) = В(Не (г) )
В м - Подставьте значения в уравнение и решите моли газообразного гелия:
n(He (г) ) (моль) = 6,8
22,71(на СТП) = 0,30 моль (на СТП)
Рабочий пример 2: Образец газообразного азота N 2(g) имеет объем 956 мл при 273,15 К и 100 кПа.
Сколько молей газообразного азота содержится в образце?
- Какой вопрос просит вас сделать?
Рассчитайте количество молей газообразного азота.
n(N 2(g) ) = моли газообразного азота = ? моль
- Какая информация была дана в вопросе?
V(N 2(g) ) = объем газообразного азота = 956 мл
Условия: 273,15 К и 100 кПа (стандартная температура и давление, STP)
So, V м = молярный объем газа = 22,71 л моль -1 (имеется в паспорте)
- Проверить согласованность в единицах измерения, все тома в одних и тех же единицах измерения?
V(N 2(g) ) дается в мл
В м дается в л (моль -1 )
Переведите объем газа, V(N 2(g) ), из объема в миллилитрах, мл, в объем в литрах, л.
V(N 2(g) ) = 956 мл = 956 мл ÷ 1000 мл л -1 = 956 × 10 -3 л = 0,956 л
- Какая связь между молями газообразного азота и объемом газообразного азота при заданных температуре и давлении?
н(N 2(г) ) (моль) = В(N 2(г) )
В м - Подставьте значения в уравнение и найдите моли газообразного азота:
н(N 2(г) ) (моль) = 0,956
22,71(на СТП) = 0,0421 моль (на СТП)
Рабочие примеры расчета объема газа с использованием молярного объема газа
Рабочий пример 1. Баллон содержит 0,50 моль чистого газообразного гелия при стандартной температуре и давлении.
Баллон содержит 0,50 моль чистого газообразного гелия при стандартной температуре и давлении.
Каков объем воздушного шара?
- Какой вопрос просит вас сделать?
Рассчитайте объем газообразного гелия в баллоне.
В(Не (г) ) = объем газообразного гелия = ? л
- Какая информация (данные) была дана в вопросе?
н (Не (г) ) = моли газообразного гелия = 0,50 моль
Условия: стандартная температура и давление (STP, 0°C и 100 кПа)
So V м = молярный объем газа = 22,71 л моль -1
- Согласованы ли единицы измерения?
n(He (g) ) в молях
В м в молях на литр
Таким образом, единицы измерениясогласованы и не требуют преобразования.
- Каково соотношение между объемом газообразного гелия V(He (г) ) и молями газообразного гелия n(He (г) ) при заданных температуре и давлении?
В(Не (г) ) = n(He (г) ) × V м
- Подставьте значения и найдите объем газообразного гелия:
V(He (г) ) = n(He (г) ) × 22,71 (при СТП)
= 0,50 × 22,71
= 11,4 л
Рабочий пример 2. Какой объем занимают 3,70 моля N 2 газ на СТП?
Какой объем занимают 3,70 моля N 2 газ на СТП?
- Какой вопрос просит вас сделать?
Рассчитайте объем газа N 2 .
V(N 2(г) ) = объем газа N 2 = ? л
- Какая информация (данные) была дана в вопросе?
n(N 2(г) ) = моли газа N 2 = 3,70 моль
9Условия 0002: STP (стандартная температура и давление, 0°C и 100 кПа)So, V м = молярный объем газа = 22,71 л моль -1 (имеется в паспорте)
- Согласованы ли единицы измерения?
количество N 2(г) газа, n(N 2(г) ), указано в молях
молярный объем газа, V м дано в молях на литр
Единицы согласованы, поэтому преобразование не требуется.
- Какая связь между объемом газа N 2 , V(N 2(г) ), и молями газа N 2 , n(N 2(г) ), при заданной температуре и давление?
V(N 2(g) ) = n(N 2(g) ) × V м
- Подставьте значения и определите объем газообразного азота:
V(N 2(g) ) = n(N 2(g) ) × 22,71 (при НТП)
= 3,70 × 22,71
= 84,0 л
Решение задач с использованием молярного объема газа
Проблема: Химик Крис работает в лаборатории, в которой поддерживается постоянная температура 25°C, а давление всегда равно 100 кПа. Крису нужно проанализировать немного карбоната кальция, CaCO 3 (s), чтобы определить, является ли он чистым или загрязненным.
Крис проанализирует карбонат кальция, взяв небольшой образец 0,00500 моль и добавляя к нему соляную кислоту, HCl (водн.), до тех пор, пока весь карбонат кальция не исчезнет и больше не будет образовываться углекислый газ, CO 2 (g).
По мере добычи газ будет собираться водовытесняющим методом.
Крису нужно проанализировать немного карбоната кальция, CaCO 3 (s), чтобы определить, является ли он чистым или загрязненным.
Крис проанализирует карбонат кальция, взяв небольшой образец 0,00500 моль и добавляя к нему соляную кислоту, HCl (водн.), до тех пор, пока весь карбонат кальция не исчезнет и больше не будет образовываться углекислый газ, CO 2 (g).
По мере добычи газ будет собираться водовытесняющим методом.
Известно, что сбалансированное химическое уравнение этой реакции выглядит следующим образом:
CaCO 3 (т) + 2HCl(водн.) → CaCl 2 (водн.) + CO 2 (г) + H 2 O(л)
Если образец чистый, какой объем углекислого газа будет собран?
Решение проблемы с использованием модели StoPGoPS для решения проблемы:
| Сформулируйте вопрос. | Какой вопрос просит вас сделать? Определите объем углекислого газа, если карбонат кальция чистый. V(CO 2(g) ) = объем углекислого газа = ? л | |
| План. | Какой химический принцип вам нужно применить? Применение стехиометрии (V (г) = n (г) × V м ) Какую информацию (данные) вам предоставили? Какие шаги необходимо предпринять для решения проблемы? Этап 1: Расчет количества молей углекислого газа CO 2 (г), полученного Предположим, что CaCO 3 имеет 100% чистоту (без примесей). Используйте сбалансированное химическое уравнение для определения количества молей CO 2 произведенного CaCO 3 (т) + 2HCl(водн.) → CaCl 2 (водн.) + CO 2 (г) + H 2 O(л) Этап 2: Расчет объема CO 2 (г) Предположим, что потери CO 2 (g) отсутствуют, т. V(CO 2(g) ) = n(CO 2(g) ) × V m | |
| Следуйте плану. | Этап 1: Расчет количества молей углекислого газа CO 2 (г), полученного Предположим, что CaCO 3 имеет 100% чистоту (без примесей). Используйте сбалансированное химическое уравнение для определения молей CO 2 произведено CaCO 3 (т) + 2HCl(водн.) → CaCl 2 (водн.) + CO 2 (г) + H 2 O(л) Шаг 2: Рассчитать объем CO 2 (г) Предположим, что потери CO 2 (g) отсутствуют, т. V(CO 2(g) ) = n(CO 2(g) ) × V m | |
| Подумайте о правдоподобии. | Вы ответили на заданный вопрос? Да, мы определили объем углекислого газа, который будет собираться. Разумно ли ваше решение вопроса? При 25°C и 100 кПа объем 1 моля газа составит 24,79 л (V m из технического паспорта) |







 е. собирается весь произведенный газ.
е. собирается весь произведенный газ.  е. собирается весь произведенный газ.
е. собирается весь произведенный газ. 