Мв = К· Мr (1)
Где: К – коэффициент пропорциональности, равный 1г/моль.
В самом деле, для изотопа углерода 12 6 С Аr = 12, а молярная масса атомов (по определению понятия «моль») равна 12г/моль. Следовательно, численные значения двух масс совпадают, а значит, К = 1. Отсюда следует, что молярная масса вещества, выраженная в граммах на моль, имеет то же численное значение, что и его относительная молекулярная (атомная) масса. Так, молярная масса атомарного водорода равна 1,008г/моль, молекулярного водорода – 2,016г/моль, молекулярного кислорода – 31,999г/моль.
Согласно закону Авогадро одно и то же число
молекул любого газа занимает при одинаковых условиях один и тот же
объем. С другой стороны, 1 моль любого вещества содержит (по
определению) одинаковое число частиц. Отсюда следует, что при
определенных температуре и давлении 1 моль любого вещества в
газообразном состоянии занимает один и тот же объем.
Отношение объема, занимаемого веществом, к его к его количеству называется молярным объемом вещества. При нормальных условиях (101,325 кПа; 273 К) молярный объем любого газа равен 22,4 л/моль (точнее, Vn = 22,4 л/моль). Это утверждение справедливо для такого газа, когда другими видами взаимодействия его молекул между собой, кроме их упругого столкновения, можно пренебречь. Такие газы называют идеальными. Для неидеальных газов, называемых реальными, молярные объемы различны и несколько отличаются от точного значения. Однако в большинстве случаев различие сказывается лишь в четвертой и последующих значащих цифрах.
Измерения объемов газа обычно проводят при условиях, отличных от нормальных. Для приведения объема газа к нормальным условиям можно пользоваться уравнением, объединяющим газовые законы Бойля – Мариотта и Гей – Люссака:
pV / T = p 0 V 0 / T 0
Где: V – объем газа при давлении p и температуре T;
V 0 – объем газа при нормальном давлении p 0 (101,325 кПа) и температуре T 0 (273,15 К).
Молярные массы газов можно вычислить также, пользуясь уравнением состояния идеального газа – уравнением Клапейрона – Менделеева:
pV = m B RT / M B ,
Где: p – давление газа, Па;
V – его объем, м 3 ;
M B — масса вещества, г;
M B – его молярная масса, г/моль;
Т – абсолютная температура, К;
R – универсальная газовая постоянная, равная 8,314 Дж / (моль·К).
Если объем и давление газа выражены в других единицах измерения, то значение газовой постоянной в уравнении Клапейрона – Менделеева примет другое значение. Оно может быть рассчитано по формуле, вытекающей из объединенного закона газового состояния для моля вещества при нормальных условиях для одного моля газа:
R = (p 0 · V 0 / T 0)
Пример 1. Выразите в молях: а) 6,0210 21 молекул СО 2 ; б) 1,2010 24 атомов кислорода; в) 2,0010 23 молекул воды. Чему равна молярная масса указанных веществ?
Решение. Моль – это количество вещества, в котором содержится число частиц
любого определённого сорта, равное постоянной Авогадро. Отсюда, а)
6,0210 21 т.е. 0,01 моль; б) 1,2010 24 , т.е. 2 моль; в) 2,0010 23 , т.е. 1 / 3
моль. Масса моля вещества выражается в кг/моль или г/моль. Молярная
масса вещества в граммах численно равна его относительной молекулярной
(атомной) массе, выраженной в атомных единицах массы (а.е.м.)
Отсюда, а)
6,0210 21 т.е. 0,01 моль; б) 1,2010 24 , т.е. 2 моль; в) 2,0010 23 , т.е. 1 / 3
моль. Масса моля вещества выражается в кг/моль или г/моль. Молярная
масса вещества в граммах численно равна его относительной молекулярной
(атомной) массе, выраженной в атомных единицах массы (а.е.м.)
Так как молекулярные массы СО 2 и Н 2 О и атомная масса кислорода соответственно равны 44; 18 и 16а.е.м.,то их молярные массы равны: а) 44г/моль; б) 18г/моль; в)16г/моль.
Пример 2. Вычислите абсолютную массу молекулы серной кислоты в граммах.
Решение. Моль любого вещества (см. пример 1) содержит постоянную Авогадро N A структурных единиц (в нашем примере молекул). Молярная масса H 2 SO 4 равна 98,0 г/моль. Следовательно, масса одной молекулы 98/(6,02 10 23) = 1,63 10 -22 г.
Моля́рный объём — объём одного моля вещества, величина, получающаяся от деления молярной массы на плотность. Характеризует плотность упаковки молекул.
Значение N A
= 6,022…×10 23
называется числом Авогадро в честь итальянского химика Амедео Авогадро. Это универсальная постоянная для мельчайших частиц любого вещества.
Это универсальная постоянная для мельчайших частиц любого вещества.
Именно такое количество молекул содержит 1 моль кислорода О 2 , такое же количество атомов в 1 моле железа (Fe), молекул в 1 моле воды H 2 O и т. д.
Согласно закону Авогадро, 1 моль идеального газа при нормальных условиях имеет один и тот же объём
Где m-масса,M-молярная масса, V- объем.
4. Закон Авогадро. Установлен итальянским физиком Авогадро в 1811 г. Одинаковые объемы любых газов, отобранные при одной температуре и одинаковом давлении, содержат одно и тоже число молекул.
Таким образом, можно сформулировать понятие количества вещества: 1 моль вещества содержит число частиц, равное 6,02*10 23 (называемое постоянной Авогадро)
Следствием этого закона является то, что 1 моль любого газа занимает при нормальных условиях (Р 0 =101,3кПа и Т 0 =298К) объём, равный 22,4л.
5. Закон Бойля-Мариотта
При постоянной температуре объем данного количества газа обратно пропорционален давлению, под которым он находится:
6. Закон Гей-Люссака
При постоянном давлении изменение объема газа прямо пропорционально температуре:
V/T = const.
7. Зависимость между объемом газа, давлением и температурой можно выразить объединенным законом Бойля-Мариотта и Гей-Люссака, которым пользуются для приведения объемов газа от одних условий к другим:
P 0 , V 0 ,T 0 -давление объема и температуры при нормальных условиях: P 0 =760 мм рт. ст. или 101,3 кПа; T 0 =273 К (0 0 С)
8. Независимая оценка значения молекулярноймассы М может быть выполнена с использованием так называемого уравнения состояния идеального газа или уравнения Клапейрона-Менделеева :
pV=(m/M)*RT=vRT. (1.1)
где р — давление газа в замкнутой системе, V — объем системы, т —

Отметим, что значение постоянной R может быть получено подстановкой величин, характеризующих один моль газа при н.у., в уравнение (1.1):
r = (р V)/(Т)=(101,325кПа 22.4 л)/(1 моль 273К)=8.31Дж/моль.К)
Примеры решения задач
Пример 1. Приведение объема газа к нормальным условиям.
Какой объем (н.у.) займут 0,4×10 -3 м 3 газа, находящиеся при 50 0 С и давлении 0,954×10 5 Па?
Решение. Для приведения объема газа к нормальным условиям пользуются общей формулой, объединяющей законы Бойля-Мариотта и Гей-Люссака:
pV/T = p 0 V 0 /T 0 .
Объем газа (н.у.) равен , где Т 0 = 273 К; р 0 = 1,013×10 5 Па; Т = 273 + 50 = 323 К;
М 3 = 0,32×10 -3 м 3 .
При (н.у.) газ занимает объем, равный 0,32×10 -3 м 3 .
Пример 2. Вычисление относительной плотности газа по его молекулярной массе.
Вычислите плотность этана С 2 Н 6 по водороду и воздуху.
Решение. Из закона Авогадро вытекает, что относительная плотность одного газа по другому равна отношению молекулярных масс (М ч ) этих газов, т. е. D=М 1 /М 2 . Если М 1 С2Н6 = 30, М 2 Н2 = 2, средняя молекулярная масса воздуха равна 29, то относительная плотность этана по водороду равна D Н2 = 30/2 =15.
е. D=М 1 /М 2 . Если М 1 С2Н6 = 30, М 2 Н2 = 2, средняя молекулярная масса воздуха равна 29, то относительная плотность этана по водороду равна D Н2 = 30/2 =15.
Относительная плотность этана по воздуху: D возд = 30/29 = 1,03, т.е. этан в 15 раз тяжелее водорода и в 1,03 раза тяжелее воздуха.
Пример 3. Определение средней молекулярной массы смеси газов по относительной плотности.
Вычислите среднюю молекулярную массу смеси газов, состоящей из 80 % метана и 20 % кислорода (по объему), используя значения относительной плотности этих газов по водороду.
Решение. Часто вычисления производят по правилу смешения, которое заключается в том, что отношение объемов газов в двухкомпонентной газовой смеси обратно пропорционально разностям между плотностью смеси и плотностями газов, составляющих эту смесь. Обозначим относительную плотность газовой смеси по водороду через D Н2 . она будет больше плотности метана, но меньше плотности кислорода:
80D Н2 – 640 = 320 – 20D Н2 ; D Н2 = 9,6.
Плотность этой смеси газов по водороду равна 9,6. средняя молекулярная масса газовой смеси М Н2 = 2D Н2 = 9,6×2 = 19,2.
Пример 4. Вычисление молярной массы газа.
Масса0,327×10 -3 м 3 газа при 13 0 С и давлении 1,040×10 5 Па равна 0,828×10 -3 кг. Вычислите молярную массу газа.
Решение. Вычислить молярную массу газа можно, используя уравнение Менделеева-Клапейрона:
где m – масса газа; М – молярная масса газа; R – молярная (универсальная) газовая постоянная, значение которой определяется принятыми единицами измерения.
Если давление измерять в Па, а объем в м 3 , то R =8,3144×10 3 Дж/(кмоль×К).
: V = n*Vm, где V – объем газа (л), n – количество вещества (моль), Vm — молярный объем газа (л/моль), при нормальных (н.у.) является стандартной величиной и равен 22,4 л/моль. Бывает так, что в условии нет количества вещества, но есть масса определенного вещества, тогда поступаем так: n = m/M, где m – масса вещества (г), M – молярная масса вещества (г/моль). Молярную массу находим по таблице Д.И. Менделеева: под каждым элементом его атомная масса, складываем все массы и получаем необходимую нам. Но такие задачи встречаются довольно редко, обычно в задачи присутствует . Решение таких задач по этом немного изменяется. Рассмотрим на примере.
Молярную массу находим по таблице Д.И. Менделеева: под каждым элементом его атомная масса, складываем все массы и получаем необходимую нам. Но такие задачи встречаются довольно редко, обычно в задачи присутствует . Решение таких задач по этом немного изменяется. Рассмотрим на примере.
Какой объем водорода выделится при нормальных условиях, если растворить алюминий массой 10,8 г в избытке соляной .
Если мы имеем дело с газовой системой, то имеет место такая формула: q(x) = V(x)/V, где q(x)(фи) – доля компонента, V(x) – объем компонента (л), V – объем системы (л). Для нахождения объема компонента получаем формулу: V(x) = q(x)*V. А если необходимо найти объем системы, то: V = V(x)/q(x).
Обратите внимание
Существуют и другие формулы для нахождения объема, но если необходимо найти объем газа подойдут только формулы, приведенные в этой статье.
Источники:
- «Пособие по химии», Г.П. Хомченко, 2005.
- как найти объем работ
- Найти объем водорода при электролизе раствора ZnSO4
Идеальным считают газ, в котором взаимодействие между молекулами пренебрежимо мало. Помимо давления, состояние газа характеризуется температурой и объемом. Соотношения между этими параметрами отображены в газовых законах.
Помимо давления, состояние газа характеризуется температурой и объемом. Соотношения между этими параметрами отображены в газовых законах.
Инструкция
Давление газа прямо пропорционально его температуре, количеству вещества, и обратно пропорционально объему сосуда, занимаемого газом. Коэффициентом пропорциональности служит универсальная газовая постоянная R, приблизительно равная 8,314. Она измеряется в джоулях, разделенных на моль и на .
Это положение формирует математическую зависимость P=νRT/V, где ν – количество вещества (моль), R=8,314 – универсальная газовая постоянная (Дж/моль К), T – температура газа, V – объем. Давление выражается в . Его можно выразить и , при этом 1 атм = 101,325 кПа.
Рассмотренная зависимость – следствие из уравнения Менделеева-Клапейрона PV=(m/M) RT. Здесь m – масса газа (г), M – его молярная масса (г/моль), а дробь m/M дает в итоге количество вещества ν, или количество молей. Уравнение Менделеева-Клапейрона справедливо для всех газов, которые допустимо считать . Это физико- газовый закон.
Это физико- газовый закон.
Одной из основных единиц в Международной системе единиц (СИ) является единица количества вещества – моль.
Моль – это такое количество вещества, которое содержит столько структурных единиц данного вещества (молекул, атомов, ионов и др.), сколько атомов углерода содержится в 0,012 кг (12 г) изотопа углерода 12 С .
Учитывая, что значение абсолютной атомной массы для углерода равно m (C) = 1,99 · 10 26 кг, можно рассчитать число атомов углерода N А , содержащееся в 0,012 кг углерода.
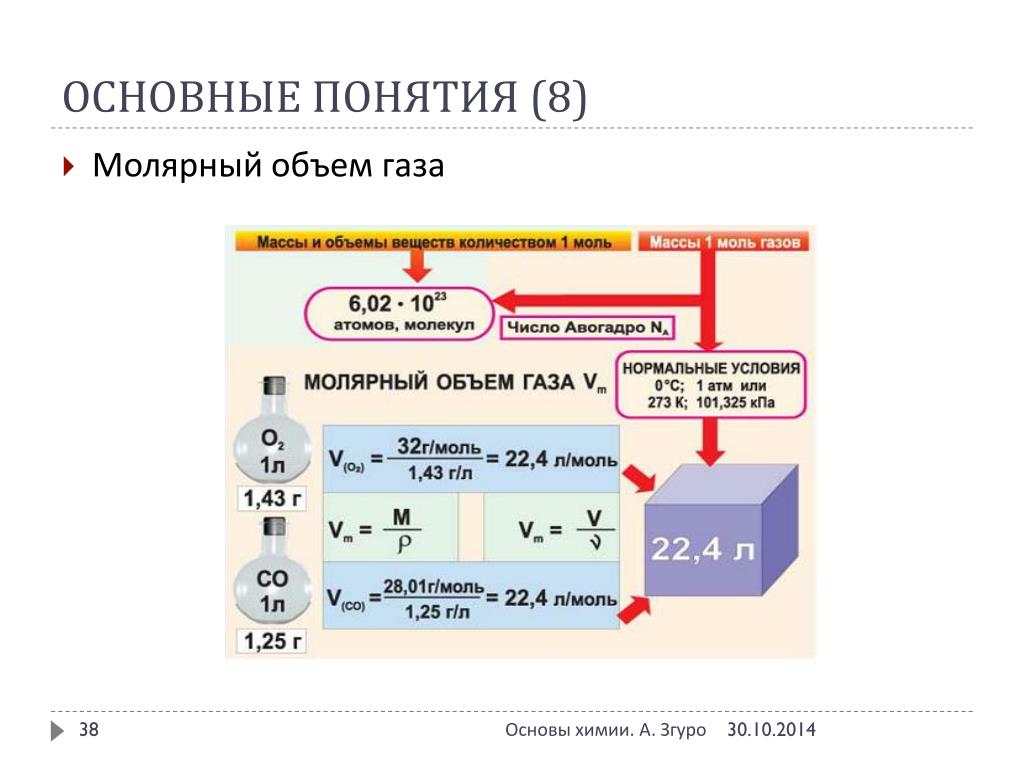
Моль любого вещества содержит одно и то же число частиц этого вещества (структурных единиц). Число структурных единиц, содержащихся в веществе количеством один моль равно 6,02·10 23 и называется числом Авогадро (N А ).
Например,
один моль меди содержит 6,02·10 23
атомов меди (Cu), а один
моль водорода (H 2)
– 6,02·10 23 молекул
водорода.
Молярной массой (M) называется масса вещества, взятого в количестве 1 моль.
Молярная масса обозначается буквой М и имеет размерность [г/моль]. В физике пользуются размерностью [кг/кмоль].
В общем случае численное значение молярной массы вещества численно совпадает со значением его относительной молекулярной (относительной атомной) массы.
Например, относительная молекулярная масса воды равна:
Мr(Н 2 О) = 2Аr (Н) + Аr (O) = 2∙1 + 16 = 18 а.е.м.
Молярная масса воды имеет ту же величину, но выражена в г/моль:
М (Н 2 О) = 18 г/моль.
Таким образом, моль воды, содержащий 6,02·10 23 молекул воды (соответственно 2·6,02·10 23 атомов водорода и 6,02·10 23 атомов кислорода), имеет массу 18 граммов. В воде, количеством вещества 1 моль, содержится 2 моль атомов водорода и один моль атомов кислорода.
1.3.4. Связь между массой вещества и его количеством
Зная
массу вещества и его химическую формулу,
а значит и значение его молярной массы,
можно определить количество вещества
и, наоборот, зная количество вещества,
можно определить его массу. Для подобных
расчетов следует пользоваться формулами:
Для подобных
расчетов следует пользоваться формулами:
где ν – количество вещества, [моль]; m – масса вещества, [г] или [кг]; М – молярная масса вещества, [г/моль] или [кг/кмоль].
Например, для нахождения массы сульфата натрия (Na 2 SO 4) количеством 5 моль найдем:
1) значение относительной молекулярной массы Na 2 SO 4 , представляющую собой сумму округленных значений относительных атомных масс:
Мr(Na 2 SO 4) = 2Аr(Na) + Аr(S) + 4Аr(O) = 142,
2) численно равное ей значение молярной массы вещества:
М(Na 2 SO 4) = 142 г/моль,
3) и, наконец, массу 5 моль сульфата натрия:
m = ν · M = 5 моль · 142 г/моль = 710 г.
Ответ: 710.
1.3.5. Связь между объемом вещества и его количеством
При
нормальных условиях (н.у.), т.е. при
давлении р ,
равном 101325 Па (760 мм. рт. ст.), и температуре Т, равной
273,15 К (0 С),
один моль различных газов и паров
занимает один и тот же объем, равный 22,4 л.
Объем, занимаемый 1 моль газа или пара при н.у., называется молярным объемом газа и имеет размерность литр на моль.
V мол = 22,4 л/моль.
Зная количество газообразного вещества (ν) и значение молярного объема (V мол) можно рассчитать его объем (V) при нормальных условиях:
V = ν · V мол,
где ν – количество вещества [моль]; V – объем газообразного вещества [л]; V мол = 22,4 л/моль.
И, наоборот, зная объем (V ) газообразного вещества при нормальных условиях, можно рассчитать его количество (ν):
Молярный объем — Учебник по Химии. 8 класс. Григорович
Учебник по Химии. 8 класс. Григорович — Новая программа
Вспомните:
• газы отличаются от жидкостей и твердых веществ тем, что в них молекулы расположены на очень больших расстояниях, которые значительно превосходят размеры самых молекул;
• в газах молекулы движутся быстро и хаотически, благодаря чему газ расширяется и занимает весь доступный ему объем сосуда.
Закон Авогадро
В 1814 г., проводя многочисленные химические эксперименты с газообразными веществами, итальянский ученый Амедео Авогадро пришел к выводу, который сегодня называют законом Авогадро:
В равных объемах любых газов при одинаковых условиях (температура и давление) содержится одинаковое число молекул.
На основании чего можно сделать такой вывод? Проводя реакцию между водородом и кислородом, Авогадро заметил, что объем водорода, вступающего в реакцию, всегда в два раза больше объема кислорода. По уравнению реакции
2Н2 + O2 = 2Н2O
видно, что на одну молекулу кислорода в реакции расходуется две молекулы водорода. Таким образом, если молекул водорода реагирует в два раза больше, чем молекул кислорода, и объем водорода в два раза больше, чем объем кислорода, то в одинаковых объемах должно содержаться одинаковое число молекул.
В настоящее время это утверждение довольно легко объясняется. Как и большинство твердых и жидких веществ, газы состоят из отдельных молекул. Но, в отличие от твердых веществ и жидкостей, в которых молекулы расположены очень плотно друг к другу, в газах молекулы находятся на больших расстояниях. Эти расстояния значительно превышают размеры молекул. И хотя молекулы разных газов отличаются друг от друга размерами, формой и объемом, этими отличиями можно пренебречь и рассматривать их как крохотные твердые шарики.
Как и большинство твердых и жидких веществ, газы состоят из отдельных молекул. Но, в отличие от твердых веществ и жидкостей, в которых молекулы расположены очень плотно друг к другу, в газах молекулы находятся на больших расстояниях. Эти расстояния значительно превышают размеры молекул. И хотя молекулы разных газов отличаются друг от друга размерами, формой и объемом, этими отличиями можно пренебречь и рассматривать их как крохотные твердые шарики.
Молекулы газа постоянно хаотически двигаются. Но среднее расстояние между молекулами постоянно и зависит только от условий, при которых находится газ. Если разные газы находятся при одинаковых условиях (температура и давление), то расстояния между молекулами примерно равны и поэтому одинаковое число молекул любых газов должно занимать равные объемы.
Молярный объем газов
Зная, что один моль любого вещества содержит определенное число молекул, можно сделать вывод о том, что все газы количеством 1 моль при одинаковых условиях занимают одинаковый объем (рис. 26.1).
26.1).
Рис. 26.1. Объемы разных газов количеством 1 моль равны, несмотря на то что у этих образцов разные массы
По аналогии с молярной массой объем одного моля вещества называют молярным объемом Vm:
Молярный объем измеряют в литрах на моль (л/моль).
Значение молярного объема газов зависит от температуры и давления.
В химии принято приводить значение молярного объема при атмосферном давлении 760 мм рт. ст. (или 101 325 Па) и температуре 0 °С — такие условия называют нормальными (сокращенно н. у.).
При нормальных условиях молярный объем любого газа равен приблизительно 22,4 л/моль.
При комнатной температуре (25 °С) и атмосферном давлении (такие условия называют стандартными) молярный объем газов несколько больше: Vm = 24,4 л/моль.
Расчеты с использованием молярного объема
Зная молярный объем газа, можно определить количество вещества п, которое содержится в определенном объеме вещества V при нормальных условиях:
Газ, в котором расстояние между молекулами намного больше размеров молекул и в котором отсутствует межмолекулярное взаимодействие, называется идеальным газом. Состояние идеального газа описывается уравнением Менделеева-Клапейрона:
Состояние идеального газа описывается уравнением Менделеева-Клапейрона:
pV = nRT,
где р — давление, V — объем газа, n — количество вещества, R — универсальная газовая постоянная (8,314 Дж/моль • К), Т — температура по шкале Кельвина. Молярный объем идеального газа при любых условиях равен:
Подставляя в это уравнение значения температуры и давления для нормальных условий, получаем:
Необходимо также помнить, что 22,4 л/моль — это молярный объем идеального газа. Для реальных газов значения их молярных объемов будут несколько отличаться от значений для идеального газа. Так, при нормальных условиях Vm(H2) = 22,371 л/моль, a Vm(O2) = 22,425 л/моль. Это связано с тем, что водород и кислород — это реальные газы, для которых следует учитывать и объем молекул, и силы взаимодействия между ними. Однако отклонение реальных молярных объемов газов от молярного объема идеального газа незначительно и им можно пренебречь.
Молярный объем жидкостей и твердых веществ
Молярный объем жидких и твердых веществ, в отличие от молярного объема газов, почти не зависит от давления и температуры и разный для различных веществ. Это объясняется отличиями в строении твердых, жидких и газообразных веществ. В твердых и жидких веществах молекулы расположены очень плотно. Поэтому объем, занимающий 1 моль твердого или жидкого вещества, зависит от размеров молекул и плотности их расположения. Например, при комнатной температуре один моль воды занимает объем 18 мл, спирта — 58 мл, золота — 10 см3 (1 см3 = 1 мл).
Молярный объем вещества в любом состоянии (твердом, жидком, газообразном) можно вычислить, если известны молярная масса М вещества и его плотность р:
Vm = M / p
Если мы знаем, что в одном моле вещества содержится число молекул, которое равное числу Авогадро, то можно вычислить число молекул газа в определенном объеме при нормальных условиях:
Зная количество газообразного вещества, можно вычислить его объем при нормальных условиях:
V = n • Vm
Задача 1.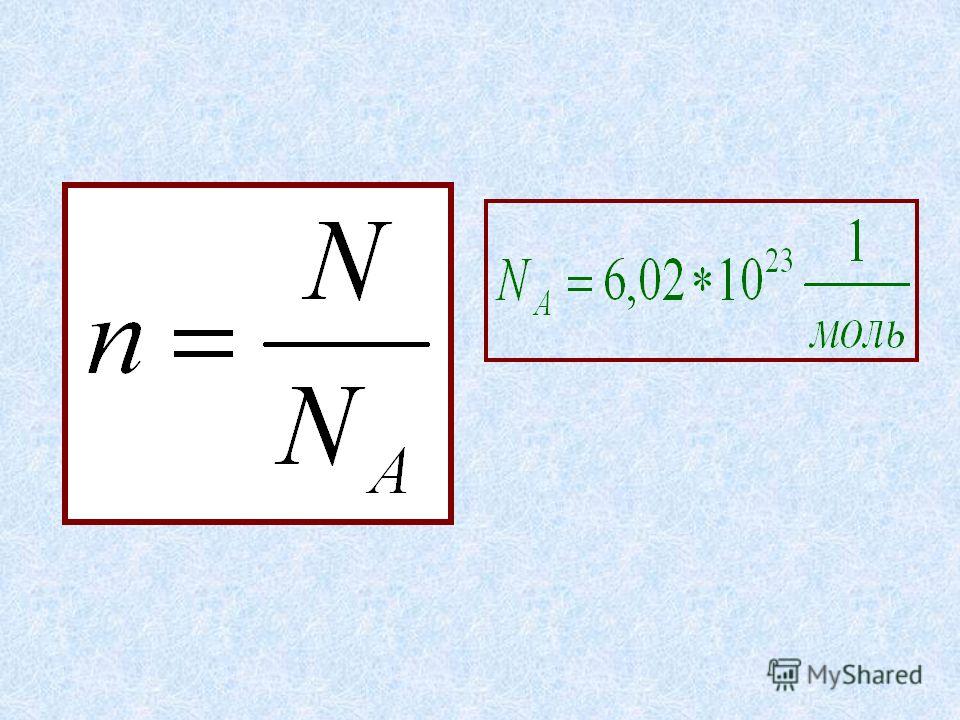 Вычислите объем, который занимает при нормальных условиях газ количеством 1,2 моль.
Вычислите объем, который занимает при нормальных условиях газ количеством 1,2 моль.
Задача 2. Вычислите количество вещества, содержащееся при нормальных условиях в газе объемом 5,6 л.
Задача 3. Вычислите число атомов Оксигена и число молекул кислорода, содержащихся в кислороде объемом 16,8 л (при н. у.).
Задача 4. Вычислите массу углекислого газа объемом 1 л (н. у.).
Лингвистическая задача
Это слово звучит почти одинаково на всех языках (даже на хинди, турецком и арабском). Придумал его в XVII в. голландский ученый Ян Баптист ван Гельмонт. Он взял его из латыни (chaos), в которую оно пришло из греческого языка. Греки словом хаос называли пустое туманное пространство, существовавшее еще до создания мира. Какое слово, по вашему мнению, имеется в виду? Как оно переводится на другие языки: украинский, английский, немецкий, французский?
В 1814 г., через три года после того как Авогадро опубликовал свой закон, появилась статья французского физика Ампера, где он сформулировал положения, очень близкие к закону Авогадро. Ампер позднее признал, что с трудом Авогадро ознакомился уже после публикации своей статьи, но на приоритете не настаивал. Поэтому в некоторых научных изданиях встречается словосочетание «закон Авогадро-Ампера».
Ампер позднее признал, что с трудом Авогадро ознакомился уже после публикации своей статьи, но на приоритете не настаивал. Поэтому в некоторых научных изданиях встречается словосочетание «закон Авогадро-Ампера».
Выводы
1. Согласно закону Авогадро, в одинаковых объемах любых газообразных веществ при одинаковых условиях содержится одинаковое число молекул этих веществ.
2. Следствием закона Авогадро является то, что любое газообразное вещество количеством 1 моль при нормальных условиях занимает объем, равный 22,4 л. Этот объем называют молярным объемом газов, его обозначают Vm, единица его измерения — л/моль.
Контрольные вопросы
1. Сформулируйте закон Авогадро.
2. Какие условия называют нормальными?
3. Чему равен молярный объем газа при нормальных условиях?
4. Объясните суть закона Авогадро по современным представлениям.
Задания для усвоения материала
1. Какой объем занимают при нормальных условиях: а) 2 моль азота; б) 0,5 моль кислорода; в) 0,25 моль фтора?
2. Сколько молекул содержится в резиновом шаре объемом 5,6 л (н. у.), заполненном водородом? Изменится ли ответ, если водород заменить; а) азотом; б) неизвестным газом; в) водопроводной водой?
Сколько молекул содержится в резиновом шаре объемом 5,6 л (н. у.), заполненном водородом? Изменится ли ответ, если водород заменить; а) азотом; б) неизвестным газом; в) водопроводной водой?
3. Определите, какой объем при нормальных условиях занимают; а) 5 моль метана СН4; б) 2 моль сероводорода H2S; в) 4,2 моль аммиака NH3.
4. В каком объеме аммиака NH3 содержится в 3 раза больше молекул, чем в метане СН4 объемом 100 л (н. у.)?
5. Имеется два газа, взятые при нормальных условиях: 10 л метана СН4 и 20 л хлора Сl2. В каком из них содержится больше молекул, а в каком — больше атомов и во сколько раз?
6. Сколько молекул кислорода содержится при нормальных условиях: а) в одном кубическом метре; б) в одном килограмме этого вещества?
7. Где содержится больше молекул аммиака — в 100 г или в 100 л (н. у.)?
8. Какой объем занимают при нормальных условиях: а) 10 г водорода; б) 10 моль водорода?
9. В четырех одинаковых сосудах содержатся одинаковые массы таких газов: аммиак NH3, азот N2, сернистый газ SO2, кислород O2. В каком сосуде содержится больше всего молекул?
В четырех одинаковых сосудах содержатся одинаковые массы таких газов: аммиак NH3, азот N2, сернистый газ SO2, кислород O2. В каком сосуде содержится больше всего молекул?
10. Сравните число молекул в 1 г аммиака NH3 и в 1 г азота. В каком случае и во сколько раз число молекул больше?
11. Вычислите массу сероводорода H2S объемом 11,2 л при нормальных условиях.
12. Масса 0,001 м3 газа (н. у.) равна 1,25 г. Вычислите массу одной молекулы этого газа.
13. Одинаковые ли массы и объемы (при одинаковых условиях) имеют 1,5 моль СO2 и 1,5 моль О2? Ответ подтвердите расчетами.
14. На вопрос: «Какой объем занимает 1 моль воды при нормальных условиях?» ученик ответил: 22,4 литра. Правильный ли этот ответ? Поясните.
15*. Каким образом с помощью закона Авогадро можно доказать, что: а) молекулы кислорода, азота, водорода состоят из двух атомов; б) состав молекулы воды — Н2O, а не НО; в) состав молекулы аммиака — NH3, а не NH?
Попередня
СторінкаНаступна
СторінкаЗміст
Написать формулу определения молярного объема.
 Количество вещества, моль, молярная масса и молярный объем. Как определить объем газа
Количество вещества, моль, молярная масса и молярный объем. Как определить объем газаГде m-масса,M-молярная масса, V- объем.
4. Закон Авогадро. Установлен итальянским физиком Авогадро в 1811 г. Одинаковые объемы любых газов, отобранные при одной температуре и одинаковом давлении, содержат одно и тоже число молекул.
Таким образом, можно сформулировать понятие количества вещества: 1 моль вещества содержит число частиц, равное 6,02*10 23 (называемое постоянной Авогадро)
Следствием этого закона является то, что 1 моль любого газа занимает при нормальных условиях (Р 0 =101,3кПа и Т 0 =298К) объём, равный 22,4л.
5. Закон Бойля-Мариотта
При постоянной температуре объем данного количества газа обратно пропорционален давлению, под которым он находится:
6. Закон Гей-Люссака
При постоянном давлении изменение объема газа прямо пропорционально температуре:
V/T = const.
7. Зависимость между объемом газа, давлением и температурой можно выразить объединенным законом Бойля-Мариотта и Гей-Люссака, которым пользуются для приведения объемов газа от одних условий к другим:
P 0 , V 0 ,T 0 -давление объема и температуры при нормальных условиях: P 0 =760 мм рт. ст. или 101,3 кПа; T 0 =273 К (0 0 С)
ст. или 101,3 кПа; T 0 =273 К (0 0 С)
8. Независимая оценка значения молекулярноймассы М может быть выполнена с использованием так называемого уравнения состояния идеального газа или уравнения Клапейрона-Менделеева :
pV=(m/M)*RT=vRT. (1.1)
где р — давление газа в замкнутой системе, V — объем системы, т — масса газа, Т — абсолютная температура, R — универсальная газовая постоянная.
Отметим, что значение постоянной R может быть получено подстановкой величин, характеризующих один моль газа при н.у., в уравнение (1.1):
r = (р V)/(Т)=(101,325кПа 22.4 л)/(1 моль 273К)=8.31Дж/моль.К)
Примеры решения задач
Пример 1. Приведение объема газа к нормальным условиям.
Какой объем (н.у.) займут 0,4×10 -3 м 3 газа, находящиеся при 50 0 С и давлении 0,954×10 5 Па?
Решение. Для приведения объема газа к нормальным условиям пользуются общей формулой, объединяющей законы Бойля-Мариотта и Гей-Люссака:
pV/T = p 0 V 0 /T 0 .
Объем газа (н.у.) равен , где Т 0 = 273 К; р 0 = 1,013×10 5 Па; Т = 273 + 50 = 323 К;
м 3 = 0,32×10 -3 м 3 .
При (н.у.) газ занимает объем, равный 0,32×10 -3 м 3 .
Пример 2. Вычисление относительной плотности газа по его молекулярной массе.
Вычислите плотность этана С 2 Н 6 по водороду и воздуху.
Решение. Из закона Авогадро вытекает, что относительная плотность одного газа по другому равна отношению молекулярных масс (М ч ) этих газов, т.е. D=М 1 /М 2 . Если М 1 С2Н6 = 30, М 2 Н2 = 2, средняя молекулярная масса воздуха равна 29, то относительная плотность этана по водороду равна D Н2 = 30/2 =15.
Относительная плотность этана по воздуху: D возд = 30/29 = 1,03, т.е. этан в 15 раз тяжелее водорода и в 1,03 раза тяжелее воздуха.
Пример 3. Определение средней молекулярной массы смеси газов по относительной плотности.
Вычислите среднюю молекулярную массу смеси газов, состоящей из 80 % метана и 20 % кислорода (по объему), используя значения относительной плотности этих газов по водороду.
Решение. Часто вычисления производят по правилу смешения, которое заключается в том, что отношение объемов газов в двухкомпонентной газовой смеси обратно пропорционально разностям между плотностью смеси и плотностями газов, составляющих эту смесь. Обозначим относительную плотность газовой смеси по водороду через D Н2 . она будет больше плотности метана, но меньше плотности кислорода:
80D Н2 – 640 = 320 – 20D Н2 ; D Н2 = 9,6.
Плотность этой смеси газов по водороду равна 9,6. средняя молекулярная масса газовой смеси М Н2 = 2D Н2 = 9,6×2 = 19,2.
Пример 4. Вычисление молярной массы газа.
Масса0,327×10 -3 м 3 газа при 13 0 С и давлении 1,040×10 5 Па равна 0,828×10 -3 кг. Вычислите молярную массу газа.
Решение. Вычислить молярную массу газа можно, используя уравнение Менделеева-Клапейрона:
где m – масса газа; М – молярная масса газа; R – молярная (универсальная) газовая постоянная, значение которой определяется принятыми единицами измерения.
Если давление измерять в Па, а объем в м 3 , то R =8,3144×10 3 Дж/(кмоль×К).
Теоретический материал смотри на странице «Молярный объём газа «.
Основные формулы и понятния:
Из закона Авогадро, например, следует, что при одинаковых условиях в 1 литре водорода и в 1 литре кислорода содержится одинаковое кол-во молекул, хотя их размеры сильно разнятся.
Первое следствие из закона Авогадро:
Объём, который занимает 1 моль любого газа при нормальных условиях (н.у.), равен 22,4 литра и называется молярным объёмом газа (V m).
V m =V/ν (м 3 /моль)
Что называют нормальными условиями (н.у.):
- нормальная температура = 0°C или 273 К;
- нормальное давление = 1 атм или 760 мм рт.ст. или 101,3 кПа
Из первого следствия закона Авогадро вытекает, что, например, 1 моль водорода (2 г) и 1 моль кислорода (32 г) занимают один и тот же объем, равный 22,4 литра при н.у.
Зная V m , можно найти объем любого кол-ва (ν) и любой массы (m) газа:
V=V m ·ν V=V m ·(m/M)
Типовая задача 1
: Какой объём при н. у. занимает 10 моль газа?
у. занимает 10 моль газа?
V=V m ·ν=22,4·10=224 (л/моль)
Типовая задача 2 : Какой объём при н.у. занимает 16 г кислорода?
V(O 2)=V m ·(m/M) M r (O 2)=32; M(O 2)=32 г/моль V(O 2)=22,4·(16/32)=11,2 л
Второе следствие из закона Авогадро:
Зная пллотность газа (ρ=m/V) при н.у., можно вычислить молярную массу этого газа: M=22,4·ρ
Плотностью (D) одного газа по другому называют отношение массы определённого объёма первого газа к массе аналогичного объёма второго газа, взятого при одинаковых условиях.
Типовая задача 3 : Определить относительную плотность углекислого газа по водороду и воздуху.
D водород (CO 2) = M r (CO 2)/M r (H 2) = 44/2 = 22 D воздух = 44/29 = 1,5
- один объём водорода и один объём хлора дают два объёма хлористого водорода: H 2 +Cl 2 =2HCl
- два объёма водорода и один объём кислорода дают два объёма водяного пара: 2H 2 +O 2 =2H 2 O
Задача 1
. Сколько молей и молекул содержится в 44 г углекислого газа.
Решение:
M(CO 2)=12+16·2=44 г/моль ν = m/M = 44/44 = 1 моль N(CO 2) = ν·N A = 1·6,02·10 23 = 6,02·10 23
Задача 2 . Вычислить массу одной молекулы озона и атома аргона.
Решение:
M(O 3) = 16·3 = 48 г m(O 3) = M(O 3)/N A = 48/(6,02·10 23) = 7,97·10 -23 г M(Ar) = 40 г m(Ar) = M(Ar)/N A = 40/(6,02·10 23) = 6,65·10 -23 г
Задача 3 . Какой объём при н.у. занимает 2 моля метана.
Решение:
ν = V/22,4 V(CH 4) = ν·22,4 = 2·22,4 = 44,8 л
Задача 4 . Определить плотность и относительную плотность оксида углерода (IV) по водороду, метану и воздуху.
Решение:
M r (CO 2)=12+16·2=44; M(CO 2)=44 г/моль M r (CH 4)=12+1·4=16; M(CH 4)=16 г/моль M r (H 2)=1·2=2; M(H 2)=2 г/моль M r (воздуха)=29; М(воздуха)=29 г/моль ρ=m/V ρ(CO 2)=44/22,4=1,96 г/моль D(CH 4)=M(CO 2)/M(CH 4)=44/16=2,75 D(H 2)=M(CO 2)/M(H 2)=44/2=22 D(воздуха)=M(CO 2)/M(воздуха)=44/24=1,52
Задача 5
. Определить массу газовой смеси, в которую входят 2,8 кубометров метана и 1,12 кубометров оксида углерода.
Решение:
M r (CO 2)=12+16·2=44; M(CO 2)=44 г/моль M r (CH 4)=12+1·4=16; M(CH 4)=16 г/моль 22,4 кубометра CH 4 = 16 кг 2,8 кубометра CH 4 = x m(CH 4)=x=2,8·16/22,4=2 кг 22,4 кубометра CO 2 = 28 кг 1,12 кубометра CO 2 = x m(CO 2)=x=1,12·28/22,4=1,4 кг m(CH 4)+m(CO 2)=2+1,4=3,4 кг
Задача 6 . Определить объёмы кислорода и воздуха требуемые для сжигания 112 кубометров двухвалентного оксида углерода при содержании в нем негорючих примесей в объёмных долях 0,50.
Решение:
- определяем объём чистого CO в смеси: V(CO)=112·0,5=66 кубометров
- определяем объём кислорода, необходимый для сжигания 66 кубов CO: 2CO+O 2 =2CO 2 2моль+1моль 66м 3 +X м 3 V(CO)=2·22,4 = 44,8 м 3 V(O 2)=22,4 м 3 66/44,8 = X/22,4 X = 66·22,4/44,8 = 33 м 3 или 2V(CO)/V(O 2) = V 0 (CO)/V 0 (O 2) V — молярные объемы V 0 — вычисляемые объемы V 0 (O 2) = V(O 2)·(V 0 (CO)/2V(CO))
Задача 7 . Как изменится давление в сосуде, заполненном газами водорода и хлора после того, как они вступят в реакцию? Аналогично для водорода и кислорода?
Решение:
- H 2 +Cl 2 =2HCl — в результате взаимодействия 1 моля водорода и 1 моля хлора получается 2 моля хлороводорода: 1(моль)+1(моль)=2(моль), следовательно, давление не изменится, поскольку получившийся объм газовой смеси равен сумме объемов компонентов, вступивших в реакцию.

- 2H 2 +O 2 =2H 2 O — 2(моль)+1(моль)=2(моль) — давление в сосуде уменьшится в полтора раза, поскольку из 3 объёмов компонентов, вступивших в реакцию, получилось 2 объёма газовой смеси.
Задача 8 . 12 литров газовой смеси из аммиака и четырехвалентного оксида углерода при н.у. имеют массу 18 г. Сколько в смеси каждого из газов?
Решение:
V(NH 3)=x л V(CO 2)=y л M(NH 3)=14+1·3=17 г/моль M(CO 2)=12+16·2=44 г/моль m(NH 3)=x/(22,4·17) г m(CO 2)=y/(22,4·44) г Система уравнений объем смеси: x+y=12 масса смеси: x/(22,4·17)+y/(22,4·44)=18 После решения получим: x=4,62 л y=7,38 л
Задача 9 . Какое кол-во воды получится в результате реакции 2 г водорода и 24 г кислорода.
Решение:
2H 2 +O 2 =2H 2 O
Из уравнения реакции видно, что кол-ва реагирующих веществ не соответствуют отношению стехиометрических коэффициентов в уравнении. В таких случаях вычисления проводят по веществу, которого меньше, т.е., это вещество закончится первым в ходе реакции. Чтобы определить какой из компонентов находится в недостатке, надо обратить внимание на коэффициенте в уравнении реакции.
Чтобы определить какой из компонентов находится в недостатке, надо обратить внимание на коэффициенте в уравнении реакции.
Количества исходных компонентов ν(H 2)=4/2=2 (моль) ν(O 2)=48/32=1,5 (моль)
Однако, торопиться не надо. В нашем случае для реакции с 1,5 моль кислорода необходимо 3 моль водорода (1,5·2), а у нас его только 2 моль, т.е., не хватает 1 моль водорода, чтобы прореагировали все полтора моля кислорода. Поэтому, расчёт кол-ва воды будем вести по водороду:
ν(H 2 O)=ν(H 2)=2 моль m(H 2 O) = 2·18=36 г
Задача 10 . При температуре 400 К и давлении 3 атмосферы газ занимает объём 1 литр. Какой объем будет занимать этот газ при н.у.?
Решение:
Из уравнения Клапейрона:
P·V/T = P н ·V н /T н V н = (PVT н)/(P н T) V н = (3·1·273)/(1·400) = 2,05 л
При изучении химических веществ важными понятиями являются такие величины, как молярная масса, плотность вещества, молярный объем. Так, что же такое молярный объем, и в чем его отличие для веществ в разном агрегатном состоянии?
Молярный объем: общая информация
Чтобы вычислить молярный объем химического вещества необходимо молярную массу этого вещества разделить на его плотность. Таким образом, молярный объем вычисляется по формуле:
Таким образом, молярный объем вычисляется по формуле:
где Vm – молярный объем вещества, М – молярная масса, p – плотность. В Международной системе СИ эта величина измеряется в кубический метр на моль (м 3 /моль).
Рис. 1. Молярный объем формула.
Молярный объем газообразных веществ отличается от веществ, находящихся в жидком и твердом состоянии тем, что газообразный элемент количеством 1 моль всегда занимает одинаковый объем (если соблюдены одинаковые параметры).
Объем газа зависит от температуры и давления, поэтому при расчетах следует брать объем газа при нормальных условиях. Нормальными условиями считается температура 0 градусов и давление 101,325 кПа.
Молярный объем 1 моля газа при нормальных условиях всегда одинаков и равен 22,41 дм 3 /моль. Этот объем называется молярным объемом идеального газа. То есть, в 1 моле любого газа (кислород, водород, воздух) объем равен 22,41 дм 3 /м.
Молярный объем при нормальных условиях можно вывести, используя уравнение состояния для идеального газа, которое называется уравнением Клайперона-Менделеева:
где R – универсальная газовая постоянная, R=8.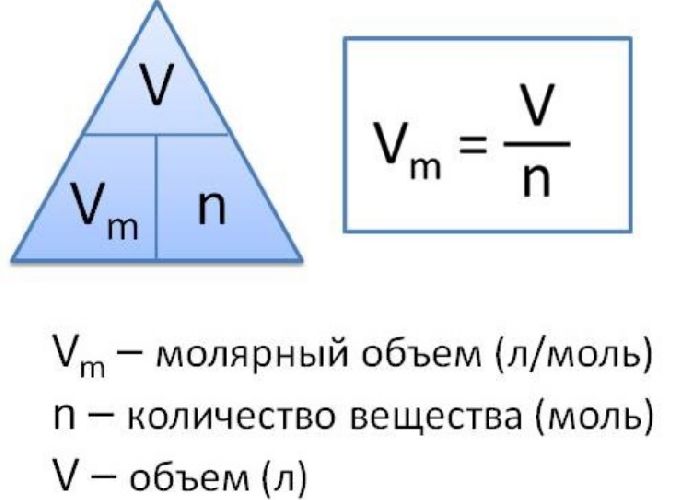 314 Дж/моль*К=0,0821 л*атм/моль К
314 Дж/моль*К=0,0821 л*атм/моль К
Объем одного моля газа V=RT/P=8.314*273.15/101.325=22.413 л/моль, где Т и Р – значение температуры (К) и давления при нормальных условиях.
Рис. 2. Таблица молярных объемов.
Закон Авогадро
В 1811 году А. Авогадро выдвинул гипотезу, что в равных объемах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковой число молекул. Позже гипотеза подтвердилась и стала законом, носящим имя великого итальянского ученого.
Рис. 3. Амедео Авогадро.
Закон становится понятен, если вспомнить, что в газообразном виде расстояние между частицами несопоставимо больше, чем размеры самих частиц.
Таким образом, из закона Авогадро можно сделать следующие выводы:
- В равных объёмах любых газов, взятых при одной и той же температуре и при одном и том же давлении, содержится одно и то же число молекул.
- 1 моль совершенно различных газов при одинаковых условиях занимает одинаковый объем.

- Один моль любого газа при нормальных условиях занимает объем 22,41 л.
Следствие из закона Авогадро и понятие молярного объема основаны на том, что моль любого вещества содержит одинаковое число частиц (для газов – молекул), равное постоянной Авогадро.
Чтобы узнать число молей растворенного вещества содержится в одном литре раствора, необходимо определить молярную концентрацию вещества по формуле c=n/V, где n – количество растворенного вещества, выражаемое в молях, V – объем раствора, выражаемый в литрах С – молярность.
Что мы узнали?
В школьной программе по химии 8 класса изучается тема «Молярный объем». В одном моле газа всегда содержится одинаковый объем, равный 22,41 кубический метр/моль. Этот объем называется молярным объемом газа.
Тест по теме
Оценка доклада
Средняя оценка: 4.2 . Всего получено оценок: 64.
Для того, чтобы узнать состав любых газообразных веществ необходимо уметь оперировать такими понятиями, как молярный объем, молярная масса и плотность вещества. В данной статье рассмотрим, что такое молярный объем, и как его вычислить?
В данной статье рассмотрим, что такое молярный объем, и как его вычислить?
Количество вещества
Количественные расчеты проводят с целью, чтобы в реальности осуществить тот или иной процесс или узнать состав и строение определенного вещества. Эти расчеты неудобно производить с абсолютными значениями массы атомов или молекул из-за того, что они очень малы. Относительные атомные массы также в большинстве случаев невозможно использовать, так как они не связаны с общепринятыми мерами массы или объема вещества. Поэтому введено понятие количество вещества, которое обозначается греческой буквой v (ню) или n. Количество вещества пропорционально числу содержащихся в веществе структурных единиц (молекул, атомных частиц).
Единицей количества вещества является моль.
Моль – это такое количество вещества, которое содержит столько же структурных единиц, сколько атомов содержится в 12 г изотопа углерода.
Масса 1 атома равна 12 а. е. м., поэтому число атомов в 12 г изотопа углерода равно:
Na= 12г/12*1,66057*10в степени-24г=6,0221*10 в степени 23
Физическая величина Na называется постоянной Авогадро. Один моль любого вещества содержит 6,02*10 в степени 23 частиц.
Один моль любого вещества содержит 6,02*10 в степени 23 частиц.
Рис. 1. Закон Авогадро.
Молярный объем газа
Молярный объем газа – это отношение объема вещества к количеству этого вещества. Эту величину вычисляют при делении молярной массы вещества на его плотность по следующей формуле:
где Vm – молярный объем, М – молярная масса, а p – плотность вещества.
Рис. 2. Молярный объем формула.
В международной системе Си измерение молярного объема газообразных веществ осуществляется в кубических метрах на моль (м 3 /моль)
Молярный объем газообразных веществ отличается от веществ, находящихся в жидком и твердом состоянии тем, что газообразный элемент количеством 1 моль всегда занимает одинаковый объем (если соблюдены одинаковые параметры).
Объем газа зависит от температуры и давления, поэтому при расчетах следует брать объем газа при нормальных условиях. Нормальными условиями считается температура 0 градусов и давление 101,325 кПа. Молярный объем 1 моля газа при нормальных условиях всегда одинаков и равен 22,41 дм 3 /моль. Этот объем называется молярным объемом идеального газа. То есть, в 1 моле любого газа (кислород, водород, воздух) объем равен 22,41 дм 3 /м.
Молярный объем 1 моля газа при нормальных условиях всегда одинаков и равен 22,41 дм 3 /моль. Этот объем называется молярным объемом идеального газа. То есть, в 1 моле любого газа (кислород, водород, воздух) объем равен 22,41 дм 3 /м.
Рис. 3. Молярный объем газа при нормальных условиях.
Таблица «молярный объем газов»
В следующей таблице представлен объем некоторых газов:
| Газ | Молярный объем, л |
| H 2 | 22,432 |
| O 2 | 22,391 |
| Cl 2 | 22,022 |
| CO 2 | 22,263 |
| NH 3 | 22,065 |
| SO 2 | 21,888 |
| Идеальный | 22,41383 |
Что мы узнали?
Молярный объем газа, изучаемый по химии (8 класс) наряду с молярной массой и плотностью являются необходимыми величинами для определения состава того или иного химического вещества. Особенностью молярного газа является то, что в одном моле газа всегда содержится одинаковый объем. Этот объем называется молярным объемом газа.
Особенностью молярного газа является то, что в одном моле газа всегда содержится одинаковый объем. Этот объем называется молярным объемом газа.
Тест по теме
Оценка доклада
Средняя оценка: 4.3 . Всего получено оценок: 182.
Урок 1.
Тема: Количество вещества. Моль
Химия – это наука о веществах. А как измерять вещества? В каких единицах? В молекулах, из которых состоят вещества, но сделать это очень сложно. В граммах, килограммах или миллиграммах, но так измеряют массу. А что если объединить массу, которую измеряют на весах и число молекул вещества, возможно ли это?
а) H-водород
А н = 1а.е.м.
1а.е.м = 1,66*10 -24 г
Возьмем 1г водорода и подсчитаем количество атомов водорода в этой массе (предложите это сделать ученикам с помощью калькулятора).
N н = 1г / (1,66*10 -24) г = 6,02*10 23
б) O-кислород
А о = 16а.е.м = 16*1.67* 10 -24 г
N o = 16г / (16 *1.66 * 10 -24) г =6,02 * 10 23
в) C-углерод
А с = 12а.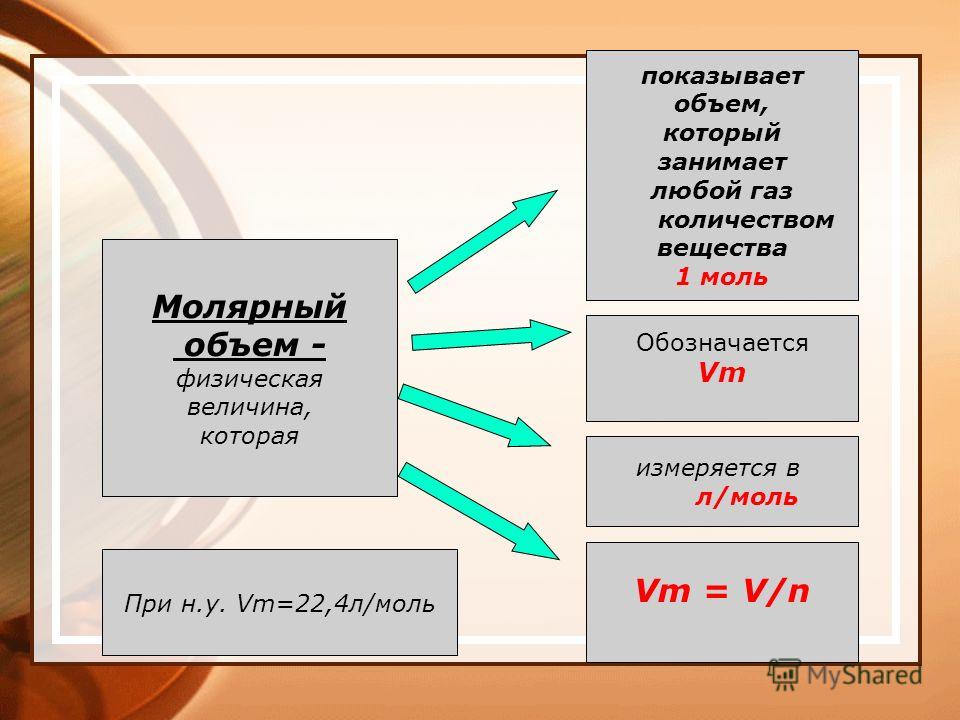 е.м = 12*1.67*10 -24 г
е.м = 12*1.67*10 -24 г
N c = 12г / (12* 1.66*10 -24) г = 6,02*10 23
Сделаем вывод: если мы возьмем такую массу вещества, которая равна атомной массе по величине, но взята в граммах, то там будет всегда (для любого вещества) 6.02 *10 23 атомов этого вещества.
H 2 O — вода
18г / (18* 1.66*10 -24) г =6,02*10 23 молекул воды и т.д.
N а = 6,02*10 23 — число или постоянная Авогадро .
Моль — количество вещества, в котором содержится 6,02 *10 23 молекул, атомов или ионов, т.е. структурных единиц.
Бывает моль молекул, моль атомов, моль ионов.
n – число молей,(число молей часто обозначают- ню),
N — число атомов или молекул,
N а = постоянная Авогадро.
Кмоль = 10 3 моль, ммоль = 10 -3 моль.
Показать портрет Амедео Авогадро на мультимедийной установке и кратко рассказать о нем, или поручить ученику подготовить небольшой доклад о жизни учёного.
Урок 2.
Тема « Молярная масса вещества»
Чему же равна масса 1 моля вещества? (Вывод учащиеся часто могут сделать сами. )
)
Масса одного моля вещества равна его молекулярной массе, но выражена в граммах. Масса одного моля вещества называется молярной массой и обозначается – M.
Формулы:
М — молярная масса,
n — число молей,
m — масса вещества.
Масса моля измеряется в г/моль, масса кмоля измеряется в кг/кмоль, масса ммоля измеряется в мг/моль.
Заполнить таблицу (таблицы раздаются).
Вещество | Число молекул | Молярная масса | Число молей | Масса вещества |
5моль | ||||
Н 2 SO 4 | ||||
12 ,0 4*10 26 |
Урок 3.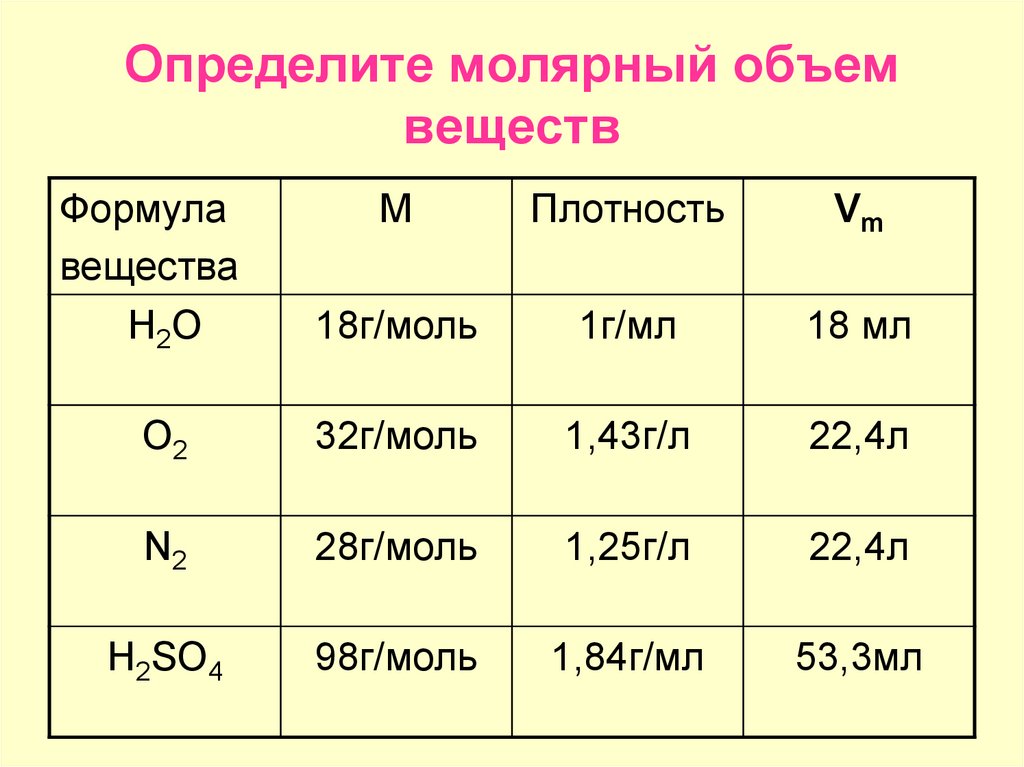
Тема: Молярный объем газов
Решим задачу. Определите объем воды, масса которой при нормальных условиях 180 г.
Дано:
Т.е. объем жидких и твердых тел считаем через плотность.
Но, при расчёте объёма газов не обязательно знать плотность. Почему?
Итальянский ученый Авогадро определил, что в равных объемах различных газов при одинаковых условиях (давлении, температуре) содержится одинаковое число молекул — это утверждение называется законом Авогадро.
Т.е. если при равных условиях V(H 2) =V(O 2) , то n(H 2) =n(O 2), и наоборот если при равных условиях n(H 2) =n(O 2) то и объемы этих газов будут одинаковы. А моль вещества всегда содержит одно и тоже число молекул 6,02 *10 23 .
Делаем вывод – при одинаковых условиях моли газов должны занимать один и тот же объем.
При нормальных условиях (t=0, P=101,3 кПа. или 760 мм рт. ст.) моли любых газов занимают одинаковый объем. Этот объем называется молярным.
V m =22,4 л/моль
1кмоль занимает объём -22,4 м 3 /кмоль,
1ммоль занимает объем -22,4 мл/ммоль.
Пример 1. (Решается на доске):
Пример 2. (Можно предложить решить ученикам):
| Дано: | Решение: |
m(H 2)=20г |
Предложить учащимся заполнить таблицу.
Вещество | Число молекул | Масса вещества | Число молей | Молярная масса | Объем |
10.
 6: Гипотеза Авогадро и молярный объем
6: Гипотеза Авогадро и молярный объем- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 53770
Как аквалангисты узнают, кончится ли у них бензин?
Знание количества газа, доступного для погружения, имеет решающее значение для выживания дайвера. Баллон на спине дайвера оснащен датчиками, показывающими, сколько газа присутствует и какое давление. Базовые знания о поведении газа позволяют дайверу оценить, как долго он может оставаться под водой без возникновения проблем.
Гипотеза Авогадро и молярный объем
Объем — это третий способ измерения количества материи после подсчета предметов и массы. У жидкостей и твердых тел объем сильно различается в зависимости от плотности вещества. Это связано с тем, что твердые и жидкие частицы упакованы близко друг к другу с очень небольшим пространством между частицами. Однако газы в основном состоят из пустых пространств между реальными частицами газа (см. рисунок ниже).
Рисунок \(\PageIndex{2}\): Частицы газа очень малы по сравнению с большим количеством пустого пространства между ними. (Источник: Christopher Auyeung; Источник: CK-12 Foundation; Лицензия: CC BY-NC 3.0 (opens in new window)) В 1811 году Амадео Авогадро объяснил, что объемы всех газов можно легко определить. Гипотеза Авогадро утверждает, что равные объемы всех газов при одинаковых температуре и давлении содержат равное количество частиц. Поскольку общий объем, который занимает газ, состоит в основном из пустого пространства между частицами, фактический размер самих частиц почти незначителен. Заданный объем газа с небольшими легкими частицами, такими как водород \(\left( \ce{H_2} \right)\), содержит такое же количество частиц, как и такой же объем тяжелого газа с крупными частицами, такими как гексафторид серы, \(\ce{SF_6}\).
Заданный объем газа с небольшими легкими частицами, такими как водород \(\left( \ce{H_2} \right)\), содержит такое же количество частиц, как и такой же объем тяжелого газа с крупными частицами, такими как гексафторид серы, \(\ce{SF_6}\).
Газы сжимаемы, а это означает, что под высоким давлением частицы сближаются. Это уменьшает количество пустого пространства и уменьшает объем газа. Объем газа также зависит от температуры. Когда газ нагревается, его молекулы движутся быстрее, и газ расширяется. Из-за изменения объема газа из-за изменений давления и температуры сравнение объемов газа необходимо проводить при стандартной температуре и давлении. Стандартная температура и давление (СТП) 9{23}\) частиц. Однако масса каждого газа различна и соответствует молярной массе этого газа: \(4,00 \: \text{г/моль}\) для \(\ce{He}\), \(28,0 \:\ text{г/моль}\) для \(\ce{N_2}\) и \(16,0 \: \text{г/моль}\) для \(\ce{CH_4}\).
Рисунок \(\PageIndex{4}\): Гипотеза Авогадро утверждает, что равные объемы любого газа при одинаковых температуре и давлении содержат одинаковое количество частиц. При стандартной температуре и давлении 1 моль любого газа занимает \(22,4 \: \text{L}\). (Источник: Christopher Auyeung; Источник: CK-12 Foundation; Лицензия: CC BY-NC 3.0 (откроется в новом окне))
При стандартной температуре и давлении 1 моль любого газа занимает \(22,4 \: \text{L}\). (Источник: Christopher Auyeung; Источник: CK-12 Foundation; Лицензия: CC BY-NC 3.0 (откроется в новом окне)) Резюме
- Равные объемы газов при одинаковых условиях содержат одинаковое количество частиц.
- Стандартная температура и давление сокращенно (STP).
- Стандартная температура 0°C (273,15 K), стандартное давление 1 атм.
- При нормальных условиях один моль любого газа занимает объем 22,4 л
Обзор
- Контейнер заполнен газом, что мы знаем о пространстве, фактически занимаемом газом?
- Почему мы должны проводить все наши сравнения при одной и той же температуре и давлении?
- При стандартной температуре и давлении 1 моль газа всегда равен количеству литров?
Эта страница под названием 10. 6: Гипотеза и молярный объем Авогадро распространяется под лицензией CK-12 и была создана, изменена и/или курирована Фондом CK-12 через исходный контент, отредактированный в соответствии со стилем и стандартами платформы LibreTexts. ; подробная история редактирования доступна по запросу.
6: Гипотеза и молярный объем Авогадро распространяется под лицензией CK-12 и была создана, изменена и/или курирована Фондом CK-12 через исходный контент, отредактированный в соответствии со стилем и стандартами платформы LibreTexts. ; подробная история редактирования доступна по запросу.
ЛИЦЕНЗИЯ ПОД
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Фонд CK-12
- Лицензия
- СК-12
- Программа OER или Publisher
- СК-12
- Показать страницу TOC
- № на стр.

- Теги
- источник@https://flexbooks.ck12.org/cbook/ck-12-chemistry-flexbook-2.0/
Расчет молярного объема газа Учебное пособие по химии
Расчет молярного объема газа Учебное пособие по химииКлючевые понятия
- 1 моль идеального газа (1) занимает определенный объем при определенной температуре и давлении.
- Это называется молярным объемом газа и обозначается символом V м
- Наиболее часто используемые единицы измерения молярного объема газа, V м , это литры на моль, л моль -1
- Примеры молярного объема для идеальных газов (V м ) приведены в таблице ниже:
Температура Давление Молярный объем газа °С (К) кПа (атм) (В м )/л моль -1 0°C (273,15К) 100 кПа (0,987 атм) 22,71 25°C (298,15 К) 100 кПа (0,987 атм) 24,79 0 °C (273,15 K) и 100 кПа (0,987 атм) известны как стандартные температура и давление и часто обозначаются аббревиатурой STP (2)
.
25°C (298,15 K) и 100 кПа (0,987 атм) иногда называют стандартной температурой и давлением окружающей среды, SATP, или даже стандартными лабораторными условиями, SLC. (3)
- Расчеты с молярными объемами газа:
н (газ) = моли идеального газа
V(газ) = объем идеального газа (при определенной температуре и давлении)
В м = молярный объем идеального газа (при определенных температуре и давлении)
Для расчета молей газа: н(газ) = В (газ)
В мДля расчета объема газа: В(газ) = н(газ) × V м
Пожалуйста, не блокируйте рекламу на этом сайте.
Нет рекламы = нет денег для нас = нет бесплатных вещей для вас!
Молярный объем газа (V
м ) Концепция Молярный объем идеального газа, V м , равен , определяемому как объем 1 моля идеального газа при заданных температуре и давлении.
Молярный объем газа, V м , следовательно, представляет собой объем газа на моль газа, поэтому единицы молярного объема газа:
единица объема/моль
или
единица объема ÷ моль
Метрическая единица (4) для объема — литр, л, поэтому молярный объем газа — это объем в л ÷ моль
| В м дюйм л моль -1 | = | объем газа в литрах 1 моль газа | (при указанной температуре и давлении) |
Мы можем использовать это соотношение для молярного объема идеального газа (V м ) написать уравнение для объема (V в литрах) любого количества газа (n в молях)
| В м дюйм л моль -1 | = | объем газа в литрах объем газа в молях | (при указанной температуре и давлении) |
| В м дюйм л моль -1 | = | V (л) n (моль) | (при указанной температуре и давлении) |
Чтобы использовать это соотношение, нам нужно знать V m .
Ниже приведен список некоторых способов описания условий, при которых V м составляет 22,71 л.
В м = 22,71 л моль -1 при 0°C и 100 кПа
В м = 22,71 л моль -1 при 273,15 К и 100 кПа
В м = 22,71 л моль -1 при стандартной температуре и давлении
В м = 22,71 л моль -1 при нормальных условиях
Когда V м = 22,71 л моль -1 , соотношение между объемом газа V (л) и количеством газа n (моль) становится следующим:
| В м дюйм л моль -1 | = | V (L) n (моль) | (на СТП) | |
| 22,71 л моль -1 | = | V (L) n (моль) | (на СТП) |
Это математическое уравнение можно преобразовать, чтобы найти объем известного количества газа, умножив обе части уравнения на количество газа в молях, n (моль),
| n ( | = | В (л) × | (на СТП) | |
| n × 22,71 | = | В (Д) | (на СТП) |
Это соотношение показывает нам, что если мы увеличим количество молей газа n, добавив больше газа при сохранении той же температуры и давления, объем газа V также увеличится.
Аналогичным образом, если мы уменьшим количество молей газа n, удалив часть газа при сохранении той же температуры и давления, объем газа V также уменьшится.
Приведенное выше математическое уравнение можно преобразовать, чтобы найти количество газа в молях, учитывая его объем в литрах, путем деления обеих частей уравнения на молярный объем газа (22,71 л моль -1 на СТП),
| n (моль) × | = | В ( 22,71 ( | (на СТП) | ||
| н (моль) | = | В 22,71 | (на СТП) | ||
Это соотношение показывает нам, что единственный способ увеличить объем газа V при сохранении той же температуры и давления — это увеличить количество молей газа n, которые присутствуют, то есть добавить больше газа.
Точно так же единственный способ уменьшить объем газа V при сохранении той же температуры и давления — это уменьшить количество молей газа n, которые присутствуют, то есть удалить часть газа.
Рабочие примеры расчета молей газа с использованием молярного объема газа
Рабочий пример 1. Образец чистого газообразного гелия занимает объем 6,8 л при 0°C и 100 кПа.
Сколько молей газообразного гелия содержится в образце?
- Какой вопрос просит вас сделать?
Рассчитайте количество молей газообразного гелия.
n(He (g) ) = моли газообразного гелия = ? моль
- Какая информация (данные) была дана в вопросе?
В (He (г) ) = объем газообразного гелия = 6,8 л.
Условия: STP (стандартная температура и давление, 0°C и 100 кПа)
So V м = молярный объем газа = 22,71 л моль -1 (имеется в паспорте)
- Проверить согласованность в единицах измерения, все тома в одних и тех же единицах измерения?
В(He (г) ) дается в л
В м дается в л (моль -1 )
Оба объема выражены в одних и тех же единицах измерения, л, поэтому преобразование не требуется.

- Какая связь между молями газообразного гелия и объемом газообразного гелия при заданных температуре и давлении?
н(Не (г) ) (моль) = В(Не (г) )
В м - Подставьте значения в уравнение и решите моли газообразного гелия:
n(He (г) ) (моль) = 6,8
22,71(на СТП) = 0,30 моль (на СТП)
Рабочий пример 2: Образец газообразного азота N 2(g) имеет объем 956 мл при 273,15 К и 100 кПа.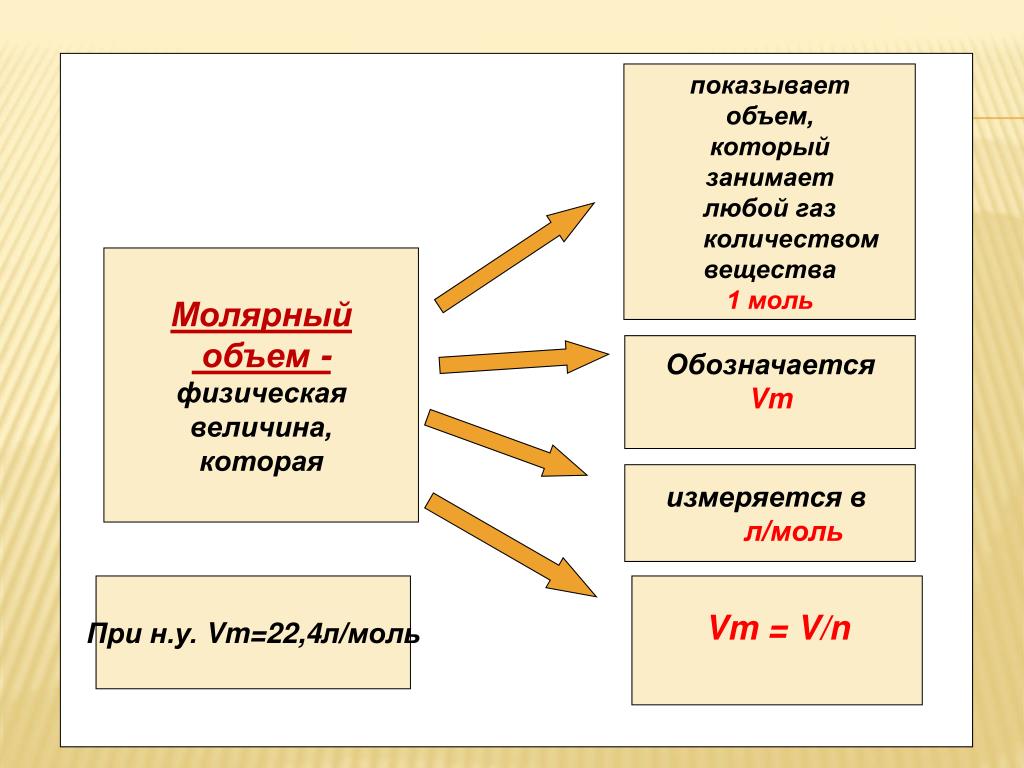
Сколько молей газообразного азота содержится в образце?
- Какой вопрос просит вас сделать?
Рассчитайте количество молей газообразного азота.
n(N 2(g) ) = моли газообразного азота = ? моль
- Какая информация была дана в вопросе?
V(N 2(g) ) = объем газообразного азота = 956 мл
Условия: 273,15 К и 100 кПа (стандартная температура и давление, STP)
So, V м = молярный объем газа = 22,71 л моль -1 (имеется в паспорте)
- Проверить согласованность в единицах измерения, все тома в одних и тех же единицах измерения?
V(N 2(g) ) дается в мл
В м дается в л (моль -1 )
Переведите объем газа, V(N 2(g) ), из объема в миллилитрах, мл, в объем в литрах, л.
V(N 2(g) ) = 956 мл = 956 мл ÷ 1000 мл л -1 = 956 × 10 -3 л = 0,956 л
- Какая связь между молями газообразного азота и объемом газообразного азота при заданных температуре и давлении?
н(N 2(г) ) (моль) = В(N 2(г) )
В м - Подставьте значения в уравнение и решите для молей газообразного азота:
н(N 2(г) ) (моль) = 0,956
22,71(на СТП) = 0,0421 моль (на СТП)
Рабочие примеры расчета объема газа с использованием молярного объема газа
Рабочий пример 1. Баллон содержит 0,50 моль чистого газообразного гелия при стандартной температуре и давлении.
Баллон содержит 0,50 моль чистого газообразного гелия при стандартной температуре и давлении.
Каков объем воздушного шара?
- Какой вопрос просит вас сделать?
Рассчитайте объем газообразного гелия в баллоне.
В(Не (г) ) = объем газообразного гелия = ? л
- Какая информация (данные) была дана в вопросе?
н (Не (г) ) = моли газообразного гелия = 0,50 моль
Условия: стандартная температура и давление (STP, 0°C и 100 кПа)
So V м = молярный объем газа = 22,71 л моль -1
- Согласованы ли единицы измерения?
n(He (g) ) в молях
В м в молях на литр
Таким образом, единицы измерениясогласованы и не требуют преобразования.
- Каково соотношение между объемом газообразного гелия V(He (г) ) и молями газообразного гелия n(He (г) ) при заданных температуре и давлении?
В(Не (г) ) = n(He (г) ) × V м
- Подставьте значения и найдите объем газообразного гелия:
V(He (г) ) = n(He (г) ) × 22,71 (при СТП)
= 0,50 × 22,71
= 11,4 л
Рабочий пример 2. Какой объем занимают 3,70 моля N 2 газ на СТП?
Какой объем занимают 3,70 моля N 2 газ на СТП?
- Какой вопрос просит вас сделать?
Рассчитайте объем газа N 2 .
V(N 2(г) ) = объем газа N 2 = ? л
- Какая информация (данные) была дана в вопросе?
n(N 2(г) ) = моли газа N 2 = 3,70 моль
9Условия 0025: STP (стандартная температура и давление, 0°C и 100 кПа)So, V м = молярный объем газа = 22,71 л моль -1 (имеется в паспорте)
- Согласованы ли единицы измерения?
количество N 2(г) газа, n(N 2(г) ), указано в молях
молярный объем газа, V м дано в молях на литр
Единицы согласованы, поэтому преобразование не требуется.
- Какая связь между объемом газа N 2 , V(N 2(г) ), и молями газа N 2 , n(N 2(г) ), при заданной температуре и давление?
V(N 2(g) ) = n(N 2(g) ) × V м
- Подставьте значения и найдите объем газообразного азота:
V(N 2(g) ) = n(N 2(g) ) × 22,71 (при НТП)
= 3,70 × 22,71
= 84,0 л
Решение задач с использованием молярного объема газа
Проблема: Химик Крис работает в лаборатории, в которой поддерживается постоянная температура 25°C, а давление всегда равно 100 кПа. Крису нужно проанализировать немного карбоната кальция, CaCO 3 (s), чтобы определить, является ли он чистым или загрязненным.
Крис проанализирует карбонат кальция, взяв небольшой образец 0,00500 моль и добавляя к нему соляную кислоту, HCl (водн.), до тех пор, пока весь карбонат кальция не исчезнет и больше не будет образовываться углекислый газ, CO 2 (г).
По мере добычи газ будет собираться водовытесняющим методом.
Крису нужно проанализировать немного карбоната кальция, CaCO 3 (s), чтобы определить, является ли он чистым или загрязненным.
Крис проанализирует карбонат кальция, взяв небольшой образец 0,00500 моль и добавляя к нему соляную кислоту, HCl (водн.), до тех пор, пока весь карбонат кальция не исчезнет и больше не будет образовываться углекислый газ, CO 2 (г).
По мере добычи газ будет собираться водовытесняющим методом.
Известно, что сбалансированное химическое уравнение этой реакции выглядит следующим образом:
CaCO 3 (т) + 2HCl(водн.) → CaCl 2 (водн.) + CO 2 (г) + H 2 O(л)
Если образец чистый, какой объем углекислого газа будет собран?
Решение проблемы с использованием модели StoPGoPS для решения проблемы:
| Сформулируйте вопрос. | Какой вопрос просит вас сделать? Определите объем углекислого газа, если карбонат кальция чистый. V(CO 2(g) ) = объем углекислого газа = ? л | |
| План. | Какой химический принцип вам нужно применить? Применение стехиометрии (V (г) = n (г) × V м ) Какую информацию (данные) вам предоставили? Какие шаги необходимо предпринять для решения проблемы? Этап 1: Расчет количества молей углекислого газа, CO 2 (г), произведенного Предположим, что CaCO 3 имеет 100% чистоту (без примесей). Используйте сбалансированное химическое уравнение для определения количества молей CO 2 произведенного CaCO 3 (т) + 2HCl(водн.) → CaCl 2 (водн.) + CO 2 (г) + H 2 O(л) Этап 2: Расчет объема CO 2 (г) Предположим, что потери CO 2 (g) отсутствуют, т. V(CO 2(g) ) = n(CO 2(g) ) × V m | |
| Следуйте плану. | Этап 1: Расчет количества молей углекислого газа, CO 2 (г), произведенного Предположим, что CaCO 3 имеет 100% чистоту (без примесей). Используйте сбалансированное химическое уравнение для определения молей CO 2 произведено CaCO 3 (т) + 2HCl(водн.) → CaCl 2 (водн.) + CO 2 (г) + H 2 O(л) Шаг 2: Рассчитать объем CO 2 (г) Предположим, что потери CO 2 (g) отсутствуют, т. V(CO 2(g) ) = n(CO 2(g) ) × V m | |
| Подумайте о правдоподобии. | Вы ответили на заданный вопрос? Да, мы определили объем углекислого газа, который будет собираться. Разумно ли ваше решение вопроса? При 25°C и 100 кПа объем 1 моля газа составит 24,79 л (V m из техпаспорта) Мы достаточно уверены, что наше решение проблемы правильное. | |
| Укажите решение. | Какой объем углекислого газа будет собран, если образец представляет собой чистый карбонат кальция? В(CO 2(г) ) = 0,124 л при 25°C и 100 кПа. |
Сноски:
(1) Вы можете использовать уравнение идеального газа PV = nRT, чтобы найти объем 1 моля идеального газа (молярный объем газа) при 100 кПа и других температурах.
(2) До 1982 г. стандартные температура и давление определялись как 0°C (273,15 K) и 1 атм (101,3 кПа), поэтому 1 моль газа занимает объем 22,41 л.
(3) При 25°C (298,15 K) и 1 атм (101,3 кПа) 1 моль газа занимает объем 24,47 л.
(4) Литр является метрической единицей, но не базовой единицей СИ. Единицей объема в СИ будет кубический метр (м 3 ).
Первоначально 1 л определялся как объем, занимаемый 1 кг воды при температуре 3,98°С.
В 1964 году 1 л был переопределен как один кубический дециметр (дм 3 ), поэтому теперь это производная единица СИ ( 1 л = 1 дм 3 ).
Полезно отметить, что это означает, что 1 мл = 1 см 3
www.ausetute.com.au
Каков молярный объем газа при СТП?
от sastry
Каков молярный объем газа при СТП?
Моль и объем газа
- Довольно сложно определить количество молей газа, взвешивая его массу. Химики определяют число молей любого газа , измеряя его объем. Однако это невозможно сделать для твердых и жидких тел.

- Установлено, что при одинаковых температуре и давлении в равных объемах всех газов содержится одинаковое число частиц. Поэтому химики ввели понятие молярного объема.
- Молярный объем газа определяется как объем одного моля газа.
- Таким образом, молярный объем — это также объем, занимаемый 6,02 x 10 23 частицами газа.
- Молярный объем любого газа 22,4 дм 3 моль -1 при нормальных условиях или 24 дм 3 моль -1 при комнатных условиях.
Примечание: STP относится к стандартной температуре 0°C и давлению 1 атмосфера. Комнатные условия относятся к температуре 25°C и давлению 1 атмосфера. - Это означает, что один моль любого газа занимает при нормальных условиях один и тот же объем, который составляет 22,4 дм 3 . В комнатных условиях один моль любого газа занимает 24 дм 3 .
Рисунок вверху Каждый из этих шаров содержит 6,02 x 10 23 молекул газа.
- Следующее соотношение показывает, как объем газа может быть преобразован в число молей и наоборот.
- При расчетах следите за тем, чтобы объем газа и молярный объем были в одной и той же единице, то есть оба были в см 3 или оба в дм 3 . Помните, 1 дм 3 = 1000 см 3
Люди также спрашивают
- Что такое относительная атомная масса и относительная молекулярная масса элемента?
- Что такое один моль и сколько частиц содержится в моле?
- Как рассчитать молярную массу вещества?
- Как узнать порядок элементов в химической формуле
- Что такое эмпирическая и молекулярная формулы?
- Как написать химическое уравнение?
Моль и объем газа Задачи с решениями
1. Каков объем 0,4 моля углекислого газа на СТП?
[Молярный объем: 22,4 дм 3 моль -1 при ст. ст. 2 = количество молей CO 2 x молярный объем при стандартной температуре
ст. 2 = количество молей CO 2 x молярный объем при стандартной температуре
= 0,4 x 22,4 дм 3 = 8,96 дм 3
2. Найти число молей газообразного аммиака, содержащегося в пробе 60 см 3 газа при комнатных условиях. [Молярный объем: 24 дм 3 моль -1 при комнатных условиях]
Решение:
Связь между молями, количеством частиц, массой и объемом
моли, количество частиц, масса и объем газов.
В большинстве расчетов мы сначала преобразуем другие величины, такие как количество частиц, массу или объем, в количество молей (см. Таблицу).
Table: Summary of steps in calculations involving the number of moles
| Conversion | Steps |
| From mass to volume | Mass → number of moles → volume |
| From объем к массе | Объем → число молей → масса |
| От объема к количеству частиц | Объем → количество молей → количество частиц |
| От количества частиц к объему | Количество частиц → количество молей → объем |
1. Каков объем 12 г метана при СТП?
Каков объем 12 г метана при СТП?
[Относительная атомная масса: H, 1; С, 12. Молярный объем: 22,4 дм 3 моль -1 при СТП]
Раствор:
2. Пробу 120 см 3 углекислого газа отбирают при комнатных условиях в эксперименте. Рассчитайте массу образца углекислого газа.
[Относительная атомная масса: C, 12; O, 16. Молярный объем: 24 дм 3 моль -1 при комнатных условиях]
Раствор:
Учитывая объем углекислого газа, CO 2 = 120 см 3 = 120/1000 DM 3 = 0,12 дм 3
Следовательно, масса CO 2 = число молей CO 2 × Molar Mass of CO 2 = 0.005 = 0.005 = 0146 ×. + 2(16)]
= 0,005 × 44
= 0,22 г
3. Сколько молекул водорода содержится в 6 дм 3 газообразного водорода при комнатных условиях? [Молярный объем: 24 дм 3 моль -1 в комнатных условиях.






 е. весь производимый газ собирается.
е. весь производимый газ собирается.  е. весь производимый газ собирается.
е. весь производимый газ собирается.  25 л
25 л 
