Оксиды — что это такое? Химические свойства и классификация
Поможем понять и полюбить химию
Начать учиться
Знакомство с оксидами обычно начинается на уроках химии в 8 классе. Из этой статьи вы узнаете, что такое оксиды в химии, их классификацию и свойства, а также способы получения.
Определение оксидов
Оксиды — это сложные вещества, состоящие из двух химических элементов (т. е. бинарные соединения), один из которых — кислород в степени окисления −2.
Общая формула оксидов: ЭxOy, где Э – химический элемент, а x и y — индексы, определяемые степенью окисления химических элементов.
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой.
Виды оксидов
Все оксиды делятся на солеобразующие и несолеобразующие.
Несолеобразующие оксиды — это оксиды, которые не взаимодействуют с кислотами и щелочами, то есть не способны образовать соли.
К несолеобразующим оксидам относят: CO, SiO, N2O, NO.
Солеобразующие оксиды — это оксиды, которые взаимодействуют с кислотами и щелочами с образованием солей.
Солеобразующие оксиды делятся на три группы:
Основные оксиды — это оксиды, образованные металлами со степенью окисления +1 или +2.
Примеры основных оксидов: Na+12O, Ca+2O, Ba+2O.
Амфотерные оксиды — оксиды, образованные металлами со степенью окисления +3 или +4.

К амфотерным оксидам относят также: ZnO, BeO, PbO, SnO.
Несмотря на то, что эти металлы проявляют степень окисления +2 в данных соединениях, их оксиды проявляют амфотерные свойства.
Примеры амфотерных оксидов: Al+32O3, Fe2+3O3.
Кислотные оксиды — оксиды, образованные металлами с валентностью V и более или неметаллами с любой валентностью (за исключением несолеобразующих оксидов, то есть CO, SiO, N2O, NO).
Примеры кислотных оксидов: S+6O3, N2+5O5, Mn2+7O7.
Если один и тот же химический элемент образовывает несколько оксидов, то с увеличением степени окисления основные свойства оксидов ослабевают и усиливаются кислотные.
Например:
CrO (оксид хрома (II)) — проявляет основные свойства;
Cr2O3 (оксид хрома (III)) — проявляет амфотерные свойства;
CrO3 (оксид хрома (VI)) — проявляет кислотные свойства.

Закрепим знания о типах оксидов, изучив схему:
Номенклатура оксидов
Названия оксидов строятся по систематической номенклатуре следующим образом:
Пишем слово «оксид».
Указываем название второго химического элемента в родительном падеже.
Если этот элемент имеет переменную валентность, то указываем валентность элемента в этом соединении в скобках римской цифрой.
Примеры названий оксидов:
Fe2O3 — оксид железа (III). Читается: феррум два о три.
Na2O — оксид натрия. Читается: натрия два о.
SO3 — оксид серы (VI). Читается: эс о три.

До появления систематической номенклатуры вещества называли по присущим им специфическим свойства (цвету, запаху и т. д.). Такой способ названия веществ — тривиальная номенклатура. Некоторые названия используются и сейчас.
Названия некоторых оксидов: таблица
Химическая формула оксида | Бытовое (тривиальное название) | Возможное научное название |
|---|---|---|
| H2O | Вода | Оксид водорода |
| CO2 | Углекислый газ | Оксид углерода (IV), диоксид углерода |
| CO | Угарный газ | Оксид углерода (II), монооксид углерода |
| SO3 | Серный газ | Оксид серы (VI), триоксид серы |
| SO2 | Сернистый газ | Оксиды серы (IV), диоксид серы |
| SiO2 | Кварц, горный хрусталь, песок кварцевый, речной и морской | Оксид кремния |
| Al2O3 | Глинозем | Оксид алюминия |
| Fe2O3 | Гематит (крокус) | Оксид железа (III) |
| CaO | Негашеная известь | Оксид кальция |
Химические свойства основных оксидов
1.
 Взаимодействие с водой
Взаимодействие с водойС водой способны реагировать оксиды тех металлов, которым соответствуют растворимые гидроксиды. То есть с водой реагируют только оксиды щелочных и щелочноземельных металлов.
Основный оксид + вода = основание Например: Na2O + H2O = 2NaOH |
|---|
Оксид магния взаимодействует с водой только при нагревании.
2. Взаимодействие с кислотными оксидами и кислотами
Основные оксиды, соответствующие щелочам, взаимодействуют со всеми кислотными оксидами и кислотами. Оксиды неактивных металлов взаимодействуют только с кислотными оксидами, соответствующими сильным кислотам, или с сильными кислотами.
Основный оксид + кислотный оксид = соль Например: BaO + SO3 = BaSO4 Основный оксид + кислота = соль + вода Например: Mg(OH)2 + 2HNO3 = Mg(NO 3)2 + 2H2O |
|---|
3.
 Взаимодействие с амфотерными оксидами
Взаимодействие с амфотерными оксидамиВ эту реакцию могут вступать только основные оксиды щелочных или щелочноземельных металлов. При сплавлении двух оксидов образуется соль.
Основный оксид + амфотерный оксид = соль Например: Na2O + Al2O3 = NaAlO2 |
|---|
Как составлять такие соли: металл в этой соли берем из основного оксида, а кислотный остаток из амфотерного оксида (они проявляют более кислотные свойства).
Химические свойства кислотных оксидов
1. Взаимодействие с водой
Кислотный оксид + вода = кислота Например: SO3 + H2O = H2SO4 |
|---|
2.
 Взаимодействие с основными оксидами и щелочами
Взаимодействие с основными оксидами и щелочамиКислотные оксиды сильных кислот способны взаимодействовать с любыми основными оксидами или основаниями.
Кислотный оксид + основный оксид = соль Например: SO3 + CuO = CuSO4 Кислотный оксид + основание = соль + вода Например: N2O5 + 2NaOH = 2NaNO3 + H2O |
|---|
Кислотные оксиды, соответствующие слабым кислотам (такие как CO2, SO2), способны взаимодействовать с основными оксидами, соответствующим щелочам, а также с щелочами.
3. Взаимодействие с амфотерными оксидами и гидроксидами
С амфотерными оксидами в реакцию вступают кислотные оксиды — как правило, сильных кислот.
Кислотный оксид + амфотерный оксид = соль Например: SO3 + Al2O3 = Al2(SO4)3 Например: SO3 + Al(OH)3 = Al2(SO4)3 + H2O |
|---|
Химические свойства амфотерных оксидов
1. Взаимодействие с водой
Амфотерные оксиды не взаимодействуют с водой — даже при нагревании!
Амфотерный оксид + вода ≠ |
|---|
2. Взаимодействие с кислотными оксидами и кислотой
Амфотерные оксиды взаимодействуют только с сильными и средними кислотами и их оксидами.
Амфотерный оксид + кислотный оксид = соль Например: Al2O3 + N2O5 = 2Al(NO3)3 Амфотерный оксид + кислота = соль + вода Например: Al2O3 + 6HCl = 2AlCl3 + 3H2O |
|---|
3. Взаимодействие с основными оксидами
Амфотерные оксиды взаимодействуют только с теми оксидами, которые соответствуют щелочам. Реакция протекает только в расплаве, так как в растворе такие оксиды взаимодействуют преимущественно с водой с образованием щелочей.
Амфотерный оксид + основный оксид (расплав) = соль Например: Al2O3 + Na2O = 2NaAlO2 |
|---|
4.
 Взаимодействие со щелочами
Взаимодействие со щелочамиПродукты взаимодействия амфотерных оксидов со щелочами зависят от условий проведения реакции. В растворе образуются комплексные соли, а при сплавлении – средние соли.
Амфотерный оксид + щелочь (раствор) + вода = комплексная соль Например: Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4] Амфотерный оксид + щелочь (расплав) = средняя соль + вода Например: ZnO + 2KOH = K2ZnO2 + H2O |
|---|
Получение оксидов
1. Окисление металлов
Почти все металлы окисляются кислородом до устойчивых степеней окисления.
Например: 4Al + 3O2 = 2Al2O3
Исключение
Не взаимодействуют с кислородом: платина, золото и палладий.
Металлы с переменной степенью окисления, как правило, образуют соединения в степени окисления +3:
4Cr + 3O2 = 2Cr2O3
При взаимодействии щелочных металлов (элемента IA группы) образуются пероксиды Me2O2 или надпероксиды MeO2, где Ме — щелочной металл.
2. Окисление простых веществ — неметаллов
При окислении неметаллов в избытке кислорода, как правило, образуются высшие оксиды (это оксиды, в которых неметалл проявляют высшую степень окисления):
4P + 5O2 (избыток) = 2P2O5
При недостаточном количестве кислорода образуются оксиды неметаллов в промежуточной степени окисления:
4P + 3O2 (недостаток) = 2P2O3
Существуют и исключения. Например, сера окисляется лишь до оксида серы (IV) даже в избытке кислорода:
S + O2 = SO2
Или азот, который взаимодействует с кислородом только при температуре 2 000̊С или под действием электрического разряда с образованием оксида азота (II):
N2 + O2 = 2NO
Запомнить
Галогены (элементы VIIA группы) вовсе не взаимодействуют с кислородом, так же как и инертные газы (элементы VIIIA группы).
3. Разложение гидроксидов
Некоторые кислоты и гидроксиды неустойчивы и самопроизвольно разлагаются по схеме:
Гидроксид (кислота) = оксид + вода
Например:
H2SO3 = SO2↑ + H2O
H2CO3 = CO2↑ + H2O
Ag(OH) = Ag2O + H2O
NH4OH = NH3↑ + H2O
Оксиды тяжелых металлов (нерастворимые гидроксиды) и кремниевая кислота разлагаются при нагревании по той же самой схеме.
Например:
4. Окисление сложных веществ
Сложные бинарные (состоящие из двух химических элементов) соединения окисляются с образованием двух оксидов этих элементов в устойчивых степенях окисления.
Например:
2H2S + 3O2 = 2SO2 + 2H2O
4NH3 + 5O2 = 4NO + 6H2O
Также оксиды получают разложением солей, например, карбонатов, нитратов сульфатов и т.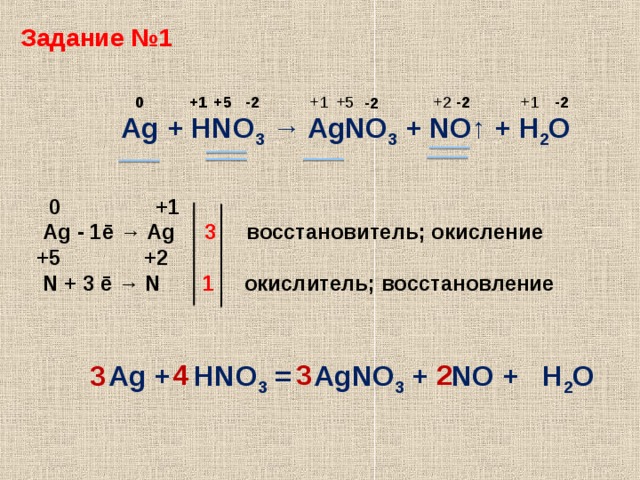 д.
д.
Например, Li2CO3 = Li2O + CO2↑
Мы узнали, какие вещества в химии называют оксидами, какие бывают оксиды, а также разобрали свойства каждого вида. Осталось подкрепить теорию практикой — а сделать это можно на курсах по химии в онлайн-школе Skysmart!
Татьяна Сосновцева
К предыдущей статье
Ковалентные неполярные и полярные связи
К следующей статье
Химические свойства металлов
Получите план обучения, который поможет понять и полюбить химию
На вводном уроке с методистом
Выявим пробелы в знаниях и дадим советы по обучению
Расскажем, как проходят занятия
Подберём курс
ГДЗ Хімія 8 клас Григорович О.В. §23 2021 / §25 2016 МОЛЯРНА МАСА відповіді » Допомога учням
Інші завдання дивись тут. ..
..
|
У всіх завданнях ГДЗ з хімії сірим кольором дається відповідь, а зеленим — пояснення. |
Контрольні запитання
1. Дайте визначення молярної маси речовини. Молярна маса — це маса речовини кількістю 1 моль.
2. У яких одиницях вимірюють молярну масу? г/моль
3. Як за хімічною формулою речовини визначити її молярну масу? Молярна маса М, виражена в г/моль, чисельно дорівнює відносній молекулярній масі Мr, тобто M=Mr г/моль
4. Що спільного й відмінного між поняттями «молярна маса» і «відносна молекулярна маса»? Поясніть на конкретних прикладах.
Спільного: мають однакові чисельні значення, бо молярна маса М, виражена в г/моль, чисельно дорівнює відносній молекулярній масі Мr.
Наприклад, Mr(H2O)=2Ar(H)+Ar(O)=2•1+16=18; M(H2O)=18 г/моль.
Відмінного: по-перше, молярна маса — маса 1 моля речовини, а відносна молекулярна маса — маса одної молекули;
по-друге, молярна маса не є відносною величиною й, на відміну від відносної молекулярної маси, має одиницю вимірювання — г/моль.
Наприклад.
Mr(Н2О)=m0(Н2О): (m0(С)/12)=3•10-23 г:(1,994•10-23 г/12)=
=3•10-23 г• 12 :1,994•10-23 г=18
Маса 1 моля Н2О дорівнює 18 г
Завдання для засвоєння матеріалу
Завдання 1
Молярна маса кисню дорівнює:
а) 16 г/моль;
б) 32 г/моль;
в) 48 г/моль.
Mr(O2)=2•Ar(O)=2•16=32, M(O2)=32 г/моль
Завдання 2
Обчисліть масу:
а) водню кількістю 2 моль;
б) кисню кількістю 3 моль;
в) води кількістю 5 моль.
Відомо: a) n(H2)=2 моль; б) n(О2)=3 моль; в) n(H2О)=5 моль
Знайти: а) m(H2)-?; б) m(О2)-?; в) m(H2О)-?
Розв’язання
а) Мг(H2)=2•Ar(Н)=2•1=2. М(H2)=2 г/моль
m(H2)=n(H2):M(H2)=2 моль • 2 г/моль=4 г
б) Мг(О2)=2•Ar(О)=2•16=32, М(О2)=32 г/моль
m(О2)=n(O2):M(O2)=3 моль • 32 г/моль=96 г
в) Мг(H2О)=2•Ar(Н)+Ar(О)=2•1+16=18, М(H2О)=18 г/моль
m(H2О)=n(H2O):M(H2O)=5 моль • 18 г/моль=90 г
Відповідь: m(H2)=4 г; m(О2)=96 г; m(H2О)=90 г.
Завдання 3.
Обчисліть масу:
а) 1,204•1022 атомів Цинку;
б) 1,806•1024 молекул кисню;
в) 6,02•1021 молекул сульфатної кислоти H2SO4.
Відомо: a) N(Zn)=1,204•1022; б) N(O2)=1,806•1024; в) N(H2SO4)=6,02•1021
Знайти: a) m(Zn)-?; б) m(O2)-?; в) m(H2SO4)-?
Розв’язання
І спосіб
1) Кількість речовини обчислюємо за формулою: n=N/NA, де NА — стала Авогадро.
а) n(Zn)=n(Zn):NA=1,204•1022 : 6,02•1023 моль-1=0,02 моль
б) n(O2)=n(O2):NA=1,806•1024: 6,02•1023 моль-1=3 моль
в) n(Н2SO4)=n(H2SO4):NA=6,02•1022: 6,02•1023 моль-1=0,01 моль
2) Масу речовини обчислюємо за формулою: m=n•M, де M — молярна маса.
а) Мг(Zn)=Ar(Zn)=65, М(Zn)=65 г/моль
m(Zn)=n(Zn)•M(Zn)=0,02 моль • 65 г/моль=1,3 г
б) Мг(О2)=2•Ar(О)=2•16=32, М(О2)=32 г/моль
m(О2)=n(O2)•M(O2)=3 моль • 32 г/моль=96 г
в) Мг(H2SO4)=2•Ar(Н)+Ar(S)+4•Ar(O)+=2•1+32+4•16=98
М(H2SO4)=98 г/моль
m(H2SO4)=n(H2SO4)•M(H2SO4)=0,01 • 98 г/моль=0,98 г
ІІ спосіб
1) Обчислюємо молярні маси
а) Мг(Zn)=Ar(Zn)=65, М(Zn)=65 г/моль
б) Мг(О2)=2•Ar(О)=2•16=32, М(О2)=32 г/моль
в) Мг(H2SO4)=2•Ar(Н)+Ar(S)+4•Ar(O)+=2•1+32+4•16=98
2) Складаємо пропорції та розв’язуємо їх.
а) 6,02•1023 атомів містяться в 65 г цинку,
1,204•1022 атомів — х г цинку.
х=1,204•1022 • 65 г : 6,02•1023=1,3 г
б) 6,02•1023 атомів містяться в 32 г кисню,
1,806•1024 атомів — х г кисню.
х=1,806•1024 • 32 г : 6,02•1023=96 г
в) 6,02•1023 молекул містяться в 98 г H2SO4,
6,02·1021 молекул — х г H2SO4.
х=6,02•1021 • 98 г : 6,02•1023 = 0,98 г
Відповідь: m(Zn)=1,3 г; m(О2)=96 г; m(H2SO4)=0,98 г.
Завдання 4
Обчисліть молярні маси речовин за їхніми формулами: H2S, NH3, F2, CaCO3, SO2, NaOH, K2SO4, Fe(NO3)3, NaAl(OH)4, CuSO4•5H2O.
M=Mr г/моль
Мг(H2S)=2•Ar(H)+Ar(S)=2•1+32=34, М(H2S)=34 г/моль
Мг(NH3)=Ar(N)+3•(H)=14+3•1=17, М(NH3)=17 г/моль
Мг(F2)=2•Ar(F)=2•19=38, М(F2)=38 г/моль
Мг(CaCO3)=Ar(Ca)+Ar(C)+3•Ar(O)=40+12+3•16=100, М(CaCO3)=100 г/моль
Мг(SO2)=Ar(S)+2•Ar(O)=32+2•16=64, М(SO2)=64 г/моль
Мг(NaOH)=Ar(Na)+Ar(O)+Ar(H)=23+16+1=40, М(NaOH)=40г/моль
Мг(K2SO4)=2•Ar(K)+Ar(S)+4•Ar(O)=2•39+32+4•16=174, М(K2SO4)=174 г/моль
Мг(Fe(NO3)3)=Ar(Fe)+3•Ar(N)+9•Ar(O)=56+3•14+9•16=242, М(Fe(NO3)3)=242 г/моль
Мг(NaAl(OH)4)=Ar(Na)+Ar(Al)+4•Ar(O)+4•Ar(H)=23+27+4•16+4•1=118,
М(NaAl(OH)4)=118 г/моль
Мг(CuSO4·5H2O)=Мг(CuSO4)+5Мг(H2O)=Ar(Cu)+Ar(S)+4•Ar(O)+5•(2•Ar(H)+Ar(O))=
=64+32+4•16+5•(2•1+16)=160+5•18=250, М(CuSO4•5H2O)=250 г/моль
Завдання 5
Обчисліть кількість речовини:
а) у 7 г заліза;
б) 21 г азоту;
в) 500 г крейди CaCO3;
г) 10 кг харчової (питної) соди NaHCO3.
Відомо: a) m(Fe)=7 г б) m(N2)=21 г в) m(CaCO3)=500 г
г) m(NaHCO3)=10 кг = 10000 г
Знайти: a) n(Fe) -? б) n(N2)-? в) n(CaCO3)-? г) n(NaHCO3)-?
Розв’язання
І спосіб
Кількість речовини обчислюємо за формулою: n=m/M, де M — молярна маса.
а) Мг(Fe)=Ar(Fe)=56, М(Fe)=56 г/моль
n(Fe)=m(Fe):M(Fe)=7 г : 56 г/моль=0,125 моль
б) Мг(N2)=2•Ar(N)=2•14=28, М(N2)=28 г/моль
n(N2)=m(N2):M(N2)=21 г : 28 г/моль=0,75 моль
в) Мг(CaCO3)=Ar(Ca)+Ar(C)+3•Ar(O)=40+12+3•16=100, M(CaCO3)=100 г/моль
n(CaCO3)=m(CaCO3):M(CaCO3)=500 г : 100 г/моль=5 моль
г) Мг(NaHCO3)=Ar(Na)+Ar(H)+Ar(C)+3•Ar(O)=23+1+12+3•16=84, М(NaHCO3)=84 г/моль
n(NaHCO3)=m(NaHCO3):M(NaHCO3)=10000 г : 84 г/моль=119,05 моль
ІІ спосіб
1. Обчислюємо молярні маси
Обчислюємо молярні маси
а) Мг(Fe)=Ar(Fe)=56, М(Fe)=56 г/моль
б) Мг(N2)=2•Ar(N)=2•14=28, М(N2)=28 г/моль
в) Мг(CaCO3)=Ar(Ca)+Ar(C)+3•Ar(O)=40+12+3•16=100,
M(CaCO3)=100 г/моль
г) Мг(NaHCO3)=Ar(Na)+Ar(H)+Ar(C)+3•Ar(O)=23+1+12+3•16=84,
М(NaHCO3)=84 г/моль
2. Складаємо пропорції та розв’язуємо їх.
а) 56 г заліза містяться в 1 моль речовини,
7 г заліза — х моль цинку.
х=7 г • 1 моль : 56 г =0,125 моль
б) 28 г азоту містяться в 1 моль речовини,
21 г азоту — х моль речовини.
х=21 г • 1 моль : 28 г =0,75 моль
в) 100 г крейди містяться в 1 моль речовини,
500 г крейди — х моль речовини.
х=500 г • 1 моль : 100 г = 5 моль
г) 84 г крейди містяться в 1 моль речовини,
10000 г крейди — х моль речовини.
х=10000 г • 1 моль : 100 г = 119,05 моль
Відповідь: n(Fe)=0,125 моль; n(N2)=0,75 моль; n(CaCO3)=5 моль; n(NaHCO3)=119,05 моль.
Завдання 6
Які маси води, цукру C12H22O11, золота необхідно взяти, щоб кожної речовини було по 5 моль?
Відомо: a) n(H2O)=5 моль б) n(C12H22О11)=5 моль в) n(Au)=5 моль
Знайти: а) m(H2O)-?; б) m(C12H22О11)-?; в) m(Au)-?
Розв’язання
І спосіб
1. Кількість речовини обчислюємо за формулою: n=m/M, де M — молярна маса.
а) Мг(H2O)=2•Ar(Н)+Ar(O)=2•1+16=18. М(H2O)=18 г/моль
m(H2O)=n(H2O)•M(H2O)=5 моль •18 г/моль=90 г
б) Мг(C12H22О11)=12•Ar(C)+22•Ar(H)+11•Ar(O)=12•12+22•1+11•16=342
М(C12H22О11)=342 г/моль
m(C12H22О11)=n(C12H22О11)•M(C12H22О11)=5 моль•342 г/моль=1710 г
в) Мг(Au)=Ar(Au)=197, М(Au)=197 г/моль
m(Au)=197 г/моль • 5 моль=985 г
ІІ спосіб
1. Обчислюємо молярні маси
Обчислюємо молярні маси
а) Мг(H2O)=2•Ar(Н)+Ar(O)=2•1+16=18, М(H2O)=18 г/моль
б) Мг(C12H22О11)=12•Ar(C)+22•Ar(H)+11•Ar(O)=12•12+22•1+11•16=342
М(C12H22О11)=342 г/моль
в) Мг(Au)=Ar(Au)=197, М(Au)=197 г/моль
2. Складаємо пропорції та розв’язуємо їх.
а) 1 моль води має 18 г,
5 моль води — х г.
х=5 моль • 18 г : 1 моль=90 г
б) 1 моль цукру має 342 г,
5 моль цукру — х г.
х=5 моль • 342 г : 1 моль=1710 г
в) 1 моль золота має 197 г,
5 моль золота — х г.
х=5 моль • 197 г : 1 моль=985 г
Відповідь: m(H2O)=90 г; m(C12H22О11)=1710 г; m(Au)=985 г.
Завдання 7
Визначте молярну масу простої речовини, якщо:
а) 7 моль її мають масу 444,5 г;
б) 3,5 моль її мають масу 84 г;
в) 0,25 моль її мають масу 8 г. Назвіть ці речовини.
Назвіть ці речовини.
Відомо: а) n=7 моль, m=444,5 г; б) n=3,5 моль, m=84 г;
в) n=0,25 моль, m=8 г
Знайти: М-?
Розв’язання
І спосіб
Молярну масу обчислюємо за формулою: M=m/n
а) М=m:n=444,5 г : 7 моль=63,5 г/моль — це мідь Cu
б) M=m:n=84 г : 3,5 моль=24 г/моль — це магній Mg
в) M=m:n=8 г : 0,25 моль=32 г/моль — це сірка S
ІІ спосіб
Складаємо пропорції та розв’язуємо їх.
а) маса 7 моль речовини 444,5 г,
маса 1 моль — х г.
х = 444,5 г • 1 моль : 7 моль=63,5 г
Отже, М=63,5 г/моль — це мідь Cu
б) маса 3,5 моль речовини 84 г,
маса 1 моль — х г.
х = 84 г • 1 моль : 3,5 моль=24 г
Отже, М=24 г/моль — це магній Mg
в) маса 0,25 моль речовини 8 г,
маса 1 моль — х г.
х = 8 г • 1 моль : 0,25 моль=32 г
Отже, М=32 г/моль — це сірка S
Завдання 8
Обчисліть, маса якого зі зразків речовини більша:
а) 3 моль кисню чи 2 моль азоту;
б) 5 моль води чи 1,4 моль хлору;
в) 1 моль негашеного вапна CaO чи 1 моль паленої магнезії MgO?
Відомо: a) n(O2)=3 моль, n(N2)=3 моль;
б) n(Н2O)=5 моль, n(Cl2)=1,4 моль
в) n(CaO)=1 моль, n(MgO)=1 моль
Знайти: маса якого зі зразків речовини більша?
Розв’язання
1. Масу речовини обчислюємо за формулою: m=n•M, де M — молярна маса.
Масу речовини обчислюємо за формулою: m=n•M, де M — молярна маса.
a) Мг(O2)=2•Ar(O)=2•16=32, М(O2)=32 г/моль
m(O2)=m(O2)•M(O2)=3•32 г/моль=96 г
Мг(N2)=2•Ar(N)=2•14=28, М(N2)=28 г/моль
m(N2)=m(N2)•M(N2)=2•28 г/моль=56 г
96 г>56 г
Відповідь: маса зразка 3 моль кисню є більша.
б) Мг(H2O)=2•Ar(H)+Ar(O)=2•1+16=18, М(H2O)=18 г/моль
m(H2O)=n(H2O)•M(H2O)=5 моль•18 г/моль= 90 г
Мг(Cl2)=2•Ar(Cl)=2•35,5=71,М(Cl2)=71 г/моль
m(Cl2)=n(Cl2)•M(Cl2)=1,4 моль•71 г/моль= 99,4 г
99,4 г>90 г
Відповідь: маса зразка 1,4 моль хлору є більша.
в) Мг(CaO)=Ar(Са)+Ar(O)=40+16=56, М(СаO)=56 г/моль
m(СаO)=n(CaO)•M(CaO)=1 моль•56 г/моль= 56 г
Мг(MgO)=Ar(Mg)+Ar(O)=24+16=40, М(MgO)=40 г/моль
m(MgO)=n(MgO)•M(MgO)=1 моль •40 г/моль= 40 г
56 г>40 г
Відповідь: маса зразка 1 моль негашеного вапна є більша.
Завдання 9
Обчисліть число молекул води, що міститься в склянці об’ємом 200 мл.
Відомо: V(H2O)=200 мл
Знайти: N(H2O)-?
Розв’язання
1. Обчислимо масу води за формулою m=ρ•V, де ρ=1 г/мл.
m(H2O)=ρ(H2O)•V(H2O)=1 г/мл•200=200 г. Бачимо, що для води маса співпадає з об’ємом, тому ця дія не є обов’язковою.
2. Обчислюємо кількість речовини за формулою: n=m/M, де М — молярна маса.
Мг(H2O)=2•Ar(H)+Ar(O)=2•1+16=18, М(H2O)=18 г/моль
n(H2O)=m(H2O):M(H2O)=200 г : 18 г/моль=11,1 моль
3. Обчислюємо число молекул за формулою: N=n•NA, де NА — стала Авогадро.
N(Н2О)=n(H2O)•NA=11,1 моль • 6•1023 моль-1=66,6•1023=6,66•1024
Відповідь: N(Н2О)=6,66•1024
Завдання 10
Обчисліть кількість речовини та число атомів Оксигену, що міститься:
а) у 3 моль сірчистого газу SO2;
Відомо: n(SO2)=3 моль
Знайти: n(O)-?, N(O)-?
Розв’язання
У молекулі SO2 міститься 2 атоми Оксигену. У 1 моль SO2 міститься 2 моль атомів Оксигену, тоді у 3 моль SO2 міститься у 3 рази більше моль атомів Оксигену, тобто, 3•2 моль=6 моль атомів Оксигену.
У 1 моль SO2 міститься 2 моль атомів Оксигену, тоді у 3 моль SO2 міститься у 3 рази більше моль атомів Оксигену, тобто, 3•2 моль=6 моль атомів Оксигену.
Обчислюємо число атомів за формулою: N=n•NA, де NА — стала Авогадро.
N(О)=6•1023 моль-1 • 6 моль=36•1023
Відповідь: n(O)=6 моль, N(O)=36•1023.
б) 40 г мідної окалини CuO.
Відомо: m(CuO)=40 г.
Знайти: n(O)-?, N(O)-?
Розв’язання
Обчислюємо кількість речовини за формулою: n=m/M, де М — молярна маса.
Мг(СuO)=Ar(Cu)+Ar(O)=64+16=80, М(CuO)=80 г/моль
n(CuO)=m(CuO):m(CuO)=40 г : 80 г/моль=0,5 моль
У формульній одиниці CuO міститься 1 атом Оксигену. У 1 моль СuO міститься 1 моль атомів Оксигену, тоді у 0,5 моль CuO міститься 0,5 моль атомів Оксигену.
Обчислюємо число атомів за формулою: N=n•NA, де NА — стала Авогадро.
N(О) = 6•1023 моль-1 • 0,5 моль= 3•1023
Відповідь: n(O)=0,5 моль, N(O)=3•1023 атомів.
Завдання 11
Де міститься більше молекул — у 100 г кисню O2 чи в 100 г озону O3?
Відомо: m(O2)=100 г, m(O3)=100 г.
Знайти: де міститься більше молекул?
Розв’язання
Кількість речовини обчислюємо за формулою: n=m/M, де М — молярна маса.
Мг(O2)=2•Ar(О)=2•16=32, М(O2)=32 г/моль
n(О2)=m(O2):M(O2)=100 г : 32 г/моль=3,125 моль
Мг(O3)=3•Ar(О)=3•16=48, М(O3)=48 г/моль
n(О3)=m(O3):M(O3)=100 г : 48 г/моль=2,08 моль
У більшій кількості речовини є більша кількість молекул, тому у 100 г кисню більше молекул, ніж у 100 г озону.
Відповідь: у 100 г кисню більше молекул, ніж у 100 г озону.
Завдання 12
Зразок нітратної кислоти HNO3 має масу 122 г. Обчисліть у цьому зразку кількість речовини:
а) нітратної кислоти;
Відомо: m(HNO3)=122 г
Знайти: n(HNO3)-?
Розв’язання
Кількість речовини обчислюємо за формулою: n=m/M, де М — молярна маса.
Мг(HNO3)=Ar(H)+Ar(N)+3•Ar(О)=1+14+3•16=63, М(HNO3)=63 г/моль
n(HNО3)=m(HNO3):M(HNO3)=122 г : 63 г/моль=1,94 моль
Відповідь: 1,94 моль.
б) атомів Нітрогену;
У одній молекулі HNO3 мітиться один атом Нітрогену, тому в 1,94 моль HNO3 міститься 1,94 моль атомів Нітрогену.
Відповідь: 1,94 моль атомів N.
в) атомів Гідрогену;
У одній молекулі HNO3 мітиться один атом Гідрогену, тому в 1,94 моль HNO3 міститься 1,94 моль атомів Гідрогену.
Відповідь: 1,94 моль атомів Н.
г) атомів Оксигену.
У одній молекулі HNO3 мітиться три атоми Оксигену, тому в 1 моль HNO3 міститься 3 моль атомів Оксигену, тоді у 1,94 моль HNO3 міститься у 1,94 рази більше моль атомів Оксигену, тобто, 1,94•3 моль=5,82 моль атомів Оксигену.
Відповідь: 5,82 моль атомів О.
Завдання 13
Зразок сполуки Карбону з Гідрогеном масою 0,8 г містить 0,05 моль речовини.
Обчисліть молярну масу цієї речовини та визначте її формулу.
Відомо: m(СхНу)=0,8 г, n(СхНу)=0,05 моль
Знайти: М(СхНу)-?, формулу СхНу-?
Розв’язання
Молярну масу обчислюємо за формулою: M=m/n
М(СхНу)=m(CxHy):n(CxHy)=0,8 г : 0,05 моль=16 г/моль, тому
Мr(СхНу)=16 і за означенням Мr(СхНу)=х•Ar(C)+y•Ar(H).
Прирівняємо ліву і праву частини рівності, отримаємо
х•Ar(C)+y•Ar(H)=16. Оскільки Ar(C)=12, тому х не може бути більшим одиниці (бо в такому випадку значення молекулярної маси сполуки буде більшим 24), тому 12+y•1=16, у=16-12=4. Отже формула сполуки СН4.
Відповідь: 16 г/моль, СН4.
Інші завдання дивись тут…
Двухфазное структурное уточнение La 2CuO 4.032 при 15 K
NASA/ADS
Двухфазное структурное измельчение La
2 CuO 4,032 при 15 К- Chaillout, C. ;
- Ченавас, Дж. ;
- Чеонг, Ю. В. ;
- Фиск, З.
 ;
; - Марецио, М. ;
- Моросин Б. ;
- Ширбер, Дж. Э.
Аннотация
Двухфазное уточнение кристалла соединения La 2 CuO 4+ δ ( δ = 0,032) по данным нейтронографии, полученным при 15 K на дифрактометре D9 в ILL, с использованием ε = 0,48 Å, было выполнено. Одна фаза (30 %) состоит из стехиометрических доменов La 2 CuO 4 , а другая (70 %) из богатых кислородом доменов La 2 CuO 4,048 . Проценты каждой фазы, которые были уточнены вместе с другими параметрами (масштабный коэффициент, позиционные параметры, тепловые факторы и коэффициенты заполнения атомами кислорода), очень хорошо согласуются со значением, определенным из χ Измерения AC . Структура La 2 CuO 4,048 по существу такая же, как и средняя структура, указанная в ссылке. [1], единственная разница заключается в содержании кислорода, которое составляет δ = {δ}/{0,70}. Дополнительный кислород O(4) находится между двумя слоями LaO в том же положении, что и атомы кислорода, расположенные между двумя слоями Nd в структуре N 2 CuO 4 . Введение дополнительного кислорода вызывает смещение части кислорода O (1) в сторону позиций O (3). Предлагаются различные модели искажения, вызванного этой вставкой, в соответствии с экспериментальным значением 3,3 [6], найденным для отношения количества O (3) к количеству O (4). Если принять это отношение равным 3 и атомы О(3) локализованы вокруг внедрения, то будет происходить образование короткой связи О(4)—О(3). Модели, не требующие образования короткой связи, соответствуют отношениям 2 или 4. В последнем случае будет четыре смещенных O(1), но из-за жесткости кислородных октаэдров будут связаны только два O(3).
Структура La 2 CuO 4,048 по существу такая же, как и средняя структура, указанная в ссылке. [1], единственная разница заключается в содержании кислорода, которое составляет δ = {δ}/{0,70}. Дополнительный кислород O(4) находится между двумя слоями LaO в том же положении, что и атомы кислорода, расположенные между двумя слоями Nd в структуре N 2 CuO 4 . Введение дополнительного кислорода вызывает смещение части кислорода O (1) в сторону позиций O (3). Предлагаются различные модели искажения, вызванного этой вставкой, в соответствии с экспериментальным значением 3,3 [6], найденным для отношения количества O (3) к количеству O (4). Если принять это отношение равным 3 и атомы О(3) локализованы вокруг внедрения, то будет происходить образование короткой связи О(4)—О(3). Модели, не требующие образования короткой связи, соответствуют отношениям 2 или 4. В последнем случае будет четыре смещенных O(1), но из-за жесткости кислородных октаэдров будут связаны только два O(3). до O (4), а два других являются апикально противоположными атомами кислорода тех же октаэдров.
до O (4), а два других являются апикально противоположными атомами кислорода тех же октаэдров.
- Публикация:
Physica C Сверхпроводимость
- Дата публикации:
- Сентябрь 1990 г.
- DOI:
- 10.1016/0921-4534(90)-5
- Биб-код:
- 1990PhyC..170…87C
BaO2.
 8h3O (октагидрат пероксида бария) => ?
8h3O (октагидрат пероксида бария) => ?| Поиск |
Октагидрат пероксида бария =
Новости Только 5% НАСЕЛЕНИЯ знают
Реклама
1 результатов найдено
Отображение уравнения от 1 до 1 Страница 1 — Пожалуйста, прокрутите до конца, чтобы увидеть больше результатов
Уравнение Результат #1
Нажмите, чтобы увидеть более подробную информацию и рассчитать вес/моль >>
| BaO 2 .8H 2 O | → | 8H 2 O | + | png» substance-weight=»169.3258″> BaO 2 | |
| Barium peroxide octahydrate | water | barium peroxide | |||
| 1 | 8 90823 3 | Hệ số | |||
| Nguyên — Phân tử khối (g/mol) | |||||
| Số mol | |||||
| Khối lượng (g) |
Реклама
Дополнительная информация об уравнении BaO
2 .8H 2 O → 8H 2 O + BaO 2Каковы условия реакции BaO2.8h3O (октагидрат пероксида бария)?
Температура: 100°C Давление: вакуум
Объяснение: идеальные условия окружающей среды для реакции, такие как температура, давление, катализаторы и растворитель. Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации.
Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации.
Как могут происходить реакции с образованием h3O (вода) и BaO2 (перекись бария)?
Явление после BaO2.8h3O (октагидрат пероксида бария)
Это уравнение не несет никакой конкретной информации о явлении.
В этом случае вам просто нужно наблюдать, чтобы убедиться, что вещество продукта BaO2 (пероксид бария), появляющийся в конце реакции.
Или если какое-либо из следующих реагентов BaO2.8h3O (октагидрат пероксида бария), исчезающий
Какую другую важную информацию вы должны знать о реакции
У нас нет дополнительной информации об этой химической реакции.
Категории уравнения
Нажмите, чтобы увидеть более подробную информацию и рассчитать вес/моль >>
Другие вопросы, связанные с химическими реакциями BaO
2 . 8H 2 O → 8H 2 O + BaO 2
8H 2 O → 8H 2 O + BaO 2 Вопросы, связанные с реагентом BaO2.8h3O (пероксид бария окта96) 90 физические характеристики BaO2.8h3O (октагидрат пероксида бария)? Какие химические реакции происходят с BaO2.8h3O (октагидратом пероксида бария) в качестве реагента?
Вопросы, связанные с продуктом h3O (вода)
Каковы химические и физические характеристики h3O (октагидрат пероксида бария)? Каковы химические реакции, в результате которых образуется h3O (вода)?
Вопросы, связанные с продуктом BaO2 (пероксид бария)
Каковы химические и физические характеристики BaO2 (октагидрата пероксида бария)? Каковы химические реакции, в которых BaO2 (пероксид бария) является продуктом?
1 результатов найдено
Отображение уравнения от 1 до 1 Страница 1
Дополнительная информация о веществах, которые используют уравнение
продукция h3O (nước) , температурные условия 100 , условия давления chân khong
Реакция, в результате которой образуется вещество BaO2.