| 1 | Найти число нейтронов | H | |
| 2 | Найти массу одного моля | H_2O | |
| 3 | Баланс | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 4 | Найти массу одного моля | H | |
| 5 | Найти число нейтронов | Fe | |
| 6 | Найти число нейтронов | Tc | |
| 7 | Найти конфигурацию электронов | H | |
| 8 | Найти число нейтронов | Ca | |
| 9 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 10 | Найти число нейтронов | C | |
| 11 | Найти число протонов | H | |
| 12 | Найти число нейтронов | O | |
| 13 | Найти массу одного моля | CO_2 | |
| 14 | Баланс | C_8H_18+O_2→CO_2+H_2O | |
| 15 | Найти атомную массу | H | |
| 16 | Определить, растворима ли смесь в воде | H_2O | |
| 17 | Найти конфигурацию электронов | Na | |
| 18 | Найти массу одного атома | H | |
| 19 | Найти число нейтронов | Nb | |
| 20 | Найти число нейтронов | Au | |
| 21 | Найти число нейтронов | Mn | |
| 22 | Найти число нейтронов | Ru | |
| 23 | Найти конфигурацию электронов | ||
| 24 | Найти массовую долю | H_2O | |
| 25 | Определить, растворима ли смесь в воде | NaCl | |
| 26 | Найти эмпирическую/простейшую формулу | H_2O | |
| 27 | Найти степень окисления | H_2O | |
| 28 | Найти конфигурацию электронов | K | |
| 29 | Найти конфигурацию электронов | Mg | |
| 30 | Найти конфигурацию электронов | Ca | |
| 31 | Найти число нейтронов | Rh | |
| 32 | Найти число нейтронов | Na | |
| 33 | Найти число нейтронов | Pt | |
| 34 | Найти число нейтронов | Be | Be |
| 35 | Найти число нейтронов | Cr | |
| 36 | Найти массу одного моля | H_2SO_4 | |
| 37 | Найти массу одного моля | HCl | |
| 38 | Найти массу одного моля | Fe | |
| 39 | Найти массу одного моля | C | |
| 40 | Найти число нейтронов | Cu | |
| 41 | Найти число нейтронов | S | |
| 42 | Найти степень окисления | H | |
| 43 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 44 | Найти атомную массу | O | |
| 45 | Найти атомное число | H | |
| 46 | Найти число нейтронов | Mo | |
| 47 | Найти число нейтронов | Os | |
| 48 | Найти массу одного моля | NaOH | |
| 49 | Найти массу одного моля | O | |
| 50 | Найти конфигурацию электронов | Fe | |
| 51 | Найти конфигурацию электронов | C | |
| 52 | Найти массовую долю | NaCl | |
| 53 | Найти массу одного моля | ||
| 54 | Найти массу одного атома | Na | |
| 55 | Найти число нейтронов | N | |
| 56 | Найти число нейтронов | Li | |
| 57 | Найти число нейтронов | V | |
| 58 | Найти число протонов | N | |
| 59 | Упростить | H^2O | |
| 60 | Упростить | h*2o | |
| 61 | Определить, растворима ли смесь в воде | H | |
| 62 | Найти плотность при стандартной температуре и давлении | H_2O | |
| 63 | Найти степень окисления | NaCl | |
| 64 | Найти атомную массу | He | He |
| 65 | Найти атомную массу | Mg | |
| 66 | Найти число электронов | H | |
| 67 | Найти число электронов | O | |
| 68 | Найти число электронов | S | |
| 69 | Найти число нейтронов | Pd | |
| 70 | Найти число нейтронов | Hg | |
| 71 | Найти число нейтронов | B | |
| 72 | Найти массу одного атома | Li | |
| 73 | Найти эмпирическую формулу | H=12% , C=54% , N=20 | , , |
| 74 | Найти число протонов | Be | Be |
| 75 | Найти массу одного моля | Na | |
| 76 | Найти конфигурацию электронов | Co | |
| 77 | Найти конфигурацию электронов | S | |
| 78 | Баланс | C_2H_6+O_2→CO_2+H_2O | |
| 79 | Баланс | H_2+O_2→H_2O | |
| 80 | Найти конфигурацию электронов | P | |
| 81 | Найти конфигурацию электронов | Pb | |
| 82 | Найти конфигурацию электронов | Al | |
| 83 | Найти конфигурацию электронов | Ar | |
| 84 | Найти массу одного моля | O_2 | |
| 85 | Найти массу одного моля | H_2 | |
| 86 | Найти число нейтронов | K | |
| 87 | Найти число нейтронов | P | |
| 88 | Найти число нейтронов | Mg | |
| 89 | Найти число нейтронов | W | |
| 90 | Найти массу одного атома | C | |
| 91 | Упростить | na+cl | |
| 92 | Определить, растворима ли смесь в воде | H_2SO_4 | |
| 93 | Найти плотность при стандартной температуре и давлении | NaCl | |
| 94 | Найти степень окисления | C_6H_12O_6 | |
| 95 | Найти степень окисления | Na | |
| 96 | Определить, растворима ли смесь в воде | C_6H_12O_6 | |
| 97 | Найти атомную массу | Cl | |
| 98 | Найти атомную массу | Fe | |
| 99 | Найти эмпирическую/простейшую формулу | CO_2 | |
| 100 | Найти число нейтронов | Mt |
8 класс.
 расстановка коэффициентов вариант i na + cl2 → nacl al + cl2 → а1с13 fecl2 + cl2 → fecl3 с3н6 + 02 → c02 + h30 cu + 02 → cuo fe(oh)3 → fe203 + н20 al + cubr2 → аlbr3 + сu ca(oh)2 + na3p04 → ca3(p04)2 + naoh к20 + н20→ кон n02 → no + 02 в2н6 + 02 → в2о3 + н20 с5н10 + 02→ с02 + н20 — Школьные Знания.net
расстановка коэффициентов вариант i na + cl2 → nacl al + cl2 → а1с13 fecl2 + cl2 → fecl3 с3н6 + 02 → c02 + h30 cu + 02 → cuo fe(oh)3 → fe203 + н20 al + cubr2 → аlbr3 + сu ca(oh)2 + na3p04 → ca3(p04)2 + naoh к20 + н20→ кон n02 → no + 02 в2н6 + 02 → в2о3 + н20 с5н10 + 02→ с02 + н20 — Школьные Знания.netВсе предметы
Математика
Литература
Алгебра
Русский язык
Геометрия
Английский язык
Физика
Биология
Другие предметы
История
Обществознание
Окружающий мир
География
Українська мова
Информатика
Українська література
Қазақ тiлi
Экономика
Музыка
Беларуская мова
Французский язык
Немецкий язык
Психология
Оʻzbek tili
Кыргыз тили
-
Астрономия
Физкультура и спорт
Вариант I
Na + Cl2 → NaCl
Al + Cl2 → А1С13
FeCl2 + Cl2 → FeCl3
С3Н6 + 02 → C02 + h30
Cu + 02 → CuO
Fe(OH)3 → Fe203 + Н20
Al + CuBr2 → АlBr3 + Сu
Ca(OH)2 + Na3P04 → Ca3(P04)2 + NaOH
К20 + Н20→ КОН
N02 → NO + 02
В2Н6 + 02 → В2О3 + Н20
С5Н10 + 02→ С02 + Н20
Ответ дан
Irinkaaaaaaaaaaa
Ответ:
2Na+Cl2=2NaCl
2Al+3Cl2=2AlCl3
2FeCl2+Cl2=2FeCl3
2C3h3+9O2=6CO2+6h3O
2Cu+O2=2CuO
2Fe(OH)3=Fe2O3+3h3O
2Al+3CuBr2=2AlBr3+3Cu
3Ca(OH)2+2NA3PO4=Ca3(PO4)2+5NaOH
K2O+h3O=2KOH
2NO2=2NO+O2
B2H6+3O2=B2O3+B2O3+3h3O
2C5h20+15O2=10CO2+10h3O
Химия
Уравновешенные уравнения и химические реакции
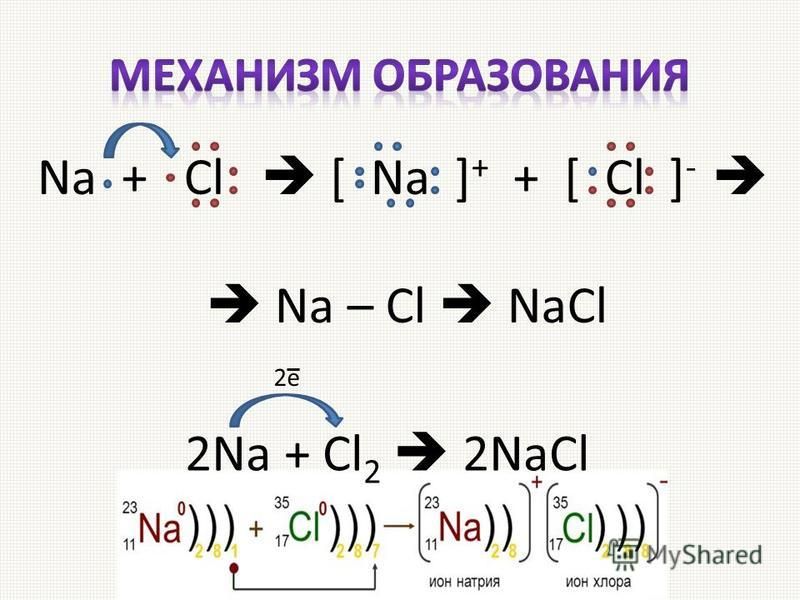
Существует четыре основных типа химических реакций. Первый является самым простым и известен как синтез или композиционная реакция. Этот тип реакции объединяет два или более веществ с образованием по крайней мере одного нового соединения. Один пример уже приводился, когда металлический натрий в твердом состоянии соединяется с газообразным хлором с образованием хлорида натрия. Реакцию можно представить следующим образом:
Первый является самым простым и известен как синтез или композиционная реакция. Этот тип реакции объединяет два или более веществ с образованием по крайней мере одного нового соединения. Один пример уже приводился, когда металлический натрий в твердом состоянии соединяется с газообразным хлором с образованием хлорида натрия. Реакцию можно представить следующим образом:
Na (т) + Cl 2 (г) NaCl (т)
Реагенты находятся слева от стрелки, а продукт(ы) справа. Это может означать, что реагенты, натрий и хлор, будут реагировать с образованием одного продукта, хлорида натрия. В приведенном выше химическом уравнении (s) обозначает твердое вещество, а (g) обозначает газ, что указывает на то, в каком состоянии вещества находится вещество. Иногда стрелка читается как «урожайность». Глядя на это уравнение, возникает естественный вопрос: почему с одной стороны уравнения три атома, а с другой только два? Что случилось с лишним атомом хлора? Хороший вопрос.
2Na (т) + Cl 2 (г) 2NaCl (т)
Это можно понять, сказав, что два атома натрия соединяются с одной двухатомной молекулой хлора, образуя две ионные единицы хлорида натрия.
Другим аспектом химических реакций являются физические свойства соединений или то, как атомы и молекулы соединяются друг с другом. Если мы посмотрим на кристаллическую структуру NaCl, то заметим, что это плотно упакованный куб.
Кристаллическая структура хлорида натрия имеет каждый атом с шестью его ближайшими соседями в октаэдрической геометрической структуре. Ионы Na окрашены в светло-голубой цвет, а ионы Cl — в темно-зеленый цвет для контраста.
Все реакции — это просто перераспределение материи более устойчивым образом. Новая материя никогда не создается, и никакая материя никогда не уничтожается. Это известно как закон сохранения материи ; материя не может быть ни создана, ни уничтожена, она просто меняет форму.
Новая материя никогда не создается, и никакая материя никогда не уничтожается. Это известно как закон сохранения материи ; материя не может быть ни создана, ни уничтожена, она просто меняет форму.
натрий + хлор → хлорид натрия
2 Na(т) + Cl 2 (г) 2 NaCl(т)
2 моля + 1 моль = 2 моля
2(23 а.е.м.) + 2(35 а.е.м.) = 2(58 а.е.м.)
46 а.е.м. + 70 а.е.м. = 116 а.е.м.
116 а.е.м. = 116 а.е.м.
Используя атомные веса из таблицы Менделеева, вы можете увидеть, что два атома натрия весят 46 атомных единиц массы. Одна молекула хлора весит 70 атомных единиц массы. Две единицы кристалла хлорида натрия весят 116 атомных единиц массы. Суммарная масса реагентов должна равняться общей массе продукта.
Реакция натрия и газообразного хлора
Натрий, очень активный металл, который вступает в реакцию с газообразным хлором с образованием хлорида натрия, нейтральной соли. Натрий окисляется до катиона натрия (Na + ), а газообразный хлор восстанавливается до хлорид-анионов (Cl —).
Натрий окисляется до катиона натрия (Na + ), а газообразный хлор восстанавливается до хлорид-анионов (Cl —).
Механизм реакции
Мы знаем, что натрий является очень активным металлом, а хлор также является очень активным неметаллом. Обычно металлы любят удалять электроны, а неметаллы, такие как галогены, любят принимать электроны.
Натрий легко устраняет свои последние электроны оболочки, превращаясь в катион Na + , и хлор принимает это электрон с образованием аниона Cl — .
Сбалансированное химическое уравнение Na + Cl
2 реакцияNa + Cl 2 → 2NaCl
Два моля газообразного хлора реагируют с одним молем натрия с образованием двух молей хлорида натрия.
Эту реакцию легче сбалансировать методом контроля, чем окислительно-восстановительным методом. Окислительно-восстановительный метод займет
много времени. Но это полезно для балансировки больших окислительно-восстановительных уравнений.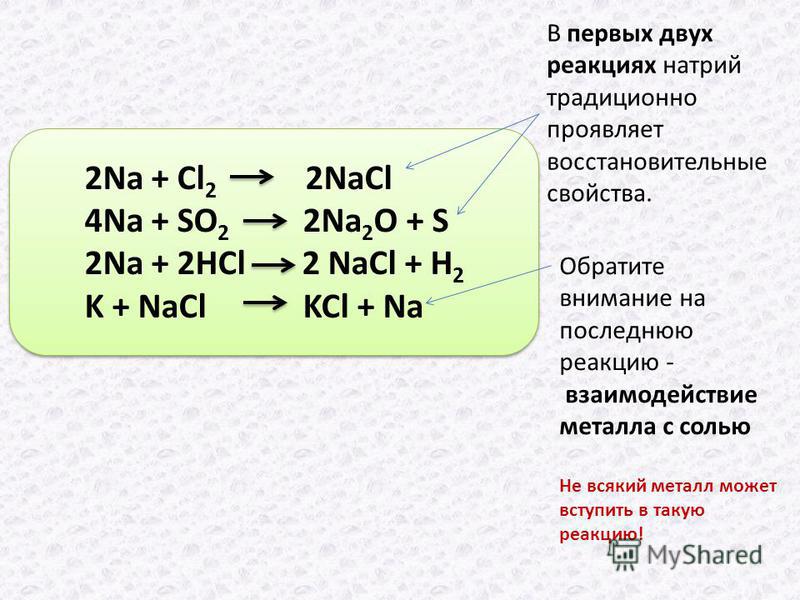
Как сбалансировать реакцию окислительно-восстановительного метода?
Это очень простая окислительно-восстановительная реакция для балансировки, и если вы новичок в уравнениях балансировки, это также хороший пример, чтобы начать балансировку окислительно-восстановительной реакции.
Натрий окисляется от степени окисления 0 до степени окисления +1. Хлор восстанавливается до степени окисления -1. от 0 степени окисления. Напишите степени окисления, если каждый атом близок к атомам.
Проверить число атомов окисленного и восстановленного в реакции (левая и правая часть) и уравновесить их, если они не сбалансированы, как следующий шаг. В левой части два атома хлора. Чтобы сбалансировать их, сделайте два хлорида натрия справа. Тогда в правой части реакции два атома натрия, а в левой только один. сторона. Следовательно, сделайте два атома натрия слева.
Затем найдите разность степеней окисления окисленных атомов (натрий в ион натрия) и восстановленных атомов (хлор
к хлориду). Разница степеней окисления натрия составляет два, а для хлора — два. Так они же
и компенсируют друг друга.
Разница степеней окисления натрия составляет два, а для хлора — два. Так они же
и компенсируют друг друга.
Физические изменения реакции
Твердый реагент натрия реагирует с зелено-желтым газообразным хлором с образованием твердого хлорида натрия который представляет собой белое кристаллическое твердое вещество.
Эта реакция протекает с высокой скоростью, поскольку оба реагента очень реакционноспособны. Натрий – металл 1 группы, любит удалять свои внешние электроны, а хлор хочет забирать электроны извне.
Энтальпия реакции натрия и хлора
Реакция натрия и хлора экзотермическая (в результате реакции выделяется тепло). Энтальпию реакции принимают за энтальпию образования двух молей хлорида натрия.
Стандартная энтальпия реакции = -411,12 кДж
Энтропия реакции (298 0 Кл) = 72,10 Дж/(К моль)
Проведем простой расчет.
Вы собираетесь смешать 4 моля натрия и 2 моля газообразного хлора. Сколько энергии выделится в результате реакции? Стандартная энтальпия образования хлорида натрия = -411,120 кДж/моль
Сколько энергии выделится в результате реакции? Стандартная энтальпия образования хлорида натрия = -411,120 кДж/моль
Определение стандартной энтальпии образования хлорида натрия: При образовании 1 моль хлорида натрия наружу выделяется 411,120 кДж. При образовании 2 моль хлорида натрия наружу выделяется 411,120*2 кДж.
Теперь вы знаете, что выделяемое тепло зависит от количества образовавшегося хлорида натрия. Теперь вам предстоит выяснить, сколько хлорида натрия вырабатывается в этом вопросе.
По стехиометрии для реакции с 1 моль газообразного хлора требуется 2 моля натрия. Из-за этого для реакции с 2 молями газообразного хлора требуется 4 моля натрия, а в начале реакции имеется 4 моля.
- Выделившееся тепло = 411,120 кДж/моль* 4 моль
- Выделившееся тепло = 1644,480 кДж
Как узнать, произошла ли реакция?
Если вы смешаете значительное количество газообразного хлора и натрия, вы увидите, что идет реакция, потому что реакционный стакан будет красного цвета из-за выделения большого количества тепла. Если количество реагентов мало, выполните
качественный анализ ионов натрия и хлористых ионов.
Если количество реагентов мало, выполните
качественный анализ ионов натрия и хлористых ионов.
Вопросы
продукт реакции металлического натрия с газообразным хлором в реакции композиции
Когда натрий реагирует с газообразным хлором, в качестве продукта образуется хлорид натрия (NaCl). Да. Это реакция соединения, потому что два соединения соединяются вместе и дают одно соединение в качестве продукта.
Я хочу получить хлорид натрия по реакции. Я изучил несколько реакций, возможных для производства хлорида натрия. Одним из способов является реакция газообразного натрия и хлора. Другой способ — реакция соляной кислоты и реакция водного гидроксида натрия. Я хочу знать, как лучше всего приготовить хлорид натрия из этих двух методов?
Во-первых, в какой фазе нужен хлорид натрия? Твердый или водный или жидкий NaCl? Вы должны планировать свой метод в соответствии с физическим состоянием хлорида натрия.
Реакция натрия и хлора является прямым способом получения хлорида натрия, если вам нужен твердый NaCl. Но эта реакция слишком опасна, потому что она выделяет большое количество энергии, а хлор — смертельно ядовитый газ.
Но эта реакция слишком опасна, потому что она выделяет большое количество энергии, а хлор — смертельно ядовитый газ.
Во втором способе можно приготовить хлорид натрия в водном состоянии. Так что вам нужно удалить воду методом разделения, если вам нужен твердый хлорид натрия. Если вам нужен водный раствор хлорида натрия, это лучший способ сделать это.
Что насчет калия и хлора? Это похоже на реакцию натрия и хлора?
Да. Калий реагирует с хлором с образованием хлорида калия.
2K + Cl 2 → 2KCl
формула натрия и хлора?
Натрий + газообразный хлор → хлорид натрия
реакция металлического лития с газообразным хлором уравнение
Литий реагирует с газообразным хлором так же, как и натрий. Таким образом, уравнение очень похоже на реакцию газообразного натрия и хлора.
2Li + Cl 2 → 2LiCl
твердый натрий реагирует с газообразным хлором с образованием твердого хлорида натрия, верно ли это?
Да.