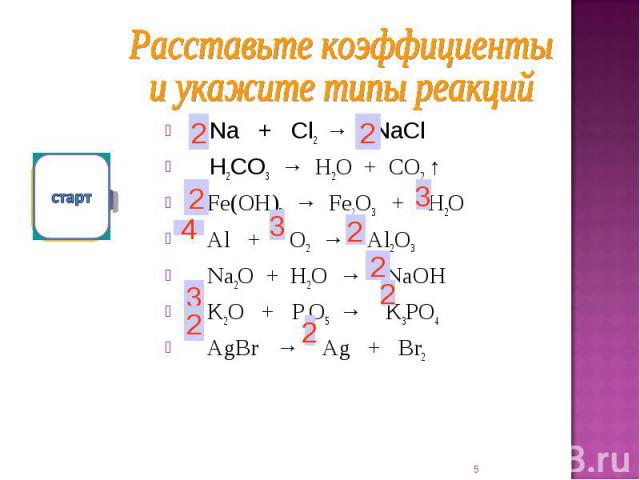
| 1 | Найти число нейтронов | H | |
| 2 | Найти массу одного моля | H_2O | |
| 3 | Баланс | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 4 | Найти массу одного моля | H | |
| 5 | Найти число нейтронов | Fe | |
| 6 | Найти число нейтронов | Tc | |
| 7 | Найти конфигурацию электронов | H | |
| 8 | Найти число нейтронов | Ca | |
| 9 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 10 | Найти число нейтронов | C | |
| 11 | Найти число протонов | H | |
| 12 | Найти число нейтронов | O | |
| 13 | Найти массу одного моля | CO_2 | |
| 14 | Баланс | C_8H_18+O_2→CO_2+H_2O | |
| 15 | Найти атомную массу | H | |
| 16 | Определить, растворима ли смесь в воде | H_2O | |
| 17 | Найти конфигурацию электронов | Na | |
| 18 | Найти массу одного атома | H | |
| 19 | Найти число нейтронов | Nb | |
| 20 | Найти число нейтронов | Au | |
| 21 | Найти число нейтронов | Mn | |
| 22 | Найти число нейтронов | Ru | |
| 23 | Найти конфигурацию электронов | ||
| 24 | Найти массовую долю | H_2O | |
| 25 | Определить, растворима ли смесь в воде | NaCl | |
| 26 | Найти эмпирическую/простейшую формулу | H_2O | |
| 27 | Найти степень окисления | H_2O | |
| 28 | Найти конфигурацию электронов | K | |
| 29 | Найти конфигурацию электронов | Mg | |
| 30 | Найти конфигурацию электронов | Ca | |
| 31 | Найти число нейтронов | Rh | |
| 32 | Найти число нейтронов | Na | |
| 33 | Найти число нейтронов | Pt | |
| 34 | Найти число нейтронов | Be | Be |
| 35 | Найти число нейтронов | Cr | |
| 36 | Найти массу одного моля | H_2SO_4 | |
| 37 | Найти массу одного моля | HCl | |
| 38 | Найти массу одного моля | Fe | |
| 39 | Найти массу одного моля | C | |
| 40 | Найти число нейтронов | Cu | |
| 41 | Найти число нейтронов | S | |
| 42 | Найти степень окисления | H | |
| 43 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 44 | Найти атомную массу | O | |
| 45 | Найти атомное число | H | |
| 46 | Найти число нейтронов | Mo | |
| 47 | Найти число нейтронов | Os | |
| 48 | Найти массу одного моля | NaOH | |
| 49 | Найти массу одного моля | O | |
| 50 | Найти конфигурацию электронов | Fe | |
| 51 | Найти конфигурацию электронов | C | |
| 52 | Найти массовую долю | NaCl | |
| 53 | Найти массу одного моля | ||
| 54 | Найти массу одного атома | Na | |
| 55 | Найти число нейтронов | N | |
| 56 | Найти число нейтронов | Li | |
| 57 | Найти число нейтронов | V | |
| 58 | Найти число протонов | N | |
| 59 | Упростить | H^2O | |
| 60 | Упростить | h*2o | |
| 61 | Определить, растворима ли смесь в воде | H | |
| 62 | Найти плотность при стандартной температуре и давлении | H_2O | |
| 63 | Найти степень окисления | NaCl | |
| 64 | Найти атомную массу | He | He |
| 65 | Найти атомную массу | Mg | |
| 66 | Найти число электронов | H | |
| 67 | Найти число электронов | O | |
| 68 | Найти число электронов | S | |
| 69 | Найти число нейтронов | Pd | |
| 70 | Найти число нейтронов | Hg | |
| 71 | Найти число нейтронов | B | |
| 72 | Найти массу одного атома | Li | |
| 73 | Найти эмпирическую формулу | H=12% , C=54% , N=20 | , , |
| 74 | Найти число протонов | Be | Be |
| 75 | Найти массу одного моля | Na | |
| 76 | Найти конфигурацию электронов | Co | |
| 77 | Найти конфигурацию электронов | S | |
| 78 | Баланс | C_2H_6+O_2→CO_2+H_2O | |
| 79 | Баланс | H_2+O_2→H_2O | |
| 80 | Найти конфигурацию электронов | P | |
| 81 | Найти конфигурацию электронов | Pb | |
| 82 | Найти конфигурацию электронов | Al | |
| 83 | Найти конфигурацию электронов | Ar | |
| 84 | Найти массу одного моля | O_2 | |
| 85 | Найти массу одного моля | H_2 | |
| 86 | Найти число нейтронов | K | |
| 87 | Найти число нейтронов | P | |
| 88 | Найти число нейтронов | Mg | |
| 89 | Найти число нейтронов | W | |
| 90 | Найти массу одного атома | C | |
| 91 | Упростить | na+cl | |
| 92 | Определить, растворима ли смесь в воде | H_2SO_4 | |
| 93 | Найти плотность при стандартной температуре и давлении | NaCl | |
| 94 | Найти степень окисления | C_6H_12O_6 | |
| 95 | Найти степень окисления | Na | |
| 96 | Определить, растворима ли смесь в воде | C_6H_12O_6 | |
| 97 | Найти атомную массу | Cl | |
| 98 | Найти атомную массу | Fe | |
| 99 | Найти эмпирическую/простейшую формулу | CO_2 | |
| 100 | Найти число нейтронов | Mt |
[PDF] Банк заданий по химии за курс 8 кл
Банк заданий для промежуточной аттестации по химии за курс 8-го класса. Выберите номер правильного ответа: А 1. Строение атома. 1. Заряд ядра атома углерода 1) 3 2) 10 3) 12 4) 6 2. Заряд ядра атома натрия 1) 23 2) 11 3) 12
Выберите номер правильного ответа: А 1. Строение атома. 1. Заряд ядра атома углерода 1) 3 2) 10 3) 12 4) 6 2. Заряд ядра атома натрия 1) 23 2) 11 3) 12
4) 4
3. Число протонов в ядре атома кальция 1) 20 2) 16 3) 21 4) 40 4. Число протонов в ядре атома серы 1) 32 2) 16 3) 9 4) 18 5. Число электронов около ядра атома кислорода 1) 16 2) 15 3) 9 4) 8 6. Число электронов около ядра атома кремния 1) 14 2) 15 3) 6 4) 28 7. Распределение электронов в атоме фосфора по энергетическим уровням соответствует ряду цифр 1) 2, 5 2) 2, 8 3) 2, 8, 3 4) 2, 8, 5 8. Распределение электронов в атоме алюминия по энергетическим уровням соответствует ряду цифр 1) 2, 3 2) 2, 8, 1 3) 2, 8, 3 4) 2, 8, 7 9. Число электронов на последнем энергетическом уровне у атома азота 1) 2 2) 4 3) 5 4) 7 10. Число электронов на последнем энергетическом уровне у атома калия 1) 4 2) 1 3) 19 4) 6 А 2 Закономерности изменения свойств химических элементов и их соединений.
1. В ряду элементов Si → P → S → Cl 1) уменьшается число электронных слоев в атомах 2) увеличиваются радиусы атомов 3) ослабевают неметаллические свойства 4) увеличивается число внешних электронов в атомах 2. В ряду элементов Li → Be → B → C 1) уменьшается число электронных слоев в атомах 2) уменьшаются радиусы атомов 3) ослабевают неметаллические свойства 4) уменьшается число внешних электронов в атомах 3. В ряду элементов F→ O→N→ C 1) уменьшается число электронных слоев в атомах 2) уменьшаются радиусы атомов 3) ослабевают неметаллические свойства 4) увеличивается число внешних электронов в атомах 4. В ряду элементов Bа → Sr → Ca → Mg 1) уменьшается число электронных слоев в атомах 2) увеличиваются радиусы атомов 3) ослабевают неметаллические свойства 1
В ряду элементов Li → Be → B → C 1) уменьшается число электронных слоев в атомах 2) уменьшаются радиусы атомов 3) ослабевают неметаллические свойства 4) уменьшается число внешних электронов в атомах 3. В ряду элементов F→ O→N→ C 1) уменьшается число электронных слоев в атомах 2) уменьшаются радиусы атомов 3) ослабевают неметаллические свойства 4) увеличивается число внешних электронов в атомах 4. В ряду элементов Bа → Sr → Ca → Mg 1) уменьшается число электронных слоев в атомах 2) увеличиваются радиусы атомов 3) ослабевают неметаллические свойства 1
4) уменьшается число внешних электронов в атомах 5. В ряду элементов N → P → As → Sb 1) уменьшается число электронных слоев в атомах 2) уменьшаются радиусы атомов 3) ослабевают неметаллические свойства 4) уменьшается число внешних электронов в атомах 6. В ряду элементов Te → Se → S → O 1) ослабевают неметаллические свойства 2) уменьшается число электронных слоев в атомах 3) уменьшается число внешних электронов в атомах 4) увеличиваются радиусы атомов 7.

4) Al, Mg, K
2. К металлам относятся 1) C, S, O 2) N, H, Na
4) Al, Mg, K
3) W, Cl, Ca
2
3. Оксидом металла является 1) HCl 2) CaO 3)
CO2
4) KOH
4. Оксидом неметалла является 1) HCl 2) CaO 3)
CO2
4) KOH
5. Ряд формул кислот 1) K2O, MgO, NaCl 2) Fe(OH)2, NaOH, Ca(OH)2 3) SO3, h3SO4, BaCl2
4) HCl, h3SO4, HNO3
6. Ряд формул оснований 1) K2O, MgO, NaCl 2) Fe(OH)2, NaOH, Ca(OH)2 3) SO3, h3SO4, BaCl2
4) HCl, h3SO4, HNO3
7. Ряд формул солей 1) KOН, NaNO3, NaCl
2) Fe(OH)2, CuCl2, Ca(OH)2 3) СаSO3, К2SO4, BaCl2 4) CuCO3, Na2SO4, HNO3
8. Формула сульфата натрия 1) Na2SO4 2) NaNO3
3) CuS
4) CuCO3
9. Формула нитрата натрия 1) Na2SO4 2) NaNO3
3) CuS
4) CuCO3
10. Формула карбоната калия 1) Na3РO4 2) NaNO3
3) CuО
4) К2CO3
А5. Химические свойства основных классов неорганических соединений. 1. Оксид кальция реагирует с 1) HCl 2) К2O 3) Mg(OH)2 4) К2SO4 2. Гидроксид натрия реагирует с 1) К2SO4 2) h3O 3) Са(OH)2
Химические свойства основных классов неорганических соединений. 1. Оксид кальция реагирует с 1) HCl 2) К2O 3) Mg(OH)2 4) К2SO4 2. Гидроксид натрия реагирует с 1) К2SO4 2) h3O 3) Са(OH)2
4) HCl
3. Углекислый газ реагирует с 1) HCl 2) h3O
3) Mg(OH)2
4) К2SO4
4. Железо реагирует с 1) HCl 2) СаO
3) Mg(OH)2
4) К2SO4
5. Серная кислота реагирует с 1) HCl 2) h3O
3) Mg(OH)2
4) К2SO4
6. Хлорид меди (II) реагирует с 1) HCl 2) К2O
3) NaOH
4) Na2SO4
7. Разбавленная серная кислота реагирует с 1 ) K2O 2) СO2 3) HCl 4) ВаSO4 8. Оксид фосфора (V) реагирует с 1) HCl 2) КNO3
3) NaOH
4) Na2SO4
А6. Теория электролитической диссоциации. 1. Ряд формул веществ электролитов 1) NaOH, Na2SO4, h3SO4 2) CO2, MgO, HCl
3) Cl2, Fe(OH)2, CuCl2
4) Cl2, N2 , CaO
2. Ряд формул веществ неэлектролитов 1) NaOH, Na2SO4, h3SO4 2) CO2, MgO, HCl
3) Cl2, Fe(OH)2, CuCl2
4) Cl2, N2 , CaO
3
3.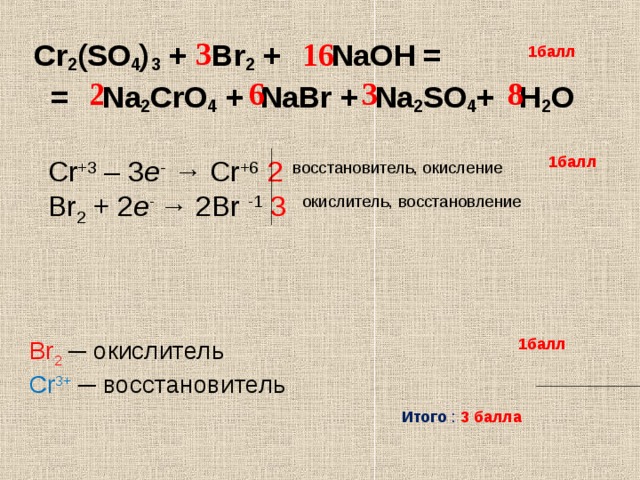 Ионы Н+ образуются при диссоциации 1) щелочей 2) кислот 3) солей 4) нерастворимых в воде оснований 4. Ионы ОН- образуются при диссоциации 1) щелочей 2) кислот 3) солей 4) нерастворимых в воде оснований 5. Отрицательно заряженные частицы называются 1) анионы 2) молекулы 3) атомы 4) катионы 6. Положительно заряженные частицы называются 1) анионы 2) молекулы 3) атомы 4) катионы 7. Краткое ионное уравнение взаимодействия серной кислоты с BaCl2 1) 2K + 2H+ = 2K+ + h3 2) Ba2+ + SO42 — = BaSO4 3) H+ + OH — = h3O 4) Ag+ + Cl — = AgCl 8. Краткое ионное уравнение взаимодействия серной кислоты с NaOH 1) 2K + 2H+ = 2K+ + h3 2) Ba2+ + SO42 — = BaSO4 3) H+ + OH — = h3O 4) Ag+ + Cl — = AgCl 9. Краткое ионное уравнение взаимодействия соляной кислоты с нитратом серебра 1) СО2- + 2H+ = СО2 + h3О 2) Ba2+ + SO42 — = BaSO4 + 3) H + OH = h3O 4) Ag+ + Cl — = AgCl А7. Массовая доля элемента в веществе. 1. Массовая доля железа в оксиде железа (II) 1) 22% 2) 77,8 % 3) 72% 4) 70 % 2. Массовая доля азота в оксиде азота (II) 1) 42% 2) 37,8 % 3) 12% 4) 46,7 % 3.
Ионы Н+ образуются при диссоциации 1) щелочей 2) кислот 3) солей 4) нерастворимых в воде оснований 4. Ионы ОН- образуются при диссоциации 1) щелочей 2) кислот 3) солей 4) нерастворимых в воде оснований 5. Отрицательно заряженные частицы называются 1) анионы 2) молекулы 3) атомы 4) катионы 6. Положительно заряженные частицы называются 1) анионы 2) молекулы 3) атомы 4) катионы 7. Краткое ионное уравнение взаимодействия серной кислоты с BaCl2 1) 2K + 2H+ = 2K+ + h3 2) Ba2+ + SO42 — = BaSO4 3) H+ + OH — = h3O 4) Ag+ + Cl — = AgCl 8. Краткое ионное уравнение взаимодействия серной кислоты с NaOH 1) 2K + 2H+ = 2K+ + h3 2) Ba2+ + SO42 — = BaSO4 3) H+ + OH — = h3O 4) Ag+ + Cl — = AgCl 9. Краткое ионное уравнение взаимодействия соляной кислоты с нитратом серебра 1) СО2- + 2H+ = СО2 + h3О 2) Ba2+ + SO42 — = BaSO4 + 3) H + OH = h3O 4) Ag+ + Cl — = AgCl А7. Массовая доля элемента в веществе. 1. Массовая доля железа в оксиде железа (II) 1) 22% 2) 77,8 % 3) 72% 4) 70 % 2. Массовая доля азота в оксиде азота (II) 1) 42% 2) 37,8 % 3) 12% 4) 46,7 % 3. Массовая доля кислорода в воде 1) 11 % 2) 79,8 % 3) 70,2%
Массовая доля кислорода в воде 1) 11 % 2) 79,8 % 3) 70,2%
4) 89 %
4. Массовая доля алюминия в оксиде алюминия 1) 52,9 % 2) 17,8 % 3) 56,2% 4) 48 % 5. Массовая доля хлора в хлориде железа (II) 1) 44,1 % 2) 47,8 % 3) 62,3 % 4) 55,9 % 6.Массовая доля магния в оксиде магния 1) 71 % 2) 60 % 3) 50 % 4) 28 % 7.Массовая доля серы в оксиде серы (IV) 1) 71 % 2) 60 % 3) 50 % 4) 28 % А8 Количество вещества. Число Авогадро. Молярная масса вещества. Масса вещества. 1. Молярная масса гидроксида натрия 1) 63 г/моль 2) 56 г/моль 3) 98 г/моль 4) 40 г/моль 2. Молярная масса азотной кислоты 1) 63 г/моль 2) 56 г/моль 3) 98 г/моль
4) 40 г/моль
3.Число молекул в 3 моль водорода 1) 18 ∙ 1023 2) 30 ∙ 1023 3) 12 ∙ 1023 4) 6 ∙ 1023 4.Число молекул в 0,1 моль воды 1) 1,5 ∙ 1023 2) 0,6 ∙ 1023
3) 12 ∙ 1022 4) 1,8 ∙ 1023
4
5. Количество вещества, содержащее 1,2 ∙ 1023 молекул воды 1) 0,1 моль 2) 2 моль 3) 0,2 моль 4) 1 моль 6. Количество вещества, содержащее 36 ∙ 1023 молекул воды 1) 6 моль 2) 4 моль 3) 5 моль 4) 0,4 моль 7. Количество вещества, содержащееся в 1,7 г сероводорода 1) 0,1 моль 2) 0,05 моль 3) 0,2 моль 4) 0,5 моль 8. Количество вещества, содержащееся в 24 г углерода 1) 1 моль 2) 2 моль 3) 0,3 моль 4) 0,25 моль 9. Масса 5 моль кислорода 1) 80 г 2) 32 г
Количество вещества, содержащееся в 1,7 г сероводорода 1) 0,1 моль 2) 0,05 моль 3) 0,2 моль 4) 0,5 моль 8. Количество вещества, содержащееся в 24 г углерода 1) 1 моль 2) 2 моль 3) 0,3 моль 4) 0,25 моль 9. Масса 5 моль кислорода 1) 80 г 2) 32 г
3) 160 г
10. Масса 1,5 моль сернистого газа 1) 48 г 2) 96 г 3) 64 г 11. Масса 3 ∙ 1023 молекул воды 1) 36 г 2) 18 г 3) 16 г
4) 16 г 4) 56 г 4) 9 г
12. Масса 1,5 ∙ 1023 молекул сернистого газа (SO2) 1) 25,6 г 2) 16 г 3) 12 г 4) 1,9 г 13. Число атомов в 160 г меди 1) 15 ∙ 1023 2) 30 ∙ 1023
3) 18 ∙ 1023 4) 6 ∙ 1023
14. Число молекул в 49 г серной кислоты 1) 1,5 ∙ 1023 2) 3 ∙ 1023 3) 1,8 ∙ 1023 4) 9 ∙ 1023 А.9 Массовая доля вещества в растворе. 1. Массовая доля вещества в растворе, для приготовления которого взяли 10 г соли и 90 г воды равна 1) 12,5 % 2) 20 % 3) 10 % 4) 25 % 2. Массовая доля вещества в растворе, для приготовления которого взяли 40 г сахара и 110 г воды равна 1) 23 % 2) 26,7 % 3) 20 % 4) 15 % 3. Масса вещества в 150 г 7 % -ного раствора 1) 10,5 г 2) 12 г 3) 105 г 4) 21,42 г 4.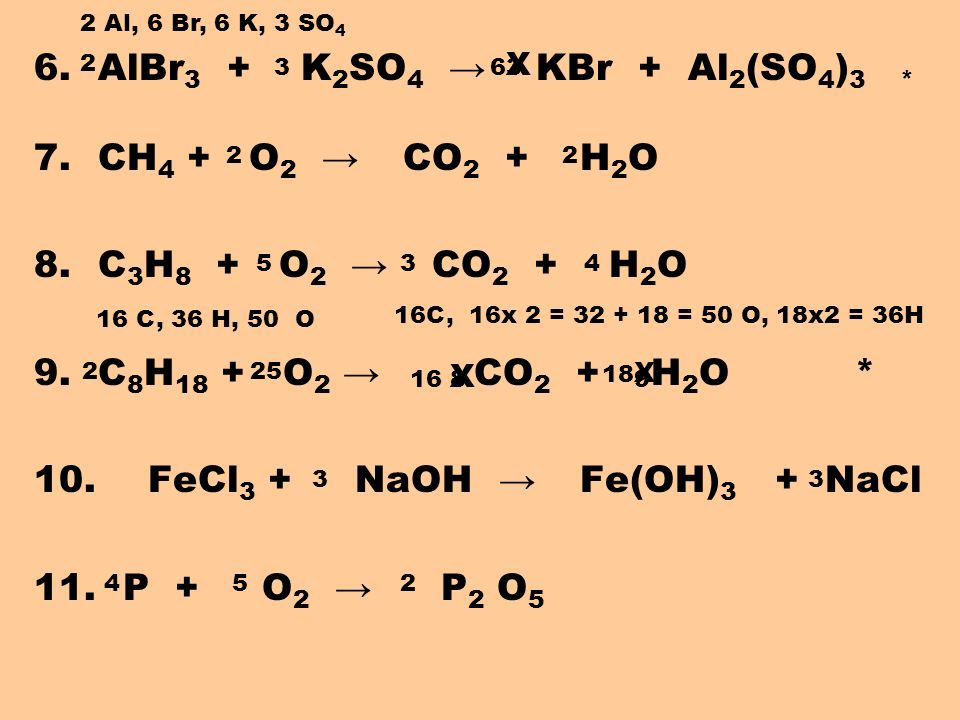 Масса вещества в 400 г 5 % -ного раствора 1) 15 г 2) 80 г 3) 10 г 4) 20 г 5. Масса вещества и масса воды в 200 г 8 % -ного раствора 1) 16 г и 184 г 2) 12 г и 188 г 3) 25 г и 175 г 4) 21 г и 150 г 6. Массовая доля вещества в растворе, приготовленного из 20 г сахара и 180 г воды 1) 5 % 2) 10 % 3) 20 % 4) 14 % 7. Массовая доля вещества в растворе, приготовленного из 30 г соли и 120 г воды 1) 5 % 2) 10 % 3) 20 % 4) 14 % А10 Химические уравнения. 1. Сумма коэффициентов в уравнении реакции 1) 3 2) 4 3) 5 4) 6 моль 2. Сумма коэффициентов в уравнении реакции 1) 6 2) 3 3) 4 4) 5
Масса вещества в 400 г 5 % -ного раствора 1) 15 г 2) 80 г 3) 10 г 4) 20 г 5. Масса вещества и масса воды в 200 г 8 % -ного раствора 1) 16 г и 184 г 2) 12 г и 188 г 3) 25 г и 175 г 4) 21 г и 150 г 6. Массовая доля вещества в растворе, приготовленного из 20 г сахара и 180 г воды 1) 5 % 2) 10 % 3) 20 % 4) 14 % 7. Массовая доля вещества в растворе, приготовленного из 30 г соли и 120 г воды 1) 5 % 2) 10 % 3) 20 % 4) 14 % А10 Химические уравнения. 1. Сумма коэффициентов в уравнении реакции 1) 3 2) 4 3) 5 4) 6 моль 2. Сумма коэффициентов в уравнении реакции 1) 6 2) 3 3) 4 4) 5
Ca + O2 → CaO Na + Cl2 → NaCl
5
3. Сумма коэффициентов в уравнении реакции 1) 7 2) 5 3) 4 4) 3
Аl + Cl2 → АlCl3
4. Сумма коэффициентов в уравнении реакции 1) 6 2) 9 3) 7 4) 5
Аl + О2 → Аl2О3
5. Сумма коэффициентов в уравнении реакции 1) 3 2) 7 3) 9 4) 5
Na + Н2О→ NaОН + Н2
6. Сумма коэффициентов в уравнении реакции 1) 6 2) 3 3) 4 4) 5
NaОН + НCl → NaCl + Н2О
7. Сумма коэффициентов в уравнении реакции 1) 13 2) 9 3) 7 4) 11
Сумма коэффициентов в уравнении реакции 1) 13 2) 9 3) 7 4) 11
Р + О2 → Р2О5
8. Сумма коэффициентов в уравнении реакции 1) 4 2) 5 3) 6 4) 9
ZnS + О2 → ZnО + SO2
9. Коэффициент перед формулой кислорода в химическом уравнении 1) 2 2) 3 3) 4 4) 5 10. Коэффициент перед формулой кислоты в химическом уравнении 1) 1 2) 2 3) 3 4) 4
Fe + O2 = Fe3O4
MgO + HCl = MgCl2 + h3O
11. Коэффициент перед формулой основания в химическом уравнении NaOH + h3SO4 = Na2SO4 + h3O 1) 2 2) 3 3) 4 4) 1 A11. Высшие оксиды и гидроксиды химических элементов.
Установите соответствие: 1.
ЭЛЕМЕНТ А) Li Б) Al В) N Г) Са
ФОРМУЛА ВЫСШЕГО ОКСИДА 1) ЭО 2) Э2О 3) Э2О3 4) Э2О5 5) ЭО2 2. ЭЛЕМЕНТ ФОРМУЛА ВЫСШЕГО ОКСИДА А) Cl 1) ЭО2 Б) C 2) ЭО В) S 3) Э2О3 Г) Be 4) Э2О7 5) ЭО3 3. ЭЛЕМЕНТ ФОРМУЛА ВЫСШЕГО ГИДРОКСИДА А) Li 1) НЭО3 Б) Al 2) Э(ОН)3 В) N 3) ЭОН Г) Са 4) НЭО4 5) Э(ОН)2 4. ФОРМУЛА ВЫСШЕГО ОКСИДА ЭЛЕМЕНТ А) Э2О5 1) натрий Б) ЭО2 2) фосфор В) ЭО3 3) бром Г) Э2О7 4) кремний 5) сера 5. ФОРМУЛА ВЫСШЕГО ГИДРОКСИДА ЭЛЕМЕНТ А) Э(ОН)2 1) калий Б) Н2ЭО3 2) бор В) Н3ЭО3 3) азот Г) ЭОН 4) магний 5) кремний
ФОРМУЛА ВЫСШЕГО ГИДРОКСИДА ЭЛЕМЕНТ А) Э(ОН)2 1) калий Б) Н2ЭО3 2) бор В) Н3ЭО3 3) азот Г) ЭОН 4) магний 5) кремний
6
A12. Номенклатура неорганических веществ. 1. Установите соответствие: Формула вещества А) NaCl Б) HNO3 В) K2O Г) Cu(OH)2 2. Установите соответствие: Формула вещества А) СО2 Б) CuSO4 В) HCl Г) KOH 3. Установите соответствие: Формула вещества А) Ca(OH)2 Б) ВаCl2 В) h4PO4 Г) МgO 4. Установите соответствие: Формула вещества . A) FeSO4 Б) h3SO4 В) СaО Г) NaOH 5. Установите соответствие: Формула вещества . A) FeS Б) h3S В) Сa3Р2 Г) Мg(OH)2
Название вещества 1) оксид калия 2) гидроксид меди (II) 3) азотная кислота 4) соляная кислота 5) хлорид натрия Название вещества 1) гидроксид калия 2) серная кислота 3) сульфат меди (II) 4) оксид углерода (IV) 5) соляная кислота Название вещества 1) оксид магния 2) сульфат железа (II) 3) гидроксид кальция 4) хлорид бария 5) серная кислота 6) фосфорная кислота Название вещества 1) оксид кальция 2) оксид калия 3) серная кислота 4) сульфат железа (II) 5) гидроксид кальция 6) гидроксид натрия Название вещества 1) фосфат кальция 2) гидроксид магния 3) сероводород 4) сульфат железа (II) 5) сульфид железа (II) 6) фосфид кальция
A13. Классификация химических реакций. Установите соответствие между уравнением реакции и типом химической реакции: 1. УРАВНЕНИЕ РЕАКЦИИ ТИП РЕАКЦИИ А) CaCO3 = CaO + CO2 1) соединения Б) Zn + CuCl2 = ZnCl2 + Cu 2) разложения В) N2 + 3h3 = 2Nh4 3) замещения Г) CuO + h3SO4 = CuSO4 + h3O 4) обмена 2.
Классификация химических реакций. Установите соответствие между уравнением реакции и типом химической реакции: 1. УРАВНЕНИЕ РЕАКЦИИ ТИП РЕАКЦИИ А) CaCO3 = CaO + CO2 1) соединения Б) Zn + CuCl2 = ZnCl2 + Cu 2) разложения В) N2 + 3h3 = 2Nh4 3) замещения Г) CuO + h3SO4 = CuSO4 + h3O 4) обмена 2.
УРАВНЕНИЕ РЕАКЦИИ А) Ca(ОН)2 + 2HСl = СаCl2 + 2Н2O Б) CuO + СО2 = CuCO3 В) S + O2 = SO2 Г) 4HNO3 = 4NO2 + 2Н2O + О2
3.
УРАВНЕНИЕ РЕАКЦИИ
ТИП РЕАКЦИИ 1) разложения 2) обмена 3) соединения 4) замещения ТИП РЕАКЦИИ
7
А) MgO + CO2 = MgCO3 Б) ZnO + h3SO4 = ZnSO4 + h3O В) Fe + 2HCl = FeCl2 + h3 Г) 2HgO = 2Hg + O2 4.
УРАВНЕНИЕ РЕАКЦИИ А) 3Fe + 4h3O = Fe3O4 + 4h3 Б) 2 Zn + O2= 2 ZnO В) Mg(OH)2 + h3SO4 = MgSO4 + 2h3O Г) 2Hg + O2 = 2HgO
5.
ТИП РЕАКЦИИ А) обмена Б) соединения В) замещения Г) разложения
1) разложения 2) соединения 3) замещения 4) обмена ТИП РЕАКЦИИ 1) разложения 2) соединения 3) замещения 4) обмена УРАВНЕНИЕ РЕАКЦИИ 1) CaCO3 = CaO + CO2 2) 2Na+ 2h3O = 2NaOH + h3 3) Fe(OH)2 + 2HCl = FeCl2 +2h3O 4) C + O2 = CO2
Часть 2 Запишите полное решение задания. 2.1 Реакции ионного обмена. (2 балла) А 14. 1.Напишите общее и ионное уравнение реакции взаимодействия растворов хлорида бария и сульфата натрия. 2.Напишите общее и ионное уравнение реакции взаимодействия растворов хлорида бария и серной кислоты. 3. Напишите общее и ионное уравнение реакции взаимодействия растворов хлорида бария и нитрата серебра. 4. Напишите общее и ионное уравнение реакции взаимодействия растворов карбоната натрия и соляной кислоты. 5. Напишите общее и ионное уравнение реакции взаимодействия растворов хлорида аммония и гидроксида натрия. 6. Напишите общее и ионное уравнение реакции взаимодействия карбоната кальция с раствором азотной кислоты. 2.2 Генетическая связь неорганических веществ. (4 балла) А15. 1) Осуществите превращения: Na → Na2O → NaOH → Na2SO4 Напишите уравнения реакций, укажите тип реакций, назовите продукты. 2) Осуществите превращения: P → P2O5 → h4PO4 → Са3(PO4)2 Напишите уравнения реакций, укажите тип реакций, назовите продукты. 3) Осуществите превращения: C → CO2 → h3CO3 → K2CO3 Напишите уравнения реакций, укажите тип реакций, назовите продукты.
2.1 Реакции ионного обмена. (2 балла) А 14. 1.Напишите общее и ионное уравнение реакции взаимодействия растворов хлорида бария и сульфата натрия. 2.Напишите общее и ионное уравнение реакции взаимодействия растворов хлорида бария и серной кислоты. 3. Напишите общее и ионное уравнение реакции взаимодействия растворов хлорида бария и нитрата серебра. 4. Напишите общее и ионное уравнение реакции взаимодействия растворов карбоната натрия и соляной кислоты. 5. Напишите общее и ионное уравнение реакции взаимодействия растворов хлорида аммония и гидроксида натрия. 6. Напишите общее и ионное уравнение реакции взаимодействия карбоната кальция с раствором азотной кислоты. 2.2 Генетическая связь неорганических веществ. (4 балла) А15. 1) Осуществите превращения: Na → Na2O → NaOH → Na2SO4 Напишите уравнения реакций, укажите тип реакций, назовите продукты. 2) Осуществите превращения: P → P2O5 → h4PO4 → Са3(PO4)2 Напишите уравнения реакций, укажите тип реакций, назовите продукты. 3) Осуществите превращения: C → CO2 → h3CO3 → K2CO3 Напишите уравнения реакций, укажите тип реакций, назовите продукты. 4) Осуществите превращения: К → КOH → К2SO4 → BaSO4 Напишите уравнения реакций, укажите тип реакций, назовите продукты. 5) Осуществите превращения: S → SO2 → h3SO3 → K2SO3 Напишите уравнения реакций, укажите тип реакций, назовите продукты. 6) Осуществите превращения: К → К2O → КOH → К3РO4 Напишите уравнения реакций, укажите тип реакций, назовите продукты. 7) Осуществите превращения: Са → СаO → Са(OH)2 → СаСО3 Напишите уравнения реакций, укажите тип реакций, назовите продукты.
4) Осуществите превращения: К → КOH → К2SO4 → BaSO4 Напишите уравнения реакций, укажите тип реакций, назовите продукты. 5) Осуществите превращения: S → SO2 → h3SO3 → K2SO3 Напишите уравнения реакций, укажите тип реакций, назовите продукты. 6) Осуществите превращения: К → К2O → КOH → К3РO4 Напишите уравнения реакций, укажите тип реакций, назовите продукты. 7) Осуществите превращения: Са → СаO → Са(OH)2 → СаСО3 Напишите уравнения реакций, укажите тип реакций, назовите продукты.
8
Реакция натрия и газообразного хлора
Натрий, очень активный металл, который реагирует с газообразным хлором и дает хлорид натрия, нейтральную соль. Натрий окисляется до катиона натрия (Na + ), а газообразный хлор восстанавливается до хлорид-анионов (Cl —).
Механизм реакции
Мы знаем, что натрий является очень активным металлом, а хлор также является очень активным неметаллом. Обычно металлы любят удалять электроны, а неметаллы, такие как галогены, любят принимать электроны.
Натрий легко устраняет свои последние электроны оболочки, превращаясь в катион Na + , и хлор принимает это электрон с образованием аниона Cl — .
Сбалансированное химическое уравнение Na + Cl
2 реакцияNa + Cl 2 → 2NaCl
Два моля газообразного хлора реагируют с одним молем натрия с образованием двух молей хлорида натрия.
Эту реакцию легче сбалансировать методом контроля, чем окислительно-восстановительным методом. Окислительно-восстановительный метод займет много времени. Но это полезно для балансировки больших окислительно-восстановительных уравнений.
Как сбалансировать реакцию окислительно-восстановительного метода?
Это очень простая окислительно-восстановительная реакция для балансировки, и если вы новичок в уравнениях балансировки, это также хороший пример, чтобы начать балансировку окислительно-восстановительной реакции.
Натрий окисляется от степени окисления 0 до степени окисления +1. Хлор восстанавливается до степени окисления -1.
от 0 степени окисления. Напишите степени окисления, если каждый атом близок к атомам.
Хлор восстанавливается до степени окисления -1.
от 0 степени окисления. Напишите степени окисления, если каждый атом близок к атомам.
Проверить число атомов окисленного и восстановленного в реакции (левая и правая часть) и уравновесить их, если они не сбалансированы, как следующий шаг. В левой части два атома хлора. Чтобы сбалансировать их, сделайте два хлорида натрия справа. Тогда в правой части реакции два атома натрия, а в левой только один. сторона. Следовательно, сделайте два атома натрия слева.
Затем найдите разность степеней окисления окисленных атомов (натрий в ион натрия) и восстановленных атомов (хлор к хлориду). Разница степеней окисления натрия составляет два, а для хлора — два. Так они же и компенсируют друг друга.
Физические изменения реакции
Твердый реагент натрия реагирует с зелено-желтым газообразным хлором с образованием твердого хлорида натрия
который представляет собой белое кристаллическое твердое вещество.
Эта реакция протекает с высокой скоростью, поскольку оба реагента очень реакционноспособны. Натрий – металл 1 группы, любит удалять свои внешние электроны, а хлор хочет забирать электроны извне.
Энтальпия реакции натрия и хлора
Реакция натрия и хлора экзотермическая (в результате реакции выделяется тепло). Энтальпию реакции принимают за энтальпию образования двух молей хлорида натрия.
Стандартная энтальпия реакции = -411,12 кДж
Энтропия реакции (298 0 C) = 72,10 Дж/(К моль)
Проведем простой расчет.
Вы собираетесь смешать 4 моля натрия и 2 моля газообразного хлора. Сколько энергии выделится в результате реакции? Стандартная энтальпия образования хлорида натрия = -411,120 кДж/моль
Определение стандартной энтальпии образования хлорида натрия: При образовании 1 моль хлорида натрия наружу выделяется 411,120 кДж. При образовании 2 моль хлорида натрия наружу выделяется 411,120*2 кДж.
Теперь вы знаете, что выделяемое тепло зависит от количества образовавшегося хлорида натрия. Теперь вам предстоит выяснить, сколько хлорида натрия вырабатывается в этом вопросе.
По стехиометрии для реакции с 1 моль газообразного хлора требуется 2 моля натрия. Из-за этого для реакции с 2 молями газообразного хлора требуется 4 моля натрия, а в начале реакции имеется 4 моля.
- Выделившееся тепло = 411,120 кДж/моль* 4 моль
- Выделившееся тепло = 1644,480 кДж
Как узнать, произошла ли реакция?
Если вы смешаете значительное количество газообразного хлора и натрия, вы увидите, что идет реакция, потому что реакционный стакан будет красного цвета из-за выделения большого количества тепла. Если количество реагентов мало, выполните качественный анализ ионов натрия и хлористых ионов.
Вопросы
продукт реакции металлического натрия с газообразным хлором в реакции композиции
Когда натрий реагирует с газообразным хлором, в качестве продукта образуется хлорид натрия (NaCl). Да. Это реакция соединения, потому что два соединения соединяются вместе и дают одно соединение в качестве продукта.
Да. Это реакция соединения, потому что два соединения соединяются вместе и дают одно соединение в качестве продукта.
Я хочу получить хлорид натрия по реакции. Я изучил несколько реакций, возможных для производства хлорида натрия. Одним из способов является реакция газообразного натрия и хлора. Другой способ — реакция соляной кислоты и реакция водного гидроксида натрия. Я хочу знать, как лучше всего приготовить хлорид натрия из этих двух методов?
Во-первых, в какой фазе нужен хлорид натрия? Твердый или водный или жидкий NaCl? Вы должны планировать свой метод в соответствии с физическим состоянием хлорида натрия.
Реакция натрия и хлора является прямым способом получения хлорида натрия, если вам нужен твердый NaCl. Но эта реакция слишком опасна, потому что она выделяет большое количество энергии, а хлор — смертельно ядовитый газ.
Во втором способе можно приготовить хлорид натрия в водном виде. Так что вам нужно удалить воду методом разделения, если вам нужен твердый хлорид натрия. Если вам нужен водный раствор хлорида натрия, это лучший способ сделать это.
Если вам нужен водный раствор хлорида натрия, это лучший способ сделать это.
Что насчет калия и хлора? Это похоже на реакцию натрия и хлора?
Да. Калий реагирует с хлором с образованием хлорида калия.
2K + Cl 2 → 2KCl
формула натрия и хлора?
Натрий + газообразный хлор → хлорид натрия
реакция металлического лития с газообразным хлором уравнение
Литий реагирует с газообразным хлором так же, как и натрий. Таким образом, уравнение очень похоже на реакцию газообразного натрия и хлора.
2Li + Cl 2 → 2LiCl
твердый натрий реагирует с газообразным хлором с образованием твердого хлорида натрия, верно ли это?
Да. происходит реакция.
какое уравнение реакции для металлического натрия и газообразного хлора
Na + Cl 2 → NaCl , это не сбалансированное уравнение. Это уравнение обозначает только реагенты и продукты.
нет данных cl2, который является токсичным?
Хлор (Cl 2 ) очень токсичен, и с ним следует обращаться очень осторожно, чтобы не повредить людей?
сжигание металлического натрия в газообразном хлоре с образованием хлорида натрия является типом реакции
Это реакция объединения . Два реагента соединяются вместе, чтобы произвести один продукт. Натрий и хлор являются двумя реагентами, а хлорид натрия является единственным продуктом.
Два реагента соединяются вместе, чтобы произвести один продукт. Натрий и хлор являются двумя реагентами, а хлорид натрия является единственным продуктом.
Уравнение слов для натрия и хлора
Твердый металлический натрий+ Газообразный хлор → Твердый хлорид натрия
Учебные пособия по натрию и хлору
Реакция гидроксида натрия и газообразного хлора
Тестирование ионов хлорида
Химия щелочноземельных металлов
Химия щелочных металлов
Амфотерные соединения реагируют с NaOH
Идентифицировать катионы путем осаждения
Осаждает составные цвета
степени окисления
Элементы периодической таблицы
Процесс производства карбоната натрия
Демонстрации — натрий + хлор
Демонстрации — натрий + хлор| Панель навигации | |
| ОСНОВНОЙ | Демонстрации |
Натрий — металл серебристого цвета, достаточно мягкий для резки
нож. Это чрезвычайно реакционноспособный металл, и в природе он всегда присутствует в
ионные соединения, а не в чистом металлическом виде. Чистый металлический натрий реагирует
бурно (а иногда и взрывоопасно) с водой, образуя гидроксид натрия,
газообразный водород и тепло:
Это чрезвычайно реакционноспособный металл, и в природе он всегда присутствует в
ионные соединения, а не в чистом металлическом виде. Чистый металлический натрий реагирует
бурно (а иногда и взрывоопасно) с водой, образуя гидроксид натрия,
газообразный водород и тепло:
2Na(тв) + 2H 2 O(ж) ——> 2NaOH(водн.) + H 2 (г)
Хлор — ядовитый желто-зеленый газ с очень резким запахом. запах и использовался в газовой войне во время Первой мировой войны.
Натрий и хлор реагируют друг с другом, однако с образованием вещества знаком почти всем в мире: хлорид натрия , или поваренная соль:
2Na(т) + Cl 2 (г) ——> 2NaCl(т)
Легко понять, почему эта реакция протекает так легко, если посмотреть на нее.
на атомном уровне: натрий имеет один электрон на самом внешнем уровне (валентность)
оболочке, в то время как хлор имеет семь электронов в своей валентной оболочке. Когда
атом натрия передает электрон атому хлора, образуя катион натрия
(Na + ) и хлорид-анион (Cl — ), оба иона имеют полную
валентные оболочки и энергетически более стабильны.
Когда
атом натрия передает электрон атому хлора, образуя катион натрия
(Na + ) и хлорид-анион (Cl — ), оба иона имеют полную
валентные оболочки и энергетически более стабильны.
Реакция чрезвычайно экзотермична, дает ярко-желтый свет и большое количество тепловой энергии.
В следующих демонстрациях 2,5-литровая бутыль заполняется хлором. газ. Покрытие из песка на дне бутылки поглощает часть тепловая энергия, выделяющаяся в ходе реакции, и предотвращает ее разрушение. А в колбу помещают небольшой кусочек свеженарезанного металлического натрия, а затем добавляется небольшое количество воды, которая вступает в реакцию с натрием и вызывает его стать горячим. Затем горячий натрий вступает в реакцию с хлором, образуя ярко-желтый свет, большое количество тепловой энергии и пары хлорида натрия, который оседает на стенках бутылки.
В первом ролике натрий вспыхивает практически сразу после
реагирует с водой и быстро «выгорает». (Не моргай,
иначе вы его пропустите.) Во втором случае воду добавляют дважды, чтобы получить один
короткая вспышка, за которой следует более длинная. (Эту реакцию можно провести и с расплавленным натрием, но я никогда не был смелым
достаточно попробовать.)
(Не моргай,
иначе вы его пропустите.) Во втором случае воду добавляют дважды, чтобы получить один
короткая вспышка, за которой следует более длинная. (Эту реакцию можно провести и с расплавленным натрием, но я никогда не был смелым
достаточно попробовать.)
Видеоклип 1: НАСТОЯЩИЙ, 679 КБ
Видеоклип 2: НАСТОЯЩИЙ, 1,74 МБ
!!! Опасности !!!
Не подвергайте металлический натрий воздействию воды! Реакция натрия и воды производит газообразный водород и тепло, что является хорошей комбинацией , а не ! натрий должны храниться под минеральным маслом или каким-либо другим высокомолекулярным углеводород.
Газообразный хлор токсичен и сильно раздражает глаза и слизистые. мембраны.
Эта реакция выделяет большое количество тепловой энергии; убедитесь, что колба
не имеет в нем трещин.