Ответы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука
| Похожие вопросы |
В каком году была сформулирована теория — предшественница кислородной теории горения.
В 150 мл воды растворили 33,6л аммиака (н. у) . Найдите массовую долю аммиака в полученном растворе.
Структурная формула всех изомеров С7Н16
Решено
помогите срочно решить задачу: при сжигании 4,4 г углеводорода получили 13,2 г оксида углерода (IV). Относительная плотность вещества по воздухуравна 1,52. Определите молекулярную формулу этого вещест
Относительная плотность вещества по воздухуравна 1,52. Определите молекулярную формулу этого вещест
Решено
KMnO4+h3O2=MnO2+KOH+O2+h3O Объясните, как уравнять, пожалуйста
Пользуйтесь нашим приложением
что, как сбалансировать и часто задаваемые вопросы —
By Бисваруп Чандра Дей
КМnО4 является сильным окислителем и может реагировать с молекулами, имеющими более высокий восстановительный потенциал. Рассмотрим подробно механизм его реакции с h3SO4.
Перманганат калия представляет собой твердую молекулу пурпурного цвета и является мощным реагентом, поскольку центральный металл Mn имеет степень окисления +7. Он может реагировать с холодной и концентрированной формой серной кислоты и образовывать различные продукты окисления. В этой реакции KMnO4 действует как самокатализатор.
О механизме реакции между серной кислотой и железом, энтальпии реакции, типе реакции, образовании продукта и т.д. поговорим в следующей части статьи.
1. Чему равно произведение H
2SO4 и KMnO4?Сульфат марганца и сульфат калия образуются в качестве основных продуктов, когда H2SO4 и KMnO4 реагируют вместе. Молекулы воды и газообразный кислород также выделяются в результате их реакции.Продукт реакции
между Н2SO4 и KMnO4
2. Какой тип реакции Н
2SO4 + КМnО4?H2SO4 + Реакция KMnO4 является примером реакции двойного замещения наряду с окислительно-восстановительными реакциями и реакциями осаждения. Это также реакция выделения кислорода наряду с реакцией гидролиза.
3. Как сбалансировать H
2SO4 + КМnО4?H2SO4 + КМnО4 = МnSO4 + К2SO4 + H2О + О2 Мы должны сбалансировать уравнение следующим образом:
- Шаг 1 – Маркировка всех реагентов и продуктов необходимым количеством алфавитов
- Во-первых, мы обозначили все реагенты и продукты буквами A, B, C, D и E, так как для этой реакции получено только пять различных атомов, и реакция выглядит как: AH2SO4 + В KMnO4 = C MnSO4 + НЗ2SO4 + ЭХ2О + ФО2
- Шаг 2 – Приравнивание всех коэффициентов для всех элементов одного типа путем их перестановки
- После перестановки всех коэффициентов тех же элементов по их стехиометрической пропорции получаем, H = 2A = 2E, S = A = C = D, O = 4A = 4B = 4C = 4D = E = 2F, Mn = B = С, К = В = 2d
- Шаг 3 – Использование метода исключения Гаусса для определения значений коэффициентов
- Используя исключение Гаусса и приравнивая все полученные уравнения, A = 6, B = 4, C = 4, D = 2, E = 6 и F = 5,
- Шаг 4- теперь запишите все уравнение в сбалансированной форме
- Общее сбалансированное уравнение будет,
- 6 H2SO4 + 4 KMnO4 = 4 MnSO4 + 2 К2SO4 + 6H2О + 5 О2
4.
 Ч2SO4 + КМnО4 титрование
Ч2SO4 + КМnО4 титрованиеЧтобы оценить количество калия или марганца, мы можем выполнить титрование между KMnO4 и H2SO4
Используемый аппарат
Для этого титрования нам потребуются бюретка, коническая колба, держатель бюретки, мерная колба и стаканы.
Титр и титрант
H2SO4 по сравнению с KMnO4, H2SO4 акты в качестве титранта, который берется в бюретку и анализируется молекула KMnO4 который отбирают в коническую колбу.
Индикаторные
Все титрование проводят в кислой среде, так как концентрация H2SO4 высока, и для этой реакции KMnO4 действует как самоиндикатор, потому что это окрашенный раствор и при разном pH он меняет цвет.
Процедура
Бюретка заполнялась стандартизированным H2SO4 и KMnO4 отбирали в коническую колбу вместе с соответствующим индикатором. H2SO4 добавляют по каплям в коническую колбу и колбу постоянно встряхивают. Через определенное время, когда конечная точка прибыла KMnO4 меняет свой цвет.
H2SO4 добавляют по каплям в коническую колбу и колбу постоянно встряхивают. Через определенное время, когда конечная точка прибыла KMnO4 меняет свой цвет.
Мы повторяем титрование несколько раз для получения лучших результатов, а затем оцениваем количество калия и марганца по формуле V1S1 V =2S2.
5. Ч
2SO4+ КМnО4 чистое ионное уравнениеЧистое ионное уравнение между H2SO4 + КМnО4 как следует,
2H+ + ТАК42- + K+ + MnO4– = Мн2+ + K+ + SO42- + H+ + OH– + О2
- Чтобы получить чистое ионное уравнение, необходимы следующие шаги:
- Первый Н2SO4 будет ионизирован протонными и сульфат-ионами, так как это сильный электролит
- После этого KMnO4 также диссоциировал на K+ ион и SO42-.

- После этого продукт MnSO4 также диссоциирован на Mn2+ что д5 стабильная конфигурация и соответствующий SO42-.
- Вода также ионизируется до H+ и ОН-.
- O2 остается нерасчлененным.
6. Ч
2SO4+ КМnО4 сопряженные парыВ реакции Н2SO4 + КМnО4 сопряженные пары будут соответствующими депротонированными и протонированными формами этого конкретного вида, которые перечислены ниже:
- Сопряженная пара H2SO4 = ТАК42-
- Сопряженная пара ОН– = H2O
7. Ч
2SO4 и KMnO4 межмолекулярные силыМежмолекулярная сила между H2SO4 представляет собой электростатическую ковалентную силу. Для КМnО4 это ионное взаимодействие, а для MnSO4 и K2SO4 ионное взаимодействие связано с кулоновской силой. Н-связь присутствует в воде, а сила Ван-дер-Ваальса действует в O.2 молекулы.
Для КМnО4 это ионное взаимодействие, а для MnSO4 и K2SO4 ионное взаимодействие связано с кулоновской силой. Н-связь присутствует в воде, а сила Ван-дер-Ваальса действует в O.2 молекулы.
| молекула | и.о. сила |
| H2SO4 | электростатический, Ван дер Вааль Диполь взаимодействие |
| КМnО4 | Ионные, металлические и электростатический |
| K2SO4 / МнSO4 | Кулоновская сила, сильное ионное взаимодействие |
| H2O | ковалентный, Н-связь |
| O2 | Сила Ван-дер-Ваала, Лондонская сила |
8.
 ЧАС2SO4 + КМnО4 энтальпия реакции
ЧАС2SO4 + КМnО4 энтальпия реакцииВ реакции Н2SO4 + КМnО4 энтальпия реакции составляет -4400.4 кДж/моль, что можно получить по формуле энтальпия продуктов – энтальпия реагентов, причем изменение энтальпии положительно.
| молекула | энтальпия (кДж/моль) |
| KMnO4 | -813 |
| H2SO4 | -814 |
| MnSO4 | -1130 |
| K2SO4 | -1437.8 |
| H2O | -68 |
| O2 | 0 |
и продукты
9.
 Н2SO4 + КМnО4 буферный раствор?
Н2SO4 + КМnО4 буферный раствор?Реакция между H2SO4 + KMnO4 дает буферный раствор и им можно регулировать рН раствора.
10. Н
2SO4 + КМnО4 полная реакция?Реакция между H2SO4 + КМnО4 является полной реакцией, потому что она дает два полных продукта MnSO4 и K2SO4 вместе с О2 газ.
11 Н2SO4 + КМnО4 экзотермическая или эндотермическая реакция?Реакция H2SO4 + KMnO4 экзотермичен с точки зрения первого закона термодинамики. Таким образом, реакция высвобождает больше энергии и температуры в окружающую среду, поэтому мы должны быть более осторожный, где δH всегда отрицательно.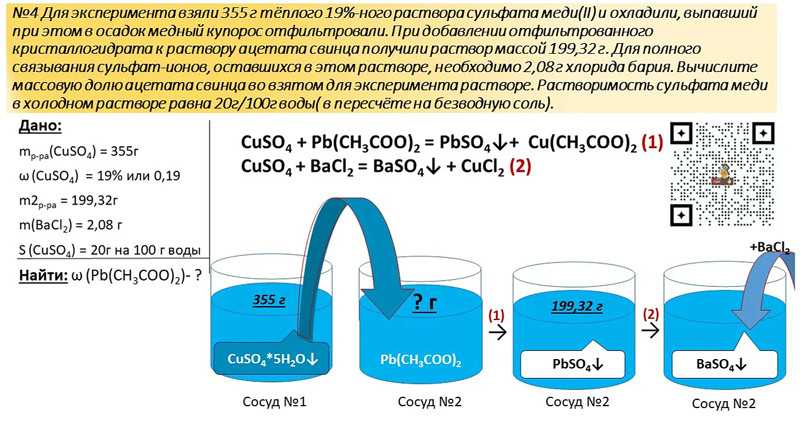
12. Н
2SO4 + КМnО4 окислительно-восстановительная реакция?Реакция между H2SO4 + КМnО4 — это окислительно-восстановительная реакция потому что в этой реакции многие элементы восстанавливаются и окисляются.Окислительно-восстановительная схема
H2SO4 и KMnO4 реакция
13. Н
2SO4 + КМnО4 реакция осажденияРеакция Н2SO4 + КМnО4 является реакцией осаждения, потому что он осаждается в растворе и не растворяется в реакционной смеси.
14. Н
2SO4 + КМnО4 обратимая или необратимая реакция?Реакция между H2SO4+ KMnO4 необратим, потому что мы получаем O2 газ как товар. Когда в ходе реакции образуется газ, энтропия реакции увеличивается, и равновесие реакции смещается только в правую сторону.
15. Н
2SO4 + КМnО4 реакция смещения?Реакция между H2SO4+ КМnО4 это пример одинарное перемещение реакция, потому что в приведенной выше реакции Mn и K замещаются H+ в H2SO4 И O2 газ освобождается от реакции.Одиночная реакция смещения
Заключение
H2SO4 и KMnO4 реакция в основном дает нам K2SO4 и MnSO4 наряду с газообразным кислородом, так что это коммерчески важная реакция для производства газообразного кислорода. Кроме того, количественный анализ H2SO4 и KMnO4 укажите количество Mn и K в соответствующем образце.
Узнайте больше о 11 фактов о h3SO4 + Al(OH)3.
Узнайте больше фактов о h3SO4:
NaCl + KMnO4 + h3SO4 = Cl2 + MnSO4 + Na2SO4 + K2SO4 + h3O
31 мая 2018 г.
Хлорид натрия и перманганат калия реагируют друг с другом в кислой среде (NaCl KMnO4 h3SO4) с образованием свободного хлора. Это окислительно-восстановительная реакция. Поскольку вы ищете баланс этой реакции, это означает, что вы уже знаете, что такое окислительно-восстановительная реакция. Простым языком можно сказать, что это реакция, в которой реагенты передают между собой электроны.
Теперь давайте поговорим о беспокоящей реакции. Эта конкретная химическая реакция является окислительно-восстановительной , т.е. окислительно-восстановительной реакцией, поскольку степень окисления Mn в KMnO4 равна +7, а после реакции степень окисления Mn становится +2. С другой стороны, степень окисления Fe в реагентах равна +2, тогда как в продуктах +3. Из этого обсуждения мы ясно видим, что в этой реакции происходит перенос электрона. Поэтому, конечно, это окислительно-восстановительная реакция.
2KMnO
4 + 10NaCl+ 8H 2 SO 4 = 5Cl 2 + 2MnSO 4 + 5Na 2 SO 4 + K 2 SO 4 + 8H 2 OРеакция хлорида натрия с перманганатом калия и серной кислотой
Чтобы уравновесить эту реакцию, мы должны использовать ионно-электронный метод. Потому что ионно-электронный метод — самый популярный и простой способ уравновесить окислительно-восстановительную реакцию. Для этого мы должны принять во внимание скелетную формулу реакции. что такое-
Потому что ионно-электронный метод — самый популярный и простой способ уравновесить окислительно-восстановительную реакцию. Для этого мы должны принять во внимание скелетную формулу реакции. что такое-
NaCl + KMnO4 + h3SO4 = Cl2
+ MnSO4+ Na2SO4 + K2SO4+ h3Oили,
NaCl + KMnO
4 + H 2 SO 4 = Cl 2 + MnSO 4 + Na 2 SO 4 + K 2 SO 4 + H 2 Oокислитель и восстановитель в реагенте. Для вышеуказанной реакции KMnO4 действует как агент окисления, а NaCl действует как агент восстановления.
Окислитель: KMnO 4 или (исключая зрительный ион) MnO 4 -1
Восстановитель : NaCl или Cl -1 (исключая зрительный ион)
Половина реакции восстановления
Окислитель принимает электроны и восстанавливается так же, как окисляет восстановитель.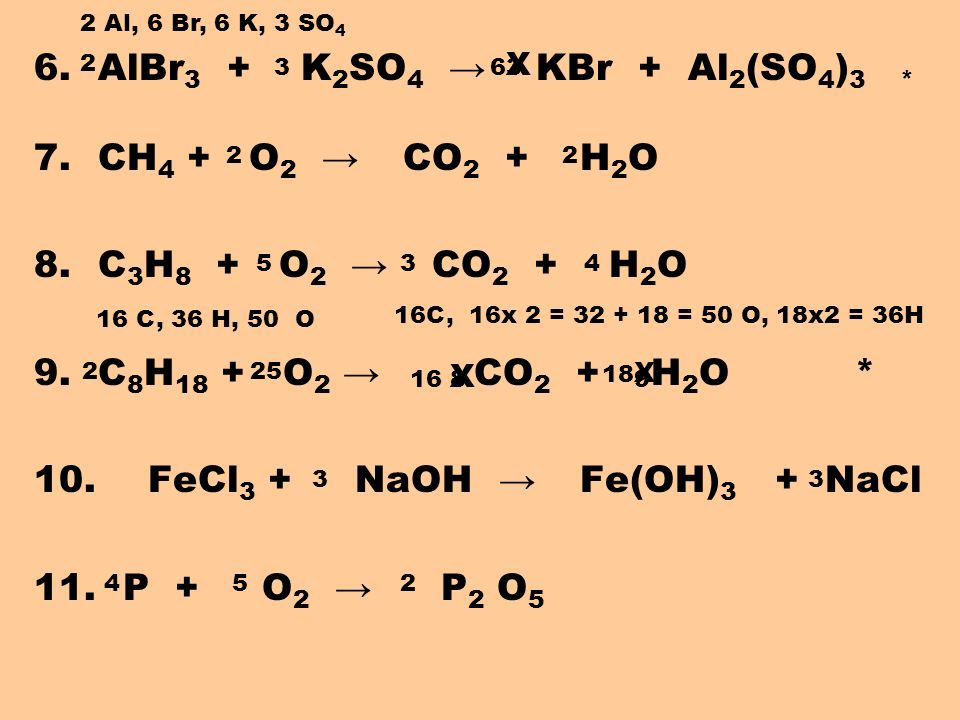 Потому что окисление и восстановление — одновременные процессы. В этой реакции Mn принимает 5 электронов, и степень окисления становится +2 с +7. Таким образом, восстановительная полуреакция для приведенной выше окислительно-восстановительной реакции выглядит следующим образом:0007
Потому что окисление и восстановление — одновременные процессы. В этой реакции Mn принимает 5 электронов, и степень окисления становится +2 с +7. Таким образом, восстановительная полуреакция для приведенной выше окислительно-восстановительной реакции выглядит следующим образом:0007
⇒ MnO 4 -1 +5e – + 8H + = 4H 2 O + Mn 2+ … …. …. …. (1)
Полуреакция окисления
С другой стороны, поскольку окисление-восстановление является одновременным процессом, полуреакция окисления протекает вместе с полуреакцией восстановления, показанной в уравнении (1). На этот раз окислитель Cl -1 высвобождает один электрон, чтобы восстановиться, а также стать свободным атомом Cl. Таким образом, полуреакция окисления —
Cl -1 – e – = Cl 0 … … … … … (2)
В это время мы должны умножить номер уравнения (2) 5 раз, а затем добавить его с номером уравнения ( 1). Поскольку окислитель забирает 5 электронов из реакции, но есть только один вид, который не принимает более одного электрона. По этой причине для восстановления одного окислителя требуется пять восстановителей. Теперь сделаем так-
Поскольку окислитель забирает 5 электронов из реакции, но есть только один вид, который не принимает более одного электрона. По этой причине для восстановления одного окислителя требуется пять восстановителей. Теперь сделаем так-
уравнение (1) + (2)x5,
MnO 4 -1 +5e – + 8H + = 4H 2 O + Mn 2-
90 002 5Cl -1 – 5e – = 5Cl 0⇒ MnO 4 -1 + 5Cl -1 + 8H + = 5Cl 0 + Mn 2- + 4H 2 O
или MnO 4 -1 + 5Cl -1 + 8H + = 5 / 2 Cl 2 + Mn 2- + 4H 2 O
или, 2MnO 4 -1 + 10Cl -1 + 16H + = 5Cl 2 + 2Mn 2- + 8H 2 O (умножая обе стороны на 2)
Теперь, добавляя необходимые ионы и радикалы, получаем Cl+ 8H 2 SO 4 = 5Cl 2 + 2MnSO 4 + 8H 2 O + 5Na 2 SO 4 +K 2 SO 4
«Ответ»
⇒ 2KMnO
4 + 10NaCl+ 8H 2 SO 4 = 5Cl 2 + 2MnSO 4 + 5Na 2 SO 4 + 8H 2 O + K 2 SO 4 Большое спасибо за прочтение статьи. Надеюсь, что эта статья была полезна для вашего обучения. Если вы считаете, что мы делаем отличную работу, подпишитесь на нас и поделитесь статьей с друзьями.
Надеюсь, что эта статья была полезна для вашего обучения. Если вы считаете, что мы делаем отличную работу, подпишитесь на нас и поделитесь статьей с друзьями.
Следуйте за нами на Twitter, Facebook, Linkedin и Tumblr
Подробнее
FeSO4 + KMnO4 + h3SO4 = Fe2(SO4) 3 + MnSO4 + h3O + K2SO4
FeSO4 + KMnO4 + h3SO4 = Fe2(SO4)3 + MnSO4 + h3O + K2SO4
Окислительно-восстановительные (ОВП) реакции
h3so4+kmno4+nacl → cl2+h3o+mnso4+na2so4+k2so4Tất cả phương trình điều chế từ h3so4+kmno4+nacl ra cl2+h3o+mnso4+na2so4+k2so4
h3so4+kmno4+nacl → cl2+h3o+mnso4+na2so4+k2so4Tất cả phương trình điều chế từ h3so4+kmno4+nacl ra cl2+h3o+mnso4+na2so4+k2so4- org/ListItem»> Транг чо
Тим Ким Пхонг Трин Хоа Хок |
| Тим Ким | Нхом Хок Мьен Пхи Онлайн Facebook | |||
| Lưu ý: mỗi chất cách nhau 1 khoảng trắng, ví dụ: h3 O2 | ||||
Tổng hợp đầy đủ và chi tiết nhất can bằng phương trình điều chế từ h3so4+kmno4+nacl ra cl2+h3o+mnso4+na2so4+k2so4. Đầy đủ trạng thai, máu sắc chất và tính số mol trong phản ứng hóa học.


 10.19
10.19

