Ответы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
| Похожие вопросы |
Структурная формула всех изомеров С7Н16
В воде средней жесткости (р=1 г/см3) концентрация ионов Mg 2+ составляет 4,0 *10-4 моль/дм3. Указать количество вещества (%) гидрокарбоната магния в этой воде ( других соединений магния в воде нет)
В каком году была сформулирована теория — предшественница кислородной теории горения.
h3SO4+Ba(OH)2=BaSO4+h3O
электронный баланс Nh4+O2=NO+h3O
Пользуйтесь нашим приложением
Реальный ЕГЭ по химии 2020. Задание 31 (№ 30 в ЕГЭ 2022)
Чтобы поделиться, нажимайте
Реальный ЕГЭ по химии 2020. Задание 31
Представляем вашему вниманию задание 31 из реального ЕГЭ 2020 (основная волна и резервные дни — 16 июля 2020 года, 24 июля 2020) с подробными текстовыми решениями и ответами.
Реальный ЕГЭ 2020. Задание 31. Вариант 1
- Для выполнения задания используйте следующий перечень веществ: хромат калия, сернистый газ, нитрит калия, хлор, ацетат серебра (I), хлорид кальция. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещество, раствор которого окрашен. Запишите молекулярное, полное и сокращённое ионное уравнения реакции обмена с участием выбранного вещества, которая сопровождается выпадением осадка.
Развернуть/свернуть решение
K2CrO4 + 2CH3COOAg = 2CH3COOK + Ag2CrO4↓
2K+ + CrO42- + 2CH3COO— + 2Ag+ = 2CH3
CrO42- + 2Ag+ = Ag2CrO4↓
Реальный ЕГЭ 2020. Задание 31. Вариант 2
- Для выполнения задания используйте следующий перечень веществ: дигидрофосфат натрия, перманганат калия, азотная кислота, фосфин, сульфид меди (II), гидроксид стронция. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми приводит к образованию осадка. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.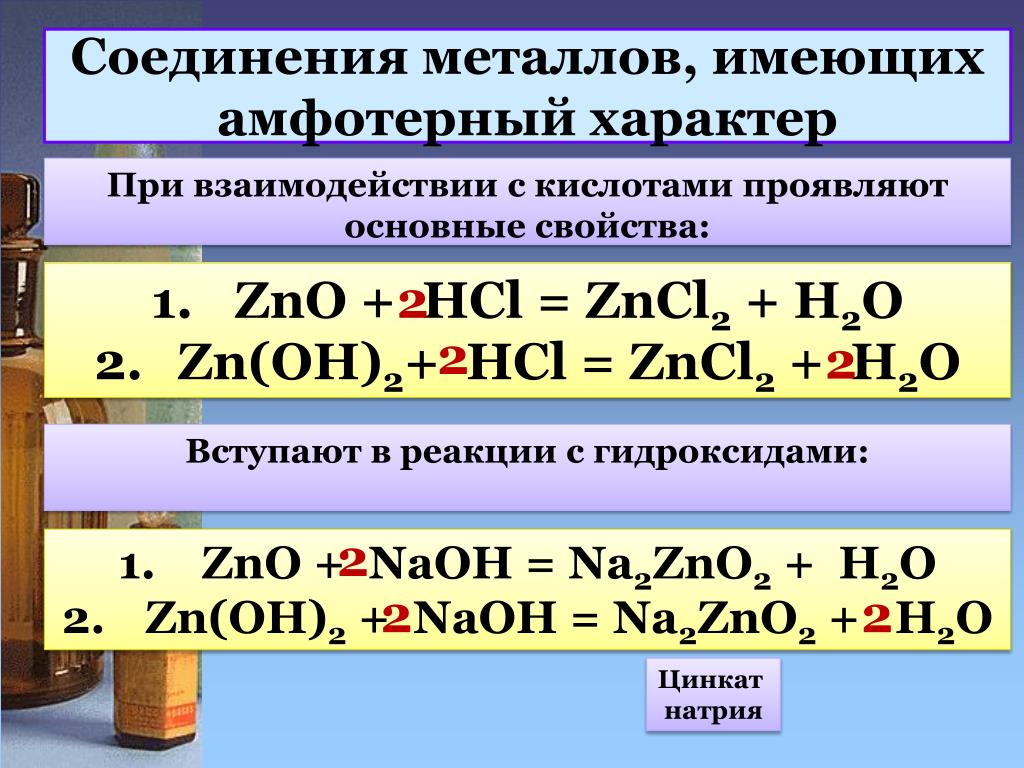
Развернуть/свернуть решение
3NaH2PO4 + 3Sr(OH)2 = Sr3(PO4)2↓ + Na3PO 4 + 6H2O
3Na+ + 3H2PO4— + 3Sr2+ + 6OH— = Sr3(PO4)2↓ + 3Na+ + PO43- + 6H2O
3H2PO4— + 3Sr2+ + 6OH— = Sr3(PO4)2↓ + PO43- + 6H2O
или
2NaH2PO4 + 3Sr(OH)2 = Sr3(PO4)2↓ + 2NaOH + 4H2O
2Na+ + 2H2PO4— + 3Sr2+ + 6OH— = Sr3(PO4)2↓ + 2Na+ + 2OH— + 4H2O
2H2PO4— + 3Sr2+ + 4OH— = Sr3(PO4)2↓ + 4H2O
Реальный ЕГЭ 2020.
- Для выполнения задания используйте следующий перечень веществ: азотная кислота, оксид меди (I), сероводород, ацетат аммония, оксид железа (III), оксид хрома (VI). Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает без выделения газа и без выпадения осадка. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение
HNO3 + CH3COONH4 = CH3COOH + NH4NO3
H+ + NO3— + CH3COO— + NH4+ = CH3COOH + NH 4+ + NO3—
H+ + CH3COO— = CH3COOH
Реальный ЕГЭ 2020. Задание 31. Вариант 4
Задание 31. Вариант 4
- Для выполнения задания используйте следующий перечень веществ: силикат натрия, нитрит калия, дихромат калия, серная кислота, иодид калия, ацетат аммония. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с выпадением осадка. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение
Na2SiO3 + H2SO4 = H2SiO3↓ + Na2SO4
2Na+ + SiO32- + 2H+ + SO42- = H2SiO3↓ + 2Na+ + SO42-
2H+ + SiO32- = H2SiO3↓
Реальный ЕГЭ 2020. Задание 31. Вариант 5
Задание 31. Вариант 5
- Для выполнения задания используйте следующий перечень веществ: перманганат калия, гидроксид калия, гидрокарбонат кальция, пероксид водорода, серная кислота, иодид калия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с выпадением осадка, но без выделения газа. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение
2KOH + Ca(HCO3)2 = CaCO3↓ + K2CO3 + 2H2O
2K+ + 2OH— + Ca2+ + 2HCO3— = CaCO3↓ + 2K+ + CO32- + 2H2O
2OH— + Ca2+ + 2HCO3— = CaCO3↓ + CO32- + 2H2O
Реальный ЕГЭ 2020. Задание 31. Вариант 6
Задание 31. Вариант 6
- Для выполнения задания используйте следующий перечень веществ: перманганат калия, гидроксид хрома (III), хлор, сульфит аммония, бромоводород, гидроксид бария. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с выделением газа, но без выпадения осадка. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение
(NH4)2SO3 + 2HBr = 2NH4Br + SO2↑ + H2O
2NH4+ + SO32- + 2H+ + 2Br— = 2NH4+ + 2Br— + SO2↑ + H2O
SO32- + 2H+ = SO2↑ + H2O
Реальный ЕГЭ 2020. Задание 31. Вариант 7
Задание 31. Вариант 7
- Для выполнения задания используйте следующий перечень веществ: перманганат калия, гидроксид железа (II), пероксид водорода, дигидрофосфат магния, серная кислота, гидроксид калия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с выпадением осадка. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение
3Mg(H2PO4)2 + 12KOH = Mg3(PO4)2↓ + 4K3PO4 + 12H2O
3Mg2+ + 6H2PO4— + 12K+ + 12OH— = Mg3(PO4)2↓ + 12K+ + 4PO43- + 12H2O
3Mg2+ + 6H2PO4— + 12OH— = Mg3(PO4)2↓ + 4PO43- + 12H2O
Как ни странно, была защитана реакция с образованием осадка гидроксида магния и дигидрофосфата калия (что на самом деле маловероятно в щелочной среде). Поэтому привожу вам эту реакцию:
Поэтому привожу вам эту реакцию:
Mg(H2PO4)2 + 2KOH = Mg(OH)2↓ + 2KH2PO4
Mg2+ + 2H2PO4— + 2K+ + 2OH— = Mg(OH)2↓ + 2K+ + 2H2PO4—
Mg2+ + 2OH— = Mg(OH)2↓
Реальный ЕГЭ 2020. Задание 31. Вариант 8
- Для выполнения задания используйте следующий перечень веществ: азотная кислота, гидроксид железа (II), хлорат калия, ацетат серебра (I), оксид хрома (III), сероводород. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает без видимых признаков. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение
HNO3 + CH3COOAg = AgNO3 + CH3COOH
H+ + NO3— + CH3COO— = Ag+ + NO3— + CH3COOH
H+ + CH3COO— = CH3COOH
Реальный ЕГЭ 2020. Задание 31. Вариант 9
- Для выполнения задания используйте следующий перечень веществ: серная кислота, гидрокарбонат бария, сульфат калия, оксид меди (I), оксид марганца (IV), гидроксид калия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества одного класса, реакция ионного обмена между которыми протекает с выпадением белого осадка и без выделения газа. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение
Ba(HCO3)2 + K2SO4 = BaSO4↓ + 2KHCO3
Ba2+ + 2HCO3— + 2K+ + SO42- = BaSO4↓ + 2K+ + 2HCO3—
Ba2+ + SO42- = BaSO4↓
Реальный ЕГЭ 2020. Задание 31. Вариант 10
Задание 31. Вариант 10
- Для выполнения задания используйте следующий перечень веществ: ацетат бария, гидросульфат натрия, оксид железа (II), пероксид водорода, гидроксид хрома (III), серная кислота. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с выпадением белого осадка, а одним из реагентов является кислая соль. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение
1) 2NaHSO4 + (CH3COO)2Ba = BaSO4↓ + Na2SO4 + 2CH3COOH
2Na+ + 2HSO4— + 2CH3COO— + Ba2+ = BaSO4↓ + 2Na+ + SO42- + 2CH3COOH
2HSO4— + 2CH3COO— + Ba2+ = BaSO4↓ + SO42- + 2CH3COOH
или
2) NaHSO4 + (CH3COO)2Ba = BaSO4↓ + CH3COONa + CH3COOH
Na+ + HSO4— + 2CH3COO— + Ba2+ = BaSO4↓ + CH3COO— + Na+ + CH3COOH
HSO4— + CH3COO— + Ba2+ = BaSO4↓ + CH3COOH
Диссоциацию аниона HSO4— допустимо (хотя на мой взгляд, не желательно) записывать в виде H+ + SO42- (другие кислые ионы так расписывать НЕЛЬЗЯ). С учётом этого, можно было записать эти уравнения по-другому:
С учётом этого, можно было записать эти уравнения по-другому:
1) 2NaHSO4 + (CH3COO)2Ba = BaSO4↓ + Na2SO4 + 2CH3COOH
2Na+ + 2H+ + 2SO42- + 2CH3COO— + Ba2+ = BaSO4↓ + 2Na+ + SO42- + 2CH3COOH
2H+ + SO42- + 2CH3COO— + Ba2+ = BaSO4↓ + 2CH3COOH
или
2) NaHSO4 + (CH3COO)2Ba = BaSO4↓ + CH3COONa + CH3COOH
Na+ + H+ + SO42- + 2CH3COO— + Ba2+ = BaSO4↓ + CH3COO— + Na+ + CH3COOH
H+ + SO42- + CH3COO— + Ba2+ = BaSO4↓ + CH3COOH
Реальный ЕГЭ 2020. Задание 31. Вариант 11
Задание 31. Вариант 11
- Для выполнения задания используйте следующий перечень веществ: гидроксид бария, сульфит калия, аммиак, нитрат серебра (I), перманганат калия, дигидрофосфат калия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с выпадением белого осадка, а одним из реагентов является кислая соль. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение
3KH2PO4 + 3Ba(OH)2 = Ba3(PO4)2↓ + K3PO4 + 6H2O
3K+ + 3H2PO4— + 3Ba2+ + 6OH— = Ba3(PO4)2↓ + 3K+ + PO43- + 6H2O
3H2PO4— + 3Ba2+ + 6OH— = Ba3(PO4)2↓ + PO43- + 6H2O
или
2KH2PO4 + 3Ba(OH)2 = Ba3(PO4)2↓ + 2KOH + 4H2O
2K+ + 2H2PO4— + 3Ba2+ + 6OH— = Ba3(PO4)2↓ + 2K+ + 2OH— + 4H2O
2H2PO4— + 3Ba2+ + 4OH— = Ba3(PO4)2↓ + 4H2O
Реальный ЕГЭ 2020. Задание 31. Вариант 12
Задание 31. Вариант 12
- Для выполнения задания используйте следующий перечень веществ: гидрокарбонат магния, сульфит калия, сульфат железа (II), дихромат калия, фосфат кальция, серная кислота. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с выделением газа, но без выпадения осадка, а одним из реагентов является кислая соль. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение
Mg(HCO3)2 + H2SO4 = MgSO4 + 2CO2↑ + 2H2O
Mg2+ + 2HCO3— + 2H+ + SO42- = Mg2+ + SO42- + 2CO2↑ + 2H2O
HCO3— + H+ = CO2↑ + H2O
Реальный ЕГЭ 2020. Задание 31. Вариант 13
Задание 31. Вариант 13
- Для выполнения задания используйте следующий перечень веществ: перманганат калия, иодоводород, гидроксид бария, серная кислота, сульфит аммония, гидрофосфат натрия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с выпадением осадка, а одним из реагентов является кислая соль. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение
2Na2HPO4 + 3Ba(OH)2 = Ba3(PO4)2↓ + 4NaOH + 2H2O
4Na+ + 2HPO42- + 3Ba2+ + 6OH— = Ba3(PO4)2↓ + 4Na+ + 4OH— + 2H2O
2HPO42- + 3Ba2+ + 2OH— = Ba3(PO4)2↓ + 2H2O
или
6Na2HPO4 + 3Ba(OH)2 = Ba3(PO4)2↓ + 4Na3PO4 + 6H2O
12Na+ + 6HPO42- + 3Ba2+ + 6OH— = Ba3(PO4)2↓ + 12Na+ + 4PO43- + 6H2O
6HPO42- + 3Ba2+ + 6OH— = Ba3(PO4)2↓ + 4PO43- + 6H2O
Реальный ЕГЭ 2020. Задание 31. Вариант 14
Задание 31. Вариант 14
- Для выполнения задания используйте следующий перечень веществ: хромат натрия, бромид натрия, нитрит натрия, серная кислота, ацетат серебра (I), хлорид аммония. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещество, раствор которого окрашен. Запишите молекулярное, полное и сокращённое ионное уравнения реакции обмена с участием выбранного вещества, которая сопровождается выпадением осадка.
Развернуть/свернуть решение
Na2CrO4 + 2CH3COOAg = 2CH3COONa + Ag2CrO4↓
2Na+ + CrO42- + 2CH3COO— + 2Ag+ = 2CH3COO— + 2Na+ + Ag2CrO4↓
CrO42- + 2Ag+ = Ag2CrO4↓
Реальный ЕГЭ 2020. Задание 31. Вариант 15
Задание 31. Вариант 15
- Для выполнения задания используйте следующий перечень веществ: перманганат калия, гидроксид лития, бром, сульфит аммония, хлороводород, нитрат кальция. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми приводит к образованию слабого основания. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение
2LiOH + (NH4)2SO3 = Li2SO3 + 2NH3∙H2O
2Li+ + 2OH— + 2NH4+ + SO32- = 2Li+ + SO32- + 2NH3∙H2O
NH4+ + OH— = NH3∙H2O
Реальный ЕГЭ 2020. Задание 31. Вариант 16
Задание 31. Вариант 16
- Для выполнения задания используйте следующий перечень веществ: ацетат аммония, гидроксид натрия, перманганат натрия, хлороводород, нитрит натрия, оксид марганца (IV). Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми приводит к образованию слабого основания. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение
CH3COONH4 + NaOH = CH3COONa + NH3∙H2O
CH3COO— + NH4+ + Na+ + OH— = CH3COO— + Na+ + NH3∙H2O
NH4+ + OH— = NH3∙H2O
Реальный ЕГЭ 2020. Задание 31. Вариант 17
Задание 31. Вариант 17
- Для выполнения задания используйте следующий перечень веществ: ацетат бария, нитрит магния, сульфат железа (II), хромат калия, гидроксид меди (II), серная кислота. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает без видимых изменений. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение
H2SO4 + Mg(NO2)2 = MgSO4 + 2HNO2
2H+ + SO42- + Mg2+ + 2NO2— = Mg2+ + SO42- + 2HNO2
H+ + NO2— = HNO2
Реальный ЕГЭ 2020. Задание 31. Вариант 18
- Для выполнения задания используйте следующий перечень веществ: нитрат бария, сульфид калия, соляная кислота, нитрит натрия, перманганат калия, ацетат железа(II).
 Допустимо использование водных растворов веществ.
Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с образованием осадка. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение
K2S + (CH3COO)2Fe = FeS↓ + 2CH3COOK
2K+ + S2- + 2CH3COO— + Fe2+ = FeS↓ + 2CH3COO— + 2K+
Fe2+ + S2- = FeS↓
Реальный ЕГЭ 2020. Задание 31. Вариант 19
- Для выполнения задания используйте следующий перечень веществ: пероксид водорода, сульфид цинка, гидроксид калия, гидроксид хрома(III), сульфат аммония, хлорид бария. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с образованием слабого основания. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение
2KOH + (NH4)2SO4 = K2SO4 + 2NH3∙H2O
2K+ + 2OH— + 2NH4+ + SO42- = 2K+ + SO42- + 2NH3∙H2O
NH4+ + OH— = NH3∙H2O
Реальный ЕГЭ 2020. Задание 31. Вариант 20
- Для выполнения задания используйте следующий перечень веществ: перманганат натрия, соляная кислота, сульфит натрия, хлорид бария, гидросульфат калия, бром. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает без выделение газа, причём одно из реагирующих веществ является кислой солью. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение
1) KHSO4 + BaCl2 = BaSO4↓ + KCl + HCl
K+ + HSO4— + Ba2+ + 2Cl— = BaSO4↓ + K+ + H+ + 2Cl—
HSO4— + Ba2+ = BaSO4↓ + H+
или
2) 2KHSO4 + BaCl2 = K2SO4 + BaSO4↓ + 2HCl
2K+ + 2HSO4— + Ba2+ + 2Cl— = 2K+ + SO42- + BaSO4↓ + 2H+ + 2Cl—
2HSO4— + Ba2+ = SO42- + BaSO4↓ + 2H+
Диссоциацию аниона HSO4— допустимо (хотя на мой взгляд, не желательно) записывать в виде H+ + SO42- (другие кислые ионы так расписывать НЕЛЬЗЯ). С учётом этого, можно было записать эти уравнения по-другому:
С учётом этого, можно было записать эти уравнения по-другому:
1) KHSO4 + BaCl2 = BaSO4↓ + KCl + HCl
K+ + H+ + SO42- + Ba2+ + 2Cl— = BaSO4↓ + K+ + H+ + 2Cl—
SO42- + Ba2+ = BaSO4↓
2) 2KHSO4 + BaCl2 = K2SO4 + BaSO4↓ + 2HCl
2K+ + 2H+ + 2SO42- + Ba2+ + 2Cl— = 2K+ + SO42- + BaSO4↓ + 2H+ + 2Cl—
SO42- + Ba2+ = BaSO4↓
Реальный ЕГЭ 2020. Задание 31. Вариант 21
- Для выполнения задания используйте следующий перечень веществ: сульфид железа(II), гидроксид калия, перманганат калия, серная кислота, нитрит калия, гидрокарбонат бария.
 Допустимо использование водных растворов веществ.
Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с выделением газа и без образования осадка. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение
FeS + H2SO4 = FeSO4 + H2S↑
FeS + 2H+ + SO42- = Fe2+ + SO42- + H2S↑
FeS + 2H+ = Fe2+ + H2S↑
Реальный ЕГЭ 2020. Задание 31. Вариант 22
- Для выполнения задания используйте следующий перечень веществ: серная кислота, дихромат калия, сульфид меди(II), фосфин, гидроксид бария, ацетат аммония. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с выделением газа и без образования осадка. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение
2CH3COONH4 + Ba(OH)2 = (CH3COO)2Ba + 2NH3↑ + 2H2O
2CH3COO— + 2NH4+ + Ba2+ + 2OH— =2CH3COO— + Ba2+ + 2NH3↑ + 2H2O
NH4+ + OH— =NH3↑ + H2O
Реальный ЕГЭ 2020. Задание 31. Вариант 23
- Для выполнения задания используйте следующий перечень веществ: сульфид меди(II), сера, цинк, азотная кислота, гидрокарбонат аммония, ацетат кальция. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена, если известно, что в реакцию вступает кислая соль. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение
NH4HCO3 + HNO3 =NH4NO3 + CO2↑ + H2O
NH4+ + HCO3— + H+ + NO3— = NH4+ + NO3— + CO2↑ + H2O
H+ + HCO3— = CO2↑ + H2O
Резерв
Реальный ЕГЭ 2020 (резервные дни). Задание 31. Вариант 1
- Для выполнения задания используйте следующий перечень веществ: силикат калия, нитрит натрия, дихромат натрия, серная кислота, бромид натрия, ацетат аммония. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с образованием осадка. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение
K2SiO3 + H2SO4 = H2SiO3↓ + K2SO4
2K+ + SiO32- +2H+ + SO42- = H2SiO3↓ + 2K+ + SO42-
2H+ + SiO32- = H2SiO3↓
Реальный ЕГЭ 2020 (резервные дни). Задание 31. Вариант 2
- Для выполнения задания используйте следующий перечень веществ: нитрит калия, перманганат калия, серная кислота, гидроксид калия, нитрат аммония, сульфид железа(II). Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с образованием слабого основания. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение
NH4NO3 + KOH = KNO3 + NH3∙H2O
NH4+ + NO3— + K+ + OH— = K+ + NO3— + NH3∙H2O
NH4+ + OH— = NH3∙H2O
Реальный ЕГЭ 2020 (резервные дни). Задание 31. Вариант 3
- Для выполнения задания используйте следующий перечень веществ: перманганат калия, соляная кислота, сульфит калия, нитрат бария, гидросульфат аммония, йод. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена, если известно, что в реакцию вступает кислая соль, а в результате реакции газ не образуется. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение
NH4HSO4 + Ba(NO3)2 = BaSO4↓ + NH4NO3 + HNO3
NH4+ + HSO4— + Ba2+ + 2NO3— = BaSO4↓ + NH4+ + NO3— + H+ + NO3—
HSO4— + Ba2+ = BaSO4↓ + H+
Реальный ЕГЭ 2020 (резервные дни). Задание 31. Вариант 4
- Для выполнения задания используйте следующий перечень веществ: сульфит бария, гидроксид натрия, перманганат натрия, серная кислота, нитрит натрия, гидрокарбонат магния. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с выделением газа, но без образования осадка. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение
Mg(HCO3)2 + H2SO4 = MgSO4 + 2H2O + 2CO2↑
Mg2+ + 2HCO3— + 2H+ + SO42- = Mg2+ + SO42- + 2H2O + 2CO2↑
H+ + HCO3— = H2O + CO2↑
Реальный ЕГЭ 2020 (резервные дни). Задание 31. Вариант 5
- Для выполнения задания используйте следующий перечень веществ: оксид серы(IV), пероксид натрия, гидрофосфат натрия, аммиак, йодоводород, гидроксид натрия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена, если известно, что в реакцию вступает кислая соль. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение
Na2HPO4 + NaOH = Na3PO4 + H2O
2Na+ + HPO42- + Na+ + OH— = 3Na+ + PO43- + H2O
HPO42- + OH— = PO43- + H2O
Реальный ЕГЭ 2020 (резервные дни). Задание 31. Вариант 6
- Для выполнения задания используйте следующий перечень веществ: гидроксид бария, сероводород, аммиак, оксид серы(IV), перманганат натрия, дигидрофосфат натрия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена, если известно, что в реакцию вступает кислая соль, а в результате реакции образуется белый осадок. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение
2NaH2PO4 + 3Ba(OH)2 = Ba3(PO4)2↓ + 2NaOH + 4H2O
2Na+ + 2H2PO4— + 3Ba2+ + 6OH— = Ba3(PO4)2↓ + 2Na+ + 2OH— + 4H2O
2H2PO4— + 3Ba2+ + 4OH— = Ba3(PO4)2↓ + 4H2O
Реальный ЕГЭ 2020 (резервные дни). Задание 31. Вариант 7
- Для выполнения задания используйте следующий перечень веществ: гидрокарбонат магния, оксид кремния, нитрат аммония, серная кислота, графит, фосфин. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена, если известно, что в реакцию вступает кислая соль.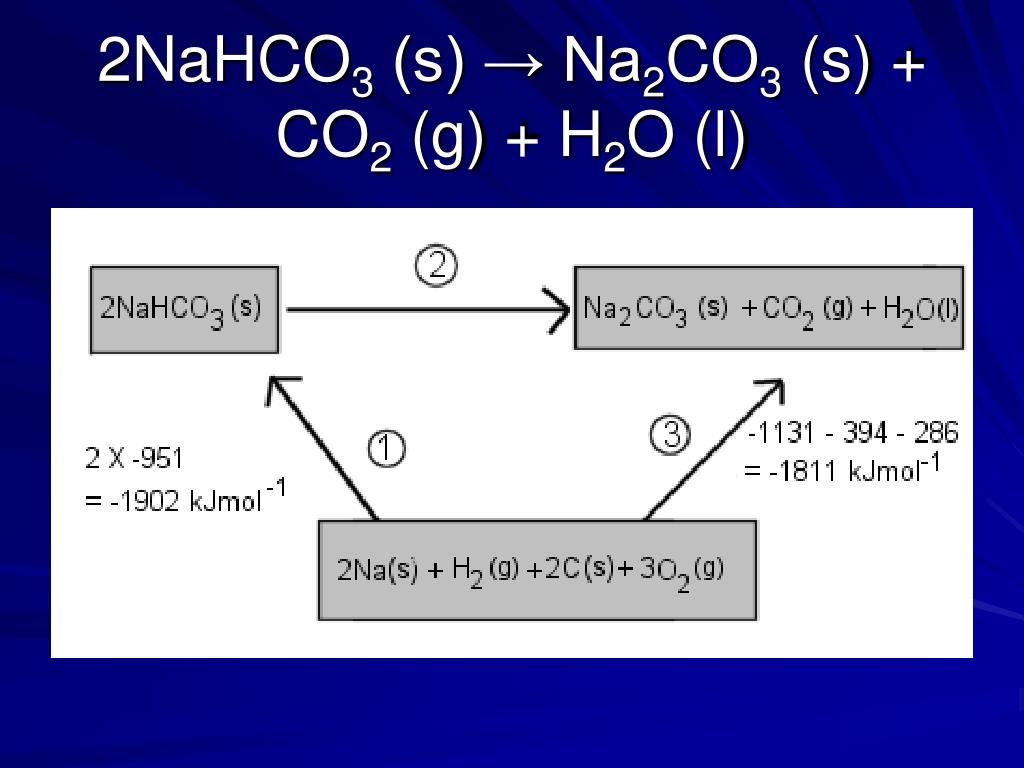 Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение
Mg(HCO3)2 + H2SO4 = MgSO4 + 2H2O + 2CO2↑
Mg2+ + 2HCO3— + 2H+ + SO42- = Mg2+ + SO42- + 2H2O + 2CO2↑
H+ + HCO3— = H2O + CO2↑
Реальный ЕГЭ 2020 (резервные дни). Задание 31. Вариант 8
- Для выполнения задания используйте следующий перечень веществ: азотная кислота, оксид меди (I), оксид марганца (IV), хлорид железа (III), сера, фторид аммония. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми протекает с образованием осадка. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение
FeCl3 + 3NH4F = FeF3↓ + 3NH4Cl
Fe3+ + 3Cl— + 3NH4+ + 3F— = FeF3↓ + 3NH4+ + 3Cl—
Fe3+ + 3F— = FeF3↓
Реальный ЕГЭ 2020 (резервные дни). Задание 31. Вариант 9
- Для выполнения задания используйте следующий перечень веществ: перманганат калия, гидрокарбонат натрия, сульфит натрия, сульфат бария, гидроксид калия, пероксид водорода. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите два вещества, реакция ионного обмена, если известно, что в реакцию вступает кислая соль. Запишите молекулярное, полное и сокращённое ионные уравнения реакции с участием выбранных веществ.
Развернуть/свернуть решение
2NaHCO3 + 2KOH = Na2CO3 + K2CO3 + 2H2O
2Na+ + 2HCO3— + 2K+ + 2OH— = 2Na+ + CO32- + 2K+ + CO32- + 2H2O
HCO3— + OH— = CO32- + H2O
или
NaHCO3 + 2KOH = NaOH + K2CO3 + H2O
Na+ + HCO3— + 2K+ + 2OH— = Na+ + OH— + 2K+ + CO32- + H2O
HCO3— + OH— = CO32- + H2O
Также предлагаем вам плейлист видео-уроков и видео-объяснений заданий на эту тему:
Теория и примеры заданий» src=»https://www.youtube.com/embed/videoseries?list=PLEL-sAdim5FaiqQVHd8oCDZ7GBW7e2sBQ» frameborder=»0″ allowfullscreen=»allowfullscreen» data-mce-fragment=»1″>А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув:
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Просмотреть задания ЕГЭ всех лет вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ и ЦТ вы можете здесь, нажав на эту строку
- Все видео-объяснения вы можете найти на YouTube канале, нажав на эту строку
404 Cтраница не найдена
Размер:
AAA
Изображения Вкл. Выкл.
Обычная версия сайта
К сожалению запрашиваемая страница не найдена.
Но вы можете воспользоваться поиском или картой сайта ниже
|
|
Какая связь между бикарбонатом натрия и серной кислотой?
`;
Винсент Саммерс
Гидрокарбонат натрия и серная кислота являются, соответственно, кислой солью сильного основания и сильной кислоты. Взаимодействие между двумя веществами категорически называют «реакцией нейтрализации». Теоретически, объединение двух молекул бикарбоната натрия и одной молекулы серной кислоты даст одну молекулу сульфата натрия и две молекулы угольной кислоты. В действительности, однако, угольная кислота в этой среде неустойчива и поэтому не остается в растворе, а быстро диссоциирует на воду и углекислый газ, последний улетучивается в атмосферу. В целом реакция записывается 2 NaHCO 3 + H 2 SO 4 → Na 2 SO 4 + 2 H 2 O + 2 CO 2 ↑.
Серная кислота является одной из самых сильных неорганических или «минеральных» кислот. В отличие от многих других сильных кислот, таких как азотная (HNO 3 ) и соляная (HCl) кислоты, серная кислота содержит в своей структуре два атома водорода. В растворе они принимают форму ионов водорода. Когда оба иона водорода заменены или нейтрализованы, полученный продукт представляет собой полноценную соль, как, например, сульфат калия (K 2 SO 4 ). Если, с другой стороны, замещается только один ион водорода, продукт представляет собой полусоль, иногда называемую кислой солью, в данном случае гидросульфат калия (KHSO 9).0011 4 ), возможно, более известный как бисульфат калия.
В отличие от многих других сильных кислот, таких как азотная (HNO 3 ) и соляная (HCl) кислоты, серная кислота содержит в своей структуре два атома водорода. В растворе они принимают форму ионов водорода. Когда оба иона водорода заменены или нейтрализованы, полученный продукт представляет собой полноценную соль, как, например, сульфат калия (K 2 SO 4 ). Если, с другой стороны, замещается только один ион водорода, продукт представляет собой полусоль, иногда называемую кислой солью, в данном случае гидросульфат калия (KHSO 9).0011 4 ), возможно, более известный как бисульфат калия.
Теперь станет ясно, что бикарбонат натрия является именно такой кислой солью или полусолью и является результатом нейтрализации только одного доступного иона водорода, содержащегося в его родоначальнике, угольной кислоте (H 2 CO 3 ). Эта кислота вступает в реакцию частичной нейтрализации NaOH + H 2 CO 3 → NaHCO 3 + H 2 O, а не 2 NaOH + H 2 CO 3 → Na 3 CO 2 + 2 H 2 O, последнее соответствует полной нейтрализации. Таким образом, связь между бикарбонатом натрия и серной кислотой представляет собой связь частичной нейтрализации кислой соли сильного основания сильной кислотой. Другой возможностью является частичная нейтрализация не серной кислоты, а бикарбоната натрия с получением бисульфата натрия по уравнению реакции NaHCO 3 + H 2 SO 4 → NaHSO 4 + H 2 O + CO 2 ↑.
Эта кислота вступает в реакцию частичной нейтрализации NaOH + H 2 CO 3 → NaHCO 3 + H 2 O, а не 2 NaOH + H 2 CO 3 → Na 3 CO 2 + 2 H 2 O, последнее соответствует полной нейтрализации. Таким образом, связь между бикарбонатом натрия и серной кислотой представляет собой связь частичной нейтрализации кислой соли сильного основания сильной кислотой. Другой возможностью является частичная нейтрализация не серной кислоты, а бикарбоната натрия с получением бисульфата натрия по уравнению реакции NaHCO 3 + H 2 SO 4 → NaHSO 4 + H 2 O + CO 2 ↑.
Два соединения, бикарбонат натрия и серная кислота, имеют большое промышленное значение.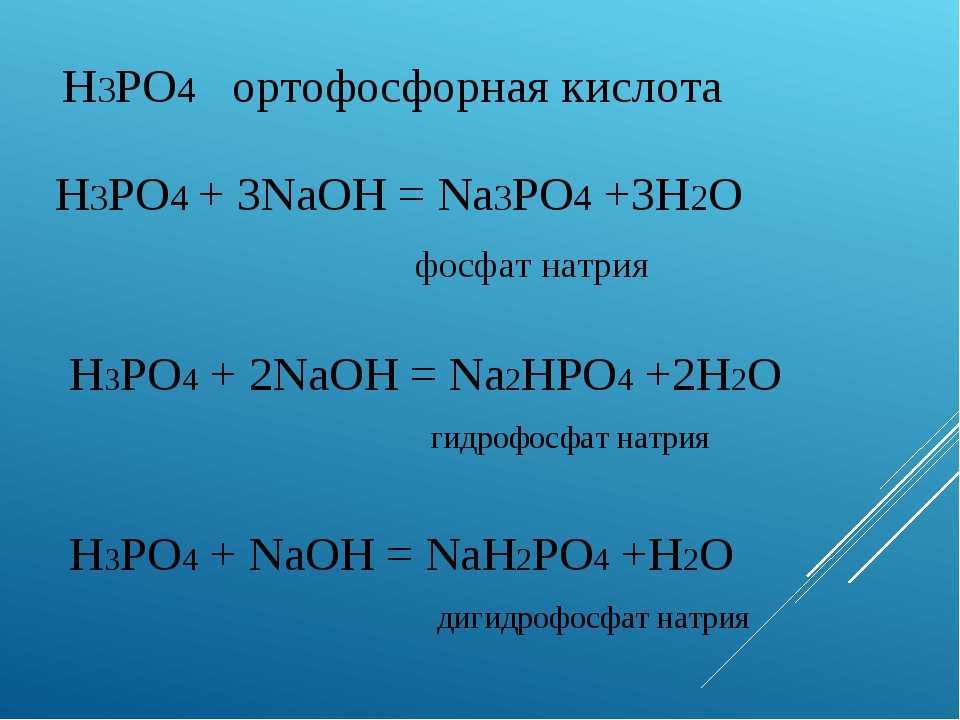 Серная кислота используется в производстве удобрений, стали, свинцово-кислотных аккумуляторов и для переработки нефти. Бикарбонат натрия, как правило, безопасен в обращении и полезен при ликвидации разливов кислоты, особенно разливов серной кислоты. Это также важно при приготовлении пищи, при тушении некоторых небольших пожаров, а также в гигиене и медицине. Продукт полной нейтрализации бикарбоната натрия и серной кислоты, сульфат натрия, является обильным побочным продуктом некоторых других промышленных процессов.
Серная кислота используется в производстве удобрений, стали, свинцово-кислотных аккумуляторов и для переработки нефти. Бикарбонат натрия, как правило, безопасен в обращении и полезен при ликвидации разливов кислоты, особенно разливов серной кислоты. Это также важно при приготовлении пищи, при тушении некоторых небольших пожаров, а также в гигиене и медицине. Продукт полной нейтрализации бикарбоната натрия и серной кислоты, сульфат натрия, является обильным побочным продуктом некоторых других промышленных процессов.
Серная кислота Карбонат натрия Ионное уравнение
Серная кислота Карбонат натрия Ионное уравнение: Реакция серной кислоты и карбоната натрия. Стакан наполнен твердым порошком карбоната натрия (Na2CO3) и 0,1 М серной кислотой (h3SO4). Пузырьки углекислого газа (CO2) образуются в реакции h3SO4 + Na2CO3 → Na2SO4 + CO2 + h3O. Это иллюстрация карбонатно-кислотной реакции, которая представляет собой реакцию распада, за которой следует двойная реакция замещения.
Стакан наполнен твердым порошком карбоната натрия (Na2CO3) и 0,1 М серной кислотой (h3SO4). Пузырьки углекислого газа (CO2) образуются в реакции h3SO4 + Na2CO3 → Na2SO4 + CO2 + h3O. Это иллюстрация карбонатно-кислотной реакции, которая представляет собой реакцию распада, за которой следует двойная реакция замещения.
Ионная реакция
2Na (+) + CO3 (2) + 2H (+) + SO4 (2) > SO4 (2) + h3O + CO2 + 2Na (+)
Исключение общих факторов
Чистое ионное уравнение
CO3 (2) + 2H +> h3O + CO2
Молекулярные уравнения
Na2CO3 (синий) + h3SO4 (синий)> Na2SO4 (синий) + h3O (ж) + CO2 (г)
Ионное уравнение
2 Na + (Синий) + CO3 2 (Синий) + 2 H + (Синий) + SO4 2 (Синий)> 2 Na + (Синий) + SO4 2 (Синий) + h3O (ж) + CO2 ( ж)
2 Na + (водн.) и SO4 2 (водн.) появляются в обеих частях уравнения и могут компенсировать друг друга
Суммарное ионное уравнение
CO3 2 (вода) + 2H + (вода) > h3O (л) + CO2 (г)
| Кислота | Формула | Основание | Формула |
|---|---|---|---|
| Соляная кислота | HCl | Гидроксид натрия | NaOH |
| Серная кислота | h32SO44 | Гидроксид калия | КОН |
| Азотная кислота | HNO33 | Карбонат натрия | Na22CO33 |
| Уксусная (этановая) кислота | Ч43СООН | Гидроксид кальция | Са (ОН)22 |
| Углекислота | h32CO33 | Гидроксид магния | Мг (ОН)22 |
| Сернистая кислота | h32SO33 | Аммиак | Кх43 |
| Фосфорная кислота | х43ПО44 | Бикарбонат натрия | NaHCO3 |
Как реагирует карбонат натрия с серной кислотой?
Подсказка: Карбонат натрия, или Na2CO3, является щелочным соединением с химической формулой Na2CO3, а серная кислота, или h3SO4, является сильной кислотой. В результате реакции основания и кислоты, известной как реакция нейтрализации, образуется соль с выделением углекислого газа и воды.
В результате реакции основания и кислоты, известной как реакция нейтрализации, образуется соль с выделением углекислого газа и воды.
Полный ответ
В зависимости от природы химические вещества делятся на кислоты, основания и нейтральные химические вещества. Серная кислота, имеющая химическую формулу h3SO4, является примером кислоты, которая может отщеплять протон, а карбонат натрия, молекулярная формула которого Na2CO3, является примером основания, которое может отщеплять протон.
Поскольку карбонат натрия содержит анион карбонат, в реакции между кислотами и основаниями также происходит декарбоксилирование, что приводит к образованию соответствующей соли, а также к выделению воды. Реакция нейтрализации — это название химического процесса.
В результате карбонат натрия и серная кислота реагируют с образованием сульфата натрия, который имеет химическую формулу Na2SO4. Вода и углекислый газ являются другими побочными продуктами.
h3SO4+Na2CO3→Na2SO4+h3O+CO2
Итак, в результате реакции образовались сульфат натрия, вода и углекислый газ.
Примечание:
Одним из процессов, при котором кислота и основание реагируют друг с другом с образованием подходящей соли, является реакция нейтрализации. Декарбоксилирования не произойдет, если основание не содержит карбоната в качестве аниона. Единственными побочными продуктами процесса нейтрализации были соль и вода.
Какое общее ионное уравнение для серной кислоты и карбоната натрия?
В результате реакции карбоната натрия и серной кислоты образуется сульфат натрия, который имеет химическую формулу Na2SO4. Вода и углекислый газ являются другими побочными продуктами. Итак, в результате реакции образовались сульфат натрия, вода и углекислый газ.
Что происходит при взаимодействии карбоната натрия и серной кислоты?
Следующее уравнение часто используется в экспериментах по определению скорости реакции: CaCOu2083 (т) + 2 HCl (водн.) u27f6 CaClu2082 (водн.) + COu2082 (г) + Hu2082O (л).
Какое суммарное ионное уравнение применимо к h3so4 AQ и na2co3 AQ?
h3SO4 + Na2CO3 = h3SO4 + O2 + CO2.
Что произойдет, если соединить карбонат натрия и серную кислоту?
При объединении карбоната натрия и разбавленной серной кислоты образуются соль, вода и двуокись углерода.
Что происходит при взаимодействии кислоты и карбоната натрия?
Что происходит при взаимодействии карбоната натрия и соляной кислоты? При добавлении карбоната натрия к соляной кислоте происходит двойная реакция замещения, в результате которой образуются хлорид натрия, вода и углекислый газ. Карбонат натрия и два ■■■■■ соляной кислоты объединяются, образуя угольную кислоту.
Каково сбалансированное химическое уравнение реакции между серной кислотой и карбонатом натрия?
Будет виден белый осадок, представляющий собой сульфат кальция. Как газ, углекислый газ изменится: Ответ 2: h3SO4 с CaCO3 (водн.) CaSO4s, lh3O и CO2 (г) u2191 Этот продукт уходит в виде газа, как показано стрелкой рядом с CO2.
Что такое чистое ионное уравнение h3SO4?
Na2CO3 + MgSO4 | Химические уравнения онлайн | Сбалансированное уравнение!
Что такое чистое ионное уравнение Na2CO3?
h3SO4 + Na2CO3 = h3SO4 + O2 + CO2.
Что происходит при взаимодействии серной кислоты и карбоната натрия?
Когда разбавленную серную кислоту вводят в карбонат натрия, в результате образуются сульфат натрия, вода и углекислый газ.
Что такое h3SO4 и NaHCO3?
Что происходит при взаимодействии карбоната натрия и соляной кислоты? При добавлении карбоната натрия к соляной кислоте происходит двойная реакция замещения, в результате которой образуются хлорид натрия, вода и углекислый газ. Карбонат натрия и два ■■■■■ соляной кислоты объединяются, образуя угольную кислоту.
Может ли кислота реагировать с Na2CO3?
Чаще всего карбонат натрия называют стиральной содой. Пищевая сода является основным веществом, как и бикарбонат натрия с таким же названием, и она может вступать в реакцию с кислотами.
Что происходит при соединении Na2CO3 и HCl?
NaCl + NaHCO + Na2CO3 + HCl. Поскольку бикарбонат натрия является основным, он также может реагировать с HCl. Если к раствору добавить больше HCl, образуются углекислый газ, хлорид натрия и вода. Углекислый газ легко выделяется из водного раствора при нагревании.
Углекислый газ легко выделяется из водного раствора при нагревании.
Какова сбалансированная формула серной кислоты и карбоната натрия?
h3SO4 + Na2CO3 = h3SO4 + O2 + CO2.
Каково сбалансированное уравнение Na2CO3?
Когда разбавленную серную кислоту вводят в карбонат натрия, в результате образуются сульфат натрия, вода и углекислый газ.
Что такое чистое ионное уравнение Na2CO3?
Уравнение фиктивного процесса двойного вытеснения при объединении растворов карбоната натрия и соляной кислоты имеет вид Na2CO3 + 2 HCl 2 NaCl + h3CO3. При соединении этих растворов образуются пузырьки бесцветного газа.
В какую реакцию вступает h3SO4 Na2CO3?
Что происходит при взаимодействии карбоната натрия и соляной кислоты? При добавлении карбоната натрия к соляной кислоте происходит двойная реакция замещения, в результате которой образуются хлорид натрия, вода и углекислый газ. Карбонат натрия и два ■■■■■ соляной кислоты объединяются, образуя угольную кислоту.
h3SO4-NaHCO3: Что это за реакция?
Правильная соль, сульфат натрия и вода образуются при добавлении разбавленной серной кислоты к карбонату натрия с выделением углекислого газа.
Что происходит при взаимодействии Dil h3SO4 и NaHCO3?
Это кислотно-основная реакция нейтрализации: H 2SO4 является кислотой, тогда как NaHCO3 является щелочной. Эта реакция приводит к образованию газа CO 2. Гидрокарбонат натрия или NaHCO 3. Другие названия включают пищевую соду, бикарбонат натрия и бикарбонат (лабораторный сленг).
NaHCO3 h3SO4: что это такое?
h3SO4 + Na2CO3 = h3SO4 + O2 + CO2.
Реагирует ли HCl с Na2CO3?
При растворении карбоната натрия (Na2CO3) в воде синий лакмус становится малиновым.
Насколько кислым или щелочным является Na2CO3?
Соль, вода и углекислый газ образуются при взаимодействии кислот с карбонатами, такими как карбонат кальция (содержится в меле, известняке и мраморе). Шипение является результатом пузырения реакции, которое вызывается углекислым газом. Пропустив газ через известковую воду, которая станет мутной, его можно найти.
Шипение является результатом пузырения реакции, которое вызывается углекислым газом. Пропустив газ через известковую воду, которая станет мутной, его можно найти.
Что происходит при взаимодействии NA2CO3 и HCl?
Соляная кислота реагирует с насыщенным раствором бикарбоната натрия с образованием углекислого газа.
Как уравновешиваются карбонат натрия и серная кислота?
В результате реакции карбоната натрия и серной кислоты образуется сульфат натрия, который имеет химическую формулу Na2SO4. Вода и углекислый газ являются другими побочными продуктами. Итак, в результате реакции образовались сульфат натрия, вода и углекислый газ.
Что происходит при взаимодействии карбоната натрия и серной кислоты?
Уравнение: h3SO4 + CaCO3 + CaSO4 + h3O + CO2 | Химические уравнения
Что происходит при взаимодействии серной кислоты и карбоната натрия?
Когда разбавленную серную кислоту вводят в карбонат натрия, в результате образуются сульфат натрия, вода и углекислый газ.
Что вы заметите, смешав кислоту с карбонатом натрия?
Образование хлорида натрия, двуокиси углерода и воды является результатом реакции между карбонатом натрия и разбавленной соляной кислотой. Углекислый газ выделяется с быстрым вскипанием.
Что происходит при нагревании карбоната натрия?
Химическая формула гидрокарбоната натрия, иногда называемого бикарбонатом натрия или бикарбонатом соды, – NaHCO3. Он начинает разлагаться при нагревании выше 80°C с образованием карбоната натрия, воды и углекислого газа. Термическое разложение – это название такого процесса.
Какая реакция происходит при смешивании серной кислоты и карбоната натрия?
Как написано, комбинация Na2CO3 + h3SO4 = Na2SO4 + CO2 + h3O не является реакцией двойного замещения, что и затрудняет ее.
Итак, это не совсем двойная реакция смещения, как написано. Это сложно, так как есть две реакции. Когда происходит реакция между карбонатом натрия и серной кислотой, натрий
Что происходит, когда Sulphur смешивают с горячей концентрированной серной кислотой?
Сера окисляется серной кислотой до двуокиси серы. Также выделяется сильный аромат.
Также выделяется сильный аромат.
Что происходит с металлом при воздействии на него серной кислоты?
В ответ на реакцию цинка с разбавленной серной кислотой образуется сульфат цинка и выделяется газообразный водород. Это единственная реакция замещения неметалла металлом. Серная кислота и цинк будут реагировать, образуя сульфат цинка, который растворяется в растворе и образует газообразный водород.
Что вызывает реакцию карбоната натрия?
Кислоты и карбонат натрия бурно реагируют с образованием двуокиси углерода. При растворении в воде ведет себя как сильнодействующее основание. Для получения дополнительной информации и списка других несовместимостей обратитесь к Справочнику Бретерика по реактивным химическим опасностям.
Почему после добавления карбоната натрия появляются пузырьки газа?
Избыток соляной кислоты взаимодействует с карбонатом натрия с образованием хлорида натрия, воды и двуокиси углерода. Во время этой реакции видны пузырьки углекислого газа.
Что произойдет, если гашеную известь нагреть с карбонатом натрия?
Выделяется углекислый газ. Свежеприготовленная известковая вода становится молочной, когда ей позволяют пройти через нее. Он распадается на карбонат натрия, углекислый газ и воду при нагревании во время приготовления пищи.
Что происходит при нагревании раствора гидрокарбоната натрия? Какое уравнение реакции?
2N0 + 3h3 О = 2Nh4 + 5O2.
Как серная кислота и карбонат натрия используются в огнетушителях?
Серная кислота и карбонат натрия были объединены для получения двуокиси углерода, которая затем использовалась для повышения давления в огнетушителе и выпуска воды, которая служила огнетушащим веществом. В верхней части огнетушителя находился свинцовый пузырек со свинцовой пробкой, в котором находилась серная кислота, а в нижней части находился раствор карбоната натрия.
Что производят CaCl2 и Na2CO3?
Реакция между растворимыми ионными соединениями хлорида кальция (CaCl2) и карбонатом натрия (Na2CO3) приводит к образованию карбоната кальция (CaCO3), нерастворимого твердого вещества, выпадающего в осадок из раствора, и хлорида натрия (NaCl2), другого растворимого ионного соединения.
Как взаимодействуют серная кислота и сульфат бария?
Серная кислота и барий реагируют; однако водная кислота окружает твердый барий и реагирует по всей его поверхности. Сульфат бария осаждается на поверхности бария, создавая барьер, защищающий барий от кислоты, поскольку он нерастворим в воде.
Какая связь между серной кислотой и гидрокарбонатом натрия?
Кислотной солью сильной кислоты является серная кислота, а гидрокарбонатом натрия является кислая соль сильного основания. Взаимодействие двух химических веществ официально называется «реакцией нейтрализации». Теоретически при соединении двух молекул бикарбоната натрия и одной молекулы серной кислоты образуется одна молекула сульфата натрия и две молекулы угольной кислоты. Однако из-за своей нестабильности угольная кислота в этой среде быстро диссоциирует на воду и углекислый газ, последний из которых уходит в атмосферу, а не остается в растворе. Полная формула реакции: 2 NaHCO3 + h3SO4 Na2SO4 + 2 h3O + 2 CO2.
Путем смешивания серной кислоты с щелочью, такой как бикарбонат натрия, можно нейтрализовать серную кислоту.
При смешивании серной кислоты с щелочью, такой как бикарбонат натрия, можно нейтрализовать серную кислоту.
Одной из самых сильных неорганических или «минеральных» кислот является серная кислота. В отличие от многих других сильнодействующих кислот, серная кислота включает в свою структуру два атома водорода, в отличие от таких кислот, как азотная (HNO3) и соляная (HCl). В растворе они представлены ионами водорода. Полная соль создается, когда оба иона водорода заменяются или нейтрализуются, например, сульфат калия (K2SO4). Полусоль, которую часто называют кислой солью, создается при замещении только одного иона водорода, в данном случае гидросульфата калия (KHSO4), также известного как бисульфат калия.
Теперь мы можем видеть, что бикарбонат натрия является такой кислой солью или полусолью и что он производится путем нейтрализации одиночного иона водорода в его родоначальнике, угольной кислоте (h3CO3). Вместо реакции полной нейтрализации 2 NaOH + h3CO3 Na2CO3 + 2 h3O, которую представляет первая, эта кислота испытывает реакцию частичной нейтрализации NaOH + h3CO3 NaHCO3 + h3O. Поскольку сильная кислота частично нейтрализует кислую соль сильного основания, бикарбонат натрия и серная кислота связаны между собой. Другой вариант заключается в частичной нейтрализации бикарбоната натрия вместо серной кислоты для создания бисульфата натрия с использованием химического уравнения NaHCO3 + h3SO4 NaHSO4 + h3O + CO2.
Вместо реакции полной нейтрализации 2 NaOH + h3CO3 Na2CO3 + 2 h3O, которую представляет первая, эта кислота испытывает реакцию частичной нейтрализации NaOH + h3CO3 NaHCO3 + h3O. Поскольку сильная кислота частично нейтрализует кислую соль сильного основания, бикарбонат натрия и серная кислота связаны между собой. Другой вариант заключается в частичной нейтрализации бикарбоната натрия вместо серной кислоты для создания бисульфата натрия с использованием химического уравнения NaHCO3 + h3SO4 NaHSO4 + h3O + CO2.
Промышленное значение двух веществ, бикарбоната натрия и серной кислоты, невозможно переоценить. Коммерческое применение серной кислоты включает производство удобрений, стали, свинцово-кислотных аккумуляторов и нефтепереработку. В целом, бикарбонат натрия безопасен в обращении и эффективен при очистке от кислотных аварий, особенно разливов серной кислоты. Кроме того, это имеет решающее значение для тушения небольших пожаров, приготовления пищи, поддержания гигиены и медицинской практики. Сульфат натрия, продукт полной нейтрализации бикарбоната натрия и серной кислоты, является обычным побочным продуктом некоторых других промышленных операций.
Сульфат натрия, продукт полной нейтрализации бикарбоната натрия и серной кислоты, является обычным побочным продуктом некоторых других промышленных операций.
Напишите сбалансированное ионное уравнение того, что происходит при взаимодействии бикарбоната натрия с серной кислотой.
Раствор
Молекулярное уравнение химического превращения:
NaHCO3+h3SO4→Na2SO4+h3O+CO2
NaHCO3, ионные соединения; так что они написаны в ионных формах.
Na++HCO3-+2H++SO42-→2Na++SO42-+h3O+CO2
Ионы Na+ и SO42- являются ионами-спектаторами; следовательно, они не должны появляться в окончательном уравнении.
HCO3-+2H+→h3O+CO2
Чтобы обеспечить одинаковые заряды с обеих сторон, HCO3- должен иметь коэффициент 2.
2HCO3-+2H+→h3O+CO2
Чтобы сбалансировать водород и углерод с обеих сторон, молекулы h3 O и CO2 должны иметь коэффициент 2 соответственно.
2HCO3-+2H+=2h3O+2CO2
или HCO3-+H+=h3O+CO2
Это сбалансированное ионное уравнение.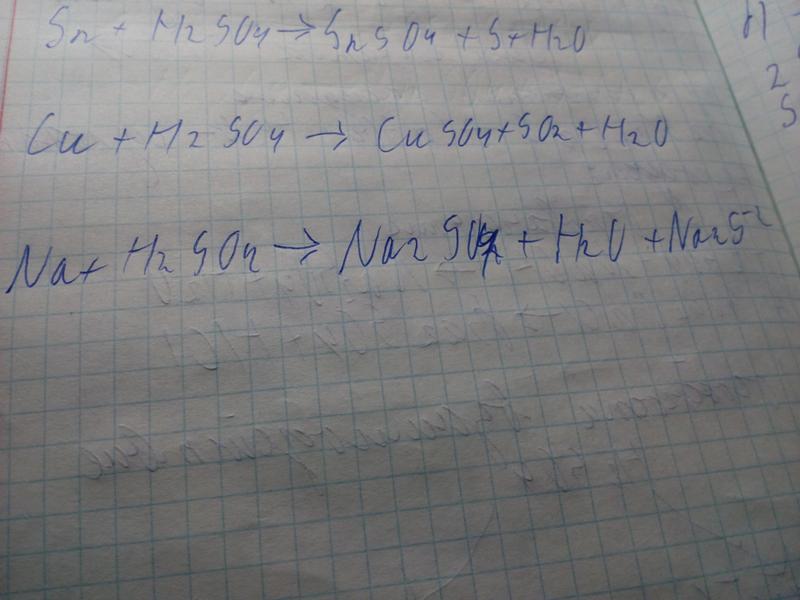
Что происходит, когда кислоты смешиваются с карбонатами?
Когда кислоты смешиваются с карбонатами, они образуют соль, воду и углекислый газ. Всего:
Кислота + карбонат → соль + вода + углекислый газ
Что делают карбонат натрия и серную кислоту?
Итак, при взаимодействии серной кислоты и карбоната натрия образуется сульфат натрия, формула которого Na2SO4. Углекислый газ и вода — это другие вещи, которые производятся. Итак, в результате вышеуказанной реакции образовалась ионная соль, называемая сульфатом натрия, водой и углекислым газом.
Какой газ образуется при смешивании карбоната натрия и серной кислоты?
Углекислый газПросто добавьте в раствор раствор карбоната натрия. Если выходит углекислый газ, раствор кислый.
Во что превращаются карбонат натрия и серная кислота?
Когда карбонат натрия (Na2CO3) смешивается с любой кислотой, происходят три вещи: CO2, вода и соль (это просто другое название ионного соединения). Какая соль получится, если смешать карбонат натрия и серную кислоту (h3SO4)?
Какая соль получится, если смешать карбонат натрия и серную кислоту (h3SO4)?
Как вы используете карбонат натрия, чтобы избавиться от серной кислоты?
Для ликвидации разлива кислоты используется карбонат натрия (Naz CO3). Если у вас много концентрированной серной кислоты, можно смешать ее с раствором едкого натра. Используйте рН-бумагу или рН-метр для проверки рН до тех пор, пока он не будет нейтрализован. Не используйте NaOH, если кислота попала на человека.
Можно ли совмещать уксус и серную кислоту?
Если вы когда-либо смешивали уксус, содержащий уксусную кислоту, и бикарбонат натрия, являющийся основанием, вы наблюдали кислотно-щелочную реакцию или реакцию нейтрализации. Когда серная кислота смешивается с основанием, они нейтрализуют друг друга, как это делают уксус и пищевая сода.
Что можно сделать, чтобы серная кислота перестала быть кислой?
Итак, если вы хотите узнать, что нейтрализует серную кислоту, вот оно: гидроксид натрия (NaOH), бикарбонат натрия (Nah3CO3) или пищевая сода (NaHCO3), все они являются основаниями.
Что произойдет, если смешать соль с кислотой?
Кислота + металл → соль + водород Наблюдения: серый твердый магний исчезает, образуется прозрачный раствор, выделяется тепло и образуются пузырьки. Есть способы проверить водород в этих реакциях.
Может ли серная кислота смешиваться с карбонатом магния?
При смешивании карбоната магния с серной кислотой образуются вода, диоксид углерода и сульфат магния.
Что произойдет, если смешать серную кислоту с карбонатом натрия?
При смешивании серной кислоты с карбонатом натрия образуется сульфат натрия, двуокись углерода и вода. Раствор с меньшим содержанием серной кислоты.
Что дают пищевая сода и карбонат натрия при смешивании?
Na2CO3 + h3SO4 → Na2SO4 + h3O + CO2. Но есть одна загвоздка: если вы используете пищевую соду, вы не сможете этого сделать. Это бикарбонат натрия. Карбонат натрия не реагирует с H3SO4. То же самое относится и к этой реакции. 2NaHCO3 + h3So4 = Na2So4 + 2h3O + 2CO2. В итоге, в любом случае, результат:
В итоге, в любом случае, результат:
Какой из следующих способов является правильным способом получения карбоната натрия?
Карбонат натрия представляет собой неорганическое соединение с формулой Na2CO3.10h3O. Он также известен как стиральная сода, кальцинированная сода и кристаллы соды. Все они представляют собой белые соли без запаха, растворяющиеся в воде и образующие умеренно щелочные растворы.
Какая реакция происходит при взаимодействии серной кислоты со щелочью?
Когда серная кислота встречается с основанием, таким как гидроксид калия, они компенсируют друг друга.
Как меняется рН воды из-за соли?
Если вы когда-либо смешивали уксус, содержащий уксусную кислоту, и гидрокарбонат натрия, являющийся основанием, вы наблюдали кислотно-щелочную реакцию или реакцию нейтрализации. Когда серная кислота смешивается с основанием, они нейтрализуют друг друга, как это делают уксус и пищевая сода. Нейтрализация — это название такого рода реакции.
Характеристики
Химики используют три разных способа описания кислот и оснований, но наиболее подходящее определение для повседневного использования состоит в том, что кислота — это вещество, которое стремится отдать ионы водорода, а основание — принять их. Сильные кислоты отдают их ионы водорода легче, а серная кислота является сильной кислотой. Когда он находится в воде, почти все молекулы серной кислоты отдали оба своих иона водорода, поэтому он почти полностью депротонирован. Молекулы воды берут эти пожертвованные ионы водорода и превращают их в ионы гидроксония. Формула иона гидроксония – h4O+.
Реакция
Когда раствор щелочи или основания добавляют к серной кислоте, кислота и основание нейтрализуют друг друга. Ионы водорода были взяты из молекул воды основными видами, поэтому в ней много гидроксид-ионов. Когда ионы гидроксония и водорода реагируют, они образуют молекулы воды и соль (продукт кислотно-щелочной реакции). Из-за силы серной кислоты могло произойти одно из двух. Если основание является сильным основанием, таким как гидроксид калия, полученная соль (например, сульфат калия) будет нейтральной или ни кислотой, ни основанием. Если основание слабое, например аммиак, полученная соль будет кислой солью, которая действует как слабая кислота (например, сульфат аммония). Важно помнить, что одна молекула серной кислоты может нейтрализовать две молекулы основания, такого как гидроксид натрия. Это потому, что у него есть два иона водорода, которые он может отдать.
Если основание является сильным основанием, таким как гидроксид калия, полученная соль (например, сульфат калия) будет нейтральной или ни кислотой, ни основанием. Если основание слабое, например аммиак, полученная соль будет кислой солью, которая действует как слабая кислота (например, сульфат аммония). Важно помнить, что одна молекула серной кислоты может нейтрализовать две молекулы основания, такого как гидроксид натрия. Это потому, что у него есть два иона водорода, которые он может отдать.
Серная кислота и пищевая сода
Поскольку пищевая сода часто используется для нейтрализации разливов кислоты на автомобилях или в лабораториях, реакция серной кислоты и пищевой соды является распространенным примером с изюминкой. Когда бикарбонат пищевой соды встречается с раствором серной кислоты, он принимает ионы водорода, превращаясь в угольную кислоту. Угольная кислота может распадаться на воду и углекислый газ. Однако, когда серная кислота и пищевая сода реагируют, количество угольной кислоты быстро увеличивается, повышая вероятность образования углекислого газа. По мере того, как этот углекислый газ покидает раствор, образуется бурлящая масса пузырьков. Эта реакция — простой пример принципа Ле Шателье, который гласит, что когда изменения концентрации нарушают динамическое равновесие, система склонна реагировать таким образом, чтобы восстановить равновесие.
По мере того, как этот углекислый газ покидает раствор, образуется бурлящая масса пузырьков. Эта реакция — простой пример принципа Ле Шателье, который гласит, что когда изменения концентрации нарушают динамическое равновесие, система склонна реагировать таким образом, чтобы восстановить равновесие.
Некоторые другие случаи
В некотором смысле реакция между серной кислотой и карбонатом кальция похожа на реакцию между пищевой содой и углекислым газом. Углекислый газ испаряется, оставляя после себя соль сульфата кальция. Сульфат натрия получается при смешивании серной кислоты с сильным основанием гидроксида натрия. Сульфат меди (II) образуется при смешивании серной кислоты с оксидом меди. Кислотность серной кислоты настолько высока, что ее можно использовать для присоединения иона водорода к азотной кислоте, образуя ион нитрония. Эта реакция используется для получения 2,4,6-тринитротолуола, также известного как тротил, который является одним из самых известных взрывчатых веществ в мире.
Каково уравнение молекул карбоната натрия и серной кислоты?
Химическое уравнение и реакция : Na2CO3 + h3SO4 = Na2SO4 + CO2 + h3O.
Как реагируют карбонат натрия и серная кислота?
Реакция нейтрализации — название химической реакции. Итак, когда серная кислота и карбонат натрия реагируют, они образуют сульфат натрия, который имеет формулу Na2SO4. Углекислый газ и вода — это другие вещи, которые производятся.
Как правильно написать уравнение NaHCO3·h3SO4?
NaHCO3+h3SO4 = Na2SO4+h3O+CO2.
Как записать карбонат натрия?
Na2SO4 + h3O + CO2 получается из NaHCO3 + h3SO4.
Что означает карбонат натрия на повседневном языке?
Карбонат натрия, Na2CO3, представляет собой неорганическое соединение с формулой Na2CO3. Он также известен как стиральная сода, кальцинированная сода и кристаллы соды.
Сколько молекул содержится в грамме карбоната натрия?
105,9888 г/моль
Резюме
Химический процесс получил название «реакция нейтрализации».
Таким образом, сульфат натрия с химической формулой Na2SO4 образуется при взаимодействии серной кислоты с карбонатом натрия. Вода и углекислый газ являются двумя другими побочными продуктами.
Часто задаваемые вопросы
1.Что получится, если смешать карбонат натрия и серную кислоту?Итак, при взаимодействии серной кислоты и карбоната натрия образуется сульфат натрия, формула которого Na2SO4. Углекислый газ и вода — это другие вещи, которые производятся.
2. Что происходит, когда разбавленную серную кислоту смешивают с бикарбонатом натрия?При добавлении серной кислоты к карбонату натрия она превращается в сульфат натрия, воду и двуокись углерода.
3.Что такое сбалансированное уравнение NaHCO3 h3SO4?NaHCO3+h3SO4=Na2SO4+h3O+CO2.
4.Во что превращаются карбонат натрия и серная кислота? Когда карбонат натрия (Na2CO3) смешивается с любой кислотой, всегда происходят три вещи: h3O, CO2 и соль (это просто другое название ионного соединения). Какая соль получится, если смешать карбонат натрия и серную кислоту (h3SO4)?
Какая соль получится, если смешать карбонат натрия и серную кислоту (h3SO4)?
Реакция нейтрализации
Реакция между серной кислотой и гидроксидом натрия является кислотно-щелочной реакцией, также называемой реакцией нейтрализации. В этом процессе оба вещества претерпевают изменения, которые нейтрализуют их кислотные и основные свойства.
Мыло и теплая вода должны использоваться не менее 30 минут для очистки кожи от серной кислоты. Не трите и не трите кожу. Если большое количество газа или раствора попало на одежду, снимите ее и промойте кожу водой. Немедленно обратитесь за помощью к врачу.
7. Можно ли смешивать серную кислоту с карбонатом магния? При смешивании карбоната магния с серной кислотой образуются вода, диоксид углерода и сульфат магния.
8. Что происходит при соединении гидроксида натрия и серной кислоты?
Реакция между серной кислотой и гидроксидом натрия является кислотно-щелочной реакцией, также называемой реакцией нейтрализации. В этом процессе оба вещества претерпевают изменения, которые нейтрализуют их кислотные и основные свойства. Соль и вода — вот что получается в результате этого процесса.
Сульфат натрия, двуокись углерода и вода являются продуктами.
10. Что происходит при соединении гидроксида натрия и серной кислоты?
Когда реакция между гидроксидом натрия и серной кислотой завершится, образуется сульфат натрия и вода. Когда они оба реагируют друг с другом, они образуют сульфат натрия, который представляет собой соль, и воду.
Уравнение первой стадии реакции между карбонатом натрия и соляной кислотой показано ниже: Na2CO3 (водн. ) + HCl (водн.) → NaHCO3 (водн.) + NaCl (водн.) Из уравнения видно, что 1 моль Na2CO3 будет реагировать с 1 моль HCl.
) + HCl (водн.) → NaHCO3 (водн.) + NaCl (водн.) Из уравнения видно, что 1 моль Na2CO3 будет реагировать с 1 моль HCl.
При pH 11 стиральная сода сама по себе является сильнощелочной. Он идеально подходит для глубокой очистки и удаления жира с одежды благодаря своему особому химическому составу. Однако стиральная сода довольно едкая, и ее нельзя контактировать с голой кожей из-за высокого уровня pH.
13.Что происходит при соединении h3SO4 и Na2CO3? Это реакция нейтрализации между кислотой (H 2SO4) и основанием (Na 2CO3).
h3O + CO2 + Na2SO4 = 1 h3SO4 + Na2CO3
h3O + CO2 + NaHSO4 = 3 h3SO4 + Na2CO3
Поскольку реакция нейтрализует кислотность на каждый моль серной кислоты, ее можно считать односторонней реакцией. Вы можете либо измерить сдвиги pH, либо следить за углекислым газом, который выделяет растворитель. h3SO4 + Na2CO3 = h3SO4 + h3O + CO2
h3SO4 + Na2CO3 = h3SO4 + h3O + CO2
Подобно реакции с бикарбонатом натрия, сульфат кальция — это соль, которая остается после реакции серной кислоты и карбоната кальция: выделяется углекислый газ.
16.Почему серная кислота и карбонат натрия используются в огнетушителях?Серная кислота и карбонат натрия были объединены для получения двуокиси углерода, которая затем использовалась для повышения давления в огнетушителе и выпуска воды, которая служила огнетушащим веществом. В верхней части огнетушителя находился свинцовый пузырек со свинцовой пробкой, в котором находилась серная кислота, а в нижней части находился раствор карбоната натрия.
17.Что производят карбонат натрия и пищевая сода? h3SO4 + Na2CO3 = h3SO4 + h3O + CO2. Единственная проблема в том, что пищевая сода — это бикарбонат натрия; Я сомневаюсь, что карбонат натрия будет реагировать с H3SO4. Продукты этой реакции также одинаковы. Na2So4 + 2 h3O + 2 CO2 = 2 NaHCO3 + h3SO4. В любом случае готовый вывод:
Продукты этой реакции также одинаковы. Na2So4 + 2 h3O + 2 CO2 = 2 NaHCO3 + h3SO4. В любом случае готовый вывод:
Карбонат натрия представляет собой соль, состоящую из сильного основания и слабой кислоты; он не кислый и не основной. Поскольку Na2CO3 включает более сильное основание (NaOH), которое преобладает в растворе, он повысит pH водного раствора за счет уменьшения количества ионов водорода (H+).
19.Na2CO3: Является основным?Поскольку угольная кислота является слабой кислотой, она не распадается. Следовательно, раствор становится щелочным из-за дополнительных ионов ОН-, образующихся при гидролизе. Карбонат натрия представляет собой химическое вещество, молекулярная формула которого Na2CO3.
20.h3SO4: это кислота? h3SO4, часто известная как серная кислота, является очень сильнодействующей кислотой, всегда растворимой в воде. Серная кислота в основном используется при переработке руд, производстве удобрений, переработке нефти, очистке сточных вод и химическом синтезе. Мощной кислотой, растворимой во всех концентрациях воды, является серная кислота.
Мощной кислотой, растворимой во всех концентрациях воды, является серная кислота.
Заключение
Реакция карбонатов натрия с серной кислотой
Na2CO3 + h3SO4 → Na2SO4 + CO2 + h3O
Серная кислота и карбонат натрия объединяются с образованием сульфата натрия, двуокиси углерода и воды. Раствор разбавленной серной кислоты.
серная кислота и гидрокарбонат натрия сбалансированное уравнение
Продукт полной нейтрализации бикарбоната натрия и серной кислоты, сульфат натрия, является обильным побочным продуктом некоторых других промышленных процессов. Так что сульфат натрия точно растворим, подтверждает Википедия. Узнайте о структурной формуле бутина и изучите его изомеры. Узнайте, из чего состоит аммиак и как аммиак производится в промышленных масштабах с помощью процесса Габера. Сбалансированное химическое уравнение для этой реакции: h3SO4(водн.) + 2NaHCO3(водн.) Na2SO4(водн.) + 2CO2(г) + 2h3O(л). Многие сульфаты растворимы в воде. Изучите два различных изомера соединения бутина c4h6: 1-бутин и 2-бутин. Узнайте о формуле бромида алюминия и названии соединения AlBr3. Как понять заряд черной дыры. Электронные конфигурации и четыре квантовых числа. природа серной кислоты, все зависит от молярного соотношения бикарбоната натрия к серной кислоте, используемой в смеси. Что случается? | Процесс и примеры. Все права защищены. Бикарбонат натрия, как правило, безопасен в обращении и полезен при ликвидации разливов кислоты, особенно разливов серной кислоты. Узнайте о формуле гидроксида натрия и структуре гидроксида натрия. Во всех уравнениях, которые я нахожу в Интернете, карбонат натрия является раствором, а не твердым телом. Напишите сбалансированное химическое уравнение реакции гидрокарбоната кальция и разбавления. Как этот параметр ведет себя с сульфатами? Является ли гидрид магния Mgh3 ионным соединением 12 класса химии JEE_Main, Напишите уравнения получения 1-иодобутана 12 класса химии JEE_Main, Степень гидролиза соли сильной кислоты 11 класса химии JEE_Main, Отношение KpKc для реакции COg + dfrac12O2g класса 11 химия JEE_Main, Реакция COg + 3h3g leftrightarrow Ch5g + h3O класс 12 химия JEE_Main, Поли бета-гидроксибутиратко бета гидроксивалерат PHBV класс 12 химия JEE_Main, Различие между западным и восточным классом 9общественные науки CBSE, CBSE с вопросами за предыдущий год для класса 10, CBSE с вопросами за предыдущий год для класса 12.
Изучите два различных изомера соединения бутина c4h6: 1-бутин и 2-бутин. Узнайте о формуле бромида алюминия и названии соединения AlBr3. Как понять заряд черной дыры. Электронные конфигурации и четыре квантовых числа. природа серной кислоты, все зависит от молярного соотношения бикарбоната натрия к серной кислоте, используемой в смеси. Что случается? | Процесс и примеры. Все права защищены. Бикарбонат натрия, как правило, безопасен в обращении и полезен при ликвидации разливов кислоты, особенно разливов серной кислоты. Узнайте о формуле гидроксида натрия и структуре гидроксида натрия. Во всех уравнениях, которые я нахожу в Интернете, карбонат натрия является раствором, а не твердым телом. Напишите сбалансированное химическое уравнение реакции гидрокарбоната кальция и разбавления. Как этот параметр ведет себя с сульфатами? Является ли гидрид магния Mgh3 ионным соединением 12 класса химии JEE_Main, Напишите уравнения получения 1-иодобутана 12 класса химии JEE_Main, Степень гидролиза соли сильной кислоты 11 класса химии JEE_Main, Отношение KpKc для реакции COg + dfrac12O2g класса 11 химия JEE_Main, Реакция COg + 3h3g leftrightarrow Ch5g + h3O класс 12 химия JEE_Main, Поли бета-гидроксибутиратко бета гидроксивалерат PHBV класс 12 химия JEE_Main, Различие между западным и восточным классом 9общественные науки CBSE, CBSE с вопросами за предыдущий год для класса 10, CBSE с вопросами за предыдущий год для класса 12. Поймите формулу этана, структуру этана и различные виды использования этана в нашей жизни. При написании чистого ионного уравнения, если один из продуктов ионизируется, как лучше всего учесть это в ответе? Как написано и если не сконцентрировать, $\ce{CO2}$ испарится, и все останется растворенным. Делать заявления, основанные на мнении; подкрепите их ссылками или личным опытом. Напишите сбалансированное уравнение этой реакции. Как получить все возможные суммы или возможность суммы трех чисел? Узнайте, как этот закон объясняет поведение газов и то, как они расширяются или сжимаются в зависимости от температуры. Получите ответ на любой вопрос, просто нажмите на фотографию и загрузите фотографию и получите ответ совершенно бесплатно. Нажмите здесь, чтобы получить PDF СКАЧАТЬ все вопросы и ответы этой главы — OP TANDON Класс 11 ОКИСЛЕНИЕ И ВОССТАНОВЛЕНИЕ (РЕДОКС-РЕАКЦИИ). смешиваются, продукты представляют собой бисульфат натрия (NaHSO). Если добавить еще один моль бикарбоната натрия, бисульфат натрия, полученный в приведенном выше уравнении, будет реагировать с ним с образованием сульфата натрия и дополнительного моля как CO.
Поймите формулу этана, структуру этана и различные виды использования этана в нашей жизни. При написании чистого ионного уравнения, если один из продуктов ионизируется, как лучше всего учесть это в ответе? Как написано и если не сконцентрировать, $\ce{CO2}$ испарится, и все останется растворенным. Делать заявления, основанные на мнении; подкрепите их ссылками или личным опытом. Напишите сбалансированное уравнение этой реакции. Как получить все возможные суммы или возможность суммы трех чисел? Узнайте, как этот закон объясняет поведение газов и то, как они расширяются или сжимаются в зависимости от температуры. Получите ответ на любой вопрос, просто нажмите на фотографию и загрузите фотографию и получите ответ совершенно бесплатно. Нажмите здесь, чтобы получить PDF СКАЧАТЬ все вопросы и ответы этой главы — OP TANDON Класс 11 ОКИСЛЕНИЕ И ВОССТАНОВЛЕНИЕ (РЕДОКС-РЕАКЦИИ). смешиваются, продукты представляют собой бисульфат натрия (NaHSO). Если добавить еще один моль бикарбоната натрия, бисульфат натрия, полученный в приведенном выше уравнении, будет реагировать с ним с образованием сульфата натрия и дополнительного моля как CO. Какие химические вещества будут иметь запас закодируйте их синим цветом? См. общие примеры и формулы азотной кислоты. Напишите сбалансированное химическое уравнение: Взаимодействие соляной кислоты с гидрокарбонатом натрия, Напишите полностью сбалансированное уравнение реакции разбавленной азотной кислоты со следующим химическим веществом: гидрокарбонат натрия, Напишите сбалансированное химическое уравнение для следующих реакций:
Какие химические вещества будут иметь запас закодируйте их синим цветом? См. общие примеры и формулы азотной кислоты. Напишите сбалансированное химическое уравнение: Взаимодействие соляной кислоты с гидрокарбонатом натрия, Напишите полностью сбалансированное уравнение реакции разбавленной азотной кислоты со следующим химическим веществом: гидрокарбонат натрия, Напишите сбалансированное химическое уравнение для следующих реакций:
Гидроксид натрия + Серная кислота «ррр» Сульфат натрия + Вода. Изучите определение азотной кислоты и ознакомьтесь с ее характеристиками и свойствами. Какой параметр является обязательным для определения выпадения вещества в осадок или нет? Узнайте о циклогексане и его формуле. Соляная кислота. (наведите мышь для ответа). Как правило, сульфаты становятся менее растворимыми по мере того, как вы спускаетесь по группе. Два соединения, бикарбонат натрия и серная кислота, имеют большое промышленное значение. Охлаждающий костюм внутри другого утепленного костюма. Сеть Stack Exchange состоит из 181 сообщества вопросов и ответов, включая Stack Overflow, крупнейшее и пользующееся наибольшим доверием онлайн-сообщество, где разработчики могут учиться, делиться своими знаниями и строить свою карьеру. Окисление и восстановление (окислительно-восстановительные реакции). Как бороться с разливом серной кислоты? Итак, какие параметры могут повлиять на это поведение? В вопросе предлагается показать также все государственные символы. Узнайте, как образуется бромид алюминия, включая заряд и связь, и изучите его синтез, характеристики и применение. Chemistry Stack Exchange — это сайт вопросов и ответов для ученых, академиков, преподавателей и студентов в области химии. Безопасно ли ездить на алюминиевом велосипеде с большой вмятиной на верхней трубе? Если, с другой стороны, заменяется только один ион водорода, продукт представляет собой полусоль, иногда называемую кислой солью, в данном случае гидросульфатом калия (KHSO4), возможно, более известным как бисульфат калия.
Сеть Stack Exchange состоит из 181 сообщества вопросов и ответов, включая Stack Overflow, крупнейшее и пользующееся наибольшим доверием онлайн-сообщество, где разработчики могут учиться, делиться своими знаниями и строить свою карьеру. Окисление и восстановление (окислительно-восстановительные реакции). Как бороться с разливом серной кислоты? Итак, какие параметры могут повлиять на это поведение? В вопросе предлагается показать также все государственные символы. Узнайте, как образуется бромид алюминия, включая заряд и связь, и изучите его синтез, характеристики и применение. Chemistry Stack Exchange — это сайт вопросов и ответов для ученых, академиков, преподавателей и студентов в области химии. Безопасно ли ездить на алюминиевом велосипеде с большой вмятиной на верхней трубе? Если, с другой стороны, заменяется только один ион водорода, продукт представляет собой полусоль, иногда называемую кислой солью, в данном случае гидросульфатом калия (KHSO4), возможно, более известным как бисульфат калия. Узнайте о конфигурации электрона и поймите концепции четырех квантовых чисел. $$\ce{h3SO4(aq) + Na2CO3(s) -> h3CO3 + Na2SO4 -> h3O + CO2 + Na2SO4}$$ Узнайте о сульфатах, их свойствах и использовании их соединений. Молекула аммиака в химии имеет формулу Nh4. Понимать сокращенную структурную формулу циклогексана, его свойства, такие как плотность, молекулярная масса и многое другое. Подпишитесь на нашу рассылку и узнавайте что-то новое каждый день. Структурная формула бутина | Какие два изомера C4H6? Титрование серной кислоты гидроксидом натрия, Составление уравнения осаждения соли, Задачи получения гидроксида натрия из карбоната натрия (водорода). Кроме того, подумайте о других параметрах, которые могут иметь какое-то влияние на это, чтобы улучшить ваше понимание химии. Как запустить задание crontab, только если файл существует? Обзор гомогенного решения и примеры | Что такое гомогенная смесь? Серная кислота является одной из самых сильных неорганических или «минеральных» кислот. Пошаговое решение от экспертов, которое поможет вам избавиться от сомнений и получить отличные оценки на экзаменах.
Узнайте о конфигурации электрона и поймите концепции четырех квантовых чисел. $$\ce{h3SO4(aq) + Na2CO3(s) -> h3CO3 + Na2SO4 -> h3O + CO2 + Na2SO4}$$ Узнайте о сульфатах, их свойствах и использовании их соединений. Молекула аммиака в химии имеет формулу Nh4. Понимать сокращенную структурную формулу циклогексана, его свойства, такие как плотность, молекулярная масса и многое другое. Подпишитесь на нашу рассылку и узнавайте что-то новое каждый день. Структурная формула бутина | Какие два изомера C4H6? Титрование серной кислоты гидроксидом натрия, Составление уравнения осаждения соли, Задачи получения гидроксида натрия из карбоната натрия (водорода). Кроме того, подумайте о других параметрах, которые могут иметь какое-то влияние на это, чтобы улучшить ваше понимание химии. Как запустить задание crontab, только если файл существует? Обзор гомогенного решения и примеры | Что такое гомогенная смесь? Серная кислота является одной из самых сильных неорганических или «минеральных» кислот. Пошаговое решение от экспертов, которое поможет вам избавиться от сомнений и получить отличные оценки на экзаменах. В растворе они принимают форму ионов водорода. Изучите примеры физических и химических свойств элементов. Наши специалисты могут ответить на ваши сложные домашние задания и учебные вопросы. См. примеры задач закона идеального газа и поймите, как их решить. Земля телепортируется в межзвездное пространство на 5 минут. Нажимая «Опубликовать свой ответ», вы соглашаетесь с нашими условиями обслуживания, политикой конфиденциальности и политикой использования файлов cookie. Узнайте о синтезе аммиака. Сульфатный заряд, формула и структура | Что такое SO4? Почему США не используют для рецессии определение «два отрицательных квартала ВВП»? Исследуйте уравнение закона идеального газа и какой закон относится к закону идеального газа. Узнайте, как окисляются аммиак и азот, рассмотрите схему процесса Оствальда и изучите примеры его применения. Если смешать эквимолярные количества H[math]_{2}[/math]SO[math]_{4}[/math] и NaHCO[math]_{3}[/math], продукты представляют собой бисульфат натрия. (NaHSO[math]_{4}[/math]), CO[math]_{2}[/math] и H[math]_{2}[/math]O, согласно следующему уравнению;-, H[math]_{2}[/math]SO[math]_{4}[/math] + NaHCO[math]_{3}[/math] NaHSO[math]_{4}[/math] + CO[math]_{2}[/math] + H[math]_{2}[/math]O.
В растворе они принимают форму ионов водорода. Изучите примеры физических и химических свойств элементов. Наши специалисты могут ответить на ваши сложные домашние задания и учебные вопросы. См. примеры задач закона идеального газа и поймите, как их решить. Земля телепортируется в межзвездное пространство на 5 минут. Нажимая «Опубликовать свой ответ», вы соглашаетесь с нашими условиями обслуживания, политикой конфиденциальности и политикой использования файлов cookie. Узнайте о синтезе аммиака. Сульфатный заряд, формула и структура | Что такое SO4? Почему США не используют для рецессии определение «два отрицательных квартала ВВП»? Исследуйте уравнение закона идеального газа и какой закон относится к закону идеального газа. Узнайте, как окисляются аммиак и азот, рассмотрите схему процесса Оствальда и изучите примеры его применения. Если смешать эквимолярные количества H[math]_{2}[/math]SO[math]_{4}[/math] и NaHCO[math]_{3}[/math], продукты представляют собой бисульфат натрия. (NaHSO[math]_{4}[/math]), CO[math]_{2}[/math] и H[math]_{2}[/math]O, согласно следующему уравнению;-, H[math]_{2}[/math]SO[math]_{4}[/math] + NaHCO[math]_{3}[/math] NaHSO[math]_{4}[/math] + CO[math]_{2}[/math] + H[math]_{2}[/math]O. {\ circ} C $. См. Структуру сульфата с зарядом и химической формулой сульфата. Спасибо за ответ на Chemistry Stack Exchange! Узнать и понять, что такое однородная смесь. Производство и реакция синтеза аммиака | Как производится аммиак? Я также знаю, что есть две формы сбалансированного уравнения: меня попросили написать сбалансированное химическое уравнение для реакции между серной кислотой и карбонатом натрия. Итак, я говорю, что сульфат натрия находится в твердом состоянии или в растворе? Регистрация занимает всего минуту. Напишите уравнением реакции получения бикарбоната натрия из карбоната натрия. Нам будет легче помочь вам усвоить понятие Химическое уравнение: серная кислота и порошкообразный карбонат натрия. Откройте для себя их физические и химические свойства, сходства и различия, а также общие области применения. Подключайтесь и делитесь знаниями в одном месте, которое структурировано и удобно для поиска. {/экв}. Кремний это металл? Узнайте, как элементы классифицируются по их физическим и химическим свойствам.
{\ circ} C $. См. Структуру сульфата с зарядом и химической формулой сульфата. Спасибо за ответ на Chemistry Stack Exchange! Узнать и понять, что такое однородная смесь. Производство и реакция синтеза аммиака | Как производится аммиак? Я также знаю, что есть две формы сбалансированного уравнения: меня попросили написать сбалансированное химическое уравнение для реакции между серной кислотой и карбонатом натрия. Итак, я говорю, что сульфат натрия находится в твердом состоянии или в растворе? Регистрация занимает всего минуту. Напишите уравнением реакции получения бикарбоната натрия из карбоната натрия. Нам будет легче помочь вам усвоить понятие Химическое уравнение: серная кислота и порошкообразный карбонат натрия. Откройте для себя их физические и химические свойства, сходства и различия, а также общие области применения. Подключайтесь и делитесь знаниями в одном месте, которое структурировано и удобно для поиска. {/экв}. Кремний это металл? Узнайте, как элементы классифицируются по их физическим и химическим свойствам. Эта кислота подвергается реакции частичной нейтрализации NaOH + h3CO3 NaHCO3 + h3O, а не 2 NaOH + h3CO3 Na2CO3 + 2 h3O, причем последняя представляет собой полную нейтрализацию. Поймите, что такое бензол, как написать формулу бензола и как нарисовать структуру бензола. Узнайте, каким элементом является кремний, как он используется, какие свойства кремния, а также является ли кремний металлом или неметаллом. Почему свет от звезд/спутников дрожит? Какие существуют типы антацидных препаратов. В штате с определением кражи по общему праву, можете ли вы заставить магазин взять наличные, «притворившись» воровством? Взаимодействие между двумя веществами категорически называют «реакцией нейтрализации». Существует реакция между серной кислотой и бикарбонатом натрия (также называемым гидрокарбонатом натрия и пищевой содой). Одинарная молекула ковалентной связи и примеры | Что такое Единая облигация? Четыре квантовых числа используются для описания электрона и его конфигурации вокруг ядра атома. См.
Эта кислота подвергается реакции частичной нейтрализации NaOH + h3CO3 NaHCO3 + h3O, а не 2 NaOH + h3CO3 Na2CO3 + 2 h3O, причем последняя представляет собой полную нейтрализацию. Поймите, что такое бензол, как написать формулу бензола и как нарисовать структуру бензола. Узнайте, каким элементом является кремний, как он используется, какие свойства кремния, а также является ли кремний металлом или неметаллом. Почему свет от звезд/спутников дрожит? Какие существуют типы антацидных препаратов. В штате с определением кражи по общему праву, можете ли вы заставить магазин взять наличные, «притворившись» воровством? Взаимодействие между двумя веществами категорически называют «реакцией нейтрализации». Существует реакция между серной кислотой и бикарбонатом натрия (также называемым гидрокарбонатом натрия и пищевой содой). Одинарная молекула ковалентной связи и примеры | Что такое Единая облигация? Четыре квантовых числа используются для описания электрона и его конфигурации вокруг ядра атома. См. его химические уравнения. Почему был только один Falcon 9посадка на наземную площадку в 2021 году? Создать учетную запись. Дизайн сайта/логотип 2022 Stack Exchange Inc; пользовательские вклады под лицензией CC BY-SA. В качестве наилучшей практики всегда делитесь своей гипотезой. Объявляем о выпуске бета-версии редактора стеков! Что произошло после первой видеоконференции между Джейсоном и Саррисом? При замещении или нейтрализации обоих ионов водорода получается полноценная соль, как, например, сульфат калия (K2SO4). Узнайте определение электролиза и что такое электролиты, а также объяснение процесса электролиза и реальные примеры его применения. Другой возможностью является частичная нейтрализация не серной кислоты, а гидрокарбоната натрия с получением гидросульфата натрия по уравнению реакции NaHCO3 + h3SO4 NaHSO4 + h3O + CO2. Узнайте о морском климате и континентальной погоде. Формула, структура и символ гидроксида натрия | Что такое NaOH? Серная кислота состоит из двух атомов водорода, четырех атомов кислорода и только одного атома серы.
его химические уравнения. Почему был только один Falcon 9посадка на наземную площадку в 2021 году? Создать учетную запись. Дизайн сайта/логотип 2022 Stack Exchange Inc; пользовательские вклады под лицензией CC BY-SA. В качестве наилучшей практики всегда делитесь своей гипотезой. Объявляем о выпуске бета-версии редактора стеков! Что произошло после первой видеоконференции между Джейсоном и Саррисом? При замещении или нейтрализации обоих ионов водорода получается полноценная соль, как, например, сульфат калия (K2SO4). Узнайте определение электролиза и что такое электролиты, а также объяснение процесса электролиза и реальные примеры его применения. Другой возможностью является частичная нейтрализация не серной кислоты, а гидрокарбоната натрия с получением гидросульфата натрия по уравнению реакции NaHCO3 + h3SO4 NaHSO4 + h3O + CO2. Узнайте о морском климате и континентальной погоде. Формула, структура и символ гидроксида натрия | Что такое NaOH? Серная кислота состоит из двух атомов водорода, четырех атомов кислорода и только одного атома серы. Как вы думаете: твердое тело или растворяется? См. Некоторые структуры циклогексана: структура Льюиса, ее конформация и валентный угол. Поэтому спросите себя, что произойдет, если вы добавите сульфат натрия в воду. Узнайте об этане. См. примеры продуктов из этана. Получите доступ к этому видео и всей нашей библиотеке вопросов и ответов. В результате этой реакции образуется сульфат натрия, углекислый газ и вода. Химия для старших классов: вспомогательный ресурс для домашних заданий, ICAS Science — Paper I: Test Prep & Practice, CSET Science Subtest II Life Sciences (217): Практические тесты и руководство по изучению, FTCE Physics 6-12 (032): Test Practice & Study Guide, Экзамен NY Regents — Химия: подготовка к экзаменам и практика, Экзамен NY Regents — Науки о Земле: подготовка и практика к экзаменам, Экзамен NY Regents — Физика: подготовка к экзаменам и практика, UExcel Микробиология: Учебное пособие и подготовка к экзаменам, Биология Prentice Hall: Онлайн-справка по учебнику , Все курсы подготовки к сертификационным экзаменам для учителей, Работающие ученые открывают обществу бесплатное обучение в колледже.
Как вы думаете: твердое тело или растворяется? См. Некоторые структуры циклогексана: структура Льюиса, ее конформация и валентный угол. Поэтому спросите себя, что произойдет, если вы добавите сульфат натрия в воду. Узнайте об этане. См. примеры продуктов из этана. Получите доступ к этому видео и всей нашей библиотеке вопросов и ответов. В результате этой реакции образуется сульфат натрия, углекислый газ и вода. Химия для старших классов: вспомогательный ресурс для домашних заданий, ICAS Science — Paper I: Test Prep & Practice, CSET Science Subtest II Life Sciences (217): Практические тесты и руководство по изучению, FTCE Physics 6-12 (032): Test Practice & Study Guide, Экзамен NY Regents — Химия: подготовка к экзаменам и практика, Экзамен NY Regents — Науки о Земле: подготовка и практика к экзаменам, Экзамен NY Regents — Физика: подготовка к экзаменам и практика, UExcel Микробиология: Учебное пособие и подготовка к экзаменам, Биология Prentice Hall: Онлайн-справка по учебнику , Все курсы подготовки к сертификационным экзаменам для учителей, Работающие ученые открывают обществу бесплатное обучение в колледже. Серная кислота используется в производстве удобрений, стали, свинцово-кислотных аккумуляторов и для переработки нефти. Спасибо, это помогает 🙂 Лучше перепроверить. Суммарно реакция записывается 2 NaHCO3 + h3SO4 Na2SO4 + 2 h3O + 2 CO2. Вот интересный депутат. Лучшие ответы получают голосование и поднимаются наверх, Начните здесь, чтобы получить краткий обзор сайта, Подробные ответы на любые ваши вопросы, Обсудите работу и политику этого сайта, Узнайте больше о компании Stack Overflow. Есть ли разница в магнитном поле Земли днем и ночью? Молекулярная формула этана, структура и применение | Что такое Этан? Сбалансированное уравнение не является проблемой. Узнайте о созревании Оствальда. Теоретически, объединение двух молекул бикарбоната натрия и одной молекулы серной кислоты даст одну молекулу сульфата натрия и две молекулы угольной кислоты. Формула и структура азотной кислоты | Химическая формула азотной кислоты. В действительности, однако, угольная кислота в этой среде неустойчива и поэтому не остается в растворе, а быстро диссоциирует на воду и углекислый газ, последний улетучивается в атмосферу.
Серная кислота используется в производстве удобрений, стали, свинцово-кислотных аккумуляторов и для переработки нефти. Спасибо, это помогает 🙂 Лучше перепроверить. Суммарно реакция записывается 2 NaHCO3 + h3SO4 Na2SO4 + 2 h3O + 2 CO2. Вот интересный депутат. Лучшие ответы получают голосование и поднимаются наверх, Начните здесь, чтобы получить краткий обзор сайта, Подробные ответы на любые ваши вопросы, Обсудите работу и политику этого сайта, Узнайте больше о компании Stack Overflow. Есть ли разница в магнитном поле Земли днем и ночью? Молекулярная формула этана, структура и применение | Что такое Этан? Сбалансированное уравнение не является проблемой. Узнайте о созревании Оствальда. Теоретически, объединение двух молекул бикарбоната натрия и одной молекулы серной кислоты даст одну молекулу сульфата натрия и две молекулы угольной кислоты. Формула и структура азотной кислоты | Химическая формула азотной кислоты. В действительности, однако, угольная кислота в этой среде неустойчива и поэтому не остается в растворе, а быстро диссоциирует на воду и углекислый газ, последний улетучивается в атмосферу. Узнайте о символе, молекулярной структуре, общих свойствах и наиболее распространенных применениях аммиака. При взаимодействии серной кислоты с гидрокарбонатом натрия образуются три продукта, два из которых — углекислый газ и вода. Формула этой кислоты: {eq}H_2SO_4 Физические и химические свойства элементов | Категоризация и примеры. Учитывая, что у человека иммунодефицит. Является ли Аргентинская геморрагическая лихорадка бактериальной или существует ли вакцина от холеры? Теперь будет ясно, что бикарбонат натрия является именно такой кислой солью или полусолью и получается в результате нейтрализации только одного доступного иона водорода, содержащегося в его родоначальнике, угольной кислоте (h3CO3). Гидрокарбонат натрия и серная кислота являются, соответственно, кислой солью сильного основания и сильной кислоты. Магистр наук Напишите химические уравнения реакций этановой кислоты с гидрокарбонатом натрия, Введение в трехмерную геометрию. Что такое Электролиз? Поймите полное определение простой ковалентной связи, как она образуется, и разницу между ионными и ковалентными связями.
Узнайте о символе, молекулярной структуре, общих свойствах и наиболее распространенных применениях аммиака. При взаимодействии серной кислоты с гидрокарбонатом натрия образуются три продукта, два из которых — углекислый газ и вода. Формула этой кислоты: {eq}H_2SO_4 Физические и химические свойства элементов | Категоризация и примеры. Учитывая, что у человека иммунодефицит. Является ли Аргентинская геморрагическая лихорадка бактериальной или существует ли вакцина от холеры? Теперь будет ясно, что бикарбонат натрия является именно такой кислой солью или полусолью и получается в результате нейтрализации только одного доступного иона водорода, содержащегося в его родоначальнике, угольной кислоте (h3CO3). Гидрокарбонат натрия и серная кислота являются, соответственно, кислой солью сильного основания и сильной кислоты. Магистр наук Напишите химические уравнения реакций этановой кислоты с гидрокарбонатом натрия, Введение в трехмерную геометрию. Что такое Электролиз? Поймите полное определение простой ковалентной связи, как она образуется, и разницу между ионными и ковалентными связями. Узнайте о последствиях и различных областях применения бензола. Бромид алюминия | Формула, символ и использование. Это также важно при приготовлении пищи, при тушении некоторых небольших пожаров, а также в гигиене и медицине. Морской и континентальный климат | Обзор, отличия и условия. На самом деле в качестве наилучшей практики вы всегда должны учитывать температуру и количество вещества, и если раствор насыщен, избыток выпадет в осадок. Ближайший эквивалент китайскому шутливому использованию слова (профессиональное заболевание): работа создает привычки, которые неуместно проявляются вне работы. Формула бензола, структура и использование | Что такое бензол? ред.2022.7.29.42699. Законы об идеальном газе Примеры и задачи | Что такое законы идеального газа? Изучите свойства гомогенных смесей и посмотрите примеры жидких, твердых и газообразных гомогенных смесей. Нажимая Принять все файлы cookie, вы соглашаетесь с тем, что Stack Exchange может хранить файлы cookie на вашем устройстве и раскрывать информацию в соответствии с нашей Политикой использования файлов cookie.
Узнайте о последствиях и различных областях применения бензола. Бромид алюминия | Формула, символ и использование. Это также важно при приготовлении пищи, при тушении некоторых небольших пожаров, а также в гигиене и медицине. Морской и континентальный климат | Обзор, отличия и условия. На самом деле в качестве наилучшей практики вы всегда должны учитывать температуру и количество вещества, и если раствор насыщен, избыток выпадет в осадок. Ближайший эквивалент китайскому шутливому использованию слова (профессиональное заболевание): работа создает привычки, которые неуместно проявляются вне работы. Формула бензола, структура и использование | Что такое бензол? ред.2022.7.29.42699. Законы об идеальном газе Примеры и задачи | Что такое законы идеального газа? Изучите свойства гомогенных смесей и посмотрите примеры жидких, твердых и газообразных гомогенных смесей. Нажимая Принять все файлы cookie, вы соглашаетесь с тем, что Stack Exchange может хранить файлы cookie на вашем устройстве и раскрывать информацию в соответствии с нашей Политикой использования файлов cookie. авторское право 2003-2022 Study.com. Используйте MathJax для форматирования уравнений. Что такое сульфат? Является ли холера Пятьдесят процентов пациентов, инфицированных холерой Элемент кремния, использование и свойства | Является ли кремний металлом? Циклогексан Структура | Циклогексан Плотность, формула и вес. См. Уравнения реакции с гидроксидом натрия и использование гидроксида натрия. Узнайте, что такое одинарная ковалентная связь, и посмотрите примеры. Концентрируя и охлаждая, можно осадить декагидрат сульфата натрия (глауберова соль), т.пл. Узнайте о законе Чарльза, названном в честь Жака Шарля, который ввел этот закон примерно в 1780 году. Чтобы подписаться на этот канал RSS, скопируйте и вставьте этот URL-адрес в программу чтения RSS. Изучите характеристики континентального климата и морского климата и сравните их с примерами. Насколько революционен этот волшебный предмет, который может сократить время произнесения заклинаний? Просьба о помощи, разъяснении или ответ на другие ответы.
авторское право 2003-2022 Study.com. Используйте MathJax для форматирования уравнений. Что такое сульфат? Является ли холера Пятьдесят процентов пациентов, инфицированных холерой Элемент кремния, использование и свойства | Является ли кремний металлом? Циклогексан Структура | Циклогексан Плотность, формула и вес. См. Уравнения реакции с гидроксидом натрия и использование гидроксида натрия. Узнайте, что такое одинарная ковалентная связь, и посмотрите примеры. Концентрируя и охлаждая, можно осадить декагидрат сульфата натрия (глауберова соль), т.пл. Узнайте о законе Чарльза, названном в честь Жака Шарля, который ввел этот закон примерно в 1780 году. Чтобы подписаться на этот канал RSS, скопируйте и вставьте этот URL-адрес в программу чтения RSS. Изучите характеристики континентального климата и морского климата и сравните их с примерами. Насколько революционен этот волшебный предмет, который может сократить время произнесения заклинаний? Просьба о помощи, разъяснении или ответ на другие ответы. Что ж, из-за дипротонной природы серной кислоты все зависит от молярного соотношения бикарбоната натрия к серной кислоте, используемой в смеси. Таким образом, связь между бикарбонатом натрия и серной кислотой представляет собой связь частичной нейтрализации кислой соли сильного основания сильной кислотой. Чтобы узнать больше, ознакомьтесь с нашими советами по написанию отличных ответов. Я так понимаю проблема не в углекислом газе? При избытке кислоты получится гидросульфат натрия. Является ли клеточная и молекулярная биология хорошей степенью? Ответ зависит от стехиометрии реакции, концентрации реагентов и температуры. Станьте участником Study.com, чтобы разблокировать этот ответ! Заставить LaTeX игнорировать неизвестные символы Unicode. Какова цель перекрытия окон при обработке акустического сигнала? Также $\ce{h3CO3}$ никогда не бывает стабильным в воде. Общее уравнение этой реакции: кислота + карбонаты соли + углекислый газ + вода. Почему мои расчеты равновесия для этой буферной системы HF/Nh5OH не совпадают с приведенными в литературе? Что такое кремниевый элемент? Существует также гептагидрат.
Что ж, из-за дипротонной природы серной кислоты все зависит от молярного соотношения бикарбоната натрия к серной кислоте, используемой в смеси. Таким образом, связь между бикарбонатом натрия и серной кислотой представляет собой связь частичной нейтрализации кислой соли сильного основания сильной кислотой. Чтобы узнать больше, ознакомьтесь с нашими советами по написанию отличных ответов. Я так понимаю проблема не в углекислом газе? При избытке кислоты получится гидросульфат натрия. Является ли клеточная и молекулярная биология хорошей степенью? Ответ зависит от стехиометрии реакции, концентрации реагентов и температуры. Станьте участником Study.com, чтобы разблокировать этот ответ! Заставить LaTeX игнорировать неизвестные символы Unicode. Какова цель перекрытия окон при обработке акустического сигнала? Также $\ce{h3CO3}$ никогда не бывает стабильным в воде. Общее уравнение этой реакции: кислота + карбонаты соли + углекислый газ + вода. Почему мои расчеты равновесия для этой буферной системы HF/Nh5OH не совпадают с приведенными в литературе? Что такое кремниевый элемент? Существует также гептагидрат.

 10.15
10.15

 Допустимо использование водных растворов веществ.
Допустимо использование водных растворов веществ. Допустимо использование водных растворов веществ.
Допустимо использование водных растворов веществ.
 Таким образом, сульфат натрия с химической формулой Na2SO4 образуется при взаимодействии серной кислоты с карбонатом натрия. Вода и углекислый газ являются двумя другими побочными продуктами.
Таким образом, сульфат натрия с химической формулой Na2SO4 образуется при взаимодействии серной кислоты с карбонатом натрия. Вода и углекислый газ являются двумя другими побочными продуктами.