Помощь студентам в учёбе от Людмилы Фирмаль
Здравствуйте!
Я, Людмила Анатольевна Фирмаль, бывший преподаватель математического факультета Дальневосточного государственного физико-технического института со стажем работы более 17 лет. На данный момент занимаюсь онлайн обучением и помощью по любыми предметам. У меня своя команда грамотных, сильных бывших преподавателей ВУЗов. Мы справимся с любой поставленной перед нами работой технического и гуманитарного плана. И не важно: она по объёму на две формулы или огромная сложно структурированная на 125 страниц! Нам по силам всё, поэтому не стесняйтесь, присылайте.
Срок выполнения разный: возможно онлайн (сразу пишите и сразу помогаю), а если у Вас что-то сложное – то от двух до пяти дней.
Для качественного оформления работы обязательно нужны методические указания и, желательно, лекции. Также я провожу онлайн-занятия и занятия в аудитории для студентов, чтобы дать им более качественные знания.
Моё видео:
youtube.com/embed/4sKc0lcxi7g» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>Вам нужно написать сообщение в Telegram . После этого я оценю Ваш заказ и укажу срок выполнения. Если условия Вас устроят, Вы оплатите, и преподаватель, который ответственен за заказ, начнёт выполнение и в согласованный срок или, возможно, раньше срока Вы получите файл заказа в личные сообщения.
Сколько может стоить заказ?Стоимость заказа зависит от задания и требований Вашего учебного заведения. На цену влияют: сложность, количество заданий и срок выполнения. Поэтому для оценки стоимости заказа максимально качественно сфотографируйте или пришлите файл задания, при необходимости загружайте поясняющие фотографии лекций, файлы методичек, указывайте свой вариант.
Какой срок выполнения заказа?Минимальный срок выполнения заказа составляет 2-4 дня, но помните, срочные задания оцениваются дороже.
Сначала пришлите задание, я оценю, после вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Какие гарантии и вы исправляете ошибки?В течение 1 года с момента получения Вами заказа действует гарантия. В течении 1 года я и моя команда исправим любые ошибки в заказе.
Качественно сфотографируйте задание, или если у вас файлы, то прикрепите методички, лекции, примеры решения, и в сообщении напишите дополнительные пояснения, для того, чтобы я сразу поняла, что требуется и не уточняла у вас. Присланное качественное задание моментально изучается и оценивается.
Теперь напишите мне в Telegram или почту и прикрепите задания, методички и лекции с примерами решения, и укажите сроки выполнения. Я и моя команда изучим внимательно задание и сообщим цену.
Если цена Вас устроит, то я вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.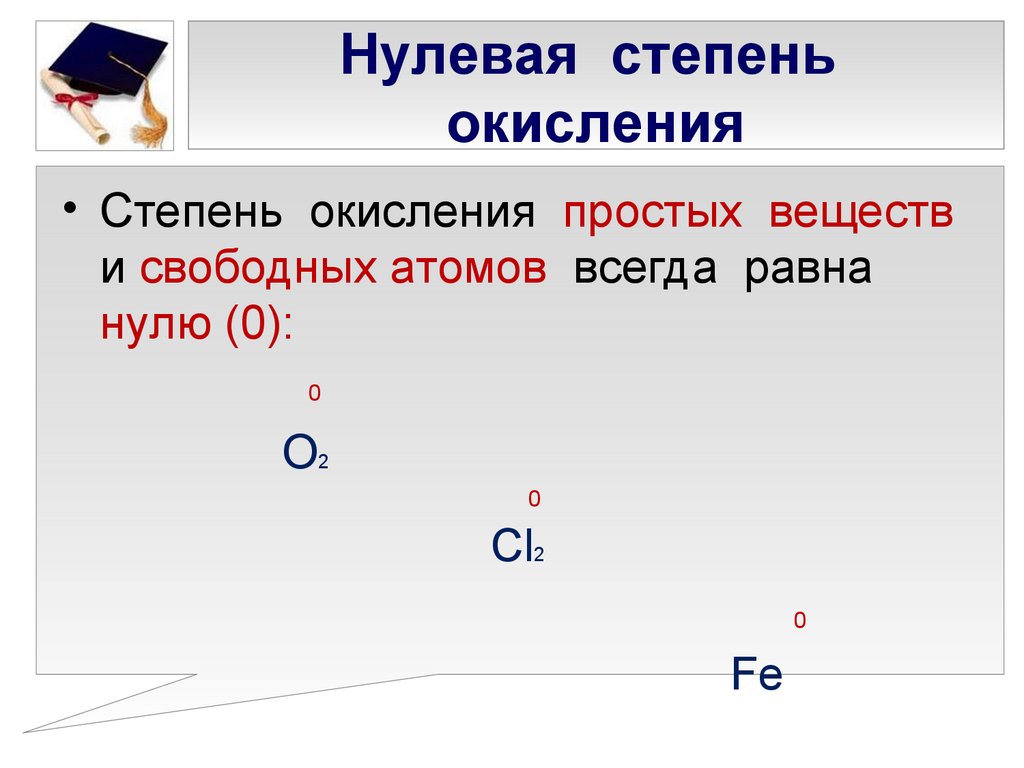
Мы приступим к выполнению, соблюдая указанные сроки и требования. 80% заказов сдаются раньше срока.
После выполнения отправлю Вам заказ в чат, если у Вас будут вопросы по заказу – подробно объясню. Гарантия 1 год. В течении 1 года я и моя команда исправим любые ошибки в заказе.
youtube.com/embed/g4ioDc7sLwU» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
youtube.com/embed/zW5JhiZ4140″ frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
Можете смело обращаться к нам, мы вас не подведем. Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
В заключение хочу сказать: если Вы выберете меня для помощи на учебно-образовательном пути, у вас останутся только приятные впечатления от работы и от полученного результата!
Жду ваших заказов!
С уважением
Пользовательское соглашение
Политика конфиденциальности
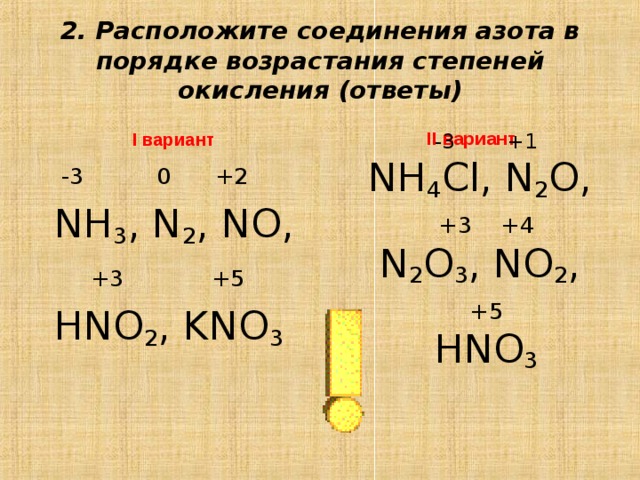
Степень окисления n в nh5cl. Задания ЕГЭ химия: Электроотрицательность
Электроотрицательность. Степень окисления и валентность химических элементов.
Реакции окислительно-восстановительные.
1) Установите соответствие между схемой изменения степени окисления элемента и уравнением реакции, в которой это изменение происходит.
3) Установите соответствие между уравнением окислительно-восстановительной реакции и свойством азота, которое он проявляет в этой реакции.
4) Установите соответствие между формулой вещества и степенью окисления хлора в нем.
6) Установите соответствие между свойствами азота и уравнением окислительно-восстановительной реакции, в которой он проявляет в эти свойства.
7) Установите соответствие между формулой вещества и степенью окисления азота в нем.
| ФОРМУЛА ВЕЩЕСТВА А) NaNO 2 | СТЕПЕНЬ ОКИСЛЕНИЯ АЗОТА 1) +5 2) +3 3) –3, +5 4) 0, +2 5) –3, +3 6) +4, +2 |
8) Установите соответствие между схемой реакции и изменением степени окисления окислителя в ней.
10. Установите соответствие между формулой соли и степенью окисления хрома в ней.
12. Установите соответствие между схемой реакции и формулой восстановителя в ней
14. Установите соответствие между формулой вещества и степенью окисления азота в нем.
16. Установите соответствие между формулой соли и степенью окисления хрома в ней.
18. Установите соответствие между схемой реакции и формулой восстановителя в ней
19. Установите соответствие между схемой реакции и изменением степени окисления восстановителя.
Установите соответствие между схемой реакции и изменением степени окисления восстановителя.
| СХЕМА РЕАКЦИИ А) Cl 2 + P → PCl 5 Б) HCl+ KMnO 4 → Cl 2 + MnCl 2 + KCl + H 2 O В) HClO + H 2 O 2 → O 2 + H 2 O + HCl Г) Cl 2 + KOH → KCl + KClO 3 + H 2 O | ИЗМЕНЕНИЕ СО ВОССТАНОВИТЕЛЯ | |
| 1) Cl 0 → Cl -1 2) Cl -1 →Cl 0 3) Cl 0 → Cl +1 | 5) Cl 0 → Cl +5 6) Mn +7 → Mn +2 | |
20. Установите соответствие между схемой реакции и изменением степени окисления окислителя.
| СХЕМА РЕАКЦИИ А) Na 2 SO 3 + I 2 +NaOH → Na 2 SO 4 + NaI + H 2 O Б) I 2 + H 2 S → S + HI В) SO 2 + NaIO 3 + H 2 O → H 2 SO 4 + NaI Г) H 2 S + SO 2 → S + H 2 O | ИЗМЕНЕНИЕ СО ОКИСЛИТЕЛЯ | |
| 1) S -2 → S 0 3) S +4 → S +6 | 5) I +5 → I -1 | |
21. Установите соответствие между схемой реакции и изменением степени окисления восстановителя.
Установите соответствие между схемой реакции и изменением степени окисления восстановителя.
23. Установите соответствие между формулой вещества и степенью окисления хрома в нем.
25. Установите соответствие между схемой реакции и изменением степени окисления восстановителя.
27. Установите соответствие между схемой реакции и изменением степени окисления окислителя.
ОПРЕДЕЛЕНИЕ
Хлорид аммония (нашатырь) в обычных условиях представляет собой белые кристаллы (рис. 1).
Летуч, термически мало устойчив (температура плавления — 400 o С при давлении). Брутто-формула — NH 4 Cl. Молярная масса хлорида аммония равна 53,49 г/моль.
Рис. 1. Хлорид аммония. Внешний вид.
Хорошо растворяется в воде (гидролизуется по катиону). Кристаллогидратов не образует. Разлагается концентрированной серной кислотой и щелочами.
Nh5Cl, степени окисления элементов в нем
Чтобы определить степени окисления элементов, входящих в состав хлорида аммония, сначала необходимо разобраться с тем, для каких элементов эта величина точно известна.
Степень окисления кислотного остатка определяется числом атомов водорода, входящих в состав образующей его кислоты, указанных со знаком минус. Хлорид-ион — это кислотный остаток хлороводородной (соляной) кислоты, формула которой HCl. В её составе имеется один атом водорода, следовательно, степень окисления хлора в хлорид ионе равна (-1).
Ион-аммония является производным аммиака (NH 3), представляющим собой гидрид. А, как известно, степень окисления водорода в гидридах всегда равна (+1). Для нахождения степени окисления азота примем её значение за «х» и определим его при помощи уравнения электронейтральности:
x + 4× (+1) + (-1) = 0;
x + 4 — 1 = 0;
Значит степень окисления азота в хлориде аммония равна (-3):
N -3 H +1 4 Cl -1 .
Примеры решения задач
ПРИМЕР 1
| Задание | Определите степени окисления азота в следующих соединениях: а) NH 3 ; б) Li 3 N; в) NO 2 . |
| Ответ | а) Аммиак представляет собой гидрид азота, а, как известно, в данных соединениях водород проявляет степень окисления (+1). Для нахождения степени окисления азота примем её значение за «х» и определим его при помощи уравнения электронейтральности: Для нахождения степени окисления азота примем её значение за «х» и определим его при помощи уравнения электронейтральности:x + 3× (+1) = 0; Степень окисления азота в аммиаке равна (-3): N -3 H 3 . б) Литий проявляет постоянную степень окисления, совпадающую с номером группы в Периодической системе Д.И. Менделеева, в которой он расположен, т.е. равна (+1) (литий — металл). Для нахождения степени окисления азота примем её значение за «х» и определим его при помощи уравнения электронейтральности: 3× (+1) + х = 0; Степень окисления азота в нитриде лития равна (-3): Li 3 N -3 . в)Степень окисления кислорода в составе оксидов всегда равна (-2). Для нахождения степени окисления азота примем её значение за «х» и определим его при помощи уравнения электронейтральности: x + 2×(-2) = 0; Степень окисления азота в диоксиде азота равна (+4): N +4 O 2 . |
ПРИМЕР 2
| Задание | Определите степени окисления азота в следующих соединениях: а) N 2 ; б) HNO 3 ; в) Ba(NO 2) 2 . |
| Ответ | а)В соединениях с неполярными связями степень окисления элементов равна нулю. Это означает, что степень окисления азота в его двухатомной молекуле равна нулю: N 0 2 . б) Степени окисления водорода и кислорода в составе неорганических кислот всегда равны (+1) и (-2) соответственно. Для нахождения степени окисления азота примем её значение за «х» и определим его при помощи уравнения электронейтральности: (+1) + х + 3×(-2) = 0; 1 + х — 6 = 0; Степень окисления азота в азотной кислоте равна (+5): HN +5 O 3 . в)Барий проявляет постоянную степень окисления, совпадающую с номером группы в Периодической системе Д.И. Менделеева, в которой он расположен, т.е. равна (+2) (барий — металл). Степень окисления кислорода в составе неорганических кислот и их остатков всегда равна (-2). Для нахождения степени окисления азота примем её значение за «х» и определим его при помощи уравнения электронейтральности: (+2) + 2×х + 4×(-2) = 0; 2 + 2х — 8 = 0; Степень окисления азота в нитрите бария равна (+3):Ba(N +3 O 2) 2 . |
Обязательный минимум знаний
Степень окисления
Закономерности изменения электроотрицательности в периодах и группах Периодической системы рассматривались в § 36.
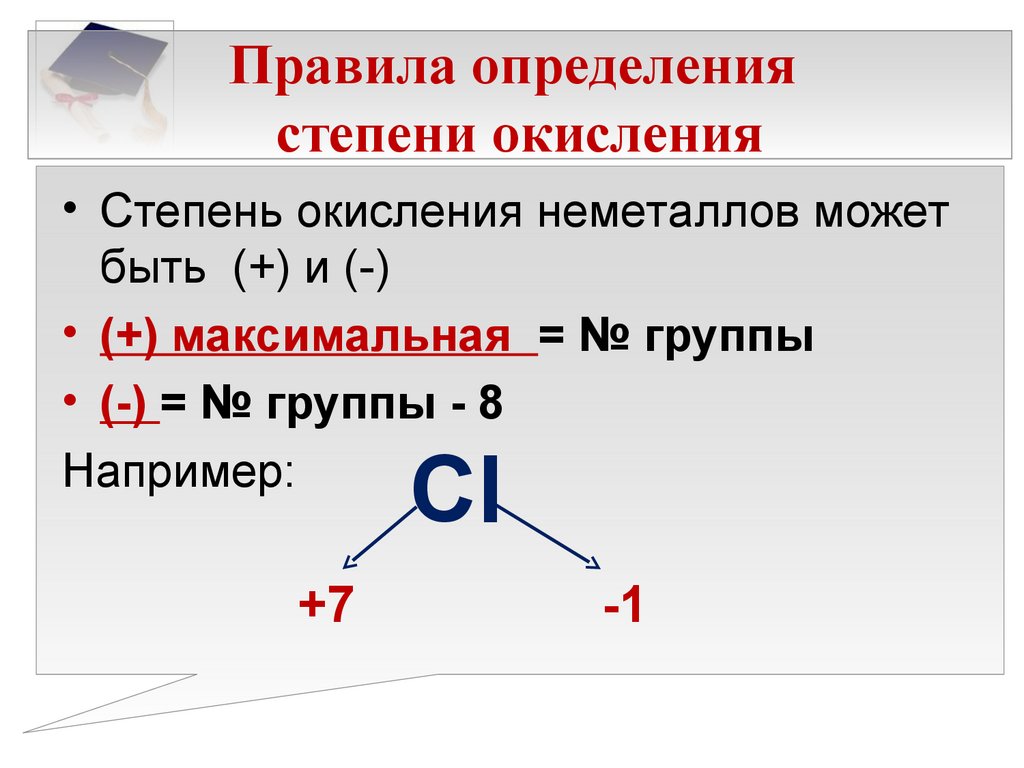
Правила для расчёта степени окисления (с. о.) химических элементов:
- Наименее электроотрицательным является химический элемент
- железо
- магний
- кальций
Следует обратить внимание на словосочетание «наименее электроотрицательный», т. е. элемент с наибольшими металлическими свойствами. Этот аргумент позволит исключить из возможных ответов азот, как неметалл, и остановиться на кальции, как наиболее активном из предложенных в задании металлов. Ответ: 4.
- Наиболее полярна химическая связь в одной из молекул
- ССl 4
- СВr 4
Знание закономерностей изменения электроотрицательности в периодах и группах Периодической системы Д. И. Менделеева позволяет исключить из списка четырёхвалентных соединений углерода метан СН 4 , а из оставшихся галогенидов остановиться на CF 4 , как на соединении углерода с наиболее электроотрицательным из всех химических элементов — фтором.
 Ответ: 2.
Ответ: 2. - В молекулах хлороводорода и хлора химическая связь соответственно
- ионная и ковалентная полярная
- ионная и ковалентная неполярная
- ковалентная полярная и ковалентная неполярная
- водородная и ковалентная неполярная
Ключевым словом для быстрого и верного выполнения этого задания является слово «соответственно». В предложенных вариантах только один из ответов начинается со слов «ковалентная полярная», т. е. связи, характерной для хлороводорода. Ответ: 3.
- Степень окисления марганца в соединении, формула которого К 2 МnO 4 , равна
Знание правил расчёта степеней окисления элементов по формуле позволит выбрать верный ответ. Ответ: 3.
- Наименьшую степень окисления имеет сера в соли
- сульфат калия
- сульфит калия
- сульфид калия
- гидросульфат калия
Очевидно, быстрому выполнению этого задания будет способствовать перевод названий солей в формулы. Так как сера — элемент VIA группы, то её наименьшая степень окисления равна -2.
 Этому значению соответствует соединение с формулой K 2 S — сульфид калия. Ответ: 3.
Этому значению соответствует соединение с формулой K 2 S — сульфид калия. Ответ: 3. - Степень окисления +5 атом хлора имеет в ионе
- С1O — 4
- С1O —
- С1O — 3
- С1O — 2
При выполнении этого задания следует обратить внимание на то, что в условии даны не электронейтральные соединения, а ионы хлора с единичным отрицательным зарядом («-»). Поскольку сумма степеней окисления атомов в ионе равна заряду иона, суммарный отрицательный заряд атомов кислорода в искомом ионе должен иметь значение -6 (+5 — 6 = -1). Ответ: 3.
- Степень окисления -3 азот имеет в каждом из двух соединений
- NF 3 И NH 3
- NH 4 Cl и N 2 O 3
- NH 4 Cl и NH 3
- HNO 2 и NF 3
Для определения верного ответа необходимо мысленно разделить варианты ответов на левый и правый подстолбики. Затем выбрать тот, в котором соединения имеют более простой состав, — в нашем случае это правый подстолбик бинарных соединений. Анализ позволит исключить ответы 2 и 4, так как в оксиде и фториде у азота положительная степень окисления, как у менее электроотрицательного элемента.
 Этот аргумент позволяет исключить и ответ 1, так как в нём первое вещество — всё тот же фторид азота. Ответ: 3.
Этот аргумент позволяет исключить и ответ 1, так как в нём первое вещество — всё тот же фторид азота. Ответ: 3. - К веществам молекулярного строения не относятся
- углекислый газ
- метан
- хлороводород
- карбонат кальция
Следует обратить внимание на отрицательное суждение, заложенное в условии задания. Так как газообразные при обычных условиях вещества имеют в твёрдом состоянии молекулярную кристаллическую решётку, то условию задания не отвечают варианты 1-3. Отнесение карбоната кальция к солям ещё раз подтвердит верный ответ. Ответ: 4.
- Верны ли следующие суждения о свойствах веществ и их строении?
А. Мокрое бельё высыхает на морозе потому, что вещества молекулярного строения способны к сублимации (возгонке).
Б. Мокрое бельё высыхает на морозе потому, что молекулы воды имеют низкую молекулярную массу.
- верно только А
- верно только Б
- верны оба суждения
- оба суждения не верны
Знание физических свойств веществ молекулярного строения позволяет решить, что причиной высыхания мокрого белья на морозе является способность льда к сублимации, а не дипольное строение молекул воды.
 Ответ: 1.
Ответ: 1. - Молекулярное строение имеет каждое из веществ, формулы которых приведены в ряду
- СO 2 , HNO 3 , СаО
- Na 2 S, Br 2 , NO 2
- H 2 SO 4 , Сu, O 3
- SO 2 , I 2 , НСl
Так как предложенные варианты содержат по три вещества, логично мысленно разделить эти варианты на три вертикальных подстолбика. Анализ каждого из них, начиная с веществ более простого состава (средний подстолбик), позволит исключить ответ 3, так как в нём содержится металл медь, имеющий металлическую кристаллическую решётку. Аналогичный анализ правого подстолбика позволит исключить ответ 1, так как он содержит оксид щёлочноземельного металла (ионная решётка). Из двух оставшихся вариантов необходимо исключить вариант 2, так как он содержит соль щелочного металла — сульфид натрия (ионная решётка). Ответ: 4.
Задания для самостоятельной работы
- Степень окисления +5 азот проявляет в соединении, формула которого
- N 2 O 5
- N 2 O 4
- N 2 O
- Степень окисления хрома в соединении, формула которого (NH 4) 2 Cr 2 O 7 , равна
- Степень окисления азота уменьшается в ряду веществ, формулы которых
- NH 3 , NO 2 , KNO 3
- N 2 O 4 , KNO 2 , NH 4 Cl
- N 2 , N 2 O,NH 3
- HNO 3 , HNO 2 , NO 2
- Степень окисления хлора увеличивается в ряду веществ, формулы которых
- НСlO, НСlO 4 , КСlO 3
- Сl 2 , С1 2 O 7 , КСlO 3
- Са(С1O) 2 , КСlO 3 , НСlO 4
- КСl, КСlO 3 , КСlO
- Наиболее полярна химическая связь в молекуле
- аммиака
- сероводорода
- бромоводорода
- фтороводорода
- Вещество с ковалентной неполярной связью
- белый фосфор
- фосфид алюминия
- хлорид фосфора (V)
- фосфат кальция
- Формулы веществ только с ионной связью записаны в ряду
- хлорид натрия, хлорид фосфора (V), фосфат натрия
- оксид натрия, гидроксид натрия, пероксид натрия
- сероуглерод, карбид кальция, оксид кальция
- фторид кальция, оксид кальция, хлорид кальция
- Атомную кристаллическую решётку имеет
- оксид натрия
- оксид кальция
- оксид серы (IV)
- оксид алюминия
- Соединение с ионной кристаллической решёткой образуется при взаимодействии хлора с
- фосфором
- барием
- водородом
- серой
- Верны ли следующие суждения о хлориде аммония?
А.
 Хлорид аммония — вещество ионного строения, образованное за счёт ковалентной полярной и ионной связей.
Хлорид аммония — вещество ионного строения, образованное за счёт ковалентной полярной и ионной связей.Б. Хлорид аммония — вещество ионного строения, а потому твёрдое, тугоплавкое и нелетучее.
- верно только А
- верно только Б
- верны оба суждения
- оба суждения неверны
Поделиться с друзьями:
Интерактивный тест по химии Степень окисления. (9 -11 класс) доклад, проект
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация на тему Интерактивный тест по химии Степень окисления. (9 -11 класс), предмет презентации: Химия. Этот материал в формате pptx (PowerPoint) содержит 23 слайдов, для просмотра воспользуйтесь проигрывателем. Презентацию на заданную тему можно скачать внизу страницы, поделившись ссылкой в социальных сетях! Презентации взяты из открытого доступа или загружены их авторами, администрация сайта не отвечает за достоверность информации в них, все права принадлежат авторам презентаций и могут быть удалены по их требованию.
(9 -11 класс), предмет презентации: Химия. Этот материал в формате pptx (PowerPoint) содержит 23 слайдов, для просмотра воспользуйтесь проигрывателем. Презентацию на заданную тему можно скачать внизу страницы, поделившись ссылкой в социальных сетях! Презентации взяты из открытого доступа или загружены их авторами, администрация сайта не отвечает за достоверность информации в них, все права принадлежат авторам презентаций и могут быть удалены по их требованию.
Степень окисления.
Тест по химии
Готовимся к ЕГЭ.
Аннотация
Ресурс по химии адресован учащихся 9,11-классов для организации самостоятельной работы в период подготовки к итоговой аттестации, а также для текущей проверки знаний учащихся в форме тестирования.
Ресурс содержит 20 вопросов на выбор одного правильного ответа из нескольких по теме: «Степень окисления». Если дан правильный ответ, то кнопка выбора ответа окрашивается в зелёный цвет. Если ответ неправильный, то кнопка выбора ответа окрашивается в красный цвет. При каждом ответе появляется соответствующая анимация.
Если ответ неправильный, то кнопка выбора ответа окрашивается в красный цвет. При каждом ответе появляется соответствующая анимация.
Cl2 O7, HClO4, KClO4
Cl2, PCl5, HCl
HCl, NaCl, Cl2
HCl, HClO, HClO4
В каком ряду степень окисления хлора не изменяется?
Вопрос 1.
HNO3, NaNO3, NaNO2
Nh4, NO, NO2
NO2, HNO2, HNO3
Mg3N2, Nh4, Nh5Cl
В каком ряду степень окисления азота не изменяется?
Вопрос 2.
Ca3(PO4)2, P, P2O5
HPO3, h4PO4, Na3PO4
P, PCl3, h4PO3
Ph4, h4PO3, h4PO4
В каком ряду степень окисления фосфора не изменяется?
Вопрос 3.
Cl2, KClO3, KClO4
Cl2, PCl5, HCl
Cl2O7, HClO, HClO4
HCl, KCl, AgCl
В каком ряду степень окисления хлора увеличивается?
Вопрос 4.
h3S, Na2S, S
SO2, SO3, h3SO4
h3SO4, SO2, S
h3S, h3SO3, h3SO4
В каком ряду степень окисления серы уменьшается?
Вопрос 5.
Nh4, N2, Mg3N2
HNO3, NO2, NO
Nh4, NO, NO2
NO2, HNO2, HNO3
В каком ряду степень окисления азота уменьшается?
Вопрос 6.
Ca3(PO4)2, P, P2O5
P2O5,h4PO4,Ca3(PO4)2
PCl5, PCl3, h4PO3
Рh4, h4PO3, h4PO4
В каком ряду степень окисления фосфора увеличивается?
Вопрос 7.
PCl3, PCl5
Ca3(PO4)2, P4O10
Ca3P2, Ca3(PO4)2
Р4O6, Ph4
Одну и ту же степень окисления фосфор имеет в каждом из двух соединений?
Вопрос 8.
Na2S
SO3
h3SO4
CaSO3
В каком соединении атом серы имеет минимальную возможную степень окисления?
Вопрос 9.
Mn2(SO4)3
MnS
MnO2
KMnO4
В каком соединении атом марганца имеет максимальную возможную степень окисления?
Вопрос 10.
Cu(NO3)2
NO
N2O
Li3N
В каком соединении атом азота имеет минимальную возможную степень окисления?
Вопрос 11.
KClO4
KClO3
AlCl3
Cl2O
В каком соединении атом хлора имеет минимальную возможную степень окисления?
Вопрос 12.
Nh4
LiH
HCl
h3
В каком соединении атом водорода имеет отрицательную степень окисления?
Вопрос 13.
CF4
CO2
Ch5
C60
В каком веществе элемент углерод имеет отрицательную степень окисления?
Вопрос 14.
железо
натрий
хлор
фтор
Какой элемент может проявлять в соединениях как положительную, так и отрицательную степень окисления?
Вопрос 15.
магний
азот
кислород
фтор
Какой элемент может проявлять в соединениях только положительную степень окисления?
Вопрос 16.
Fe2(SO4)3 K2SO4 CaSO4
h3S Na2S MnS
Na2SO3 BaSO3 SO2
h3S SO2 SO3
Укажите схему превращений, в которой степень окисления серы изменяется:
Вопрос 17.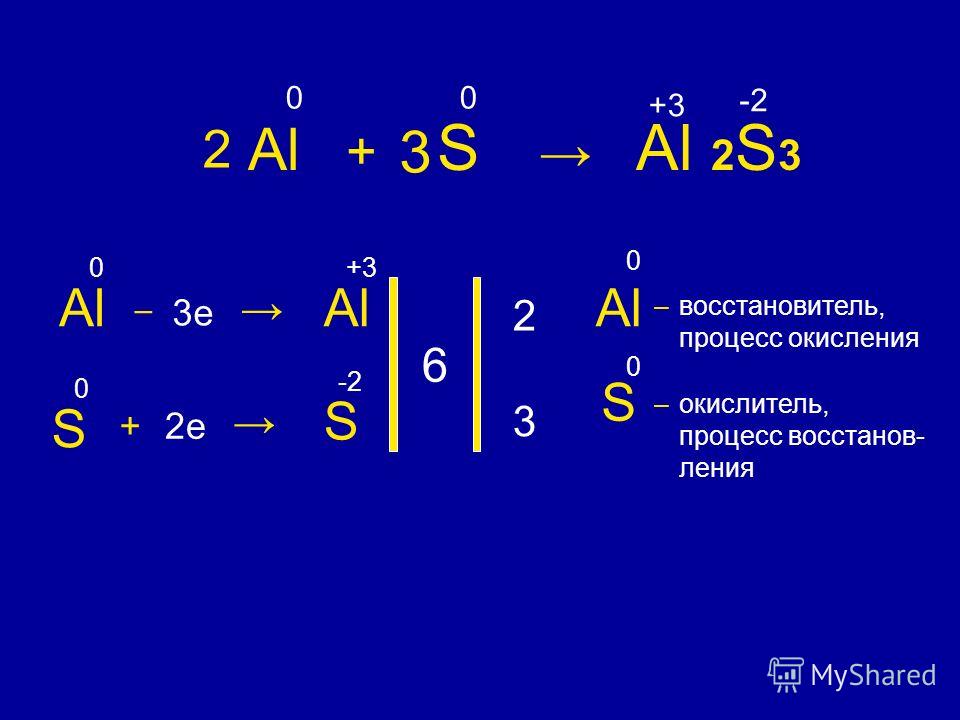
Li3N Nh4 NO
N2O5 HNO3 Ba(NO3)2
HNO3 Ba(NO3)2 NO2
Nh4 NO NO2
Укажите схему превращений, в которой степень окисления азота не изменяется:
Вопрос 18.
+4, 0
+5, 0
+4, -3
+5, -3
Определите высшую и низшую степень окисления азота в соединениях.
Вопрос 19.
+6, 0
0, -2
+6, -2
+2, -2
Определите высшую и низшую степень окисления кислорода в соединениях.
Вопрос 20.
Список использованных ресурсов:
А.А. Дроздов, В.В. Еремин «Пособие для подготовки к ЕГЭ по химии». — М. : БИНОМ. Лаборатория знаний, 2010.
http://smayli. ru/data/smiles/emocii-2154.gif
ru/data/smiles/emocii-2154.gif
http://smayli.ru/data/smiles/emocii-2198.gif
http://smayli.ru/data/smiles/emocii-2035.gif
http://www.smayli.ru/data/smiles/emocii-1634.gif
Скачать презентацию
Это сайт презентаций, где можно хранить и обмениваться своими презентациями, докладами, проектами, шаблонами в формате PowerPoint с другими пользователями. Мы помогаем школьникам, студентам, учителям, преподавателям хранить и обмениваться учебными материалами.
Для правообладателей
Обратная связь
Email: Нажмите что бы посмотреть
Дидактический материал Тренировочные тесты ЕГЭ по химии Электроотрицательность. Степень окисления и валентность химических элементов. 1. Электроотрицательность атома – это 1) отрицательный заряд атома в молекуле 2) способность атома переходить в возбужденное состояние 3) способность атома, участвующего в химической связи, смещать к себе электронную пару, участвующую в образовании химической связи 4) потенциал ионизации атома
2. 1) O, H, Br, Te 2) C, I, B, P 3) Sn, Se, Br, F 4) H, Br, C, B
3. Степень окисления атома – это 1) условный заряд, вычисленный из предположения, что все полярные ковалентные связи являются ионными 2) число отданных в ходе химической реакции электронов 3) отрицательный заряд, сосредоточенный на какой-либо части молекулы 4) заряд иона в нерастворимом веществе
4. Степень окисления элемента в простом веществе равна 1) нулю 2) числу электронов во внешнем электронном слое 3) числу неспаренных электронов 4) номеру группы 5. Высшую степень окисления марганец проявляет в соединении 1) КМnО4 2) МnО2 3) К2MnО4 4) MnSO4
6. Наибольшую степень окисления марганец проявляет в соединении 7. 1) MnSO4 2) МnО2 3) К2МnО4 4) Мn2Оз
8. Степень окисления — 3 фосфор проявляет в соединении 1) РН3 2) Р2Оз 3) NaH2PO4 4) Н3РО4
9. Наименьшую степень окисления сера проявляет в соединении 1) Na2S 2) Na2SO3 3) Na2SO4 4) SO3
10. Степень окисления — 3 фосфор проявляет в соединении 1) РН3 2) Р2Оз 3) NaH2PO4 4) НзРО4
11. Наибольшую степень окисления сера проявляет в соединении I ) Na2S 2) Na2SO3 3) Na2SO4 4) SO2
12. 1) N2O5, HNO3, NaNO3 2) NО2, HNO3, KNO3 3) NO, NO2, N2O3 4) HNO3,HNO2,NO2 13. В порядке увеличения электроотрицательности элементы расположены в ряду: 1) O-N-C-B 2) Si-Ge-Sn-Pb 3) Li-Na-K-Rb 4) Sb-P-S-Cl
14. Степень окисления азота увеличивается в ряду веществ: 1) NH3,NO,HNO3 2) NO,NO2,NH3 3) NH3,HNO3,NO2 4) KNO3, KNO2, NO2
15. Электроотрицательность химических элементов увеличивается в ряду: 1) Be,Mg,Ca 2) F,Cl,Br 3) P,S,C1 4) Cl.S.P
16. В порядке возрастания относительной электроотрицательности элементы расположены в ряду: 1) Na, Mg,Al 2) N,P,As 3) O,N,C 4) Cl, Br, I
17.
18. Степень окисления хлора в Са(С1О)2 равна 1)+1 2) +3 3) +5 4) +7
19. Степень окисления хлора в Ва(СlOз)2 равна 1) + 1 2) + 3 3) +5 4) + 7
20. Минимальную степень окисления хлор проявляет в соединении 1) NH4Cl 2) Сl2 3) Ca(OCl)2 4} NaCIO
21. Степень окисления + 3 азот проявляет в каждом из двух соединений: 1) HNO2 и NH3 2) NH4C1 и N203 3) NaNO2 и NF3 4) HNO3 и N2
22. В каком соединении степень окисления серы равна +4? 1) H2SO4 2) FeS 3) H2SO3 4) SO3
23. 1) кремний 2) свинец 3) олово 4) углерод
24. Азот проявляет степень окисления +3 в каждом соединении, указанном в ряду: 1) N203, HNO2, NH3 2) NH4C1, N20, NF3 3) HNO2,N2H4,N2 4) NaNO2, NF3, N2O3
25. Наиболее электроотрицательным элементом является I) кремний 2) азот 3) фосфор 4) селен
26. В порядке возрастания электроотрицательности элементы расположены в ряду 1) H-Se-S-O-F 2) F-O-C1-S-H 3) H-CI-S-O-F 4) H-S-C1-F-O
27. Хлор проявляет положительную степень окисления в соединении с 1) серой 2) водородом 3) кислородом 4) железом
28. Степень окисления + 3 азот проявляет в соединении 1) NН4С1 2) NaNO3 3) N2O4 4) KNO2
29. 1) СrО 2) Сr2О3 3) СrО3 4) Н2СrО4
30. Степень окисления азота в сульфате аммония равна 1) — 3 2) — 1 3) + 1 4) + 3
Ответы: 1-3, 2-3, 3-1, 4-1, 5-1, 6-3, 7-3, 8-1, 9-1, 10-1, 11-3, 12-1, 13-4, 14-1, 15-3, 16-1, 17-4, 18-1, 19-3, 20-1, 21-3, 22-3, 23-4, 24-4, 25-2, 26-1, 27-3, 28-4, 29-2, 30-1 |
Контрольная работа по теме «Многообразие химических реакций»
Контрольная работа № 1.
по теме «Многообразие химических реакций».
Вариант 1
Часть 1
I. Тест.
1. К электролитам относится:
а) АgCl б) BaCl2 в) BaО г) О2
2. В каком из соединений степень окисления азота +3
а) NaNO2 б) NaNO3 в) N2О г) N2О5
3. При диссоциации Na2SO4 образуются ионы:
При диссоциации Na2SO4 образуются ионы:
а) Na+ и SO42- б) 2Na+ и SO42- в) 2Na+ и 4SO2- г) Na+ и 4SO-
4. Скорость реакции, уравнение которой N2+3H2=2NH3, увеличится при
а) увеличении концентрации аммиака
б) понижение температуры
в) уменьшении концентрации аммиака
г) увеличении концентрации водорода
5. Равновесие реакции сместится в сторону прямой реакции СО(г)+Н2О(г) ↔ CO2(г)+Н2(г)+Q
а) при повышении температуры
б) при понижении температуры
в) при увеличении концентрации СО2
г) при увеличении давления.
6. Выберите все верные высказывания относительно реакции
CaCO3 (тв ) ↔ CaO(тв ) + CO2 (г ) -157 кДж
а) реакция разложения б) реакция соединения в) эндотермическая
г) экзотермическая д) окислительно-восстановительная ж) обратимая
7. Признаками реакции между сульфатом натрия и хлоридом бария является:
Признаками реакции между сульфатом натрия и хлоридом бария является:
а) выделение газа; б) образование белого осадка; в) образование желтого осадка;
в) воды
8.Составьте уравнения разложения на ионы для данных веществ. Для многоосновной кислоты составьте уравнение полной и ступенчатой диссоциации:
а) HNO3→_______________________ г) h3SO4→____________________(полная)
б)K3PO4→_______________________ ____________________________(1 ступень)
в) Ba(OH)2→_____________________ ___________________________(2 ступень)
9.Допишите число электронов, принимающих участие в данных процессах. Укажите, какие из процессов являются окислением, а какие восстановлением.
Схема | Процесс (окисление или восстановление) |
h30______________→2H+ | |
Mn+7____________→Mn+2 | |
N-3______________→N+5 | |
Ca+2____________→Ca0 |
Часть 2.
10.Установите соответствие между схемой окислительно-восстановительной реакции и веществом-окислителем в ней.
11. Закончите уравнения реакций. Составьте для них полные и сокращенные ионные уравнения:
а) HNO3+Ba(OH)2→ б) NaOH+FeCl3→ в) Na2CO3+HCl→
Часть 3
12.Используя метод электронного баланса, составьте уравнение реакции::
P+HNO3+h3O→h4PO4+NO
Определите окислитель и восстановитель.
13. Составить уравнение в молекулярной форме, которое бы соответствовало следующему уравнению в ионной форме:
H++OH-→h3O
14. В результате реакции, термохимическое уравнение которой
выделилось 968 кДж теплоты. Вычислите массу образовавшейся при этом воды. Ответ укажите в граммах с точностью до целых.
Контрольная работа № 1.
по теме «Многообразие химических реакций».
Вариант 2
I. Тест
1. К неэлектролитам относится
а) h3O б) HNO3 в) AgNO3 г) CaCl2
2. В каком из соединений степень окисления хлора +5
а) HCl б) HClO4 в) Cl2O7 г) NaClO3
3. При диссоциации К2SO4 образуются ионы:
а) К+ и SO42- б) 2К+ и SO42- в) 2К+ и 4SO2- г) К+ и 4SO-
4. Скорость реакции, уравнение которой Zn+H2SO4=H2+ZnSO4 понизится при:
а) увеличении концентрации серной кислоты
б) нагревании
в) увеличении концентрации водорода
г) уменьшении концентрации сульфата цинка
5. Равновесие реакции сместится в сторону обратной реакции 2Н2(г)+О2(г)↔2Н2О(г)+Q
а) при понижении температуры
б) при повышении температуры
в) при уменьшении давления
г) при увеличении концентрации Н2
6. Выберите все верные высказывания относительно реакции
Выберите все верные высказывания относительно реакции
S(тв ) + O2 (г ) ↔ SO2(г) + 297 кДж
а) реакция разложения б) реакция замещения в) эндотермическая
г) экзотермическая д) окислительно-восстановительная ж) обратимая
7. Признаками реакции между хлоридом натрия и нитратом серебра является:
а) выделение газа; б) образование белого осадка; в) образование желтого осадка;
в) воды
8.Составьте уравнения разложения на ионы для данных веществ. Для многоосновной кислоты составьте уравнение полной и ступенчатой диссоциации:
а) KNO3→_______________________ г) h3CO3→______________(полная)
б)Al2(SO4)3→____________________ _____________________________(1 ступень)
в) Ca(OH)2→_____________________ ___________________________(2 ступень)
9.Допишите число электронов, принимающих участие в данных процессах. Укажите, какие из процессов являются окислением, а какие восстановлением.
Схема | Процесс(окисление или восстановление) |
S+6_____________→S-2 | |
O20____________→2O-2 | |
N-3_____________→N+2 | |
Pb0____________→Pb+2 |
Часть 2.
10.Установите соответствие между схемой окислительно-восстановительной реакции и веществом-восстановителем в ней.
11.Закончите уравнения реакций. Составьте для них полные и сокращенные ионные уравнения:
а) K2CO3+BaCl2 → б) KOH+ Mg(NO3)2→ в) BaCO3+HCl→
Часть 3.
12. Используя метод электронного баланса, составьте уравнение реакции::
KNO2+KJ +h3SO4→J2+NO+K2SO4+h3O
Определите окислитель и восстановитель.
13. Составить уравнение в молекулярной форме, которое бы соответствовало следующему уравнению в ионной форме:
Са+2 +СО32- = СаСО3
14. В результате реакции, термохимическое уравнение которой
выделилось 1452 кДж теплоты. Вычислите массу образовавшейся при этом воды (в граммах). Запишите число с точностью до целых.
Правильные ответы:
1 | 2 | 3 | 4 | 5 | 6 | 7 | |
В-1 | б | а | б | в, г | б | а, в | б |
В-2 | а | г | б | в | б, в | г, д | б |
В-1
8. а) HNO3→H++NO3- г) h3SO4→2H+ + SO4 2-
а) HNO3→H++NO3- г) h3SO4→2H+ + SO4 2-
б)K3PO4→ 3K++PO43- h3SO4 →H+ + HSO4 – (1 ступень)
в) Ba(OH)2→Ba2++2OH- HSO4 – → H+ + SO4 2-_(2 ступень)
9..
Схема | Процесс (окисление или восстановление) |
h30-2ē→2H+ | окисление |
Mn+7+5ē_→Mn+2 | восстановление |
N-3-8ē→N+5 | окисление |
Ca+2+2ē→Ca0 | восстановление |
10. А)2; Б)1; В)5
12. 3P+5HNO3+2h3O=3h4PO4+5NO
14. Ответ:72г.
В-2
8. а) KNO3→ K+ + NO3- г) h3CO3→2H+ + CO3 2- (полная)
б)Al2(SO4)3→2Al3+ +3SO42- h3CO3 →H+ + HCO3 – _(1 ступень)
в) Ca(OH)2→ Ca2+ +2OH- HCO3 – → H+ + CO3 2-_( (2 ступень)
9.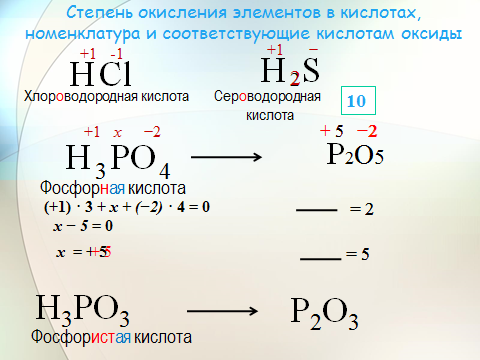
Схема | Процесс(окисление или восстановление) |
S+6+8ē→S-2 | восстановление |
O20+4ē→2O-2 | восстановление |
N-3-5ē→N+2 | окисление |
Pb0-2ē→Pb+2 | окисление |
10. А)2; Б)3; В)5
12. 2KNO2 +2 KI +2h3SO4=I2+2NO+2K2SO4+2h3O
14. Ответ:108г.
Критерии оценивания
Всего 30 баллов
За задания части 1
1-7 – 7 баллов (1 балл за каждое правильно выполненное задание )
8 – 4 балла ( 1 балла за каждое правильное написание диссоциацию веществ)
9— 4 балла ( 1 балл за каждое правильное написание схемы реакции и определение процесса)
За задания части 2
10 – 3 балла(за каждое правильное соответствие 1 б)
11.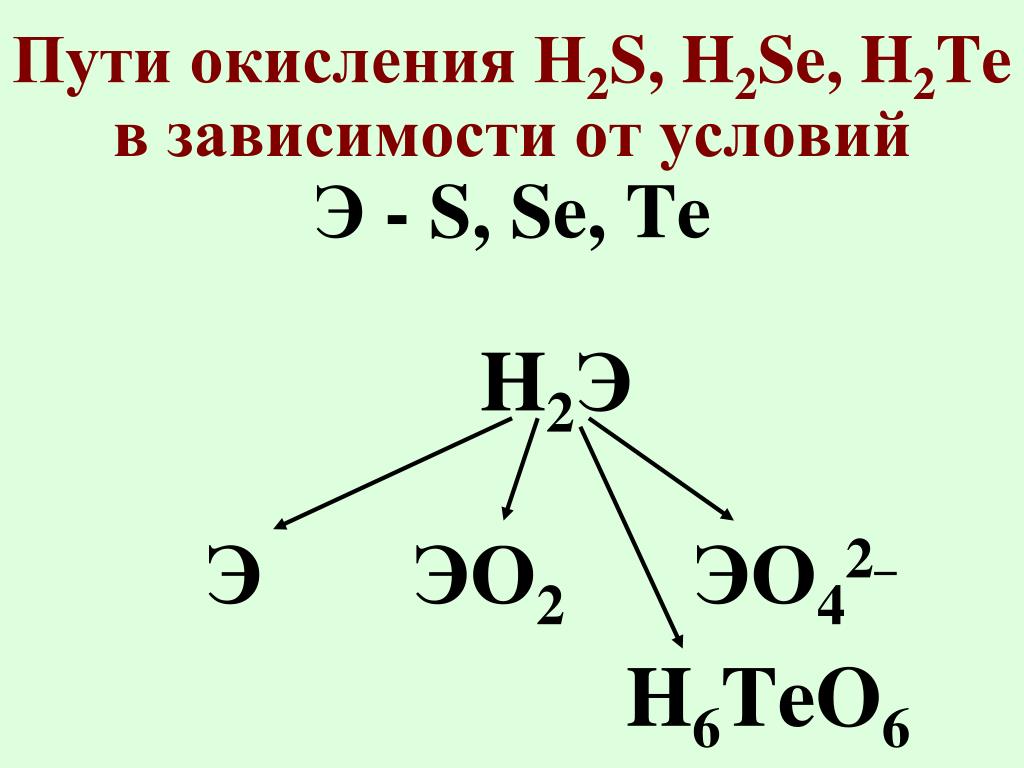 – 3 балла (за каждое правильно написанное уравнение 1 б )
– 3 балла (за каждое правильно написанное уравнение 1 б )
За задания части 3
12. – 3 балла (за правильное написание баланса, определение процесса окисления и восстановления, расставление коэффициентов)
13. – 3 балла (1 балл за правильное написанное уравнение, 2 балла за ионное уравнение)
14. – 3 балла – за правильное решение задачи
— отметка «5» выставляется обучающемуся, если 24-30 баллов;
— отметка «4» выставляется обучающемуся, если 18-23 баллов;
— отметка «3» выставляется обучающемуся, если 13-17 баллов;
— отметка «2» выставляется обучающемуся, если менее 13 баллов.
Получение и использование азотистой кислоты | Азотная(iii) кислота
Азотистая кислота может быть получена в лаборатории в несколько этапов. Азотистую кислоту нельзя хранить в бутылках как азотную кислоту, потому что азотистая кислота легко разлагается на азотную кислоту, оксид азота (NO) и воду. Твердый нитрат натрия и холодная разбавленная соляная кислота (HCl)
хочу приготовить азотную кислоту. Азотистая кислота — слабая одноосновная кислота.
Азотистая кислота — слабая одноосновная кислота.
В этом уроке мы узнаем, как приготовить азотистую кислоту и для чего она нужна.
Азотистая кислота | азотная(iii) кислота | HNO
2 этапы подготовкиВ качестве основного метода приготовления мы используем твердый NaNO 3 . В этом методе есть три этапа для получения HNO 2 . Обычно мы готовим азотистую кислоту, когда она нам нужна. В противном случае мы не храним его в лабораториях, потому что он легко разлагается.
Нагревание нитрата натрия как первая стадия получения азотистой кислоты
Твердый нитрат натрия (NaNO 3 ) нагревают до разложения до твердого нитрита натрия
(NaNO 2 ) и кислород (O 2 ) газ. Эта реакция является
окислительно-восстановительная реакция (окислительно-восстановительная реакция), так как при протекании реакции изменяются степени окисления атомов азота и кислорода.
Растворение нитрита натрия в воде для приготовления водного раствора нитрита натрия
Твердый нитрит натрия растворяют в воде для приготовления водного раствора нитрита натрия . На этом этапе реакции не происходит. Только происходит растворение.
Холодная разбавленная HCl и NaNO
2 реакцияДобавьте холодную разбавленную HCl в водный раствор нитрита натрия. Дает разбавленную азотистую кислоту и раствор NaCl.
Почему к водному раствору
NaNO 2 добавляют разбавленную HCl?ПРИМЕЧАНИЕ
Если разбавленной HCl добавить к твердого NaNO 2 , NO 2 образуется коричневый газ. Тогда нет возможности подготовиться. азотная кислота кроме того.
Почему
холодная разбавленная HCl добавляется к водному раствору NaNO 2 Азотистая кислота стабильна в холодном состоянии. При высокой температуре раствора образующаяся азотистая кислота разлагается на азотную кислоту (HNO 3 ), окись азота (NO) и воду. Поэтому мы должны использовать холодную HCl при получении азотистой кислоты.
Поэтому мы должны использовать холодную HCl при получении азотистой кислоты.
Реакция трехокиси азота и воды | N
2 O 3 + H 2 OТриоксид азота реагирует с водой с образованием азотистой кислоты. Он показывает N 2 О 3 имеет слабые кислотные характеристики из-за образования слабой кислоты. В этой реакции N 2 O 3 реагирует с водой, защищая степени окисления атомов.
Хранение раствора в холодном состоянии важно для защиты образующейся HNO 2 кислоты и предотвращения разложения.
Степень окисления азота в азотистой кислоте
Нарисовав структуру Льюиса HNO 2 , мы можем увидеть степень окисления, если азот равен +3.
Из уравнения
Принять степень окисления азота за x. Степень окисления атома кислорода и водорода равна -2 и +1.
- +1 + x + (-2)*2 = 0
- x = 0
Применение азотистой кислоты
Азотистая кислота используется во многих областях органической химии для производства очень многих химических веществ. Теперь мы узнаем, каковы эти области применения азотистой кислоты.
Теперь мы узнаем, каковы эти области применения азотистой кислоты.
Для получения спиртов
Азотистая кислота реагирует с первичными алифатическими аминами для получения первичного спирта . Но помните, что для этой реакции NaNO 2 и разбавленная HCl используются для получения кислоты HNO 2 .
Для приготовления N-нитрозамина
N-нитрозамина представляет собой масло желтого цвета. Когда соединение вторичного амина обрабатывают азотистой кислотой, в качестве продукта получают N-нитрозамин.
Получение хлорида бензолдиазония
Хлорид бензолдиазония используется для изготовления пигментов. При обработке анилина NaNO 2 и разбавить HCl ниже 5 0 C , в качестве продукта получают хлорид бензолдиазония.
Вопросы
Задайте свой вопрос по химии и найдите ответы бесплатно
Как определить водный раствор NaNO
2 и HNO 2 ?Вопрос
Классный руководитель посоветовал вам и вашему другу приготовить раствор азотистой кислоты из твердого нитрата натрия для
провести больше экспериментов. Но вы не можете прийти на подготовительный день и ваш друг сказал, что сделает подготовку
один. Придя на следующий день в лабораторию, вы должны провести дальнейшие эксперименты с приготовленным раствором азотной кислоты.
Когда на следующий день вы пошли в лабораторию, вы видите, что ваш друг сделал некоторые приготовления, но он забыл пометить два
решения. Итак, вы хотите знать, в каком растворе содержится приготовленная азотная кислота. Как отличить азотистую кислоту от водной?
раствор нитрита натрия. Дайте пояснения.
Но вы не можете прийти на подготовительный день и ваш друг сказал, что сделает подготовку
один. Придя на следующий день в лабораторию, вы должны провести дальнейшие эксперименты с приготовленным раствором азотной кислоты.
Когда на следующий день вы пошли в лабораторию, вы видите, что ваш друг сделал некоторые приготовления, но он забыл пометить два
решения. Итак, вы хотите знать, в каком растворе содержится приготовленная азотная кислота. Как отличить азотистую кислоту от водной?
раствор нитрита натрия. Дайте пояснения.
Ответ
При получении азотистой кислоты из твердого нитрата натрия в водном растворе присутствует NaCl при перегонке или других метод химического разделения не используется для удаления NaCl.
Добавлять нитрат серебра к растворам NaNO
2 и HNO 2 Белый осадок AgCl образуется в растворе, в то время как в водном растворе NaNO 2 изменений нет.pH растворов NaNO
2 и HNO 2 HNO 2 является слабой кислотой, а NaNO 2 имеет слабоосновные характеристики. Таким образом, значение pH раствора HNO 2 равно
меньше, чем раствор NaNO 2 .
Таким образом, значение pH раствора HNO 2 равно
меньше, чем раствор NaNO 2 .
NaNO
2 кислота или основание?NaNO 2 имеет слабые основные характеристики. NaNO 2 полностью диссоциирует в воде на ион натрия и NO 2 — ионы. Ион натрия стабилен в воде и не участвует в гидролизе воды.
Стабилен или нестабилен нитрит-ион в воде?
Ион нитрита не является стабильной водой и принимает протон от молекулы воды и образует азотистую кислоту и ион гидроксила. За счет образования гидроксильного иона водный раствор становится щелочным.
Согласно приведенным выше объяснениям, водный раствор NaNO 2 является основным раствором.
Почему мы должны готовить азотную кислоту в лаборатории, когда это требуется?
Азотистая кислота является нестабильной кислотой. Поэтому хранить его долгое время невозможно, потому что он легко разлагается.
Что такое азотная (iii) кислота
Азотная (iii) кислота представляет собой оксокислоту азота. Эта кислота является слабой кислотой. В скобках указана степень окисления атома азота (iii). Так называют неорганические кислоты по номенклатуре ИЮПАК.
Одноосновная кислота
Когда кислота имеет только один атом водорода для реакции с основанием, мы говорим, что это одноосновная кислота.
Можно ли сделать азотную кислоту из азотистой кислоты?
Да, можно. Нагрейте раствор азотистой кислоты. Из-за нестабильности азотистая кислота разлагается на азотную кислоту, NO и воду.
Какова степень окисления азота в hno2
Мы можем найти степень окисления азота по алгебраическому уравнению. В большинстве случаев степень окисления кислорода равна -2, а водорода +1. За х примем степень окисления азота.
HNO 2 представляет собой нейтральную молекулу. Таким образом, сумма степеней окисления каждого элемента должна быть ноль .
- +1 + x + (-2)*2 = 0
- x = +3
Итак, степень окисления азота в HNO 3 это +3.
какова степень окисления азота в nano2?
Мы можем использовать алгебраическое уравнение, чтобы найти степень окисления азота в NaNO 2 . Щелочные металлы всегда имеют только +1 степень окисления. Таким образом, степень окисления натрия равна +1. В большинстве случаев кислород находится в степени окисления -2. Тогда неизвестная степень окисления азота равна х.
+1 + x + (x)*2 = 0
x = +3
Похожие темы
Диоксид серы
подготовка и реакции
Оствальдский процесс —
HNO 3 Производство
Характеристики газообразного азота и подготовка
Подготовка и характеристики газообразного аммиака
Оксиды азота
HNO 3 и HNO 2 Кислоты
Какой оксид азота является нейтральным, NO или NO 2
Нитрит натрия – обзор
ScienceDirectRegisterSign in
эффективный ингибитор окисления липидов и антимикробное средство.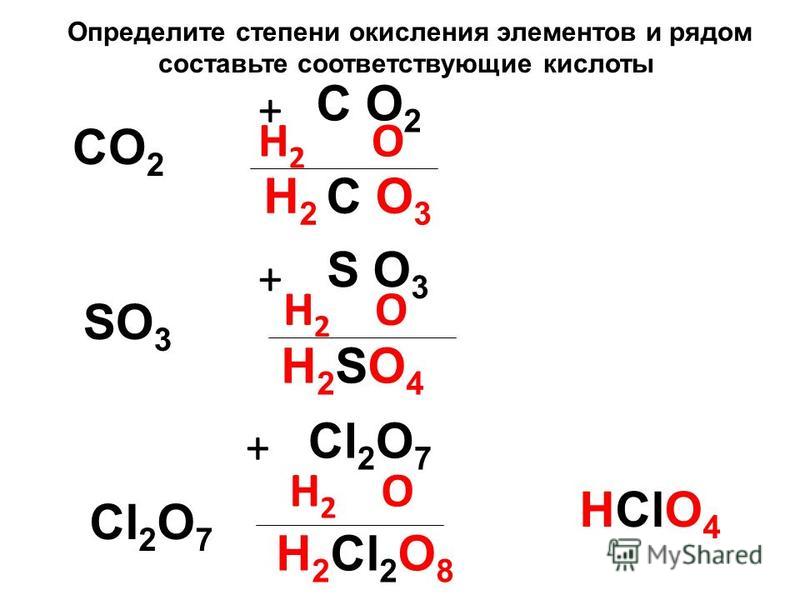
Из: Окисление липидов (второе издание), 2012 г.
PlusAdd to Mendeley М. Абдоллахи, М. Р. Хаксар, в Энциклопедии токсикологии (третье издание), 2014 г. по названию и применению похож на нитрат натрия. Оба являются консервантами, используемыми в переработанном мясе, таком как салями, хот-доги и бекон. Нитрит натрия был синтезирован с помощью нескольких химических реакций, включающих восстановление нитрата натрия. Промышленное производство нитрита натрия осуществляется в основном путем абсорбции оксидов азота водным раствором карбоната натрия или гидроксида натрия. За прошедшие годы нитрит натрия вызвал некоторые опасения по поводу его безопасности в пищевых продуктах, но он по-прежнему используется, и есть признаки того, что он действительно может быть полезен для здоровья. Нитрит натрия был разработан в 1960-е годы. В 1977 году Министерство сельского хозяйства США (USDA) рассматривало вопрос о ее запрете, но окончательное решение Министерства сельского хозяйства США о добавке вышло в 1984 году, разрешив ее использование. Просмотреть главуКнига покупок Прочитать всю главу URL: https://www.sciencedirect.com/science/article/pii/B9780123864543012069 Wood 1982 Нитрит натрия (4 г) добавляли небольшими порциями в течение 1,5 ч к амиду ( 46 ) (560 мг) в уксусной кислоте (2,5 мл) и уксусном ангидриде (12 мл) при 0° и смесь выдерживали при 0–3° в течение 16 ч. Хлорсульфонилизоцианат (500 мг, 3,5 ммоль) добавляли по каплям к силану ( 43 ) (715 мг, 2,8 ммоль) в четыреххлористом углероде (1,2 мл) при 0°. После выдерживания при 0° в течение 10 мин и затем при комнатной температуре в течение 2,5 ч растворитель выпаривали. Остаток перемешивали при 0° с уксусной кислотой (3 мл) в уксусном ангидриде (15 мл) и порциями добавляли нитрит натрия (4,5 г) в течение 1 часа. Смесь выдерживали в атмосфере азота при 0–3° в течение 16 ч и отделяли осадок. К осадку добавляли ацетат натрия (10 г) в воде (25 мл) при 0°; смесь перемешивали при 0° в течение 2 ч, затем при комнатной температуре в течение 3 ч, затем экстрагировали дихлорметаном (5 х 25 мл), остаток обрабатывали диазометаном и очищали, как указано выше, с получением сложного эфира ( 47 ) (410 мг, 61%). Просмотреть главуКнига покупок Прочитать главу полностью URL: https://www.sciencedirect. P.W.G. СМИТ, А.Р. TATCHELL, в Fundamental Aliphatic Chemistry, 1965 Добавление нитрита натрия к щелочному раствору первичного или вторичного нитроалкана с последующим подкислением дает азотную кислоту и псевдонитрол соответственно. Алкилнитроловые кислоты представляют собой кристаллические твердые вещества, дающие красные растворы при растворении в щелочи. Псевдонитролы распознаются по темно-синему раствору, полученному экстракцией хлороформом. Поскольку третичные нитроалканы не вступают в реакцию, приведенная выше реакция использовалась в качестве диагностического теста для первичных, вторичных и третичных нитроалканов. Исторический интерес этой реакции состоит в том, что первичные, вторичные и третичные спирты первоначально классифицировались путем превращения сначала в алкилгалогенид, а затем с помощью нитрита серебра в соответствующий нитроалкан. Просмотреть главуКнига покупок Прочитать главу полностью URL: https://www.sciencedirect.com/science/article/pii/B9780080107462500168 PG JEFFERY, D. HUTCHISON Chemical Method of Edition, D. HUTCHISON. ), 1981 Периодат калия. Нитрит натрия. Раствор азотной кислоты, кипятят 1 литр 0,2 н. азотной кислоты с примерно 0,1 г перйодата калия, охлаждают и хранят в цельностеклянной промывной бутыли. Стандартный маточный раствор марганца, точно взвесьте 0,155 г чистого марганца в небольшой химический стакан, растворите в 50 мл 0,5 N серной кислоты, перенесите в мерную колбу на 1 л и доведите до нужного объема водой. Этот раствор содержит 200 мкг MnO на мл. Стандартный рабочий раствор марганца, перенесите 25 мл исходного раствора в мерную колбу вместимостью 100 мл и доведите до нужного объема водой. Этот раствор содержит 50 мкг MnO на мл и должен использоваться для калибровки 1-сантиметровых кювет спектрофотометра. Просмотреть главуКнига покупок Прочитать главу полностью URL: https://www.sciencedirect.com/science/article/pii/B9780080238067500336 D.L.H. WILLIAMS, в Nitrosation Reactions and the Chemistry of Nitric Oxide, 2004 Обычно считается, что когда нитрит натрия растворяется в карбоновой кислоте, образуется равновесная концентрация нитрозилкарбоксилата. , который действует как нитрозирующий агент [119]. Многие реакции нитрозирования были проведены препаративно с использованием, например, нитрит натрия, растворенный в уксусной или муравьиной кислотах, уравнение (77). Впоследствии из ацетата серебра и нитрозилхлорида был синтезирован нитрозилацетат (77)HNO2+h4O++RCOO-⇄RCOONO+2h3O (78)Ch4COOAg+ClNO=Ch4COONO+AgCl (ацетилнитрит) [120]. (79)Ch4(Ch3)6Ch3OH+Ch4COONO→Ch4(Ch3)6Ch3ONO (80) Кинетические результаты реакции в присутствии карбоксилатных буферов часто показывают путь, который протекает через нитрозилкарбоксилат. Стедман [121] показал, что реакция между азотистой кислотой и азотистоводородной кислотой в ацетатных буферах протекает по двум путям с участием как нитрозилацетата, так и триоксида диазота в качестве нитрозирующих частиц. Было показано, что нитрит натрия в трифторуксусной кислоте эффективен при нитрозировании водонерастворимых амидов [123]. Тот же самый реагент был успешно использован для диазотирования (и последующей реакции с ионом азида) сильно дезактивированных производных анилина, таких как перфторанилин и 2,6-дифторанилин, уравнение (81). Точно так же нитрит натрия в безводной пропионовой (81) кислота образует 2-нитрозопродукты из фенолов региоселективно [124], возможно, посредством образования нитрозилпропионата in situ. Просмотреть главуКнига покупок Прочитать главу полностью URL: https://www.sciencedirect.com/science/article/pii/B9780444517210500025 Betty J. Locey, 20000 Betty J. Locey, в энциклопедии В одном исследовании крысы получали нитрит натрия в дозе 100 мг кг -1 в питьевой воде ежедневно в течение всей жизни на протяжении трех поколений, и не наблюдалось никаких признаков хронической токсичности, канцерогенности или тератогенности. Длительное воздействие нитритов и нитратов в достаточно высоких концентрациях может вызвать увеличение образования мочи почками (диурез), увеличение отложений крахмала и кровотечение из селезенки. Нитриты обычно не классифицируются как канцерогены для человека. При определенных условиях нитриты могут соединяться с аминами в организме с образованием нитрозаминов. Просмотр книги Глава покупки Читать полную главу URL: https://www.sciendirect.com/science/article/pii/b0123694000006864 Yang-heon Song, в комплект Heteroccricl 202920595050595929299595959595959595959595969296969695959595959695969296959692969596959595959596969695959596959696969695969596959695969596959695969596969 Обработка аминопиррола 257 нитритом натрия с последующей циклизацией полученного диазосоединения 258 при обработке 25% серной кислотой с получением пирроло[3,4- c ]тиено[2,3- e ]пиридазин 259 (схема 18). схема 18 5 H -тиазоло[5,4- c ][1,2,4]триазоло[1,2- a ]пиридазин-7,9(8 H ,10a H )-дион 262 с количественным выходом (уравнение 73). 109 (73) Бис([1,2,4]триазоло)[3,4- a :4′3′- c ]фталазин 264 – антибактериальный агент, синтезированный окислительная циклизация бис(2-бензилиденгидразинил)нафталина 263 диацетатом иодбензола (уравнение 74). 110 (74) Дегидратационная циклизация ацилгидразида 265 в пиридине с обратным холодильником дала 3,9-диметилизоксазоло[4,5- d ][1,2,4]триазоло[4 — d ]пиридазин 266 (ур. 75). 111 (75) View chapterPurchase book Read full chapter URL: https://www. K. Hemming, in Comprehensive Heterocyclic Chemistry III, 2008 Недавняя работа продемонстрировала, что опосредованная нитритом натрия циклизация ряда гликозидов гидразиноурацила дает ряд гликозидов токсофлавина вместе с их 4-оксидными аналогами, где последние могут восстанавливаться до первого гипосульфитом. Метод циклизации описан в разделе 10.20.9..2.3(i) в уравнениях (22)–(24). Образующиеся таким образом гликозиды токсофлавина являются потенциальными пролекарствами для направленной антителами ферментативной терапии опухолей <2007CAR1254>. Ряд токсофлавиноподобных соединений (азаптеридинов) был идентифицирован как ингибиторы РНК-зависимой РНК-полимеразы гепатита С, что представляет определенный интерес, учитывая, что использование токсофлавинов, как обсуждалось в разделе 10.20.10.3, было ограничено их токсичностью. Просмотр главыКнига покупок Прочитать главу полностью URL: https://www.sciencedirect.com/science/article/pii/B9780080449920009202 Ричард Н. Батлер, Всесторонняя химия гетероциклов II, 1996 3,7 0005 Диазотирование 5-аминотетразола нитритом натрия и водным раствором HCl дает хлорид тетразол-5-диазония ( 199 ), который взрывоопасен в твердом состоянии или если он кристаллизуется из раствора, но хранится в растворе является важным синтетическим промежуточным продуктом в химии тетразолов 〈75CRV241〉. Схема 32. Просмотр главыКнига покупок65185000952 Тадао Сугимото, в монодисперсных частицах (второе издание), 2019 г. Схема 3. Радикальную привитую полимеризацию акриламида с поверхности ультрадисперсного кремнезема проводили в окислительно-восстановительной системе, состоящей из ионов церия и восстановителей, таких как спиртовые гидроксильные, амино- и меркаптогруппы, сопряженные с гидроксилом группы на поверхности кремнезема. Схема 4. Посмотреть главуКнига покупок Читать всю главу URL: https://www.sciencedirect.com/science/article/pii/B97804446274 Исследования, проведенные в 1990-х годах, показали некоторые побочные эффекты нитрита натрия, например, способность вызывать у детей лейкемию и рак мозга. В конце 1990-х годов Национальная программа по токсичности (NTP) начала обзор нитрита натрия и предложила включить нитрит натрия в список токсикантов для развития и репродуктивной системы, но в отчете NTP от 2000 года было предложено, чтобы нитрит натрия не был токсичным веществом, и он был удален из список токсикантов развития и репродуктивной системы. В настоящее время считается, что он может помочь при пересадке органов и проблемах с сосудами ног, а также предотвращает сердечные приступы и серповидно-клеточную анемию.
Исследования, проведенные в 1990-х годах, показали некоторые побочные эффекты нитрита натрия, например, способность вызывать у детей лейкемию и рак мозга. В конце 1990-х годов Национальная программа по токсичности (NTP) начала обзор нитрита натрия и предложила включить нитрит натрия в список токсикантов для развития и репродуктивной системы, но в отчете NTP от 2000 года было предложено, чтобы нитрит натрия не был токсичным веществом, и он был удален из список токсикантов развития и репродуктивной системы. В настоящее время считается, что он может помочь при пересадке органов и проблемах с сосудами ног, а также предотвращает сердечные приступы и серповидно-клеточную анемию. 2-экзо-карбометокси-6-экзо-метилбицикло[3.3.0]окт-3-ен-7-экзо-илацетат (
47 ) Метод А
 К осажденному твердому веществу добавляли холодный насыщенный водный раствор ацетата натрия (20 мл) и смесь перемешивали на бане со льдом в течение 0,5 часа, а затем при комнатной температуре в течение 2 часов. Смесь экстрагировали дихлорметаном (5 х 20 мл), экстракты упаривали. Остаток растворяли в метаноле и добавляли избыток эфирного диазометана. Через 0,5 ч при комнатной температуре избыток диазометана разлагали уксусной кислотой, смесь промывали водой, сушили (Na 2 SO 4 ), и выпарили. Растворимую в четыреххлористом углероде часть остатка очищали методом ТСХ (SiO 2 , эфир, R f 0,6) с последующей перегонкой (температура бани (130–140°, 0,07 мм) с получением сложного эфира ( 47 ) (410 мг, 69%) (Найдено: C 65,44; H 7,85. C 13 H 18 O 4 требуется: C 65,5; H 7,6%), v max (пленка) 1740s см − 1 δ (CCl 4 ) 0,96 (3 Н, д, J 7 Гц, Ме), 1,38–2,24 (7 Н, м, с синглетом 1,96), 2,95, 3,08 (каждый 1 Н, м, аллильный Н), 3,60 (3H, с, ОМе), 5,03 (1H, кв, J 8 и 4 Гц, AcOC H ), 5,52 и 5,75 (каждый 1H, м, CH=CH).
К осажденному твердому веществу добавляли холодный насыщенный водный раствор ацетата натрия (20 мл) и смесь перемешивали на бане со льдом в течение 0,5 часа, а затем при комнатной температуре в течение 2 часов. Смесь экстрагировали дихлорметаном (5 х 20 мл), экстракты упаривали. Остаток растворяли в метаноле и добавляли избыток эфирного диазометана. Через 0,5 ч при комнатной температуре избыток диазометана разлагали уксусной кислотой, смесь промывали водой, сушили (Na 2 SO 4 ), и выпарили. Растворимую в четыреххлористом углероде часть остатка очищали методом ТСХ (SiO 2 , эфир, R f 0,6) с последующей перегонкой (температура бани (130–140°, 0,07 мм) с получением сложного эфира ( 47 ) (410 мг, 69%) (Найдено: C 65,44; H 7,85. C 13 H 18 O 4 требуется: C 65,5; H 7,6%), v max (пленка) 1740s см − 1 δ (CCl 4 ) 0,96 (3 Н, д, J 7 Гц, Ме), 1,38–2,24 (7 Н, м, с синглетом 1,96), 2,95, 3,08 (каждый 1 Н, м, аллильный Н), 3,60 (3H, с, ОМе), 5,03 (1H, кв, J 8 и 4 Гц, AcOC H ), 5,52 и 5,75 (каждый 1H, м, CH=CH).
Метод В
 com/science/article/pii/B9780080292380500099
com/science/article/pii/B9780080292380500099 4 Реакция с азотистой кислотой

Реактивы:
 Если будут использоваться 4-см ячейки, рабочий раствор можно приготовить, разбавив 5 мл маточного раствора до 100 мл, давая 10 мкг на мл.
Если будут использоваться 4-см ячейки, рабочий раствор можно приготовить, разбавив 5 мл маточного раствора до 100 мл, давая 10 мкг на мл. Нитрозилкарбоксилаты (ацилнитриты) RCOONO
 , уравнение (78) при температурах жидкого азота. Это бледно-коричневая жидкость при комнатной температуре, зеленая жидкость при -78°C и зеленое твердое вещество при -19°C.6°С. Он быстро гидролизуется в воде, но достаточно стабилен в растворителях, таких как пиридин или уксусная кислота, чтобы действовать как эффективный нитрозирующий агент. Он превращает 1-октанол в нитритовый эфир пиридина, уравнение (79) и дает такое же распределение продуктов дезаминирования из 1-октиламина, как и при использовании реагента нитрит натрия/уксусная кислота, уравнение. (80).
, уравнение (78) при температурах жидкого азота. Это бледно-коричневая жидкость при комнатной температуре, зеленая жидкость при -78°C и зеленое твердое вещество при -19°C.6°С. Он быстро гидролизуется в воде, но достаточно стабилен в растворителях, таких как пиридин или уксусная кислота, чтобы действовать как эффективный нитрозирующий агент. Он превращает 1-октанол в нитритовый эфир пиридина, уравнение (79) и дает такое же распределение продуктов дезаминирования из 1-октиламина, как и при использовании реагента нитрит натрия/уксусная кислота, уравнение. (80). Позже [122] более детальная кинетическая работа по нитрозированию N-метиланилина и пиперазина в сходных условиях выявила пути через CH 3 COONO, N 2 O 3 и H 2 NO2+/NO + . По сравнению с другими субстратами оказывается, что CH 3 COONO может реагировать на пределе диффузии, что обеспечивает константу равновесия для образования нитрозилацетата, уравнение. (77), который можно оценить как ~1,4 × 10 90 144 -8 90 145 M 90 144 -1 90 145 . Такое малое значение не позволило бы обнаружить нитрозилацетат в этих растворах ни одним спектроскопическим методом.
Позже [122] более детальная кинетическая работа по нитрозированию N-метиланилина и пиперазина в сходных условиях выявила пути через CH 3 COONO, N 2 O 3 и H 2 NO2+/NO + . По сравнению с другими субстратами оказывается, что CH 3 COONO может реагировать на пределе диффузии, что обеспечивает константу равновесия для образования нитрозилацетата, уравнение. (77), который можно оценить как ~1,4 × 10 90 144 -8 90 145 M 90 144 -1 90 145 . Такое малое значение не позволило бы обнаружить нитрозилацетат в этих растворах ни одним спектроскопическим методом.
Хроническая токсичность (или воздействие)
Животные
Человек
 Существует ряд различных нитрозаминов; многие из них регулируются как человеческие канцерогены. Некоторые химические вещества, такие как витамин С (аскорбиновая кислота), могут ограничивать превращение нитритов в нитрозамины. Министерство сельского хозяйства США (USDA) требует добавления аскорбиновой кислоты или эриторбиновой кислоты в бекон, чтобы снизить риск образования нитрозаминов.
Существует ряд различных нитрозаминов; многие из них регулируются как человеческие канцерогены. Некоторые химические вещества, такие как витамин С (аскорбиновая кислота), могут ограничивать превращение нитритов в нитрозамины. Министерство сельского хозяйства США (USDA) требует добавления аскорбиновой кислоты или эриторбиновой кислоты в бекон, чтобы снизить риск образования нитрозаминов. 12.15.2.4 Пиридазиновое центральное кольцо
 108
108  sciencedirect.com/science/article/pii/B9780124095472148991
sciencedirect.com/science/article/pii/B9780124095472148991 10.20.11 Дальнейшие разработки
 2007MI1>. Чувство кворума ацил-гомосерин-лактона (см. Раздел 10.20.10.3) и его значение в биосинтезе фитотоксина токсофлавина были изучены дополнительно, что дало дополнительную информацию о производстве и роли токсофлавина в больном рисе <2007MI4950>. Фервенулин, 2-метилфервенулин-3-он и их 4-N-оксиды были подвергнуты подробному изучению с помощью рентгеновской дифракции, 1 Н ЯМР и 13 С ЯМР спектроскопии, при этом те же исследователи провели углубленное исследование. изучение их химической активности к окислению, хлорированию, алкилированию и нуклеофильной атаке <2006KFZ49>. Более поздние работы установили исход реакции тех же трех видов с индолами <2007KFZ49>.
2007MI1>. Чувство кворума ацил-гомосерин-лактона (см. Раздел 10.20.10.3) и его значение в биосинтезе фитотоксина токсофлавина были изучены дополнительно, что дало дополнительную информацию о производстве и роли токсофлавина в больном рисе <2007MI4950>. Фервенулин, 2-метилфервенулин-3-он и их 4-N-оксиды были подвергнуты подробному изучению с помощью рентгеновской дифракции, 1 Н ЯМР и 13 С ЯМР спектроскопии, при этом те же исследователи провели углубленное исследование. изучение их химической активности к окислению, хлорированию, алкилированию и нуклеофильной атаке <2006KFZ49>. Более поздние работы установили исход реакции тех же трех видов с индолами <2007KFZ49>. Его можно легко восстановить до гидразина или N 2 можно заменить галогеном, OH или H 〈77AHC(21)323, 84CHEC-I(5)791, 84CHEC-I(5)822〉. Удаление протона дает диазоформу, которая использовалась для контролируемого образования атомарного углерода 〈74JA7830〉. Теоретические исследования ряда диазоазолов позволяют предположить, что 5-диазотетразол должен легко входить в переходное состояние циклоприсоединения с электронно-богатыми алкенами 〈90JCS(P2)1943〉. Соль диазония ( 199 ) соединяется с малонодинитрилом в основных условиях с образованием производного 3-азидо-1,2,4-триазина ( 201 ). Эта реакция формально включает последовательность раскрытия тетразольного кольца, прототропных таутомеризаций и внутримолекулярного нуклеофильного присоединения к исходному диазопродукту, представленному как ( 200 ) на схеме 32 для иллюстрации процесса, хотя этот конкретный вид не обязательно должен быть промежуточным продуктом 〈84KGS557〉. Также сообщалось о гидрате 5-[(диазометил)-азо]тетразола, HN 4 C-NN-CHN 2 H 2 O, который восстанавливается до 5-гидразинотетразола и до тетразол-5-илдиазометанола.
Его можно легко восстановить до гидразина или N 2 можно заменить галогеном, OH или H 〈77AHC(21)323, 84CHEC-I(5)791, 84CHEC-I(5)822〉. Удаление протона дает диазоформу, которая использовалась для контролируемого образования атомарного углерода 〈74JA7830〉. Теоретические исследования ряда диазоазолов позволяют предположить, что 5-диазотетразол должен легко входить в переходное состояние циклоприсоединения с электронно-богатыми алкенами 〈90JCS(P2)1943〉. Соль диазония ( 199 ) соединяется с малонодинитрилом в основных условиях с образованием производного 3-азидо-1,2,4-триазина ( 201 ). Эта реакция формально включает последовательность раскрытия тетразольного кольца, прототропных таутомеризаций и внутримолекулярного нуклеофильного присоединения к исходному диазопродукту, представленному как ( 200 ) на схеме 32 для иллюстрации процесса, хотя этот конкретный вид не обязательно должен быть промежуточным продуктом 〈84KGS557〉. Также сообщалось о гидрате 5-[(диазометил)-азо]тетразола, HN 4 C-NN-CHN 2 H 2 O, который восстанавливается до 5-гидразинотетразола и до тетразол-5-илдиазометанола. , ХН 4 C-NN-CH 2 ОН 〈92KGS1351〉. В более ранней литературе было показано, что замещенные по кольцу 5-аминотетразолы претерпевают окислительную димеризацию до азотетразолов и диазотирование до 5-нитрозаминотетразолов или 1,3-бистетразол-5-илтриазенов, в зависимости от условий диазотирования 〈75CRV241, 84CHEC-I(5 )791〉.
, ХН 4 C-NN-CH 2 ОН 〈92KGS1351〉. В более ранней литературе было показано, что замещенные по кольцу 5-аминотетразолы претерпевают окислительную димеризацию до азотетразолов и диазотирование до 5-нитрозаминотетразолов или 1,3-бистетразол-5-илтриазенов, в зависимости от условий диазотирования 〈75CRV241, 84CHEC-I(5 )791〉. Радикальная полимеризация, инициируемая поверхностно-связанными группами как 2-нафталинтиол,
фенил-диазогруппа образуется на поверхности кремнезема, которые разлагаются при нагревании при повышенных температурах, таких как 60°C, с образованием фенильных радикалов, химически связанных с поверхностью кремнезема, и несвязанных тиорадикалов, оба из которых способны инициировать свободнорадикальную полимеризацию виниловых мономеров. 197 Схема 3 представляет такие реакции. С помощью этой радикальной полимеризации к поверхностям кремнезема прививают различные полимеры; например, полистирол (в толуоле или в массе), поли(метилметакрилат) (в толуоле или в массе), полиакриламид (в воде), полиакрилонитрил (в ДМФА), полиакриловая кислота (в воде). ) и поли(4-винилпиридин) (в этаноле или в массе). Фенилдиазогруппы, связанные с диоксидом кремния, также использовались для реакций сочетания с одноцепочечными DNA , и ожидалось, что продукт будет полезен для реакций гибридизации ДНК. 190
С помощью этой радикальной полимеризации к поверхностям кремнезема прививают различные полимеры; например, полистирол (в толуоле или в массе), поли(метилметакрилат) (в толуоле или в массе), полиакриламид (в воде), полиакрилонитрил (в ДМФА), полиакриловая кислота (в воде). ) и поли(4-винилпиридин) (в этаноле или в массе). Фенилдиазогруппы, связанные с диоксидом кремния, также использовались для реакций сочетания с одноцепочечными DNA , и ожидалось, что продукт будет полезен для реакций гибридизации ДНК. 190  201 В результате гидрофильный диоксид кремния с привитым полиакриламидом был синтезирован. Эти восстанавливающие группы, связанные с поверхностью диоксида кремния, были введены реакциями поверхностных силанольных групп с 3-глицидоксипропилтриметоксисиланом (ГПС), 3-аминопропилтриэтоксисиланом (АПС) и 3-меркаптопропилтриметоксисиланом (МПС) соответственно. Аналогичным образом была получена сажа с привитым полиакриламидом . 202 Схема 4 представляет такие реакции.
201 В результате гидрофильный диоксид кремния с привитым полиакриламидом был синтезирован. Эти восстанавливающие группы, связанные с поверхностью диоксида кремния, были введены реакциями поверхностных силанольных групп с 3-глицидоксипропилтриметоксисиланом (ГПС), 3-аминопропилтриэтоксисиланом (АПС) и 3-меркаптопропилтриметоксисиланом (МПС) соответственно. Аналогичным образом была получена сажа с привитым полиакриламидом . 202 Схема 4 представляет такие реакции.089
Термодинамическое моделирование процессов окисления Ag2Se под действием NaNO2
Заголовки статей
Характеристика гамма-облученной смеси ПП/ПЭНП
стр. 90
90
Экспериментальное исследование скорости распространения пламени в золе рисовой шелухи в неподвижных слоях
стр.96
Сжатие агрегатов двумерных монодисперсных материалов для оценки распространения дефектов
стр.101
Интерактивная сила двумерной деформации сжатия методом дискретных элементов (DEM)
стр.106
Термодинамическое моделирование процессов окисления Ag 2 Se NaNO 2
стр.111
Сушка промышленных керамических кирпичей: экспериментальное исследование в печи
стр. 116
116
Оценка корреляции Нуссельта для численного прогноза мощности промерзания на трубчатых валах треугольного расположения
стр.121
Математическое моделирование процесса высокоэнергетического шарового измельчения (HEBM)
стр.126
In Situ Оптический анализ структурных изменений в полимолочной кислоте (ПМК) в процессе растворения газа
стр.131
Главная Форум дефектов и диффузии Форум дефектов и диффузии Vol. 353 Термодинамическое моделирование окисления…
Предварительный просмотр статьи
Abstract:
Проведено термодинамическое моделирование процессов окисления селенида серебра такими реагентами, как NaNO 2 , NaNO 3 и NaOH при их термообработке. Оценена энергия Гиббса реакций окисления селенида серебра. Показано, что в качестве реагента-окислителя селенида серебра рационально использовать смесь нитрита натрия и гидроксида натрия. Окисление селенида серебра при термообработке совместно с нитритом натрия и гидроксидом натрия сопровождается образованием растворимых соединений типа Na 2 SeO 3 и Na 2 SeO 4 , серебро проходит в металлическом состоянии. Оценены коэффициенты разделения, характеризующие эффективность окисления и уровень перехода селена в растворимые соединения. С использованием полученных данных предложен метод разделения материалов, содержащих селениды, путем их спекания с натрийсодержащими реагентами. Метод основан на переводе селена в водорастворимые соединения с последующим выщелачиванием, при этом драгоценные металлы находятся в элементарном состоянии. Полученные продукты пригодны для производства селена и драгоценных металлов по традиционным технологиям.
Оценена энергия Гиббса реакций окисления селенида серебра. Показано, что в качестве реагента-окислителя селенида серебра рационально использовать смесь нитрита натрия и гидроксида натрия. Окисление селенида серебра при термообработке совместно с нитритом натрия и гидроксидом натрия сопровождается образованием растворимых соединений типа Na 2 SeO 3 и Na 2 SeO 4 , серебро проходит в металлическом состоянии. Оценены коэффициенты разделения, характеризующие эффективность окисления и уровень перехода селена в растворимые соединения. С использованием полученных данных предложен метод разделения материалов, содержащих селениды, путем их спекания с натрийсодержащими реагентами. Метод основан на переводе селена в водорастворимые соединения с последующим выщелачиванием, при этом драгоценные металлы находятся в элементарном состоянии. Полученные продукты пригодны для производства селена и драгоценных металлов по традиционным технологиям.
Доступ через ваше учреждение
* — Автор, ответственный за переписку
использованная литература
[1]
Кудрявцев А. А. Химия и технология селена и теллура. Москва, Металлургическая, 1968. 340 с.
А. Химия и технология селена и теллура. Москва, Металлургическая, 1968. 340 с.
[2] М.А. Ласточкина, С.А. Мастюгин, Т.В. Вергизова, Т.Н. Грейвер, В.В. Ашихин. Влияние условий автоклавного окислительного выщелачивания медеэлектролитных шламов на их поведение при флотации / Цветные металлы, 2012. № 8, с.50-56.
[3] Грейвер Т.Н. Некоторые особенности образования шламов при электролитическом рафинировании меди и никеля/цветных металлов. 1965. № 1. С. 28-33.
[4]
Букетов Е. А., Малышев В.П. Удаление селена и теллура из медного электролитного шлама. Алма-Ата: Наука. 1969. 206.
А., Малышев В.П. Удаление селена и теллура из медного электролитного шлама. Алма-Ата: Наука. 1969. 206.
[5] Грейвер Т.Н., Зайцева И.Г., Косовер В.М. Селен и теллур. Новая технология производства и переработки. Москва: Металлургия. 1977. 296 с.
[6] Патент РФ № 2451759/ М.А. Ласточкина, Т.Н. Грейвер, Т.В. Вергизова, С.А. Мастюгин, В.В. Ашихин, С.А. Краюхин, А.Т. Крестьянинов. Способ переработки свинцового шлама электролитной меди (варианты). Опубл. 27. 05. (2012).
[7]
Патент РФ № 2458159. Способ получения металлического серебра из халькогенида серебра. Громов О.Г., Локшин Е.П., Савельев Ю.А., Мастюгин С.А. по 20.03.(2011).
Способ получения металлического серебра из халькогенида серебра. Громов О.Г., Локшин Е.П., Савельев Ю.А., Мастюгин С.А. по 20.03.(2011).
Цитируется
ОКИСЛЕНИЕ ПЛУТОНИЯ (III) НИТРИТОМ НАТРИЯ (Технический отчет)
ОКИСЛЕНИЕ ПЛУТОНИЯ (III) НИТРИТОМ НАТРИЯ (Технический отчет) | ОСТИ.GOVперейти к основному содержанию
- Полная запись
- Другие родственные исследования
Приведена константа скорости реакции окисления Pu(III) нитритом в растворе HNO/sub 3/, содержащем сульфанат железа. Было обнаружено, что скорость реакции можно измерить с помощью спектрофотометрии. Данные показывают, что реакция является реакцией псевдопервого порядка в интересующей области концентрации HNO/sub 3/ и нитрита. Константа скорости реакции, выраженная как реакция первого порядка по Pu, была найдена для нескольких значений концентрации HNO/sub 3/ и нитрита. Дана зависимость HNC/sub 3/константы скорости реакции. Окисление сульфамата железа — раствор Pu(III) Pu(III) протекает последовательно через ионы сульфамата, железа и Pu(III). С окислением как ионов железа, так и ионов Pu(III) связан автокаталитический механизм, что исключает возможность простые расчеты констант на основе концентрации нитрита.Дана эмпирическая связь между константой скорости реакции и концентрацией (добавленного) нитрита.(авт.)
Было обнаружено, что скорость реакции можно измерить с помощью спектрофотометрии. Данные показывают, что реакция является реакцией псевдопервого порядка в интересующей области концентрации HNO/sub 3/ и нитрита. Константа скорости реакции, выраженная как реакция первого порядка по Pu, была найдена для нескольких значений концентрации HNO/sub 3/ и нитрита. Дана зависимость HNC/sub 3/константы скорости реакции. Окисление сульфамата железа — раствор Pu(III) Pu(III) протекает последовательно через ионы сульфамата, железа и Pu(III). С окислением как ионов железа, так и ионов Pu(III) связан автокаталитический механизм, что исключает возможность простые расчеты констант на основе концентрации нитрита.Дана эмпирическая связь между константой скорости реакции и концентрацией (добавленного) нитрита.(авт.)
- Авторов:
- Брюнстад, А
- Дата публикации:
- Исследовательская организация:
- General Electric Co. Hanford Atomic Products Operation, Ричленд, Вашингтон
- Идентификатор ОСТИ:
- 4345806
- Номер(а) отчета:
- HW-51655
- Номер АНБ:
- НСА-12-003620
- Номер контракта Министерства энергетики:
- W-31-109-ENG-52
- Тип ресурса:
- Технический отчет
- Отношение ресурсов:
- Другая информация: Децл. 12 ноября 1957 г. Ориг. Дата поступления: 31 декабря 1958 г.
- Страна публикации:
- США
- Язык:
- Английский
- Тема:
- ХИМИЯ; КАТАЛИЗ; ХИМИЧЕСКИЕ РЕАКЦИИ; СОЕДИНЕНИЯ ЖЕЛЕЗА; АЗОТНАЯ КИСЛОТА; НИТРИТЫ; ОКИСЛЕНИЕ; ФОТОМЕТРИЯ; ПЛУТОНИЙ; КИНЕТИКА РЕАКЦИИ; СОЕДИНЕНИЯ НАТРИЯ; РЕШЕНИЯ; СПЕКТРОСКОПИЯ; СУЛЬФАМИНОВАЯ КИСЛОТА; СУЛЬФОКИСЛОТЫ; СОЕДИНЕНИЯ СЕРЫ; СКОРОСТЬ
Форматы цитирования
- MLA
- АПА
- Чикаго
- БибТекс
Брунстад, А. ОКИСЛЕНИЕ ПЛУТОНИЯ (III) НИТРИТОМ НАТРИЯ . США: Н. П., 1957.
Веб. дои: 10.2172/4345806.
ОКИСЛЕНИЕ ПЛУТОНИЯ (III) НИТРИТОМ НАТРИЯ . США: Н. П., 1957.
Веб. дои: 10.2172/4345806.
Копировать в буфер обмена
Брюнстад, А. ОКИСЛЕНИЕ ПЛУТОНИЯ (III) НИТРИТОМ НАТРИЯ . Соединенные Штаты. https://doi.org/10.2172/4345806
Копировать в буфер обмена
Бранстад, А. 1957.
«ОКИСЛЕНИЕ ПЛУТОНИЯ (III) НИТРИТОМ НАТРИЯ». Соединенные Штаты. https://doi.org/10.2172/4345806. https://www.osti.gov/servlets/purl/4345806.
Копировать в буфер обмена
@статья{osti_4345806,
title = {ОКИСЛЕНИЕ ПЛУТОНИЯ (III) НИТРИТОМ НАТРИЯ},
автор = {Брунстад, А},
abstractNote = {Дана константа скорости реакции окисления Pu(III) нитритом в растворе HNO/sub 3/, содержащем сульфанат железа. Было обнаружено, что скорость реакции можно измерить с помощью спектрофотометрии. Данные показывают, что реакция является реакцией псевдопервого порядка в интересующей области концентрации HNO/sub 3/ и нитрита. Константа скорости реакции, выраженная как реакция первого порядка по Pu, была найдена для нескольких значений концентрации HNO/sub 3/ и нитрита. Дана зависимость HNC/sub 3/константы скорости реакции. Окисление сульфамата железа - раствор Pu(III) Pu(III) протекает последовательно через ионы сульфамата, железа и Pu(III). С окислением как ионов железа, так и ионов Pu(III) связан автокаталитический механизм, что исключает возможность простые расчеты констант на основе концентрации нитрита.Дана эмпирическая связь между константой скорости реакции и концентрацией (добавленного) нитрита.(авт.)},
Было обнаружено, что скорость реакции можно измерить с помощью спектрофотометрии. Данные показывают, что реакция является реакцией псевдопервого порядка в интересующей области концентрации HNO/sub 3/ и нитрита. Константа скорости реакции, выраженная как реакция первого порядка по Pu, была найдена для нескольких значений концентрации HNO/sub 3/ и нитрита. Дана зависимость HNC/sub 3/константы скорости реакции. Окисление сульфамата железа - раствор Pu(III) Pu(III) протекает последовательно через ионы сульфамата, железа и Pu(III). С окислением как ионов железа, так и ионов Pu(III) связан автокаталитический механизм, что исключает возможность простые расчеты констант на основе концентрации нитрита.Дана эмпирическая связь между константой скорости реакции и концентрацией (добавленного) нитрита.(авт.)},
дои = {10.2172/4345806},
URL-адрес = {https://www.osti.gov/biblio/4345806},
журнал = {},
номер =,
объем = ,
место = {США},
год = {1957},
месяц = {7}
}
Копировать в буфер обмена
Посмотреть технический отчет (5,46 МБ)
https://doi.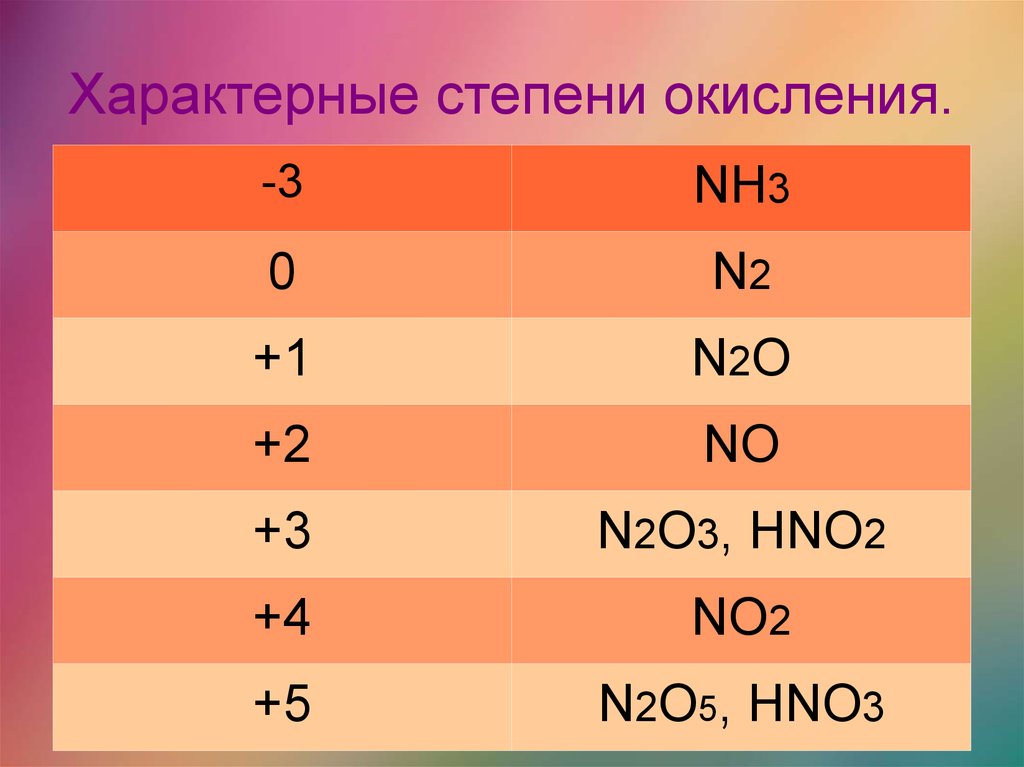 org/10.2172/4345806
org/10.2172/4345806
Экспорт метаданных
Сохранить в моей библиотеке
Вы должны войти в систему или создать учетную запись, чтобы сохранять документы в своей библиотеке.
Аналогичных записей в сборниках OSTI.GOV:
- Аналогичные записи
кислородная кислота | химическое соединение | Британика
оксикислота
См. все средства массовой информации
- Связанные темы:
- сульфоновая кислота серная кислота фосфорная кислота азотная кислота пероксикислота
Просмотреть весь соответствующий контент →
Резюме
Прочтите краткий обзор этой темы
оксикислота , любая кислородсодержащая кислота. Большинство ковалентных оксидов неметаллов реагируют с водой с образованием кислых оксидов; то есть они реагируют с водой с образованием оксикислот, которые дают ионы гидроксония (H 3 O + ) в растворе. Есть некоторые исключения, такие как окись углерода, CO, закись азота, N 2 O, и окись азота, NO.
Большинство ковалентных оксидов неметаллов реагируют с водой с образованием кислых оксидов; то есть они реагируют с водой с образованием оксикислот, которые дают ионы гидроксония (H 3 O + ) в растворе. Есть некоторые исключения, такие как окись углерода, CO, закись азота, N 2 O, и окись азота, NO.
Сила оксикислоты определяется степенью ее диссоциации в воде (т. е. ее способностью образовывать H + 9ионов 0145). В общем, относительную силу оксикислот можно предсказать на основе электроотрицательности и степени окисления центрального атома неметалла. Сила кислоты увеличивается по мере увеличения электроотрицательности центрального атома. Например, поскольку электроотрицательность хлора (Cl) выше, чем у серы (S), которая, в свою очередь, выше, чем у фосфора (P), можно предположить, что хлорная кислота HClO 4 является более сильной кислота, чем серная кислота, H 2 SO 4 , которая должна быть более сильной кислотой, чем фосфорная кислота, H 3 PO 4 . Для данного центрального атома неметалла сила кислоты увеличивается по мере увеличения степени окисления центрального атома. Например, азотная кислота HNO 3 , в которой атом азота (N) имеет степень окисления +5, является более сильной кислотой, чем азотистая кислота HNO 2 , где степень окисления азота равна +3. Таким же образом серная кислота H 2 SO 4 с серой в степени окисления +6 является более сильной кислотой, чем сернистая кислота, H 2 SO 3 , где существует степень окисления серы +4.
Для данного центрального атома неметалла сила кислоты увеличивается по мере увеличения степени окисления центрального атома. Например, азотная кислота HNO 3 , в которой атом азота (N) имеет степень окисления +5, является более сильной кислотой, чем азотистая кислота HNO 2 , где степень окисления азота равна +3. Таким же образом серная кислота H 2 SO 4 с серой в степени окисления +6 является более сильной кислотой, чем сернистая кислота, H 2 SO 3 , где существует степень окисления серы +4.
Соль оксикислоты представляет собой соединение, образующееся при взаимодействии кислоты с основанием: кислота + основание → соль + вода. Этот тип реакции называется нейтрализацией, потому что раствор становится нейтральным.
Оксикислоты азота
Азотная кислота, HNO 3 , была известна алхимикам 8-го века как «aqua fortis» (сильная вода). Он образуется в результате реакции как пятиокиси азота (N 2 O 5 ) и диоксид азота (NO 2 ) с водой.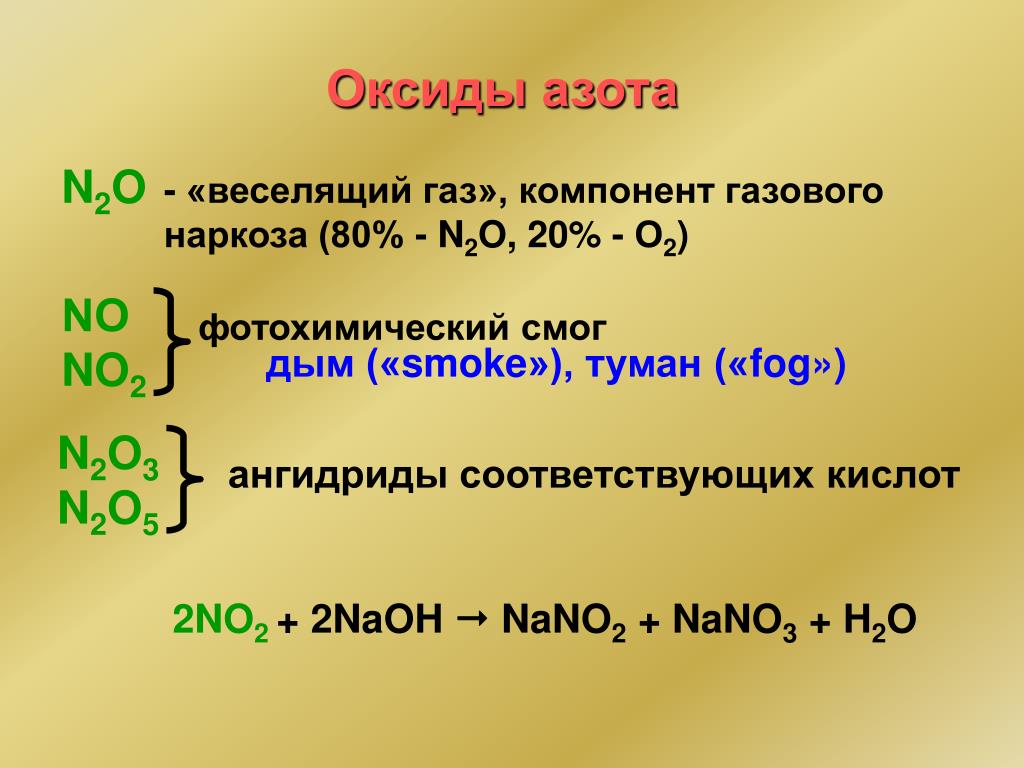 Небольшие количества азотной кислоты обнаруживаются в атмосфере после гроз, а ее соли, называемые нитратами, широко распространены в природе. Огромные залежи нитрата натрия, NaNO 3 , также известного как чилийская селитра, находятся в пустынной области недалеко от границы Чили и Перу. Эти отложения могут иметь ширину 3 км (2 мили), длину 300 км (200 миль) и толщину до 2 метров (7 футов). Нитрат калия, KNO 3 , иногда называемая бенгальской селитрой, встречается в Индии и других странах Восточной Азии. Азотную кислоту можно получить в лаборатории путем нагревания азотнокислой соли, такой как упомянутые выше, с концентрированной серной кислотой; Например,
NaNO 3 + H 2 SO 4 + тепло → NaHSO 4 + HNO 3 .
Поскольку HNO 3 кипит при 86 °C (187 °F), а H 2 SO 4 кипит при 338 °C (640 °F), NaNO 3 и NaHSO 4 – нелетучие соли, азотная кислота легко удаляется перегонкой.
Небольшие количества азотной кислоты обнаруживаются в атмосфере после гроз, а ее соли, называемые нитратами, широко распространены в природе. Огромные залежи нитрата натрия, NaNO 3 , также известного как чилийская селитра, находятся в пустынной области недалеко от границы Чили и Перу. Эти отложения могут иметь ширину 3 км (2 мили), длину 300 км (200 миль) и толщину до 2 метров (7 футов). Нитрат калия, KNO 3 , иногда называемая бенгальской селитрой, встречается в Индии и других странах Восточной Азии. Азотную кислоту можно получить в лаборатории путем нагревания азотнокислой соли, такой как упомянутые выше, с концентрированной серной кислотой; Например,
NaNO 3 + H 2 SO 4 + тепло → NaHSO 4 + HNO 3 .
Поскольку HNO 3 кипит при 86 °C (187 °F), а H 2 SO 4 кипит при 338 °C (640 °F), NaNO 3 и NaHSO 4 – нелетучие соли, азотная кислота легко удаляется перегонкой.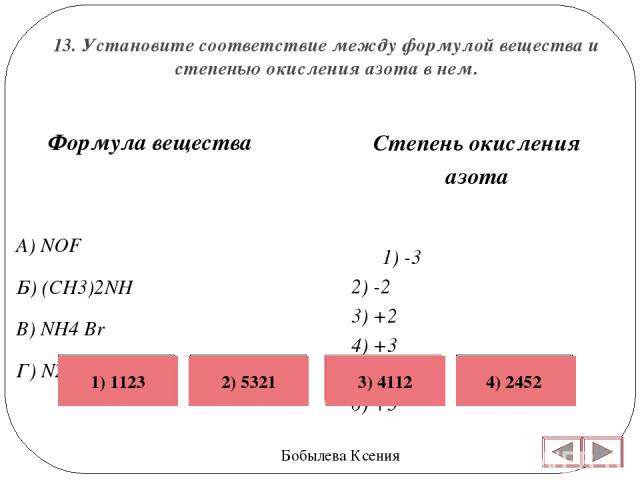
Викторина «Британника»
Наука: правда или вымысел?
Вас увлекает физика? Устали от геологии? С помощью этих вопросов отделите научный факт от вымысла.
В промышленных масштабах азотная кислота производится по процессу Оствальда. Этот процесс включает окисление аммиака NH 3 до оксида азота NO и дальнейшее окисление NO до диоксида азота NO 2 9.0012, а затем превращение NO 2 в азотную кислоту (HNO 3 ). Это поточный процесс, при котором смесь аммиака и избыточного воздуха нагревается до 600–700 °C (от 1100 до 1300 °F) и проходит через платино-родиевый катализатор. (Катализатор увеличивает скорость реакции, не расходуясь при этом сам.) Когда происходит окисление до NO, эта газообразная смесь буквально горит пламенем. Добавляется дополнительный воздух для окисления NO до NO 2 . № 2 , избыток кислорода и нереакционноспособный азот из воздуха пропускают через распыляемую воду, где образуются HNO 3 и NO в виде диспропорционирования NO 2 . Газообразный NO рециркулирует в процессе с большим количеством воздуха, а жидкая HNO 3 отбирается и концентрируется. Около 7 миллиардов кг (16 миллиардов фунтов) HNO 3 ежегодно производится в Соединенных Штатах в промышленных масштабах, причем основная часть производится по процессу Оствальда.
Газообразный NO рециркулирует в процессе с большим количеством воздуха, а жидкая HNO 3 отбирается и концентрируется. Около 7 миллиардов кг (16 миллиардов фунтов) HNO 3 ежегодно производится в Соединенных Штатах в промышленных масштабах, причем основная часть производится по процессу Оствальда.
В чистом виде азотная кислота представляет собой бесцветную жидкость, которая кипит при 86 ° C (187 ° F) и замерзает при -42 ° C (-44 ° F). Под воздействием света или тепла он разлагается с образованием кислорода, воды и смеси оксидов азота (в основном NO 2 ).
4HNO 3 + свет (или тепло) → 4ΝΟ 2 + 2H 2 O + O 2 Следовательно, азотная кислота часто имеет желтый или коричневый цвет из-за NO 2 , который образуется при ее разложении. Азотная кислота стабильна в водном растворе, и 68-процентные растворы кислоты (т. е. 68 граммов HNO 3 на 100 граммов раствора) продаются как концентрированная HNO 3 . Это одновременно сильный окислитель и сильная кислота. Неметаллические элементы, такие как углерод (C), йод (I), фосфор (P) и сера (S), окисляются концентрированной HNO 3 до их оксидов или оксикислот с образованием NO 2 ; Например,
S + 6HNO 3 → H 2 SO 4 + 6NO 2 + 2H 2 O.
Кроме того, многие соединения окисляются HNO 3 . Соляная кислота, водный раствор HCl, легко окисляется концентрированной HNO 3 до хлора Cl 2 и диоксида хлора ClO 2 . Царская водка («царская вода»), смесь одной части концентрированной HNO 3 и три части концентрированной HCl, энергично реагирует с металлами. Использование этой смеси алхимиками для растворения золота задокументировано еще в 13 веке.
Это одновременно сильный окислитель и сильная кислота. Неметаллические элементы, такие как углерод (C), йод (I), фосфор (P) и сера (S), окисляются концентрированной HNO 3 до их оксидов или оксикислот с образованием NO 2 ; Например,
S + 6HNO 3 → H 2 SO 4 + 6NO 2 + 2H 2 O.
Кроме того, многие соединения окисляются HNO 3 . Соляная кислота, водный раствор HCl, легко окисляется концентрированной HNO 3 до хлора Cl 2 и диоксида хлора ClO 2 . Царская водка («царская вода»), смесь одной части концентрированной HNO 3 и три части концентрированной HCl, энергично реагирует с металлами. Использование этой смеси алхимиками для растворения золота задокументировано еще в 13 веке.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Действие азотной кислоты на металл обычно приводит к восстановлению кислоты (т. е. к уменьшению степени окисления азота). Продукты реакции определяют по концентрации HNO 3 , задействованный металл (т. е. его реакционная способность) и температура. В большинстве случаев образуется смесь оксидов азота, нитратов и других продуктов восстановления. Относительно нереакционноспособные металлы, такие как медь (Cu), серебро (Ag) и свинец (Pb), восстанавливают концентрированную HNO 3 прежде всего до NO 2 . Реакция разбавленной HNO 3 с медью дает NO, тогда как более активные металлы, такие как цинк (Zn) и железо (Fe), реагируют с разбавленной HNO 3 с образованием N 2 O. При использовании чрезвычайно разбавленной HNO 3 может образовываться либо газообразный азот (N 2 ), либо ион аммония (NH 4 + ). Азотная кислота реагирует с белками, например, с белками кожи человека, с образованием желтого вещества, называемого ксантопротеином.
е. к уменьшению степени окисления азота). Продукты реакции определяют по концентрации HNO 3 , задействованный металл (т. е. его реакционная способность) и температура. В большинстве случаев образуется смесь оксидов азота, нитратов и других продуктов восстановления. Относительно нереакционноспособные металлы, такие как медь (Cu), серебро (Ag) и свинец (Pb), восстанавливают концентрированную HNO 3 прежде всего до NO 2 . Реакция разбавленной HNO 3 с медью дает NO, тогда как более активные металлы, такие как цинк (Zn) и железо (Fe), реагируют с разбавленной HNO 3 с образованием N 2 O. При использовании чрезвычайно разбавленной HNO 3 может образовываться либо газообразный азот (N 2 ), либо ион аммония (NH 4 + ). Азотная кислота реагирует с белками, например, с белками кожи человека, с образованием желтого вещества, называемого ксантопротеином.
Нитраты, представляющие собой соли азотной кислоты, образуются при взаимодействии металлов или их оксидов, гидроксидов или карбонатов с азотной кислотой. Большинство нитратов растворимы в воде, и азотная кислота в основном используется для получения растворимых нитратов металлов. Все нитраты разлагаются при нагревании и могут происходить со взрывом. Например, когда нитрат калия (KNO 3 ) нагревается, образуется нитрит (соединение, содержащее NO 2 − ) и выделяется газообразный кислород.
2КНО 3 + нагрев → 2КНО 2 + О 2 При нагревании нитратов тяжелых металлов образуется оксид металла, как, например, в
2Cu(NO 3 ) 2 + тепло → 2CuO + 4NO 2 + O 2 .
Нитрат аммония (NH 4 ) 2 NO 3 производит закись азота N 2 O и особенно опасен для нагревания или детонации.
Большинство нитратов растворимы в воде, и азотная кислота в основном используется для получения растворимых нитратов металлов. Все нитраты разлагаются при нагревании и могут происходить со взрывом. Например, когда нитрат калия (KNO 3 ) нагревается, образуется нитрит (соединение, содержащее NO 2 − ) и выделяется газообразный кислород.
2КНО 3 + нагрев → 2КНО 2 + О 2 При нагревании нитратов тяжелых металлов образуется оксид металла, как, например, в
2Cu(NO 3 ) 2 + тепло → 2CuO + 4NO 2 + O 2 .
Нитрат аммония (NH 4 ) 2 NO 3 производит закись азота N 2 O и особенно опасен для нагревания или детонации.
Азотная кислота широко используется в лаборатории и в химической промышленности как сильная кислота и как окислитель. Кислота широко используется в производстве взрывчатых веществ, красителей, пластмасс и лекарств.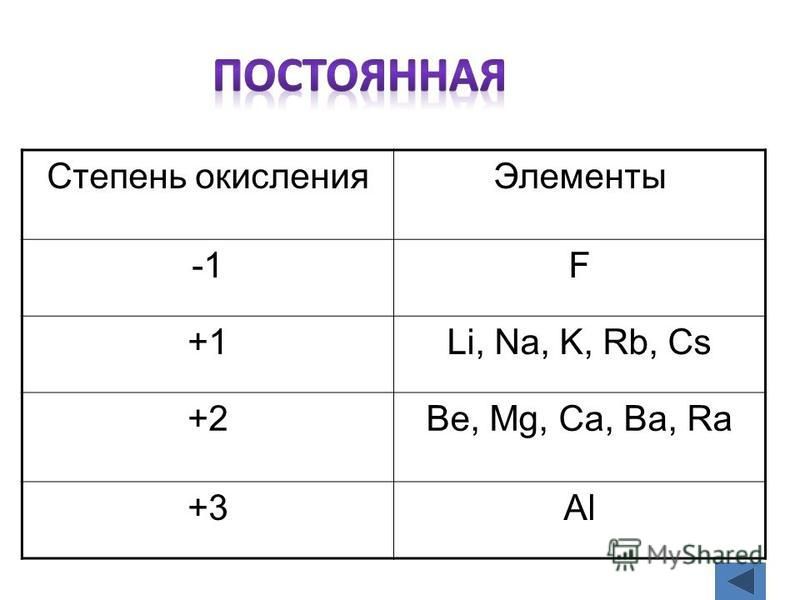 Нитраты ценны как удобрения. Порох представляет собой смесь нитрата калия, серы и древесного угля. Аммонал, взрывчатое вещество, представляет собой смесь аммиачной селитры и алюминиевой пудры.
Нитраты ценны как удобрения. Порох представляет собой смесь нитрата калия, серы и древесного угля. Аммонал, взрывчатое вещество, представляет собой смесь аммиачной селитры и алюминиевой пудры.
Реакции солей диазония: Зандмейера и родственные реакции
Соли диазония из аминов и реакции солей диазония
Сегодня поговорим о наборе реакций ароматических аминов, которые по-разному классифицируются как «амины» и «ароматические соединения», в зависимости от учебника.
Он включает преобразование ароматической аминогруппы (NH 2 ) в очень хорошую уходящую группу (N 2 ), которую затем можно заменить различными нуклеофилами. Однако N 2 представляет собой , такую как , хорошую уходящую группу, так что метод хорошо работает только для ароматических аминов; алкильные («алифатические») амины склонны терять N 2 слишком быстро , что делает метод в этом случае гораздо менее полезным.
СОДЕРЖАНИЕ
- Образование солей диазония из ароматических аминов
- Реакции диазония Соли: Сэндмейер и другие реакции
- Механизм: формирование диазония.
- (Дополнительно) Ссылки и дополнительная литература
1. Образование солей диазония из ароматических аминов
Вот процесс. Обработка ароматического амина азотистой кислотой ( или нитритом натрия, который превращается в азотистую кислоту в присутствии кислоты ) в присутствии сильной кислоты, такой как HCl, приводит к потере H 2 O и образованию новая тройная связь N-N. Полученный вид называется «ионом диазония»:
(Как это работает? Мы рассмотрим механизм внизу поста) 903:30 .
2. Реакции солей диазония: обзорТак почему же это важно?
Это важно, потому что полученные соли диазония могут быть преобразованы во всевозможные полезные функциональные группы. Вместо того, чтобы описывать все словами, сначала давайте просто покажем 7 примеров на диаграмме:
Вместо того, чтобы описывать все словами, сначала давайте просто покажем 7 примеров на диаграмме:
Любой процесс, в котором используется один исходный материал, который может быть преобразован в семь различных потенциальных продуктов, можно с полным основанием назвать «универсальным».
Эти реакции можно условно разделить на две категории: реакции Зандмейера и все остальное.
Реакции Сандмейера
Одним из способов преобразования солей диазония является их обработка различными соединениями меди. Они известны как реакции Зандмейера в честь Трауготта Зандмейера, который впервые открыл реакцию в 1884 году (с ацетилидом меди!).
Три ключевых примера:
- CuCl превращает соли арилдиазония в арилхлориды
- CuBr превращает соли арилдиазония в арилбромиды
- CuCN превращает соли арилдиазония в арилцианиды (нитрилы).
Механизм, о котором вы можете прочитать в другом месте, вероятно, происходит через арильный радикал, который окисляется до арильного катиона, а затем атакуется нуклеофилом.
Другие реакции
Медь не требуется для замещения, если присутствует достаточно сильный нуклеофил или если смесь достаточно нагрета:
- Арилиодиды также могут быть получены из солей арилдиазония путем обработки йодидом калия (KI).
- Гидроксильные группы (ОН) могут быть установлены на соли арилдиазония путем нагревания с водой и кислотой. (ранее мы видели один пример в работе Джона Робертса по аринам, которую мы рассмотрели здесь.)
- Арил фториды можно установить с помощью двухэтапного процесса. Первый включает замену противоиона (X – ) на арилдиазониевую соль ионом тетрафторбората ( BF 4 – ) путем обработки диазониевой соли HBF 4 . Тогда при нагревании фтор может действовать как нуклеофил, вытесняя N 2 и выделяя в качестве побочного продукта BF 3 .
- Соль диазония также может быть восстановлена до C– H путем обработки соли арилдиазония гипофосфористой кислотой (H 3 PO 2 ).

Не так уж и плохо из одной функциональной группы!
3. Механизм: образование ионов диазония
- образование ионов нитрозония из HNO 2
Теперь давайте рассмотрим, как работают некоторые из этих реакций.
Во-первых, давайте пройдем через образование соли диазония, процесс, называемый «диазотированием».
Первым ключевым реагентом для этого процесса является либо нитрит натрия (NaNO 2 ), либо азотистая кислота (HNO 2 ). Преимущество нитрита натрия состоит в том, что с ним легко обращаться, в то время как HNO 2 — несколько нестабильная жидкость.
Вторым ключевым реагентом является сильная минеральная кислота, такая как HCl; если используется NaNO 2 , HCl превращает его в HNO 2 .
Основной целью HCl является дальнейшее преобразование HNO 2 в мощный электрофил NO + , «ион нитрозония», который является ключевым электрофилом в реакции, в результате которой образуется соль диазония.
Ион нитрозония образуется в результате протонирования ОН и последующей потери воды:
2. Образование иона диазония
Следующим этапом является образование иона диазония в результате реакции между амином и ионом нитрозония, для которой также требуется кислота.
Как это работает?
Первая стадия – образование новой связи N–N, которое происходит в результате атаки иона нитрозония ароматическим амином (, стадия 1 ). За этим следуют два переноса протона от азота к кислороду (, шаги 2 и 3, ), сопровождающиеся реорганизацией каркаса пи-связей [с образованием N-N (pi), разрывом N-O (pi)]. Заключительный этап – образование тройной связи азот-азот, сопровождающееся вытеснением воды ( Шаг 4 ).
Будучи довольно нестабильными (и потенциально взрывоопасными), соли диазония обычно не выделяют (относительно безопасно обращаться с тетрафторборатными солями в виде твердых веществ, но это все). После образования их обычно сразу же обрабатывают соответствующим реагентом по пути к желаемому продукту.
После образования их обычно сразу же обрабатывают соответствующим реагентом по пути к желаемому продукту.
Стоит упомянуть еще одну последнюю реакцию солей диазония. Удивительно много красителей в нашем повседневном опыте являются производными диазобензол , основная структура которого представляет собой две молекулы бензола, соединенные двойной связью азот-азот. См., например, эту статью об азокрасителях . Желтый, красный и оранжевый — обычные цвета азокрасителей.
Азокрасители получают в результате реакции богатого электронами ароматического компонента с солью диазония. Только богатые электронами ароматические соединения являются достаточно хорошими нуклеофилами, чтобы атаковать соли диазония.
Проверьте себя!
(Дополнительно) Ссылки и дополнительная литература
- Ueber die Ersetzung der Amidgruppe durch Хлор в ароматических веществах
Bergot. 1884 17 (2), 1633-1635
1884 17 (2), 1633-1635
Он пытался синтезировать фенилацетилен, соединив хлорид бензолдиазония и ацетилид меди, и вместо этого получил хлорбензол. - Ueber die Ersetzung der Amid-gruppe durch Chlor, Brom und Cyan в ароматических веществах
Traugott Sandmeyer
Ber. 1884 17 (2), 2650-2653
DOI: 10.1002/cber.188401702202
Зандмейер обобщает реакцию, включив в нее синтез бромбензола и CuCN и CuCN. - Реакция Сандмейера.
Герберт Х. Ходжсон
Химические обзоры 1947, 40 (2), 251-277
DOI : 10.1021/cr60126a003
Это старый обзор, полезный, если вы хотите найти некоторые оригинальные ссылки на эту химию. - Über flavortische Fluorverbindungen, I.: Ein neues Verfahren zu ihrer Darstellung
Günther Balz, Günther Schiemann
Ber. 1927 , 60 (5), 1186-1190
1927 , 60 (5), 1186-1190
DOI : 10.1002/cber.19270600539
. который первым описал реакцию. - The Mechanism of the Sandmeyer and Meerwein Reactions
Jay K. Kochi
Journal of the American Chemical Society 1957, 79 (11), 2942-2948
DOI : 10.1021/ja01568a066
Kochi был выдающимся физико-химиком-органиком в 20 -м -м веке. В этой статье он исследует механизм реакции Зандмейера, предоставляя дополнительные доказательства того, что она протекает через промежуточный арильный радикал. - Radical reactions of arenediazonium ions: An easy entry into the chemistry of the aryl radical
Carlo Galli
Chemical Reviews 1988, 88 (5), 765-792
DOI : 10.1021/cr00087a004
This обзор охватывает результаты различных исследований механизма реакции Зандмейера и родственных реакций — предполагается, что они проходят через промежуточные соединения арильных радикалов.
- Исследование двухстадийности реакции Зандмейера
Карло Галли
Хим. Soc., Perkin Trans. 2 , 1981 , 1459-1461
DOI : 10.1039/P29810001459
Роль солей Cu в реакции Зандмейера заключается в передаче электрона промежуточному арильному катиону с образованием арильного радикала. Если это так, то другие соли и соединения металлов (например, ферроцен) должны быть способны восстанавливать соли диазония, и это рассматривается здесь. - Дезаминирование фосфорноватистой кислотой солей диазония в оксиде дейтерия
Эллиот Р. Александр и Роберт Э. Бердж младший
Журнал Американского химического общества 1950, 72 (7), 3100-3103
DOI : 10.1021/ja01163A082 DOI : 10.1021/ja01163A082 . соли с H 3 PO 3 могут показаться бесполезной реакцией, в этой статье показано очень полезное применение – если вы сделаете это в D 2 O, вы сможете получить ipso -дейтерирование! - Простое получение фенолов из ионов диазония путем образования и окисления арильных радикалов солями меди
Теодор Коэн, Альберт Г. Дитц-младший, и Джейн Р. Мизер
Дитц-младший, и Джейн Р. Мизер
Журнал органической химии 1977, 42 (12), 2053-2058
DOI : 10.1021/1043A00 39313A00 3A. Во введении к этой статье говорится, что превращение ионов арилдиазония в фенолы просто на бумаге, но не обязательно на практике. Для подавления побочных реакций, таких как азосочетание, требуется высокая кислотность. Использование солей Cu для этой реакции также обеспечивает более чистые реакции, более высокие выходы и упрощенную обработку. - Mechanism of formation of aryl fluorides from arenediazonium fluoborates
Gardner Swain and Randall J. Rogers
Journal of the American Chemical Society 1975, 97 (4), 799-800
DOI : 10.1021 /ja00837a019
Элегантное кинетическое исследование для определения механизма реакции Бальца-Шимана. Из-за нечувствительности распределения продукта к избытку BF 3 предполагается, что фторбензол образуется путем прямого захвата из BF 4 – интермедиатом Ar + , образующимся при дедиазонировании.

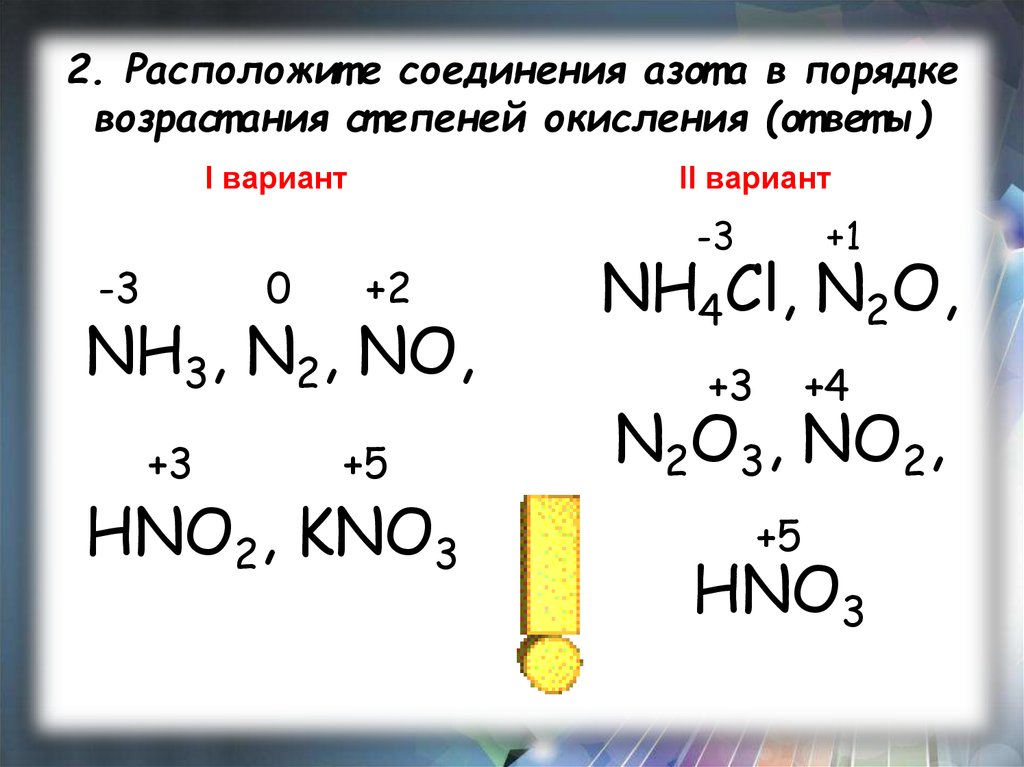
 Ответ: 2.
Ответ: 2. Этому значению соответствует соединение с формулой K 2 S — сульфид калия. Ответ: 3.
Этому значению соответствует соединение с формулой K 2 S — сульфид калия. Ответ: 3.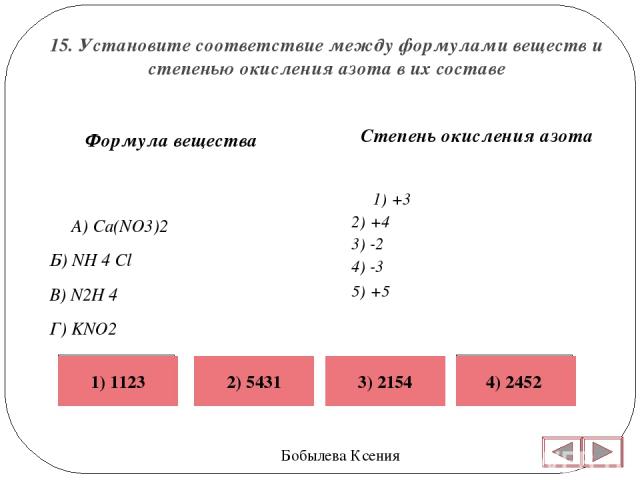 Этот аргумент позволяет исключить и ответ 1, так как в нём первое вещество — всё тот же фторид азота. Ответ: 3.
Этот аргумент позволяет исключить и ответ 1, так как в нём первое вещество — всё тот же фторид азота. Ответ: 3. Ответ: 1.
Ответ: 1. Хлорид аммония — вещество ионного строения, образованное за счёт ковалентной полярной и ионной связей.
Хлорид аммония — вещество ионного строения, образованное за счёт ковалентной полярной и ионной связей. Элементы расположены в порядке возрастания электроотрицательности в ряду
Элементы расположены в порядке возрастания электроотрицательности в ряду Наибольшую степень окисления марганец имеет в соединении
Наибольшую степень окисления марганец имеет в соединении Одинаковую степень окисления азот проявляет в веществах, указанных в РЯДУ:
Одинаковую степень окисления азот проявляет в веществах, указанных в РЯДУ: Из перечисленных элементов наиболее электроотрицательным является
Из перечисленных элементов наиболее электроотрицательным является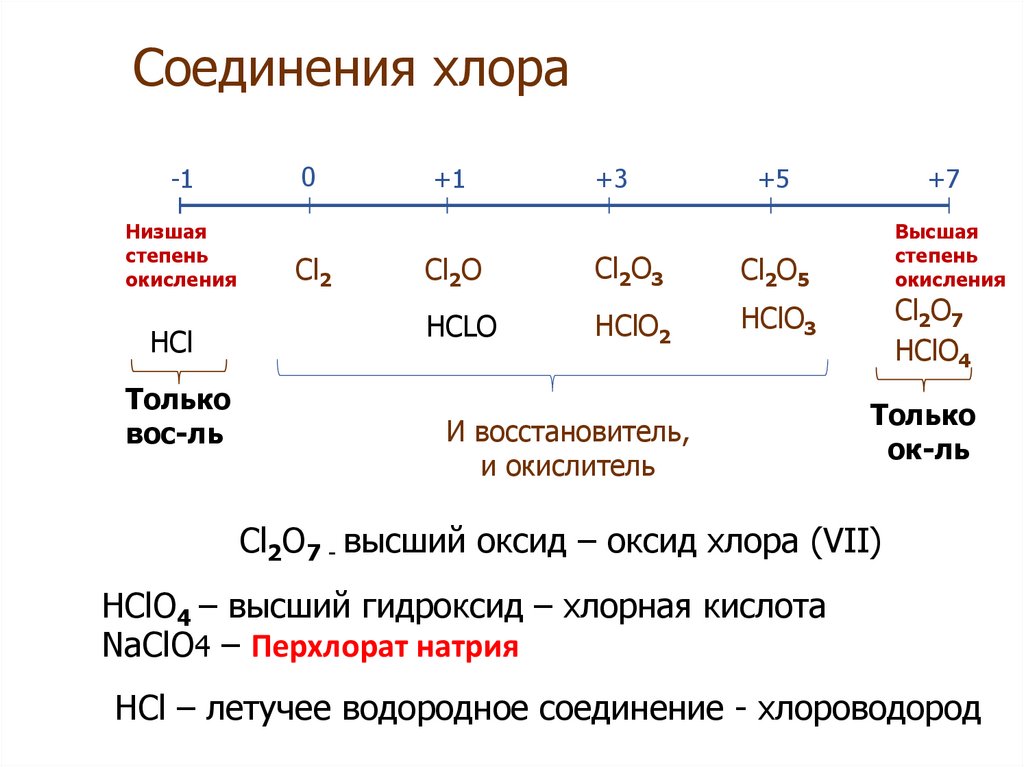 Наиболее электроотрицательным элементом является
Наиболее электроотрицательным элементом является Степень окисления + 3 хром имеет в соединении
Степень окисления + 3 хром имеет в соединении
 1884 17 (2), 1633-1635
1884 17 (2), 1633-1635  1927 , 60 (5), 1186-1190
1927 , 60 (5), 1186-1190 
 Дитц-младший, и Джейн Р. Мизер
Дитц-младший, и Джейн Р. Мизер