с реакцией на несколько элементов —
Цель этой статьи — объяснить, как nh4 + hcl происходит реакция, как образуется продукт, как достигается балансировка и как проводить титрование данных смесей.
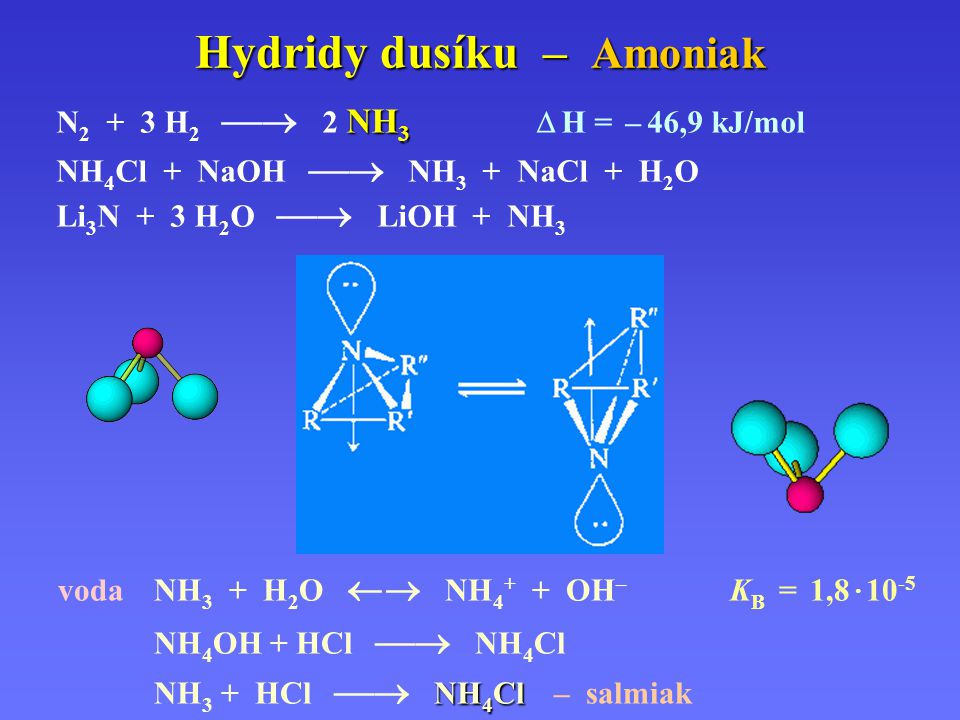
Реакция между аммиаком (NH3) и соляная кислота (HCl) в присутствии воды выглядит следующим образом: NH3 + HCl → NH4+ + Кл—, это реакция в растворе или на водной основе. Если мы подумаем об этом, в газовой фазе он производит NH3 + HCl → NH4Cl (дым хлоридов аммония).
Что происходит, когда Nh4 взаимодействует с HCl?При взаимодействии аммиака с хлористым водородом образуются пары хлористого аммония. Реакция выглядит следующим образом: NH3 (г) + HCl(Г) → НГ4Cl(S) (когда дает осесть в стакане).
Что за реакция nh4 + hcl?NH3 + HCl → NH4Cl представляет собой реакцию сочетания (реакция синтеза), аммиак (NH3) реагирует с хлористым водородом (HCl), или мы можем сказать, что хлористый водород дает продукт в виде хлорида аммония (NH4Cl), который находится в виде паров в газовой фазе.
На этапе решения, NH3 + HCl → NH4+ + Кл—. Это кислотно-щелочная реакция, которая следует теории кислотно-щелочной реакции Бренстеда-Лоури, поэтому, согласно теории Бренстеда-Лоури, сильная кислота имеет сопряженное основание и наоборот.
Итак, HCl имеет ионы хлора в качестве сопряженного кислотно-основного, а аммиак имеет ионы аммония в качестве сопряженной кислотно-основной. Перенос ионов водорода из кислоты (HCl), на базу (NH3) известен как кислотно-основная реакция.
Таким образом, мы можем сказать, что он ведет себя как кислотно-щелочная реакцияи комбинированная реакция, реакция нейтрализации.
При балансировке химических уравнений необходимо согласовать количество атомов каждого реагента и продукта. Хлороводород (HCl), одна из самых сильных кислот, реагирует с аммиаком (Nh4), одним из самых слабых оснований. Ниже приводится уравнение реакции:
NH3 (г) + HCl(Г) → НГ4Cl(S)
Шаг: 1 Запишите несбалансированное химическое уравнение:NH3 + HCL→ NH4Cl (несбалансированное уравнение).
Шаг: 2 Создайте таблицу:Подсчитайте элементы, присутствующие с обеих сторон (реагент и продукт), составив таблицу.
NH3 + HCl (сторона реагента), NH4Cl (сторона продукта).
| Имя элемента или символ | Реактивный элемент | Элемент продукта |
| Азот (N) | 1 | 1 |
| Водород (Н) | 4 | 4 |
| Хлор (Cl) | 1 | 1 |
Как видно из таблицы, здесь есть элемент Reactant = и элемент Product, это показывает, что реакция уравновешена.
Итак, результат Реагент = Продукт наличие коэффициента 1: 1: 1.
Шаг: 4 Уравнение баланса:Таким образом, сбалансированная реакция выглядит следующим образом:
NH3 + HCl → НГ4Cl
Является ли nh4 + hcl полной реакцией?Да, это полная реакция, и это происходит, когда два разных атома или молекулы объединяются, образуя новое соединение или молекулу. В большинстве случаев реакции синтеза являются экзотермическими, что означает выделение энергии.
NH3 + HCl → НГ4Cl
Nh4+hcl=nh5clNH3 (Аммиак) + HCl (хлороводород) → NH4Cl (хлорид аммония) представляет собой комбинированную реакцию (реакцию синтеза). Как правило, реакции синтеза являются экзотермическими и выделяют энергию.
A.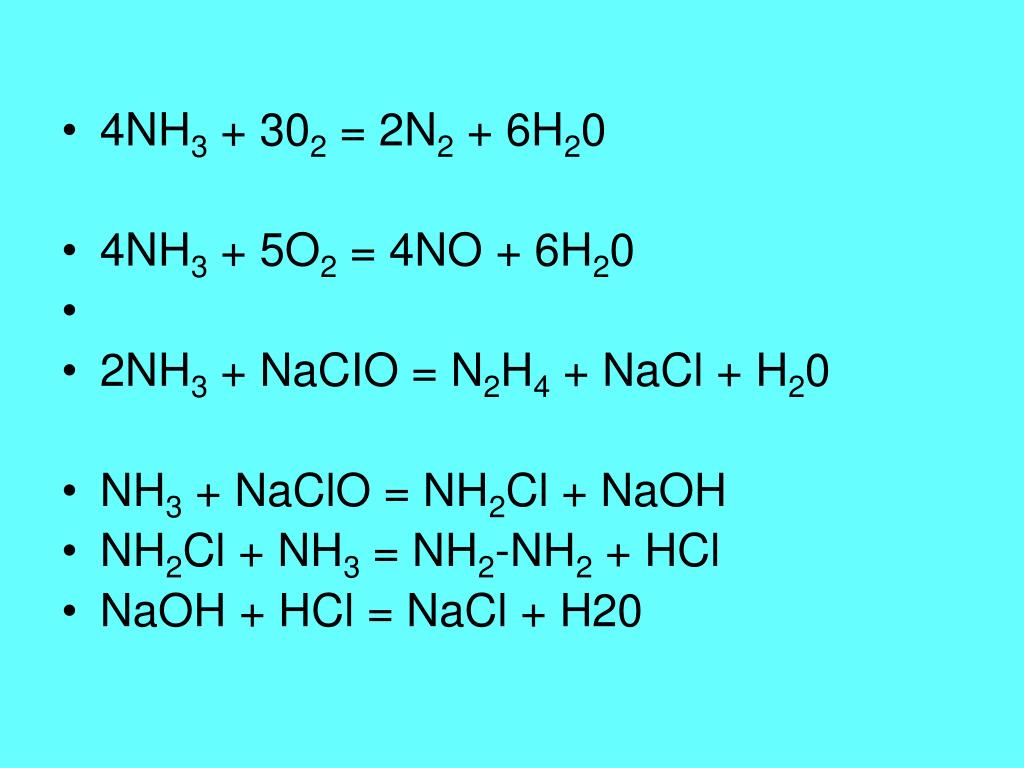 Какой тип реакции имеет Nh4+hcl?
Какой тип реакции имеет Nh4+hcl?Nh4+hcl является комбинированной реакцией, она также показывает кислотно-основную реакцию. В фазе раствора это кислотно-щелочная реакция, которая следует теории кислотно-щелочной реакции Бренстеда-Лоури.
Сильная кислота имеет сопряженное основание, и наоборот, согласно теории Бренстеда-Лоури. NH3 + HCl → NH4+ + Кл—
Б. Что является продуктом реакции nh4 + hcl?NH3 + HCl → НГ4Cl, Аммиак (газообразное состояние) реагирует с хлористым водородом (газообразное состояние), давая продукт в виде твердого хлорида аммония.
C. Шаги по балансировке химического уравненияНиже приведены шаги для балансировки (nh4 + hcl)реакционная смесь:
- Запишите несбалансированное химическое уравнение: NH3 + HCl→ NH4Cl
- Сделать таблицу:
| Имя элемента или символ | Реактивный элемент | Элемент продукта |
| Азот (N) | 1 | 1 |
| Водород (Н) | 4 | 4 |
| Хлор (Cl) | 1 | 1 |
- Подсчитайте элементы, присутствующие с обеих сторон (реагент и продукт), составив таблицу.

- Nh4 + HCl (сторона реагента), Nh5Cl (сторона продукта).
- Как видно из таблицы, здесь есть элемент Reactant = и элемент Product, это показывает, что реакция уравновешена. Итак, результирующий коэффициент равен 1:1:1.
- Таким образом, сбалансированная реакция выглядит следующим образом: NH3 + HCl → НГ4Cl.
Метод кислотно-щелочного титрования включает нейтрализацию кислоты или основания известной концентрацией основания или кислоты для определения их концентрации (молярность неизвестна).
Возьмем пример титрования Nh4 vs HCL, здесь известна концентрация одного и узнают другие. Сначала напишите сбалансированное химическое уравнение: NH3 + HCl → НГ4Cl.
Используемый аппаратХимический стакан (250 мл-1, 100 мл-3), пипетка, зажим для бюретки, резиновая трубка со шприцем, прикрепленным к пипетке, подставка для смазки с карандашом, сухие и чистые стаканы, колба 250 мл.
Метиловый красный — индикатор, используемый для титрования слабоосновного аммиака сильнокислым хлороводородом. Таким образом, эта смесь имеет рН < 7, что показывает, что индикатор метиловый красный дает хороший результат.
Процедура:- Приготовьте раствор соляной кислоты в колбе на 250 мл.
- Разбавьте раствор 100 мл дистиллированной воды.
- Смешайте пару капель раствора метилового красного со смесью.
- Цвет должен измениться в первый раз после титрования раствора аммония.
- Получите показания, повторив эксперимент 3-4 раза.
Как следует из названия, буферные растворы представляют собой смеси слабых кислот и их солей или слабых оснований и их солей. Они устойчивы к изменению рН, вызванному добавлением небольшого количества кислоты или основания.
Добавление к раствору слабой кислоты и ее соли создает буферный раствор. Да, Nh4 и Nh5Cl являются буферными растворами. Буферная система может быть записана как соль/кислота или сопряженное основание/кислота в целом, например NH.3/ NH4+
B. Уравнение буфера Nh4 и HClБуферные растворы готовят путем смешивания хлорида натрия со слабым кислоты в равных количествах или наоборот. Северная Каролина3 и NH4Cl представляет собой буферный раствор, когда NH3(водный) реагирует с HCl (водн.) дает NH4Cl(водный) раствор.
Уравнение буфера:У нас есть стехиометрический раствор аммиака; мы сразу добавляем соляную кислоту, которая протонирует аммиак, и теперь у вас есть буферная система с аммиаком и хлоридом аммония.
NH3(водн.)+HCl(водн.)→NH4Cl (водн.)
NH3+H2О⇋ НХ4+ + OH—
NH4Cl → NH4+ + Кл—
При проведении титрования слабое основание/сильная кислота или сильная кислота/слабое основание и построении кривой первый участок титрования часто называют буферным участком.
Nh4 +hcl белый дымАммиак — слабое основание, образующее хлорид аммония при взаимодействии с HCl. Однако для осуществления этой реакции требуется влага. В результате при контакте с воздухом они объединяются, образуя плотные пары хлорида аммония.
Nh4+cl2=ncl3+hclПри взаимодействии аммиака с хлором образуются трихлорид азота (NCl3) и пары хлороводорода. Уравнение реакции выглядит следующим образом: NH3 + 3 кл2= NCl3 +3 НСl.
Уравнение реакции выглядит следующим образом: NH3 + 3 кл2= NCl3 +3 НСl.
Это окислительно-восстановительная реакция, NH3 + 3 кл2= NCl3 +3 НСl. когда газообразный хлор (Cl2) реагирует с аммиаком, присутствующим в избытке, это приводит к хлориду аммония (Nh5Cl) и газообразному азоту. Реакция поясняется ниже:
3 кл2 + 8 НХ3 = 6 НХ4Кл + Н2(грамм).
Однако, если мы реагируем с избытком сильной кислоты, треххлористый азот (NCl3) и пары хлористого водорода (HCl). Реакция ниже: —
В этой реакции хлор восстанавливается и окисляется. В результате имеем реакция диспропорционирования.
В результате имеем реакция диспропорционирования.
NH3 + 3 кл2= NCl3 +3 HCl, при взаимодействии избыточного количества хлора с аммиаком образуется треххлористый азот и пары хлористого водорода.
Треххлористый азот (NCl3) является мощным катализатором в этой ситуации.
C. Список шагов для балансировкиНиже приведены шаги для балансировки уравнения:
- Запишите неуравновешенное уравнение, NH3 + Кл2= NCl3 + HCl
- Разделите один и тот же элемент в реагенте и продукте из левой и правой частей уравнения, например Реагент = NH.3 + Кл2, а Продукт = NCl3 + HCl.

- Составьте диаграмму или таблицу, чтобы разделить элементы.
| Имя элемента | Реактивный элемент | Элемент продукта |
| N | 1 | 1 |
| H | 3 | 1 |
| Cl | 2 | 4 |
- Чтобы уравнять H и Cl, мы начнем с Cl и используем 3 в качестве коэффициента для Cl.2. NH3 + 3 кл2= NCl3 + HCl
- Теперь, когда на стороне реагента имеется 6 атомов Cl, используйте 3 в качестве значения коэффициента для HCl. Северная Каролина3 + 3 кл2= NCl3 +3 соляная кислота
- Уравнение теперь является сбалансированным химическим уравнением.

- NH3 + 3 кл2= NCl3 +3 соляная кислота
Аммиак является слабым основанием, то есть он лишь частично ионизируется в воде. Соляная кислота является сильной кислотой, которая полностью ионизирует. Аммиак должен реагировать с этой кислотно-щелочной реакцией нейтрализации в водном растворе.
Ниже приведена процедура:
А. Какой тип реакции nh4(водн.) + HCl(водн.)?Аммиак является слабым основанием, а это означает, что он лишь частично ионизируется в воде. Соляная кислота является сильной кислотой и полностью ионизируется. Водный раствор необходим для того, чтобы аммиак прореагировал с этой реакцией кислотно-щелочной нейтрализации.
Nh4(водн.) + HCl(водн.) → Nh5Cl(водн.) представляет собой кислотно-щелочную реакцию нейтрализации.
Б. Что является продуктом этой реакции?Nh4(водн. ) + HCl(водн.) → Nh5Cl(водн.), когда аммиак в виде водного раствора реагирует с соляной кислотой в водной среде с образованием хлорида аммония в виде осадка на дне стаканов, который находится в виде соль.
) + HCl(водн.) → Nh5Cl(водн.), когда аммиак в виде водного раствора реагирует с соляной кислотой в водной среде с образованием хлорида аммония в виде осадка на дне стаканов, который находится в виде соль.
Таким образом, продуктом является соль, а именно хлорид аммония, имеющий химическую формулу Nh5Cl(водн.).
C. Список шагов для балансировкиНиже приведены шаги для балансировки уравнения:
- Запишите несбалансированное уравнение в водной форме: Nh4(водн.) + HCl(водн.) → Nh5Cl(водн.).
- Разделите один и тот же элемент в реагенте и продукте из левой и правой частей уравнения, например Реагент = Nh4 (водн.) + HCl (водн.), а Продукт = Nh5Cl (водн.).
- Составьте диаграмму или таблицу, чтобы разделить элементы.
| Имя элемента | Реактивный элемент | Элемент продукта |
| N | 1 | 1 |
| H | 4 | 4 |
| Cl | 1 | 1 |
- Из таблицы видно, что Реагент = Продукт, значит, уравнение сбалансировано, поэтому нет необходимости изменять уравнение.

NH3 (г)+HCl(Г)представляет собой комбинированную реакцию, Итак, Когда аммиак (Nh4) реагирует с соляной кислотой (HCl), образуется соль. В этой реакции Nh4 является слабым основанием, которое принимает протон от HCl с образованием ионов аммония и Cl.
Хлорид аммония представляет собой соль, образующуюся при соединении этих двух ионов.
А. Что является продуктом реакции Nh4(г)+hcl(г)?Nh3 (г)+HCl(Г)→NH4Cl(S), Аммиак (газообразное состояние) реагирует с хлористым водородом (газообразное состояние) с образованием продукта в виде твердого хлорида аммония.
B. Шаги по балансировке химического уравненияНиже приведены шаги, чтобы сбалансировать Nh3 (г)+HCl(Г) реакционная смесь:
- Запишите несбалансированное химическое уравнение: NH3 (г)+HCl(Г)→NH4Cl(S)
- Сделать таблицу:
| Имя элемента или символ | Реактивный элемент | Элемент продукта |
| Азот (N) | 1 | 1 |
| Водород (Н) | 4 | 4 |
| Хлор (Cl) | 1 | 1 |
- Подсчитайте элементы, которые присутствуют с обеих сторон (реагент и продукт), составив таблицу.
 3 (г)+HCl(Г) (сторона реагента), NH4Cl(S) (сторона продукта).
3 (г)+HCl(Г) (сторона реагента), NH4Cl(S) (сторона продукта). - Как мы видим из таблицы, Реактивный элемент = и a Элемент продукта, это показывает, что реакция уравновешена. Итак, результирующий коэффициент равен 1:1:1.
- Таким образом, сбалансированная реакция выглядит следующим образом: NH3 (г)+HCl(Г)→NH4Cl(S).
В присутствии воды реакция между аммиаком (Nh4) и соляной кислотой (HCl) выглядит следующим образом:
Nh4 + HCl = Nh5+ + Кл–.
Теория Бренстеда-Лоури используется для объяснения этой кислотно-щелочной реакции.
LAS 5000XD, measurement of Nh4 HCl HF CO O2 | Emissions
Skip to contentThe In-Situ TDLS gas analyzer has been designed for meeting the requirements of a large range of CEMS and Process applications.
Thanks to ClearPath, interference of relative humidity, O2 or CO2 is removed in purging areas.
LAS 5000XD quantity
Add to Compare
- FEATURES & BENEFITS
- MAIN APPLICATIONS
- TECHNICAL SPECIFICATIONS
- TECHNICAL DATA
- DOWNLOADS
KEY FEATURES
- New Embedded ClearPath functionality
- Highly sensitive and selective measurement
- High signal-to-noise ratio
- No measurement drift
- Response time 1 s
- Large dynamic range from ppm to %
- Real-time communication between Transmitter (Tx) and Receiver (Rx)
- Robust, ready for Ex Zone II (certification to come)
💡 CLEARPATH
- Interference of relative humidity, O2 or CO2 is removed in purging areas.

Operator’s benefits:
- No need for N2 or dry air purge
- High accuracy of O2 measurement
- High accuracy of H2O measurement
- High accuracy of CO2 measurement
CUSTOMER BENEFITS
- Low maintenance and cost of ownership
- No need for N2 or dry air purge: Oil & dust free air instrument is enough
- Process optimization leading to reduction of operating costs
Application examples:
A WIDE RANGE OF APPLICATIONS FOR CEMS AND PROCESS
- Ammonia slip control (DeNox)
- Process and combustion control
- HF emission control in aluminum plant
- HCl/SO2 abatement control
- Ethylene cracking furnace control
- HCl level in semiconductor production
- Ammonia concentration control in pet food, fertilizer plants, etc.
| Measurable parameters | |||
|---|---|---|---|
| Pollutant | Range | ||
| NH3 + H2O | 0–10 ppm / 0–5000 ppm + 0–5% / 0–50% | ||
| HF | 0–3 ppm / 0–500 ppm | ||
| CO ppm + H2O | 0-50 ppm / 0-1% + 0-10% / 0-50% | ||
| CO% + H2O | 0-1% / 0-100% + 0-10% / 0-50% | ||
| CO% + CO2 | |||
| CO2 + H2O | 0-1% / 0-100% + 0-10% / 0-50% | ||
| O2 | 0-1%/ 0-100% | ||
| HCl + H2O* | 0-10 ppm / 0-5000 ppm + 0-10% / 0-50% (*gas temperature must be above 150°C). | ||
| Other gases | Available upon request: CH4, H2S, H2, NO… | ||
| Technical Specifications | |
|---|---|
| Technology | ADLAS (Advanced Detection Laser Absorption Spectroscopy) • Optimized Opto-Mechanical Design • High Speed Low-Drift Electronics • Powerful Signal Processing and Algorithm • Independent Spectroscopy Technique |
| Lower Detection Limit | < 1% of FS |
| Response Time (0–90%) – Short | 1 s |
| Lack of fit/Linearity | ≤ ±1% |
| Flue Gas Temperature (°C max) NH3 + H2O / HCl + H2O / HF CO + H2O / O2 / CO + CO2 | +400°C (Depends on the concentration range) +1200°C (Depends on the concentration range) |
| Flue Gas Pressure | 2 bars max (absolute) |
| Display on Tx | 4 x 20 LCD |
| Communication | Modbus RTU (RS485) / Ethernet (RJ45) – Web server |
| Power supply type | + 24 V DC, ripple and noise 50 mV |
| Power consumption | 15 W (warm-up) < 15 W in standard use |
| Recommended T° (ambient) | -20°C to +55°C |
| IP index Tx & Rx enclosures | IP65 |
| Flange specification requirement on stack | DN50 PN16, 2’’ – 150 lbs, Class 150 |
| Flange material | SS 316 L |
| Air consumption (main purge – necessary) | 5-50 L/min (to adjust according to site conditions) (dry and oil free, ISO 8573. 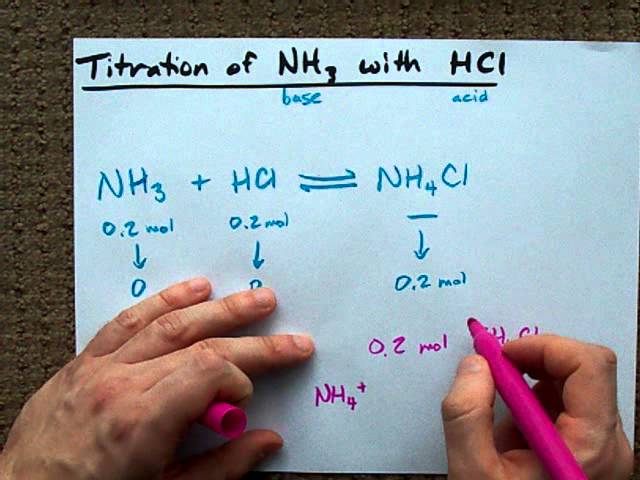 1 Class 2-3) 1 Class 2-3) |
| Air consumption (secondary purge – recommended) | 2-3 L/min (dry and oil free, ISO 8573.1 Class 2-3) |
| Stack diameter compatibility | From 0.5 to 20 m |
Note – The technical specifications are defined in the following conditions: Gas temperature = 25°C / gas
pressure = 1013 mbar / pathlength = 100 cm / ambient temperature = 25 °C
| Options | |
|---|---|
| Junction Box | Analog I/O (2 x 4-20 mA/2 x 4-20 mA) – Digital Output (2 relays) |
| Thermal Shield | Thickness: 20 mm (100°C<Tp<300°C) ; 40 mm (300°C<Tp<600°C) ; 60 mm (Tp above 600°C). |
| Audit Cell | |
| Inline Cell | |
| Alignment Tool | |
| Weather protection covers | |
Related products
Produits apparentés
Verwandte Produkte
Prodotti correlati
Productos relacionados
相关产品
Produtos relacionados
Сопутствующие товары
MIR 9000P
The MIR 9000P belongs to the new generation of ENVEA gas monitors, showcasing eco-design, IoT and on board intelligence.

MoreEn savoir +MehrLeggi di piùMás阅读更多MaisЧитать далее
€0.00
CompareComparerConfrontaProdukt vergleichen比较СравнитьCompareCompara
DM 170
The DM 170 is designed to comply with the TÜV suitability testing scheme to EN 15267 and for measuring dust concentrations in a wide range of industrial applications.
MoreEn savoir +MehrLeggi di piùMás阅读更多MaisЧитать далее
€0.00
CompareComparerConfrontaProdukt vergleichen比较СравнитьCompareCompara
AirFlow P
Measurement of the volume flow, especially in dusty applications. Easy installation on existing ducts, no Venturi or similar conversions are required. Can be used in environments with low dust loads or in harsh conditions with e. g. high dust loads.
MoreEn savoir +MehrLeggi di piùMás阅读更多MaisЧитать далее
€0.
 00
00CompareComparerConfrontaProdukt vergleichen比较СравнитьCompareCompara
LEAK LOCATE 662
The LEAK LOCATE 662 is a digitally networked, multi-compartment baghouse monitoring system providing remote observation of the condition of bag and cartridge filters. Condition Monitoring
MoreEn savoir +MehrLeggi di piùMás阅读更多MaisЧитать далее
€0.00
CompareComparerConfrontaProdukt vergleichen比较СравнитьCompareCompara
QUOTEDEVISANGEBOTOFFERTACOTIZACIÓN报价COTAÇÃOЗАПРОС ЦЕНЫCONTACTCONTACTKONTAKTCONTATTICONTACTO联系我们CONTATOКОНТАКТЫ
ALL PRODUCTSTOUS LES PRODUITSALLE PRODUKTETUTTI I PRODOTTITODOS LOS PRODUCTOS所有产品TODOS OS PRODUTOSВСЕ ПРОДУКТЫ
Go to Top
7 фактов о реакции Nh4 + Hcl: с несколькими элементами —
смеси.
Реакция между аммиаком (NH 3 ) и соляной кислотой (HCl) в присутствии воды выглядит следующим образом: раствор или реакция на водной основе. Если мы подумаем об этом, в газовой фазе он производит NH 9.0006 3 + HCl → NH 4 Cl (дым хлорида аммония).
Если мы подумаем об этом, в газовой фазе он производит NH 9.0006 3 + HCl → NH 4 Cl (дым хлорида аммония).
Когда аммиак реагирует с хлористым водородом, образуются пары хлористого аммония. Реакция протекает следующим образом: NH 3(г) + HCl (г) → NH 4 Cl (т) (когда дают осесть в стакане).
Какая реакция nh4 + hcl?НХ 3 + HCl → NH 4 Cl представляет собой комбинированную реакцию (реакцию синтеза), аммиак (NH 3 ) реагирует с хлористым водородом (HCl), или мы можем сказать, что хлористый водород дает продукт в виде хлорида аммония (NH 4 Cl ), который находится в виде дыма в газовой фазе.
NH 3 + HCL → NH 4 CL от Wikimedia на этапе раствора, NH 3 9007 + HCL → NH 4 + HCl → NH 4 + HCl → NH 4 0007 + HCl → NH 4 0007 + HCl → NH 40007 + HCl → NH 40007 + HCl → NH 0020 + + Кл − . Это кислотно-щелочная реакция, которая следует теории кислотно-основных реакций Бренстеда-Лоури, поэтому, согласно теории Бренстеда-Лоури, сильная кислота имеет сопряженное основание и наоборот.
Это кислотно-щелочная реакция, которая следует теории кислотно-основных реакций Бренстеда-Лоури, поэтому, согласно теории Бренстеда-Лоури, сильная кислота имеет сопряженное основание и наоборот.
Итак, HCl имеет ионы хлора в качестве сопряженного кислотно-щелочного соединения , а аммиак имеет ионы аммония в качестве сопряженного кислотно-основного соединения. Перенос ионов водорода от кислоты (HCl) к основанию (NH 3 ) известна как кислотно-щелочная реакция.
Таким образом, мы можем сказать, что она ведет себя как кислотно-основная реакция и комбинированная реакция , реакция нейтрализации .
Как сбалансировать nh4 + hcl? При балансировке химических уравнений количество атомов каждого реагента и продукта должно совпадать. Хлороводород (HCl), одна из самых сильных кислот, реагирует с аммиаком (Nh4), одним из самых слабых оснований. Вот уравнение реакции:
Вот уравнение реакции:
NH 3 (G) + HCL (G) → NH 4 CL (S)
Шаг: 1 Запишите несбалансированное химическое уравнение:нм 3 +. HCL→ NH 4 Cl (несбалансированное уравнение) .
Шаг:2 Составьте таблицу:Подсчитайте элементы, присутствующие с обеих сторон (со стороны реагента и со стороны продукта), составив таблицу.
NH 3 + HCl (сторона реагента), NH 4 Cl (сторона продукта).
| Element name or Symbol | Reactant element | Product element |
| Nitrogen(N) | 1 | 1 |
| Hydrogen( З) | 4 | 4 |
| Хлор (CL) | 1 | 1 |
 элемент Reactant= и элемент Product, это показывает, что реакция уравновешена.
элемент Reactant= и элемент Product, это показывает, что реакция уравновешена. Итак, результат Реагент = Продукт с коэффициентом 1:1:1 .
Шаг:4 Уравнение баланса:Таким образом, сбалансированная реакция выглядит следующим образом:
NH 3 + HCl → NH 4 Cl
hcl + nhcl 90Да, это полная реакция, и она происходит, когда два разных атома или молекулы объединяются, образуя новое соединение или молекулу. В большинстве случаев реакции синтеза являются экзотермическими, что означает выделение энергии.
НХ 3 + HCL → NH 4 CL
NH4+ HCL = NH5CL NH 3 (аммония)+ HCL (водород Хлорид) → NH 4 Cl (Ammonium CHLIDE) AMMOMIMIMIME) AMMONIMIMIN комбинированная реакция (реакция синтеза). Как правило, реакции синтеза являются экзотермическими и выделяют энергию.
Как правило, реакции синтеза являются экзотермическими и выделяют энергию.
Nh4+hcl является комбинированной реакцией, она также показывает Кислотно-основную реакцию. В фазе раствора это кислотно-щелочная реакция, которая следует теории кислотно-щелочной реакции Бренстеда-Лоури.
Сильная кислота имеет сопряженное основание, и наоборот, согласно теории Бренстеда-Лоури. NH 3 + HCL → NH 4 + + CL —
B. What Procect of NH4 + HL Recement? NH 3 + HCl → NH 4 90007 Cl, Аммиак (газообразное состояние) реагирует с хлористым водородом (газообразным состоянием) с образованием продукта в виде твердого хлорида аммония.
Следующие шаги для баланса ( NH4 + HCL) Реакционная смесь:
- Запишите несоблаченную химическую уравнение: nh 5559 . Отказ. 3 + HCl→NH 4 Cl
- Make a Table:
| Element name or Symbol | Reactant element | Product element |
| Nitrogen(N) | 1 | 1 |
| Hydrogen(H) | 4 | 4 |
| Chlorine(Cl) | 1 | 1 |
- ) Подсчитайте элементы, присутствующие в таблице как побочный продукт (реактивное вещество) с обеих сторон.

- Nh4 + HCl (сторона реагента), Nh5Cl (сторона продукта).
- Как видно из таблицы, здесь есть элемент Реагент = и элемент Продукт, это показывает, что реакция уравновешена. Итак, результирующий коэффициент равен 1:1:1.
- Таким образом, сбалансированная реакция выглядит следующим образом: NH 3 + HCl → NH 4 Cl.
Метод кислотно-основного титрования включает нейтрализацию кислоты или основания известной концентрацией основания или кислоты для определения их концентрации (молярность неизвестна).
Возьмем пример титрования Nh4 против HCL, здесь известна концентрация одного и узнают другие. Сначала напишите сбалансированное химическое уравнение: NH 3 + HCl → NH 4 Cl.
Стакан (250 мл-1, 100 мл-3), пипетка, зажим для бюретки, резиновая трубка со шприцем, прикрепленным к пипетке, подставка для смазки с карандашом, сухие и чистые стаканы, колба на 250 мл.
Индикатор титрования Nh4+hclМетиловый красный — индикатор, используемый для титрования слабого основания аммиака сильнокислым хлористым водородом. Таким образом, эта смесь имеет рН < 7, что показывает, что индикатор метиловый красный дает хороший результат.
Процедура:- Приготовьте порцию раствора соляной кислоты в колбе на 250 мл.
- Разбавьте раствор 100 мл дистиллированной воды.
- Смешайте пару капель раствора метилового красного со смесью.
- Цвет должен измениться в первый раз после титрования раствора аммония.
- Получите показания, повторив эксперимент 3-4 раза.

Как следует из названия, буферные растворы представляют собой смеси слабых кислот и их солей или слабых оснований и их солей. Они устойчивы к изменению рН, вызванному добавлением небольшого количества кислоты или основания.
A. Является ли Nh4 и Nh5Cl буферным раствором?Добавление к раствору слабой кислоты и ее соли создает буферный раствор. Да, Nh4 и Nh5Cl — буферные растворы. Буферная система может быть записана как соль/кислота или сопряженное основание/кислота в целом, например NH 3 /NH 4 +
B. NH4 и HCL Buffer Уравнение Buffer Solution наоборот. NH 3 и NH 4 CL — буферное решение, когда NH 3 (AQ ) реагирует с HCL (AQ). 0020 4 Cl(водный) раствор.
0020 4 Cl(водный) раствор.
У нас есть стехиометрический раствор аммиака; мы сразу же добавляем соляную кислоту, которая протонирует аммиак, и теперь у вас есть буферная система с аммиаком и хлоридом аммония.
NH 3 (aq)+HCl (aq) → NH 4 Cl (aq)
NH 3 + H 2 O⇋ NH 4 + + OH —
NH 4 CL → NH 4 + + CL —
+ + CL —. при титровании сильной кислотой или сильной кислотой/слабым основанием и построении кривой первый участок титрования часто называют буферным участком.
Nh4 +hcl белый дым Аммиак — слабое основание, образующее хлорид аммония при реакции с HCl. Однако для осуществления этой реакции требуется влага. В результате при контакте с воздухом они объединяются, образуя плотные пары хлорида аммония.
В результате при контакте с воздухом они объединяются, образуя плотные пары хлорида аммония.
Трихлорид азота (NCl3) и пары хлороводорода образуются при реакции аммиака с хлором. Уравнение реакции выглядит следующим образом: NH 3 + 3 Cl 2 = NCl 3 3 HCl.
A. Какой тип реакции nh4+cl2?Это окислительно-восстановительная реакция, NH 3 + 3 Cl 2 = NCl 3 +3 HCl. когда газообразный хлор (Cl2) реагирует с аммиаком, присутствующим в избытке, это приводит к хлориду аммония (Nh5Cl) и газообразному азоту. The reaction is explained below:-
3 Cl 2 + 8 NH 3 = 6 NH 4 Cl + N 2 (г).
Однако, если мы реагируем с избытком сильной кислоты, треххлористый азот (NCl 3 ) и пары хлористого водорода (HCl). Реакция ниже:-
Хлор восстанавливается и окисляется в этой реакции. В результате имеем реакцию диспропорционирования .
B. Что является продуктом этой реакции?NH 3 + 3 CL 2 = NCL 3 +3 HCl, когда избыток Clorine Reacts с ammoni хлористого водорода.
Трихлорид азота (NCl3) является мощным ускорителем в этой ситуации.
C. Список шагов для балансаНиже приведены шаги для балансировки уравнения:
- . Запишите несбалансированное уравнение, NH 3 + CL 9000 2 + CL 2009 2 207207 = NCl 3 + HCl
- Разделите один и тот же элемент в реагенте и продукте из левой и правой частей уравнения, например Реагент = NH 3 + Cl 2 и Продукт = NCl 3 + HCl.

- Создайте диаграмму или таблицу, чтобы разделить элементы.
| Element name | Reactant element | Product element |
| N | 1 | 1 |
| H | 3 | 1 |
| Cl | 2 | 4 |
- To equalize H and Cl , мы начнем с Cl и используем 3 в качестве коэффициента для Cl 2 . NH 3 + 3 Cl 2 = NCl 3 + HCl
- Теперь, когда на стороне реагента имеется 6 атомов Cl, используйте 3 в качестве значения коэффициента для HCl.
 НХ 3 + 3 Cl 2 = NCl 3 +3 HCl
НХ 3 + 3 Cl 2 = NCl 3 +3 HCl - Уравнение теперь представляет собой сбалансированное химическое уравнение.
- NH 3 + 3 Cl 2 = NCl 3 +3 HCl
Ammonia is a weak основания, что означает, что он только частично ионизируется в воде. Соляная кислота является сильной кислотой, которая полностью ионизирует. Аммиак должен реагировать с этой кислотно-щелочной реакцией нейтрализации в водном растворе.
Процедура следующая:
A. Какой тип реакции nh4(водн.) + HCl(водн.)? Аммиак является слабым основанием, что означает, что он лишь частично ионизируется в воде. Соляная кислота является сильной кислотой и полностью ионизируется. Водный раствор необходим для того, чтобы аммиак прореагировал с этой реакцией кислотно-щелочной нейтрализации.
Nh4(водн.) + HCl(водн.) → Nh5Cl(водн.) представляет собой кислотно-основную реакцию нейтрализации.
B. Что является продуктом этой реакции?Nh4(водн.) + HCl(водн.) → Nh5Cl(водн.), Когда аммиак в виде водного раствора реагирует с соляной кислотой в водной среде с образованием хлорида аммония в виде осадка на дне стаканов, который в виде соли.
Таким образом, продукт представляет собой соль и представляет собой хлорид аммония, имеющий химическую формулу Nh5Cl(водн.).
C. Список шагов для балансировкиНиже приведены шаги для балансировки уравнения:
- Запишите несбалансированное уравнение в водной форме: Nh4(водн.) + HCl(водн.) → Nh5Cl(водн.).
- Отделите один и тот же элемент в реагенте и продукте от левой и правой частей уравнения, например, Реагент = Nh4 (водн.) + HCl (водн.) и Продукт = Nh5Cl (водн.
 ).
). - Создайте диаграмму или таблицу, чтобы разделить элементы.
| Название элемента | Реактивный элемент | Product element |
| N | 1 | 1 |
| H | 4 | 4 |
| Cl | 1 | 1 |
- Из таблицы видно, что Реагент = Продукт, поэтому уравнение сбалансировано, поэтому нет необходимости изменять уравнение.

NH 3 (G) +HCL (G) +COBLIDE DACE Итак, когда аммиак (Nh4) реагирует с соляной кислотой (HCl), образуется соль. В этой реакции Nh4 является слабым основанием, которое принимает протон от HCl с образованием ионов аммония и Cl.
Хлорид аммония представляет собой соль, образующуюся при соединении этих двух ионов.
A. Что является продуктом реакции Nh4(g)+hcl(g)? NH 3 (G) +HCL (G) → NH 4 CL (S) 92020202020202020202020509. (S) 020 . ) реагирует с хлористым водородом (газообразное состояние) с образованием твердого хлорида аммония.
Ниже приведены этапы балансировки Nh 3(g) +HCl (g) reaction mixture:
- Write down the unbalanced chemical equation: NH 3(g) +HCl (g) →NH 4 Cl (s)
- Make a Table:
| Element name or Symbol | Reactant element | Product element |
| Nitrogen(N) | 1 | 1 |
| Hydrogen(H) | 4 | 4 |
| Хлор (CL) | 1 | 1 |
- Столь.
 Сторонни. .Nh 3 (G) +HCL (G) (сторона реагента), NH 4 CL (S) (продукт).
Сторонни. .Nh 3 (G) +HCL (G) (сторона реагента), NH 4 CL (S) (продукт). - Как видно из таблицы, элемент Реагент=, а элемент Продукт, это показывает, что реакция сбалансирована. Итак, результирующий коэффициент равен 1:1:1.
- Таким образом, сбалансированная реакция выглядит следующим образом: NH 3 (G) +HCL (G) → NH 4 CL (S) .
В присутствии воды реакция между аммиаком (Nh4) и соляной кислотой (HCl) выглядит следующим образом:
Nh4 + HCl = Nh5 + + Cl – 90.
Теория Бренстеда-Лоури используется для объяснения этой кислотно-щелочной реакции.
9Видео с вопросом 0000: Выбор поправочного уравнения для обратимой реакции хлористого водорода и аммиака с образованием хлорида аммонияХлорид аммония разлагается при нагревании на газообразный аммиак и газообразный хлористый водород. Если газы собрать и дать им остыть, то хлорид аммония преобразуется. Какое из следующих химических уравнений описывает эти изменения? [A] NH3 (г) + HCl (г) ⇌ NH4Cl (т) [B] NH3 (г) ⇌ NH4Cl (т) + HCl (г) [C] NH3 (г) ⟶ NH4Cl (т) + HCl (г) ) [D] NH3 (г) + HCl (г) ⟶ NH4Cl (т) [E] NH4Cl (т) ⟶ NH3 (г) + HCl (г)
Стенограмма видео
Хлорид аммония разлагается при нагревании на газообразный аммиак и хлористый водород
газ. Если газы собрать и дать им остыть, то хлорид аммония преобразуется. Какое из следующих химических уравнений описывает эти изменения? (A) Газообразный Nh4 плюс газообразный HCl обратимо реагируют с образованием твердого вещества Nh5Cl. (B) Газообразный Nh4 обратимо реагирует с образованием твердого Nh5Cl и газообразного HCl. (C) Газообразный Nh4 реагирует с образованием твердого вещества Nh5Cl и газообразного HCl. (D) Газообразный Nh4 плюс газообразный HCl реагируют с образованием твердого вещества Nh5Cl. (E) Твердое вещество Nh5Cl реагирует с образованием газообразного Nh4 и газообразного HCl.
(B) Газообразный Nh4 обратимо реагирует с образованием твердого Nh5Cl и газообразного HCl. (C) Газообразный Nh4 реагирует с образованием твердого вещества Nh5Cl и газообразного HCl. (D) Газообразный Nh4 плюс газообразный HCl реагируют с образованием твердого вещества Nh5Cl. (E) Твердое вещество Nh5Cl реагирует с образованием газообразного Nh4 и газообразного HCl.
В этом вопросе мы хотим знать, какое уравнение лучше всего представляет оба
разложение хлорида аммония и его преобразование из его разложения
продукты. Хлорид аммония имеет химическую формулу Nh5Cl и представляет собой белое твердое вещество при комнатной температуре.
температура. Нам говорят, что реагентом в этой химической реакции является хлорид аммония и что
он разлагается при нагревании на газообразный аммиак, Nh4, и газообразный хлористый водород, HCl. Образующиеся вещества называются продуктами. Эти продукты также могут реагировать вместе при охлаждении с образованием хлорида аммония.
Такая реакция называется обратимой реакцией, так как она протекает в обоих направления. Реагенты реагируют, образуя продукты, а продукты реагируют, чтобы преобразовать реагенты. Мы можем представить этот обратимый процесс с помощью двух полустрелок, направленных в противоположные стороны. направления.
Противоположностью обратимой реакции является необратимая реакция. Необратимая реакция – реакция, протекающая только в одном направлении. Продукты не реагируют вместе, чтобы преобразовать реагенты. При написании химического уравнения необратимой реакции мы используем одно стрелка. Используя эту информацию, мы можем исключить варианты ответов (C), (D) и (E), поскольку они все показывают необратимые реакции.
Варианты ответа (A) и (B) имеют две полустрелки, указывающие на обратимость
реакции. Однако только вариант ответа (А) содержит правильные химические формулы в правильном
места.




 3 (г)+HCl(Г) (сторона реагента), NH4Cl(S) (сторона продукта).
3 (г)+HCl(Г) (сторона реагента), NH4Cl(S) (сторона продукта).

 00
00