Получение
В лаборатории образуется при взаимодействии меди с горячей концентрированной азотной кислотой:
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O;
при термическом разложении высушенных нитратов тяжелых металлов:
2Pb(NO3)2 = 2PbO + 4NO2 + O2.
В промышленности окисление оксида азота (II) кислородом:
2NO + O2 = 2NO2,
реакция является обратимой.
Химические свойства
Оксид азота, и мономер, и димер, хорошо растворим в воде, и взаимодействует с ней:
2NO2 + H2O = HNO3 + HNO2,
при этом происходит диспропорционирование на азотную и азотистую кислоты.
При температуре выше 0 °С реакция протекает по другому:
3NO2 +
H2O
= 2HNO3 +
NO.
Если через воду пропускать смесь оксида азота (IV) и воздуха, то образуется только азотная кислота:
4NO2 + 2H2O + О2 = 4HNO3.
Диоксид азота – сильный окислитель, в его атмосфере горят углерод и сера:
С + 2NO2 = CO2 + 2NO;
S + 2NO2 = SO2 + 2NO.
N2O5 — бесцветные, очень летучие кристаллы. Крайне неустойчив.
Оксид азота (V) – ангидрид азотной кислоты, построен из ионов NO2+ и NO3—, в газовой фазе и растворе состоит из молекул N2O5
.Получение
Образуется при пропускании азотной кислоты через колонку с оксидом фосфора (V):
2HNO3 + P2O5 = N2O5 + 2HPO3,
реакция протекает при
-10 °С.
Получается при окислении оксида азота (IV) озоном:
2NO2 + O3 = N2O5 + O2.
Химические свойства
Разложение:
2N2O5 = 4NO2 + O2.
При растворении в воде образует азотную кислоту:
N2O5 + H2O = 2HNO3.
Является сильным окислителем:
N2
Аммиа́к — Nh4, нитрид водорода, при нормальных условиях — бесцветный газ с резким характерным запахом (запах нашатырного спирта).
Молекула
аммиака имеет форму тригональной
пирамиды с атомом азота в вершине. Три
неспаренных p-электрона атома азотаучаствуют
в образовании полярных ковалентных
связей с 1s-электронами трёх атомов
водорода (связи N−H), четвёртая пара
внешних электронов является неподелённой,
она может образовать донорно-акцепторную
связь с ионом водорода, образуя ион
аммония Nh5+. Благодаря тому, что не
связывающее двухэлектронное облако
строго ориентировано в пространстве,
молекула аммиака обладает высокой
полярностью, что приводит к его хорошей
растворимости в воде.
Благодаря тому, что не
связывающее двухэлектронное облако
строго ориентировано в пространстве,
молекула аммиака обладает высокой
полярностью, что приводит к его хорошей
растворимости в воде.
Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота:
N2 + 3h3 ↔ 2Nh4
Это так называемый процесс Габера
Для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония:
Nh5Cl + NaOH = Nh4↑ + NaCl + h3O.
Nh5NO3 + NaOH = Nh4↑ + NaNO3 + h3O.
1. Реакции присоединения:
а) С водой: (реакция обратимая»)
Nh4 + h3O = Nh4*h3O
или Nh4 + h3O = Nh5OH
б) С кислотами:
Nh4 + HCl = Nh5Cl
Nh4 + h3SO4 = Nh5HSO4
2 Nh4 + h3SO4 = (Nh5)2SO4
в) С кислыми солями аммония (превращает в средние)
Nh4 + Nh5h3PO4 = (Nh5)2HPO4
Nh4 + Nh5HSO4 = (Nh5)2SO4
2. С кислородом:
4Nh4 + 3О2 = 2N2 + 6h3O
4Nh4 + 5О2 = 4NO + 6h3O
3. C хлором:
Nh4 + 3Cl2 = 2N2 ↑ + 6HCl
4. С
оксидом меди (II):
С
оксидом меди (II):
3CuO + 2 Nh4 = 3Cu + N2 ↑ + 3h3O
5. C металлами:
2Nh4 + 2Al = 2AlN +3h3
6. С углекислым газом
2 Nh4 + CO2 = h3O + CO(Nh3)2
7. Реакция разложения:
2 Nh4 = N2 + 3h3
Гидрази́н (диамид) h3N—Nh3 — бесцветная, сильно гигроскопическая жидкость с неприятным запахом. Ядовитый.
Гидразин получают окислением аммиака Nh4 или мочевины CO(Nh3)2 гипохлоритом натрия NaClO:
Nh4 + NaClO Nh3Cl + NaOH
Nh3Cl + Nh4 N2h5 · HCl,
реакция проводится при температуре 160 °C и давлении 2,5−3,0 МПа.
Синтез гидразина окислением мочевины гипохлоритом по механизму аналогичен синтезу аминов из амидов по Гофману:
h3NCONh3 + NaOCl + 2 NaOH N2h5 + h3O + NaCl + Na2CO3,
реакция проводится при температуре ~100 °C и атмосферном давлении.
В целом гидразин характеризуется восстановительными свойствами:
N2h5+O2=N2+2h3O (t)
2N2h5+4KMnO4+6h3SO4=5N2+4MnSO4+K2SO4+16h3O
-3
Только очень сильные восстановители способны восстановить его до N
N2h5+Mg+4HCl=MgCl2+2Nh5Cl
ТЕРМИЧЕСКОЕ РАЗЛОЖЕНИЕ СОЛЕЙ АММОНИЯ:Nh5NO3=N2O+2h3O (250°)
2Nh5NO3=2N2+O2+2h3O (400°)
Nh5NO2=N2+2h3O (t)
(Nh5)2Cr2O7=N2+Cr2O3+4h3O (t)
Nh5Cl=Nh4+HCl (t)
(Nh5)2SO4=2Nh4+h3SO4 (t)
Гидроксиламин
(Nh3OH) –кристаллическое ядовитое
вещество, проявляющее преимущественно
восстановительные свойства.
Получение: электрохимиичекски врсстанавливают раствор азотной кислоты, на катоде суммарно происходит реакция: HNO3+ 6H++6е= Nh3OH+2h3O
Свойства:
Nh3OH+2KMnO4+9h3SO4=5N2+2MnSO4+K2SO4+18h3O
2Nh3OH+I2+2KOH=N2+2KI+4h3O
Промежуточная степень окисления атома азота объясняет диспропорционирование этого соединения при нагревании и способность восстанавливаться до иона Nh5+
3Nh3OH=N2+Nh4+3h3O(t)
4KI+2Nh3OH+3h3SO4=2I2+(Nh5)2SO4+K2SO4+2h3O
Nh3OH+HCl=[Nh4OH]Cl
Азотистый водород (в растворе-азотистоводородная кислота) может быть получена следующим образом:
N2h5+HNO2=HN3+h3O
Соль этой кислоты-азид натрия-получают так:
2NaNh3+N2O=NaN3+h3O (200°)
Как окислитель HN3 в растворе имее черты сходства с азоткой, например:
Cu+3HN3=Cu(N3)2+N2+Nh4
Азиды щелочные и щелочноземельных металлов плавятся не разлагаясь и хорошо растворимы в воде, азиды тяжелых металлов при нагревании и даже от удара взрываются.
ВЗАИМОДЕЙСТВИЕ МЕТАЛЛОВ С АЗОТНОЙ КИСЛОТОЙ
HNO3 как сильная одноосновная кислота взаимодействует:
а) с основными и амфотерными оксидами:
Азотная
кислота в любой концентрации проявляет
свойства кислоты-окислителя, при этом
азот восстанавливается до степени
окисления от +4 до −3. Глубина восстановления
зависит в первую очередь от природы
восстановителя и от концентрации азотной
кислоты. Как кислота-окислитель,
HNO3 взаимодействует:
Глубина восстановления
зависит в первую очередь от природы
восстановителя и от концентрации азотной
кислоты. Как кислота-окислитель,
HNO3 взаимодействует:
а) с металлами, стоящими в ряду напряжений правее водорода:
Концентрированная HNO3
Разбавленная HNO3
б) с металлами, стоящими в ряду напряжений левее водорода:
С золотом и платиной азотная кислота, даже концентрированная не взаимодействует. Железо, алюминий, хром холодной концентрированной азотной кислотой пассивируются. С разбавленной азотной кислотой железо взаимодействует, причем в зависимости от концентрации кислоты образуются не только различные продукты восстановления азота, но и различные продукты окисления железа:
Смесь 3 объемов концентрированной соляной и 1 объема азотной кислоты называют «царской водкой». Это название отражает тот факт,что указанная смесь растворяет «царя металлов»- золото:
Au+4HCl+HNO3=H[AuCl4]+NO+2h3O
3Pt+4HNO3+18HCl=3h3[PtCl6]+4NO+8h3O
3HgS + 8HNO3(конц.
Соли азотной кислоты — нитраты — при нагревании необратимо разлагаются, продукты разложения определяются катионом:
а) нитраты металлов, стоящих в ряду напряжений левее магния:
2NaNO3 = 2NaNO2 + O2
б) нитраты металлов, расположенных в ряду напряжений между магнием и медью:
4Al(NO3)3 = 2Al2O3 + 12NO2 + 3O2
в) нитраты металлов, расположенных в ряду напряжений правее ртути:
2AgNO3 = 2Ag + 2NO2 + O2
г) нитрат аммония:
NH4NO3 = N2O + 2H2O
Азот в химии: подготовка к ЕГЭ (формула, химические свойства, классификация, подробное описание, получение и происхождение)
Автор Jeremiah На чтение 16 мин Просмотров 450 Опубликовано
Содержание
История открытия элемента
Такие соединения, как аммиак, селитра и азотная кислота, были известны и применялись на практике задолго до получения чистого азота в свободном состоянии.
Во время эксперимента в 1772 году Дэниел Резерфорд сжег фосфор и другие вещества в стеклянном сосуде. Он обнаружил, что газ, остающийся после сгорания соединений, не благоприятствует горению и дыханию, и назвал его «удушливым воздухом».
В 1787 году Антуан Лавуазье установил, что газы, из которых состоит обычный воздух, являются простыми химическими элементами и предложил название «азот». Чуть позже (в 1784 году) физик Генри Кавендиш показал, что это вещество входит в состав селитры (группы нитратов). Отсюда происходит латинское название азота (от позднелатинского nitrum и греческого gennao), предложенное Ж. А. Шапталем в 1790 г.
К началу 19 века учёные выяснили химическую инертность элемента в свободном состоянии и его исключительную роль в соединениях с другими веществами.
Происхождение названия
Название «азот» (по-французски бич, по наиболее распространенной версии, от древнегреческого ἄζωτος — безжизненный), вместо прежних названий («флогистик», «мефитический» и «испорченный воздух») было предложено в 1787 г. Антуаном Лавуазье, который в свое время в составе группы других французских ученых разрабатывал принципы химической номенклатуры, в том же году это предложение было опубликовано в работе «Метод химической номенклатуры». Как показано выше, в то время уже было известно, что азот не поддерживает ни горение, ни дыхание. Это свойство считалось наиболее важным. Хотя позже стало известно, что азот, наоборот, необходим всему живому, название сохранилось во французском и русском языках.
Само слово «азот» (отсутствие связи с газом) известно с древних времен и использовалось философами и алхимиками средневековья для обозначения «сырья металлов», так называемой «ртути» у философов, « двойная ртуть» среди алхимиков. Алхимики считали «металлическое сырье» «альфой и омегой» всех вещей. А слово для его обозначения было составлено из начальных и конечных букв алфавитов трех языков, считавшихся священными: латинского, греческого и древнееврейского: а, альфа, алеф и зет, омега, тов — АААЗОТ. Инициатор создания новой химической номенклатуры Гитон де Морво отмечал в своей «Методологической энциклопедии» (1786 г.) алхимическое значение термина.
Алхимики считали «металлическое сырье» «альфой и омегой» всех вещей. А слово для его обозначения было составлено из начальных и конечных букв алфавитов трех языков, считавшихся священными: латинского, греческого и древнееврейского: а, альфа, алеф и зет, омега, тов — АААЗОТ. Инициатор создания новой химической номенклатуры Гитон де Морво отмечал в своей «Методологической энциклопедии» (1786 г.) алхимическое значение термина.
Многие современники Лавуазье считали название элемента неудачным, в частности, Жан-Антуан Шапталь предложил название fr nitrogène — «родивший селитру» (и использовал это название в своей книге «Элементы химии». До наших дней азот соединения называются «нитраты», «нитриты» и «нитриды».
Во французском языке название «азот» не прижилось, а в английском, испанском, венгерском и норвежском используется производное от этого слова. На португальском языке оно используется как название (Port nitrogé(ê)nio) и (особенно в Португалии) (Port azoto).
В немецком языке используется немецкое имя. Stickstoff , что означает «удушающее вещество», похоже на голландский; имена с похожим значением используются в некоторых славянских языках, например, в хорватском и словенском (например, «душик»), а также в иврите (חנקן, «ханкан»).
Stickstoff , что означает «удушающее вещество», похоже на голландский; имена с похожим значением используются в некоторых славянских языках, например, в хорватском и словенском (например, «душик»), а также в иврите (חנקן, «ханкан»).
Название «азот», кроме французского и русского, принято в итальянском, турецком и нескольких славянских языках, а также во многих языках народов бывшего СССР.
До принятия символа Н в России, Франции и других странах использовался символ Аз, что можно увидеть, например, в статье А. М. Бутлерова об аминах 1864 г.
Общая характеристика
Азот — химический элемент V группы периодической системы Менделеева, атомный номер 7, атомная масса 14, формула азота — N2. Перевод названия элемента «безжизненный» может относиться к азоту как к простому веществу. Однако азот в связанном состоянии является одним из основных элементов жизни, он входит в состав белков, нуклеиновых кислот, витаминов и др.
Азот: элемент второго периода, у него нет возбужденных состояний, поскольку у атома нет свободных орбиталей. Но этот химический элемент может проявлять валентность не только III, но и IV в основном состоянии за счет образования ковалентной связи по донорно-акцепторному механизму с участием неподеленной пары электронов азота. Степень окисления, которую может проявлять азот, широко варьируется от -3 до +5.
Но этот химический элемент может проявлять валентность не только III, но и IV в основном состоянии за счет образования ковалентной связи по донорно-акцепторному механизму с участием неподеленной пары электронов азота. Степень окисления, которую может проявлять азот, широко варьируется от -3 до +5.
Изучая строение молекулы азота, следует помнить, что химическая связь осуществляется за счет трех общих пар электронов р, орбитали которых направлены по осям х, у, z.
Электронное строение азота
Рассмотрим строение атома и электронную конфигурацию азота, а затем сделаем некоторые выводы.
Атомный или порядковый номер азота равен 7, что соответствует количеству электронов и протонов в ядре. Молярная масса равна 14,00728 г/моль, а число нейтронов в атоме этого изотопа равно семи.
Теперь перейдем к электронной структуре. В основном состоянии электронная формула азота: 1s2 2s2 2p3, сокращенно — He2s2 2p3. Внешний энергетический уровень имеет 5 валентных электронов, в том числе 3 неспаренных p-электрона.
Исходя из этой конфигурации, азот может образовать только 3 связи по обменному механизму и еще одну по донорно-акцепторному механизму. Это связано с тем, что на втором подуровне азот уже не имеет пустых орбиталей, на которых могли бы испаряться электроны 2s-подуровня. Отсюда следует максимальная валентность азота IV.
Важно! Валентности азота V нет!
Азот характеризуется полным диапазоном возможных степеней окисления от -3 до +5.
Рассмотрим шкалу, отражающую соединения азота в различных веществах.
Строение молекулы азота
Азот представляет собой двухатомную молекулу, атомы которой связаны прочной тройной связью. Длина связи 0,110 нм.
Почему тройная связь и из чего она состоит?
Помните, что каждый атом в молекуле азота имеет 3 неспаренных электрона, которые впоследствии образуют тройную связь, которая, в свою очередь, состоит из одной сигма-связи и двух пи-связей.
Физические свойства
Азот немного легче воздуха. Его плотность 1,2506 кг/м³ (0 °С, 760 мм рт ст.), температура плавления — -209,86 °С, температура кипения — -195,8 °С. Азот трудно сжижается. Его критическая температура относительно низка (-147,1 °C), а критическое давление достаточно велико: 3,39 МН/м². Плотность в жидком состоянии – 808 кг/м³. В воде этот элемент менее растворим, чем кислород: в 1 м³ (при 0 °С) Н2О можно растворить 23,3 г N. При работе с некоторыми углеводородами этот показатель выше.
Его плотность 1,2506 кг/м³ (0 °С, 760 мм рт ст.), температура плавления — -209,86 °С, температура кипения — -195,8 °С. Азот трудно сжижается. Его критическая температура относительно низка (-147,1 °C), а критическое давление достаточно велико: 3,39 МН/м². Плотность в жидком состоянии – 808 кг/м³. В воде этот элемент менее растворим, чем кислород: в 1 м³ (при 0 °С) Н2О можно растворить 23,3 г N. При работе с некоторыми углеводородами этот показатель выше.
Химические свойства
В природе азот встречается в виде простого вещества — газообразного N2 (объемная доля в воздухе 78%) и в связанном состоянии. В молекуле азота атомы связаны прочной тройной связью. Энергия этой связи составляет 940 кДж/моль. При обычных температурах азот может взаимодействовать только с литием (Li3N). После предварительной активации молекул нагреванием, облучением или действием катализаторов азот вступает в реакцию с металлами и неметаллами. Азот может реагировать с магнием, кальцием или, например, алюминием:
3Mg+N2=Mg3N23Ca+N2=Ca3N22Al+N2=2AlN
Особое значение имеет синтез аммиака из простых веществ: азота и водорода в присутствии катализатора (губчатого железа): N2 + 3h3 = 2Nh4 + Q. Аммиак — бесцветный газ с резким запахом. Он хорошо растворим в воде, что в значительной степени обусловлено образованием водородных связей между молекулами аммиака и воды, а также реакцией присоединения к воде по донорно-акцепторному механизму. Слабощелочная реакция раствора обусловлена наличием в растворе ионов ОН- (в небольшой концентрации, так как степень диссоциации гидроксида аммония очень мала — это слаборастворимое основание).
Аммиак — бесцветный газ с резким запахом. Он хорошо растворим в воде, что в значительной степени обусловлено образованием водородных связей между молекулами аммиака и воды, а также реакцией присоединения к воде по донорно-акцепторному механизму. Слабощелочная реакция раствора обусловлена наличием в растворе ионов ОН- (в небольшой концентрации, так как степень диссоциации гидроксида аммония очень мала — это слаборастворимое основание).
Из шести оксидов азота — N2O, NO, N2O3, NO2, N2O4, N2O5, где азот имеет степень окисления от +1 до +5, первые два — N2O и NO — не образуют солей, остальные реагируют с образованием солей.
Азотная кислота, наиболее важное соединение азота, производится в промышленных масштабах из аммиака в 3 этапа:
- окисление аммиака на платиновом катализаторе:
4Nh4 +5O2=4NO+6h3O,
- окисление NO до NO2 кислородом воздуха:
2NO+O2=2NO2,
- поглощение NO2 водой при избытке кислорода:
4NO2 +2h3O+O2=4HNO3.
Азот также может реагировать при высоких температурах и давлениях (в присутствии катализатора) с водородом:
Н2+3Н2=2Nh4.
Важнейшие соединения азота
Аммиак
Прежде всего, поговорим о водородном соединении азота: аммиаке. Аммиак — бесцветный газ с характерным резким запахом. Давайте посмотрим на строение молекулы аммиака:
Аммиак имеет форму трехугольной пирамиды. Этот газ очень ядовит и может вызвать химические ожоги глаз, а пары сильно раздражают слизистые оболочки органов дыхания. В то же время аммиак обладает достаточно высокой растворимостью в воде за счет образования водородных связей с молекулами воды. Вы когда-нибудь приходили в себя после того, как потеряли сознание от ватного тампона, смоченного чем-то вонючим? Поздравляю, это был ваш первый контакт с аммиаком в воде.
Теперь поговорим о химических свойствах этого газа.
В отличие от самого азота аммиак является высокореактивным соединением. Поскольку азот находится в аммиаке в самой низкой степени окисления (-3), аммиак проявляет только восстановительные свойства.
Например, аммиак реагирует с кислородом (при нагревании):
Как видно из уравнений, аммиак вступает в реакции окисления, а продукты его окисления напрямую зависят от силы окислителя и условий реакции.
Аммиак реагирует со сложными веществами-окислителями следующим образом:
- 6Nh4 + 8KClO3 + 6NaOH = 6NaNO3 + 8KCl + 12h3O,
- 10Nh4 + 6KMnO4 + 9h3SO4 = 5N2 + 6MnSO4 + 3K2SO4 + 24h3O.
Аммиак реагирует с кислотами благодаря своим основным свойствам, что приводит к образованию различных солей:
- Nh4 + HCl = Nh5Cl,
- Nh4 + h3SO4 = Nh5HSO4.
Теперь рассмотрим получение аммиака. Различают два вида методов: промышленные и лабораторные.
- Промышленный метод — синтез из простых веществ:
- Лабораторная форма:В этом методе аммиак собирают в перевернутую колбу, потому что аммиак легче воздуха.
Азотная кислота
Азотная кислота является одной из важнейших неорганических кислот. Это бесцветная летучая жидкость с резким запахом, которую можно смешивать с водой в любой пропорции.
Получить его в отрасли можно в несколько этапов. Рассмотрим подробнее каждый из них:
- Окисление аммиака кислородом воздуха на платиновом катализаторе
4Nh4 + 5O2 = 4NO + 6h3O, - Окисление оксида азота (II)
2NO + О2 = 2NO2, - Абсорбция образующегося оксида азота (IV) водой в избытке воздуха
4NO2 + О2 + 2h3O = 4HNO3.
Азотная кислота характеризуется особыми химическими свойствами в зависимости от ее концентрации.
Например, с металлами эта кислота никогда не будет реагировать с выделением газообразного водорода. Рассмотрим таблицу с примерами металлов с разной концентрацией азотной кислоты:
Также азотная кислота, как сильный окислитель, способна окислять некоторые неметаллы до их кислот. Давайте посмотрим примеры:
Азотная кислота в соотношении 1:3 с соляной кислотой образует смесь, называемую царской водкой. Это желтовато-оранжевая дымящаяся жидкость, получившая свое название от алхимиков из-за способности растворять «настоящие» металлы — золото и платину.
Оксиды азота
В отличие от других химических элементов азот образует большое количество оксидов: N2O, NO, N2O3, NO2, N2O4 и N2O5, каждый из которых является кислым. В таблице показано, какой оксид какой кислоте соответствует:
Оксид азота (I) N2O. Это оксид, не образующий соли, бесцветный газ с приятным запахом и сладким вкусом. Его молярная масса тяжелее воздуха и растворяется в воде. Этот оксид известен под другими названиями, наиболее распространенным из которых является закись азота. Оксид азота (I) использовался в медицине в качестве анестетика более 200 лет назад. При вдыхании этого газа человека наполняет радость и безудержный смех, за что оксид получил еще одно название — веселящий газ.
Оксид азота (II) NO. Несолеобразующий оксид, представляющий собой бесцветный газ при нормальных условиях, плохо растворим в воде и в высоких концентрациях ядовит для человека.
Оксид азота (III) N2O3. Соединение очень нестабильно и существует только при низких температурах. Оксид азота (III) в твердом и жидком состоянии имеет ярко-синий цвет. При температуре выше 0 градусов он разлагается на окись азота (II) и окись азота (IV).
Оксид азота (III) в твердом и жидком состоянии имеет ярко-синий цвет. При температуре выше 0 градусов он разлагается на окись азота (II) и окись азота (IV).
Оксиды азота (IV) NO2 и N2O4. Твердый оксид азота (IV) бесцветен, так как состоит из молекул N2O4. При нагревании появляется коричневая окраска, усиливающаяся с повышением температуры по мере увеличения содержания NO2 в смеси. Эти оксиды хорошо растворяются в воде и взаимодействуют с ней.
Оксид азота (V) N2O5. Азотный ангидрид, образующийся в виде летучих бесцветных гигроскопичных кристаллов. Это чрезвычайно нестабильное вещество, которое распадается в течение нескольких часов. При нагревании он со взрывом разлагается на оксид азота (IV) и газообразный кислород.
Получение
Реакция экзотермическая, с выделением 80 ккал (335 кДж), поэтому во время ее протекания требуется охлаждение сосуда (хотя для начала реакции требуется нитрит аммония).
На практике эту реакцию проводят, добавляя по каплям насыщенный раствор нитрита натрия к нагретому насыщенному раствору сульфата аммония, при этом образующийся в результате обменной реакции нитрит аммония мгновенно разлагается.
Выделяющийся при этом газ загрязнен аммиаком, оксидом азота (I) и кислородом, от которых его очищают путем последовательного пропускания через растворы серной кислоты, сульфата железа (II) и над раскаленной медью. Затем азот сушат.
Так называемый «воздушный», или «атмосферный» азот, то есть смесь азота с инертными газами, получают реакцией воздуха с горячим коксом, с образованием так называемого «генератора», или « воздух», газ — сырье, сырье для химического синтеза и топливо. При необходимости азот можно удалить путем поглощения монооксида углерода.
Молекулярный азот получают в промышленных масштабах путем фракционной перегонки жидкого воздуха. Этот метод также может быть использован для получения «атмосферного азота». Также широко применяются азотные установки и станции, использующие мембранный газоразделительный и адсорбционный метод.
Аммиак извлекают из его насыщенного раствора нагреванием. Количество CuO в 2 раза выше расчетного. Непосредственно перед использованием азот очищают от примесей кислорода и аммиака пропусканием его над медью и ее оксидом (II) (также ~700 °С), затем сушат концентрированной серной кислотой и сухой щелочью. Процесс довольно медленный, но он того стоит: газ очень чистый.
Процесс довольно медленный, но он того стоит: газ очень чистый.
Применение
Несмотря на пассивность азота, этот элемент широко используется в промышленности. Кроме того, азот входит в состав клеток, без него невозможно построение белков и ДНК.
Большая часть полученного свободного азота используется в промышленном производстве аммиака, который затем в довольно больших количествах перерабатывается в удобрения, взрывчатые вещества и т д.
Помимо прямого синтеза Nh4 из элементов, используется цианамидный метод, разработанный в начале прошлого века. Он основан на том, что при = 1000 °С карбид кальция (образующийся при нагревании смеси угля и извести в электропечи) реагирует со свободным азотом (формула: CaC₂ + N₂ = CaCN₂ + C). Образовавшийся цианамид кальция разлагается на CaCO₃ и 2NH₃ под действием паров горячей воды₃.
В свободном виде этот элемент используется во многих отраслях промышленности: как инертная среда в различных металлургических и химических процессах, при перекачивании горючих жидкостей, для заполнения пространства в ртутных термометрах и т д. В жидком состоянии он используется в различные холодильные установки. Его транспортируют и хранят в стальных сосудах Дьюара, а сжатый газ хранят в баллонах.
В жидком состоянии он используется в различные холодильные установки. Его транспортируют и хранят в стальных сосудах Дьюара, а сжатый газ хранят в баллонах.
Многие соединения азота также широко используются. Его производство начало интенсивно развиваться после Первой мировой войны и в настоящее время достигло поистине огромных масштабов.
Роль азота в биологии
Это вещество является одним из основных биогенных элементов и входит в состав важнейших элементов живых клеток: нуклеиновых кислот и белков. Однако количество азота в живых организмах невелико (приблизительно 1—3% сухого веса). Молекулярный материал, присутствующий в атмосфере, усваивается только сине-зелеными водорослями и некоторыми микроорганизмами.
Достаточно большие запасы этого вещества сосредоточены в почве в виде различных минеральных (нитраты, соли аммония) и органических соединений (в составе нуклеиновых кислот, белков и продуктов их разложения, в том числе еще не полностью разрушенных остатков флоры и фауны).
Растения прекрасно усваивают азот из почвы в виде органических и неорганических соединений. В природных условиях большое значение имеют особые почвенные микроорганизмы (аммонификаторы), способные минерализовать почвенный органический N до солей аммония.
Почвенный азот образуется при жизнедеятельности нитрифицирующих бактерий, открытых С. Виноградским в 1890 г. Они окисляют аммонийные соли и аммиак до нитратов. Часть материала, ассимилированного флорой и фауной, теряется под действием денитрифицирующих бактерий.
Микроорганизмы и растения прекрасно усваивают как нитратный, так и аммиачный. Они активно превращают неорганический материал в различные органические соединения: аминокислоты и амиды (глутамин и аспарагин). Последние входят в состав многих белков микроорганизмов, растений и животных. Многие представители флоры и фауны осуществляют синтез аспарагина и глутамина путем амидирования (ферментативного) аспарагиновой и глутаминовой кислот.
Получение аминокислот происходит путем восстановительного аминирования различных кетокислот и кислых альдегидов, возникающих при ферментативном переаминировании, а также в результате окисления различных углеводов. Конечными продуктами усвоения аммиака (Nh4) растениями и микроорганизмами являются белки, входящие в состав клеточного ядра, протоплазмы, а также откладывающиеся в виде так называемых запасных белков.
Конечными продуктами усвоения аммиака (Nh4) растениями и микроорганизмами являются белки, входящие в состав клеточного ядра, протоплазмы, а также откладывающиеся в виде так называемых запасных белков.
Человек и большинство животных могут синтезировать аминокислоты лишь в довольно ограниченной степени. Они не способны вырабатывать восемь незаменимых соединений (лизин, валин, фенилаланин, триптофан, изолейцин, лейцин, метионин, треонин), поэтому для них основным источником азота является потребляемый с пищей белок, то есть, в конечном счете, собственные белки микроорганизмов и растений.
Опасность для здоровья
В обычных условиях азот не токсичен, но при высоком атмосферном давлении может вызвать отравление азотом. Большинство соединений азота представляют серьезную опасность для здоровья.
Азот относится ко второму классу опасности. Рейтинг NFPA 704: Опасность для здоровья: 3, Воспламеняемость: 0, Реакционная способность: 0.
Периодическая система химических элементов Д.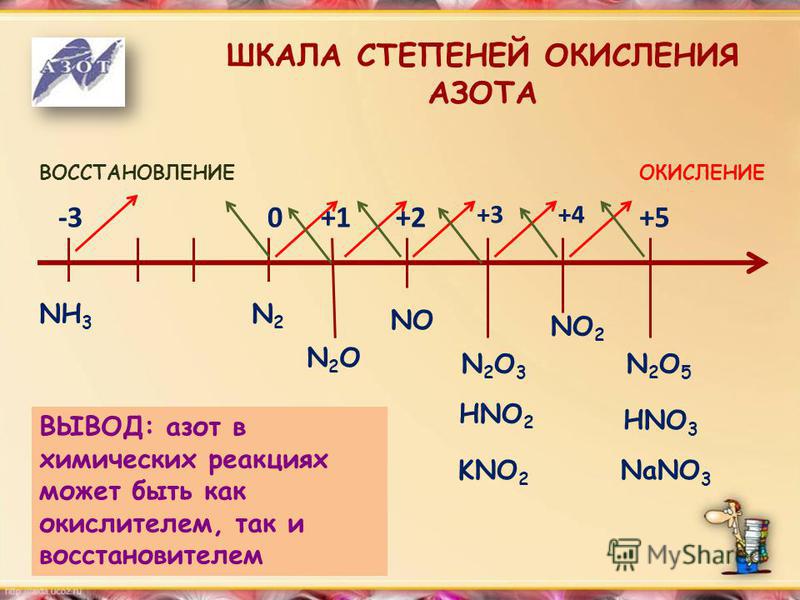 И. Менделеева
И. Менделеева
| один | два | 3 | 4 | 5 | 6 | 7 | восемь | девять | десять | 11 | 12 | тринадцать | 14 | пятнадцать | шестнадцать | 17 | Восемнадцать | один | ЧАС | эль | два | Ли | Быть | Б | С | Север | ЛИБО | Ф | К северо-востоку | 3 | Н/Д | Миллиграммы | Алабама | Да | П | Да | Кл | Арканзас | 4 | К | Калифорния | Южная Каролина | Ты | В | Кр | Миннесота | Вера | Ко | Ни один | Медь | Цинк | Грузия | Ge | Что | Я знаю | Родной брат | Кр | 5 | Руб | Мистер | Д | Zr | NB | Месяц | КТ | Ру | Rh | P. S S | Сельское хозяйство | Компакт диск | В | Да | Суббота | Чай | Я | Хэ | 6 | Cs | Лицензия в письмах | Ла | ЕС | Пиар | Северная Дакота | Вечера | ВЫ | Евросоюз | Бог | Туберкулез | Ди | Хо | Привет | Тм | У б | Мо | ВЧ | Резервная армия | Вт | Ре | Ты | Идти | Пятно | Вот это да | Ртутного столба | Т-л | Pb | Би | Почта | В | Р-н | 7 | Пт | Ра | Переменный ток | Эль | Пенсильвания | Ты | Государственный нотариус | ПУ | Являюсь | См | Бк | Ср | ЭТО | FM | Мэриленд | Не | Я | РФ | БД | Сержант | Чч | Время | Гора | Дс | Г | Сп | Н.Х | Флорида | Мак | Уровень | Ц | Ог | восемь | Евросоюз | Сбн | Убу | Убб | Сомневаться | УБК | Ппу | Фу | УБС | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| один | два | 3 | 4 | 5 | 6 | 7 | восемь | девять | десять | 11 | 12 | тринадцать | 14 | пятнадцать | шестнадцать | 17 | Восемнадцать | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| один | ЧАС | эль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| два | Ли | Быть | Б | С | Север | ЛИБО | Ф | К северо-востоку | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3 | Н/Д | Миллиграммы | Алабама | Да | П | Да | Кл | Арканзас | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4 | К | Калифорния | Южная Каролина | Ты | В | Кр | Миннесота | Вера | Ко | Ни один | Медь | Цинк | Грузия | Ge | Что | Я знаю | Родной брат | Кр | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5 | Руб | Мистер | Д | Zr | NB | Месяц | КТ | Ру | Rh | P. S S | Сельское хозяйство | Компакт диск | В | Да | Суббота | Чай | Я | Хэ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6 | Cs | Лицензия в письмах | Ла | ЕС | Пиар | Северная Дакота | Вечера | ВЫ | Евросоюз | Бог | Туберкулез | Ди | Хо | Привет | Тм | У б | Мо | ВЧ | Резервная армия | Вт | Ре | Ты | Идти | Пятно | Вот это да | Ртутного столба | Т-л | Pb | Би | Почта | В | Р-н | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 7 | Пт | Ра | Переменный ток | Эль | Пенсильвания | Ты | Государственный нотариус | ПУ | Являюсь | См | Бк | Ср | ЭТО | FM | Мэриленд | Не | Я | РФ | БД | Сержант | Чч | Время | Гора | Дс | Г | Сп | Н.Х | Флорида | Мак | Уровень | Ц | Ог | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| восемь | Евросоюз | Сбн | Убу | Убб | Сомневаться | УБК | Ппу | Фу | УБС |
Исследование промотирующего действия WO3 на разложение и реакционную способность Nh5HSO4 с NO на катализаторах СКВ V2O5–WO3/TiO2
Исследование промотирующего действия WO
3 на разложение и реакционную способность NH 4 HSO 4 с NO на V 2 O 5 –WO 3 /TiO 90s катализаторДонг Е, и Руян Цюй, и Хао Песня, и Ченхан Чжэн, и Сян Гао* a Чжунъян Луо, и Минцзян № и а также Кефа Цен и
Принадлежности автора
* Соответствующие авторы
и Государственная ключевая лаборатория использования чистой энергии, факультет энергетики, Чжэцзянский университет, Ханчжоу, Китай
Электронная почта: xgao1@zju.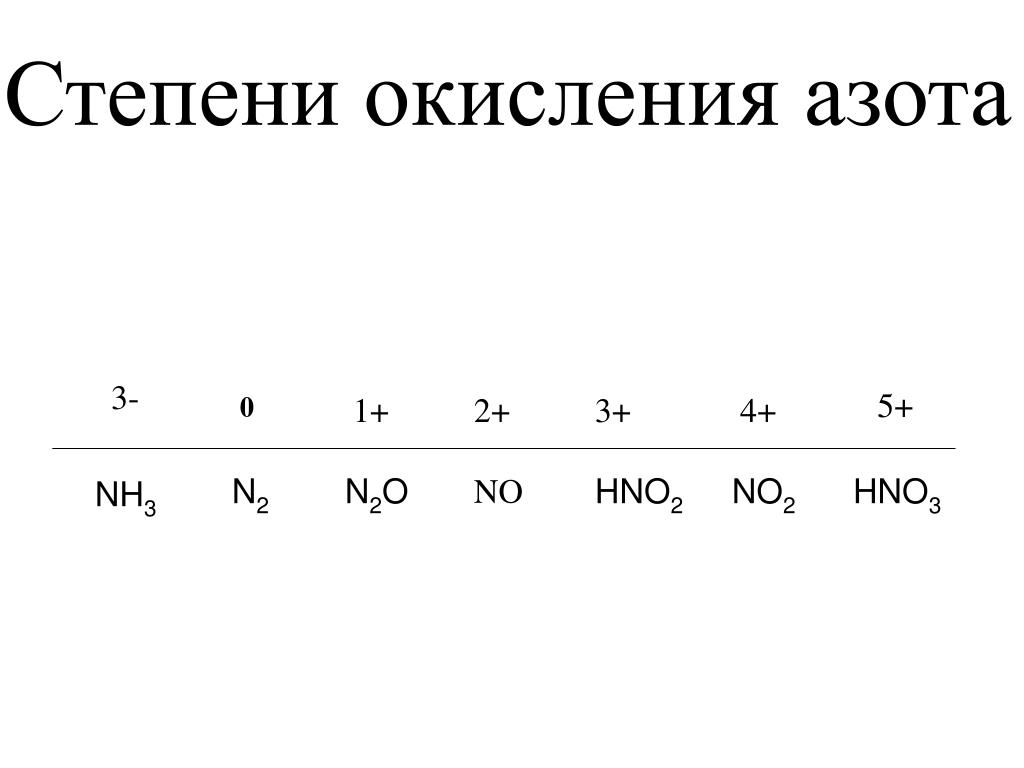 edu.cn
edu.cn
Тел.: +86 571 87951335
Аннотация
In this study, we systematically investigated the interaction between NH 4 HSO 4 and WO 3 -promoted V 2 O 5 /TiO 2 катализатора селективного каталитического восстановления NO NH 3 , наряду с стимулирующим действием WO 3 на разложение и реакционную способность NH 4 HSO 4 с NO. In the NH 4 HSO 4 -deposited samples, WO 3 addition increased the electron cloud density around the S atoms in SO 4 2− , which was полезно для восстановления атомов S с формальной степенью окисления +6, как в NH 4 HSO 4 до тех, которые находятся в степени окисления +4, как в SO 2 . Следовательно, легирование WO 3 привело к увеличению количества SO 2 , выделяющегося в низкотемпературных областях в процессе нагрева, а также к явному улучшению поведения NH 4 при разложении. HSO 4 , о чем свидетельствует снижение температуры, связанное с пиками потери веса. Между тем, введенный WO 3 оказывал незначительное стимулирующее действие на реакционную способность NH 4 HSO 4 с NO вместе с ингибирующим действием на образование N 2 O в ходе реакции. Наконец, промотированные катализаторы WO 3 проявляли повышенную устойчивость к SO 2 .
Следовательно, легирование WO 3 привело к увеличению количества SO 2 , выделяющегося в низкотемпературных областях в процессе нагрева, а также к явному улучшению поведения NH 4 при разложении. HSO 4 , о чем свидетельствует снижение температуры, связанное с пиками потери веса. Между тем, введенный WO 3 оказывал незначительное стимулирующее действие на реакционную способность NH 4 HSO 4 с NO вместе с ингибирующим действием на образование N 2 O в ходе реакции. Наконец, промотированные катализаторы WO 3 проявляли повышенную устойчивость к SO 2 .
ch4-ch3-n(ch3-ch4)-ch3-ch4 = nh5hso4 | Химические уравнения не найдены
| Поиск |
Новости Только 5% НАСЕЛЕНИЯ знают
Рекламное объявление
Новости Только 5% НАСЕЛЕНИЯ знают
Рекламное объявление
Поиск в нашей базе данных по более чем 5552 химическим веществам
CH
3 -CH 2 -N(CH 2 -CH 3 )-CH 2 -Ч 3Краткая форма
Триэтиламин
триэтиламин
Искать как реагент Искать как продукт
Подробнее
NH
4 HSO 4Краткая форма H
5 НЕТ 4 SАмони гидро солярий
Сернокислая аммониевая соль; Сульфат аммония
Атомный_вес (г/моль) 115.
 1090
1090Искать как реагент Искать как продукт
Подробнее
Реакция объединения
Также известна как реакция синтеза. Одним из часто встречающихся комбинированных реакций является реакция элемента с кислородом с образованием оксида. При определенных условиях металлы и неметаллы легко реагируют с кислородом. После воспламенения магний вступает в реакцию быстро и бурно, реагируя с кислородом воздуха с образованием мелкодисперсного порошка оксида магния.
CH 3 COCH 3 + HCN → (CH 3 ) 2 C(OH)CN Cl 2 + H 2 → 2HCl 2Na + Se → Na 2 Se 3F 2 + S → SF 6 C 2 H 2 + C 2 H 5 OH + CO → C 2 H 3 COOC 2 H 5 3Mg + 2P → Mg 3 P 2 Ca 3 (PO 4 ) 2 + 4H 3 PO 4 → 3Ca(H 2 Заказ на покупку 4 ) 2 Просмотреть все Комбинированная реакция
Рекламное объявление
Реакция разложения
Многие реакции разложения включают тепло, свет или электричество для ввода энергии. Бинарные соединения — это соединения, состоящие только из двух элементов. Простейшая реакция на разложение — это когда бинарное соединение распадается на его элементы. Оксид ртути (II), красное твердое вещество, при нагревании разлагается с образованием ртути и газообразного кислорода.
Кроме того, реакция считается реакцией разложения, даже если один или несколько продуктов все еще являются соединением. Карбонат металла распадается с образованием оксида металла и углекислого газа. Карбонат кальция, например, разлагается на оксид кальция и диоксид углерода.
Бинарные соединения — это соединения, состоящие только из двух элементов. Простейшая реакция на разложение — это когда бинарное соединение распадается на его элементы. Оксид ртути (II), красное твердое вещество, при нагревании разлагается с образованием ртути и газообразного кислорода.
Кроме того, реакция считается реакцией разложения, даже если один или несколько продуктов все еще являются соединением. Карбонат металла распадается с образованием оксида металла и углекислого газа. Карбонат кальция, например, разлагается на оксид кальция и диоксид углерода.
2Cu(NO 3 ) 2 → 2CuO + 4NO 2 + O 2 2NaHCO 3 → H 2 O + Na 2 CO 3 + CO 2 2HI → H 2 + I 2 C 2 H 6 → C 2 H 4 + H 2 Hg(OH) 2 → H 2 O + HgO (NH 4 ) 2 SO 4 → H 2 SO 4 + 2NH 3 2Ag 2 O → 4Ag + O 2 Просмотреть все Реакция разложения
Рекламное объявление
Окислительно-восстановительная реакция
Окислительно-восстановительная (окислительно-восстановительная) реакция представляет собой тип химической реакции, включающей перенос электронов между двумя частицами. Окислительно-восстановительная реакция — это любая химическая реакция, в которой степень окисления молекулы, атома или иона изменяется путем приобретения или потери электрона. Окислительно-восстановительные реакции являются обычными и жизненно важными для некоторых основных функций жизни, включая фотосинтез, дыхание, горение, коррозию или ржавчину.
Окислительно-восстановительная реакция — это любая химическая реакция, в которой степень окисления молекулы, атома или иона изменяется путем приобретения или потери электрона. Окислительно-восстановительные реакции являются обычными и жизненно важными для некоторых основных функций жизни, включая фотосинтез, дыхание, горение, коррозию или ржавчину.
NH 4 NO 2 → 2H 2 O + N 2 FeO + H 2 → Fe + H 2 O Cl 2 + H 2 SO 4 + 2FeSO 4 → Fe 2 (SO 4 ) 3 + 2HCl 2AlCl 3 + 3Mg → 2Al + 3MgCl 2 2Al + 3CuO → Al 2 O 3 + 3Cu 4NH 3 + 5O 2 → 6H 2 O + 4NO 8H 2 SO 4 + 10KCl + 2KMnO 4 → 5Cl 2 + 8H 2 O + 2MnSO 4 + 6K 2 SO 4 Просмотреть все Окислительно-восстановительная реакция
Рекламное объявление
Реакция с одной заменой
A + BC → AC + B
Элемент А представляет собой металл в этой общей реакции и заменяет элемент В, который также является металлом в соединении. Если замещающий элемент является неметаллом, он должен заменить другой неметалл в соединении, и это становится общим уравнением.
Многие металлы легко реагируют с кислотами, и одним из продуктов реакции при этом является газообразный водород. Цинк реагирует с водным раствором хлорида цинка и водородом с соляной кислотой (см. рисунок ниже).
Если замещающий элемент является неметаллом, он должен заменить другой неметалл в соединении, и это становится общим уравнением.
Многие металлы легко реагируют с кислотами, и одним из продуктов реакции при этом является газообразный водород. Цинк реагирует с водным раствором хлорида цинка и водородом с соляной кислотой (см. рисунок ниже).
2Al + 6HBr → 3H 2 + 2AlBr 3 C 2 H 2 + 2[Ag(NH 3 ) 2 ]OH → H 2 O + NH 3 + C 2 03 Ag 4
04
Cl 2 + C 6 H 5 CH 3 → HCl + C 6 H 5 CH 2 Cl
Fe + H 2 SO 4 → H 2 + FeSO 4 NH 3 + (CH 3 CO) 2 O → CH 3 СООН + СН 3 КОНН 2 NaOH + C 2 H 5 Cl → C 2 H 5 OH + NaCl
Br 2 + CH 4 → CH 3 Br + HBr
Просмотреть все Реакция с одним замещением
Рекламное объявление
Реакция двойной замены
AB + CD → AD + CB
В этой реакции А и С являются положительно заряженными катионами, а В и D — отрицательно заряженными анионами. Реакции двойного замещения обычно происходят в водном растворе между соединениями. Чтобы вызвать реакцию, один из продуктов обычно представляет собой твердый осадок, газ или молекулярное соединение, такое как вода.
Осадок образуется в реакции двойного замещения, когда катионы одного реагента объединяются с образованием нерастворимого ионного соединения с анионами другого реагента. При смешивании водных растворов йодида калия и нитрата свинца (II) происходит следующая реакция.
Реакции двойного замещения обычно происходят в водном растворе между соединениями. Чтобы вызвать реакцию, один из продуктов обычно представляет собой твердый осадок, газ или молекулярное соединение, такое как вода.
Осадок образуется в реакции двойного замещения, когда катионы одного реагента объединяются с образованием нерастворимого ионного соединения с анионами другого реагента. При смешивании водных растворов йодида калия и нитрата свинца (II) происходит следующая реакция.
Ca 3 P 2 + 6HCl → 2PH 3 + 3CaCl 2 Ca(NO 3 ) 2 + Na 2 CO 3 → CaCO 3 + 2NaNO 3 3Ba(NO 3 ) 2 + 2K 3 PO 4 → 6KNO 3 + Ba 3 (PO 4 ) 2
3 3Ba(NO
3 ) 2 + Fe 2 (SO 4 ) 3 → 2Fe(NO 3 ) 3 + 3BaSO 4 Al 2 O 3 + 6HCl → 2AlCl 3 + 3H 2 O 4Cr + 12HCl + O 2 → 2H 2 + 2H 2 O + 4CrCl 3 2NaOH + ZnCl 2 → 2NaCl + Zn(OH) 2 Просмотреть все Реакция двойной заменыРекламное объявление
Рекламное объявление
Вы не нашли ?
Воспользуйтесь нашей настраиваемой системой поиска, чтобы сосредоточиться только на результатах поиска Google Chemistry
Уравнения с Ch4-Ch3-N(Ch3-Ch4)-Ch3-Ch4 в качестве реагента
триэтиламин
Просмотреть все уравнения с Ch4-Ch3-N(Ch3-Ch4)-Ch3-Ch4 в качестве реагента
Рекламное объявление
Уравнения с Nh5HSO4 в качестве произведения
Сернокислая аммониевая соль; Сульфат аммония
10H 2 O + 5 (NH 4 ) 2 S 2 O 8 → 5H 2 O 2 + 10NH 4 HSO 4 .

 S
S Х
Х