Data & Results — Enthalpy of Reaction and Hess’s Law
50.0 mL h3O-Heated = 63.6 c
| Time (sec) | Temperature (Celsius) | Time (sec) | Temperature (Celsius) |
| 20 | 40.6 c | 120 | 39.9 c |
| 40 | 40.3 c | 140 | 39.8 c |
| 60 | 40.2 c | 160 | 39.7 c |
| 80 | 40.1 c | 180 | 39.6 c |
| 100 | 40.0 c |
Tave (Celcius) = 41,6 C
QCAL (Joules) = 209,2 J
CCAL (Joules/Celcius) = 9,95 J/C
HEAPS Реактивная0011
Реакция 1: HCl(водн. ) + NaOH(водн.) —> NaCl(водн.) + h3O(л)
) + NaOH(водн.) —> NaCl(водн.) + h3O(л)
50,0 мл 2,0 М HCl = 22,7 с
| Время (г.) | Температура (Цельсии) | Время (г.) 36.1 в | |
| 40 | 36.3 c | 140 | 36.0 c |
| 60 | 36.2 c | 160 | 35.8 c |
| 80 | 36.1 c | 180 | 35.7 c |
| 100 | 36,0 C |
QRXN (Joules) = -62,4 J
DELTA H (KJ/MOL) = -56,79 KJ/MOL
. + NaOH —> Nh4 +NaCl + h3O
50,0 мл 2,0 м NH5CL = 21,4 C
50,0 мл 2,0 м NAOH = 21,3 C
| Время (г.) Temperature (Celsius) | |||
| 20 | 22.5 c | 120 | 22. 4 c 4 c |
| 40 | 22.5 c | 140 | 22.4 c |
| 60 | 22.5 c | 160 | 22.4 c |
| 80 | 22.5 c | 180 | 22.4 c |
| 100 | 22.4 c |
qrxn (Joules) = -4,97 J
Delta H (KJ/MOL) = 9,8 кДж/моль
Реакция 3: NH4 +HCL -> NH5CL
50,0 мл 2,0 м. 50,0 мл 2,0 М HCl = 22,9·
| Время (г.) | Температура (Цельсии) | Время (г.) C | |
| 40 | 32,0 C | 140 | 32,8 C |
| 60 | 32,9 C | 160 | 32,8 C | 9009 | 32,8 C | 9000 | 9000 9000 9000 9000 9000 | 32,8 C | 32,8 C | 9 | .32,9 C | 180 | 32,7 C |
| 100 | 32,8 C |
Результаты( Послелабораторные расчеты и анализ)
Часть 1. Расчет теплоемкости калориметра
2
1.2. 19,6 c + 63,6 x = 83,2 83,2/2 = 41,6 c Tave = 41,6 c
qводы = 50 г H3O x 4,184 x (40,6 — 41,6)
qводы = 209,2 x (-1)
qводы = -209,2
qкал = 209,2 Поскольку калориметр получает тепло, вода его теряет.
4. Ккал = ккал/(Tmix — Tinitial) Ккал = 209/(40,6 — 19,6) Ккал = 209/21 Ккал = 9.95 J/C
Часть 2. Рассчитайте энтальпию реакции, Delta HRXN
1.
TMIX = 36,5 C
Реакция 1
TMIX = 22,5 C
Реакция 2
TMIX = 33,0 C.
Реакция 3
2. Найдите qrxn реакции 1,2 и 3
Реакция 1:
qrxn = -[1,03 x 4,184 x (36,5 -22,7)
qrxn = -62,4 кдж/моль
Реакция 2:
qrxn = -[1,03 х 4,184 х (22,5 — 21,4)
qrxn = -4,97 кДж/моль
Реакция 3:
qrxn = -[1,03 x 4,184 x (33,0 — 22,9)
qrxn = -45,63 кДж/моль
5 Реакция 3, дельта H,
5 Найти 2 и 3Реакция 1: NaOH(водн.) + HCl(водн.) —> NaCl(водн.) + h3O(л)
(-407,27 — 285,83) — (-469,15 — 167,16) =
— 693,1 + 636,31 = -56,79
Delta H = -56,79 кДж/моль
Реакция 2: Nh5Cl(водн.) + NaOH(водн.) —> Nh4(водн.) + NaCl(водн.) + h3O(л)
( −80,8 – 407,27 – 285,83) – (–314,55 – 469).15) =
-773,9 + 783,7 = 9,8
Delta H = 9,8 кДж/моль
Реакция 3: Nh4(водн.) + HCl(водн.) —> Nh5Cl(водн.)
(-314,55) — ( −80,8-167,2) =
-314,55 +248 = -66,55
Дельта H = -66,55 кДж/моль
Часть 3. Проверьте закон Hess
Проверьте закон Hess
1. NaOH (AQ) +HCL (AQ (AQ ) —> NaCl(водн.) + h3O(ж)
Nh5Cl(водн.) + NaOH(водн.) —> Nh4(водн.) + NaCl(водн.) + h3O(ж.)
Nh4(водн. ) + HCl(водн.) —> Nh5Cl(водн.)
NaOH компенсируется, NaCl компенсируется, h3O компенсируется. Затем у нас остаются HCl, Nh4 и Nh5Cl. Который, когда вы переставите его, будет выглядеть как Nh4 + HCl —> Nh5Cl, что является 3-м уравнением.
2. Реакция 3: Nh4(водн.) + HCl(водн.) —> Nh5Cl(водн.)
(-314,55) — (-80,8 — 167,2) =
-314,55 + 248 = -60,045 Дельта H = -66,55 кДж/моль (с использованием дельты H реакции 3)
(Реакция 1) — (Реакция 2) =
(-56,79) — (9,8) = -66,59 кДж/моль (используя значения реакции 1 и 2 для определения дельты H реакции 3)
3. Разница в процентах
-66,59 — (-66,55)
—- —————- = 0,06
-66,55
Разница в процентах = 6%
Что такое гидроксид аммония? — The Chemistry Blog
Гидроксид аммония представляет собой основной или щелочной раствор аммиака, который имеет несколько применений, таких как мытье окон, очистка воды, производство алкиламина и обработка пищевых продуктов. Он также используется в лаборатории для качественного анализа неорганических веществ и может использоваться в качестве химического индикатора.
Он также используется в лаборатории для качественного анализа неорганических веществ и может использоваться в качестве химического индикатора.
Гидроксид аммония иначе известен как раствор аммиака, аммиачная вода, аммиачная жидкость или нашатырный спирт. Хотя некоторые называют его просто аммиаком, на самом деле это неверно, поскольку гидроксид аммония представляет собой водный раствор, а аммиак находится в газообразной форме.
Несмотря на это, формула гидроксида аммония такая же, как у аммиака, потому что, хотя молекулы разделяются на гидроксид и ионы аммония, молекулы гидроксида аммония невозможно выделить.
В этом сообщении:
Какова формула гидроксида аммония?
Гидроксид аммония представляет собой щелочное соединение с формулой NH 4 OH. Это связано с тем, что раствор содержит следующие ионы: [NH 4 + ][OH — ]. Его стандартная формула выражается просто как водный раствор аммиака: NH 3 (водн.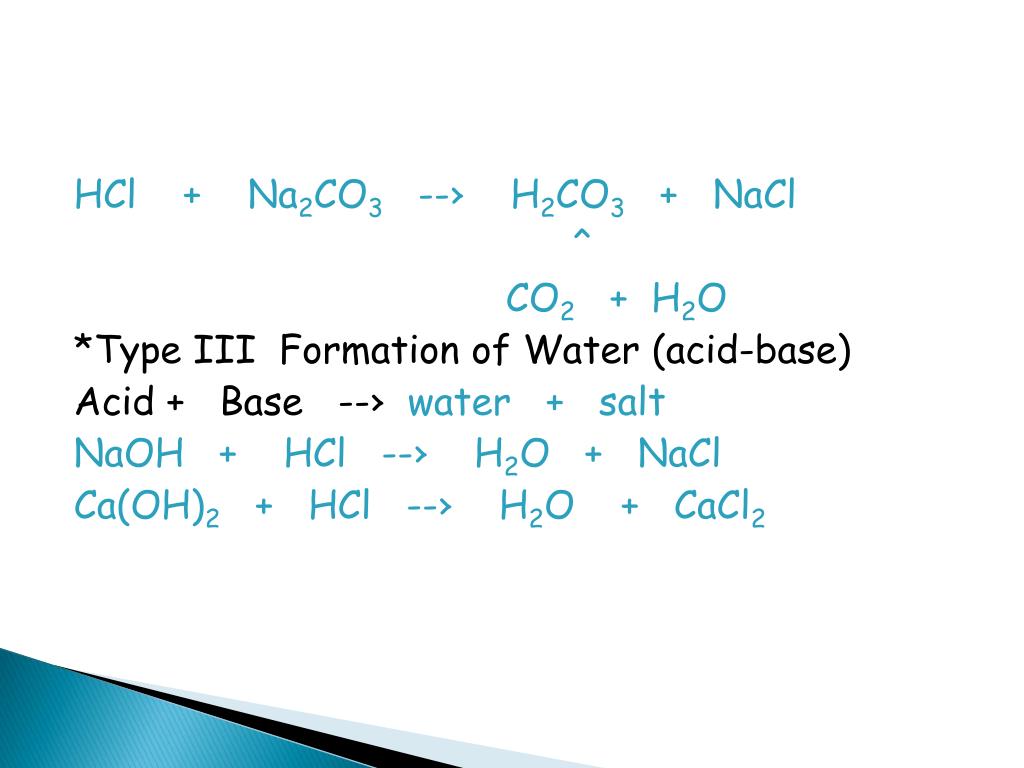 ).
).
Основная причина этого заключается в том, что образцы гидроксида аммония невозможно выделить из раствора, а также потому, что в растворе не так много ионов. Это означает, что молекулярный аммиак по-прежнему преобладает, за исключением крайне разбавленных растворов.
По молекулярному строению это вещество имеет тригонально-пирамидальную геометрическую форму, как показано ниже:
Щелочность водного раствора аммиака обусловлена депротонированием (переносом протона) небольшой доли молекулы воды. Это приводит к образованию ионов аммония и гидроксида, как показано в приведенном ниже сбалансированном уравнении:0542 2 O ⇌ NH 4 + + OH −
Only a very small amount аммиака в водном растворе превращается в ионы. Например, в одном моле раствора аммиака примерно 0,43% молекул аммиака превращаются в аммоний. Эквивалент pH этого одного моля раствора равен 11,3. Это основано на приведенных ниже вычислениях с учетом базовой константы ионизации:
Например, в одном моле раствора аммиака примерно 0,43% молекул аммиака превращаются в аммоний. Эквивалент pH этого одного моля раствора равен 11,3. Это основано на приведенных ниже вычислениях с учетом базовой константы ионизации:
- [Nh5+] = 0,0042 M
- [OH-] = 0,0042 M
- Nh4] = 0,9958 M
- pH = 14 + log10[OH-] = 11,62
Источник
Поскольку константа представляет собой просто отношение концентрации, она не имеет единицы измерения, и мы можем подставить заданные значения. С учетом этого его можно записать так:
K b = [NH 4 + ][OH − ] / [NH 3 ] = 1,77 × 10 −5
Ниже приведен табличный список некоторых слабых оснований и соответствующих им констант ионизации оснований. Эти константы полезны при определении неизвестной концентрации ионов в растворе. Эти константы действительны при 25°C.
Эти константы полезны при определении неизвестной концентрации ионов в растворе. Эти константы действительны при 25°C.
Источник
Является ли гидроксид аммония токсичным?
Концентрация аммиака в растворе гидроксида аммония, которая может достигать 30%, делает его токсичным. Если случайно вдохнуть пары аммиака, это может привести к раздражению дыхательных путей, особенно полости носа, где первыми начальными рефлекторными реакциями являются чихание и кашель. Если вы подвергаетесь воздействию высоких концентраций вещества, это может привести к отеку легких или отеку легких. За падением уровня кислорода в крови может следовать цианоз, вызывающий шок и судороги.
Пары аммиака также могут раздражать глаза, кожу и слизистую оболочку стенок желудка. Он может даже перфорировать желудочно-кишечный тракт. Другие риски, связанные с длительным воздействием гидроксида аммония, включают угнетение центральной нервной системы, изъязвление роговицы и конъюнктивы глаз, что может привести к временной слепоте. Мало того, он может серьезно раздражать кожу и даже привести к химическим ожогам. При проглатывании гидроксид аммония может вызвать у человека тошноту и рвоту.
Мало того, он может серьезно раздражать кожу и даже привести к химическим ожогам. При проглатывании гидроксид аммония может вызвать у человека тошноту и рвоту.
При работе в лаборатории с гидроксидом аммония или при использовании его для мытья окон, например, вы должны носить перчатки, защитные очки и защитную одежду, чтобы избежать контакта с кожей и слизистыми оболочками. Вы также должны носить лицевую маску или противогаз с респиратором при работе с большими количествами химического вещества.
Является ли гидроксид аммония кислотой?
Гидроксид аммония имеет очень высокий pH, что делает его щелочным или щелочным веществом. По определению это означает, что гидроксид аммония не является кислотой, поскольку кислоты имеют уровень pH ниже 7, что является нейтральным уровнем. Для сравнения, один моль этого раствора имеет рН 11,3.
Согласно теории кислот и оснований Бренстеда-Лоури, кислота отдает протоны, а основание является акцептором протонов. Протон здесь — ион водорода, который на самом деле просто протон.
Вещество не обязательно должно иметь ион водорода или гидроксид-ион, чтобы считаться кислотой или основанием. Пока выполняется условие действия в качестве донора или акцептора протонов, вещество можно классифицировать как кислоту или основание. Рассмотрим пример ниже:
Это уравнение показывает, что в смеси водного раствора соляной кислоты и гидроксида аммония (растворенный аммиак) соляная кислота отдает протон аммиаку. В результате реакции образуется ион аммония, который заряжен положительно, и ион хлорида, который заряжен отрицательно.
Таким образом, HCl классифицируется как кислота Бренстеда-Лоури, а аммиак классифицируется как основание Бренстеда-Лоури. Кроме того, ион хлорида известен как сопряженное основание кислоты, а ион аммония является сопряженным основанием аммиака.
Растворим ли гидроксид аммония?
Гидроксид аммония сам по себе представляет собой водный раствор аммиака. Он не только растворяется в воде, но и смешивается. Это означает, что он может образовывать с водой полностью однородную смесь. Однако он не растворяется в неполярных растворителях.
Это означает, что он может образовывать с водой полностью однородную смесь. Однако он не растворяется в неполярных растворителях.
Помимо воды, аммиак также растворим в хлороформе, этаноле и метаноле. Подобно другим типам газов, растворимость аммиака в воде и других растворителях обратно пропорциональна температуре растворителя и окружающей среды. С повышением температуры растворимость аммиака уменьшается.
Оптимальная растворимость, т.е. точка насыщения аммиака в воде, достигается при 15,6°C. При этой температуре раствор содержит 35,6% аммиака по массе.
Заявление об ограничении ответственности
Блог на сайтеchemicals.co.uk и все, что в нем публикуется, предоставляется только в качестве информационного ресурса. Блог, его авторы и аффилированные лица не несут ответственности за любые несчастные случаи, травмы или ущерб, вызванные частично или непосредственно в результате использования информации, представленной на этом веб-сайте. Мы не рекомендуем использовать какие-либо химические вещества без предварительного ознакомления с Паспортом безопасности материала, который можно получить у производителя, и следуя советам по безопасности и мерам предосторожности, указанным на этикетке продукта.

 0012
0012