SCIRP Открытый доступ
Издательство научных исследований
Журналы от A до Z
Журналы по темам
- Биомедицинские и биологические науки.
- Бизнес и экономика
- Химия и материаловедение.
- Информатика. и общ.
- Науки о Земле и окружающей среде.
- Машиностроение
- Медицина и здравоохранение
- Физика и математика
- Социальные науки. и гуманитарные науки
Журналы по тематике
- Биомедицина и науки о жизни
- Бизнес и экономика
- Химия и материаловедение
- Информатика и связь
- Машиностроение
- Медицина и здравоохранение
- Физика и математика
- Социальные и гуманитарные науки
Публикация у нас
- Представление статьи
- Информация для авторов
- Ресурсы для экспертной оценки
- Открытые специальные выпуски
- Заявление об открытом доступе
- Часто задаваемые вопросы
Публикуйте у нас
- Представление статьи
- Информация для авторов
- Ресурсы для экспертной оценки
- Открытые специальные выпуски
- Заявление об открытом доступе
- Часто задаваемые вопросы
Подпишитесь на SCIRP
Свяжитесь с нами
клиент@scirp. org org | |
| +86 18163351462 (WhatsApp) | |
| 1655362766 | |
| Публикация бумаги WeChat |
| Недавно опубликованные статьи |
| Недавно опубликованные статьи |
Безопасность водного экстракта листьев Senna alata (L.) Roxb. (Leguminosae-Caesalpinioideae), растение, используемое в Бенине для лечения инфекций()
Максимин Сену, Рене Деу, Фелисьен Агбогба, Паскаль Чогоу, Йолланде Абисси, Альбан Хунгбеме, Гутемберг Кпоссу, Эжени Анаго, Эжен Аттакпа
Journal of Biosciences and Medicines Vol.
 10 No.12, 16 декабря 2022 г.
10 No.12, 16 декабря 2022 г.DOI: 10.4236/jbm.2022.1012008 14 загрузок 92 просмотра
- Определение факторов, ограничивающих урожайность сорго, и критериев фермера в Восточном и Северо-Западном Нигере()
Ардали Абду Усейни, Мамаду Айссата Ибрагим, Джон Спаситель Яв Элеблу, Квадво Офори, Иссака Бурейма Хамани
Журнал библиотеки открытого доступа Том 9№12, 16 декабря 2022 г.
DOI: 10.4236/oalib.1109543 9 загрузок 55 просмотров
Взаимосвязь между формой коррозии и элюирующим поведением поверхностей медных трубок с различным содержанием остаточного углерода()
Юма Кано, Итару Икеда, Такаши Иясу, Юна Ямагучи, Ютака Ямада, Осаму Сакурада
Материаловедение и приложения Том 13 № 12, 16 декабря 2022 г.

DOI: 10.4236/MSA.2022.1312037 7 загрузок 46 просмотров
Влияние некоторых физико-химических факторов воздействия на содержание карбоцистеина во вскрытом фармацевтическом продукте()
Жан-Кисито Куаме, Мариэтт Дезире Йеэ, Карин Нина Эйбл, Винсент Де Поль Ови, Эрве Тазо Бро, Клод Беренже Нгалемо Нганчуко, Гильдас Коменан Гбасси
Американский журнал аналитической химии Том 13 № 12, 16 декабря 2022 г.
DOI: 10.4236/ajac.2022.1312033 9 загрузок 56 просмотров
Антибактериальная активность экзогенного глутатиона и его синергизм в отношении антибиотиков в метициллин-ассоциированных клинических изолятах с множественной лекарственной устойчивостью Staphylococcus aureus ()
Клейфорд Сенра, Минерва А.
 Гарсия, Донг Х. Квон
Гарсия, Донг Х. КвонДостижения микробиологии Том 12 № 12, 16 декабря 2022 г.
DOI: 10.4236/цель.2022.1212044 9 загрузок 57 просмотров
Быстрый алгоритм для обучения крупномасштабных машин опорных векторов()
Майова Кассим Арегбесола, Игорь Грива
Журнал компьютеров и коммуникаций Том 10 № 12, 16 декабря 2022 г.
DOI: 10.4236/jcc.2022.1012001 10 загрузок 52 просмотров
Подпишитесь на SCIRP
Свяжитесь с нами
клиент@scirp.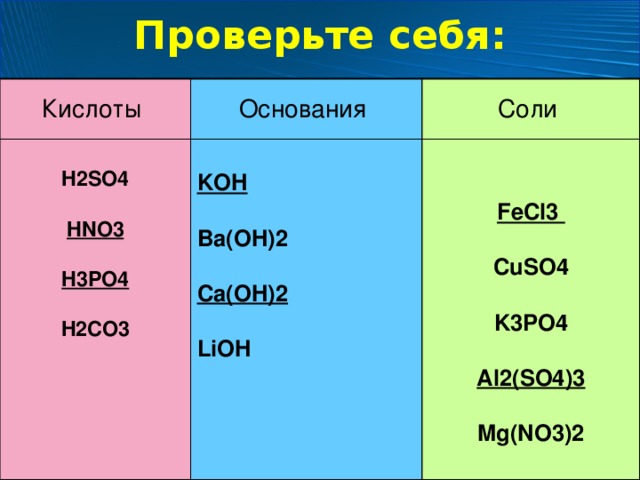 org org | |
| +86 18163351462 (WhatsApp) | |
| 1655362766 | |
| Публикация бумаги WeChat |
Бесплатные информационные бюллетени SCIRP
Copyright © 2006-2022 Scientific Research Publishing Inc. Все права защищены. ВершинаBa(oh)2 Структура Льюиса, характеристики: 13 фактов, которые необходимо знать
Гидроксид бария получают при растворении оксида бария в воде. Он существует в виде белых гранул. Он используется в качестве дегидратирующего агента и используется для удаления серы из различных соединений.
Ba(oh)2 Структурный чертеж Льюиса Ba(oh)2 образован двумя элементами, т. е. одним является атом бария, а другим является гидроксидная группа. Ba является родственным щелочноземельному металлу, то есть группе (II), а кислород является родственным семейству группы 16. Барий имеет атомный номер 56. Электронная конфигурация его самой внешней оболочки — [Xe] 6s2. Когда он теряет два электрона, он приобретает ближайшую конфигурацию благородного газа Xe.
е. одним является атом бария, а другим является гидроксидная группа. Ba является родственным щелочноземельному металлу, то есть группе (II), а кислород является родственным семейству группы 16. Барий имеет атомный номер 56. Электронная конфигурация его самой внешней оболочки — [Xe] 6s2. Когда он теряет два электрона, он приобретает ближайшую конфигурацию благородного газа Xe.
Когда атом Ba теряет 2 электрона, образуется ион Ba+2. В случае гидроксильного радикала атом O связан одинарной связью с атомом H, т.е. содержит всего 7 электронов. Когда 2 радикала Oh получают по 1 электрону, каждый из которых отторгается Ba, он получает стабильную ближайшую конфигурацию благородного газа Ne. Затем ионы Ba+2 и 2Oh- присоединяются колумбовой силой притяжения и образуется ba(oh)2.
Ba(oh)2 Структурный резонанс Льюиса Резонанс — это эмпирический метод, при котором электроны перемещаются от одного атома к другому, теряя и приобретая электроны. Гидроксид бария представляет собой нейтральное соединение с нулевым формальным зарядом (fc). При резонансе Ba(oh)2 распадается на ион Ba+2 и 2 иона OH-.
Гидроксид бария представляет собой нейтральное соединение с нулевым формальным зарядом (fc). При резонансе Ba(oh)2 распадается на ион Ba+2 и 2 иона OH-.
Ионы бария и гидроксида стабилизируются, потому что оба после резонанса приобретают стабильную конфигурацию ближайшего благородного газа, т. е. ион Ba2+ имеет благородную электронную конфигурацию ксенона (Xe), а ион гидроксида приобретает конфигурацию благородного газа неона (Ne), оба иона выполнили свой октет после резонанс.
Ba(oh)2 Форма структуры ЛьюисаСогласно теории VSEPR ba(oh)2 имеет октаэдрическую координационную геометрию. В кристаллической структуре ba(oh)2 6 ионов Ba2+ окружены 6 ионами Oh- и 6 ионов Oh- окружены 6 ионами Ba2+.
По этой причине ионы Ba2+ и Oh- имеют координационное число равное 6. Из-за этого ba(oh)2 имеет октаэдрическую форму и приобретает d2sp3-гибридизацию.
Ba(oh)2 Структура Льюиса Формальные заряды В гидроксиде бария общий формальный заряд соединения равен нулю. Ba(oh)2 ионизируется с образованием ионов Ba2+ и 2 Oh-. Барий имеет +2 формальных заряда, которые уравновешиваются формальным зарядом 2 гидроксида -1.
Ba(oh)2 ионизируется с образованием ионов Ba2+ и 2 Oh-. Барий имеет +2 формальных заряда, которые уравновешиваются формальным зарядом 2 гидроксида -1.
В кубической кристаллической решетке гидроксида бария 6 ионов Ba2+ окружены 6 ионами Oh- и 6 ионов Oh- окружены 6 ионами Ba2+, что делает все соединение электрически нейтральным.
Ba(oh)2 Структурный уголок ЛьюисаКак видно из структуры льюиса ba(oh)2, ba(oh)2 имеет октаэдрическую геометрию с гибридизацией d2sp3 и согласно октаэдрической геометрии угол должен быть равен 900. Ba(oh)2 также обладает таким же валентным углом, равным до 900.
Ba(oh)2 Правило октета структуры Льюиса В структуре Льюиса гидроксида бария как ионы бария, так и гидроксид ионы соответствуют своему октету. Когда образуется ba(oh)2, ba теряет два электрона из валентной оболочки, чтобы приобрести ближайшую конфигурацию благородного газа Xe, которая имеет 8 электронов в валентной оболочке (5s 2 5p 6 ), т. е. октет выполнен.
е. октет выполнен.
Гидроксид-радикал получает два электрона, которые отбрасываются атомом ba, чтобы приобрести ближайшую конфигурацию благородного газа неона, который также имеет 8 валентных электронов (2s2 2p6). Следовательно, и барий, и радикал oh выполнили свой октет.
Ba(oh)2 Структура Льюиса Неподеленные парыКогда мы видим структуру ba(oh)2 Льюиса, ноль неподеленной пары присутствует на атоме Ba и 1 неподеленная пара электронов присутствует на ионе гидроксида.
Это связано с тем, что барий теряет два своих электрона с образованием иона Ba2+, который не содержит ни одной неподеленной пары электронов. Но 2 радикала Oh приобретают по 1 электрону, каждый из которых отторгается атомом Ва и превращается в 2 иона Oh-, в которых на каждом ионе Oh- присутствует 1 неподеленная пара электронов.
Валансные электроны Ba(oh)2 Прежде всего, чтобы узнать общее количество валентных электронов в Ba(oh)2, важно выяснить электронную конфигурацию атома Ba. Электронная конфигурация атома Ba — [Xe] 6s2, и из электронной конфигурации ba мы видим, что в валентной оболочке атома Ba имеется 2 электрона.
Электронная конфигурация атома Ba — [Xe] 6s2, и из электронной конфигурации ba мы видим, что в валентной оболочке атома Ba имеется 2 электрона.
В радикале О 7 электронов. Общее количество валентных электронов, существующих на ba(oh)2, будет равно (сумме валентного электрона атома Ba и радикала oh), т.е. равно (1*2)+(7*2)=16. В ba(oh)2 16 валентных электронов.
Ba(oh)2 ГибридизацияПри распаде ba(oh)2 образуются Ba+2 и 2 Oh-ионы. Гидроксид бария имеет кубическую структуру кристаллической решетки. И атом бария, и гидроксидный радикал обладают гибридизацией d2sp3, т.е. ba(oh)2 имеет октаэдрическую координационную геометрию.
В структуре кристаллической решетки гидроксида бария каждый ион Ba+2 окружен шестью ионами Oh- и каждый ион Oh- окружен 6 ионами Ba+2. Следовательно, и ион бария, и гидроксид-ион имеют одинаковое координационное число, равное 6.
Ba(oh)2 Растворимость В ba(oh)2 из-за большей электроотрицательности oh-группы и меньшей электроотрицательности атома бария он существует в ионах Ba2+ и 2 oh-, т. е. образуются противоположные диполи. Поскольку различные диполи создаются на ионах Ba2+ и oh-, это полярное соединение.
е. образуются противоположные диполи. Поскольку различные диполи создаются на ионах Ba2+ и oh-, это полярное соединение.
Растворим в полярных растворителях, т.е. этанол (C2H5OH), разбавленные минеральные кислоты, такие как HCl, HBr, HF и т. д., а также растворимые в воде. Но он не растворяется в неполярных растворителях, таких как ацетон, эфир и т. д. Когда гидроксид бария реагирует с водой, образуются ионы Ba2+ и гидроксид-ионы. Эта среда является базовой по своей природе.
Растворимость Ba(oh)2 в воде Является ли Ba(oh)2 ионным?Ba(oh)2 представляет собой ионное соединение. Это связано с тем, что ba(oh)2 распадается на ионы Ba2+ и Oh- при растворении в водном растворе или в расплавленном состоянии. Это важная характеристика ионного соединения.
Проводит электричество в водном или расплавленном состоянии. Это происходит из-за присутствия ионов Ba2+ и Oh- в обоих состояниях, и мы также знаем, что ионы переносят ток. Подобно ионным соединениям, ba(oh)2 растворяется в полярных растворителях, например, в воде, метаноле и т. д.
Подобно ионным соединениям, ba(oh)2 растворяется в полярных растворителях, например, в воде, метаноле и т. д.
Гидроксид бария представляет собой полярное соединение. Это связано с тем, что в гидроксиде бария и атом бария, и гидроксидный радикал имеют разную электроотрицательность, и, следовательно, на барийном и гидроксидном радикалах создается противоположный диполь.
Из-за меньшей электроотрицательности бария он приобретает на нем положительный диполь, а из-за большей электроотрицательности атома О радикал О имеет отрицательный диполь. Поскольку противоположные диполи создаются на гидроксиде бария, это ионное соединение с высоким дипольным моментом. Следовательно, ba(oh)2 является полярным соединением.
Является ли Ba(oh)2 кислотным или основным? Ba имеет большую склонность к потере электронов, т.е. имеет металлические характеристики. Ba(oh)2 является основным по своей природе.

 10 No.12, 16 декабря 2022 г.
10 No.12, 16 декабря 2022 г.
 Гарсия, Донг Х. Квон
Гарсия, Донг Х. Квон