Про молярный объем. Химия, 8 класс, параграф 44-46, 2 вопрос. Рудзитис и Фельдман – Рамблер/класс
Про молярный объем. Химия, 8 класс, параграф 44-46, 2 вопрос. Рудзитис и Фельдман – Рамблер/классИнтересные вопросы
Школа
Подскажите, как бороться с грубым отношением одноклассников к моему ребенку?
Новости
Поделитесь, сколько вы потратили на подготовку ребенка к учебному году?
Школа
Объясните, это правда, что родители теперь будут информироваться о снижении успеваемости в школе?
Школа
Когда в 2018 году намечено проведение основного периода ЕГЭ?
Новости
Будет ли как-то улучшаться система проверки и организации итоговых сочинений?
Вузы
Подскажите, почему закрыли прием в Московский институт телевидения и радиовещания «Останкино»?
Помагите, кому не жалко. .. Поясните, почему можно вывести понятие «молярный объем газа» на основе следствия закона Авогадро.
.. Поясните, почему можно вывести понятие «молярный объем газа» на основе следствия закона Авогадро.
Лучший ответ
тёска, лови
При одних и тех же условиях расстояниемежду отдельными молекулами у всех газов примерно одинаковое. Объем самих молекул по сравнению с межмолекулярными расстояниями мал, поэтому в равных объемах газов одинаковое число молекул. Поэтому 1 моль любого газа занимает одинаковый объем. Объем 1 моль данного газа и называют молярным объемом газа.
еще ответы
ваш ответ
Можно ввести 4000 cимволов
отправить
дежурный
Нажимая кнопку «отправить», вы принимаете условия пользовательского соглашения
похожие темы
Психология
ЕГЭ
10 класс
9 класс
похожие вопросы 5
Всем привет! Решим задачку? химия 10 класс Рудзитис задача 4 параграф 13
Подскажите верное решение) вот условие: Какой объем воздуха (н.
ГДЗ10 классХимияРудзитис Г.Е.
Приготовление раствора сахара и расчёт его массовой доли в растворе. Химия. 8 класс. Габриелян. ГДЗ. Хим. практикум № 1. Практ. работа № 5.
Попробуйте провести следующий опыт. Приготовление раствора
сахара и расчёт его массовой доли в растворе.
Отмерьте мерным (Подробнее…)
ГДЗШкола8 классХимияГабриелян О.С.
Здравствуйте.
(Подробнее…)
Химия
16. Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)… Цыбулько И. П. Русский язык ЕГЭ-2017 ГДЗ. Вариант 13.
16.
Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)
в предложении должна(-ы) стоять запятая(-ые). (Подробнее…)
ГДЗЕГЭРусский языкЦыбулько И.П.
ЕГЭ-2017 Цыбулько И. П. Русский язык ГДЗ. Вариант 13. 18. Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых). ..
..
18.
Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)
в предложении должна(-ы) стоять запятая(-ые). (Подробнее…)
ГДЗЕГЭРусский языкЦыбулько И.П.
|
|
Молярный объем и молярная концентрация — Mini Chemistry
от Mini Chemistry
Показать/скрыть подтемы (стехиометрия | уровень O)Молярный объем

- Молярный объем изменяется в зависимости от температуры и давления. (Более высокая температура = больший объем, более высокое давление = меньший объем)
- Молярный объем при фиксированной температуре и давлении одинаков для ВСЕХ газов. 9{3}$
Делиться значит заботиться:
Категории O Уровень, Стехиометрия Теги
Молярный объем газа: значения и примеры
Представьте, что у вас есть бутылка газированного напитка. Мы знаем, что когда мы открываем бутылку, она сильно шипит. Знаете ли вы, что это шипение на самом деле указывало на то, что газ выходит из бутылки? Это также можно увидеть на шинах. Иногда в машине нам может понадобиться заправить их бензином, что означает утечку бензина. В обоих случаях мы видим газ, но сколько газа содержится в каждой из этих вещей? Здесь мы можем изучить, как измерить молярный объем газа и что мы будем исследовать в этой статье.
- Сначала мы рассмотрим определение молярного объема газа
- Затем мы рассмотрим уравнение молярного объема газа при комнатной температуре и давлении.

- Затем мы изучим молярные единицы объема газа.
Затем мы рассмотрим другой тип уравнения молярного объема газа, который возникает при некомнатных температуре и давлении.
Наконец, мы рассмотрим несколько примеров расчета молярного объема газа.
Определение молярного объема газа
Итак, каков молярный объем газа?
Итак, если мы разберем его, это позволит нам увидеть, что это измерение объема одного моля газа, это может быть при комнатной температуре и давлении или не при комнатной температуре и давлении. Комнатная температура 298,15 К, стандартное давление 1 атм.
Молярный объем газа – это пространство, которое занимает один моль газа при определенных условиях.
Давайте посмотрим на эти газовые баллоны, они могут хранить многие типы газов, такие как кислород, который вы можете увидеть в больницах, или баллоны с углекислым газом, которые используются для газирования безалкогольных напитков.
 Знаете ли вы, как рассчитать, сколько одного моля газа может занять один из этих газовых баллонов? Читай дальше что бы узнать!
Знаете ли вы, как рассчитать, сколько одного моля газа может занять один из этих газовых баллонов? Читай дальше что бы узнать!Чтобы вычислить температуру от градусов Цельсия до Кельвина, мы прибавляем 273,15 к температуре в градусах Цельсия. Ранее мы упоминали бутылку газированного напитка. Используя измерения газированного напитка и пока у нас есть два из объема, моли или молярный объем, мы можем найти ответ, который мы ищем.
Молярный объем газа формула
Молярный объем – это объем одного моля газа при заданных условиях (температура и давление). Интересно, что все газы имеют примерно одинаковый объем при одинаковых условиях. Если вы работаете в так называемых стандартных условиях (давление 1 атм и 298,15 К), можно сказать, что все газы поглощают примерно 24,5 дм 3 на моль газа. Для всех нестандартных условий вам придется фактически рассчитывать!
Запоминание 24,5 дм3 на моль газа при стандартных условиях помогает пропустить множество вычислений на экзамене A-level и сэкономить время.

Объем — это объем пространства, занимаемый трехмерной фигурой. Опять же, если мы исследуем это с помощью бутылки для газированного напитка, мы знаем, что они бывают разных размеров. Например, 330 мл и 1 л являются примерами объема.
Наконец-то у нас появились родинки. Это количество вещества. Если это необходимо рассчитать, есть несколько способов сделать это, например, это можно сделать, разделив вес вещества на молекулярную массу вещества. Это даст количество молей вещества. Например, если бы у нас было 24 г кислорода, для расчета молей мы бы разделили массу 24 г на молекулярную массу, которая для кислорода равна 32 г/моль: 93\]
Молярная единица объема газа
Итак, как мы исследовали ранее в статье, мы знаем, что при стандартной температуре и давлении молярный объем газа составляет около 24,5 дм 3 . Тем не менее, важно помнить, что при нестандартных температурах этот показатель может быть разным в зависимости от газа.
В нашем последнем примере вы могли видеть, что молярный объем имеет единицу измерения, и он равен дм 3 , разделенному на моли.
 Это довольно интуитивно понятно, если учесть, как мы нашли это число, измерив, сколько объема занимает 1 моль газа. вверх. Неудивительно, что в следующем разделе вы увидите, что, просто следуя закону идеального газа, вы вернетесь к тем же результатам для единицы измерения.
Это довольно интуитивно понятно, если учесть, как мы нашли это число, измерив, сколько объема занимает 1 моль газа. вверх. Неудивительно, что в следующем разделе вы увидите, что, просто следуя закону идеального газа, вы вернетесь к тем же результатам для единицы измерения.Молярный объем газа в нестандартных условиях формула
Идеальных газов не существует, но мы любим использовать их для расчетов. Они ведут себя очень похоже на большинство газов в большинстве условий, поэтому мы можем использовать удобное уравнение для идеальных газов, чтобы рассчитать вещи и для реальных газов. Итак, что это за удобное уравнение? Вот он:
\[ p \times V = n \times R \times T\]
Здесь вам нужно знать пару вещей о газе, чтобы его использовать, а именно:
p = давление [Па].
V = объем [м 3 ]
n = моли [моль]
R = это газовая постоянная, которая примерно равна 8,314 [JK -1 моль -1 ]
7 T = температура [K]
Как и в любом уравнении, вы можете исключить один параметр (это будет неизвестный) и все равно вычислить результаты.
 Молярный объем — это то, сколько места (V) занимает моль газа (n). Разделив обе части на n, получим уравнение молярного объема:
Молярный объем — это то, сколько места (V) занимает моль газа (n). Разделив обе части на n, получим уравнение молярного объема:\[\text{молярный объем} = V \div n = R \times T \div p\]
Это означает, что молярный объем зависит только от двух условий температуры и давления. Будет увеличиваться с температурой и уменьшаться с давлением. Поэтому, если вы хотите транспортировать много газа, вы должны сжать его (поднять давление) и охладить (понизить температуру). Именно так компании транспортируют природный газ кораблями, это называется сжиженным природным газом и является лишь одним из примеров использования химии в реальном мире.
Давайте теперь воспользуемся этим уравнением для расчета некоторых свойств газов, а после этого мы приступим к измерению!
Молярный объем газа, примеры
Теперь, когда мы узнали, как рассчитать молярный объем газа при комнатной температуре и давлении, какие условия являются стандартными, и какое уравнение использовать для всех других условий, давайте поработаем с пару примеров вместе!
Допустим, у нас есть колба объемом 1500 см 3 , который содержит 5,45 г неизвестного газа.
 Давление в колбе 250 кПа, температура 21°С.
Давление в колбе 250 кПа, температура 21°С.Рассчитайте относительную молекулярную массу газа.
1. Во-первых, нам нужно перестроить уравнение для расчета молей:
\[ p \times V = n \times R \times T\]
2. Теперь нам нужно рассчитать, какие значения будут ввести в уравнение:
p = 250 кПа, что равно 250 000 Па
V = 1500 см 3 9{-1}\]
Хотя существует множество вариантов того, чем может быть этот газ, и мы не можем быть уверены, однако, это подозрительно похоже на газ Cl 2 . Постараемся не сломать!
В качестве второго примера рассмотрим гораздо более безопасный для человека газ кислород:
Рассчитаем объем, занимаемый 0,666 моль кислорода при давлении 180 кПа и температуре 27 °C
1. Нам нужно чтобы изменить уравнение для расчета объема, это будет:
93\]Как мы упоминали ранее, большинство газов ведут себя очень похоже на идеальные газы, и мы можем использовать эти вычисления, чтобы узнать их объем, давление или количество молей в них.
 Однако не все газы похожи на идеальные газы, и иногда «они ведут себя примерно как идеальные газы» просто не режут. Если вы действительно хотите знать (как почти все), вы должны измерить это! Итак, приступим к измерениям!
Однако не все газы похожи на идеальные газы, и иногда «они ведут себя примерно как идеальные газы» просто не режут. Если вы действительно хотите знать (как почти все), вы должны измерить это! Итак, приступим к измерениям! Измерение молярного объема газов
До сих пор мы рассмотрели два уравнения, которые можно использовать для расчета молярного объема газов, но как мы можем измерить молярный объем газов? Это то, что мы собираемся исследовать сейчас, и не волнуйтесь, это не слишком сложно.
Мы будем использовать реакцию между этановой кислотой. уксусной кислоты и карбоната кальция для этого эксперимента. Полное уравнение этой реакции:
\[ CaCO_3(s) + 2CH_3COOH(s) \rightarrow CO_2(g) + H_2O(l) + Ca(CH_3COO)_2(aq)\]
Вы видите эти маленькие индексы? Они скажут вам, в каком состоянии находится реагент или продукт. Твердые компоненты представлены (s), а газы представлены (g). Точно так же (l) означает, что это жидкость, а (aq) состояния для водного, что означает просто растворенный в воде.
 Вы можете видеть, что мы образуем газ в этой реакции, и контролируя количество CaCO 3 мы используем в этой реакции, мы можем контролировать, сколько газа мы производим. Однако просто производство газа в известных количествах не является нашей целью, мы хотим измерить объем после того, как газ будет добыт. Для этого нам понадобится специальная установка, и мы рассмотрим ее далее.
Вы можете видеть, что мы образуем газ в этой реакции, и контролируя количество CaCO 3 мы используем в этой реакции, мы можем контролировать, сколько газа мы производим. Однако просто производство газа в известных количествах не является нашей целью, мы хотим измерить объем после того, как газ будет добыт. Для этого нам понадобится специальная установка, и мы рассмотрим ее далее.Оборудование
Нам нужно довольно много вещей, но будьте уверены, что ваш техник или учитель позаботится о том, чтобы у вас было все необходимое и чтобы все было в безопасности. Настройка выглядит так:
Как вы можете видеть на картинке выше, вам понадобится много, чтобы построить эту установку. В частности, для измерения объема газа вам потребуется следующее:
- Подставка и зажим
- Трубка для кипячения
- Водяная баня для сбора газа
- Пробка с нагнетательной трубкой для установки в трубку для кипячения
- Пробирка
- Кипячение трубка
- Весы
- 100 см 3 мерный цилиндр
- 50 см 3 мерный цилиндр
- 1 моль дм -3 Этановая кислота
- Порошкообразный карбонат кальция
Теперь, когда у вас есть все это, приступим к измерениям!
Метод
Вот что вам нужно сделать, чтобы измерить объем:
- Отмерьте 30 см 3 этановой кислоты с помощью мерного цилиндра 50 см 3 и добавьте его в пробирку.

- Теперь установите оборудование, как показано на схеме выше, и убедитесь, что пробка подходит к кипящей трубе, чтобы исключить утечку газа.
- Теперь отмерьте 0,05 г карбоната кальция с помощью весов, добавьте его в пробирку и взвесьте пробирку (запишите полученное значение).
- Снимите пробку с кипящей трубки, быстро добавьте карбонат кальция и закройте пробку.
- Теперь вы заметите, как пузырьки перемещаются в 100-сантиметровый 3 мерный цилиндр, когда он остановится, реакция будет завершена.
- Глядя на мерный цилиндр 100 см 3 , мы можем увидеть, сколько газа было произведено, также запишите это.
- Наконец, повторно взвесьте пробирку с карбонатом кальция.
- Теперь повторите опыт 5 раз, каждый раз увеличивая массу карбоната кальция на 0,05 г. Убедитесь, что вы не используете более 0,4 г за один раз.
- После того, как мы получили все цифры, мы можем теперь проанализировать наши выводы.
Начинаете усердно работать, не так ли? Помните, как легко было использовать это уравнение, вот почему большинство людей просто используют идеальные газы, они очень удобны! Но мы еще не закончили, нам нужно проанализировать данные, которые вы только что собрали!
Анализ
Теперь мы завершили эксперимент и можем работать с некоторыми цифрами.
 Во-первых, мы нанесем наши результаты на график с массой карбоната кальция по оси x и объемом собранного газа по оси y. Исходя из этого, теперь мы можем исследовать различные объемы газа с различными массами карбоната кальция.
Во-первых, мы нанесем наши результаты на график с массой карбоната кальция по оси x и объемом собранного газа по оси y. Исходя из этого, теперь мы можем исследовать различные объемы газа с различными массами карбоната кальция.Результаты измерения- Study Smarter Originals-
Вы можете видеть, что она очень близка к прямой линии, и это здорово, поскольку наше уравнение закона идеального газа предсказало, что это будет прямая линия. Наклон этой линии покажет вам объем газа в дм 3 производится из грамма карбоната кальция. Если вы теперь умножите этот наклон на молярную массу карбоната кальция, вы можете получить молярный объем газа, образующегося в этой реакции (CO2).
Я надеюсь, что теперь вы уверены в своей способности измерить молярный объем газа, но если у вас дома нет оборудования, вы можете, по крайней мере, оценить его с помощью удобного уравнения!
Молярный объем газа – основные выводы
- Молярный объем газа – это измерение объема одного моля газа.


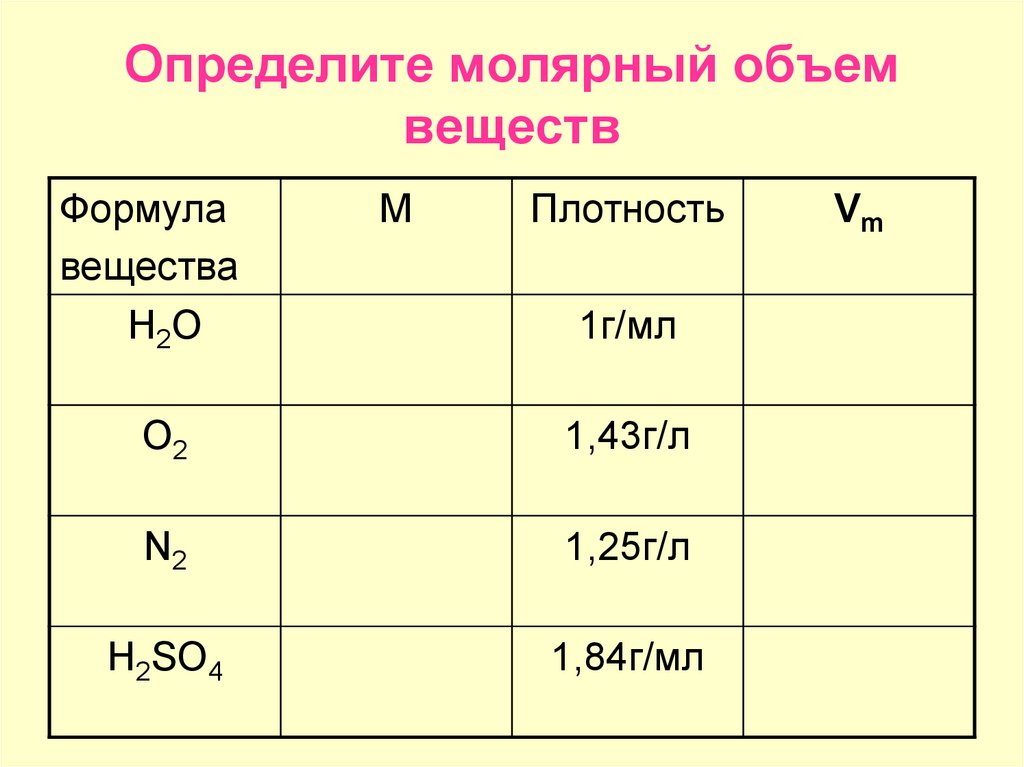
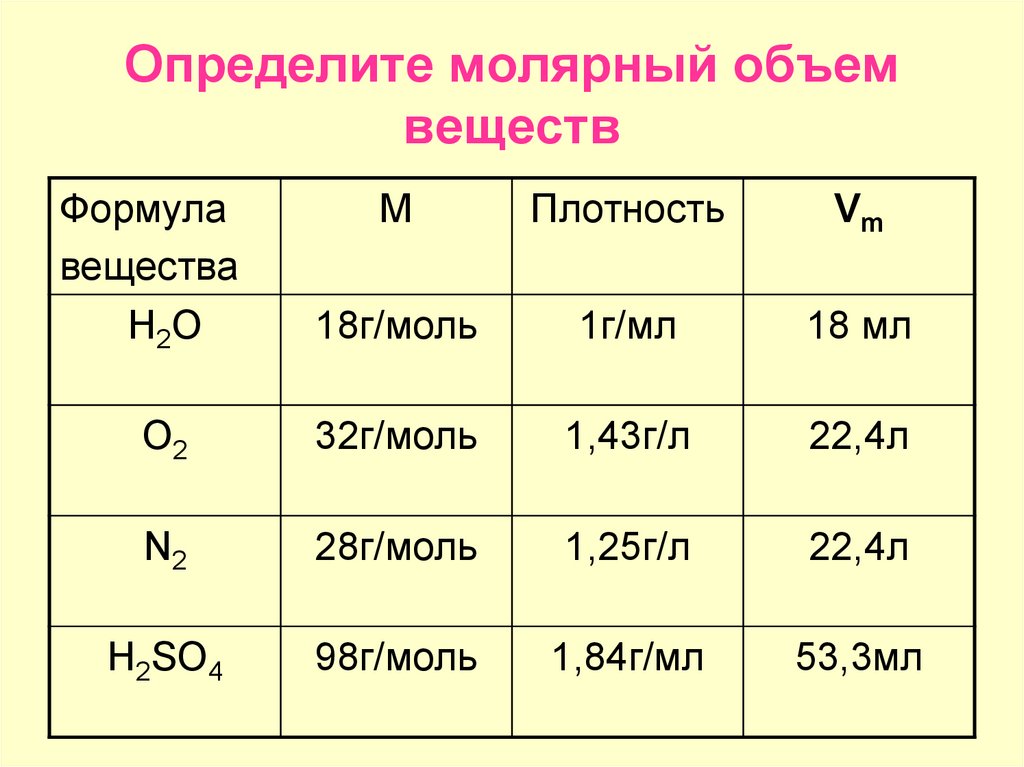 А
поскольку объемы газообразных веществ пропорциональны их количеству, то
коэффициенты уравнения указывают объемные отношения веществ.
А
поскольку объемы газообразных веществ пропорциональны их количеству, то
коэффициенты уравнения указывают объемные отношения веществ.

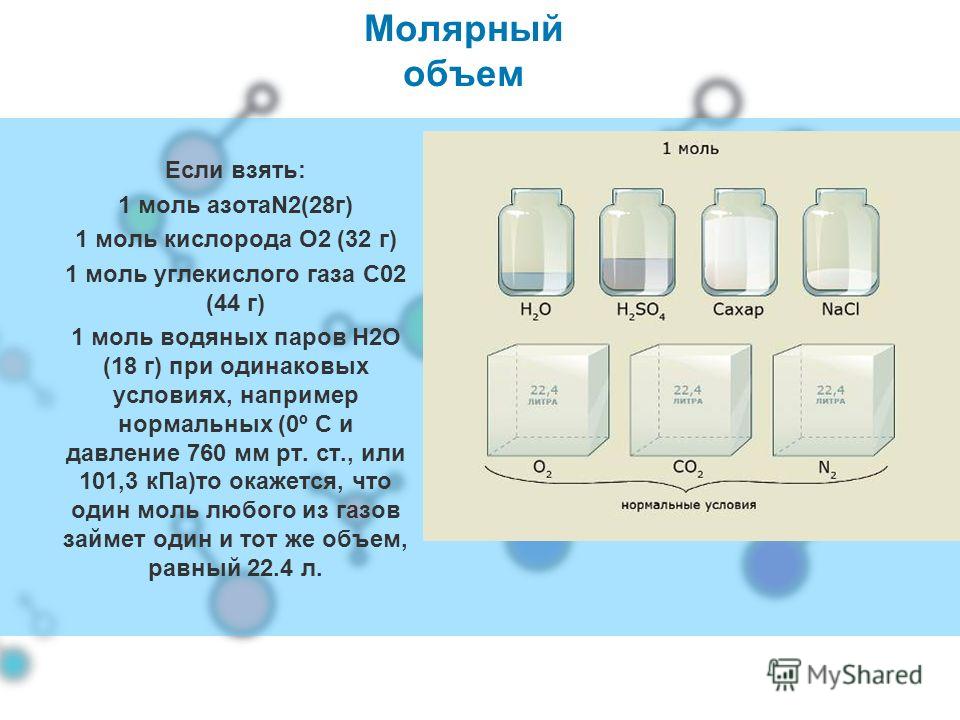 Знаете ли вы, как рассчитать, сколько одного моля газа может занять один из этих газовых баллонов? Читай дальше что бы узнать!
Знаете ли вы, как рассчитать, сколько одного моля газа может занять один из этих газовых баллонов? Читай дальше что бы узнать!
 Это довольно интуитивно понятно, если учесть, как мы нашли это число, измерив, сколько объема занимает 1 моль газа. вверх. Неудивительно, что в следующем разделе вы увидите, что, просто следуя закону идеального газа, вы вернетесь к тем же результатам для единицы измерения.
Это довольно интуитивно понятно, если учесть, как мы нашли это число, измерив, сколько объема занимает 1 моль газа. вверх. Неудивительно, что в следующем разделе вы увидите, что, просто следуя закону идеального газа, вы вернетесь к тем же результатам для единицы измерения. Молярный объем — это то, сколько места (V) занимает моль газа (n). Разделив обе части на n, получим уравнение молярного объема:
Молярный объем — это то, сколько места (V) занимает моль газа (n). Разделив обе части на n, получим уравнение молярного объема: Давление в колбе 250 кПа, температура 21°С.
Давление в колбе 250 кПа, температура 21°С. Однако не все газы похожи на идеальные газы, и иногда «они ведут себя примерно как идеальные газы» просто не режут. Если вы действительно хотите знать (как почти все), вы должны измерить это! Итак, приступим к измерениям!
Однако не все газы похожи на идеальные газы, и иногда «они ведут себя примерно как идеальные газы» просто не режут. Если вы действительно хотите знать (как почти все), вы должны измерить это! Итак, приступим к измерениям!  Вы можете видеть, что мы образуем газ в этой реакции, и контролируя количество CaCO 3 мы используем в этой реакции, мы можем контролировать, сколько газа мы производим. Однако просто производство газа в известных количествах не является нашей целью, мы хотим измерить объем после того, как газ будет добыт. Для этого нам понадобится специальная установка, и мы рассмотрим ее далее.
Вы можете видеть, что мы образуем газ в этой реакции, и контролируя количество CaCO 3 мы используем в этой реакции, мы можем контролировать, сколько газа мы производим. Однако просто производство газа в известных количествах не является нашей целью, мы хотим измерить объем после того, как газ будет добыт. Для этого нам понадобится специальная установка, и мы рассмотрим ее далее.
 Во-первых, мы нанесем наши результаты на график с массой карбоната кальция по оси x и объемом собранного газа по оси y. Исходя из этого, теперь мы можем исследовать различные объемы газа с различными массами карбоната кальция.
Во-первых, мы нанесем наши результаты на график с массой карбоната кальция по оси x и объемом собранного газа по оси y. Исходя из этого, теперь мы можем исследовать различные объемы газа с различными массами карбоната кальция.