Вольфрам лучше свинца. | 16 мая 2021
Что тяжелее сталь или железо??
Лучший ответ:
Это одно и тоже Сталь это тоже самое что и железо. Это прочный материал.
Другие вопросы:
Начни вопрос с Have/Has? it got big ears? you got a sister? she got a cat? Nanny Shine got blue eyes?
Собственая скорость теплохода 30 км/ч скорость течения реки 4целых1/2 км/ч.За ккое время теплоход преодалеет 23 км по течению реки?За какое время теплоход преодалеет 17 км против течения реки?
Металлы человечество начало активно использовать еще в 3000-4000 годах до нашей эры. Тогда люди познакомились с самыми распространенными из них, это золото, серебро, медь. Эти металлы было очень легко найти на поверхности земли. Чуть позже они познали химию и начали выделять из них такие виды как олово, свинец и железо. В Средневековье набирали популярность очень ядовитые виды металлов. В обиходе был мышьяк, которым было отравлено больше половины королевского двора во Франции.
 Так же и ртуть, которая помогала вылечить разные болезни тех времен, начиная от ангины и до чумы. Уже до двадцатого столетия было известно более 60 металлов, а вначале XXI века – 90. Прогресс не стоит на месте и ведет человечество вперед. Но встает вопрос, какой металл является тяжелым и превосходит по весу все остальные? И вообще, какие они, эти самые тяжелые металлы в мире?
Так же и ртуть, которая помогала вылечить разные болезни тех времен, начиная от ангины и до чумы. Уже до двадцатого столетия было известно более 60 металлов, а вначале XXI века – 90. Прогресс не стоит на месте и ведет человечество вперед. Но встает вопрос, какой металл является тяжелым и превосходит по весу все остальные? И вообще, какие они, эти самые тяжелые металлы в мире?Многие ошибочно думают, что золото и свинец являются самыми тяжелыми металлами. Почему именно так сложилось? Многие из нас выросли на старых фильмах и видели, как главный герой использует свинцовую пластину для зашиты от злобных пуль. В добавок, и сегодня используют свинцовые пластины в некоторых видах бронежилетов. А при слове золото у многих всплывает картинка с тяжелыми слитками этого металла. Но думать, что они самые тяжелые – ошибочно!
Для определения самого тяжелого металла надо брать во внимание его плотность, ведь чем больше плотность вещества, тем оно тяжелее.
Что является более тяжелым: золото или свинец?
Практически всем, учащимся в школе, учителя химии рассказывали о невероятной плотности желтого металла. И большинство учеников спрашивало, что тяжелее золото или его собрат по таблице Менделеева – свинец? Она составляет порядка 19,3 грамма на один кубический сантиметр. Благодаря своему химическому составу, золото не вступает ни в какие реакции с окружающей средой.
И большинство учеников спрашивало, что тяжелее золото или его собрат по таблице Менделеева – свинец? Она составляет порядка 19,3 грамма на один кубический сантиметр. Благодаря своему химическому составу, золото не вступает ни в какие реакции с окружающей средой.
Именно поэтому его так активно используют в стоматологии. Этот металл может быть не только желтого цвета. Это зависит от входящих в его состав компонентов. Однако в независимости от цвета изделия из этого металла пользуются невероятной популярностью.
Возникает вопрос, как плотность золота соотносится с плотностью других металлов? У какого элемента самая большая масса? На эти и многие другие вопросы сможет ответить данная статья.
Использование золота
Спрос на желтый металл определяет не только использование его в производстве украшений и увеличения золотовалютных запасов государства. Он также очень широко применяется еще во многих других направлениях.
В промышленности золото начали активно использовать из-за химических свойств. Им покрывают зеркала, работающие в дальнем инфракрасном диапазоне. Это особенно полезно при проведении всевозможных ядерных исследованиях. Также золото очень часто применяют для пайки компонентов из различных материалов.
Им покрывают зеркала, работающие в дальнем инфракрасном диапазоне. Это особенно полезно при проведении всевозможных ядерных исследованиях. Также золото очень часто применяют для пайки компонентов из различных материалов.
Еще одной сферой применения является стоматология. Это связано не только с невозможностью вступления желтого металла в химическую связь с человеческим организмом, но и с невероятной коррозийной устойчивостью.
Фармакология также не может обойтись без использования этого удивительного желтого металла. Соединения золота сейчас активно используют в различных медицинских препаратах, спасающих от самых различных заболеваний.
Это не единственные сферы применения золота. Благодаря быстрому прогрессу появляется все больше необходимости использования содержания золота в технологических новинках. Из этого можно сделать вывод, что желтый металл – это не только атрибут роскоши, но и полезный технический инструмент, значение которого с каждым годом возрастает.
Серебро
Серебро, как и золото известно человечеству с давних времен. Оно используется не только при изготовлении ювелирных украшений, но и для производства посуды. Ранее серебро очень активно использовали при чеканке монет. И сегодня можно увидеть некоторые монеты, содержащие в себе немного серебра. При выборе драгоценного металла, нередко возникает вопрос, что же все-таки тяжелее золото или же другой драгоценный металл – серебро.
Оно используется не только при изготовлении ювелирных украшений, но и для производства посуды. Ранее серебро очень активно использовали при чеканке монет. И сегодня можно увидеть некоторые монеты, содержащие в себе немного серебра. При выборе драгоценного металла, нередко возникает вопрос, что же все-таки тяжелее золото или же другой драгоценный металл – серебро.
Плотность этого металла немного меньше, чем плотность свинца. Она равна 10,5 грамм на сантиметр кубический. Это говорит о том, что золото тяжелее серебра почти в два раза.
Кроме создания столового серебра и различных украшений, этот материал очень активно используют в промышленности, а также в сфере фотоиндустрии.
Основными свойствами, благодаря которым этот элемент стал так широко применяться в промышленной сфере, являются отличная тепло- и электропроводность, отличная устойчивость к взаимодействию с окружающей средой, а также превосходные отражающие способности.
Быстро развивающийся технический прогресс заметно сократил использование серебра в фотоиндустрии. Это связано с тем, что благодаря внедрению современных технологий процесс производства и использования фототехники стал намного доступнее для большинства людей. Именно это и обеспечило сокращение использования серебра более чем в 3 раза.
Это связано с тем, что благодаря внедрению современных технологий процесс производства и использования фототехники стал намного доступнее для большинства людей. Именно это и обеспечило сокращение использования серебра более чем в 3 раза.
Благодаря своим бактерицидным свойствам этот металл очень активно используется в медицине. В данный момент серебро используют для производства антибактериального пластыря, а также производства фильтров для очистки воды от вредных микроорганизмов.
Нитрат серебра, используемый в медицине.
Свинец
Следует сказать, что плотность свинца почти в 10 раз меньше плотности благородного желтого металла. Чтобы осознать плотность свинца, следует сказать о том, что плотность березы или липы в 25 раз меньше. По таблице плотностей, свинец находится на 20 месте, а золото на седьмом. Из этого несложно сделать вывод о том, что желтый металл намного тяжелее своего оппонента.
Данный элемент очень хорошо используется в производстве различных конструкций из металла, а также в медицинской сфере. Это связано с непропусканием лучей рентгеновского излучения. Широкое применение свинца в различных сферах связано еще с очень дешевой стоимостью этого металла. Его стоимость практически в два раза меньше стоимости алюминия. Еще одним плюсом выступает относительная легкость добычи данного материала, это обеспечивает огромное поступления предложения на мировой рынок.
Это связано с непропусканием лучей рентгеновского излучения. Широкое применение свинца в различных сферах связано еще с очень дешевой стоимостью этого металла. Его стоимость практически в два раза меньше стоимости алюминия. Еще одним плюсом выступает относительная легкость добычи данного материала, это обеспечивает огромное поступления предложения на мировой рынок.
Железо
Это один из самых древнейших металлов, известных человеку. Первые металлические изделия, согласно результатам археологических исследований, появились в четвертом тысячелетии до нашей эры. Железо намного дешевле желтого драгоценного металла. Это связано с большим содержанием в недрах железной руды. И как говориться в учебнике по экономики, чем больше спрос, тем меньше цена товара.
Осмий и иридий — самые тяжелые металлы в мире
Рассмотрим основных тяжеловесов, которые делят 1 и 2 места. Начнем с иридия и заодно произнесём слова благодарности в адрес английского ученого Смитсона Теннат, который в 1803 году получил этот химический элемент из платины, где присутствовал вместе с осмием в виде примеси.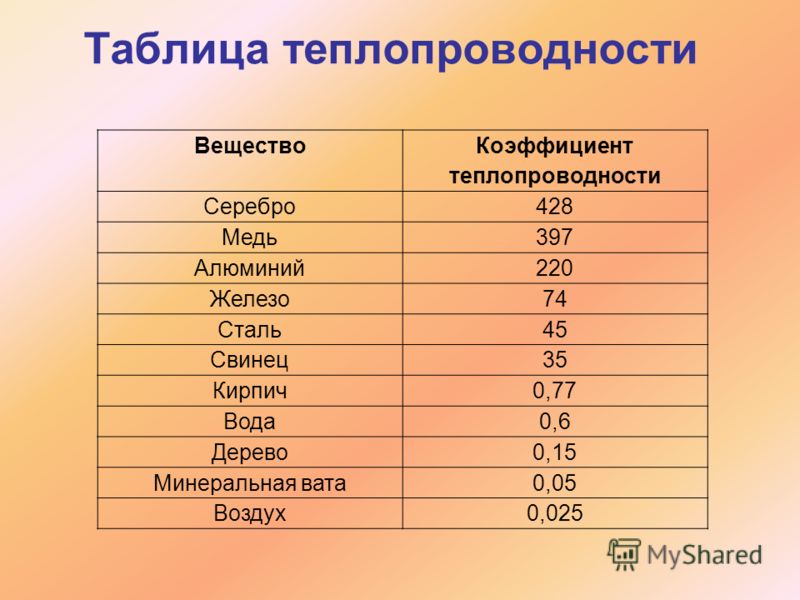 Иридий с древнегреческого можно перевести, как «радуга». Металл имеет белый цвет с серебряным оттенком и его можно назвать ни только тяжеловесным, но и самым прочным. На нашей планете его очень мало и за год его добывают всего до 10000 кг. Известно, что большинство месторождений иридия можно обнаружить на местах падения метеоритов. Некоторые ученые приходят к мысли, что данный металл ранее был широко распространён на нашей планете, однако из-за своего веса, он постоянно выдавливал себя ближе к центру Земли. Иридий сейчас широко востребован в промышленности и используется для получения электрической энергии. Так же его любят использовать палеонтологи, и с помощью иридия определяют возраст многих находок. Вдобавок, данный металл могут использовать для покрытия некоторых поверхностей. Но сделать это сложно.
Иридий с древнегреческого можно перевести, как «радуга». Металл имеет белый цвет с серебряным оттенком и его можно назвать ни только тяжеловесным, но и самым прочным. На нашей планете его очень мало и за год его добывают всего до 10000 кг. Известно, что большинство месторождений иридия можно обнаружить на местах падения метеоритов. Некоторые ученые приходят к мысли, что данный металл ранее был широко распространён на нашей планете, однако из-за своего веса, он постоянно выдавливал себя ближе к центру Земли. Иридий сейчас широко востребован в промышленности и используется для получения электрической энергии. Так же его любят использовать палеонтологи, и с помощью иридия определяют возраст многих находок. Вдобавок, данный металл могут использовать для покрытия некоторых поверхностей. Но сделать это сложно.
Что тяжелее медь или свинец
Свинец – мягкий тяжелый металл серебристо-серого цвета, блестящий, но довольно быстро теряющий свой блеск. Наравне с оловом и медью относится к элементам, известным человечеству с самых древних времен. Использовался свинец весьма широко, да и сейчас его применение чрезвычайно разнообразно. Итак, сегодня мы узнаем, свинец — это металл или неметалл, а также цветной или черный металл, узнаем о его видах, свойствах, применении и добыче.
Использовался свинец весьма широко, да и сейчас его применение чрезвычайно разнообразно. Итак, сегодня мы узнаем, свинец — это металл или неметалл, а также цветной или черный металл, узнаем о его видах, свойствах, применении и добыче.
Что такое свинец
Свинец – элемент 14 группы таблицы Д. И. Менделеева, расположен в одной группе с углеродом, кремнием и оловом. Свинец является типичным металлом, но инертным: вступает в реакции крайне неохотно даже с сильными кислотами.
Молекулярная масса – 82. Это не только указывает на так называемое магическое число протонов в ядре, но и на большой вес вещества. Самые интересные качества металла связаны именно с его большим весом.
Понятие и особенности металла свинец рассмотрены в данном видео:
Понятие и особенности
Свинец – металл достаточно мягкий при нормальной температуре, его несложно процарапать или расплющить. Такая пластичность позволяет получить листы и прутки металла очень малой толщины и любой формы. Ковкость и была одной из причин, по которой свинец стал использоваться с самой древности.
Ковкость и была одной из причин, по которой свинец стал использоваться с самой древности.
Свинцовые водопроводные трубы Древнего Рима общеизвестны. С тех пор такого рода водопровод устанавливался не единожды и не в одном месте, но действовал не столь долго. Что, без сомнений, сохранило немалое количество человеческих жизней, так как свинец, увы, при длительном контакте с водой, в конце концов, образует растворимые соединения, которые являются токсичными.
Токсичность – то самое свойство металла, благодаря которому его применение стараются ограничить. Пары металла и множество его органических и неорганических солей очень опасны и для окружающей среды, и для людей. В основном, конечно, опасности подвергаются работники таких предприятий и жители зоны вокруг промышленного объекта. 57% выбрасывается вместе с большими объемами запыленного газа, а 37% – с конвертерными газами. Проблема этого одна – несовершенство очистительных установок.
Что тяжелее медь или железо
Тяжёлые мета́ллы
— химические элементы со свойствами металлов (в том числе и полуметаллы) и значительным атомным весом либо плотностью.
Определение [ править | править код ]
Известно около сорока различных определений термина тяжёлые металлы
, и невозможно указать на одно из них, как наиболее принятое. Соответственно, список тяжёлых металлов согласно разным определениям будет включать разные элементы. Используемым критерием может быть относительная атомная масса свыше 50, и тогда в список попадают все металлы, начиная с ванадия, независимо от плотности.
Другим часто используемым критерием является плотность, примерно равная или большая плотности железа (8 г/см 3 ), тогда в список попадают такие элементы как свинец, ртуть, медь, кадмий, кобальт, а, например, более легкое олово выпадает из списка. Существуют классификации, основанные и на других значениях пороговой плотности (например — плотность 5 г/см 3 [1] [2] ) или атомного веса.
Некоторые классификации делают исключения для благородных и редких металлов, не относя их к тяжёлым, некоторые исключают нецветные металлы (железо, марганец).
Термин тяжёлые металлы
чаще всего рассматривается не с химической, а с медицинской и природоохранной точек зрения [3] и, таким образом, при включении в эту категорию учитываются не только химические и физические свойства элемента, но и его биологическая активность и токсичность, а также объём использования в хозяйственной деятельности [4] .
Биологическая роль [ править | править код ]
Многие тяжёлые металлы
, такие как железо, медь, цинк, молибден, участвуют в биологических процессах и в определенных количествах являются необходимыми для функционирования растений, животных и человека
микроэлементами
.
С другой стороны, тяжёлые металлы
и их соединения могут оказывать вредное воздействие на организм человека, способны накапливаться в тканях, вызывая ряд заболеваний. Не имеющие полезной роли в биологических процессах металлы, такие как свинец и ртуть, определяются как
токсичные металлы
.
Некоторые элементы, такие как ванадий или кадмий, обычно имеющие токсичное влияние на живые организмы, могут быть полезны для некоторых видов [5] .
Читать также: Мотоблок с плугом фото
Загрязнение тяжёлыми металлами [ править | править код ]
Среди разнообразных загрязняющих веществ тяжёлые металлы
(в том числе ртуть, свинец, кадмий, цинк) и их соединения выделяются распространенностью, высокой токсичностью, многие из них — также способностью к накоплению в живых организмах. Они широко применяются в различных промышленных производствах, поэтому, несмотря на очистительные мероприятия, содержание соединений
тяжёлых металлов
в промышленных сточных водах довольно высокое.
Важнейшие металлы и сплавы
Алюминий. Очень легкий серебристо-белый металл, не подверженный коррозии. Его получают из бокситов путем электролиза. Из алюминия делают электропровода, самолеты, корабли (см. статью «Плавучесть«), автомобили, банки для напитков, фольгу для приготовления пищи. Алюминиевые банки для напитков очень легкие и прочные.
Латунь. Ковкий сплав меди и цинка. Из латуни делают украшения, орнаменты, музыкальные инструменты, винты, кнопки для одежды.
Из латуни делают украшения, орнаменты, музыкальные инструменты, винты, кнопки для одежды.
Бронза. Известный с древнейших времен ковкий, не подверженный коррозии сплав меди и олова.
Кальций. Мягкий серебристо-белый металл. Входит в состав известняка и мела, а также костей и зубов животных. Кальций в человеческом организме содержится в костях и зубах. Он используется в производстве цемента и высоко качественной стали.
Хром. Твердый серый металл. Используется в производстве нержавеющей стали. Хромом покрывают металлические изделия в защитных целях и для придания им зеркального блеска.
Медь. Ковкий красноватый металл. Из меди делают электропровода, резервуары для горячей воды. Медь входит в состав латуни, бронзы, мельхиора.
Мельхиор. Сплав меди и никеля. Из него делают почти все «серебряные» монеты.
Золото. Мягкий неактивный ярко-желтый металл. Используется в электронике и в ювелирном деле.
Железо. Ковкий серебристо-белый ферромагнетик. Добывается в основном из руды в доменных печах. Используется в инженерных конструкциях, а также в производстве стали и сплавов. В нашей крови тоже есть железо.
Свинец. Тяжелый ковкий ядовитый синевато-белый металл. Добывается из минерала галенита. Из свинца делают электрические батареи, крыши и экраны, защищающие от рентгеновских лучей.
Cвойства золотa — Aukso Bankas
Золото — металл красивого желтого цвета, который устойчив к различным химическим воздействиям. В обычных условиях оно не окисляется на воздухе и в воде, не меняется под действием кислот. Растворяется металл лишь в «царской водке» — смеси концентрированных соляной и азотной кислот, а также в щелочных растворах цианистого калия или натрия. Благодаря всем этим качествам золото всегда сохраняет первозданный цвет и блеск, а изделия из него практически вечны. Золото вместе с серебром, рутением, родием, палладием, осмием, иридием и платиной входит в группу благородных металлов, получивших своё название из-за весьма стойкого «нежелания» подвергаться химическому воздействию и вступать в реакцию.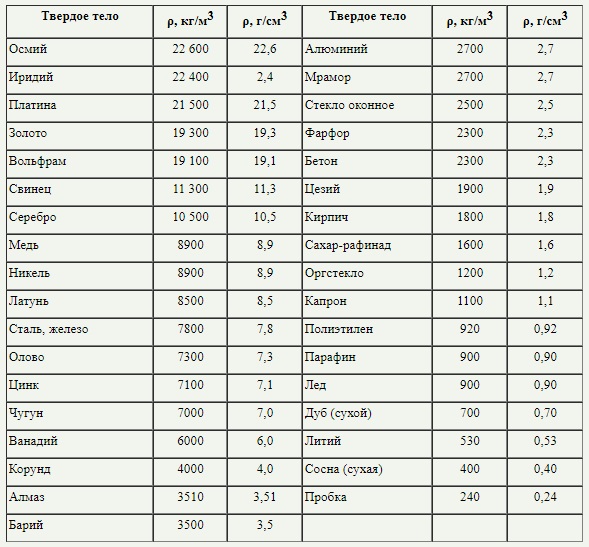
Содержание золота в земной коре очень низкое: всего 4,3·10-7% по массе, т.е., в среднем, лишь 4 мг в тонне горных пород, это один из самых редких элементов: его в 3 раза меньше, чем редкого металла палладия, в 15 раз меньше серебра, в 300 раз меньше вольфрама, в 600 раз меньше урана, в 10 тысяч раз меньше меди.По физическим свойствам, золото считается самым пластичным, из известных металлов, а также одним из лучших проводников тепла и электрического тока. Листы золота толщиной около 0,001 мм называются сусальным золотом. Они применяются для декоративных покрытий, в частности алтарей и куполов церквей. Например, для покрытия фонтана «Самсон» в Петродворце, было использовано всего лишь — 5 грамм золота!
Золото обладает уникальными физиологическим свойствами, при правильном использовании которых, из него можно изготавливать лекарства от многих болезней. В медицине широкое применение получили препараты, содержащие соединения солнечного металла, для лечения ревматоидного артрита и полиартрита.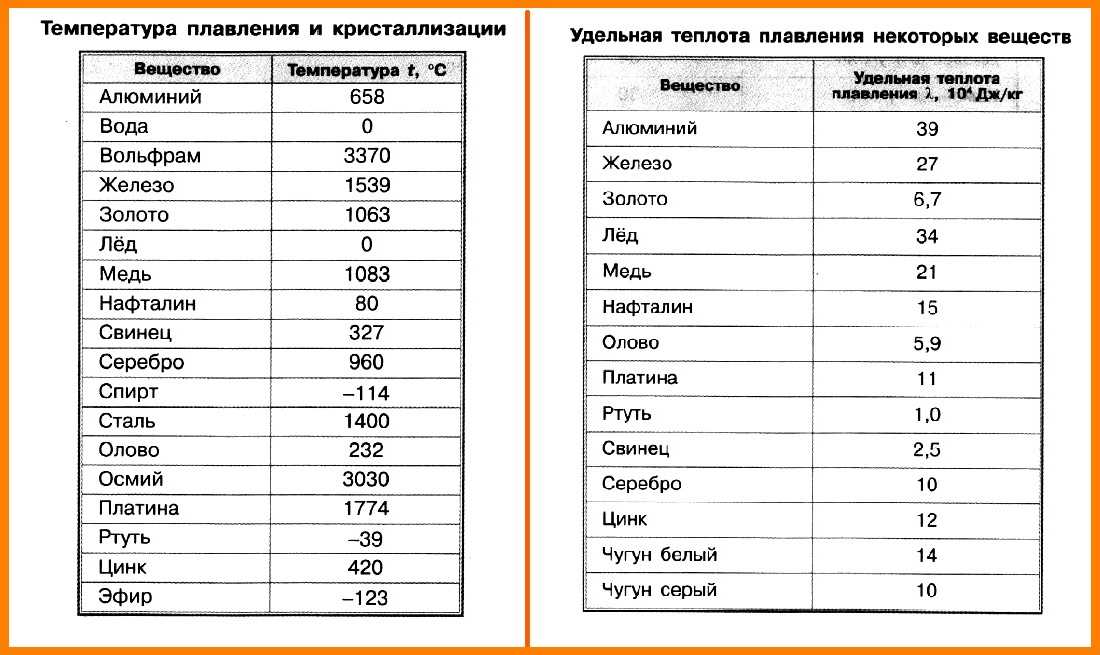 Для сохранения молодости золото применяется также в пластической хирургии.
Для сохранения молодости золото применяется также в пластической хирургии.
Существует мнение, что золото, само по себе — один из самых малополезных металлов, который годится только для изготовления украшений и денег. После ознакомления с физическим, химическим и физиологическим свойствами этого редкого металла, возникает вопрос — так ли это?
физические
Золото — один из самых тяжелых и красивых известных металлов, на нашей планете. Плотность чистого золота равна — 19,3 г/cм3. Шар из чистого золота диаметром всего лишь 46 мм имеет массу 1 кг, Если плотно заполнить золотыми слитками комнату площадью 20 м2 и высотой 3 м, их масса составит 1150 тонн — вес тяжело груженного железнодорожного состава.
Из не радиоактивных элементов, тяжелее золота только: осмий — 22,61 г/cм3, иридий — 22,5 г/cм3, платина — 21,45 г/cм3 и рений — 21,02 г/cм3. Содержание этих четырех элементов в земной коре ничтожно мало, они встречаются гораздо реже золота. Плутоний — химический радиоактивный элемент, его плотность — 19,84 г/cм3.
Плутоний — химический радиоактивный элемент, его плотность — 19,84 г/cм3.
Есть еще один металл, который, очень, идеально подходит для подделки золота — это вольфрам. Тот самый вольфрам, из которого делают волоски лампочек, твердые сплавы, электроды и многое другое. Он недорог, пластичен, хорошо поддается обработке. Плотность вольфрама практически неотличима от золота — 19,3 г/cм3. В древности не знали вольфрама, но если допустить, что золотая корона сиракузского царя Гиерона была бы подделана не серебром, а вольфрамом, то великий Архимед, пользуясь выведенным им законом, не смог бы обнаружить подделки и уличить мошенника — мастера.
Золото это самый пластичный металл, его легко расплющить, превратить в тончайшие пластинки и листы. Из него можно изготовить фольгу толщиной меньше 0,001 мм. При сильном истончении оно становится прозрачным и на просвет имеет зеленоватый оттенок. Из одного грамма золота можно сделать проволоку длинной более 3000 метров, а из слитка весом один килограмм, золотой фольгой можно покрыть поверхность площадью 530 м2.
Золото очень легко истирается, превращаясь в тончайшую пыль. Благодаря этому свойству оно рассеяно везде и таким образом, широко распространено в природе. Хорошо известны случаи, когда возле тех мест, где обрабатывали или добывали золото, оседала мельчайшая золотая пыль и на этом некоторые ловкие люди сумели сделать целые состояния.
Чистое золото настолько мягкий металл, что его можно поцарапать даже ногтем. Мягкость золота, в древние времена делала его очень удобным для обработки материалом. В наше время, украшения высокой пробы стараются не делать, так как они легко царапаются, теряют свой блеск и привлекательность. При изготовлении ювелирных изделий в золото для твердости, добавляют другие металлы. Но золото не самый мягкий металл, мягче его свинец и олово.
Соединение золота с другими металлами — снижает температуру их плавления, а также изменяет механические свойства самого золота. Например, серебро и медь резко повышают его твердость, и этим широко пользуются в ювелирном деле. Свинец, мышьяк, платина, кадмий, теллур, висмут, наоборот делают золото хрупким. Лидером в этом отношении является свинец. Сплав, содержащий всего 1% свинца, при ударе разлетается на куски. Интересно, что замечательная ковкость чистого золота пропадает, если в его состав добавить всего лишь 0,01% свинца.
Свинец, мышьяк, платина, кадмий, теллур, висмут, наоборот делают золото хрупким. Лидером в этом отношении является свинец. Сплав, содержащий всего 1% свинца, при ударе разлетается на куски. Интересно, что замечательная ковкость чистого золота пропадает, если в его состав добавить всего лишь 0,01% свинца.
Золото — хороший проводник тепла и электрического тока, очень хороший, но не лучший. По электропроводности золото занимает почетное третье место, уступая двум металлам: серебру и меди, а по теплопроводности четвертое место, уступая только: алмазу, серебру и меди.
химические
Золото, сокращенно Au — от латинского Aurum, в периодической системе Д.И. Менделеева находится в одной группе с серебром и медью. Несмотря на это, его химические свойства гораздо ближе к химическим свойствам металлов платиновой группы: рутений, родий, палладий, осмий, иридий, платина.
Из-за высокого значения электродного потенциала, на золото, по отдельности, не действуют разбавленные и концентрированные кислоты: HCl(соляная), HNO(азотная), HSO(серная).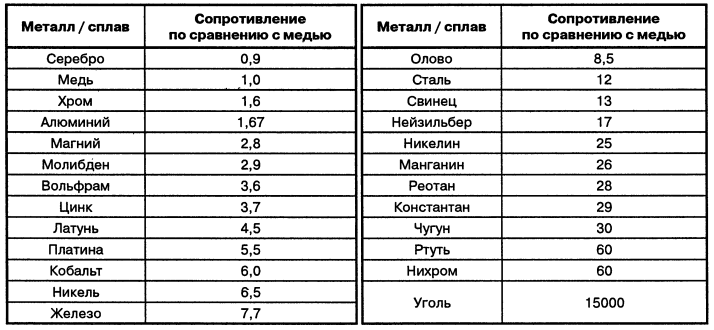 Из чистых кислот, золото растворяется только в горячей, концентрированной селеновой кислоте:
Из чистых кислот, золото растворяется только в горячей, концентрированной селеновой кислоте:
2Au + 6H2SeO4 = Au2(SeO4)3 + 3H2SeO3 + 3H2O
За прошедшие столетия химики, а до них алхимики, провели с «царем металлов» огромное количество различных экспериментов. Открытие способов превращения неблагородных металлов в золото, всегда было главной целью алхимии. В результате этих опытов выяснилось, что золото вовсе не полностью устойчиво к химическим воздействиям. Оказалось, что золото легко растворяется в смесиHNO и HCl, так называемой «царской водке» даже при комнатной температуре. «Царская водка» стала известна алхимикам еще задолго до открытия соляной кислоты в отдельности, и готовилась ими, по Геберу(8 век н. э.), перегонкой смеси селитры, медного купороса и квасцов с прибавкою нашатыря и употреблялась для растворения золота.
э.), перегонкой смеси селитры, медного купороса и квасцов с прибавкою нашатыря и употреблялась для растворения золота.
В наше время «царскую водку» приготавливают: смешением одной части азотной кислоты с тремя частями соляной. В ней металл растворяется с образованием золотохлористоводородной кислоты:
4HCl + HNO3 + Au = H (AuCl4) + NO + 2H2
В присутствии кислорода золото растворяется в растворах цианидов — солей цианистой кислотыHCN:
8KCN + O2 + 4Au + 2H2O = 4K (Au(CN))2 + 4KOH
С хлором золото реагирует только при нагревании:
2Au + 3Cl = Au2Cl6
Соединения золота непрочны, легко восстанавливаются до металла. Интересна с этой точки зрения реакция трихлорида «благородного» золота и дихлорида «неблагородного» олова — хлорид восстанавливается хлоридом:
Интересна с этой точки зрения реакция трихлорида «благородного» золота и дихлорида «неблагородного» олова — хлорид восстанавливается хлоридом:
2AuCl3 + 3SnCl2 = 2Au + 3SnCl4
Интересно, что при нагревании золота выше 100°C на его поверхности образуется очень тонкая, окисная пленка, она не исчезает даже при охлаждении. При температуре 20°C, толщина пленки равна примерно 0,000001 мм.
физиологические
Золото обладает не только материальной ценностью, но и целебными свойствами. Еще с древних времен считалось, что золото помогает избавиться от болей и перебоев в работе сердца, от душевных расстройств и робости. По старинным поверьям, если держать золото во рту, это поможет при болезнях горла и сделает запах изо рта приятным. Если золотой иглой проколоть ухо, то сделанное отверстие больше не зарастет. Имеющий при себе золото не будет знать печали, и чем больше золота, тем радостнее станет у него на душе. Возможно, что в этих суевериях есть крупица здравого смысла. С давних пор золото применяли как лекарство. Идею введения золота в медицинскую практику приписывают Парацельсу, который в свое время провозгласил, что «не превращение металлов в золото должно быть целью химии, а приготовление лекарств».
Возможно, что в этих суевериях есть крупица здравого смысла. С давних пор золото применяли как лекарство. Идею введения золота в медицинскую практику приписывают Парацельсу, который в свое время провозгласил, что «не превращение металлов в золото должно быть целью химии, а приготовление лекарств».
В 1583 году французский алхимик, придворный врач и хирург Давид де Плани-Кампи опубликовал Трактат об истинном, непревзойденном, великом и универсальном лекарстве древних, или же о питьевом золоте, несравненной сокровищнице неисчерпаемых богатств. В нем он, ссылаясь на своих предшественников, в основном, арабских алхимиков, описывал целебные свойства так называемого питьевого золота, приписывая ему самые чудодейственные свойства. Это и было золото в буквальном смысле этого слова, только очень мелко раздробленное — коллоидный раствор золота красного цвета. Китайские врачи называли его «эликсир жизни» — напиток, дарующий молодость, здоровье и силу.
Наукой доказано, что в крови каждого человека содержится золото.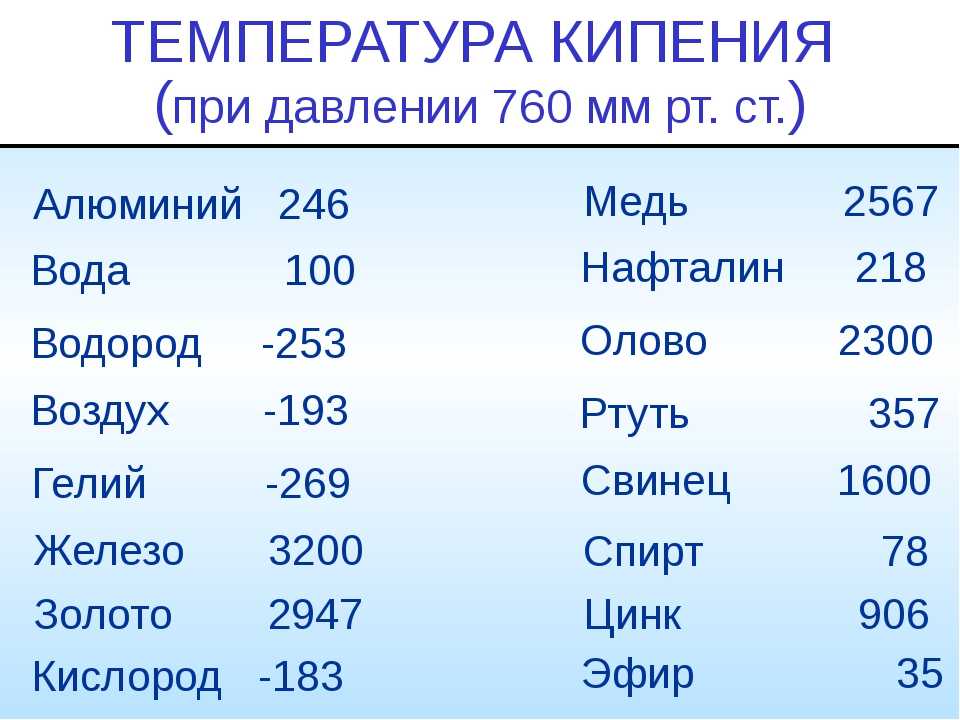 И хотя концентрация его в организме чрезвычайно мала, но врачи-гомеопаты утверждают, что и в таких количествах этот металл физиологически активен. Золото, а также его сплавы с серебром и платиной обладают лечебными свойствами. Считается, что носить такие украшения полезно при истерии, эпилепсии и депрессии. Это успокаивает и, вместе с тем, дает бодрость, хорошее настроение. Кроме того, золото имеет выраженный бактерицидный эффект, повышает давление, активизирует обменные процессы, улучшает циркуляцию крови.
И хотя концентрация его в организме чрезвычайно мала, но врачи-гомеопаты утверждают, что и в таких количествах этот металл физиологически активен. Золото, а также его сплавы с серебром и платиной обладают лечебными свойствами. Считается, что носить такие украшения полезно при истерии, эпилепсии и депрессии. Это успокаивает и, вместе с тем, дает бодрость, хорошее настроение. Кроме того, золото имеет выраженный бактерицидный эффект, повышает давление, активизирует обменные процессы, улучшает циркуляцию крови.
В современной медицине золото применяется для диагностики и лечения злокачественных опухолей. Помимо достаточно распространенной химиотерапии, в которой используются коллоидные растворы радиоактивного золота, сегодня существует совершенно новый современный метод, которым предусмотрено введение в опухолевую ткань микроскопических золотых нано-капсул и воздействие на них инфракрасными лучами. При этом раковые клетки погибают, а здоровая ткань остается неповрежденной.
Для сохранения молодости пластическая хирургия применяет золото. Для этого тончайшие нити из этого металла толщиной всего несколько микрон с помощью специального проводника вводятся под кожу. Через несколько недель вокруг каждой из них формируется эластичная коллагеновая ткань, которая становится «каркасом» для кожи.
Для этого тончайшие нити из этого металла толщиной всего несколько микрон с помощью специального проводника вводятся под кожу. Через несколько недель вокруг каждой из них формируется эластичная коллагеновая ткань, которая становится «каркасом» для кожи.
В медицине широкое применение получили препараты, содержащие соединения солнечного металла, для лечения ревматоидного артрита и полиартрита. По статистике, соединения золота вызывают клиническое улучшение приблизительно у 70-80% больных, которые хорошо переносят ауротерапию, поэтому такие препараты могут считаться препаратами выбора среди базисных антиревматических средств.
Несмотря на целебные свойства золота, чрезмерное увлечение украшениями из него может быть небезопасно для здоровья. Некоторые соединения золота токсичны, накапливаются в почках, печени, селезёнке и гипоталамусе, что может привести к органическим заболеваниям и дерматитам, стоматитам и тромбоцитопении.
Внимание! Если Вы обнаружили ошибку на сайте, то выделите ее и нажмите Ctrl+Enter.
|
| |||||||||||
Разница между свинцом и оловом
Основное различие между свинцом и оловом заключается в том, что свинец представляет собой металлический серый металл с синим оттенком, тогда как олово представляет собой серебристо-белый металл со слабым желтым оттенком .
Свинец и олово являются химическими элементами 14 группы периодической таблицы элементов. Эта группа элементов называется группой углерода, потому что первым членом этой группы является общий химический элемент «углерод».
СОДЕРЖАНИЕ
1. Обзор и ключевые отличия
2. Что такое свинец
3. Что такое олово
4. Параллельное сравнение – свинец и олово в табличной форме
5. Резюме
Резюме
Что такое свинец?
Свинец представляет собой химический элемент с атомным номером 82 и химическим символом Pb. Это металлический химический элемент, относящийся к категории тяжелых металлов, плотность которого выше, чем у большинства известных нам материалов. Однако свинец является мягким и ковким металлом, имеющим относительно низкую температуру плавления. Мы можем только что разрезать этот металл и можем наблюдать характерный синий оттенок наряду с серебристо-серым металлическим внешним видом. Этот металл может тускнеть под воздействием воздуха, что придает металлической поверхности тускло-серый вид. Что еще более важно, у свинца самый высокий атомный номер среди всех стабильных элементов.
Рисунок 01: Свинец
Свинец является относительно нереакционноспособным постпереходным металлом. Мы можем проиллюстрировать слабый металлический характер свинца, используя его амфотерную природу. Например. свинец и оксиды свинца реагируют с кислотами и основаниями и склонны к образованию ковалентных связей. Мы можем найти соединения свинца, часто имеющие степень окисления свинца +2, а не степень окисления +4 (+4 является наиболее распространенным окислением для химических элементов группы 14).
Мы можем найти соединения свинца, часто имеющие степень окисления свинца +2, а не степень окисления +4 (+4 является наиболее распространенным окислением для химических элементов группы 14).
Если рассматривать объемные свойства свинца, то он обладает высокой плотностью, ковкостью, пластичностью и высокой коррозионной стойкостью благодаря пассивации. Свинец имеет плотноупакованную гранецентрированную кубическую структуру и большой атомный вес, что приводит к плотности, превышающей плотность большинства распространенных металлов, таких как железо, медь и цинк. По сравнению с большинством металлов свинец имеет очень низкую температуру плавления, а также самую низкую температуру кипения среди элементов 14 группы.
Свинец имеет тенденцию образовывать защитный слой при воздействии воздуха различного состава. Наиболее распространенным компонентом этого слоя является карбонат свинца (II). Также могут быть сульфатные и хлоридные компоненты свинца. Этот слой делает поверхность металлического свинца химически инертной по отношению к воздуху.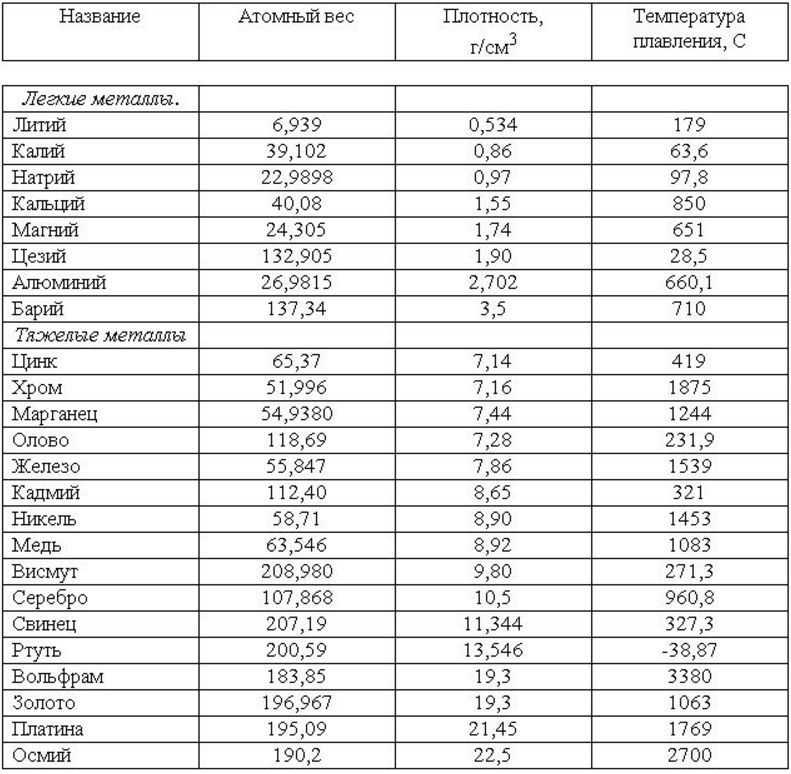 Кроме того, газообразный фтор может реагировать со свинцом при комнатной температуре с образованием фторида свинца (II). Аналогичная реакция происходит и с газообразным хлором, но требует нагревания. Кроме того, металлический свинец устойчив к серной и фосфорной кислотам, но реагирует с кислотой HCl и HNO3. Органические кислоты, такие как уксусная кислота, могут растворять свинец в присутствии кислорода. Точно так же концентрированные щелочные кислоты могут растворять свинец с образованием плюмбитов.
Кроме того, газообразный фтор может реагировать со свинцом при комнатной температуре с образованием фторида свинца (II). Аналогичная реакция происходит и с газообразным хлором, но требует нагревания. Кроме того, металлический свинец устойчив к серной и фосфорной кислотам, но реагирует с кислотой HCl и HNO3. Органические кислоты, такие как уксусная кислота, могут растворять свинец в присутствии кислорода. Точно так же концентрированные щелочные кислоты могут растворять свинец с образованием плюмбитов.
Что такое олово?
Олово — это химический элемент с атомным номером 50 и химическим символом Sn. Он имеет серебристо-белый вид с характерным бледно-желтым оттенком. Олово находится в 14-й группе периодической таблицы элементов и, следовательно, в углеродной группе. Это мягкий металл, который мы можем резать без особого усилия. Однако олово демонстрирует химическое сходство со своими соседями, свинцом и германием.
Олово имеет две основные степени окисления; +2 и +4 степени окисления. Состояние +4 немного более стабильно, чем состояние окисления +2. Мы можем описать олово как мягкий, ковкий, пластичный и высококристаллический металл серебристо-белого цвета. Существует десять стабильных изотопов олова. Наиболее распространенным изотопом является изотоп Sn-120.
Состояние +4 немного более стабильно, чем состояние окисления +2. Мы можем описать олово как мягкий, ковкий, пластичный и высококристаллический металл серебристо-белого цвета. Существует десять стабильных изотопов олова. Наиболее распространенным изотопом является изотоп Sn-120.
Рисунок 02: Металлическая поверхность с луженым покрытием
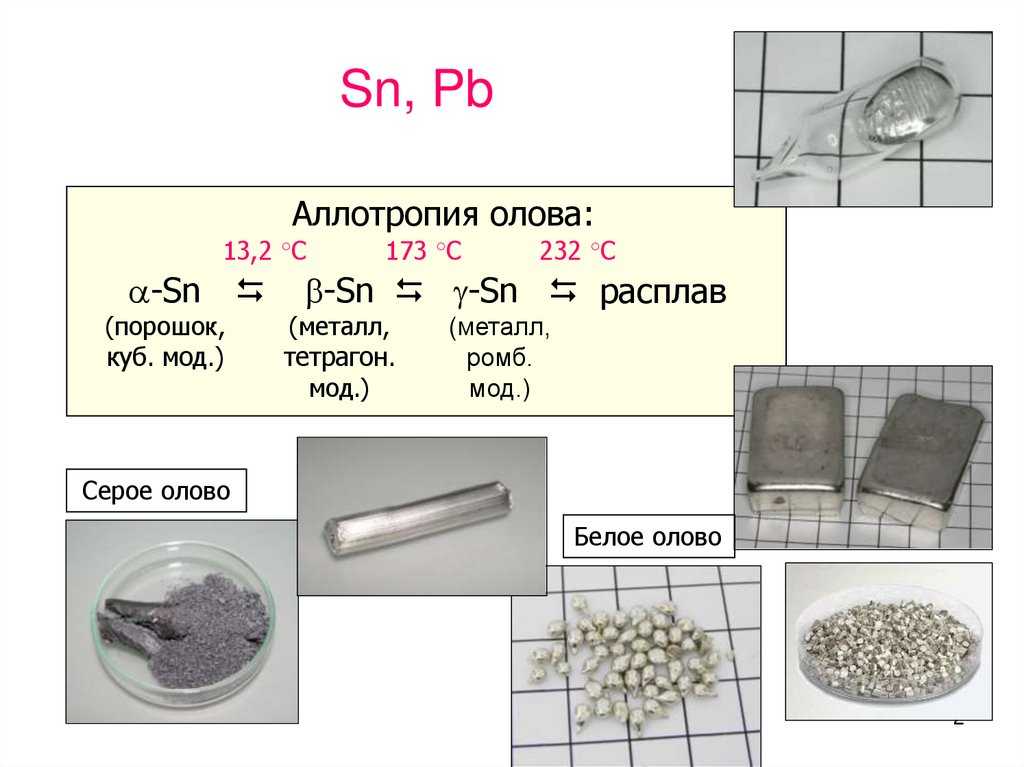
Существует два основных аллотропа олова: альфа-олово и бета-олово. Среди них бета-олово более стабильно при комнатной температуре, а также пластично. Альфа-олово стабильно при низких температурах и хрупко при комнатной температуре.
Что еще более важно, олово устойчиво к коррозии от воды. Однако этот металл может подвергаться воздействию кислот и щелочей. Следовательно, его можно хорошо полировать, и мы можем использовать его в качестве защитного покрытия для других важных металлов. Защитный оксидный слой, образующийся на металлическом олове, может дополнительно предотвратить окисление поверхности металла, и такой же слой может образовываться на сплавах олова. Более того, олово может действовать как катализатор в присутствии кислорода в реакционной смеси, тем самым ускоряя ту или иную химическую реакцию.
Более того, олово может действовать как катализатор в присутствии кислорода в реакционной смеси, тем самым ускоряя ту или иную химическую реакцию.
В чем разница между свинцом и оловом?
Свинец и олово являются металлическими элементами. Химический символ свинца — Pb, а химический символ олова — Sn. Основное различие между свинцом и оловом заключается в том, что свинец имеет металлический серый цвет с голубым оттенком, тогда как олово выглядит как серебристо-белый металл со слабым желтым оттенком.
Ниже в инфографике сравниваются основные свойства обоих металлов, а также таблицы различий между свинцом и оловом.
Резюме – свинец против олова
Свинец и олово являются металлическими элементами. Основное различие между свинцом и оловом заключается в том, что свинец имеет металлический серый цвет с голубым оттенком, тогда как олово выглядит как серебристо-белый металл со слабым желтым оттенком.
Артикул:
1. «Жесть». Британская энциклопедия , Британская энциклопедия, Inc. , доступна здесь.
, доступна здесь.
Изображение предоставлено:
1. «Свинцовый электролит и куб 1 см3» Alchemist-hp (разговор) (www.pse-mendelejew.de) — собственная работа, FAL) через Commons Wikimedia
2. «Внутри жестяной банки». Автор Schtone — собственная работа (общественное достояние) через Commons Wikimedia
Балласт: вольфрам против свинца: скорость строительства
NASCAR недавно оштрафовала пару команд за сброс вольфрамового балласта на гоночную трассу . Давайте еще раз посмотрим, почему эти куски вольфрама вообще там.
Балласт — это груз, добавляемый к гоночному автомобилю для соответствия требованиям к общему весу, указанным в правилах. И хотя вы можете просто поставить балласт в любом удобном месте, почему бы не поставить его там, где это поможет лучше управлять автомобилем?
С 2020 года NASCAR требует, чтобы гоночный автомобиль весил не менее:
Минимум 3200 фунтов (1451 кг) без водителя и топлива
Минимум 3400 фунтов (1542 кг) с водителем и топливом
Топливный элемент вмещает около 17,75 галлонов и топливо E15 весит около 6,2 фунтов на галлон, что означает, что полный топливный бак весит около 110 фунтов.
Но даже с относительно крупным водителем использование таких материалов, как углеродное волокно и алюминий, означает, что большинство автомобилей не имеют минимального веса.
Зачем строить автомобили легче, чем это необходимо?
Потому что это позволяет вам разместить вес там, где вы хотите. Благодаря переносу нагрузки автомобиль, поворачивающий налево, смещает свой вес вправо. Ускоряющийся автомобиль переносит вес с передних колес на задние колеса и наоборот для тормозящего автомобиля.
Сцепление пропорционально тому, насколько сильно колесо вдавливается в гусеницу. Автомобили с левым поворотом испытывают трудности с удержанием веса на этих внутренних колесах, поэтому размещение балласта на левой стороне автомобиля помогает с левосторонним сцеплением.
Свинцовый балласт и вольфрамовый балласт
Люди любят говорить, что вольфрам тяжелее свинца, но это верно только тогда, когда вы сравниваете два куска металла одинакового объема.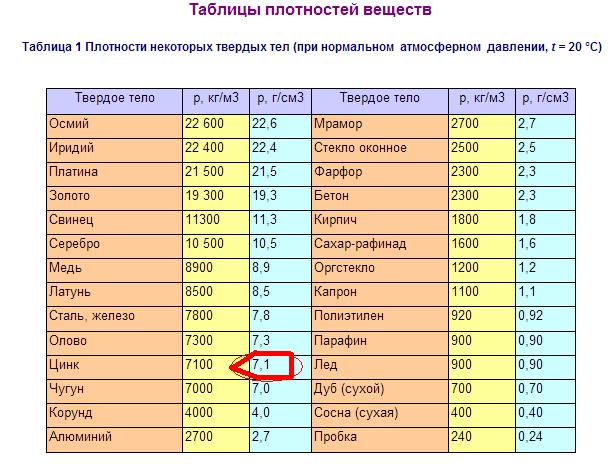 Я усвоил этот урок, когда работал над своей книгой «Физика NASCAR».
Я усвоил этот урок, когда работал над своей книгой «Физика NASCAR».
Кирк Алмквист, в то время автомобильный начальник Эллиота Сэдлера, принес мне два металлических блока одинакового размера. Он протянул их мне, чтобы я мог видеть, но не дал мне их подержать. Они оба были довольно невыразительного тускло-серого цвета.
— Один из них, — сказал он, — вольфрам. Другой — свинец. Что тяжелее?»
Я открыл свою ментальную периодическую таблицу, которая далеко не так опрятна, как та, которую я показываю ниже.
Свинец и вольфрам — два раздражающих элемента, символы которых не имеют ничего общего с их названиями, потому что это латынь.
- Вольфрам имеет атомный символ W, потому что этот элемент был обнаружен в составе минерала под названием Вольфрамит , в котором содержится много вольфрама.
- Свинец — это Pb, который происходит от латинского plumbum,
, что означает «жидкое серебро». На самом деле, plumbum означает «свинец», как указал один из комментаторов. Я знал, что должен был изучать латынь в старшей школе.
Я знал, что должен был изучать латынь в старшей школе.
Вольфрам имеет атомный номер 74, а свинец — атомный номер 82. За некоторыми исключениями, чем больше атомный номер, тем тяжелее атом. Это не одно из тех исключений. Атомная таблица говорит нам, что если у нас есть один моль атомов вольфрама, он будет весить 183,85 грамма или около 0,4 фунта. Один моль атомов свинца будет весить 207,2 грамма (0,45 фунта). Атом свинца примерно в 1-1/8 раза тяжелее атома вольфрама. Так что я догадался, что это свинец.
Кирк широко улыбнулся и протянул мне кубики. Вольфрамовый блок был на много на тяжелее свинцового блока.
Почему я ошибался?
Это особенно неловко, потому что я учился на физика твердого тела, а это значит, что я изучал, как атомы образуют твердые тела. Вольфрамовый блок тяжелее свинцового блока того же размера, потому что в тот же объем можно поместить больше атомов вольфрама. Атомы вольфрама просто немного более общительны, чем атомы свинца, и они не возражают против того, чтобы их раздавили. 0007
0007
Эти металлы образуют регулярно упорядоченные структуры, когда они образуют твердые тела. Чем плотнее упакованы атомы, тем выше плотность твердого тела. Вольфрам в 1,7 раза плотнее свинца и примерно в 2,5 раза плотнее обычной стали.
- Плотность свинца 0,410 фунта/дюйм 3 , что означает, что куб свинца в один дюйм со всех сторон весит 0,41 фунта.
- Вольфрам имеет плотность 0,70 фунта/дюйм 3 . Кубик вольфрама толщиной в один дюйм со всех сторон будет весить 0,70 фунта — в 1,74 раза больше, чем такой же куб свинца.
Балласт устанавливается внутри лонжеронов рамы автомобиля, поэтому типичное поперечное сечение балласта составляет 2-5/8″ x 3-5/8″.
- Двадцать пять фунтов вольфрама будут иметь длину 3,75 дюйма
- Двадцать пять фунтов свинца будут иметь длину 6,40 дюйма.
Использование вольфрама позволяет более точно разместить вес и тем самым точнее повлиять на управляемость вашего автомобиля.
Вольфрамовый балласт не допускается?
Вольфрам запрещен во многих гоночных сериях более низкого уровня, потому что он дорогой.
Stock Car Steel and Aluminium Company продаст вам 35-фунтовый кусок вольфрама длиной 2-5/8″ x 3-5/8″ x 6″ за 1876,88 долларов. Сопоставимый кусок свинца будет стоить вам где-то около 100 долларов. Серии более низкого уровня не хотят устанавливать цены для команд вне конкуренции. Когда одна команда получает преимущество, всем остальным приходится делать то же самое, чтобы не отставать. Это становится вопросом стоимости.
Почему вольфрам дорог?
Вольфрам встречается реже, чем свинец, и с ним сложнее работать. Температура плавления 6192 °F. Сравните это с температурой плавления свинца 621°F. Для формовки вольфрама в слитки требуется мощная печь и много энергии.
Вольфрам трудно обрабатывать, потому что он твердый и хрупкий, если только он не очень чистый. Делая его чистым, он становится дороже. Даже не будучи действительно чистым, вольфрамовый балласт все же примерно в сто раз дороже свинца.
Возможно, вы помните, как Чейза Эллиотта дисквалифицировали после победы в Snowball Derby 2013 года, потому что в его машине вместо свинца был обнаружен вольфрамовый балласт. Эта дисквалификация дала победу Эрику Джонсу
Еще одна проблема с вольфрамом
Сейчас модно делать украшения из вольфрама и вольфрамовых сплавов, что создает большую проблему. Если золотое кольцо застряло на пальце, его можно отрезать. Вы не можете сделать это с вольфрамом. (Решение состоит в том, что вы должны воспользоваться преимуществами хрупкости материала и раздавить его, не раздавливая пальцы.)0000 Плотность Плотность
4-4 Плотность
Плотность
количество вещества в данной единице объема. Его можно измерить в граммах.
на кубический сантиметр (г/см 3 ). Это мера того, насколько плотно
упакованы атомы вещества. Когда мы говорим, что лед менее плотный
чем вода, мы имеем в виду, что молекулы воды более плотно упакованы, когда они
находятся в жидком состоянии. Формула для определения плотности:
Формула для определения плотности:
или же
Всегда можно услышать, что мышцы плотнее жира. Это означает, что я могу тренироваться, не худеть и при этом терять лишние сантиметры. мою талию. Это потому, что 1 фунт мышц займет меньше места, чем 1 фунт жира.
Масса обычно измеряется в граммах. Объем обычно измеряется в мл, что соответствует см 3 (или кубические сантиметры cc. 1 мл = 1 см 3 = 1 куб.см)
Плотность воды 1,00 г/мл. Плотность некоторых общих элементов показана ниже:
Плотность выбранных элементов
элемент | плотность (г/см 3 ) | внешний вид |
алюминий | 2,70 | серебристый белый, металлик |
сурьма | 6,68 | серебристый белый, металлик |
кадмий | 8,64 | серебристый белый, металлик |
углерод (графит) | 2,25 | черный, тупой |
хром | 7. | сталь серый, твердый |
кобальт | 8,9 | серебристый серый, металлик |
Медь Золото | 8,92 19,3 | красноватый, металлический желтый, металлический |
железо | 7,86 | серебро , металлический |
свинец | 11,3 | серебристо-голубоватый белый, мягкий, металлик |
марганец | 7. | серый розовый, металлик |
Никель Платина | 8,9 21,4 | серебро , металлический серебро, металлический |
кремний | 2,32 | сталь серый, кристаллический |
серебро | 10,5 | серебро , металлический |
банка (серый) | 5,75 | серый |
банка (белый) | 7,28 | белый металлический |
Цинк | 7. |

 Так же и ртуть, которая помогала вылечить разные болезни тех времен, начиная от ангины и до чумы. Уже до двадцатого столетия было известно более 60 металлов, а вначале XXI века – 90. Прогресс не стоит на месте и ведет человечество вперед. Но встает вопрос, какой металл является тяжелым и превосходит по весу все остальные? И вообще, какие они, эти самые тяжелые металлы в мире?
Так же и ртуть, которая помогала вылечить разные болезни тех времен, начиная от ангины и до чумы. Уже до двадцатого столетия было известно более 60 металлов, а вначале XXI века – 90. Прогресс не стоит на месте и ведет человечество вперед. Но встает вопрос, какой металл является тяжелым и превосходит по весу все остальные? И вообще, какие они, эти самые тяжелые металлы в мире? Рассмотрены припои, бронзы, баббиты и пьютеры. Описываются их марки, свойства, применение
Рассмотрены припои, бронзы, баббиты и пьютеры. Описываются их марки, свойства, применение — баббиты на основе свинца с добавлением сурьмы и олова.
— баббиты на основе свинца с добавлением сурьмы и олова. Незначительная степень прочности этих лигатур позволяет применять их лишь в производстве подшипников, которые, напротив, отличаются износостойким и надежным корпусом, выполненным из стали или бронзы. Долговечность подшипников напрямую зависит от толщины слоя баббитового сплава, залитого на вкладыш из стали. И, соответственно, чем тоньше баббитовый слой, тем меньше срок эксплуатации подшипника.
Незначительная степень прочности этих лигатур позволяет применять их лишь в производстве подшипников, которые, напротив, отличаются износостойким и надежным корпусом, выполненным из стали или бронзы. Долговечность подшипников напрямую зависит от толщины слоя баббитового сплава, залитого на вкладыш из стали. И, соответственно, чем тоньше баббитовый слой, тем меньше срок эксплуатации подшипника. Она плавится при 930—1140 °C. А плотность бронзы равна 7800-8700 кг/м
Она плавится при 930—1140 °C. А плотность бронзы равна 7800-8700 кг/м

 Изделия из бронзы для нефтегазового оборудования
Изделия из бронзы для нефтегазового оборудования В них также включают и другие элементы. Однако, как правило, их содержание в припоях бывает незначительно. Легирующие элементы обычно добавляют в данные сплавы для улучшения показателей тех или иных свойств (антикоррозийной защите, прочности и т.д.).
В них также включают и другие элементы. Однако, как правило, их содержание в припоях бывает незначительно. Легирующие элементы обычно добавляют в данные сплавы для улучшения показателей тех или иных свойств (антикоррозийной защите, прочности и т.д.). Те же сплавы, в составе которых преобладает свинец (а не олово), имеют матовую поверхность темно-серого цвета. Еще одна их отличительная особенность – хорошая пластичность. Те припои, в которых больше олова, жестки и прочны. Их невозможно легко и быстро погнуть.
Те же сплавы, в составе которых преобладает свинец (а не олово), имеют матовую поверхность темно-серого цвета. Еще одна их отличительная особенность – хорошая пластичность. Те припои, в которых больше олова, жестки и прочны. Их невозможно легко и быстро погнуть. Практически один и тот же сплав. Применяется для запаивания печатных плат радиоприборов. Довольно часто используется при сборке электронного оборудования. Он начинает плавиться при 183 градусах Цельсия и выше. При 190 градусах припой расплавляется полностью.
Практически один и тот же сплав. Применяется для запаивания печатных плат радиоприборов. Довольно часто используется при сборке электронного оборудования. Он начинает плавиться при 183 градусах Цельсия и выше. При 190 градусах припой расплавляется полностью. Содержание сурьмы в таких припоях варьируется от 0,5 % до 2%. ПОССу плавится при 189 градусах Цельсия.
Содержание сурьмы в таких припоях варьируется от 0,5 % до 2%. ПОССу плавится при 189 градусах Цельсия. В те или иные оловянные сплавы нередко добавляют легирующие компоненты для улучшения их свойств. Благодаря большому разнообразию соединений такого рода олово нашло применение в ряде отраслей промышленности.
В те или иные оловянные сплавы нередко добавляют легирующие компоненты для улучшения их свойств. Благодаря большому разнообразию соединений такого рода олово нашло применение в ряде отраслей промышленности.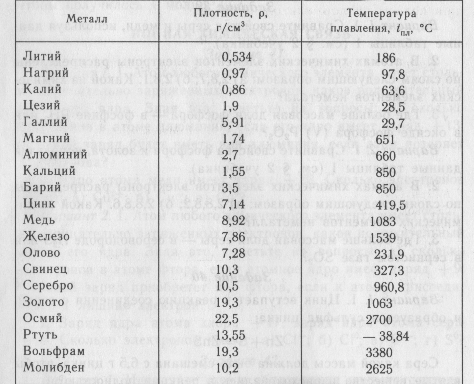 Я знал, что должен был изучать латынь в старшей школе.
Я знал, что должен был изучать латынь в старшей школе. 2
2 2
2