Решение задач на растворы, с избытком
Пример 1:
Какой объём водорода (н. у.) может получиться при действии 6,5 г цинка на 200 г 10%-ного раствора серной кислоты?
Решение:
- Записываем уравнение реакции:
Zn + H2SO4 = ZnSO4 + H2↑
Находим молярную массу цинка:
M (Zn) = 65 г/моль
Находим молярную массу серной кислоты:
M (H2SO4) = 1 • 2 + 32 + 16 • 4 = 98 (г/моль)
(молярную массу каждого элемента, численно равную относительной атомной массе, смотрим в периодической таблице под знаком элемента и округляем до целых) - Находим чистую массу серной кислоты в растворе:
m растворенного вещества = m раствора • ω = 200 • 0,10 = 20 (г)
Более рационально подставить в уравнение массу, но если Ваш учитель требует решать через моли, находим количество вещества серной кислоты:
n (H2SO4) = m/M = 20 г / 198 г/моль и т. д. Потом подставляем в уравнение моли.
д. Потом подставляем в уравнение моли. - Находим, какое вещество в недостатке. Для этого записываем над уравнением реакции имеющиеся данные, а под уравнением — массу согласно уравнению (равна молярной массе, умноженной на число моль, т. е. коэффициент перед веществом. В этом примере равен 1):
Zn + H2SO4 = ZnSO4 + H2↑
65 г 98 г
Составляем неравенство из двух дробей:
6,5 г < 20 г
65 г 98 г
Цинк в недостатке — расчет ведем по нему (его отношение фактической массы к эквивалентной массе меньше, значит, он израсходуется раньше. Серная кислота останется в избытке)
Будьте внимательны! Ошибка в этом действии делает решение неверным! - Записываем над уравнением реакции полученные данные, а под уравнением — данные по уравнению в тех же единицах измерения:
6,5 г x моль
Zn + H2SO4 = ZnSO4 + H2↑
65 г 1 моль
Составляем пропорцию:
6,5 г — x моль
65 г — 1 моль
Находим число моль выделившегося водорода:
x = 6,5 г • 1 моль / 65 г = 0,1 моль - Находим объем водорода:
v = 22,4 л/моль • n,
где 22,4 — молярный объем, т. е. объем одного моля любого газа,
е. объем одного моля любого газа,
n — количество вещества (моль)
v = 22,4 л/моль • 0,1 моль = 2,24 л
Ответ: 2,24 л.
Пример 2:
Какой объём газа (н. у.) выделится, если цинк опустить в 40 мл 10%-ного раствора соляной кислоты, плотность которого 1.07 г/мл?
Решение:
- Записываем уравнение реакции:
Zn + 2HCl = ZnCl2 + H2↑
Задача имеет решение, если цинк в избытке. - Находим массу раствора соляной кислоты:
m = v • ρ = 40 мл • 1,07 г/мл = 42,8 г - Находим чистую массу соляной кислоты в растворе:
m растворенного вещества = 42,8 • 0,10 = 4,28 (г) - Находим молярную массу соляной кислоты:
Находим количество вещества соляной кислоты:
n (HCl) = m/M = 4,28 г / 36,5 г/моль = 0,117 моль - Записываем над уравнением реакции имеющиеся данные, а под уравнением — число моль согласно уравнению (равно коэффициенту перед веществом):
0,117 моль x моль
Zn + 2HCl = ZnCl2 + H2↑
2 моль 1 моль
Составляем пропорцию:
0,117 моль — x моль
2 моль — 1 мольНаходим x:
x = 0,117 моль • 1 моль / 2 моль = 0,0585 моль - Находим объем водорода:
v = 22,4 л/моль • 0,0585 моль = 1,31 л - Округляем результат, чтобы в нем было не больше значащих цифр, чем в величинах в условии задачи (2 значащие цифры)
Ответ: 1,3 л.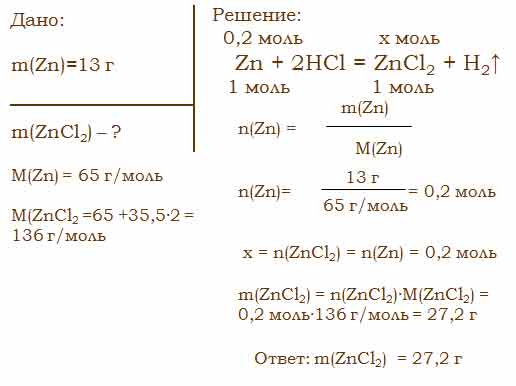
Пример 3:
Какую массу сложного эфира можно получить при действии на 100 г 20%-ного раствора этилового спирта избытком уксусной кислоты?
Решение:
- Записываем уравнение реакции:
CH3COOH + HOC2H5 → CH3COOC2H5 + H2O - Находим чистую массу этилового спирта:
mспирта = mр-ра • ω = 100 г • 20 % = 100 г • 0,20 = 20 г - Находим молярную массу спирта и эфира:
M (HOC2H5) = 1 + 16 + 12 • 2 + 5 = 46 (г/моль)
M (CH3COOC2H5) = 12 + 3 + 12 + 16 + 45 = 88 (г/моль) - Подставляем данные по условию задачи в уравнение
20 г x г
CH3COOH + HOC2H5 → CH3COOC2H5 + H2O
46 г 88 г - Составляем пропорцию, находим x:
20 г — x г
46 г — 88 г
x = 20 • 88 / 46 = 38,3 (г)
Ответ: 38 г
Если ваши преподаватели требуют решать все в молях, переводите чистую массу спирта в моли по формуле:
n = m / M
а уравнение будет выглядеть так:
CH3COOH + HOC2H5 → CH3COOC2H5 + H2O
1 моль 1 моль
В конце найденное количество моль переводим в массу, умножая моли эфира на молярную массу:
m = n • M = . ..
..
(Ответ должен получиться приблизительно такой же)
автор: Владимир Соколов
UNEC – Azərbaycan Dövlət İqtisad Universiteti — Page not found
Why UNEC?
Regionda iqtisad elmini dərindən öyrədən fundamental elm və təhsil mərkəzidir;
Tədris prosesi və kadr hazırlığı beynəlxalq təhsil sisteminə uyğundur;
İxtisaslar bakalavr, magistr və doktorantura təhsil pillələri üzrə
azərbaycan, ingilis, rus və türk dillərində tədris edilir;
Auditoriyada mərkəz nöqtəsi tələbədir;
Tələbə universiteti iki və daha çox ixtisasla (dual major) bitirə bilər;
Tələbələrin müxtəlif mübadilə proqramlarında iştirak etmək imkanı vardır;
403 professor və dosent çalışır.
Son xəbərlər Elanlar Bütün xəbərlər ALL ANNOUNCEMENTS
The Journal of Economic Sciences: Theory and Practice
№ 2
ECONOMIC HERITAGE OF HEYDAR ALIYEV
Connect with
rector
-
Graduates
Mikayıl Cabbarov
İqtisadiyyat naziri
-
Graduates
Ceyhun Bayramov
Xarici işlər naziri
-
Graduates
Şahin Mustafayev
Azərbaycan Respublikası Baş Nazirinin müavini
-
Graduates
Muxtar Babayev
Ekologiya və təbii sərvətlər naziri
-
Graduates
Fərid Qayıbov
Gənclər və idman naziri
-
Graduates
Səttar Möhbalıyev
Azərbaycan Həmkarlar İttifaqları Konfederasiyasının sədri
-
Graduates
Vüqar Gülməmmədov
Hesablama Palatasının sədri -
Graduates
Vüsal Hüseynov
Dövlət Miqrasiya Xidmətinin rəisi
-
Graduates
Ramin Quluzadə
Azərbaycan Respublikası Prezidentinin İşlər müdiri
-
Graduates
Natiq Əmirov
Azərbaycan Respublikası Prezidentinin İqtisadi islahatlar üzrə köməkçisi
-
Graduates
Kərəm Həsənov
Prezident Administrasiyasının Dövlət nəzarəti məsələləri şöbəsinin müdiri
-
Graduates
Azər Əmiraslanov
Nazirlər Kabineti Aparatının İqtisadiyyat şöbəsinin müdiri
-
Graduates
Rövşən Nəcəf
AR Dövlət Neft Şirkətinin prezidenti
-
Graduates
Firudin Qurbanov
Elm və təhsil nazirinin müavini
-
Graduates
İdris İsayev
Elm və təhsil nazirinin müavini
-
Graduates
Sevinc Həsənova
İqtisadiyyat nazirinin müavini
-
Graduates
Şirzad Abdullayev
İqtisadiyyat nazirinin müşaviri
-
Graduates
Azər Bayramov
Maliyyə nazirinin müavini
-
Graduates
Sahib Məmmədov
İqtisadiyyat nazirinin müavini
-
Graduates
Məmməd Musayev
Azərbaycan Respublikası Sahibkarlar (İşəgötürənlər) Təşkilatları Milli Konfederasiyasının prezidenti
-
Graduates
Vüsal Qasımlı
İqtisadi İslahatların Təhlili və Kommunikasiya Mərkəzinin direktoru
-
Graduates
İlqar Rəhimov
Milli Paralimpiya Komitəsinin prezidenti
-
Graduates
Rüfət Rüstəmzadə
Qida Təhlükəsizliyi Agentliyinin sədr müavini
-
Graduates
Rəşad Mafusov
Qida Təhlükəsizliyi Agentliyinin sədr müavini
-
Graduates
Rauf Səlimov
Dövlət Statistika Komitəsi sədrinin müavini
-
Graduates
Cabbar Musayev
Dövlət Statistika Komitəsinin Aparat rəhbəri
-
Graduates
Fərhad Hacıyev
Gənclər və idman nazirinin müavini
-
Graduates
Süleyman Qasımov
AR Dövlət Neft Şirkətinin iqtisadi məsələlər üzrə vitse-prezidenti
-
Graduates
Fərhad Tağı-zadə
General-leytenant
-
Graduates
Ziyad Səmədzadə
Millət vəkili
-
Graduates
Xanhüseyn Kazımlı
Azərbaycan Sosial Rifah Partiyasının sədri
-
Graduates
Mikayıl İsmayılov
AR Dövlət Neft Şirkətinin vitse-prezidenti
-
Graduates
Vahab Məmmədov
Dövlət Statistika Komitəsi sədrinin birinci müavini
-
Graduates
Yusif Yusifov
Dövlət Statistika Komitəsi sədrinin müavini
-
Graduates
Fəxrəddin İsmayılov
Auditorlar Palatası sədrinin müavini
-
Graduates
Xalid Əhədov
Birinci vitse-prezidentin köməkçisi
-
Graduates
Emin Hüseynov
Birinci vitse-prezidentin köməkçisi
-
Graduates
Qəşəm Bayramov
Auditorlar Palatası aparatının rəhbəri
-
Graduates
Rafiq Aslanov
Meliorasiya və Su Təsərrüfatı Açıq Səhmdar Cəmiyyətinin sədr müavini
-
Graduates
Tahir Mirkişili
Millət vəkili, Milli Məclisin İqtisadi siyasət, sənaye və sahibkarlıq komitəsinin sədri
-
Graduates
Əli Məsimli
Millət vəkili
-
Graduates
Vüqar Bayramov
Millət vəkili
-
Graduates
Eldar Quliyev
Millət vəkili
-
Graduates
Əli Nuriyev
AMEA-nın müxbir üzvü
-
Graduates
İqbal Məmmədov
Millət vəkili
-
Graduates
Şahin Əliyev
Nəqliyyat, Rabitə və Yüksək Texnologiyalar Nazirliyi yanında Elektron Təhlükəsizlik Xidmətinin rəisi
-
Graduates
Şahin Bayramov
Mingəçevir Dövlət Universitetinin rektoru
-
Graduates
Balakişi Qasımov
İctimai Televiziya və Radio Yayımları Şirkətinin baş direktoru
-
Graduates
Elnur Rzayev
Xaçmaz Rayon İcra Hakimiyyətinin başçısı
-
Graduates
Kamran İbrahimov
“Azərpoçt” MMC-nin baş direktor müavini
-
Graduates
Alim Quliyev
Mərkəzi Bankın sədrinin birinci müavini
-
Graduates
Vadim Xubanov
Mərkəzi Bankın sədrinin müavini
-
Graduates
Aftandil Babayev
Mərkəzi Bankın sədrinin müavini
-
Graduates
Mehman Məmmədov
“Expressbank” ASC-nin İdarə Heyətinin sədri
-
Graduates
Anar Həsənov
AccessBankın İdarə Heyətinin Sədri
-
Graduates
Fərid Hüseynov
«Kapital Bank»ın İdarə Heyəti sədrinin I müavini
-
Graduates
Rövşən Allahverdiyev
Kapital Bankın İdarə Heyətinin sədri
-
Graduates
Rza Sadiq
“Bank BTB” Müşahidə Şurasının Sədri
-
Graduates
Elnur Qurbanov
“AFB Bank” ASC-nin Müşahidə Şurasının Sədri
-
Graduates
Zaur Qaraisayev
“AFB Bank” ASC-nin İdarə Heyətinin Sədri
-
Graduates
Kamal İbrahimov
“Baku Steel Company” şirkətinin direktoru
-
Graduates
Vaqif Həsənov
«Qarant Sığorta» ASC-nin İdarə Heyətinin sədri
Elektron Kitabxana
ABCÇDEƏFGĞHXIİJKQLMNOÖPRSŞTUÜVYZ0-9
Налоги и налогообложение в Азербайджане
460 PAGES | DOWNLOAD
Dördüncü sənaye inqilabı
204 PAGES | DOWNLOAD
Mühasibat hesabatı
258 PAGES | DOWNLOAD
İaşə məhsullarının texnologiyası kursundan laboratoriya praktikumu
219 PAGES | DOWNLOAD
Susuz həyat yoxdur
215 PAGES | DOWNLOAD
Elektron kommersiya
212 PAGES | DOWNLOAD
www. president.az
www.mehriban-aliyeva.org
www.heydar-aliyev-foundation.org
www.azerbaijan.az
www.edu.gov.az
www.tqdk.gov.az
www.economy.gov.az
www.science.gov.az
www.azstat.org
www.atgti.az
www.virtualkarabakh.az
www.ecosciences.edu.az
www.polpred.com
president.az
www.mehriban-aliyeva.org
www.heydar-aliyev-foundation.org
www.azerbaijan.az
www.edu.gov.az
www.tqdk.gov.az
www.economy.gov.az
www.science.gov.az
www.azstat.org
www.atgti.az
www.virtualkarabakh.az
www.ecosciences.edu.az
www.polpred.comХимия: Молярная масса
Говоря о проведении химических реакций, не очень удобно говорить, что вы хотите, чтобы «один моль соединения X прореагировал с двумя молями соединения Y». Возможно, это то, что вам нужно сделать, но, к сожалению, не существует машин, способных сосчитать 6,02 × 10 23 молекул.
Молекулярные значения
Молярная масса вещества представляет собой массу 6,02 × 10 23 атомов или молекул этого вещества в граммах. Единицей молярной массы является грамм/моль, обычно сокращенно г/моль.
В результате нам придется научиться находить то, что называется молярной массой — весом одного моля химического соединения. Таким образом, если кто-то скажет, что нам нужно использовать два моля воды в реакции, мы можем пойти на весы и просто взвесить их вместо того, чтобы считать по отдельности очень большое количество молекул.
Таким образом, если кто-то скажет, что нам нужно использовать два моля воды в реакции, мы можем пойти на весы и просто взвесить их вместо того, чтобы считать по отдельности очень большое количество молекул.
Chemistrivia
Другими распространенными терминами, которые означают то же самое, что и «молярная масса», являются «молекулярная масса», «молекулярная масса» и даже «масса формулы грамма».
Найти молярные массы соединений несложно, если знать их формулы. Для этого умножьте количество атомов каждого элемента в соединении на их атомные массы из таблицы Менделеева. Складывая эти числа, вы получаете молярную массу соединения.
Например, найдем молярную массу серной кислоты, H 2 SO 4 :
| Элемент | Количество атомов | Атомная масса (г) | Масса × Атомы |
|---|---|---|---|
| Н | 2 | 1. 01 01 | 2,02 |
| С | 1 | 32.07 | 32.07 |
| О | 4 | 16.00 | 64,00 |
| Всего: | 98,09 г |
В результате мы бы сказали, что молярная масса серной кислоты составляет «98,09 г/моль».
У вас есть проблемы
Задача 1. Найдите молярные массы следующих соединений:
(a) Na 2 SO 4
(b) треххлористый азот
(c) фтор
Выдержки из Полное руководство по химии для идиотов © 2003, Ян Гуч. Все права защищены, включая право на полное или частичное воспроизведение в любой форме. Используется по договоренности с Alpha Books , членом Penguin Group (USA) Inc.
Чтобы заказать эту книгу непосредственно у издателя, посетите веб-сайт Penguin USA или позвоните по телефону 1-800-253-6476.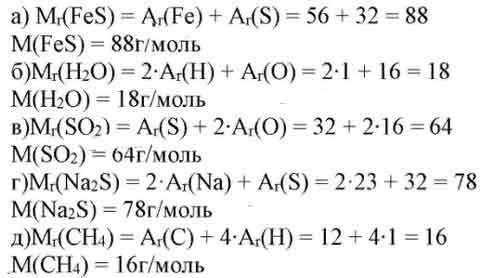 Вы также можете приобрести эту книгу на Amazon.com и в Barnes & Noble.
Вы также можете приобрести эту книгу на Amazon.com и в Barnes & Noble.
- Химия: что такое моль?
Сколько существует языков?
Эдвард Дж. Уилер: Ночной Марди Гра
Джон Донн: Увещевание XVII. Нунк Ленто
Папа Франциск, Папство и Римско-католическая церковь
22 самых посещаемых места в Техасе
Сколько молей содержится в 1 моль h3SO4?
В 1 моле вещества содержится только один моль h3SO4; это связано с тем, что молекулярная формула h3SO4 — h3SO4, которая содержит два атома водорода, один атом серы и четыре атома кислорода. Таким образом, молярная масса h3SO4 равна 98,
Таким образом, молярная масса h3SO4 равна 98,
08 г/моль, что означает, что на 98.08 грамм вещества. Следовательно, если имеется 1 моль h3SO4, присутствует только 1 моль вещества.
Содержание
Что такое 1M h3SO4?
1M h3SO4 представляет собой одномолярный раствор серной кислоты, коррозионного и сильнокислотного вещества, получаемого из газообразного диоксида серы. Это бесцветная жидкость без запаха, состоящая из двух атомов водорода, одного атома серы и четырех атомов кислорода (h3SO4).
При разбавлении водой ведет себя как сильная кислота и образует ионы сульфата и гидроксония. В водном растворе 1 М серной кислоты составляет примерно 1,8 М (18 мас.ч.) в концентрации ионов гидроксония, что делает ее одной из самых сильных кислот.
Его кислотность широко используется в различных отраслях промышленности, таких как производство удобрений, медицинских товаров и различных промышленных химикатов. Он также используется в батареях и лабораторном оборудовании.
Как приготовить раствор 1 h3SO4?
Чтобы приготовить 1 раствор H3SO4, вам понадобится серная кислота, которая представляет собой едкую бесцветную маслянистую жидкость. Чтобы начать приготовление раствора, возьмите соответствующий контейнер и защитное снаряжение (очки, латексную перчатку и фартук).
Используйте защитное снаряжение во время процесса. Затем отвесьте в контейнер 10 граммов серной кислоты. Затем с помощью мерного стакана наполните контейнер водой, пока он не будет заполнен примерно на 75%. Наконец, перемешайте содержимое емкости до полного растворения серной кислоты.
Наконец, перемешайте содержимое емкости до полного растворения серной кислоты.
Когда раствор готов, пометьте контейнер соответствующим образом и храните в прохладном, сухом месте.
1 г равен 1 моль?
Нет, 1 г не равен 1 моль. Граммы (G) — это единица измерения массы, а моли (моль) — это единица измерения определенного количества вещества. 1 грамм эквивалентен 0,001 моля. Это означает, что для любого данного материала 1G будет содержать 0,
001 моль этого вещества. Итак, 1G не равен 1 моль.
Итак, 1G не равен 1 моль.
Что такое 1G в M s2?
1G (одна сила тяжести) равна 9,80665 м/с2, то есть ускорению силы тяжести на поверхности земли. 1G определяется как ускорение, которое в идеале испытывает свободно падающее тело вблизи земной поверхности, с помощью которого можно измерить любое другое ускорение.
Следовательно, 1G в м/с2 равен 9,80665 м/с2.
Чему равен один моль?
923 частицы данного вещества.Сколько NaOH требуется для нейтрализации h3SO4?
youtube.com/embed/v6_lftov6JI?enablejsapi=1&rel=1&modestbranding=0&autoplay=0&cc_load_policy=0&cc_lang_pref=&iv_load_policy=1&loop=0&fs=1&playsinline=0&autohide=2&theme=dark&color=red&controls=1&» title=»YouTube player» allow=»accelerometer; autoplay; clipboard-write; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»» data-no-lazy=»1″ data-skipgform_ajax_framebjll=»»>Количество NaOH, необходимое для нейтрализации h3SO4, зависит от концентрации нейтрализуемой серной кислоты. Обычно стехиометрическое соотношение NaOH и h3SO4 составляет 1:1. Следовательно, на каждый 1 моль h3SO4 нужен 1 моль NaOH для его нейтрализации.
Чтобы рассчитать необходимое количество NaOH, вы можете использовать следующее уравнение:
Моль NaOH = (Молярность h3SO4 x Литры h3SO4) / (Молярность NaOH)
Например, если у вас есть 1 л h3SO4 с молярностью 2M, вам потребуется 2M (2 моля) NaOH для его нейтрализации. Следовательно, вам нужно использовать 2 л NaOH с молярностью 2M, чтобы нейтрализовать кислоту.
Следовательно, вам нужно использовать 2 л NaOH с молярностью 2M, чтобы нейтрализовать кислоту.
Реагирует ли NaOH с h3SO4 в молярном соотношении 1 1?
Нет, NaOH и h3SO4 не реагируют в молярном соотношении 1:1. NaOH и h3SO4 образуют кислотно-щелочную реакцию, и фактическое соотношение реакции составляет 2:1, а это означает, что на каждый 1 моль NaOH нужно 2 моля h3SO4.
В химической реакции количество реагентов и продуктов определяется химическим уравнением и не зависит от количества используемых NaOH и h3SO4. Реакция выглядит следующим образом:
Реакция выглядит следующим образом:
NaOH + h3SO4 → NaHSO4 + h3O
Является ли реакция между NaOH и h3SO4 окислительно-восстановительной реакцией?
Нет, реакция между NaOH и h3SO4 не является окислительно-восстановительной реакцией. Окислительно-восстановительная реакция, или окислительно-восстановительная реакция, включает перенос электронов между двумя частицами. В реакции между NaOH и h3SO4 электроны не передаются, что делает ее не настоящей окислительно-восстановительной реакцией.
Однако все окислительно-восстановительные реакции включают в себя тот или иной тип кислотно-основной реакции, и, поскольку NaOH и h3SO4 являются основаниями и кислотами соответственно, их можно классифицировать как окислительно-восстановительные реакции. Реакцию между NaOH и h3SO4 обычно называют реакцией нейтрализации, которая является кислотно-основной реакцией.
В ходе этой реакции образуются вода и соль, и рН смеси обычно не меняется.
Когда 1M h3SO4 полностью нейтрализуется NaOH?
Когда 1M h3SO4 (серная кислота) полностью нейтрализуется NaOH (гидроксидом натрия), полученный раствор представляет собой нейтральный раствор с pH 7. Это связано с тем, что серная кислота является сильной кислотой, а гидроксид натрия является сильным основанием, поэтому, когда их смешивают в равных количествах, все ионы водорода из кислоты нейтрализуются ионами гидроксида из основания, в результате чего раствор становится нейтральным.
Для достижения полной нейтрализации необходимо использовать соответствующее молярное соотношение кислоты и основания. В этом случае, поскольку концентрация обеих частиц составляет 1 М, для достижения полной нейтрализации требуется соотношение h3SO4 и NaOH 1:1 (или 2 моля кислоты на 2 моля основания).
В этом случае, поскольку концентрация обеих частиц составляет 1 М, для достижения полной нейтрализации требуется соотношение h3SO4 и NaOH 1:1 (или 2 моля кислоты на 2 моля основания).
Любое количество основания меньше требуемого может привести к кислому или щелочному раствору, в зависимости от того, насколько близко молярное соотношение к требуемому соотношению, причем самое близкое соотношение приводит к нейтральному раствору.
Какое молярное соотношение NaOH и h3SO4 необходимо для реакции нейтрализации?
Молярное соотношение NaOH и h3SO4, необходимое для реакции нейтрализации, зависит от концентрации каждого реагента и стехиометрии реакции. Для общей кислотно-щелочной реакции молярное отношение составляет один моль кислоты к одному молю основания.
Следовательно, в реакции нейтрализации между h3SO4 (кислотой) и NaOH (основанием) молярное отношение NaOH к h3SO4 составляет 1:1.
Однако реакция между сильной кислотой и сильным основанием более сложная, так как концентрации реагентов могут влиять на степень нейтрализации. Согласно закону химического равновесия, если концентрации реагентов и продуктов различны, реакция будет происходить до тех пор, пока они не сравняются.
Согласно закону химического равновесия, если концентрации реагентов и продуктов различны, реакция будет происходить до тех пор, пока они не сравняются.
Следовательно, если концентрация кислоты больше концентрации основания, реакция будет происходить до тех пор, пока концентрации не сравняются и реакция не завершится.
В реакции между h3SO4 и NaOH концентрация h3SO4 должна быть близка к концентрации NaOH, чтобы реакция была нейтрализована. Таким образом, молярное соотношение NaOH и h3SO4 должно быть близко к 1:1, но может варьироваться в зависимости от концентрации каждого реагента.
Если молярное соотношение NaOH и h3SO4 не равно 1:1, некоторое количество h3SO4 может остаться непрореагировавшим, и смесь будет кислой или щелочной. Важно обеспечить соотношение 1:1 для обеспечения полной нейтрализации.
Как рассчитать количество молей NaOH, необходимое для титрования?
youtube.com/embed/uobTLCceM1Y?enablejsapi=1&rel=1&modestbranding=0&autoplay=0&cc_load_policy=0&cc_lang_pref=&iv_load_policy=1&loop=0&fs=1&playsinline=0&autohide=2&theme=dark&color=red&controls=1&» title=»YouTube player» allow=»accelerometer; autoplay; clipboard-write; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»» data-no-lazy=»1″ data-skipgform_ajax_framebjll=»»>Чтобы рассчитать количество молей NaOH, необходимое для титрования, сначала необходимо определить молярность титруемого раствора кислоты. Как только вы узнаете молярность раствора кислоты, вы можете использовать формулу молей кислоты для расчета необходимого количества молей NaOH.
Формула молей кислоты:
Моль NaOH = (Молярность раствора кислоты) x (Объем раствора кислоты, использованный в литрах)
Например, если вы титруете 100 мл 0,1 М раствора кислоты, необходимое количество молей NaOH будет рассчитываться следующим образом:
моль NaOH = (0,1 М)(0,1 л)
моль NaOH = 0,01 моль NaOH
Следовательно, вам потребуется 0,01 моль NaOH для титрования 100 мл 0,1 М раствора кислоты.

 д. Потом подставляем в уравнение моли.
д. Потом подставляем в уравнение моли. е. объем одного моля любого газа,
е. объем одного моля любого газа,