Ответы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
| Похожие вопросы |
В каком году была сформулирована теория — предшественница кислородной теории горения.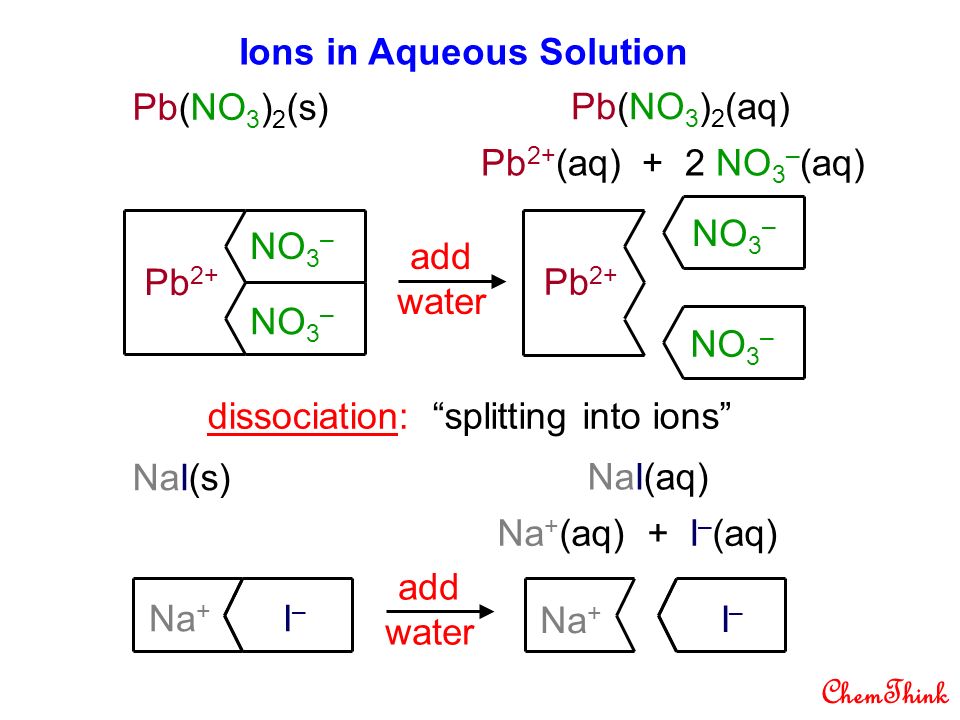
Решено
Вычислите эквивалент и молярную массу эквивалентов Н3РО4 в каждой из следующих реакций, выраженных уравнениями:
ацетон+h3= ацетон+Br2= ацетон+C6H5NHNh3=
Решено
пересчет от объемных процентов к молям
Как изменится скорость реакции 2NO + O2 = 2NO2, если концентрации исходных веществ увеличить в 4 раза?
Пользуйтесь нашим приложением
3. Pb – металл, входящий в состав электрода хит
СВИНЕЦ (лат. Plumbum), Pb, химический элемент IV группы периодической системы Менделеева, атомный номер 82, атомная масса 207,2.
3.1.Свойства
Свинец обычно
имеет грязно-серый цвет, хотя свежий
его разрез имеет синеватый отлив и
блестит. Однако блестящий металл быстро
покрывается тускло-серой защитной
пленкой оксида. Плотность свинца (11,34
г/см3) в полтора раза больше, чем у железа,
вчетверо больше, чем у алюминия; даже
серебро легче свинца.
Свинец очень легко плавится – при 327,5° С, кипит при 1751° С и заметно летуч уже при 700° С. Этот факт очень важен для работающих на комбинатах по добыче и переработке свинца. Свинец – один из самых мягких металлов. Он легко царапается ногтем и прокатывается в очень тонкие листы. Свинец сплавляется со многими металлами. С ртутью он дает амальгаму, которая при небольшом содержании свинца жидкая.
2.Химические свойства
По химическим
свойствам свинец – малоактивный металл:
в электрохимическом ряду напряжений
он стоит непосредственно перед водородом.
Поэтому свинец легко вытесняется другими
металлами из растворов его солей. Если
опустить в подкисленный раствор ацетата
свинца цинковую палочку, свинец выделяется
на ней в виде пушистого налета из мелких
кристалликов, имеющего старинного
название «сатурнова дерева».
Pb + 4HNO3 = Pb(NO3)2 + 2NO2 + h3O, G=-5,04 кДж/моль
Разложение нитрата свинца(II) при нагревании – удобный лабораторный метод получения диоксида азота:
2Pb(NO3)2 = 2PbO + 4NO2 + O2,G=-82,2кДж/моль
Возможна
реакция Pb
с разбавленной и концентрированной
серных кислотах при определенной
температуре и катализаторе. С разбавленной:
С разбавленной:
Pb + h3SO4 = PbSO4 + h3,G=-69,27кДж/моль
С концентрированной:
Pb + 2h3SO4 = PbSO4 + SO2 + 2h3O,G=-468,17кДж/моль
В присутствии кислорода свинец растворяется также в ряде органических кислот. При действии уксусной кислоты образуется легкорастворимый ацетат Pb(Ch4COO)2 (старинное название – «свинцовый сахар»). Свинец заметно растворим также в муравьиной, лимонной и винной кислотах. Растворимость свинца в органических кислотах могло раньше приводить к отравлениям, если пищу готовили в посуде, луженной или паянной свинцовым припоем. Растворимые соли свинца (нитрат и ацетат) в воде гидролизуются:
Pb(NO3)2 + h3O = Pb(OH)NO3 + HNO3,G=-31,3кДж/моль
Взвесь основного ацетата свинца («свинцовая примочка») имеет ограниченное медицинское применение в качестве наружного вяжущего средства. Свинец медленно растворяется и в концентрированных щелочах с выделением водорода:
Pb + 2NaOH + 2h3O = Na2Pb(OH)4 + h3,G=-47,8кДж/моль
что указывает на
амфотерные свойства соединений свинца. Белый гидроксид свинца(II), легко осаждаемый
из растворов его солей, также растворяется
как в кислотах, так и в сильных щелочах:
Белый гидроксид свинца(II), легко осаждаемый
из растворов его солей, также растворяется
как в кислотах, так и в сильных щелочах:
Pb(OH)2 + 2NaOH = Na2Pb(OH)4,G=-57,9кДж/моль
При стоянии или
нагревании Pb(OH)2 разлагается с выделением
PbO. При сплавлении PbO со щелочью образуется
плюмбит состава Na2PbO2. Из щелочного
раствора тетрагидроксоплюмбата натрия
Na2Pb(OH)4 тоже можно вытеснить свинец более
активным металлом. Если в такой нагретый
раствор положить маленькую гранулу
алюминия, быстро образуется серый
пушистый шарик, который насыщен мелкими
пузырьками выделяющегося водорода и
потому всплывает. Если алюминий взять
в виде проволоки, выделяющийся на ней
свинец превращает ее в серую «змею».
При нагревании свинец реагирует с
кислородом, серой и галогенами. Так, в
реакции с хлором образуется тетрахлорид
PbCl4 – желтая жидкость, дымящая на воздухе
из-за гидролиза, а при нагревании
разлагающаяся на PbCl2 и Cl2. (Галогениды
PbBr4 и PbI4 не существуют, так как Pb(IV) –
сильный окислитель, который окислил бы
бромид- и иодид-анионы.) Тонкоизмельченный
свинец обладает пирофорными свойствами
– вспыхивает на воздухе. При продолжительном
нагревании расплавленного свинца он
постепенно переходит сначала в желтый
оксид PbO (свинцовый глет), а затем (при
хорошем доступе воздуха) – в красный
сурик Pb3O4 или 2PbO•PbO2. Это соединение
можно рассматривать также как свинцовую
соль ортосвинцовой кислоты Pb2[PbO4]. С
помощью сильных окислителей, например,
хлорной извести, соединения свинца(II)
можно окислить до диоксида:
(Галогениды
PbBr4 и PbI4 не существуют, так как Pb(IV) –
сильный окислитель, который окислил бы
бромид- и иодид-анионы.) Тонкоизмельченный
свинец обладает пирофорными свойствами
– вспыхивает на воздухе. При продолжительном
нагревании расплавленного свинца он
постепенно переходит сначала в желтый
оксид PbO (свинцовый глет), а затем (при
хорошем доступе воздуха) – в красный
сурик Pb3O4 или 2PbO•PbO2. Это соединение
можно рассматривать также как свинцовую
соль ортосвинцовой кислоты Pb2[PbO4]. С
помощью сильных окислителей, например,
хлорной извести, соединения свинца(II)
можно окислить до диоксида:
Pb(Ch4COO)2 + Ca(ClO)Cl + h3O = PbO2 + CaCl2 + 2Ch4COOH,
G=-95,6 кДж/моль
Диоксид образуется также при обработке сурика азотной кислотой:
Pb3O4 + 4HNO3 = PbO2 + 2Pb(NO3)2 + 2h3O,
G=-150,9кДж/моль
Если сильно
нагревать коричневый диоксид, то при
температуре около 300° С он превратится
в оранжевый Pb2O3 (PbO•PbO2), при 400° С – в
красный Pb3O4, а выше 530° С – в желтый PbO
(разложение сопровождается выделением
кислорода). В смеси с безводным глицерином
свинцовый глет медленно, в течение 30–40
минут реагирует с образованием водоупорной
и термостойкой твердой замазки, которой
можно склеивать металл, стекло и камень.
Диоксид свинца – сильный окислитель.
Струя сероводорода, направленная на
сухой диоксид, загорается; концентрированная
соляная кислота окисляется им до хлора:
В смеси с безводным глицерином
свинцовый глет медленно, в течение 30–40
минут реагирует с образованием водоупорной
и термостойкой твердой замазки, которой
можно склеивать металл, стекло и камень.
Диоксид свинца – сильный окислитель.
Струя сероводорода, направленная на
сухой диоксид, загорается; концентрированная
соляная кислота окисляется им до хлора:
PbO2 + 4HCl = PbCl2 + Cl2 + h3O,G=-86,7кДж/моль
сернистый газ – до сульфата:
PbO2 + SO2 = PbSO4,G=-187,6кДж/моль
а соли Mn2+ – до перманганат-ионов:
5PbO2 + 2MnSO4 + h3SO4 = 5PbSO4 + 2HMnO4 + 2h3O,
G=-73,5кДж/моль
Диоксид свинца образуется, а затем расходуется при зарядке и последующем разряде самых распространенных кислотных аккумуляторов. Соединения свинца(IV) обладают еще более типичными амфотерными свойствами. Так, нерастворимый гидроксид Pb(OH)4 бурого цвета легко растворяется в кислотах и щелочах:
Pb(OH)4 + 6HCl = h3PbCl6,G=-23,4кДж/моль
Pb(OH)4 + 2NaOH = Na2Pb(OH)6,G=-36,7кДж/моль
Диоксид свинца, реагируя со щелочью, также образует комплексный плюмбат(IV):
PbO2 + 2NaOH + 2h3O = Na2[Pb(OH)6],G=-75,8кДж/моль
Если же PbO2 сплавить
с твердой щелочью, образуется плюмбат
состава Na2PbO3. Из соединений, в которых
свинец(IV) входит в состав катиона,
наиболее важен тетраацетат. Его можно
получить кипячением сурика с безводной
уксусной кислотой:
Из соединений, в которых
свинец(IV) входит в состав катиона,
наиболее важен тетраацетат. Его можно
получить кипячением сурика с безводной
уксусной кислотой:
Pb3O4 + 8Ch4COOH = Pb(Ch4COO)4 + 2Pb(Ch4COO)2 + 4h3O,
G=-93,7кДж/моль
При охлаждении из раствора выделяются бесцветные кристаллы тетраацетата свинца. Другой способ – окисление ацетата свинца(II) хлором:
2Pb(Ch4COO)2 + Cl2 = Pb(Ch4COO)4 + PbCl2,
G=-29,5кДж/моль
Водой тетраацетат
мгновенно гидролизуется до PbO2 и Ch4COOH.
Тетраацетат свинца находит применение
в органической химии в качестве
селективного окислителя. Например, он
весьма избирательно окисляет только
некоторые гидроксильные группы в
молекулах целлюлозы, а 5-фенил-1-пентанол
под действием тетраацетата свинца
окисляется с одновременной циклизацией
и образованием 2-бензилфурана. Органические
производные свинца – бесцветные очень
ядовитые жидкости. Один из методов их
синтеза – действие алкилгалогенидов
на сплав свинца с натрием:
Один из методов их
синтеза – действие алкилгалогенидов
на сплав свинца с натрием:
4C2H5Cl + 4PbNa = (C2H5)4Pb + 4NaCl + 3Pb,G=-42,5кДж/моль
Действием газообразного HCl можно отщеплять от тетразамещенных свинца один алкильный радикал за другим, заменяя их на хлор. Соединения R4Pb разлагаются при нагревании с образованием тонкой пленки чистого металла. Такое разложение тетраметилсвинца было использовано для определения времени жизни свободных радикалов. Тетраэтилсвинец – антидетонатор моторного топлива.
PB (NO3) 2 → PBO + NO2 + O2
- Home
- CDS & Defense Emesclis
- Статья
By Ritesh | Обновлено: 4 ноября, 2022
0 Комментарии. Сбаланное равное — 2. Pb(NO3)2 → 2PbO + 4NO2 + O2. Шаги для балансировки этого уравнения Pb(NO3)2 → PbO + NO2 + O2:
Шаг 1 : Учитывая уравнение:
Pb (NO3)2 → PbO + NO2 + O2
Шаг 2 : Используемый метод для балансировки уравнения:
- с использованием стандартного подхода к балансировке химических уравнений.
 Во-первых, сравните атомы каждого элемента на стороне продукта и реагента в соответствии с методикой.
Во-первых, сравните атомы каждого элемента на стороне продукта и реагента в соответствии с методикой. - Молекулы, содержащие элемент с различным числом атомов на стороне продукта и реагента, должны иметь стехиометрические коэффициенты. Количество атомов с обеих сторон должно быть уравновешено коэффициентом.
- Обычно стехиометрические коэффициенты кислорода и водорода указываются в конце.
- Стехиометрический коэффициент необходимо умножить на общее количество атомов элемента, присутствующего в 1 молекуле вида, чтобы определить количество атомов в одном виде.
- Продолжайте делать это до тех пор, пока обе стороны реагента и продукта не будут иметь одинаковое количество атомов всех реагирующих компонентов.
Прочитать статью полностью
Шаг 3 : Достижение баланса уравнения:
Уравнение выглядит следующим образом: Pb (NO3)2→ PbO + NO2 + O2
Reactant side :
- 1 Lead atom
- 2 Nitrogen atoms
- 6 Oxygen atoms
Product side :
- 1 Lead atom
- 1 Nitrogen atom
- 5 Oxygen atoms
Атомы кислорода уравновешиваются в первую очередь. После уравновешивания получается следующее уравнение: 2 Pb (NO3)2 → 2PbO + 4NO2 + O2
После уравновешивания получается следующее уравнение: 2 Pb (NO3)2 → 2PbO + 4NO2 + O2
Затем атомы свинца и азота уравновешиваются. Обновленное уравнение: 2 Pb (NO3)2→ 2PbO + 4NO2 + O2
Reactant side :
- 2 Lead atom
- 4 Nitrogen atoms
- 12 Oxygen atoms
Product side :
- 2 Lead atom
- 4 Nitrogen atom
- 12 Oxygen atoms
Уравнение уравновешено, потому что имеется равное количество всех атомов реагирующих компонентов как на стороне продукта, так и на стороне реагента.
Итак, уравнение, которое сбалансировано: 2 Pb (NO3)2 → 2PbO + 4NO2 + O2
Резюме :
Сбалансированное уравнение Pb(NO3)2 → PbO + NO2 + O2is 2 Pb(NO3)2 → 2PbO + 4NO2 + O2 . Сбалансированная химическая формула имеет одинаковое количество атомов на стороне реагента и продукта каждого элемента, участвующего в реакции.
CDS & Defense Exams
CDSCAPFAFCATTA ExamACC ExamOther ExamsPracticePreparation
Избранные статьи
Следите за последними обновлениями0011
Наши приложения
- BYJU’S Exam Prep: приложение для подготовки к экзамену
GradeStack Learning Pvt. Ltd.Windsor IT Park, Tower — A, 2nd Floor,
Sector 125, Noida,
Uttar Pradesh 201303
\\[Pb{\\left( {N{O_3}} \ \right)_2} \\to PbO + N{O_2} + {O_2}\\]
Дата последнего обновления: 22 января 2023
•
Всего просмотров: 174,9 тыс.
Ответить
Verified
174.9k+ views
Подсказка: Во-первых, мы знаем, что закон сохранения материи гласит, что материя не может быть произведена или уничтожена в замкнутой изолированной системе.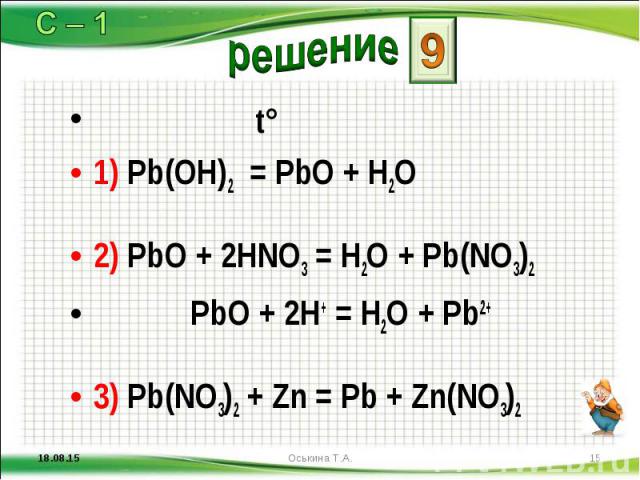
Чтобы сбалансировать химическую реакцию, сначала рассмотрим несбалансированное уравнение, чтобы показать реагенты и продукты. Затем определите и подсчитайте атомы как в реагентах, так и в продуктах следующей реакции. Затем, чтобы количество атомов было одинаковым как в реагентах, так и в продуктах, нам нужно добавить коэффициенты, чтобы количество атомов каждого элемента было одинаковым в обеих частях химического уравнения.
Полный ответ:
Данное несбалансированное химическое уравнение имеет вид
\[Pb{\left( {N{O_3}} \right)_2} \to PbO + N{O_2} + {O_2}\]—(1 )
В уравнении (1) число атомов \[Pb\],\[N\] в реагентах и продуктах одинаково, но число атомов кислорода в реагентах и продуктах равно \[6\] и \[4\] соответственно. Итак, умножьте \[PbO\] на \[2\]. Тогда количество атомов \[Pb\] в реагентах и продуктах становится \[1\] и \[2\] соответственно. Итак, умножьте \[Pb{\left({N{O_3}} \right)_2}\] и \[N{O_2}\] на \[2\]. Тогда число атомов кислорода в реагентах и продуктах становится равным \[12\] и \[8\] соответственно.

 01.20
01.20 Во-первых, сравните атомы каждого элемента на стороне продукта и реагента в соответствии с методикой.
Во-первых, сравните атомы каждого элемента на стороне продукта и реагента в соответствии с методикой.