Что тверже олово или свинец
Содержание
- Свинец
- Сплавы свинца
- Основные данные
- Характеристики отдельных марок
- Больше половины олова
- Меньше половины олова
- Группа специальных сплавов
Олово – мягкий и пластичный блестящий металл серебристо-белого цвета. Характеризуется хорошей коррозионной стойкостью в атмосферных условиях, растворимо в разбавленных сильных кислотах и концентрированных щелочах. Олово применяют для нанесения покрытий (лужения), получения сплавов и припоев для пайки, а также в качестве легирующих присадок.
Сплавы олова представляют собой системы олово – сурьма – медь и олово сурьма – свинец, которые содержат от 3 до 90 % олова. Их применяют как антифрикционные сплавы – баббиты для заливки подшипников и как припои. Использование свинца сокращает стоимость припоя, а введение сурьмы повышает прочность шва.
Свинец
Свинец – мягкий ковкий пластичный металл светло-серого цвета с синеватым оттенком. Значительно мягче олова, режется ножом и царапается ногтем, легко прокатывается в тонкие листы. Свинец устойчив против коррозии и воздействия ряда химических веществ, особенно серной кислоты. Выплавка свинца была одним из первых металлургических процессов. Он широко применяется в химической промышленности для защиты аппаратуры от разъедания. Из свинца изготавливают оболочки для защиты электрических кабелей, дробь, краски и свинцовые аккумуляторы.
Значительно мягче олова, режется ножом и царапается ногтем, легко прокатывается в тонкие листы. Свинец устойчив против коррозии и воздействия ряда химических веществ, особенно серной кислоты. Выплавка свинца была одним из первых металлургических процессов. Он широко применяется в химической промышленности для защиты аппаратуры от разъедания. Из свинца изготавливают оболочки для защиты электрических кабелей, дробь, краски и свинцовые аккумуляторы.
Сплавы свинца
Сплавы свинца имеют высокую плотность и низкую механическую прочность. Они легкоплавки и устойчивы против коррозии. Сплавы с преобладанием свинца значительно дешевле, чем на основе олова. Их используют как антифрикционные сплавы – баббиты, как типографские сплавы и припои. Свинец с добавками олова и сурьмы становится значительно тверже.
Точную дату появления оловянно-свинцового припоя вряд ли кто-то назовет. Однако соединение, обозначаемое «ПОС», известно еще со средних веков. Оно обладает оптимальными качествами для того, чтобы соединять многие металлы.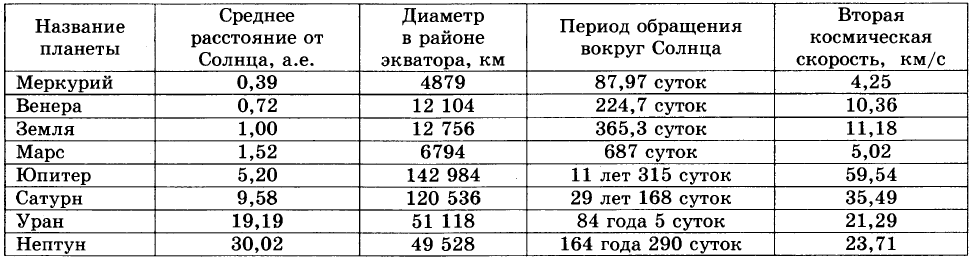
Его легко расплавить, а свинец и олово, входящие в состав, добывались несколько тысяч лет назад. В настоящее время припой ПОС – самый распространенный вид расходного материала, применяемый в каждодневной практике.
Основные данные
Популярность припоев из олова и свинца объясняется несколькими обстоятельствами.
Главная особенность сплавов – способность при определенном соотношении компонентов образовывать состав с эвтектическими свойствами. Это межметаллическая система, температура плавления которой меньше, чем ожидаемые значения.
Можно себе представить радость первооткрывателей, которые обнаружили, что оловянно-свинцовый сплав для превращения в жидкое состояние можно нагревать до меньшей температуры.
Интересно, что эвтектическая смесь может служить растворителем, в котором распределяется при добавлении определенное дополнительное количество какого-либо металла.
Так были разработаны разнообразные марки припоев ПОС. В их технических характеристиках указаны пропорции, значения физических констант.
Визуально заметно, что при преобладании в оловянно-свинцовом сплаве олова припой имеет сильно выраженный металлический блеск. Если в сплаве больше свинца, поверхность имеет сероватый цвет с синим оттенком.
Характеристики отдельных марок
Все представители категории относятся к легкоплавким припоям. Оловянно-свинцовые сплавы при любом соотношении исходных металлов плавятся при температуре до 450 °С. Характеристики припоев ПОС регламентированы ГОСТом.
Производители поставляют припойную продукцию:
- в литых чушках;
- в виде проволочных изделий;
- лентообразной фольги;
- трубчатой продукции с флюсами внутри;
- порошков или пастообразной массы.
В целом существует однозначная закономерность. Чем меньше массовая доля олова в оловянно-свинцовом припое, тем больше его температура плавления и меньше прочностные показатели.
Больше половины олова
В сплаве, содержащем 90 % олова, остальную часть массы составляет свинец.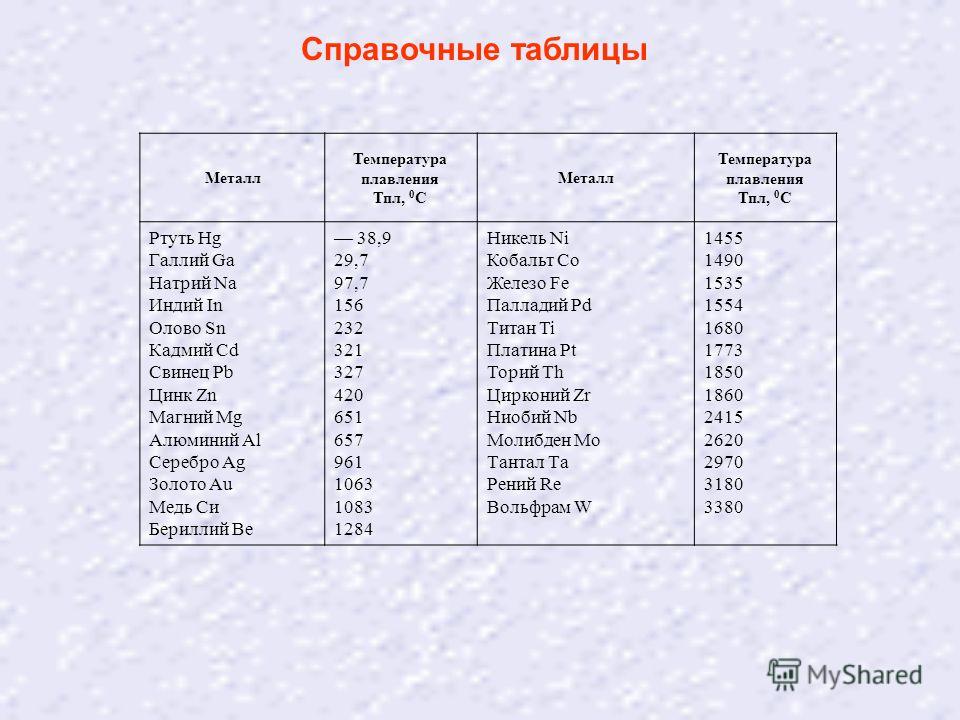 Припой ПОС-90 имеет температуру плавления 220 ℃.
Припой ПОС-90 имеет температуру плавления 220 ℃.
Применяется для пайки изделий, которые впоследствии будут подвергаться гальванической обработке золотом или серебром.
Оловянно-свинцовый припой с 61 % олова имеет более доступную температуру плавления, равную 191 °С. ПОС-61 используется для изготовления тонких контактов деталей из медных и стальных сплавов в различных измерительных приборах. Места нанесения сплава не должны подвергаться сильному нагреванию.
Припой модно применять для пайки проводов, имеющих толщину до 0,08 мм, в обмотке. Он может подвергаться действию токов высокой частоты.
Припой используют во всех ситуациях, требующих большой прочности и надежности соединения радиоэлементов, компонентов микросхем. Им можно паять провода, защищенные оболочкой из поливинилхлорида.
Оловянно-свинцовый припой, содержащий равные доли двух металлов, обозначается как ПОС-50. Он плавится при температуре 222 ℃. Применим во всех ситуациях, где может использоваться ПОС-61.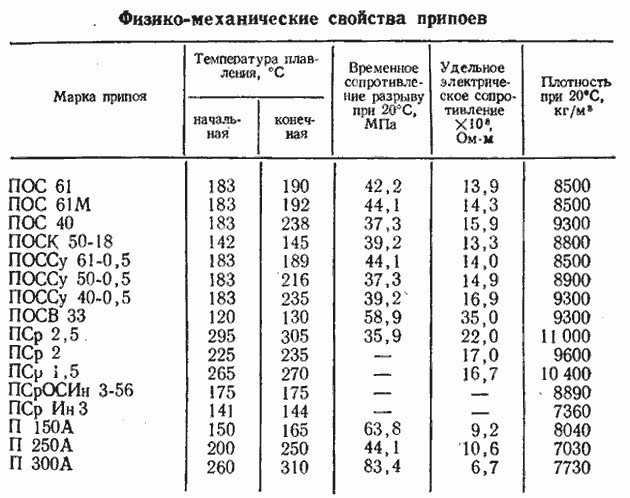
Отличие сводится к тому, что данный припой имеет более высокую температуру плавления. Если контакт может нагреваться это качество будет полезным.
Меньше половины олова
Швы, для которых велика вероятность нагрева до еще более высоких температур, следует паять посредством припоя ПОС-40. Температура плавления оловянно-свинцового сплава, содержащего от 39 % до 41 % олова, составляет 238 °С.
Обращаем внимание на то, что представленные показатели характерны для окончательного плавления сплава. Начинается процесс при несколько более низких температурах.
Сплав предназначен для работы с проводами, деталями из разных металлов. Образующийся шов имеет меньший запас прочности, чем соединения, полученные сплавами с большей массовой долей олова. Припой используют для получения соединений, не подвергающихся большой механической нагрузке.
Еще большую температуру окончательного расплавления имеет сплав ПОС-30. Она равна 256 ℃.
Этот оловянно-свинцовый припой используется для пайки швов, не подлежащих нагрузке, из медных и стальных материалов.
Припой ПОС-18 окончательно расплавляется при 277 ℃. Образующийся шов имеет небольшую механическую устойчивость.
Представленный оловянно-свинцовый сплав можно применять для лужения, пайки ненагружаемых медных деталей, изделий из оцинкованного железа.
Оловянно-свинцовый сплав, содержащий всего 10 % олова, имеет максимальную в этом ряду температуру плавления, равную 299 ℃, и минимальную прочность.
ПОС-10 может использоваться для пайки, лужения контактов на поверхности приборов реле. ГОСТ позволяет применять состав для обработки контрольных точек в топках паровозов. В настоящее время паровозы остались уже только в музеях, иногда их приходится ремонтировать, реставрировать.
Припои с маркировкой ПОС – бессурьмянистые расходные материалы.
Группа специальных сплавов
При добавлении в состав металлических композиций в небольших количествах сурьмы значительно увеличивается прочность шовных соединений.
Материал обозначается маркировкой «ПОСсу», имеет температуры плавления от 189 ℃ (у состава со следовым содержанием сурьмы) до 270 ℃ (у припоя с содержанием сурьмы, достигающим 4 %, в некоторых даже 6 %).
Материалы первой подгруппы с концентрацией добавки, измеряющейся в сотых долях процента – это малосурьмянистые марки.
Такие припои применяются в авиа- и автомобилестроении, при производстве холодильного оборудования, пищевой посуды, подлежащей последующему лужению.
| Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 5 6 |
Олово и свинец находятся в главной подгруппе IV группы Периодической системы, в которую также входят углерод C, кремний Si и германий Ge. Первые два элемента являются неметаллами, германий принадлежит к переходным элементам, а олово и свинец – типичные металлы. Поэтому в данном разделе олово и свинец будут рассматриваться отдельно от остальных элементов главной подгруппы IV группы.
Исторические сведения. Олово и свинец принадлежат к числу семи металлов, известных человечеству издревле, поэтому точная дата их открытия не известна. Следует отметить, что вплоть до наступления н. э. олово и свинец нередко путали между собой, поскольку оба металла обладают схожими свойствами. Отголоски такого заблуждения сохранились до сих пор: например, в некоторых славянских языках (болгарском, сербском, чешском, польском) металл свинец называется словом олово.
Первые упоминания о чистом олове относятся ко II тысячелетию до н. э. Металл был, очевидно, малодоступен и дорог, так как оловянные предметы редко встречаются среди римских и греческих древностей. Открытие олова было связано, скорее всего, со случайным восстановлением касситерита (оловянного камня), наносные отложения которого встречаются на поверхности земли или близко к ней. Другим фактором, способствовавшим открытию металла, явилось то, что оловянные руды намного легче восстанавливаются, чем руды других металлов. Но задолго до того как научились добывать олово в чистом виде, человечеством широко использовался сплав олова с медью (бронза), который получали уже в IV тысячелетии до н. э. На протяжении всего бронзового века этот сплав был, выражаясь современным языком, стратегическим материалом: из него изготавливали орудия труда, оружие, предметы обихода и т. д.
Но задолго до того как научились добывать олово в чистом виде, человечеством широко использовался сплав олова с медью (бронза), который получали уже в IV тысячелетии до н. э. На протяжении всего бронзового века этот сплав был, выражаясь современным языком, стратегическим материалом: из него изготавливали орудия труда, оружие, предметы обихода и т. д.
Первые изделия из свинца датируются III тысячелетием до н. э. (Месопотамия, Древний Египет). Металл был открыт благодаря широкой распространенности своих руд и легкости, с которой его можно выплавить – достаточно было положить свинцовую руду в костер с большим количеством древесного угля и создать тягу (постоянный доступ свежего воздуха).
Происхождение латинского и русского названий обоих металлов доподлинно не установлено. Одна из версий звучит следующим образом: латинское слово stannum (стойкий) первоначально относилось к сплаву свинца и серебра, позднее к другому, имитирующему его сплаву, содержащему около 67% олова, и лишь с IV века н. э. этим словом стали называть олово.
э. этим словом стали называть олово.
Распространение в природе. Олово и свинец не принадлежит к группе наиболее распространенных элементов в земной коре, но и не являются редкими металлами.
Оба металла встречаются в природе в основном в виде кислородных или сернистых соединений, среди которых промышленное значение имеют касситерит (оловянный камень) SnO2, станнин (оловянный колчедан) Cu2S∙FeS∙SnS2, галенит (свинцовый блеск) PbS, англезит PbSO4 и церуссит PbCO3. Всего же известно около 25 оловянных и более 100 свинцовых минералов. Исключительно редко олово и свинец встречаются в самородном состоянии.
Физические свойства. Олово имеет две аллотропные модификации. При обычных условиях устойчивой является β-форма (белое олово) – блестящий металл серебристо-белого цвета. Постепенно блеск исчезает, так как на поверхности металла образуется оксидная пленка. При температурах ниже –13оС белое олово превращается в α-форму (серое олово), особенно быстро этот переход происходит при температурах ниже –30оС. α-Олово представляет собой металл серого цвета, внешне похожий на свинец. Кроме цвета, две модификации олова различаются между собой по плотности и пластичности. Белое олово плотностью 7,29 г/см3 несколько тяжелее серого, плотность которого составляет 5,85 г/см3. β-Олово – мягкий и пластичный металл, он легко прокатывается в тонкую фольгу (станиоль), тогда как серое олово не обладает пластичностью и легко рассыпается в порошок.
α-Олово представляет собой металл серого цвета, внешне похожий на свинец. Кроме цвета, две модификации олова различаются между собой по плотности и пластичности. Белое олово плотностью 7,29 г/см3 несколько тяжелее серого, плотность которого составляет 5,85 г/см3. β-Олово – мягкий и пластичный металл, он легко прокатывается в тонкую фольгу (станиоль), тогда как серое олово не обладает пластичностью и легко рассыпается в порошок.
Известно немало случаев, когда изделия, выполненные из белого олова, на морозе приобретали серый цвет и разрушались. Такое явление получило название «оловянная чума». Причина разрушения состоит в резком увеличении объема металла, ведь плотность белого олова больше, чем серого, и следовательно, при равной массе α-олово будет занимать объем на 25-26% больше по сравнению с β-формой. Переход одной формы олова в другую облегчается при контакте белого олова с частицами серой формы, и он распространяется подобно «болезни». Эта «болезнь» – одна из причин гибели экспедиции Скотта к Южному полюсу в 1912 году. На обратном пути участники остались без топлива из-за того, что оно просочилось через запаянные оловом баки, пораженные «чумой».
На обратном пути участники остались без топлива из-за того, что оно просочилось через запаянные оловом баки, пораженные «чумой».
Свинец представляет собой металл грязно-серого цвета, но на свежем разрезе он имеет синеватый отлив и блестит. Однако блеск быстро пропадает, так как металл покрывается защитной пленкой оксида. Свинец – один из самых тяжелых металлов: его плотность составляет 11,34 г/см3, что примерно в полтора раза больше, чем у железа, или вчетверо больше, чем у алюминия. Недаром в русском языке слово «свинцовый» является синонимом «тяжелого». Кроме того, свинец – один из самых мягких металлов: его можно легко поцарапать ногтем или разрезать ножом.
И олово, и свинец принадлежат к группе легкоплавких металлов. Их температуры плавления равны 232оС и 327оС соответственно. Точки кипения: для олова 2270оС, для свинца 1750оС. Но еще задолго до достижения температуры кипения олово и свинец начинают испаряться. Для олова летучесть начинается примерно с 1200оС, для свинца – с 700оС. Последнее необходимо помнить тем, кто работает со свинцом при повышенных температурах, поскольку сам металл, а также его соединения токсичны. Попадая в организм, свинец накапливается в костях, вызывая в дальнейшем их разрушение.
Последнее необходимо помнить тем, кто работает со свинцом при повышенных температурах, поскольку сам металл, а также его соединения токсичны. Попадая в организм, свинец накапливается в костях, вызывая в дальнейшем их разрушение.
Электропроводность олова и свинца низкая для металлов. Если сравнить оба металла с медью, то они примерно в 10 раз хуже проводят электрический ток.
Химические свойства. Электронная конфигурация атомов олова и свинца завершается на ns2np2, где n – номер последнего (внешнего) электронного слоя. Поэтому оба металла могут проявлять валентности II или IV. Олово в одинаковой мере проявляет обе валентности, но соединения четырехвалентного олова более устойчивы. У свинца двухвалентное состояние преобладает над четырехвалентным, поэтому в большинстве соединений он проявляет валентность II. Кроме того, в атомах обоих металлов присутствуют незаполненные р – и d-орбитали, что сказывается на возможности олова и свинца к комплексообразованию.
Поскольку олово и свинец в электрохимическом ряду напряжений металлов расположены непосредственно перед водородом, их можно отнести к малоактивным металлам. Тем более что на снижении их реакционноспособности сказывается наличие оксидного слоя на поверхности металла.
Тем более что на снижении их реакционноспособности сказывается наличие оксидного слоя на поверхности металла.
При комнатной температуре олово и свинец устойчивы к воздействию большинства неметаллов и соединяются только с хлором и бромом, при этом олово проявляет валентность IV, а свинец – валентность II:
Но если подобрать определенные условия, можно получить хлорид четырехвалентного свинца (бромида и иодида свинца (IV) не существует, так как четырехвалентный свинец является сильным окислителем и он окислил бы бромид – и иодид-ионы до свободных галогенов):
Однако соединения свинца (IV) в основном нестабильны и легко превращаются в соединения двухвалентного свинца:
При повышенных температурах химическая активность металлов значительно возрастает, и они вступают в реакцию с кислородом, фтором, йодом, серой, селеном и теллуром. Кроме того, олово при нагревании взаимодействует с фосфором и азотом. И опять наблюдается различие по валентности: олово, как правило, проявляет валентность IV, тогда как свинец – II:
Лишь при реагировании с серой оба металла двухвалентны:
Существует также сульфид четырехвалентного олова SnS2, который получают косвенными методами, например, пропусканием сероводорода через подкисленные растворы солей олова (IV). Сульфида свинца (IV) не существует по той же причине, по которой никогда не образуются бромид и иодид свинца (IV).
Сульфида свинца (IV) не существует по той же причине, по которой никогда не образуются бромид и иодид свинца (IV).
С холодной или кипящей водой оба металла не взаимодействуют, зато при повышенных температурах они способны разлагать водяной пар:
Именно инертностью олова по отношению к воде и кислороду при обычных условиях объясняется использование этого металла в покрытии жестяной тары для продуктов питания. К тому же металлическое олово и продукты его коррозии относительно безвредны для человеческого организма. Некоторое время для этих целей применялся свинец, но после того, как стало известно о его токсичности, от него отказались.
Поскольку олово и свинец расположены в ряду металлов левее водорода, они способны вступать в реакцию с кислотами. При этом оба металла проявляют валентность II, исключение составляют концентрированная серная и азотная кислоты – с ними олово уже четырехвалентно. Из-за низкой химической активности металлов их растворение в кислотах происходит крайне медленно.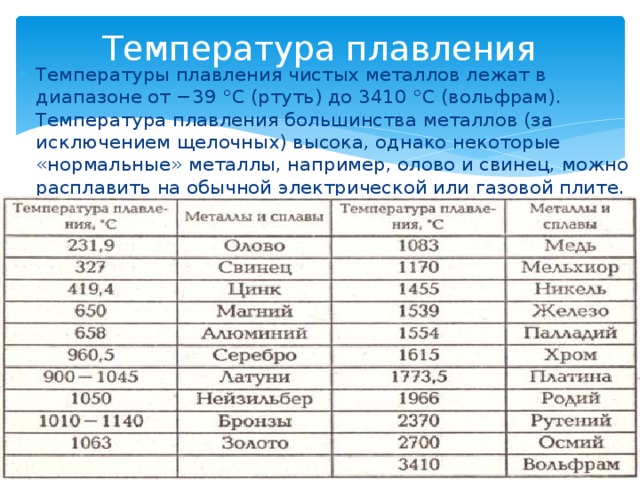 Например, разбавленные соляная и серная кислоты начинают заметно действовать на олово только при нагревании. При комнатной температуре реакция идет с очень низкой скоростью, что почти невозможно заметить пузырьки выделяющегося газа:
Например, разбавленные соляная и серная кислоты начинают заметно действовать на олово только при нагревании. При комнатной температуре реакция идет с очень низкой скоростью, что почти невозможно заметить пузырьки выделяющегося газа:
1.6.3. Олово и свинец
Олово и свинец являются p-элементами IVB группы Периодической системы. Электронная конфигурация атомов … ns2np2. В таблице 10 представлены некоторые константы, характеризующие физико-механические свойства металлов.
Олово
полиморфно. В обычных условиях устойчиво
белое олово (β-модификация), но при
охлаждении до 13,2 °С оно переходит в
серое олово (α-модификация). Белое олово
серебристо-белый металл. Электрическая
проводимость которого в 8
раз
выше ,чем у ртути. Серое олово — полупроводник
с алмазоподобной кристаллической
решеткой. Плотность α-олова невелика
(5,85 г/см3)
по сравнению с плотностью β-олова (7,29
г/см3). При переходе β-Sn
в α-Sn
удельный объём возрастает на 25,6%, в связи
с чем олово рассыпается в порошок.
При переходе β-Sn
в α-Sn
удельный объём возрастает на 25,6%, в связи
с чем олово рассыпается в порошок.
Свинец — темно-серый мягкий металл, тяжелый. С невысокой температурой плавления и типичной для металлов электрической проводимостью.
Таблица 3
Физико-механические свойства олова и свинца
Металлы | р, г/см3 | tпл °C | Tкип °C | Твердость, Мн/м2 | φ,B |
Олово | 7,29 | 231,9 | 2200 | 51,0 | -0,14 |
Свинец | 11,34 | 327,4 | 1740 | 38,3 | -ОДЗ |
Химические
свойства.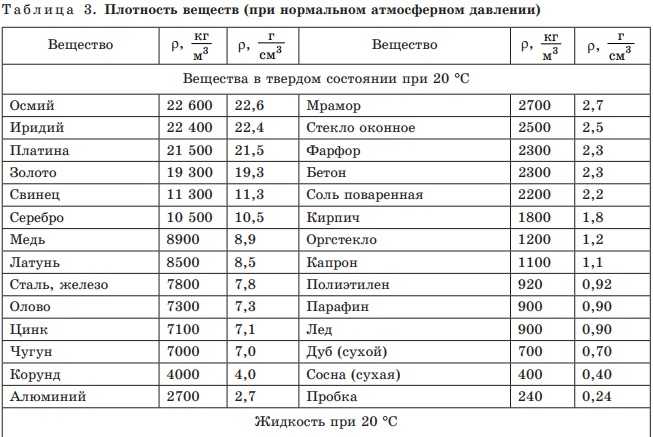 Хотя
олово проявляет степень окисления +4 в
соединениях, они менее устойчивы, чем
соединения со степенью окисления
+2. У свинца эта тенденция еще более
усиливается.
Хотя
олово проявляет степень окисления +4 в
соединениях, они менее устойчивы, чем
соединения со степенью окисления
+2. У свинца эта тенденция еще более
усиливается.
Взаимодействие с элементарными окислителями. Гидриды олова и свинца образуются или непосредствено, или косвенным путем:
SnCl2 + Zn = ZnCl2 + Sn
Свежеосажденное олово реагирует с атомарным водородом:
4НС1 +2Zn = ZnCl2 +4Н
Sn + 4Н = SnH4
Гидриды олова и свинца очень непрочны (ядовиты!).
Галиды высшей степени окисления характерны только для олова (SnF4, SnCl4), а для свинца устойчиво только соединение РЬР4. Эти соединения построены за счет ковалентнополярных связей и имеют структуру, подобную метану.
SnF4 — кристаллы, легко испаряющиеся (tпл 200 °С).
SnCl4 + ЗН2O = h3S11O3↓ + 4НС1
SnCl4 обладает окислительными свойствами и переходит в дихлорид SnCl2.
Дихлориды олова и свинца SnCl2 и РЬС12 — соли с преобладающими ионными связями. РЬС12 плохо растворим в воде. РЫ2 желтого цвета, при комнатной температуре очень трудно растворяется в воде, но при нагревании растворимость растет. При охлаждении раствора выпадают золотистые блестки РЫ2.
Оксиды олова и свинца соответствуют двум степеням окисления +2 и +4. Диоксид SnC>2 является кислотообразующим оксидом оловянной кислоты (орто- и мета-) и обладает кислотными свойствами
SnO2 + 2NaOH
+ Н2О
= Na2[Sn(OH)
Образуется
SnO2 при окислении олова при температурах
выше температуры плавления. Применяется
для приготовления белых глазурей и
эмалей.
Применяется
для приготовления белых глазурей и
эмалей.
Диоксид свинца РbO2 — соединение непрочное ми обладает сильными окислительными свойствами, переходя в РbО. Кислотные свойства РbO2 сохраняет, образуя с низшим оксидом РbО соли по типу орто- и мета- кислот.
2РbO + РbO2 = Рb2(РbO4) → Рb3O4
Сурик Рb304 сохраняет окислительные свойства, и окраска металла суриком на олифе пассивирует металл и хорошо предохраняет его от коррозии (окраска подводной части судов, трубопроводов и т.п.)
Монооксиды SnO и РЬО — амфотерны:
РЬО + 2NaOH = Na 2PbO2 + Н2O (при сплавлении)
РЬО + 2НС1 = РЬС12 + Н2O
Гидроксиды Sn и РЬ получают косвенным путем:
Sn2+ + 2ОН¯ = Sn(OH)2
Sn(OH)2 + 2NaOH = Na2[Sn(OH)4]
Sn(OH)2 +2HC1 — SnCl2 +2H2O
Сульфиды олова и свинца. Олово образует дисульфид
SnS2 желтого цвета:
Олово образует дисульфид
SnS2 желтого цвета:
H2[SnCl6] + 2H2S = SnS2 + 6НС1
SnS2 — «сусальное золото» применяется для декоративных работ (позолота дерева, мозаика и т.п.)
Моносульфид олова SnS — соль, нерастворимая в воде и разбавленных кислотах.
Свинец образует сульфид PbS — соль черного цвета, нерастворимую в воде. Разлагается только концентрированными кислотами при нагревании. Бумажка, смоченная раствором соли РЬ2+ быстро темнеет, если в воздухе присутствуют даже незначительные количества H2S .
Основные соли свинца белого цвета (свинцовые белила) постепенно переходят в PbS под действием H2S, присутствующего в малых количествах в воздухе. Этот процесс объясняет потемнение старинной живописи, так как художники в то время пользовались свинцовыми белилами.
Отношение
олова и свинца к кислотам, воде и щелочам. Олово
и свинец стоят до водорода в ряду
напряжений. Поэтому могут вытеснять
водород из растворов неокисляющих
кислот:
Олово
и свинец стоят до водорода в ряду
напряжений. Поэтому могут вытеснять
водород из растворов неокисляющих
кислот:
Sn + 2НС1 = SnCl2 + Н2
Pb + 2СН3СООН = Pb(CH3COO)2 +H2
Серной кислотой свинец пассивируется, образуя труднорастворимую соль PbSO4, которая растворяется в избытке концентрированной H2SO4, образуя кислую соль Pb(HSO4)2:
PbSO4 + H2SO4(к) = Pb(HSO4)2
С азотной кислотой олово взаимодействует по следующим реакциям:
4Sn + 10HNO3(p) = 4Sn(NO3)2 + NH4NO3 + 3 H2O
Sn + 4HNO3(K) = H2SnO3 + NO2 + H2O
Свинец растворяется, образуя нитрат свинца:
ЗРЬ + 8HNO3 = 3Pb(NO3)2 + 2 NO + 4Н2O
С
водой эти металлы не реагируют, но с
водой, содержащей растворенный
углекислый газ, свинец медленно
разрушается, образуя гидрокарбонат
РЬ(НСO
Концентрированные щелочи растворяют олово:
Sn + 2NaOH = Na2SnO2 + Н2
В растворах станниты существуют в виде гидроксокомплексов:
Na2SnO2 + 2Н2O = Na2[Sn(OH)4]
Свинец растворяется в щелочах с небольшой скоростью, более интенсивно при нагревании:
Pb + 4КОН + 2Н2O = К4[РЬ(ОН)5] + Н2
Получение и применение олова и свинца. Олово получают из природного соединения — оловянного камня SnO2 восстановлением углеродом:
SnO2 + 2С = Sn + 2СO
Свинец получают из сернистой руды PbS по следующим реакциям:
2PbS + 3O2 = 2РЬО + 2SO2
2РЪО + PbS = ЗРЬ + SO2
Олово
— химически пассивный металл, поэтому
используется для нанесения покрытий
на черные металлы (лужение). Так получают
белую жесть, потребителем которой в
основном является консервная
промышленность. Олово входит в состав
подшипниковых сплавов (баббиты),
типографских (гарт), а также бронз.
Так получают
белую жесть, потребителем которой в
основном является консервная
промышленность. Олово входит в состав
подшипниковых сплавов (баббиты),
типографских (гарт), а также бронз.
Из свинца изготавливают различные легкоплавкие сплавы (типографский сплав, припои, легкоплавкие предохранители). В чистом виде свинец идет для производства кислотостойких труб, для кабельной изоляции, для защиты от радиоактивного излучения. Свинцом покрывают металлические поверхности для защиты их от серной кислоты и других агрессивных сред. Большие количества свинца расходуются для изготовления аккумуляторных пластин.
Олово Против. Вес свинца | Наука
••• Jupiterimages/Photos.com/Getty Images
Обновлено 24 апреля 2017 г.
Автор Джон Бреннан
Вес элемента, такого как олово или свинец, зависит как от его атомного атом элемента весит — и его плотность. Чем плотнее вещество, тем больше массы оно содержит в единице объема и тем тяжелее будет данный его кусок.
Атомная масса
Свинец имеет атомный номер 82, что означает, что его ядро содержит 82 протона, а в нейтральном (не ионизированном) состоянии имеет 82 электрона. Электроны вносят незначительный вклад в массу атома, и ими можно пренебречь, когда речь идет об атомном весе. Различные изотопы свинца имеют разное количество нейтронов, поэтому атомный вес, который вы видите в таблице Менделеева, на самом деле является средневзвешенным: 207,2 атомных единицы массы (а.е.м.). Олово, напротив, имеет атомный номер 50 и, следовательно, только 50 протонов/электронов. Его атомный вес составляет 118,710 а.е.м. 923 атома этого элемента. Молярная масса — это просто атомная масса, но с единицами измерения грамм/моль, а не а.е.м. Таким образом, молярная масса олова составляет 118,710 г на моль, а молярная масса свинца — 207,2 г на моль. Опять же, моль свинца весит намного больше, чем моль олова.
Плотность
Если у вас есть два предмета одинакового размера из свинца и олова, разница в весе между этими предметами определяется плотностью.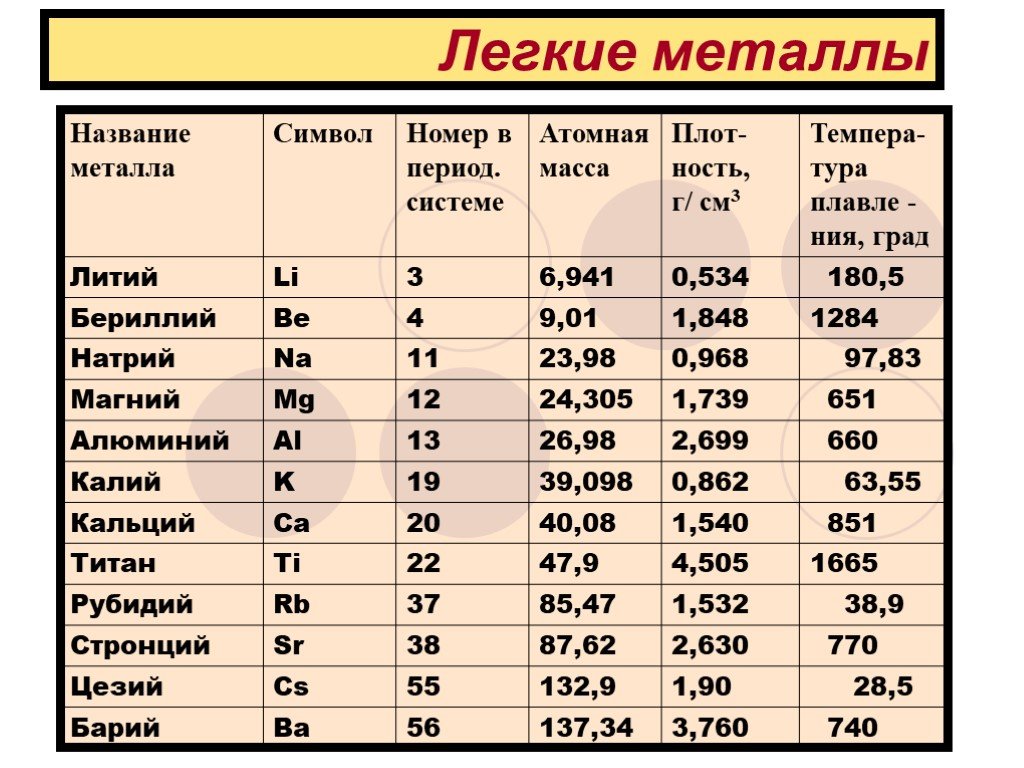 Здесь снова лидирует свинец. При комнатной температуре плотность свинца составляет 11,342 грамма на кубический сантиметр, а плотность олова — 7,287 грамма на кубический сантиметр. Следовательно, предмет из свинца весит гораздо больше, чем такой же предмет из олова.
Здесь снова лидирует свинец. При комнатной температуре плотность свинца составляет 11,342 грамма на кубический сантиметр, а плотность олова — 7,287 грамма на кубический сантиметр. Следовательно, предмет из свинца весит гораздо больше, чем такой же предмет из олова.
Соображения
Соединение, изготовленное из свинца, не обязательно весит больше, чем соединение, изготовленное из олова; вес каждого зависит от типа соединения и других атомов, которые оно содержит. Иодид олова (II), например, имеет большую молярную массу, чем диоксид свинца. Твердые предметы, сделанные из свинца и олова, тонут в воде, потому что плотность свинца и олова при комнатной температуре намного больше, чем у воды (1 грамм на кубический сантиметр).
Связанные статьи
Ссылки
- Лаборатория Джефферсона: Элементаль, Элемент Олово
- Лаборатория Джефферсона: Элементаль, Элемент Свинец
Об авторе 2006 г. Его статьи публиковались в журналах «Plenty», «San Diego Reader», «Santa Barbara Independent» и «East Bay Monthly».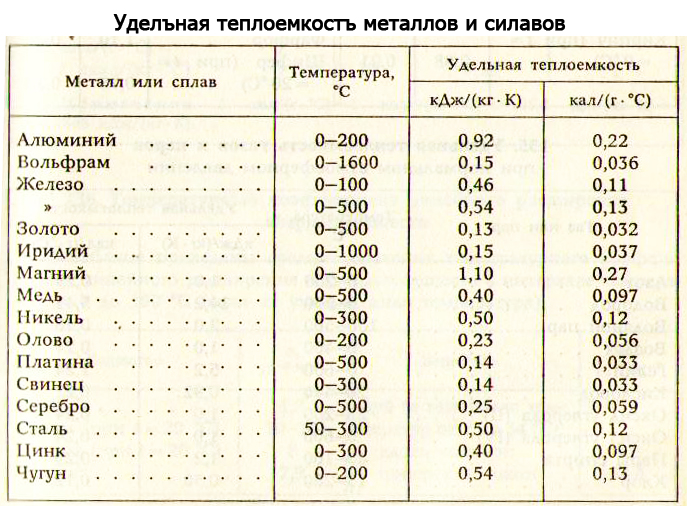 Бреннан имеет степень бакалавра биологических наук Калифорнийского университета в Сан-Диего.
Бреннан имеет степень бакалавра биологических наук Калифорнийского университета в Сан-Диего.
Photo Credits
Jupiterimages/Photos.com/Getty Images
Припои
Припои| Припой | Температура плавления, °C солидус/ликвидус | Плотность, г/см³ | Электрический Удельное сопротивление, мкОм⋅м | Термическая Проводимость, Вт/м⋅K | Растяжение Прочность на разрыв, кгс/см² | Растяжение Удлинение при разрыве, % | Твердость по Бринеллю , HB |
|---|---|---|---|---|---|---|---|
| сплавы олова (Sn) с серебром (Ag) и/или медью (Cu) | |||||||
| Sn96.5Ag3.5 | 221 / 221 | 7.37 | 0,123 | 55 | 580 | 35 | 15 |
| Sn95Ag05 | 221 / 240 | 7. 40 40 | 0,137 | — | 565 | 30 | 14 |
| Sn90Ag10 | 221 / 295 | 7.51 | — | — | — | — | — |
| Sn99.3Cu0.7 | 227 / 227 | 7.31 | 0,126 | 66 | 300 | 21 | 9 |
| Sn97Cu03 | 227 / 300 | 7.32 | 0,118 | — | — | — | — |
| Sn99.2Ag0.1Cu0.7 (SAC0107) | 217 / 228 | 7.32 | — | — | — | — | — |
| Sn99Ag0.3Cu0.7 (SAC0307) | 217 / 228 | 7.33 | — | — | 300 | 22 | 14 |
| Sn98.5Ag0.8Cu0.7 (SAC0807) | 216 / 225 | 7.33 | 0,140 | — | 310 | 21 | 16 |
Sn98.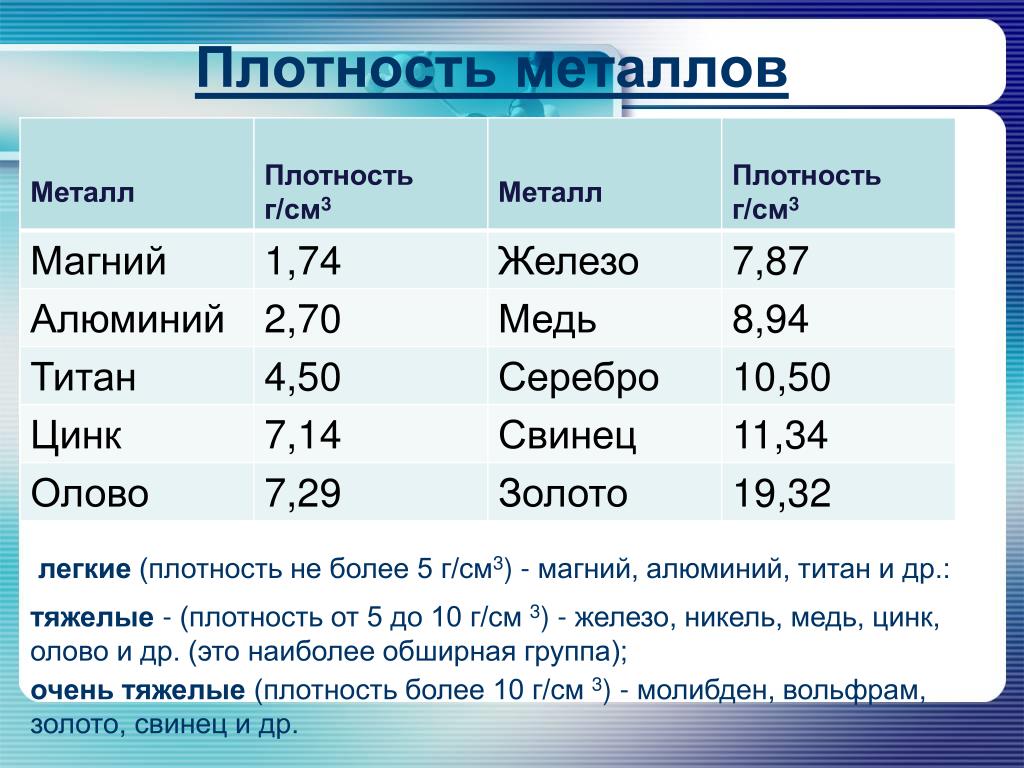 5Ag1.0Cu0.5 5Ag1.0Cu0.5 (SAC105) | 215 / 227 | 7.32 | 0,133 | 60 | 400 | 13 | 13 |
| Sn97.1Ag2.6Cu0.3 (SAC263) | 217 / 224 | 7.36 | 0,132 | — | — | — | — |
| Sn96.5Ag3.0Cu0.5 (SAC305) | 217 / 220 | 7.38 | 0,132 | 58 | 500 | 19 | 15 |
| Sn95.5Ag4.0Cu0.5 (SAC405) | 217 / 220 | 7.44 | 0,132 | 62 | 530 | 17 | 15 |
| Sn95.5Ag3.8Cu0.7 (SAC387) | 217 / 220 | 7.44 | 0,132 | 60 | 600 | 16 | 15 |
| сплавы олова (Sn) и свинца (Pb) с серебром (Ag) или без него | |||||||
| Sn90Pb10 | 183 / 213 | 7,55 | — | — | 490 | 40 | — |
| Sn63Pb37 | 183 / 183 | 8.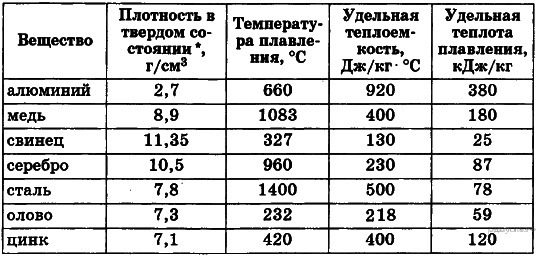 40 40 | 0,145 | 50 | 525 | 37 | 17 |
| Sn62.5Pb36.1Ag1.4 | 179 / 179 | 8.41 | 0,145 | 50 | 490 | — | 16 |
| Sn60Pb40 | 183 / 191 | 8.50 | 0,153 | 49 | 535 | 40 | 16 |
| Sn55Pb45 | 183/200 | 8,68 | — | — | — | — | — |
| Sn50Pb50 или Pb50Sn50 | 183 / 212 | 8,87 | 0,158 | 48 | 420 | 35 | 14 |
| Pb55Sn45 или Sn45Pb55 | 183 / 227 | 9.07 | 0,166 | — | — | — | — |
| Pb60Sn40 или Sn40Pb60 | 183 / 238 | 9.28 | 0,171 | 44 | 380 | 25 | 12 |
| Pb65Sn35 или Sn35Pb65 | 183 / 247 | 9.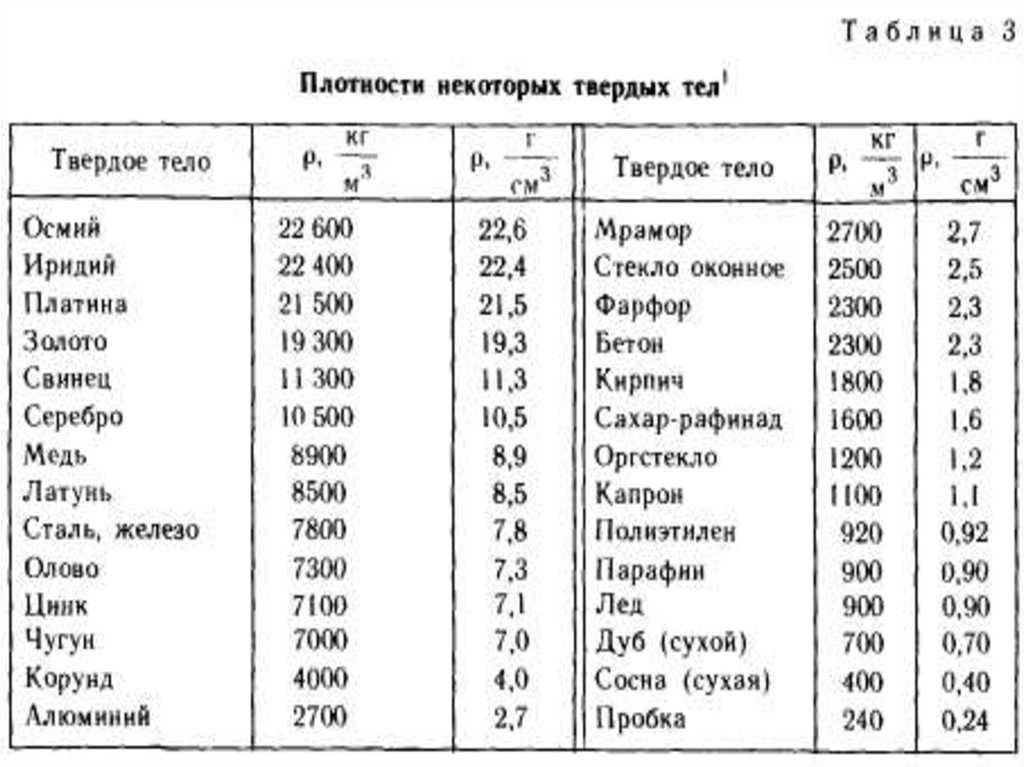 50 50 | 0,176 | — | — | — | 12 |
| Pb70Sn30 или Sn30Pb70 | 183 / 257 | 9,72 | 0,185 | 41 | 350 | 18 | 12 |
| Pb75Sn25 или Sn25Pb75 | 183 / 268 | 9,96 | 0,194 | — | 240 | 53 | 11 |
| Pb80Sn20 или Sn20Pb80 | 183 / 280 | 10.21 | 0,198 | 37 | 340 | 20 | 11 |
| Pb85Sn15 или Sn15Pb85 | 183 / 288 | 10.70 | — | — | 330 | — | 11 |
| Pb88Sn10Ag02 | 267 / 290 | 10,75 | 0,203 | 27 | 230 | 42 | — |
| Pb90Sn10 или Sn10Pb90 | 275 / 302 | 10,75 | 0,194 | 25 | 310 | 30 | 10 |
Pb92. 5Sn05Ag2.5 5Sn05Ag2.5 | 287 / 296 | 11.02 | 0,200 | — | 295 | — | — |
| Pb95Sn05 или Sn05Pb95 | 308 / 312 | 11.06 | 0,196 | 23 | 280 | 45 | 8 |
| Pb97.5Ag1.5Sn01 | 309 / 309 | 11.28 | 0,287 | 23 | 310 | 23 | 9 |
| сплавы висмута (Bi) и/или кадмия (Ca) с оловом (Sb) и/или свинцом (Pb) | |||||||
| Би58Сн42 | 138 / 138 | 8,56 | 0,383 | 19 | 565 | 55 | 23 |
| Сн60Би40 | 138 / 170 | 8.12 | 0,345 | 30 | 525 | 35 | 24 |
| Bi55.5Pb44.5 | 124 / 124 | 10.44 | 0,431 | 4 | 450 | 38 | 15 |
| Sn43Pb43Bi14 | 144 / 163 | 9. 02 02 | — | — | 450 | 41 | — |
| Sn51.2Pb30.6Cd18.2 | 145 / 145 | 8.45 | — | 35 | 440 | — | — |
| сплавы индия (In) со свинцом (Pb) и/или оловом (Sn) и/или серебром (Ag) | |||||||
| In70Pb30 | 165 / 175 | 8.19 | 0,196 | 38 | 245 | — | — |
| In60Pb40 | 173 / 181 | 8.52 | 0,246 | 29 | 290 | — | — |
| In50Pb50 или Pb50In50 | 184 / 210 | 8,86 | 0,287 | 22 | 330 | 55 | 10 |
| Pb60In40 | 197/231 | 9.30 | 0,332 | 19 | 350 | — | — |
| Pb75In25 | 240 / 260 | 9,97 | 0,375 | 18 | 385 | 48 | 10 |
| Pb81In19 | 260 / 275 | 10. 27 27 | 0,383 | 17 | 390 | — | — |
| Pb95In05 | 300 / 313 | 11.06 | 0,338 | 21 | 305 | 52 | 6 |
| Ин52Сн48 | 118 / 118 | 7.30 | 0,147 | 34 | 120 | 83 | 5 |
| In50Sn50 или Sn50In50 | 118/125 | 7.30 | 0,147 | 34 | 120 | 83 | 5 |
| Ин97Аг03 | 143 / 143 | 7.38 | 0,075 | 73 | 55 | — | 2 |
| In90Ag10 | 143 / 237 | 7,54 | 0,078 | 67 | 115 | 61 | 3 |
| In80Pb15Ag05 | 149/154 | 7,85 | 0,133 | 43 | 180 | 58 | 5 |
| Pb90In05Ag05 | 290 / 310 | 11.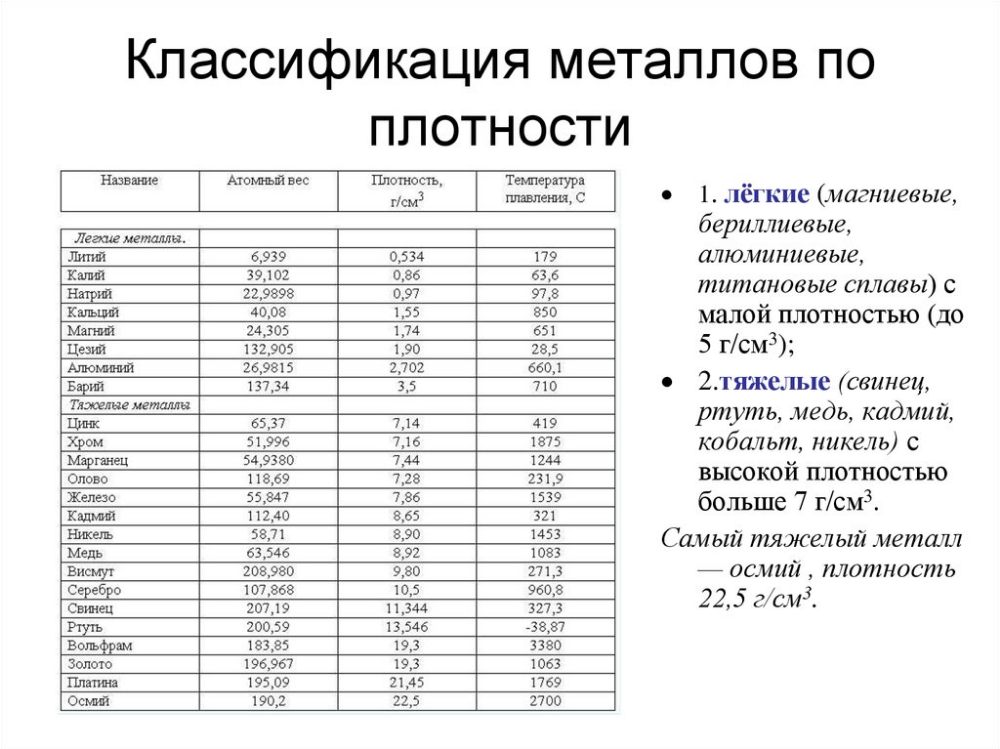 00 00 | 0,308 | 25 | 405 | 23 | 9 |
| Pb92.5In05Ag2.5 | 300 / 310 | 11.02 | 0,313 | 25 | 320 | — | — |
| Sn77.2In20Ag2.8 | 175 / 187 | 7.25 | 0,176 | 54 | 480 | 47 | 17 |
| Sn37.5Pb37.5In25 | 134 / 181 | 8.42 | 0,221 | 23 | 370 | 101 | 10 |
| Sn54Pb26In20 | 136 / 152 | 8.05 | — | — | — | — | — |
| Sn70Pb18In12 | 154 / 167 | 7,79 | 0,141 | 45 | 375 | 136 | 12 |
| низкотемпературные сплавы | |||||||
| In51.0Bi32.5Sn16.5 (сплав Филда) | 60/60 | 7,88 | 0,522 | — | 340 | — | 11 |
Bi50Pb26.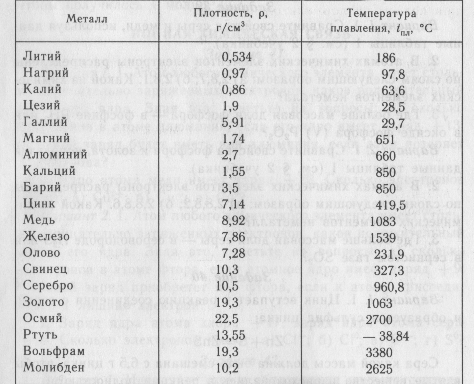 7Sn13.3Cd10 7Sn13.3Cd10 (Сплав Вуда) | 70 / 70 | 9,58 | 0,431 | 18 | 420 | 120 | 15 |
| Bi52Pb30Sn18 (сплав Ньютона) | 96 / 96 | 9.60 | 0,750 | 13 | 365 | 100 | 16 |
| Bi50Pb28Sn22 (сплав Розе) | 100/100 | 9.44 | — | — | — | — | — |
| прочие сплавы | |||||||
| Сн95Сб05 | 235 / 240 | 7.25 | 0,145 | 28 | 415 | 38 | 13 |
| Sn91Zn09 | 199 / 199 | 7.27 | 0,115 | 61 | 560 | 33 | 22 |
| Au80Sn20 | 280 / 280 | 14.51 | — | 57 | 2800 | 2 | — |
| Au88Ge12 | 356 / 356 | 14,67 | — | — | 2150 | 1 | — |
Pb97.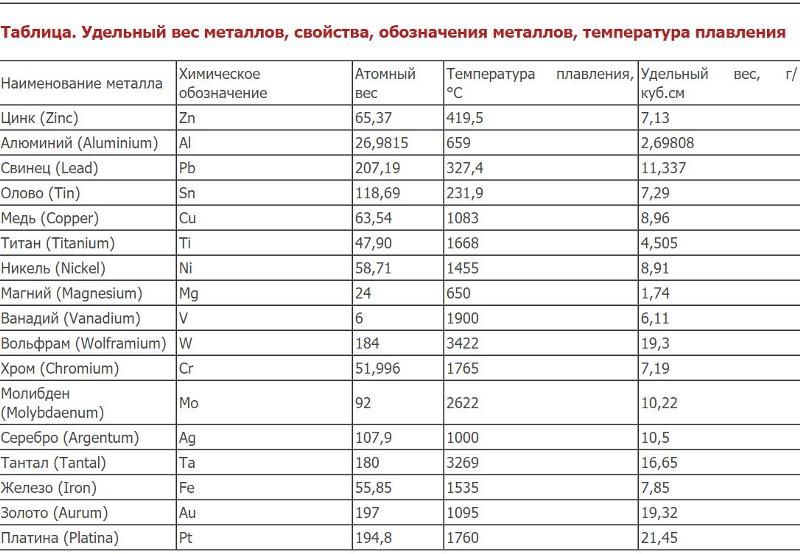 5Ag2.5 5Ag2.5 | 303 / 303 | 11.33 | 0,200 | — | 310 | 42 | — |
| Pb94.5Ag5.5 | 304 / 365 | 11.35 | 0,287 | 23 | 310 | — | — |
| Pb85Sb10Sn05 | 245 / 255 | 10.36 | 0,287 | — | 390 | 4 | — |
| чистые металлы | |||||||
| In100 (чистый индий) | 157 / 157 | 7.31 | 0,0837 | 86 | 20 | — | 1 |
| Sn100 (чистое олово) | 232 / 232 | 7.29 | 0,124 | 73 | 135 | — | 4 |
| Bi100 (висмут чистый) | 271 / 271 | 9,78 | 1,29 | 8 | — | — | 7 |
| Pb100 (чистый свинец) | 327 / 327 | 11.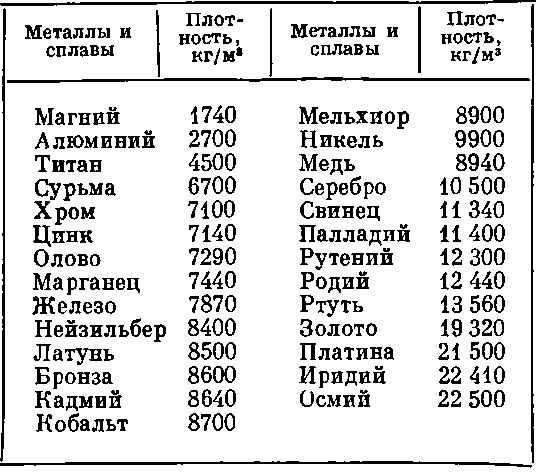 | |||||
