Способ получения катализатора для конверсии so2 в so3
Способ получения катализатора для конверсии SO2 в SO3 включает смешение растворов активных компонентов, содержащих оксиды ванадия и щелочных металлов (К, Na, Cs, Rb) с синтетическим кремнеземом с последующей термообработкой и формовкой. При этом кремнезем получают осаждением из жидкого стекла раствором серной кислоты в два этапа: на первом концентрацию диоксида кремнезема перед приливанием серной кислоты поддерживают 50-160 г/л, рН меняется от 12,5-10,5 до 4,0-8,5, на втором скачкообразно повышают концентрацию до 170-270 г/л и рН до 12,0-9,0 добавлением жидкого стекла, после чего вновь приливают серную кислоту до рН 4,0-8,5. Способ улучшает эксплуатационные характеристики катализатора — кажущуюся плотность катализатора и механическую прочность при сохранении высокой активности. 1 з. п. ф-лы, 1 табл.
Изобретение относится к каталитической химии, в частности к получению ванадиевых катализаторов конверсии SO2 в SO3.
Известен способ приготовления катализатора для окисления диоксида серы, включающий смешение активных компонентов с синтетическим кремнеземом — силикагелем, полученным в два этапа: на первом — жидкое стекло и кислоту одновременно сливают при постоянных значениях pH 5.5 — 7.0, концентрации SiO2 80 — 100 г/л и скорости осаждения. На втором этапе — после длительного выдерживания (4 часа) в полученную суспензию вводят порошкообразный силикагель при определенном соотношении и с определенной величиной удельной поверхности. Пульпу высушивают, формуют, прокаливают. Способ позволяет получить высокоактивный катализатор, уменьшить количество сточных вод. Однако катализатор обладает достаточно высокой величиной кажущейся плотности и довольно низкой прочностью. (А.с. СССР N 1785733, 1993).
Известен также способ получения катализатора путем смешения раствора активных компонентов с гидрогелем, полученным осаждением из жидкого стекла в два этапа: на первом — из разбавленного раствора жидкого натриевого стекла ( 1. 16 г/см3, т.е. 130 г/л) гидрогель осаждают раствором сульфата алюминия до pH = 8.5. На втором — через 0.5 часа перемешивания добавляют серную кислоту = 36%) до pH 1.5. Пульпу катализатора сушат, формуют и прокаливают. Способ позволяет получить высокоактивный катализатор, но насыпная плотность его весьма велика (см. табл.). Недостатком катализатора, полученного таким способом, является также довольно низкая механическая прочность. (А.С.СССР N 1616688, 1990).
16 г/см3, т.е. 130 г/л) гидрогель осаждают раствором сульфата алюминия до pH = 8.5. На втором — через 0.5 часа перемешивания добавляют серную кислоту = 36%) до pH 1.5. Пульпу катализатора сушат, формуют и прокаливают. Способ позволяет получить высокоактивный катализатор, но насыпная плотность его весьма велика (см. табл.). Недостатком катализатора, полученного таким способом, является также довольно низкая механическая прочность. (А.С.СССР N 1616688, 1990).
Цель изобретения — улучшение эксплуатационных характеристик катализатора — кажущейся плотности катализатора и механической прочности при сохранении высокой активности.
Цель достигается соблюдением ряда технологических приемов, обеспечивающих получение оптимальной структуры носителя, а именно: способ получения катализатора конверсии SO2 в SO3 включает смешение растворов активных компонентов, содержащих оксиды ванадия и щелочных металлов (К, Na, Cs, Rb) с синтетическим кремнеземом, полученным осаждением гидрокремнегеля из жидкого стекла раствором серной кислоты с последующей термообработкой и формовкой. Осаждение гидрокремнегеля проводят в два этапа: на первом этапе концентрацию диоксида кремния в пульпе поддерживают в пределах 50 — 160 г/л, при этом pH меняется от 12.5 — 10.5 до 4.0 — 8.5. На втором этапе концентрацию диоксида кремния скачкообразно повышают до 170 — 270 г/л путем добавления жидкого стекла, при этом значение pH возрастает до 12.0 — 9.0, после чего вновь приливают серную кислоту до pH 4.0 — 8.5.
Осаждение гидрокремнегеля проводят в два этапа: на первом этапе концентрацию диоксида кремния в пульпе поддерживают в пределах 50 — 160 г/л, при этом pH меняется от 12.5 — 10.5 до 4.0 — 8.5. На втором этапе концентрацию диоксида кремния скачкообразно повышают до 170 — 270 г/л путем добавления жидкого стекла, при этом значение pH возрастает до 12.0 — 9.0, после чего вновь приливают серную кислоту до pH 4.0 — 8.5.
Время приливания серной кислоты как на первом, так и на втором этапах составляет от 1 до 90 мин.
В контактном аппарате при заданной скорости газового потока реагентов для обеспечения заданной степени конверсии требуется определенное время контакта реагентов с катализатором, т.е. слой катализатора должен иметь определенную высоту, и значит не массу, а объем. Таким образом, расход загружаемого катализатора тем меньше, чем меньше его насыпная плотность, которая определяется порозностью слоя (долей пустого пространства между гранулами, т.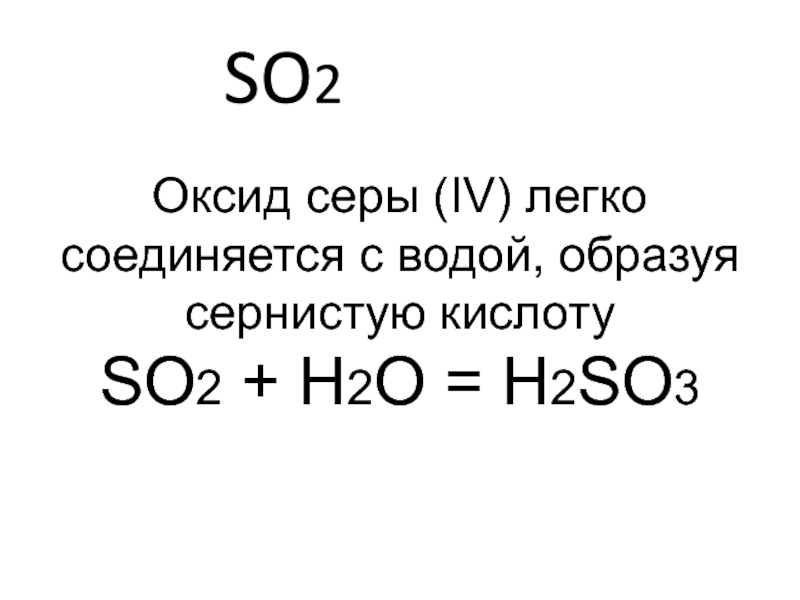 е. их формой и размером) и кажущейся плотностью собственно массы катализатора.
е. их формой и размером) и кажущейся плотностью собственно массы катализатора.
Для гранул одинаковой формы и размера расход катализатора определяется только его кажущейся плотностью, которая зависит в значительной мере от его пористости.
Очевидно, что синтез катализатора с оптимальными эксплуатационными свойствами должен обеспечить наличие в нем оптимального по размерам и объему набора пор.
Эффективный катализатор должен содержать как тонкие поры, образующие развитую внутреннюю поверхность, так и средние и крупные. Объем двух последних должен быть достаточно большим, чтобы обеспечить низкую кажущуюся плотность, но и не чрезмерным, поскольку это может привести к снижению прочности катализатора.
При разработке способа получения носителя предпочтительнее пользоваться кажущейся плотностью, а не насыпной, т.к. кажущаяся плотность учитывает свойства только материала гранулы, а насыпная, кроме того, форму и крупность гранул.
Структура носителя в значительной мере задается условиями осаждения гидрогеля. Так, если оно проводится в условиях высоких концентраций SiO2 в пульпе, то образуется единовременно много первичных глобул (зародышей), которые, не успев вырасти, сразу слипаются между собой, образуя вторичные глобулы (агрегаты), обеспечивающие в дальнейшем наличие преимущественно крупных пор. Пульпа мгновенно «схватывается», т.е. превращается в нетекучую студнеобразную массу, которая после обезвоживания легко уплотняется. Формуется такой материал при малых усилиях, крупные поры легко «зажимаются», при этом общая пористость носителя недостаточна и мал объем тонких пор. Этим, по-видимому, объясняется пониженная активность и высокая величина кажущейся плотности. Пористость носителя можно было бы повысить за счет меньшего усилия при формовке, однако это приведет к резкому падению прочности.
В прототипе сделана попытка увеличить количество тонких и средних пор в катализаторе за счет получения более тонкопористого и менее «сминаемого» при формовке носителя. Это достигается использованием двух приемов: 1) осаждением геля из разбавленных растворов жидкого стекла, что позволяет иметь много индивидуальных зародышей, не агрегирующихся между собой; 2) выдерживанием раствора (0.5 часа) перед добавлением концентрированной кислоты, позволяющим даже в разбавленных растворах значительной доле глобул вырасти до разных размеров, что впоследствии обеспечит наличие не только мелких, но и средних пор.
Это достигается использованием двух приемов: 1) осаждением геля из разбавленных растворов жидкого стекла, что позволяет иметь много индивидуальных зародышей, не агрегирующихся между собой; 2) выдерживанием раствора (0.5 часа) перед добавлением концентрированной кислоты, позволяющим даже в разбавленных растворах значительной доле глобул вырасти до разных размеров, что впоследствии обеспечит наличие не только мелких, но и средних пор.
Механизм формирования глобул поясняет сравнительный эксперимент, проведенный без указанного растягивания времени формирования глобул. Из разбавленного жидкого стекла образуется много мелких однородных по размеру неслипающихся зародышей, при этом пульпа сохраняет текучесть. После обезвоживания такого геля носитель имеет однородную тонкопористую структуру, в которой средние и крупные поры практически отсутствуют. Силикагель стекловиден, плохо сжимается, не формуется, имеет высокую кажущуюся плотность.
Таким образом, в прототипе созданы такие условия осаждения геля, которые закладывают образование мелких и средних пор, обеспечивающих активность при высокой механической прочности катализатора. Однако доля средних и крупных пор слишком мала, чтобы обеспечить низкую величину кажущейся плотности.
Однако доля средних и крупных пор слишком мала, чтобы обеспечить низкую величину кажущейся плотности.
В предлагаемом решении осаждение гидрогеля на первом этапе идет из разбавленного жидкого стекла для обеспечения большого числа индивидуальных глобул и возможности их роста. На втором этапе к пульпе добавляют концентрированное жидкое стекло, т.е. скачкообразно повышают одновременно и концентрацию двуокиси кремния, и pH среды, после чего вновь добавляют серную кислоту. Образующийся в таком режиме носитель содержит поры и тонкие, и средние, и крупные. Он хорошо формуется, но не подвержен повышенной «сминаемости». Полученный на его основе катализатор обладает высокой активностью и пониженной кажущейся плотностью при высокой прочности. Возможно, высокое качество носителя связано со скачкообразным изменением концентрации SiO2 и соответственно pH.
Используемый в предлагаемом решении режим осаждения гидрокремнегеля в известной нам литературе не описан. Поскольку процесс гелеобразования сложен и многопараметричен, то механизм его формирования в данном случае может быть представлен лишь предположительно. Вероятно, на II этапе при повышении pH и, следовательно, повышении концентрации ионов OH— степень ионизации уже сформированных индивидуальных глобул возрастает. При последующем добавлении серной кислоты так же, как и у аналога, происходит агрегация глобул, поскольку концентрация SiO2 высока. Но в отличие от аналога эти агрегаты более «рыхлые» — ионизированные глобулы в них менее плотно упакованы, и поэтому у носителя кроме крупных пор, образованных агрегатами, появляются средние и тонкие, образованные зазорами между глобулами внутри агрегатов.
Поскольку процесс гелеобразования сложен и многопараметричен, то механизм его формирования в данном случае может быть представлен лишь предположительно. Вероятно, на II этапе при повышении pH и, следовательно, повышении концентрации ионов OH— степень ионизации уже сформированных индивидуальных глобул возрастает. При последующем добавлении серной кислоты так же, как и у аналога, происходит агрегация глобул, поскольку концентрация SiO2 высока. Но в отличие от аналога эти агрегаты более «рыхлые» — ионизированные глобулы в них менее плотно упакованы, и поэтому у носителя кроме крупных пор, образованных агрегатами, появляются средние и тонкие, образованные зазорами между глобулами внутри агрегатов.
Предлагаемый способ регулирования структуры носителя более эффективен и надежен, чем у прототипа, поскольку обеспечивает больший объем крупных пор и не требует строгого соблюдения скорости слива кислоты (т.е. скорости изменения pH среды). Последнее затруднительно обеспечить во всем объеме промышленного реактора, учитывая особенности гелеобразующих структур. В предлагаемом способе структура носителя существенно не зависит от времени приливания серной кислоты в широком интервале как на I, так и на II этапе.
Последнее затруднительно обеспечить во всем объеме промышленного реактора, учитывая особенности гелеобразующих структур. В предлагаемом способе структура носителя существенно не зависит от времени приливания серной кислоты в широком интервале как на I, так и на II этапе.
Пределы параметров обоснованы следующими закономерностями. На первом этапе при концентрации диоксида кремния менее 50 г/л образуется мало зародышей, снижается объем тонких пор, что приводит к уменьшению активности катализатора (см. таблицу). Повышение концентрации диоксида кремния выше 160 г/л приводит к снижению доли индивидуальных глобул, и уже на первом этапе начинается их агрегация. В результате из-за недостаточного количества тонких пор снижается активность катализатора при 420oC.
На втором этапе — при концентрации диоксида кремния менее 170 г/л образуются структуры с недостаточным количеством крупных пор и повышенной величиной кажущейся плотности.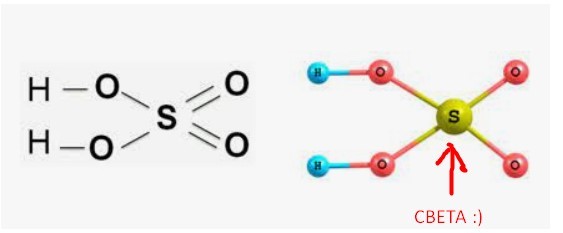 При концентрации выше 270 г/л ослабевает эффект «рыхлых» агрегатов, снижается объем тонких пор и активность при 420oC снижается.
При концентрации выше 270 г/л ослабевает эффект «рыхлых» агрегатов, снижается объем тонких пор и активность при 420oC снижается.
Начальное значение pH на первом этапе задается свойствами раствора жидкого стекла, на втором этапе — определяется концентрациями растворов, используемых на первом этапе.
Величина конечного значения pH должна быть не менее 4.0 и не более 8.5, т.к. иначе снижается скорость фильтрации гидрокремнегеля.
Время приливания серной кислоты на первом и втором этапе должно быть не менее 1 мин, т.к. иначе возникает невоспроизводимость свойств катализатора, и не более 90 мин, т.к. в противном случае начинается процесс самопроизвольного уплотнения гелевой структуры, и кажущаяся плотность катализатора возрастает.
Сравнение предлагаемого решения с прототипом показывает, что оно обладает следующими отличиями: — осаждение геля разбивается на два этапа, отличающихся концентрацией диоксида кремния, при этом второй этап осаждения ведут при повышенной концентрации диоксида кремния; — в процессе осаждения наблюдается скачок pH, влияющий на характер роста полимеров, на степень их ионизации, а следовательно, на структуру носителя. Таким образом, заявляемый способ соответствует критерию «новизна».
Таким образом, заявляемый способ соответствует критерию «новизна».
Известны способы получения катализаторов данного класса, предполагающие ведение осаждения геля при высоких концентрациях диоксида кремния, однако из них не следует возможность получения при этом катализатора с низкой кажущейся плотностью, обладающих при этом высокой активностью и прочностью. Это позволяет сделать вывод о соответствии заявляемого способа критерию «существенные отличия».
Порядок конкретной реализации способа описан в примерах, условия и свойства полученных катализаторов приведены в таблице.
Пример 1. Для приготовления носителя использовали стандартное жидкое натриевое стекло с плотностью 1.42 г/см3 и концентрацией SiO2 31.5%. К 201 мл жидкого стекла добавляли 1500 мл воды, раствор перемешивали в течение 5 мин. Концентрация SiO2 в растворе составила 50 г/л, pH среды — 10. 5. Из разбавленного жидкого стекла на первом этапе осаждали гидрокремнегель, добавляя серную кислоту с концентрацией 92.5% в течение 1 мин до получения pH 4.0. К полученной пульпе на втором этапе доливали 799 мл стандартного жидкого стекла. Концентрация SiO2 в пульпе при этом составила 270 г/л, pH среды — 12.0. Далее вновь добавляли серную кислоту в течение 1 мин до получения pH 8.5. Пульпу гидрокремнегеля отфильтровывали, осадок промывали водой из расчета 15 л на 1 кг сухого SiO2.
5. Из разбавленного жидкого стекла на первом этапе осаждали гидрокремнегель, добавляя серную кислоту с концентрацией 92.5% в течение 1 мин до получения pH 4.0. К полученной пульпе на втором этапе доливали 799 мл стандартного жидкого стекла. Концентрация SiO2 в пульпе при этом составила 270 г/л, pH среды — 12.0. Далее вновь добавляли серную кислоту в течение 1 мин до получения pH 8.5. Пульпу гидрокремнегеля отфильтровывали, осадок промывали водой из расчета 15 л на 1 кг сухого SiO2.
Для приготовления 100 г катализатора к 50 г гидрокремнегеля (в расчете на сухой SiO2) добавляли 19.3 мл серной кислоты с содержанием H2SO4 92.5%, перемешивали в течение 1 ч, затем добавляли 82 мл раствора ванадата калия с концентрацией V2O5 92.5 г/л и K2O 171 г/л и перемешивали в течение 1 ч.
Пульпу упаривали досуха, полученный порошок увлажняли и экструдировали, гранулы сушили и прокаливали при 500oC в течение 2 ч.
Катализатор имел следующий состав, мас.%: V2O5 — 7.5 K2O — 14.0 Na2О — 2.4 SiO2 — 50.0 Носитель — остальное
Пример 2. Катализатор готовили по примеру 1.
Концентрация SiO2 на первом этапе составляла 160 г/л, на втором -170 г/л; pH начальное соответственно — 12.5 и 9.0; pH конечное соответственно — 8.5 и 4.0; время приливания серной кислоты соответственно — 90 мин и 90 мин.
Пример 3. Катализатор готовили по примеру 1.
Концентрация SiO2 на первом этапе составляла 90 г/л, на втором — 190 г/л; pH начальное соответственно — 12.0 и 10.8; pH конечное соответственно — 5.7 и 6.2; время приливания серной кислоты соответственно — 5 мин и 5 мин.
Катализатор имел следующий состав, мас.%:
V2O5 — 9.5
K2O — 17. 2
2
Na2O — 3.5
SO3 — 34.9
Носитель — остальное
Пример 4. Катализатор готовили по примеру 1.
Концентрация SiO2 на первом этапе составляла 40 г/л, на втором — 200 г/л; pH начальное соответственно — 10.5 и 11,9; pH конечное соответственно — 3.8 и 8.5; время приливания серной кислоты соответственно — 5 мин и 5 мин.
Пример 5. Катализатор готовили по примеру 1.
Концентрация SiO2 на первом этапе составляла 170 г/л, на втором — 250 г/л; pH начальное соответственно — 12.1 и 11.0; pH конечное соответственно — 4.0 и 8.7; время приливания серной кислоты соответственно — 5 мин и 5 мин.
Пример 6. Катализатор готовили по примеру 1.
Концентрация SiO2 на первом этапе составляла 80 г/л, на втором — 160 г/л; pH начальное соответственно — 12.0 и 12.3; pH конечное соответственно — 8. 7 и 4.0; время приливания серной кислоты соответственно — 60 мин и 60 мин.
7 и 4.0; время приливания серной кислоты соответственно — 60 мин и 60 мин.
Пример 7. Катализатор готовили по примеру 1.
Концентрация SiO2 на первом этапе составляла 85 г/л, на втором — 280 г/л; pH начальное соответственно — 12.0 и 12.1; pH конечное соответственно — 5.7 и 3.6; время приливания серной кислоты соответственно — 5 мин и 5 мин.
Пример 8. Катализатор готовили по примеру 3.
Время приливания серной кислоты на первом этапе составляло 0.8 мин, на втором — 8 мин.
Пример 9. Катализатор готовили по примеру 3.
Время приливания серной кислоты на первом этапе составляло 28 мин, на втором — 8 мин.
Формула изобретения
1. Способ получения катализатора конверсии SO2 в SO3, включающий смешение растворов активных компонентов, содержащих оксиды ванадия и щелочных металлов (K, Na, Cs, Rb) с синтетическим кремнеземом, полученным осаждением гидрокремнегеля из жидкого стекла раствором серной кислоты при определенной концентрации диоксида кремния в пульпе, с последующей термообработкой и формовкой, отличающийся тем, что осаждение гидрокремнегеля проводят в два этапа: на первом концентрацию диоксида кремния перед приливанием серной кислоты поддерживают в пределах 50 — 160 г/л, при этом pH меняется от 12,5 — 10,5 до 4,0 — 8,5, на втором скачкообразно повышают концентрацию до 170 — 270 г/л и pH до 12,0 — 9,0 путем добавления жидкого стекла, после чего вновь приливают серную кислоту до pH 4,0 — 8,5.
2. Способ по п.1, отличающийся тем, что время приливания серной кислоты как на первом этапе, так и на втором этапе составляет 1 — 90 мин.
РИСУНКИ
Рисунок 1
QZ4A — Регистрация изменений (дополнений) лицензионного договора на использование изобретения
Лицензиар(ы): Общество с ограниченной ответственностью Научно-внедренческий центр «Катализ»
Вид лицензии*: ИЛ
Лицензиат(ы): Открытое акционерное общество «Елизаветинский опытный завод»
Характер внесенных изменений (дополнений):
Взаимное согласие
Дата и номер государственной регистрации договора, в который внесены изменения:
29.01.2001 № 11887
Извещение опубликовано: 27.08.2006 БИ: 24/2006
* ИЛ — исключительная лицензия НИЛ — неисключительная лицензия
MM4A Досрочное прекращение действия патента из-за неуплаты в установленный срок пошлины заподдержание патента в силе
Дата прекращения действия патента: 13. 05.2010
05.2010
Дата публикации: 10.12.2011
Арматура для системы СИП с отдельным неизолированным несущим проводником (СИП–1)
В разделе представлены анкерные и поддерживающие зажимы для системы СИП с неизолированным несущим нулевым проводником.
МРН – минимальная разрушающая нагрузка, кН; 1 кН = 1000 Н = 100 даН = 100 кгс
СИП с неизолированным несущим нулевым проводником также является надежной и безопасной
основой при строительстве воздушных линий электропередачи (ВЛИ). Система представляет
собой алюминиевые изолированные проводники в количестве от одного до пяти, скрученные
вокруг неизолированного несущего нулевого проводника из алюминиевого сплава АВЕ
(«альмелек») с разрывной прочностью 300 Н/мм2. Изоляция выполнена из
атмосферостойкого светостабилизированного сшитого полиэтилена высокой плотности.
Несущий проводник, который также является нейтральным проводником, несет всю механическую
нагрузку. Сечение фазных проводников может варьироваться от 16 до 150 мм
Сечение фазных проводников может варьироваться от 16 до 150 мм
Анкерные зажимы серии SO3 и SO4
При монтаже несущий проводник отрезается, проталкивается в цанговый зажим, фиксируется гайкой-барашком и загибается вниз для создания максимального трения в зажиме.
| Тип | Код EAN | Сечение несущего провода, мм2 | Диаметр несущего провода, мм | МРН, кН | Цвет | Масса, г | Кол-во в упак., шт. |
| SO3.16 | 6418677414541 | 16 | 4. 8 8 |
4.0 | — | 105 | 50 |
| SO3.25 | 6418677404597 | 25 | 5.8 | 6.6 | Оранжевый | 103 | 50 |
| SO3.35 | 6418677404603 | 35 | 6.8 | 9.3 | Красный | 103 | 50 |
| SO3.50 | 6418677404627 | 50 | 8.0 | 13.2 | 103 | 50 | |
SO4. 70 70 |
6418677404733 | 70 | 9.6 | 18.6 | Белый | 237 | 50 |
| SO4.95 | 6418677404740 | 95 | 11.3 | 18.6 | Черный | 237 | 50 |
Анкерные зажимы SO28 и SO141
Несущий провод при монтаже не нужно обрезать, он помещается в канавку зажима и фиксируется болтом или двумя болтами.
| Тип | Код EAN | Сечение проводов, мм2 | Диаметр провода, мм | МРН, кН | Масса, г | Количество в упаковке, шт. |
| SO28 | 6418677404580 | 25–50 | 5.8–8.0 | 13.2 (50 мм2) | 247 | 50 |
| SO141 | 6418677404405 | 16–95 | 4.9–11.3 | 25.1 (95 мм2) | 25 |
Анкерный зажим SN2.2
Используется для анкерного крепления несущего проводника.
| Тип | Код EAN | Сечение проводов, мм2 | Диаметр провода, мм | МРН, кН | Масса, г | Количество в упаковке, шт. |
| SN2.2 | 6418677404009 | 16–50 | 4.4–8.3 | 13.2 (50 мм2) | 96 | 100 |
Анкерный зажим SO65
Несущий провод при монтаже не нужно обрезать, он помещается в канавку зажима и фиксируется тремя болтами.
| Тип | Код EAN | Сечение проводов, мм2 | Диаметр провода, мм | МРН, кН | Масса, г | Количество в упаковке, шт. |
| SO65 | 6418677404832 | 16–70 | 4.9–9.8 | 18. 6 (70 мм2) 6 (70 мм2) |
230 | 50 |
Поддерживающий зажим SO214
Применяется для крепления несущего проводника СИП на промежуточных и угловых
опорах при углах поворота трассы до 90
| Тип | Код EAN | Сечение проводов, мм2 | Диаметр провода, мм | МРН, кН | Масса, г | Количество в упаковке, шт. |
| SO214 | 6418677410666 | 16–95 | 5.8–13 | 25 | 250 | 50 |
Версия для печати
© ВЛ Комплект, 2023
Черный список
so3
so3 —
Имена и идентификаторы| Name | sulfur trioxide |
| Synonyms | SO3 Sulfan sulfuricoxide Sulfuric oxide sulfur trioxide SULFUR TRIOXIDE SULPHUR TRIOXIDE SULFURIC ANHYDRIDE Sulfur oxide (SO3) Oxosulfane dioxide Sulfur(VI) триоксид Сульфурацидангидрид sulfurtrioxide,stabilized Sulfur trioxide, stabilized |
| CAS | 7446-11-9 |
| EINECS | 231-197-3 |
| InChI | InChI=1/O3S/c1- 4(2)3 |
so3 —
Физико-химические свойства| Молекулярная формула | O3S | |
| Молярная масса | 80,06 | |
| Плотность | 1,97 г/мл. | Реагирует насильственно |
| Парсии для пара | 280 мм рт.0010 | 13,9069 |
| Условия хранения | В помещении | |
| Стабильность | Стабильность. Несовместим с органическими материалами, тонкоизмельченными металлами, основаниями, водой, цианидами и многими другими химическими веществами. Реагирует бурно с водой, кислородом и другими химическими веществами — читать полностью | |
| Физические и химические свойства | Бесцветная прозрачная маслянистая жидкость с сильным раздражающим запахом. температура плавления 16,83 ℃ boiling point 44.8 ℃ relative density 1.97(20 ℃) | |
| Use | For organic synthesis, production of chlorosulfonic acid and sulfuric acid |
so3 —
Risk and Safety| Коды риска | R45 — Может вызывать рак R8 — Контакт с горючим материалом может вызвать пожар R14 — Бурно реагирует с водой R26 — Очень токсичен при вдыхании R34 — Вызывает ожоги R37 — Раздражает дыхательную систему R35 — Вызывает сильные ожоги |
| Описание безопасности | S53 — Избегайте воздействия — перед использованием получите специальные инструкции. S17 — Хранить вдали от горючих материалов. S26 — При попадании в глаза немедленно промыть большим количеством воды и обратиться к врачу. S36/37/39 — Носите подходящую защитную одежду, перчатки и средства защиты глаз/лица. S45 — В случае несчастного случая или при плохом самочувствии немедленно обратитесь к врачу (по возможности покажите этикетку). S8 — Держите контейнер сухим. S25 — Избегайте попадания в глаза. S30 — Никогда не добавляйте воду в этот продукт. |
| UN IDs | UN 1829 8/PG 1 |
| WGK Germany | 1 |
| RTECS | WT4830000 |
| Hazard Class | 8 |
| I |
so3 —
Upstream Downstream Industry| Сырье | Диоксид серы Серная (α) Серная кислота кислород |
SO3 —
Nature. Транспара, транспара, жидкость с сильным угрюмым. Относительная плотность 1,97 (20 ℃). Температура плавления 16,83°С. Точка кипения (101,3 кПа) 44,8 град С. Сильный окислитель, может быть восстановлением серы, фосфора, углерода. Эффект обезвоживания серной кислоты и дымящейся серной кислоты сильнее. Коррозия золотой пыли, чем серная кислота, дымящаяся серная кислота слабее.
Транспара, транспара, жидкость с сильным угрюмым. Относительная плотность 1,97 (20 ℃). Температура плавления 16,83°С. Точка кипения (101,3 кПа) 44,8 град С. Сильный окислитель, может быть восстановлением серы, фосфора, углерода. Эффект обезвоживания серной кислоты и дымящейся серной кислоты сильнее. Коррозия золотой пыли, чем серная кислота, дымящаяся серная кислота слабее.
Последнее обновление:2022-01-01 11:03:49
so3 —
Метод приготовленияМетод дымления серной кислотой: сера (или пирит или другие серосодержащие вещества) и сухой воздух сжигаются в печи для сжигания серы для получения газообразного диоксида серы высокой концентрации, а триоксид серы получают путем каталитического окисления, дымящую серную кислоту получают путем абсорбции серной кислотой, а затем газообразный триоксид серы получают путем перегонки. После охлаждения и компрессионного сжижения получают жидкий триоксид серы.
Последнее обновление:2022-01-01 11:03:51
so3 —
Использование В основном используется для сульфирования и сульфатирования органических соединений. Он широко используется в качестве реагента в производстве поверхностно-активных веществ и ионообменных смол. Он также используется в синтезе сульфаниламидов. Для производства промежуточных красителей, фракций рафинированных масел и смазок.
Он широко используется в качестве реагента в производстве поверхностно-активных веществ и ионообменных смол. Он также используется в синтезе сульфаниламидов. Для производства промежуточных красителей, фракций рафинированных масел и смазок.
Последнее обновление:2022-01-01 11:03:50
so3 —
Безопасность см. техническая серная кислота, жидкий диоксид серы. Предельно допустимая концентрация трехокиси серы в воздухе составляет 1 мг/м3. Код риска: продукты кислотной коррозии. GB8.1 класс 810100 ООН N0.1829; Кодовая страница IMDG 8233. Класс B1. Стабильная технология транспортировки жидкого триоксида серы и высокая концентрация дымящейся серной кислоты одинаковы, чтобы избежать попадания воды для предотвращения полимеризации. При производстве, хранении и обращении должны быть полностью герметичны. Выхлопная труба резервуара-накопителя, загрузочного резервуара и другого оборудования должна быть пропущена через кислотную промывочную колонну, чтобы предотвратить проникновение атмосферной влаги и перелив триоксида серы. Для коагуляции
Для коагуляции
Жидкий триоксид серы с температурой 16,8°С должен поддерживаться при температуре 30°С на стадии обработки, в резервуаре для хранения готовой продукции и в резервуаре для наливных грузов. Хранение в бочках разрешено только для растений, допускающих пролечку. Емкость с жидким триоксидом серы нельзя промывать водой, необходимо использовать концентрированную серную кислоту для растворения твердых отложений триоксида серы. Когда есть пожар, огонь можно потушить с помощью углекислого газа. Также можно удалить песок, кварцевый песок и соду. Пожарные должны носить противогазы и необходимые средства защиты.
Последнее обновление: 2022-01-01 11:03:52
SO3-
Справочная информация| NIST Chemical Information | Информация, предоставленная: WebBook.nist.gov (внешняя ссылка) | |
| EPA информация о химическом веществе | информация предоставлена: ofmpeb.epa.gov (внешняя ссылка) | |
| триоксид серы реагирует с водой | подобно диоксиду серы, триоксид серы также является кислотным оксидом со свойствами кислотных оксидов, он реагирует с водой с образованием серной кислоты, поэтому мы также называем его «ангидридом серы». Наиболее важным свойством триоксида серы является его реакция с водой, поскольку он реагирует с водой с образованием серной кислоты, что является одной из стадий промышленного получения серной кислоты. SO3 h3O = = h3SO4 в реакции с водой, выделяя при этом много тепла и даже заставляя воду кипеть, поэтому обычно не используют воду для поглощения триоксида серы, а с 98.3 концентрированной серной кислоты для поглощения триоксида серы. Небольшое количество воды в концентрированной серной кислоте может продолжать поглощать триоксид серы. Наиболее важным свойством триоксида серы является его реакция с водой, поскольку он реагирует с водой с образованием серной кислоты, что является одной из стадий промышленного получения серной кислоты. SO3 h3O = = h3SO4 в реакции с водой, выделяя при этом много тепла и даже заставляя воду кипеть, поэтому обычно не используют воду для поглощения триоксида серы, а с 98.3 концентрированной серной кислоты для поглощения триоксида серы. Небольшое количество воды в концентрированной серной кислоте может продолжать поглощать триоксид серы. | |
| молекулярная структура | триоксид серы — мономер в газообразном состоянии, форма молекулы — плоский треугольник, атом серы центрирован, валентный угол 120°, длина связи S-O 1,43×10-10м , для которого, очевидно, характерна двойная связь (длина одинарной связи S-O около 1,55·10-10м), в которой атом серы находится в sp2-гибридном состоянии. В жидком состоянии мономер и тример (SO3)3 находятся в равновесии: чем выше температура, тем меньше тримера. Твердый триоксид серы в основном существует в двух формах: одна представляет собой волокнистую (SO3)n, а другая представляет собой льдоподобную структуру тримера (SO3)3. Твердый триоксид серы в основном существует в двух формах: одна представляет собой волокнистую (SO3)n, а другая представляет собой льдоподобную структуру тримера (SO3)3. | |
| Состояние при нормальной температуре и давлении | триоксид серы, также известный как серный ангидрид, высоковалентный оксид серы, один из продуктов производства серной кислоты. Это бесцветная жидкость с температурой кипения 44,8°С. При нормальном давлении и комнатной температуре. Сильное задымление атмосферы, образование трудноосаждаемого сернокислотного тумана. С водой происходит необычно интенсивная реакция с образованием серной кислоты, сопровождающаяся кислотным туманом, с выделением большого количества тепла. Триоксид серы растворяли в 100% серной кислоте для получения фумаровой кислоты. Твердый триоксид серы имеет три формы с температурами плавления 16,86 ℃, 30,4 ℃ и 62,2 ℃ соответственно. Два последних представляют собой высокомолекулярные полимеры триоксида серы, а первый представляет собой смесь мономолекул и тримеров. Полимеризации жидкого триоксида серы можно способствовать, снижая температуру в присутствии следов воды или серной кислоты. При плавлении полимеризованного триоксида серы может произойти взрыв, поскольку перед плавлением создается более высокое давление паров. Полимеризации жидкого триоксида серы можно способствовать, снижая температуру в присутствии следов воды или серной кислоты. При плавлении полимеризованного триоксида серы может произойти взрыв, поскольку перед плавлением создается более высокое давление паров. | |
| токсичность | см. Кислота серная техническая, сернистый газ жидкий. Предельно допустимая концентрация триоксида серы в воздухе составляет 1 мг/м3. | |
| Заявка | для серной кислоты, хлорсульфоновой кислоты, сульфаминовой кислоты, диметилсульфата, детергента и используемого в качестве сульфирующего агента в органическом синтезе в основном используется при сульфировании и сульфатировании органических соединений. Он широко используется в качестве реагента в производстве поверхностно-активных веществ и ионообменных смол. Он также используется в синтезе сульфаниламидов. Для производства промежуточных красителей, фракций рафинированных масел и смазок. для органического синтеза, получения хлорсульфокислоты и серной кислоты | |
| способ производства | метод дымления серной кислоты сжигание серы (или пирита или других серосодержащих веществ) с сухим воздухом в установке для сжигания серы, диоксид серы высокой концентрации образуется газ, а при каталитическом окислении образуется триоксид серы. Дымящую серную кислоту получают путем абсорбции серной кислотой, а газообразный трехокись серы получают путем перегонки. S2 2O2 → 2SO22SO2 O2 → 2SO3 Дымящую серную кислоту получают путем абсорбции серной кислотой, а газообразный трехокись серы получают путем перегонки. S2 2O2 → 2SO22SO2 O2 → 2SO3 | |
| категория | коррозионное вещество | |
| степень токсичности | отравление | |
| Острая токсичность | вдыхание-0 человек TCL0; Вдыхание морской свинки LC50: 50 мг/м3 | |
| характеристики взрывоопасности | высокая температура взрыва в воде | |
| характеристики опасности воспламеняемости | воспламеняемость в случае органических | |
| особенности хранения и транспортировки | Склад проветриваемый и осушенный при пониженной температуре, раздельное хранение горючих материалов | |
| огнетушащее вещество | песок сухой, двуокись углерода | |
| СООТ0; Тел. 2 мг/м3 | ||
| данные о токсичных веществах | информация предоставлена: pubchem. ncbi.nlm.nih.gov (внешняя ссылка) ncbi.nlm.nih.gov (внешняя ссылка) |
Последнее обновление: 2022-12-14 21:24:49
ICSC 1202 — ТРИОКСИД СЕРЫ
ICSC 1202 — ТРИОКСИД СЕРЫ« вернуться к списку результатов поиска
Китайский — ZHАнглийский — ENФинский — FIFФранцузский — FRНемецкий — DEИврит — HEВенгерский — HUIИтальянский — ITЯпонский — JAKКорейский — KOPперсидский — FAПольский — PLПортугальский — PTРусский — RUSиспанский — ES
| ТРИОКСИД СЕРЫ | ICSC: 1202 (октябрь 2002 г.) |
| Серный (кислотный) ангидрид Серный оксид | |
| Номер CAS: 7446-11-9 |
| № ООН: 1829 |
| Номер ЕС: 231-197-3 |
| ОСТРЫЕ ОПАСНОСТИ | ПРЕДУПРЕЖДЕНИЕ | ПОЖАРОТУШЕНИЕ | |
|---|---|---|---|
| ПОЖАР И ВЗРЫВ | Не горючий. Нагрев приведет к повышению давления с риском разрыва. При пожаре выделяет раздражающие или токсичные пары (или газы). Опасность возгорания и взрыва при контакте с основаниями, горючими веществами, восстановителями или водой. Нагрев приведет к повышению давления с риском разрыва. При пожаре выделяет раздражающие или токсичные пары (или газы). Опасность возгорания и взрыва при контакте с основаниями, горючими веществами, восстановителями или водой. | НЕ допускать контакта с основаниями, горючими веществами, восстановителями или водой. | НЕТ водосодержащих агентов. Нет воды. В случае возгорания поблизости используйте соответствующие средства пожаротушения. В случае пожара: охлаждайте бочки и т. д., обрызгивая их водой. НЕТ прямого контакта с водой. |
| ПРЕДОТВРАТИТЬ ОБРАЗОВАНИЕ ТУМАНА! ИЗБЕГАЙТЕ ВСЕХ КОНТАКТОВ! ВО ВСЕХ СЛУЧАЯХ ОБРАЩАЙТЕСЬ К ВРАЧУ! | |||
|---|---|---|---|
| СИМПТОМЫ | ПРЕДУПРЕЖДЕНИЕ | ПЕРВАЯ ПОМОЩЬ | |
| Вдыхание | Ощущение жжения. Кашель. Затрудненное дыхание. Больное горло. Свистящее дыхание. Одышка. Одышка. | Используйте вентиляцию, местную вытяжку или защиту органов дыхания. | Свежий воздух, отдых. Полупрямое положение. Обратитесь за медицинской помощью. |
| Кожа | Покраснение. Серьезные ожоги кожи. Боль. волдыри. | Защитные перчатки. Защитная одежда. | Снять загрязненную одежду. Промойте кожу большим количеством воды или примите душ. Обратитесь за медицинской помощью. |
| Глаза | Покраснение. Боль. Затуманенное зрение. Тяжелые глубокие ожоги. | Носите защитную маску или защиту для глаз в сочетании с защитой органов дыхания. | Сначала промыть большим количеством воды в течение нескольких минут (снять контактные линзы, если это возможно), затем обратиться за медицинской помощью. |
| Проглатывание | Боль в животе. Обжигающее ощущение. Тошнота. Шок или коллапс. | Не есть, не пить и не курить во время работы. | Обратитесь за медицинской помощью. Прополоскать рот. Не вызывает рвоту. Дайте выпить один или два стакана воды. |
| ЛИКВИДАЦИЯ УТЕЧЕК | КЛАССИФИКАЦИЯ И МАРКИРОВКА |
|---|---|
| Эвакуировать опасную зону! Проконсультируйтесь со специалистом! Индивидуальная защита: костюм химзащиты, включая автономный дыхательный аппарат. Вентиляция. НИКОГДА не направляйте струю воды на жидкость. НЕ допускайте попадания этого химического вещества в окружающую среду. НЕ поглощать опилками или другими горючими абсорбентами. Абсорбируйте оставшуюся жидкость сухим песком или инертным абсорбентом. Затем храните и утилизируйте в соответствии с местным законодательством. | В соответствии с критериями СГС ООН Транспорт |
| ХРАНЕНИЕ | |
Хранить только в стабилизированном состоянии. Отдельно от пищевых продуктов и кормов и несовместимых материалов. См. Химическая опасность. Сухой. Хранить при температуре от 17°C до 25°C. Отдельно от пищевых продуктов и кормов и несовместимых материалов. См. Химическая опасность. Сухой. Хранить при температуре от 17°C до 25°C. | |
| УПАКОВКА | |
| Не перевозить вместе с пищевыми продуктами и кормами. Герметичный. |
| ТРИОКСИД СЕРЫ | КМГС: 1202 |
| ФИЗИЧЕСКАЯ И ХИМИЧЕСКАЯ ИНФОРМАЦИЯ | |
|---|---|
Физическое состояние; Внешний вид Физические опасности Химическая опасность | Формула: SO 3 |
| ВОЗДЕЙСТВИЕ И ВЛИЯНИЕ НА ЗДОРОВЬЕ | |
|---|---|
Пути воздействия Последствия кратковременного воздействия | Опасность при вдыхании Последствия длительного или многократного воздействия |
| ПРЕДЕЛЫ ВОЗДЕЙСТВИЯ НА РАБОЧЕМ МЕСТЕ |
|---|
| ОКРУЖАЮЩАЯ СРЕДА |
|---|
Вещество вредно для водных организмов. |
| ПРИМЕЧАНИЯ |
|---|
| НИКОГДА не заливайте это вещество водой; при растворении или разбавлении всегда медленно добавляйте его в воду. Когда альфа-форма плавится, она принимает гамма-форму, и давление паров резко возрастает с опасностью взрыва. Температура плавления составляет 62, 33 и 17°C для альфа-, бета- и гамма-форм. Давление пара составляет 9,7, 45,9 и 57,7 кПа при 25°C для альфа-, бета- и гамма-форм. |
| ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ |
|---|
| Классификация ЕС |
Все права защищены. Опубликованный материал распространяется без каких-либо явных или подразумеваемых гарантий.
Ни МОТ, ни ВОЗ, ни Европейская комиссия не несут ответственности за интерпретацию и использование информации, содержащейся в этом материале. |

 Это создает опасность пожара и взрыва. Интенсивно Реагирует с водой и влажным воздухом. Получается серная кислота. Раствор в воде — сильная кислота. Он бурно реагирует с основаниями и вызывает коррозию металлов. При этом выделяется легковоспламеняющийся/взрывоопасный газ (водород — см. ICSC 0001).
Это создает опасность пожара и взрыва. Интенсивно Реагирует с водой и влажным воздухом. Получается серная кислота. Раствор в воде — сильная кислота. Он бурно реагирует с основаниями и вызывает коррозию металлов. При этом выделяется легковоспламеняющийся/взрывоопасный газ (водород — см. ICSC 0001).