Сухой гидроксид алюминия | Полезное
Гидроксид алюминия – соединение Al(OH)3 на основе оксида алюминия и воды, получаемое в виде белого вещества, обладающего амфотерными свойствами и плохо растворимого в воде. Свежеосажденный гидроксид способен взаимодействовать с кислотами и щелочами, в результате чего происходит образование ортоалюминатов – солей ортоалюминиевой кислоты H3AlO3 или метаалюминатов – солей метаалюминиевой кислоты HAlO2.
Сухой гидроксид алюминия имеет вид белого кристаллического вещества, нерастворимого в щелочах и кислотах.
Свойства и применение сухого гидроксида алюминия
Гидрооксид алюминия благодаря способности адсорбировать различные вещества используется в процессах очистки воды, в медицине как адъювант для изготовления вакцин, также служит антацидным средством. Соединение применяется как антипирен в составе пластиков и многих других материалов, поглощает тепло, подавляет горение, адсорбирует горючие газы, исключает нагрев и дальнейшее разложение полимеров, снижает горючесть материалов.
В промышленности сухой гидроксид алюминия служит минеральным наполнителем в процессах производства пластических масс, используется как мелкодисперсный наполнитель для изготовления лакокрасочных материалов, заменитель пигментов, ускоритель затвердевания и схватывания в составе сухих и растворных смесей, применяемых в строительстве. После прохождения термохимической активации гидроксид применяется в виде носителя – структурообразующего элемента для производства катализаторов гидроочистки, риформинга, а также осушителей и сорбентов.
Сухой гидроксид алюминия используется как наполнитель в производстве огнеупоров, абразивов, герметиков, клеев, шлифовальных паст. Соединение находит применение в стекольной, резиновой, химической промышленности, производстве износостойкой, технической, электротехнической керамики, обладающей специальными свойствами.
Получение сухого гидроксида алюминия
Наиболее распространенным в современной промышленности способом получения гидроксида алюминия является метод Байера, который относится к гидрохимическим щелочным процессам и заключается в гидролизе алюминатных растворов с образованием гидроксида алюминия в форме кристаллического осадка.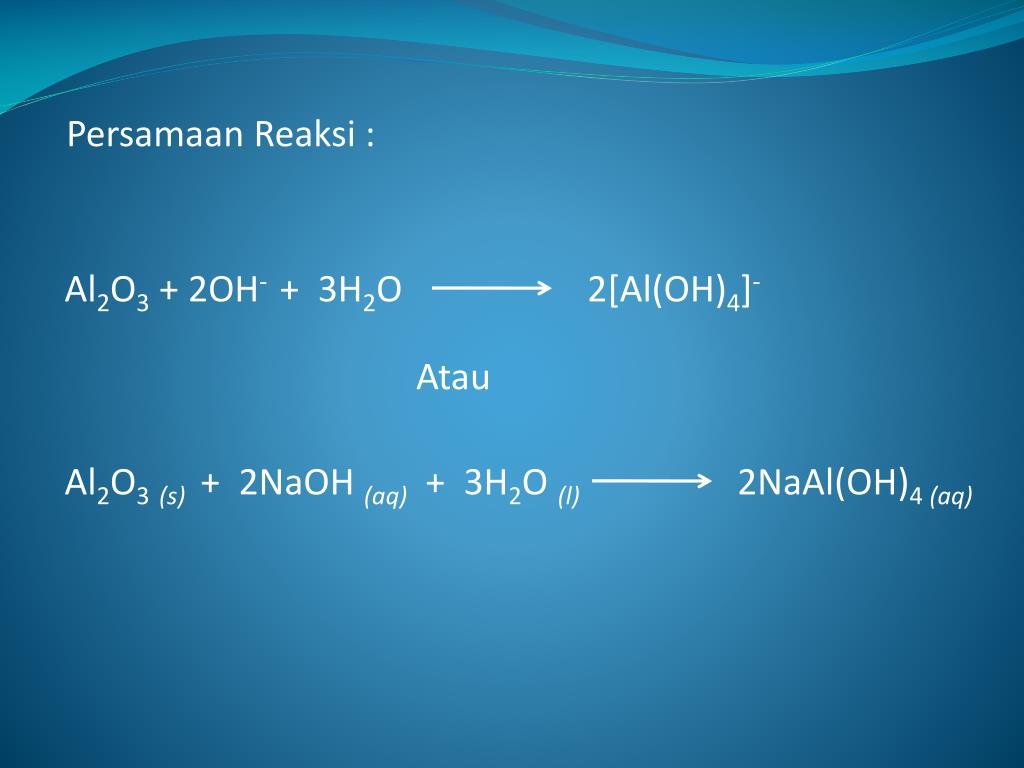 Сухой гидроксид алюминия производят путем фильтрации, промывания и выпаривания полученного осадка до получения вещества в сухом виде.
Сухой гидроксид алюминия производят путем фильтрации, промывания и выпаривания полученного осадка до получения вещества в сухом виде.
Использование различных типов гидроксидов алюминия, специальных технологий термообработки, высушивания, измельчения, размалывания, просеивания и прокаливания позволяет получать широкий ассортимент специализированных материалов с необходимыми свойствами.
Компания «Микроинтек» обладает современными технологическими линиями для разработки и производства необходимых объемов сухого гидроксида алюминия, отвечающего индивидуальным потребностям определенного производства по всем важнейшим физико-химическим характеристикам.
Гидроксид алюминия Al(OH)3 в Первомайском (Гидроксид алюминия)
- Россия
- Первомайское org/ListItem»> Минералы: галогениды, оксиды и гидроксиды
- Гидроксид алюминия Гидроксид алюминия Al(OH)3 в Первомайском Автономной Республики Крым
за 1 ед.
Компания Соловьев (Оценка в Крыму), ЧП (Первомайское) является зарегистрированным поставщиком на сайте BizOrg.su. Вы можете приобрести товар Гидроксид алюминия Al(OH)3, расчеты производятся в ₽. Если у вас возникли проблемы при заказе товара, пожалуйста, сообщите об этом нам через форму обратной связи.
Описание товара
Гидроксид алюминия Al(OH)3
Гидроксид алюминия Al(OH)3 — бесцветное твердое вещество, нерастворимое в воде, входит в состав многих бокситов, с содержанием до 99. 5%.
5%.
Гидроксид алюминия Al(OH)3 — бесцветное твердое вещество, нерастворимое в воде, входит в состав многих бокситов. Существует в четырех полиморфных модификациях. На холоде образуется α-Al(OH)3 — байерит, а при осаждении из горячего раствора γ-Al(OH)3 — гиббсит (гидаргилит), обе кристаллизуются в моноклинной сингонии, имеют слоистое строение, слои состоят из октаэдров [Al(OH)6], между слоями действует водородная связь. Существует также триклинный гиббсит γ’-Al(OH)3, триклинный нордстрандит β-Al(OH)3 и две модификации оксогидроксида AlOOH — орторомбические бемит и диаспор. Аморфный гидроксид алюминия имеет переменный состав Al2O3 · nh3O. При нагревании выше 180°С разлагается.
Гидроксид алюминия — типичное амфотерное соединение, свежеполученный гидроксид растворяется в кислотах и щелочах:
2Al(OH)3 + 6HCl = 2AlCl3 + 6h3O
Al(OH)3 + NaOH + 2h3O = Na[Al(h3O)2(OH)4].
При нагревании разлагается, процесс дегидратации довольно сложен и схематично может быть представлен следующим образом:
Al(OH)3 = AlOOH + h3O;
2AlOOH = Al2O3 + h3O.

Получение
Образуется при действии водного раствора аммиака на растворы солей алюминия:
растворы щелочей не применяются, поскольку образующийся гидроксид алюминия в них хорошо растворяется.
Кристаллический гидроксид алюминия образуется при пропускании углекислого газа через щелочной раствор тетрагидроксодиакваалюмината натрия:
2Na[Al(h3O)2(OH)4] + 2СО2 = 2Al(OH)3 + 2NaHCO3 + 4h3O.
Товары, похожие на Гидроксид алюминия Al(OH)3
Вы можете оформить заказ на «Гидроксид алюминия Al(OH)3» в организации «Соловьев (Оценка в Крыму), ЧП» через наш каталог БизОрг. Сейчас предложение находится в статусе «в наличии».
Почему «Соловьев (Оценка в Крыму), ЧП»
специальное предложение по цене для пользователей торговой площадки БизОрг;
своевременное выполнение взятых обязательств;
разнообразные методы оплаты.
Оставьте заявку прямо сейчас!
FAQ
- Как оставить заявку?Чтобы оставить заявку на «Гидроксид алюминия Al(OH)3» свяжитесь с фирмой «Соловьев (Оценка в Крыму), ЧП» по контактным данным, которые указаны в правом верхнем углу.
 Обязательно укажите, что нашли организацию на торговой площадке БизОрг.
Обязательно укажите, что нашли организацию на торговой площадке БизОрг. - Где узнать более подробную информацию об организации «Соловьев (Оценка в Крыму), ЧП»?Для получения подробных даных об организации перейдите в правом верхнем углу по ссылке с названием фирмы. Затем перейдите на нужную вкладку с описанием.
- Предложение указано с ошибками, контактный номер телефона не отвечает и т.п.Если у вас появились проблемы при взаимодействии с «Соловьев (Оценка в Крыму), ЧП» – сообщите идентификаторы организации (380188) и товара/услуги (8088992) в нашу службу поддержки пользователей.
Служебная информация
«Гидроксид алюминия Al(OH)3» можно найти в следующей категории: «Гидроксид алюминия».
Предложение было создано 03.10.2013, дата последнего обновления — 13.10.2013.
За это время предложение было просмотрено 591 раз.
Обращаем ваше внимание на то, что торговая площадка BizOrg. su носит исключительно информационный характер и ни при каких условиях не является публичной офертой.
su носит исключительно информационный характер и ни при каких условиях не является публичной офертой.
Заявленная компанией Соловьев (Оценка в Крыму), ЧП цена товара «Гидроксид алюминия Al(OH)3» может не быть окончательной ценой продажи. Для получения подробной информации о наличии и стоимости указанных товаров и услуг, пожалуйста, свяжитесь с представителями компании Соловьев (Оценка в Крыму), ЧП по указанным телефону или адресу электронной почты.
Телефоны:
+380 (50) 9346746
Купить гидроксид алюминия Al(ОН)3 в Первомайском Автономной Республики Крым:
Россия,АР Крым, Первомайское,96300, ул. Спортивная, 6/7
Гидроксид алюминия Al(OH)3Синтез наноструктур Al(OH) из микроагломератов Al(OH) методом растворения-осаждения
3 микроагломератов путем растворения в 9,0 моль·л -1 NaOH при 115°C с последующим разбавлением и выдержкой раствора при комнатной температуре. Влияние Al(OH) 3 нанозатравки и поверхностно-активные вещества, такие как додецилсульфат натрия (SDS), полиэтиленгликоль 6000 (PEG6000) и бромид цетилтриметиламмония (CTAB), на формирование наноструктур Al(OH) 3 . Результаты экспериментов показали, что микросферы Al(OH) 3 , состоящие из наночастиц, были получены в холостом опыте, а дисперсионные наночастицы Al(OH) 3 диаметром 80–100 нм – в присутствии Ал(ОН) 3 нано-семена и ЦТАБ.
Результаты экспериментов показали, что микросферы Al(OH) 3 , состоящие из наночастиц, были получены в холостом опыте, а дисперсионные наночастицы Al(OH) 3 диаметром 80–100 нм – в присутствии Ал(ОН) 3 нано-семена и ЦТАБ.1. Введение
Синтезу наноструктур Al(OH) 3 в последние годы уделяется большое внимание благодаря их уникальным свойствам и широкому применению в пластмассах, каучуках, бумаге, стекле, лекарствах и т. д. [1]. –4]. Микрочастицы Al(OH) 3 обычно получали на алюминиевых металлургических заводах по методу Байера, который включал выщелачивание бокситовых руд в щелочных гидротермальных условиях (150–250°C), удаление примесей в виде Si и Fe при повышенные температуры и осаждение Al(OH) 3 микрочастиц в присутствии Al(OH) 3 затравки путем постепенного охлаждения раствора алюмината натрия от 90–100°С до 50–60°С, которое обычно продолжалось 48–72 ч [5–8]. Для синтеза наноструктур Al(OH) 3 было разработано множество мокрых химических методов. Например, Ли и др. [9] получили нановискеры Al(OH) 3 длиной 8–12 м и диаметром 100 нм путем прикапывания 0,05 моль·л −1 HCl к 1,6 моль·л −1 алюмината натрия при 60°С. Чен и др. [10] синтезировали Al(OH) 3 шестиугольные пластины диаметром 100–200 нм и толщиной 20–30 нм путем карбонизации раствора алюмината натрия при комнатной температуре. Ли и др. В работе [11] были получены наночастицы Al(OH) 3 со средним размером 30–40 нм из разбавленного раствора алюмината натрия, содержащего 0,4 моль·л −1 NaOH в присутствии α -Al 2 O 3 наносемя и полиэтиленгликоль 20000 (PEG20000). Однако в прежних методах все еще существовали некоторые проблемы, такие как низкая эффективность в разбавленной системе, использование дорогих органических растворителей и сброс сточных вод или побочных продуктов. Ван и др. синтезированный Al(OH) 3 частицы со средним диаметром 0,5–1,2 м растворением агломератов Al(OH) 3 микроагломератов со средним диаметром 1,5 м в 2,0 моль·л −1 раствор NaOH при 90–100°C и затем охлаждают до 50-70°С.
Например, Ли и др. [9] получили нановискеры Al(OH) 3 длиной 8–12 м и диаметром 100 нм путем прикапывания 0,05 моль·л −1 HCl к 1,6 моль·л −1 алюмината натрия при 60°С. Чен и др. [10] синтезировали Al(OH) 3 шестиугольные пластины диаметром 100–200 нм и толщиной 20–30 нм путем карбонизации раствора алюмината натрия при комнатной температуре. Ли и др. В работе [11] были получены наночастицы Al(OH) 3 со средним размером 30–40 нм из разбавленного раствора алюмината натрия, содержащего 0,4 моль·л −1 NaOH в присутствии α -Al 2 O 3 наносемя и полиэтиленгликоль 20000 (PEG20000). Однако в прежних методах все еще существовали некоторые проблемы, такие как низкая эффективность в разбавленной системе, использование дорогих органических растворителей и сброс сточных вод или побочных продуктов. Ван и др. синтезированный Al(OH) 3 частицы со средним диаметром 0,5–1,2 м растворением агломератов Al(OH) 3 микроагломератов со средним диаметром 1,5 м в 2,0 моль·л −1 раствор NaOH при 90–100°C и затем охлаждают до 50-70°С. До сих пор остается сложной задачей разработка умеренного, эффективного и экологически безопасного метода синтеза наноструктур Al(OH) 3 .
До сих пор остается сложной задачей разработка умеренного, эффективного и экологически безопасного метода синтеза наноструктур Al(OH) 3 .
В этой статье был разработан простой метод осаждения растворением для синтеза Al(OH) 3 наноструктуры из Al(OH) 3 микроагломераты. Обсуждается влияние нанозатравки Al(OH) 3 и поверхностно-активных веществ, включая SDS, PEG6000 и CTAB, на формирование наноструктур Al(OH) 3 .
2. Экспериментальный
2.1. Методика эксперимента
На рис. 1 показаны морфология и термогравиметрический анализ сырья и затравки Al(OH) 3 . Сырье Al(OH) 3 было предоставлено алюминиевым металлургическим заводом в провинции Шаньдун, Китай. Ал(ОН) 9Затравку 0007 3 синтезировали соосаждением 0,5 моль·л −1 Al(NO 3 ) 3 и 1,0 моль·л −1 NaOH при комнатной температуре, сохраняя исходное молярное соотношение Al(NO 3 ) 3 в NaOH при 1 : 3. Как показано на рисунке 1(a), исходный материал Al(OH) 3 состоял в основном из неправильных агломератов диаметром 5–20 мкм мкм , а потеря массы (36,11%), происходящая между 30 и 800°С, должна быть отнесена на счет удаления кристаллизационной воды; таким образом, формула сырья была выведена как Al 2 O 3 ·3,20H 2 O. Данные на рис. 1(b) показали, что размер частиц затравки Al(OH) 3 составлял 20–40 нм, а потеря веса составляла от 30 до 800°C составляло 35,04%, а затем формула затравки была выведена как Al 2 O 3 ·3,15H 2 O.
Как показано на рисунке 1(a), исходный материал Al(OH) 3 состоял в основном из неправильных агломератов диаметром 5–20 мкм мкм , а потеря массы (36,11%), происходящая между 30 и 800°С, должна быть отнесена на счет удаления кристаллизационной воды; таким образом, формула сырья была выведена как Al 2 O 3 ·3,20H 2 O. Данные на рис. 1(b) показали, что размер частиц затравки Al(OH) 3 составлял 20–40 нм, а потеря веса составляла от 30 до 800°C составляло 35,04%, а затем формула затравки была выведена как Al 2 O 3 ·3,15H 2 O.
На рисунке 2 показана блок-схема получения Al(OH) 3 наноструктуры из микроагломератов Al(OH) 3 .
Растворение Al(OH) 3 в растворе NaOH. 66,4 г исходного материала Al(OH) 3 растворяли в 110 мл 3,0–11,0 моль·л −1 NaOH при 115°C в течение 0,5 ч для приготовления раствора натрия и алюминия с наличием или отсутствием -растворенный Al(OH) 3 . Растворы или супернатанты использовали для анализа растворения Al(OH) 3 .
Растворы или супернатанты использовали для анализа растворения Al(OH) 3 .
Образование Al(OH) 3 наноструктур . 66,4 г Al(OH) 3 исходный материал был растворен в 110 мл 90,0 моль·л -1 NaOH при 115°C в течение 0,5 ч для получения раствора натрия и алюминия. Затем раствор охлаждали до комнатной температуры и разбавляли деионизированной водой, чтобы получить раствор, содержащий 3,0 моль·л 900 11 -1 900 12 NaOH. Затем определенное количество нанозатравки Al(OH) 3 и поверхностно-активного вещества (ДСН, ЭДТА или ПЭГ 6000) добавляли к разбавленному раствору алюминия и натрия с получением раствора, содержащего 0,125 моль·л -1 Al(OH ) 3 наносемя и 13,0 г·л −1 поверхностно-активное вещество. Раствор натрия-алюминия выдерживали в течение 0–10,0 ч для получения осадка Al(OH) 3 . Затем осадок Al(OH) 3 промывали деионизированной водой и этанолом и сушили при 105°С в течение 4,0 ч. Все химические реактивы, использованные в экспериментах, были аналитической чистоты без дополнительной очистки.
Все химические реактивы, использованные в экспериментах, были аналитической чистоты без дополнительной очистки.
2.2. Анализ
Морфологию образцов исследовали с помощью автоэмиссионной сканирующей электронной микроскопии (FESEM, JSM 7401F, JEOL, Япония). Структуры образцов идентифицировали по порошковым рентгенограммам (XRD, D8 Advance, Bruker, Германия) с использованием Cu K α излучение ( нм). Состав образцов определяли на термогравиметрическом анализаторе (ТГ/ДСК, Mettler Toledo, Швейцария). Концентрацию растворимого иона Al определяли методом титрования комплекс ЭДТА-Zn 2+ [12].
3. Результаты и обсуждение
3.1. Растворение микроагломератов Al(OH)
3 в растворе NaOH На рис. 3 показано растворение микроагломератов Al(OH) 3 в 3,0–11,0 моль·л -1 Растворы NaOH. В условиях эксперимента увеличение концентрации NaOH с 3,0 моль·л -1 до 11,0 моль·л -1 способствовало растворению Al(OH) 3 . Установлено, что сырье полностью растворялось, если [NaOH] 9,0 моль·л -1 . Таким образом, 9,0 моль·л -1 NaOH было адаптировано для растворения исходного материала Al(OH) 3 в более поздних экспериментах.
Установлено, что сырье полностью растворялось, если [NaOH] 9,0 моль·л -1 . Таким образом, 9,0 моль·л -1 NaOH было адаптировано для растворения исходного материала Al(OH) 3 в более поздних экспериментах.
3.2. Осаждение Al(OH)
3 при комнатной температуре3.2.1. Влияние Al(OH)
3 Нанозатравка На рис. 4 представлена морфология наноструктур Al(OH) 3 , сформированных в отсутствие и в присутствии Al(OH) 3 нанозатравки. Как показано на рисунках 4(a)–4(c), агломерированные микросферы были приготовлены в холостом эксперименте. Микросферы состояли из пластин диаметром 0,6–1,0 м и толщиной 0,2–0,3 мкм мкм, а пластины – из наночастиц диаметром 80–100 нм. Диаметры микросфер, образовавшихся на 2,0 ч, 6,0 ч и 10,0 ч, составляли 0,5–1,5 мкм мкм, 1,0–3,5 мкм мкм и 1,0–4,0 мкм мкм соответственно, показывая, что размеры микросфер увеличивались с увеличением времени старения. В присутствии 0,125 моль·л нанопластины, сформированные через 2,0 ч, 6,0 ч и 10,0 ч, были очень похожи друг на друга.
В присутствии 0,125 моль·л нанопластины, сформированные через 2,0 ч, 6,0 ч и 10,0 ч, были очень похожи друг на друга.
На рис. 5 представлены кривые ТГ и рентгенограммы Al(OH) 3 нанопластинки, образованные в присутствии Al(OH) 3 нанозатравки. Как показано на рис. 5(а), в диапазоне температур 30–800°С происходит потеря массы на 35,91%; таким образом, формула нанопластин Al(OH) 3 была выведена как Al 2 O 3 ·3,17H 2 O. Явление, что молекулярное число воды было немного выше 3,0, показало, что некоторая вода физически поглощался нанопластинами Al(OH) 3 . Большинство дифракционных пиков на рисунке 6(b) могут быть отнесены к гиббситу (PDF № 74-1775, Å, Å и Å), а пик при 2 θ = 40,506° показал, что небольшое количество байерита (PDF № 20-0011, Е, Е и Е) также присутствует в нанопластинках Al(OH) 3 .
На рис. 6 показано влияние нанозатравки Al(OH) 3 на осаждение наноструктур Al(OH) 3 .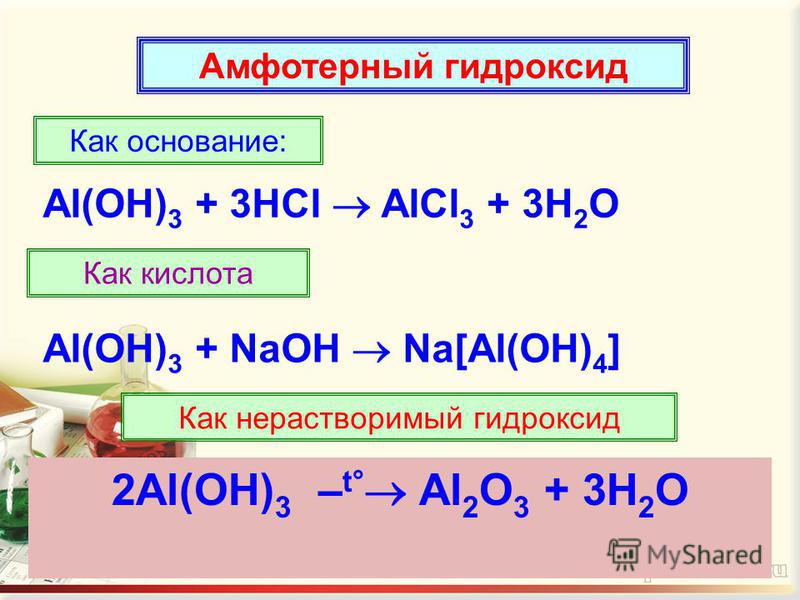 Осаждение Al(OH) 3 , очевидно, ускорялось добавлением нанозатравки Al(OH) 3 . 63,0% растворимого иона Al в растворе алюмината натрия превратилось в Al(OH) 3 осаждается после старения в течение 2,0 ч, в то время как только около 1,0% растворимого иона Al выпадает в осадок после старения в течение 2,0 ч в холостом эксперименте.
Осаждение Al(OH) 3 , очевидно, ускорялось добавлением нанозатравки Al(OH) 3 . 63,0% растворимого иона Al в растворе алюмината натрия превратилось в Al(OH) 3 осаждается после старения в течение 2,0 ч, в то время как только около 1,0% растворимого иона Al выпадает в осадок после старения в течение 2,0 ч в холостом эксперименте.
Влияние нанозатравки Al(OH) 3 на морфологию и осаждение наноструктур Al(OH) 3 можно объяснить следующим образом. В отсутствие нанозатравки Al(OH) 3 Al(OH) 3 сначала гомогенно и медленно осаждается из раствора алюмината натрия, а Al(OH) 3 мелкие частицы, образующиеся на ранней стадии старения, служили зародышем для последующего осаждения Al(OH) 3 , что приводило к постепенному росту агломерированных микросфер. В то же время в присутствии нанозатравки Al(OH) 3 к исходному раствору алюмината натрия добавлялось много наночастиц Al(OH) 3 , которые действовали как зародыш для последующего гетерогенного осаждения Al(OH) . 3 из раствора алюмината натрия, что приводит к быстрому превращению большей части растворимого иона Al в Al(OH) 3 в течение 2,0 часов после старения и получения нанопластин Al(OH) 3 очень похожей формы.
3 из раствора алюмината натрия, что приводит к быстрому превращению большей части растворимого иона Al в Al(OH) 3 в течение 2,0 часов после старения и получения нанопластин Al(OH) 3 очень похожей формы.
3.3. Влияние поверхностно-активных веществ
Влияние поверхностно-активных веществ, включая SDS, PEG6000 и CTAB, на морфологию осадков Al(OH) 3 показано на рис. 7. Преципитаты Al(OH) 3 были приготовлены после обработки старением растворы алюмината натрия, содержащие 0,125 моль·л −1 Al(OH) 3 нанозатравки и 13,0 г·л -1 поверхностно-активное вещество (SDS, PEG6000 или CTAB) в течение 10,0 часов. По сравнению с теми, которые образуются при единственном существовании нанозатравки Al(OH) 3 (рис. 6(f)), в присутствии нанозатравки Al(OH) 3 были получены наночастицы Al(OH) 3 меньшего размера. и поверхностно-активные вещества. Наночастицы Al(OH) 3 диаметром 200–300 нм, 150–250 нм и 80–100 нм были получены в присутствии ДСН, ПЭГ6000 и ЦТАБ соответственно. Порядок влияния ПАВ на образование Al(OH) 3 наночастиц было CTAB>PEG6000>SDBS, и это явление может быть связано с взаимодействием между поверхностями Al(OH) 3 и поверхностно-активными веществами. Поверхности Al(OH) 3 , сформированные в концентрированных растворах NaOH, были заряжены отрицательно из-за адсорбции [13], которые легче поглощали катионные ПАВ, такие как ЦТАБ, и плохо поглощали неионогенные ПАВ, такие как ПЭГ6000, или анионные ПАВ. как СДС.
Порядок влияния ПАВ на образование Al(OH) 3 наночастиц было CTAB>PEG6000>SDBS, и это явление может быть связано с взаимодействием между поверхностями Al(OH) 3 и поверхностно-активными веществами. Поверхности Al(OH) 3 , сформированные в концентрированных растворах NaOH, были заряжены отрицательно из-за адсорбции [13], которые легче поглощали катионные ПАВ, такие как ЦТАБ, и плохо поглощали неионогенные ПАВ, такие как ПЭГ6000, или анионные ПАВ. как СДС.
На рис. 8 показана схема влияния Al(OH) 3 нанозатравка и поверхностно-активные вещества при осаждении Al(OH) 3 из раствора алюмината натрия. Как правило, наличие нанозатравки Al(OH) 3 способствует гетерогенному осаждению Al(OH) 3 и адсорбции поверхностно-активных веществ, таких как SDS, PEG6000 и CTAB, особенно катионного поверхностно-активного вещества CTAB, на поверхности Al. (OH) 3 ингибировал рост Al(OH) 3 . Совместное влияние нанозатравки Al(OH) 3 и ЦТАБ на осаждение Al(OH) 3 из раствора алюмината натрия приводила к образованию дисперсных наночастиц Al(OH) 3 диаметром 80–100 нм.
4. Заключение
Al(OH) 3 наноструктур синтезированы из Al(OH) 3 микроагломератов растворением микроагломератов Al(OH) 3 в 9,0 моль·12 Na OH 11 − °С в течение 0,5 ч с последующим разбавлением и выдержкой раствора при комнатной температуре. Экспериментальные результаты показали, что Al(OH) 3 микросфер, состоящих из наночастиц, были приготовлены в холостом опыте, а дисперсные Al(OH) 3 наночастиц диаметром 80–100 нм образовались в присутствии 0,125 моль·л −1 Al(OH) 3 наносемя и 13,0 г·л −1 CTAB.
Благодарность
Эта работа была поддержана Национальным фондом естественных наук (№ 51174125 и 51234003).
Ссылки
Ajouyed O., Hurel C., Ammari M., Allal L.B. и Marmier N., «Сорбция Cr(VI) на природных (окси)гидроксидах железа и алюминия: влияние pH, ионной силы и начальная концентрация» Журнал опасных материалов , том. 174, нет.
 1–3, стр. 616–622, 2010.
1–3, стр. 616–622, 2010.Посмотреть по адресу:
Сайт издателя | Google Scholar
Т. Дж. Рейх и К. М. Корецкий, «Адсорбция Cr(VI) на гамма-оксиде алюминия в присутствии и в отсутствие CO 2 : сравнение трех моделей поверхностного комплексообразования», Geochimica et Cosmochimica Acta , vol. . 75, нет. 22, стр. 7006–7017, 2011.
Посмотреть по адресу:
Google Scholar
WQ Cai, JG Yu и M. Jaroniec, «Бесшаблонный синтез иерархических веретенообразных материалов γ -Al 2 O 3 и их адсорбционное сродство к органическим и неорганическим загрязнителям в воде», Journal химии материалов , вып. 20, нет. 22, стр. 4587–4594, 2010.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Н.
 К. Ренука, А. В. Шижина, А. К. Правин, «Мезопористые наночастицы гамма-оксида алюминия: синтез, характеристика и эффективность удаления красителя», Материалы Письма , том. 82, стр. 42–44, 2012.
К. Ренука, А. В. Шижина, А. К. Правин, «Мезопористые наночастицы гамма-оксида алюминия: синтез, характеристика и эффективность удаления красителя», Материалы Письма , том. 82, стр. 42–44, 2012.Посмотреть по адресу:
Google Scholar
К. А. Бланкс, «Новый синтез гиббсита с помощью лазерно-стимулированного зародышеобразования в пересыщенных растворах алюмината натрия», Journal of Crystal Growth, . об. 220, нет. 4, стр. 572–578, 2000.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Х. Ли, Дж. Аддай-Менса, Дж. К. Томас и А. Р. Герсон, «Механизм кристаллизации Al(OH) 3 из растворов алюмината натрия», Journal of Crystal Growth , vol. 279, нет. 3–4, стр. 508–520, 2005 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Т.
 Раднаи, П. М. Мэй, Г. Т. Хефтер и П. Сипос, «Структура водных растворов алюмината натрия: исследование дифракции рентгеновских лучей в растворе», Journal of Physical Chemistry A , vol. 102, нет. 40, стр. 7841–7850, 1998.
Раднаи, П. М. Мэй, Г. Т. Хефтер и П. Сипос, «Структура водных растворов алюмината натрия: исследование дифракции рентгеновских лучей в растворе», Journal of Physical Chemistry A , vol. 102, нет. 40, стр. 7841–7850, 1998.Посмотреть по адресу:
Google Scholar
М. Дж. Чен и Л. Сян, «Влияние кристалличности Al 2 O 3 · xH 2O на морфологию вискеров AlOOH», Nano Biomedicine and Engineering , vol. 2, нет. 2, pp. 121–125, 2010.
Просмотр по адресу:
Google Scholar
Ю. Ли, Ю. Ф. Чжан и К. Ян, «Волокообразные наночастицы гидроксида алюминия, полученные нейтрализацией раствора алюмината натрия, Китайский журнал цветных металлов , том. 18, нет. 1, pp. 264–267, 2008.
Просмотр по адресу:
Google Scholar
Дж.
 Ф. Чен, Л. Шао, Ф. Го и X. М. Ван, «Синтез нановолокон гидроксида алюминия в новых вращающихся реактор с уплотненным слоем», Chemical Engineering Science , vol. 58, нет. 3–6, стр. 569–575, 2003 г.
Ф. Чен, Л. Шао, Ф. Го и X. М. Ван, «Синтез нановолокон гидроксида алюминия в новых вращающихся реактор с уплотненным слоем», Chemical Engineering Science , vol. 58, нет. 3–6, стр. 569–575, 2003 г.Посмотреть по адресу:
Сайт издателя | Google Scholar
Х. Ли, Х. Лу, С. Ван, Дж. Цзя, Х. Сунь и С. Ху, «Подготовка наноразмерного α -Al 2 O 3 порошок из пересыщенного раствора алюмината натрия», Ceramics International , vol. 35, нет. 2, стр. 901–904, 2009 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Л. Л. Льюис, М. Дж. Нардоцци и Л. М. Мельник, «Быстрое химическое определение алюминия, кальция и магния в сырье, агломератах и шлаках», Analytical Chemistry , vol. 33, нет. 10, стр. 1351–1355, 1961.
Посмотреть по адресу:
Сайт издателя | Google Scholar
А.
 Деген и М. Косек, «Влияние pH и примесей на поверхностный заряд оксида цинка в водном растворе», Журнал Европейского керамического общества , том. 20, нет. 6, стр. 667–673, 2000.
Деген и М. Косек, «Влияние pH и примесей на поверхностный заряд оксида цинка в водном растворе», Журнал Европейского керамического общества , том. 20, нет. 6, стр. 667–673, 2000.Посмотреть по адресу:
Сайт издателя | Google Scholar
Copyright
Copyright © 2013 Bo Yu et al. Это статья с открытым доступом, распространяемая в соответствии с лицензией Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии надлежащего цитирования оригинальной работы.
Гидроксид алюминия (Al(OH)3) Нанопорошок/наночастицы
(пока отзывов нет) Написать рецензию
Гидроксид алюминия (Al(OH)3) Нанопорошок/наночастицы, высокая чистота: 99,95%, размер: 8–18 нм, гидрофильный
Рейтинг Требуется Выберите рейтинг1 звезда (худший)2 звезды3 звезды (средний)4 звезды5 звезд (лучший)
Имя
Тема отзыва Обязательно
Комментарии Обязательно
- Артикул:
- НГ04СО0201
- Доставка:
- Рассчитывается на кассе
Сейчас: €30,00
Текущий запас:
Количество:
Часто покупают вместе:
- Описание
Description
| 5 grams/30 € 25 grams/70 € 500 грамм/420 €
Пожалуйста, свяжитесь с нами для расценок на большие количества !!! |
Высокая степень чистоты: 99,95 %, размер: 8-18 нм, гидрофильность
Применение:
Наночастицы гидроксида алюминия используются в качестве огнезащитного и огнезащитного наполнителя.

 Обязательно укажите, что нашли организацию на торговой площадке БизОрг.
Обязательно укажите, что нашли организацию на торговой площадке БизОрг. 1–3, стр. 616–622, 2010.
1–3, стр. 616–622, 2010. К. Ренука, А. В. Шижина, А. К. Правин, «Мезопористые наночастицы гамма-оксида алюминия: синтез, характеристика и эффективность удаления красителя», Материалы Письма , том. 82, стр. 42–44, 2012.
К. Ренука, А. В. Шижина, А. К. Правин, «Мезопористые наночастицы гамма-оксида алюминия: синтез, характеристика и эффективность удаления красителя», Материалы Письма , том. 82, стр. 42–44, 2012. Раднаи, П. М. Мэй, Г. Т. Хефтер и П. Сипос, «Структура водных растворов алюмината натрия: исследование дифракции рентгеновских лучей в растворе», Journal of Physical Chemistry A , vol. 102, нет. 40, стр. 7841–7850, 1998.
Раднаи, П. М. Мэй, Г. Т. Хефтер и П. Сипос, «Структура водных растворов алюмината натрия: исследование дифракции рентгеновских лучей в растворе», Journal of Physical Chemistry A , vol. 102, нет. 40, стр. 7841–7850, 1998. Ф. Чен, Л. Шао, Ф. Го и X. М. Ван, «Синтез нановолокон гидроксида алюминия в новых вращающихся реактор с уплотненным слоем», Chemical Engineering Science , vol. 58, нет. 3–6, стр. 569–575, 2003 г.
Ф. Чен, Л. Шао, Ф. Го и X. М. Ван, «Синтез нановолокон гидроксида алюминия в новых вращающихся реактор с уплотненным слоем», Chemical Engineering Science , vol. 58, нет. 3–6, стр. 569–575, 2003 г. Деген и М. Косек, «Влияние pH и примесей на поверхностный заряд оксида цинка в водном растворе», Журнал Европейского керамического общества , том. 20, нет. 6, стр. 667–673, 2000.
Деген и М. Косек, «Влияние pH и примесей на поверхностный заряд оксида цинка в водном растворе», Журнал Европейского керамического общества , том. 20, нет. 6, стр. 667–673, 2000.