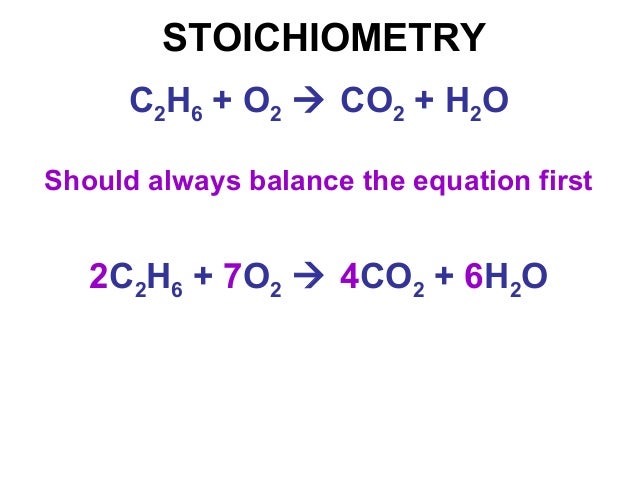
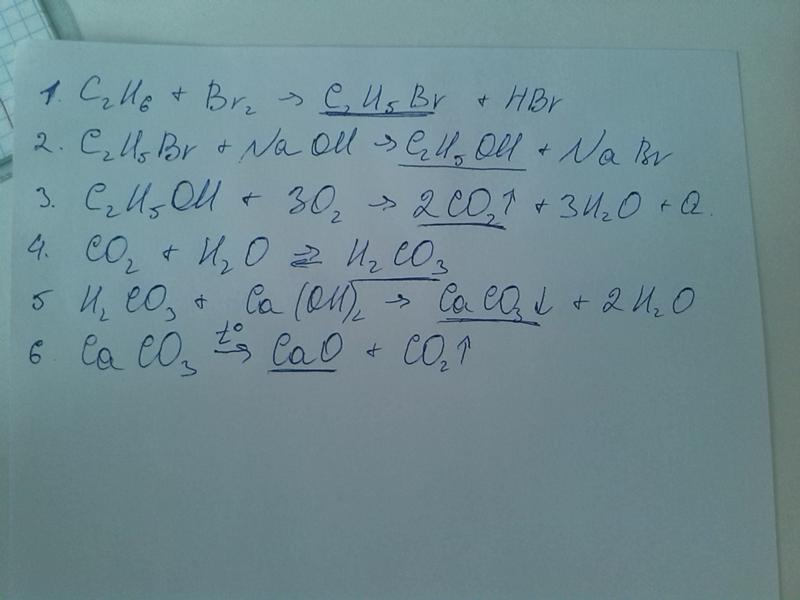Ch5, C2H6, C3H8, C4h20, C5h22, C6h24
Чистые газы/вещества
- Метан [CH4]
- Этан [C2H6]
- Пропан [C3H8]
- Бутан [C4H10]
- Пентан [C5H12]
- Гексан [C6H14]
- Чистые вещества (газы) доступные для заказа
| Марка | 5.0 | 4.5 | 4.0 | 3.5 | 3.0 | 2.5 | 2.0 |
| Молярная доля, % | 99.999 | 99.995 — 99.998 | 99.99 — 99.994 | 99.95 — 99.8 | 99.9 — 99.94 | 99.5 — 99.8 | 99.0 — 99.4 |
Метан [Ch5]
| Марка | Концентрация, молярная доля, % |
Примеси, молярная доля, % |
5. 0 0 |
99.999 | N2+O2 C2H6+C3H8 CO2 |
| 4.5 | 99.995 — 99.998 | N2+O2 C2H6+C3H8 CO2 |
| 4.0 | 99.990 — 99.994 | N2+O2 C2H6+C3H8 CO2 |
| 3.5 | 99.95 — 99.98 | N2+O2 C2H6+C3H8 CO2 |
| 3.0 | 99.9 — 99.94 | N2+O2 C2H6+C3H8 |
Этан [C2H6]
| Марка | Концентрация, молярная доля, % |
Примеси, молярная доля, % |
| 5.0 | 99.999 | N2+O2 другие УВ CO+CO2 h3O |
| 4.5 | 99.995 — 99.998 | N2+O2 другие УВ CO+CO2 h3O |
4. 0 0 |
99.990 — 99.994 | N2+O2 другие УВ CO+CO2 h3O |
| 3.5 | 99.95 — 99.98 | N2+O2 другие УВ CO+CO2 h30 |
| 3.0 | 99.9 — 99.94 | N2+O2 другие УВ CO+CO2 h30 |
Пропан [C3H8]
| Марка | Концентрация, молярная доля, % |
Примеси, молярная доля, % |
| 4.0 | 99.990 — 99.994 | N2 другие УВ C3H6 h3+O2 h3O |
| 99.95 — 99.98 | N2 другие УВ C3H6 O2 CO2 h3O | |
| 3.0 | 99.9 — 99.94 | N2 другие УВ C3H6 O2+h3 h3O |
2. 5 5 |
99.5 — 99.8 | N2 другие УВ C3H6 O2 CO2 h3O |
Бутан [C4h20]
| Марка | Концентрация, молярная доля, % |
Примеси, молярная доля, % |
| 4.0 | 99.990 — 99.994 | N2 другие УВ O2 h3O |
| 3.5 | 99.95 — 99.98 | N2 другие УВ O2 h3O |
| 3.0 | 99.9 — 99.94 | N2 другие УВ O2 h3O |
| 2.5 | 99.5 — 99.8 | N2 другие УВ O2 h3O |
| 2.0 | 99.0 — 99.4 | N2 другие УВ O2 h3O |
Пентан [C5h22]
| Марка | Концентрация, молярная доля, % |
Примеси, молярная доля, % |
3. 0 0 |
99.9 — 99.94 | h3O другие примеси |
| 2.5 | 99.5 — 99.8 | h3O другие примеси |
| 2.0 | 99.0 — 99.4 | h3O другие примеси |
Гексан [C6h24]
| Марка | Концентрация, молярная доля, % |
Примеси, молярная доля, % |
| 3.5 (%) | 99.95 — 99.98 | h3O сульфиды другие примеси |
Лучший ответ по мнению автора | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
| Похожие вопросы |
Решено
Эта соль — типичный окислитель.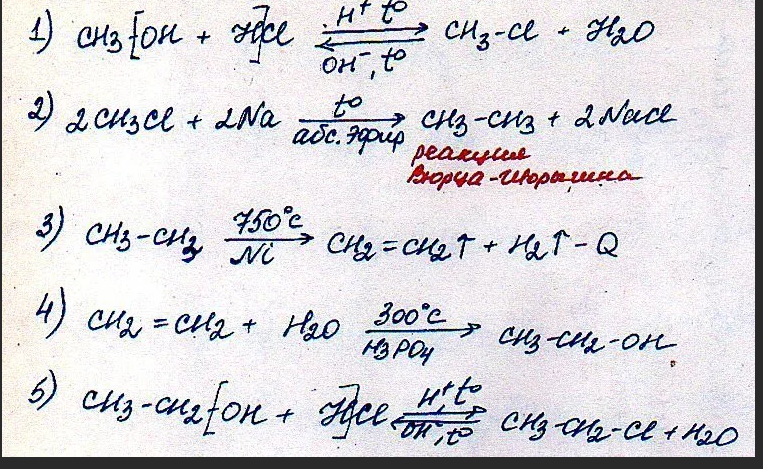
Решено
Расшифруйте цепочку превращений и определите загаданные соединения, если известно, что вещество В не горит в кислороде.
11 кл химия
В фэнтези-саге «Песнь Льда и Пламени» в военных целях используют горючую смесь, созданную Гильдией Алхимиков и называемую «диким огнём». Дикий огонь
Решено
В урановых рудах содержится радиоактивный изотоп урана-238: 92238U. Определенная последовательность ядерных реакций позволяет получить из него изотоп
Пользуйтесь нашим приложением
Высокоселективное преобразование CO2 в C2H6 на модифицированном графеном хлорофилле Cu посредством многоэлектронного процесса для искусственного фотосинтеза
Высокоселективное преобразование CO
2 в C 2 H 6 на модифицированном графеном хлорофилле Cu посредством многоэлектронного процесса для искусственного фотосинтеза†Тонгшунь Ву, * и Ченг Чжу, б Дунсюэ Хан, ак Чжэньхуэй Кан * б и Ли Ню ак
Принадлежности автора
* Соответствующие авторы
и Центр передовых аналитических наук при Школе химии и химического машиностроения Университета Гуанчжоу, Гуанчжоу 510006, КНР
Электронная почта: tswu@gzhu. edu.cn
edu.cn
б Ключевая лаборатория Цзянсу по углеродным функциональным материалам и устройствам, Институт функциональных нано- и мягких материалов (FUNSOM), Сучжоуский университет, 199 Ren’ai Road, Сучжоу, Цзянсу, КНР
Электронная почта: [email protected]
с Государственная ключевая лаборатория электроаналитической химии, c/o Инженерная лаборатория современных аналитических методов, Чанчуньский институт прикладной химии Китайской академии наук, Чанчунь 130022, Цзилинь, Китай
Аннотация
rsc.org/schema/rscart38″> Искусственный фотосинтез является многообещающей стратегией преобразования углекислого газа в углеводородное топливо с помощью солнечной энергии, поскольку он чист, экономичен и безвреден для окружающей среды. Здесь мы разработали селективный и стабильный фотокатализатор для фотокаталитического восстановления CO 2 в C 2 H 6 посредством многоэлектронного пути переноса без внешних жертвенных реагентов. Основной компонент этого составного катализатора был извлечен из экскрементов тутового шелкопряда и модифицирован для получения хлорофилла Cu (Chl-Cu), который содержал порфириновую структуру в качестве антенны для поглощения света и катион Cu в качестве активного центра. Мы обнаружили, что C 2 углеводороды, такие как C 2 H 2 , C 2 H 90 003 4 и C 2 H 6 имели тенденцию генерировать на хлорофилле-а/графене. После замены катионов Mg 2+ на Cu 2+ в центре порфирина и модификации графеном остается только C 2 H 6 был обнаружен в 18-часовой реакции. Этот фотокатализатор показал выдающуюся активность и селективность для фотокаталитического восстановления CO 2 (CO 2 RR) с C 2 H 6 9 0004 Выход при 68,23 мкмоль·м – 2 h -1 при облучении видимым светом и кажущейся квантовой эффективностью 1,26% при 420 нм. В этой системе порфириновые кольца возбуждались светом для образования электронно-дырочных пар. Фотоиндуцированные дырки окисляли воду с образованием кислорода, в то время как графен работал как адсорбционный центр и акцептор электронов для CO 9 .0057 2 сокращение.
После замены катионов Mg 2+ на Cu 2+ в центре порфирина и модификации графеном остается только C 2 H 6 был обнаружен в 18-часовой реакции. Этот фотокатализатор показал выдающуюся активность и селективность для фотокаталитического восстановления CO 2 (CO 2 RR) с C 2 H 6 9 0004 Выход при 68,23 мкмоль·м – 2 h -1 при облучении видимым светом и кажущейся квантовой эффективностью 1,26% при 420 нм. В этой системе порфириновые кольца возбуждались светом для образования электронно-дырочных пар. Фотоиндуцированные дырки окисляли воду с образованием кислорода, в то время как графен работал как адсорбционный центр и акцептор электронов для CO 9 .0057 2 сокращение.Исследования точки замерзания СО2 в присутствии Ch5, C2H6 и N2
Основной проблемой при криогенной переработке и транспортировке газового потока, содержащего углекислый газ, является его инееобразование. Твердый диоксид углерода (сухой лед) может образовываться при низких давлениях, когда температура газового потока, содержащего CO 2 , падает ниже температуры тройной точки CO 2 . Температура и давление тройной точки CO 2 составляют -56,57 ° C (-69,83 ° F) и 518 кПа (75,12 фунта на кв. дюйм) соответственно. Его критическая температура и давление составляют 31,10 ° C (87,98 ° F) и 7386 кПа (1071 фунт на квадратный дюйм). Точка инея возникает вдоль кривой равновесия твердого тела и пара (SVE). Кроме того, CO 2 вызывает коррозию в системах с водяным охлаждением и снижает теплотворную способность газа и индекс Воббе (число). В связи с этим существуют ограничения на концентрацию CO 2 в товарном газе и жидких продуктах. Спецификация продажи газа/транспортировки по трубопроводу ограничивает CO 2 концентрация до 1–3 мольных %. Чтобы избежать образования инея при криогенной обработке газа, часто требуется удаление CO 2 для выполнения требований последующей обработки.
Твердый диоксид углерода (сухой лед) может образовываться при низких давлениях, когда температура газового потока, содержащего CO 2 , падает ниже температуры тройной точки CO 2 . Температура и давление тройной точки CO 2 составляют -56,57 ° C (-69,83 ° F) и 518 кПа (75,12 фунта на кв. дюйм) соответственно. Его критическая температура и давление составляют 31,10 ° C (87,98 ° F) и 7386 кПа (1071 фунт на квадратный дюйм). Точка инея возникает вдоль кривой равновесия твердого тела и пара (SVE). Кроме того, CO 2 вызывает коррозию в системах с водяным охлаждением и снижает теплотворную способность газа и индекс Воббе (число). В связи с этим существуют ограничения на концентрацию CO 2 в товарном газе и жидких продуктах. Спецификация продажи газа/транспортировки по трубопроводу ограничивает CO 2 концентрация до 1–3 мольных %. Чтобы избежать образования инея при криогенной обработке газа, часто требуется удаление CO 2 для выполнения требований последующей обработки. Типы переработки включают:
Типы переработки включают:
► Установки для глубокой экстракции ШФЛУ: обычно менее 0,5–1,0 мольных % в зависимости от используемого процесса
► Установки для сжижения природного газа: менее 50 частей на миллион по объему меньше, чем при подаче СПГ
Поэтому важно точно оценить температуру, при которой диоксид углерода затвердевает. Равновесия твердого тела и пара (SVE) систем природного газа, содержащих двуокись углерода, можно точно предсказать с помощью программ моделирования.
Продолжая апрель 2012 г. и апрель 2018 г. концевые месяцы (TOTM) [1, 2], это исследование было предпринято для подготовки простых диаграмм для оценки CO 2 температуры инея или давления бинарных и тройных систем, содержащих CH 4 , C 2 H 6 и N 2 , и CO 2 . На диаграммах представлена зависимость температуры инея (или давления) CO 2 + легких углеводородов и смесей азота от давления (или температуры) и CO 2 концентрация для широкого диапазона температур от -80 °C до -120 °C (от -112 °F до -184 °F). Диапазон давлений составлял от 100 до 3500 кПа (от 14,5 до 508 фунтов на кв. дюйм), а диапазон концентраций CO 2 составлял от 0,1 до 55 мольных %. Для каждого случая точность графиков будет сравниваться с экспериментальными данными.
Диапазон давлений составлял от 100 до 3500 кПа (от 14,5 до 508 фунтов на кв. дюйм), а диапазон концентраций CO 2 составлял от 0,1 до 55 мольных %. Для каждого случая точность графиков будет сравниваться с экспериментальными данными.
На рис. 1 [3] представлена фазовая диаграмма для чистого CO 2 . Области S, L и V обозначают твердую, жидкую и паровую фазы соответственно. Точка C является критической точкой, а точка T является тройной точкой, где сосуществуют три фазы твердое тело-жидкость-пар. Рисунок 1A (FPS) представлен в Приложении A. Символы представляют экспериментальные данные [4], а сплошные кривые были предсказаны уравнением состояния Насрифара – Болланда [5].
Рис. 1. Экспериментальная [4] и прогнозная кривые сосуществования чистого диоксида углерода [5] Идентификация термодинамического пакета
Для проверки точности моделирования ProMax [6] программа, ее уравнение состояния Пенга – Робинсона и инструмент Freeze Analysis Tool были использованы для прогнозирования температуры твердого образования бинарных смесей CO 2 + CH 4 в зависимости от давления и CO 2 состав. Прогнозируемые морозные температуры сравнивались с экспериментальными данными. На рисунках 1 и 2 представлена температура инея в зависимости от давления и состава для двух наборов экспериментальных данных [7, 8] и значений, предсказанных ProMax [6].
Прогнозируемые морозные температуры сравнивались с экспериментальными данными. На рисунках 1 и 2 представлена температура инея в зависимости от давления и состава для двух наборов экспериментальных данных [7, 8] и значений, предсказанных ProMax [6].
Рис. 2. Экспериментальная [7] и прогнозируемая точки замерзания углекислого газа (CO 2 мольных % < 11)
Рисунок 3. Экспериментальная [8] и прогнозируемая точки замерзания по углекислому газу (10
Рисунок 2, предсказанный ProMax, по сравнению с соответствующими экспериментальными значениями [7] составляет 1,27%. Точно так же % AARE для 17 морозных температур (в K или ° R) на рисунке 3, предсказанный ProMax, по сравнению с соответствующими экспериментальными значениями [8] составляет 0,27%. Таблицы 1А и 2А в Приложении А представляют поточечное сравнение. Анализ погрешностей на рисунках 2 и 3 показывает, что предсказанные ProMax морозные температуры являются точными для проектирования оборудования объектов и устранения неполадок.
Давление инея для бинарной системы CO 2 + CH 4 как функция мольной доли CO 2 при заданной температуре было оценено путем корректировки давления с помощью решателя ProMax для соответствия экспериментальным значениям инея. температура. Расчетные давления инея для шести изотерм сравниваются с соответствующими экспериментальными значениями [9] на рисунке 4.
9019 2 + CH 4 в зависимости от содержания CO 2 на различных изотермах. Экспериментальные данные взяты из работы. [9].
Аналогичным образом, на рисунках 5 и 6 представлены экспериментальные [9] и рассчитанные ProMax давления инея тройной системы CO 2 + CH 4 + N 2 как функция CO 90 003 2 моль фракция и пять изотерм для 3 мольных % и 5 мольных % N 2 соответственно. Эти два рисунка и рисунок 6А (в Приложении А) показывают, что давление инея одинаково при заданном уровне CO 2 и изотерма для содержания азота 3 мольных % и 5 мольных %.
4 в зависимости от содержания CO 2 на разных изотермах. Экспериментальные данные взяты из работы. [9].
Рис. 6. Давление точки замерзания CO 2 + CH 4 + 5 мол. % N 2 в зависимости от содержания CO 2 на различных изотермах. Экспериментальные данные взяты из работы. [9].
Аналогично, на рисунках 7 и 8 представлены экспериментальные [9] и расчетные значения морозного давления тройной системы CO 2 + CH 4 + C 2 H 6 900 04 в зависимости от CO 2 мольных долей и пять изотерм для 3 мольных % и 5 мольных % C 2 H 6 соответственно. Эти два рисунка и рисунок 8А (в Приложении А) показывают, что давление инея одинаково при данном CO 2 и изотерма для содержания этана 3 мольных % и 5 мольных %.
4 H 6 в зависимости от содержания CO 2 на разных изотермах. Экспериментальные данные взяты из работы. [9]. Рисунок 8.0004 + 5 мольных % C 2 H 6 в зависимости от содержания CO 2 на разных изотермах. Экспериментальные данные взяты из работы. [9].
Экспериментальные данные взяты из работы. [9]. Рисунок 8.0004 + 5 мольных % C 2 H 6 в зависимости от содержания CO 2 на разных изотермах. Экспериментальные данные взяты из работы. [9].
Резюме
На основании работы, проделанной в этом совете, можно сделать следующие выводы:
1. Для чистого CO 2 увеличивается, температура инея увеличивается (рис. 1)
2. CO 2 концентрация оказывает большое влияние на давление и температуру точки замерзания смеси.
а. При постоянном давлении по мере увеличения концентрации CO 2 температура замерзания смеси увеличивается (рис. 2 – 3).
б. При постоянной температуре по мере увеличения концентрации CO 2 давление замерзания смеси уменьшается (рис. 4 – 8).
3. При постоянной температуре концентрация 3 и 5 мольных % N 2 или C 2 H 6 оказывает незначительное влияние или не оказывает никакого влияния на давление замерзания газовых смесей, содержащих CO 2 + CH 4 (рис. 5, 6, 6А, 7, 8 и 8А).
5, 6, 6А, 7, 8 и 8А).
4. ProMax относительно точен для оценки точки замерзания газовых смесей легких углеводородов и CO 2 (таблицы 1A и 2A и рисунки 4–8).
5. Представлены простые графики для точной оценки точки замерзания газовых смесей легких углеводородов, азота и СО 2 в зависимости от давления (или температуры) и концентрации СО 2 (рис. 2 – 8) . Эти диаграммы зависят от композиции, подобные диаграммы должны быть разработаны для разных композиций. В будущем TOTM аналогичные диаграммы будут представлены для типичных смесей природного газа.
6. Знание границ фаз и их поведения необходимо для расчета точки замерзания.
Чтобы узнать больше о подобных случаях и о том, как свести к минимуму эксплуатационные проблемы, мы предлагаем посетить наши G4 ( Подготовка и переработка газа ) , G5 (Практическое компьютерное моделирование приложений в Переработка газа) и G6 (Очистка газа и извлечение серы) курсы.
Автор: Махмуд Мошфегян, доктор философии.
Ссылки
Phase-behavior/», Совет месяца от PetroSkills, апрель 2012 г.
2. М. Мошфегян, «http://www.jmcampbell.com/tip-of-the-month/2018/04/impact-of-co2 -о плотности природного газа/», Совет месяца от PetroSkills, апрель 2018 г.
3. Х. Насрифар и М. Мошфегян, «Прогноз точки замерзания диоксида углерода для модельных систем природного газа», Представлено для публикации, май 2019 г.
4. Интернет-книга NIST по химии; http://webbook.nist.gov/chemistry/ [По состоянию на 26 апреля 2019 г.]
5. Насрифар К., Болланд О. Прогнозирование термодинамических свойств смесей природного газа с использованием десяти уравнений состояния, включая новую кубическую двухконстантную уравнение состояния, J. Pet. науч. англ. 51 (2006) 253-266.
6. ProMax 5.0, сборка 5.0.19050.0, Bryan Research and Engineering, Inc., Брайан, Техас, 2019 г.
7. Г.М. Агравал, Р.Дж. Лаверман, Фазовое поведение системы метан-диоксид углерода в твердо-паровой области, Adv. Крио инж. 19(1974) 317-338.
8. Л. Чжан, Р. Бургасс, А. Чапой, Б. Тохиди, Э. Солбраа, Измерение и моделирование СО 2 точки замерзания в СО 2 – метановые системы, J. Chem. англ. Данные 56 (2011) 2971-2975.
9. X. Xiong, W. Lin, R. Jia, Y. Song, A. Gu, Измерение и расчет CO 2 точки замерзания в CH 4 + CO 2 /CH 4 + CO 2 + N 2 /CH 4 + CO 2 + C 2 H 6 смеси при низких температурах, J. Chem. англ. Данные 60 (2015) 3077-3086.
Приложение А
Рис. 1А. Экспериментальная [4] и предсказанная кривые сосуществования чистого диоксида углерода [5]
Рисунок 6A. Влияние содержания N 2 на давление точки замерзания CO 2 + CH 4 + N 2 в зависимости от содержания CO 2 на разных изотермах.
Рисунок 8А. Влияние содержания C 2 H 6 на давление точки замерзания CO 2 + CH 4 + C 2 H 6 9000 4 в зависимости от содержания CO 2 на разных изотермах.
Таблица 1А. Сравнение прогнозируемой ProMax температуры замерзания с экспериментальными значениями [7]
Средняя абсолютная относительная ошибка % (AARE%) рассчитывается по следующему уравнению.
Где:
Cal Temp = расчетная температура замерзания, K (°R)
Exp Temp = экспериментальная температура замерзания, K (°R)
n = количество точек данных, 42
Таблица 2А . Сравнение прогнозируемой ProMax температуры замерзания с экспериментальными значениями [8]
Средняя абсолютная относительная ошибка % (AARE%) рассчитывается по следующему уравнению.